β-甘露聚糖酶(β-mannanase),又称作β-1,4-D-甘露聚糖酶,是水解半纤维素的第二大酶类[1-2]。1958年COURTOIS J E等[3-4]在对苜蓿的半乳甘露聚糖的研究中第一次发现了β-甘露聚糖酶的存在。 直至1965年SHIBATA对β-甘露聚糖酶进行了详细界定,为相关研究提供了基础依据[4]。β-甘露聚糖酶来源十分广泛,在植物、动物和微生物中均有发现[5-6],其中微生物是β-甘露聚糖酶的宝贵来源。目前报道可产β-甘露聚糖酶的微生物超过100余种,包括芽孢杆菌属(Bacillus)、双歧杆菌属(Bifidobacterium)、链霉菌属(Streptomyces)、青霉菌属(Penicillium)和木霉菌属(Trichoderma)等[7-10]。微生物来源的β-甘露聚糖酶具有产量高、成本低、提取简单等优势,微生物来源的β-甘露聚糖酶在广泛的pH和温度范围内具有良好催化活性,适用于食品、日用品和养殖业等多个工业领域,市场应用潜力大[3,9,11]。YANGM等[1]在造纸过程中添加β-甘露聚糖酶和木聚糖酶,显著提高了牛皮纸的亮度。 DVAID A等[12]发现在洗涤剂中添加β-甘露聚糖酶能有效分解冰淇淋、番茄酱和酸奶等含甘露糖的污渍,同时还有助于防止洗涤过程中去除的污垢重新沉积。 THOMBARE N等[13]论述了甘露聚糖酶可用做为采油过程中瓜尔胶基压裂液破胶剂。以上研究说明β-甘露聚糖酶在生产和生活中具有广泛的应用性,在工业发酵生产中具有较高的研究价值。
野生型菌株相较于突变体菌株,具有抗逆性强、稳定性高和经济性高等优势,是工业化生产常用的菌种来源。王佰涛等[14]通过筛选得到一株黑曲霉菌,产酶活力为2.67 U/mL;李盛前等[15]在对枯草芽孢杆菌进行产酶优化后,使最终酶活力达到84.38 U/mL;王烁等[16]在对干酪乳杆菌3MP-5-3进行产酶优化后,最终酶活可达到65.55 U/mL。上述研究通过发酵优化,虽然相较初始条件下产酶的量有所提高,但产酶效果仍无法满足工业化生产的要求,因此有必要对高产β-甘露聚糖酶菌株进行筛选及培养条件优化。
本研究以大豆种植地的土样为材料进行菌株分离,通过初筛和复筛获得产β-甘露聚糖酶菌株,并通过形态学和分子生物学方法对该菌株进行鉴定,同时通过单因素及响应面法对其产酶条件进行优化,旨在为β-甘露聚糖酶的工业化生产和应用提供支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
土壤样品:取自黑龙江省大庆市大豆种植基地土壤。
1.1.2 试剂
魔芋粉:湖北强森魔芋科技公司;瓜尔胶:山东广饶六合化工有限公司;刺槐豆胶:浙江正宏生物科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):福州飞净生物科技有限公司;蔗糖、可溶淀粉、β-甘露糖:广东西陇科学股份有限公司;蛋白胨、胰蛋白胨、大豆蛋白胨(均为生化试剂):北京奥博星生物技术有限公司;氯化铵、硫酸铵、硝酸钠、碘(J)、碘化钾(KI)、氢氧化钠、磷酸二氢钾(均为分析纯):上海国药集团化学试剂有限公司。
I-KI溶液[17]:碘1 g、碘化钾2 g、溶解于300 mL超纯水中、pH自然。
酶活力检测所需底物:0.1 mol/L NaOH溶液15.2 mL、KH2PO4 0.68 g、纯水定容至100 mL,加入刺槐豆胶0.5 g。
1.1.3 培养基
富集培养基:蛋白胨10 g/L、酵母粉5 g/L、NaCl 10 g/L,琼脂15 g/L,pH自然。
初始发酵培养基:魔芋粉10 g/L、蛋白胨10 g/L,K2HPO4 1 g/L,MgSO4 0.25 g/L,pH自然。
筛选培养基:瓜尔胶10g/L、K2HPO41g/L、MgSO40.25g/L、琼脂20 g/L、pH自然。
培养基灭菌条件均为121 ℃,20 min。
1.2 仪器与设备
101-2A型恒温培养箱:天津天泰公司;UV1901PC型紫外分光光度计:上海奥析科学有限公司;HH-4型恒温水浴锅:常州智博光电有限公司;GL21MC型高速离心机:长沙英泰仪器有限公司;THZ-C恒温摇床:太仓市强文实验设备有限公司;LDZX-75L-1高压蒸汽灭菌锅:上海申安医疗器械厂。
1.3 方法
1.3.1 土样采集
确定采样地点,去除地表枝叶,取地表下2~5 cm的土壤,将土样装入无菌袋中,注明日期、地点,置于4 ℃下保存。
1.3.2 菌株的分离纯化
称取1 g土样置于250 mL锥形瓶中,加入100 mL无菌水,30 ℃,130 r/min振荡培养1 h,静置吸取上清液2 mL加入到100 mL富集培养基内,30 ℃,130 r/min培养24 h。富集液适当稀释,涂布至筛选培养基上,30 ℃条件下倒置培养24 h,挑取不同形态特征的细菌单菌落进行多次纯化。
1.3.3 菌株的筛选
菌株的初筛:挑取长势较好的菌落接种至富集培养基上,每个菌落平行接种两个平板,在平板上滴加I-KI溶液进行初筛,滴入试剂完全覆盖培养基,静置5 min观察透明圈,挑选在培养基生长产透明圈的菌株,判断其产β-甘露聚糖酶。
菌株的复筛:将产生透明圈的菌株进行产酶活测定,从而选出产酶活最高的菌株进行鉴定。
1.3.4 产β-甘露聚糖酶菌株的鉴定
形态学观察:将纯化好的菌株划线接种于LB培养基上,置于30 ℃条件下培养24 h,观察菌落形态及特征,并进行革兰氏染色观察其细胞形态。
分子生物学鉴定:用细菌基因组提取试剂盒提取基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以此为模板,利用细菌通用上游引物27F:5'-AG-AGTTTGATCMTGGCTCAG-3',下游 引物1492R:5'-GGTTACCTTGTTACGACTT-3'进行菌株16S rDNA基因片段扩增[18],聚合酶链式反应(polymerase chain reaction,PCR)扩增体系(25 μL):2×Taq Plus Master Mix Ⅱ12.5 μL;上引物(10 μmol/L)1 μL;下引物(10 μmol/L)1 μL;DNA模板1 μL(约100 ng);双蒸水(ddH2O)9.5 μL。PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,56 ℃退火15 s,72 ℃延伸1 min,重复35个循环;72 ℃终延伸10 min,用2%琼脂糖凝胶电泳检测PCR结果。菌株DNA提取及测序工作委托上海生工黑龙江分公司完成。测序结果通过进入美国国家生物技术信息中心(national center for biotechnology information,NCBI)进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,下载相似度及同源性高的序列,利用MEGA11.0软件中的邻接法(neighbor-joining,NJ)构建系统进化树[25]。
1.3.5 菌株发酵与粗酶液制备
用接种环刮取一环菌体接入富集培养基中,装液量为100 mL/500 mL,封口膜封口,在30 ℃条件下活化24 h获取种子液,以5%的接种量将种子液接入发酵培养基内,发酵培养基在锥形瓶中装液量为100 mL/500 mL, 在30 ℃、130 r/min的条件下发酵24 h。 在4 ℃,5 000 r/min的条件下离心15 min去除菌体和杂质,上清液即为粗酶液。
1.3.6 β-甘露聚糖酶酶活力测定
采用3,5-二硝基水杨酸法测定底物酶活力[15,19]。取粗酶液进行适当稀释,分别取以上稀释液100 μL和底物900 μL混匀,在60 ℃条件下反应10 min,反应后加入1 mL DNS显色剂混匀,沸水煮沸5 min,冲凉后加入8 mL纯水,混匀后检测波长540 nm处的吸光度值(OD540 nm)。反应条件下每1 min水解产生相当于1 μmol D-甘露糖所需要的酶量定义为1个酶活力单位,U/mL[2]。
分析过程中以灭活酶液作为空白对照,每项测试重复3次,酶活计算公式如下:
式中:10-定容体积,mL;F-由标准曲线得到的葡萄糖质量浓度,μg/mL;n-稀释倍数;V-加入酶液体积,mL;t-反应时间,min;180-葡萄糖摩尔质量,g/mol。
1.3.7 菌株发酵条件优化
单因素试验:在初始发酵培养基的基础上,通过更换不同碳氮源种类以及用量,在发酵时间为24 h的条件下[15],研究6种碳源(魔芋粉、瓜尔胶、刺槐豆胶、蔗糖、可溶性淀粉、β-甘露糖)、6种氮源((NH4)2SO4、NH4Cl、NaNO3、大豆蛋白胨、蛋白胨、胰蛋白胨)、初始pH(5.0、6.0、7.0、8.0、9.0)、碳源添加量(10 g/L、20 g/L、30 g/L、40 g/L)、氮源添加量(30 g/L、15 g/L、10 g/L、7.5 g/L、5 g/L)、发酵温度(20 ℃、25 ℃、30 ℃、37 ℃)对菌株产酶的影响。
响应面试验设计:根据单因素试验结果,采用Box-Behnken试验设计方案,选择对β-甘露聚糖酶活力影响较大的3个因素(碳源添加量、氮源添加量和初始pH)。 使用Design Expert 8.0.6软件进行响应面试验设计。每个因素设3个水平(-1、0、1),以β-甘露聚糖酶活力作为响应值,对发酵条件进行设计优化[20-21]。响应面试验因素与水平见表1。
表1 菌株发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface experiments for strain fermentation conditions optimization
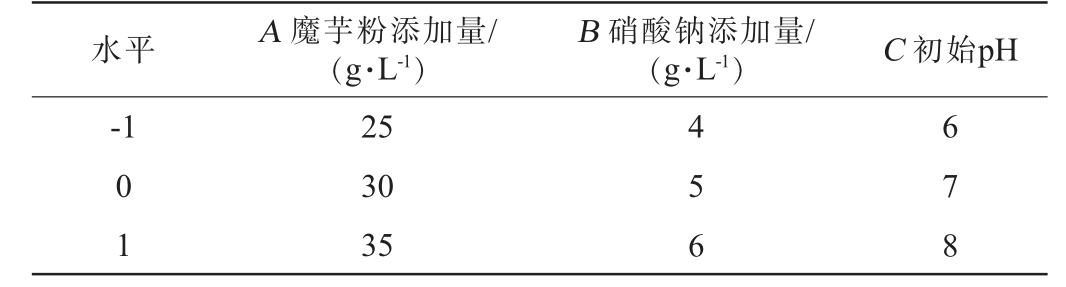
水平 A 魔芋粉添加量/(g·L-1)B 硝酸钠添加量/(g·L-1) C 初始pH-1 0 1 25 30 35 4 5 6 6 7 8
1.3.8 数据统计分析
取3次平行试验得到的结果,在GraphPad Prism 5.0中通过软件内置功能计算并绘制误差限,采用单因素方差分析的多组比较法评估组间显著性差异,最终通过软件输出结果。
2 结果与分析
2.1 产β-甘露聚糖酶菌株的分离筛选
通过平板划线法从土壤样品中共分离得到6株菌,分别命名为D-1~D-6,利用I-KI透明圈法进行初筛,观察其产透明圈现象,结果见图1。
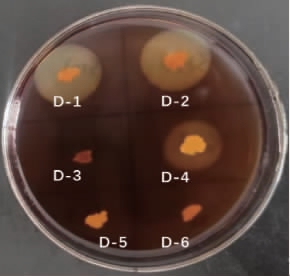
图1 分离菌株初筛结果
Fig.1 Preliminary screening results of isolated strains
由图1可知,在6株菌中得到3株菌可产生透明圈现象,分别为菌株D-1、D-2和D-4,对这3株菌进行产酶活力测定,结果见表2。由表2可知,菌株D-1产酶活力最高,为12.19U/mL,其次为菌株D-2,酶活力为10.64 U/mL,因此后续选择菌株D-1进行研究。
表2 菌株D-1发酵条件优化响应面试验设计及结果
Table 2 Design and results of response surface tests for strain D-1 fermentation conditions optimization
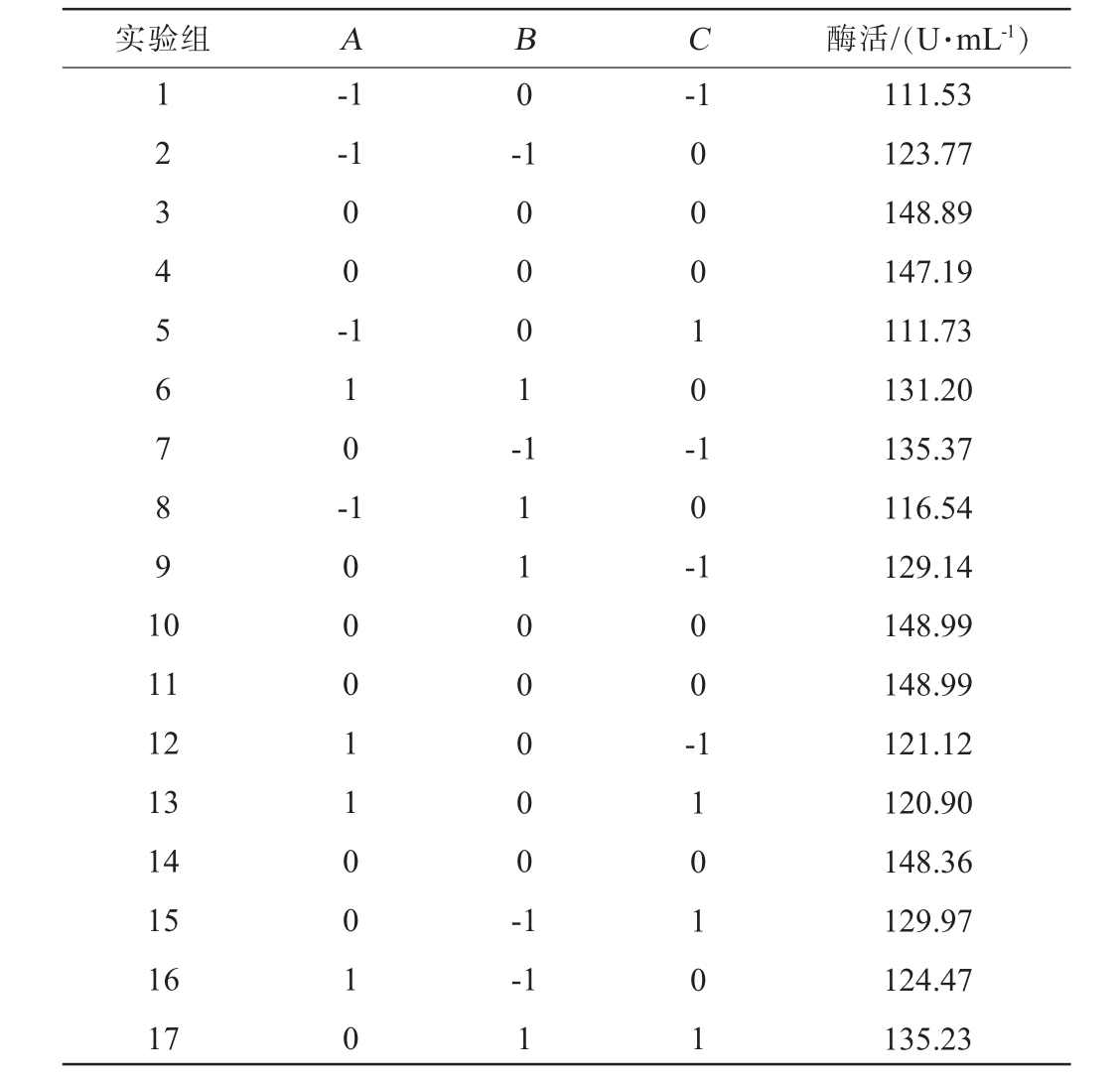
实验组 A B C 酶活/(U·mL-1)1 2 3 4 5 6 7 8 9 1 0-1-1 0-1-1 0 0 -1 1 0 -0 0 0 1 -0 0 0 1 0 -1 0 -11 12 13 14 15 16 17 1 0 0 0 1 1 0 0 1 0 1 1 1 0 0 0 0 0 -1 1 0 0 --1 1 1 1 0 1 0 1 111.53 123.77 148.89 147.19 111.73 131.20 135.37 116.54 129.14 148.99 148.99 121.12 120.90 148.36 129.97 124.47 135.23
表2 产β-甘露聚糖酶菌株酶活力测定结果
Table 2 Enzyme activity determination results of β-mannanaseproducing strains
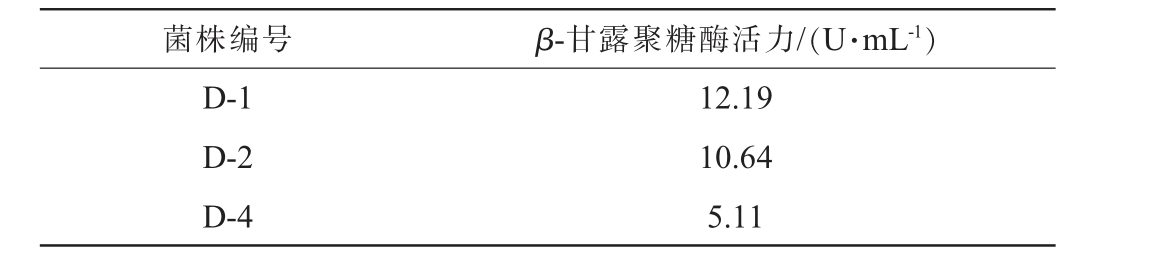
菌株编号 β-甘露聚糖酶活力/(U·mL-1)D-1 D-2 D-4 12.19 10.64 5.11
2.2 菌株D-1的菌落形态及革兰氏染色结果
对菌株D-1进行划线培养和革兰氏染色, 结果见图2。由图2可知,菌株D-1的菌落呈米色,近圆形,边缘规则,表面隆起,微微折皱,革兰氏染色呈蓝紫色,为革兰氏阳性菌,菌体呈杆状,初步判定为芽孢杆菌属(Bacillus)。
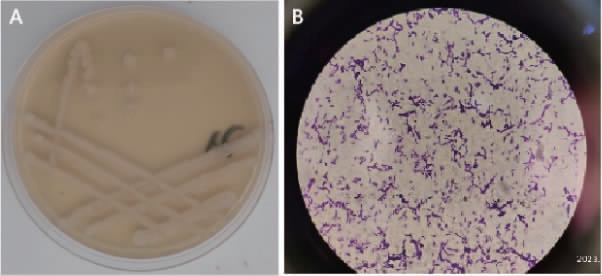
图2 菌株D-1在LB培养基上的菌落形态(A)及革兰氏染色结果(B)
Fig.2 Colony morphology of strain D-1 on LB medium (A) and gram stained results (B)
对筛选的产β-甘露聚糖酶菌株D-1提取基因组,利用通用引物27F/1492R进行16S rDNA扩增,得到目标片段大小为1 485 bp,通过BLAST进行序列比对,用MEGA11.0进行发育树构建,结果见图3。 由图3可知,菌株D-1与枯草芽孢杆菌(NR 027552)序列同源性最高,为100%,结合菌落形态特征,鉴定该菌株为枯草芽孢杆菌(Bacillus subtilis)。
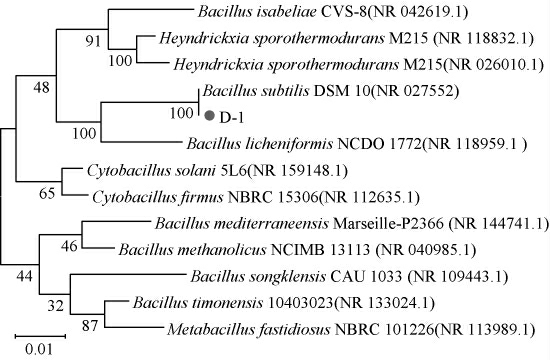
图3 基于16S rDNA序列构建的菌株D-1系统发育树
Fig.3 Phylogenetic tree of strain D-1 based on 16S rDNA sequence
2.3 菌株D-1发酵条件优化单因素试验
β-甘露聚糖酶是一种诱导性酶,产酶效果会随着诱导物不同产生较大差异化,分别选取6种不同物质作为碳源(添加量10 g/L)进行初始发酵培养基碳源替换试验,结果见图4A。由图4A可知,所选的6种碳源均可诱导菌株D-1产酶,以魔芋粉作为诱导物产酶效果最好,酶活可达到44.27 U/mL。 其次是蔗糖作为碳源的17.60 U/mL,其余碳源诱导产酶活力则在9.09~13.29 U/mL之间,经数据分析,魔芋粉作为碳源的结果显著优于其余5种碳源(P<0.05),因此选择魔芋粉作为发酵碳源,这一结果与多数研究学者结果相一致[5,22,24]。

图4 培养条件对菌株D-1产酶的影响
Fig.4 Effect of culture conditions on enzyme production by strain D-1
不同小写字母代表组间差异显著(P<0.05)。
选取6种氮源对初始发酵培养基中氮源进行替换试验(添加量10 g/L),结果见图4B。由图4B可知,硝酸钠作为氮源诱导产酶效果最好,菌株酶活可达到71.70 U/mL,优于初始发酵添加蛋白胨的44.73 U/mL,且显著高于其他氮源(P<0.05)。总体来看无机氮源对菌株D-1产酶的诱导效果优于有机氮源,选择硝酸钠作为发酵氮源。
选取前期效果最好的魔芋粉10 g/L和硝酸钠10 g/L分别作为发酵培养基的碳、氮源,使用20%盐酸溶液和20%氢氧化钠溶液调节发酵培养基的初始pH,初始发酵pH对产酶的影响见图4C。由图4C可知,发酵初始pH在5.0~7.0范围内,产酶活性随着pH升高而显著升高(P<0.05),直至7.0时达到最高(107.27 U/mL)。 继续调高初始pH,产酶活性则开始缓慢下降(P<0.05)。因此,选择初始pH值为7.0。
发酵温度对菌株产酶的影响见图4D。由图4D可知,发酵温度在20~30 ℃范围内,产酶活性随着温度升高而显著升高(P<0.05),直至30 ℃时达到最大活性138.3 U/mL,继续升高发酵温度则产酶活性开始下降。因此,选择发酵温度为30 ℃。
固定氮源添加量为10 g/L,通过单因素控制碳源的量进行试验,发酵碳源的量对产酶的影响见图4E。 由图4E可知,以魔芋粉为碳源,添加量在10~30 g/L时,产酶活性随着碳源含量增高而显著增高(P<0.05),在30 g/L时达到最大值141.9 U/mL,继续增加碳源添加量,产酶活性则开始下降,推测出现此现象的原因为魔芋粉添加量过高导致培养介质黏度过高,影响了溶液中溶氧量,菌株生长受到抑制,因此在有限时间内产酶活性较低。因此,魔芋粉最佳添加量为30 g/L。
固定魔芋粉的添加量为30 g/L,调整氮源添加量进行试验,硝酸钠的添加量对产酶的影响见图4F。由图4F可知,氮源的添加量与产酶活性无一致性,硝酸钠添加量为5 g/L时,产酶活性最高,显著高于其他添加量(P<0.05),在此条件下测得酶活可达146.8 U/mL。因此,选择硝酸钠5 g/L进行发酵培养。
2.4 菌株D-1发酵条件优化响应面试验设计及结果
根据单因素试验结果,选取对酶活影响最大的3个单因素魔芋粉添加量(A)、硝酸钠添加量(B)和初始发酵pH(C)作为考察因素,运用Desgin-Expert 8.0.6进行响应面试验设计,结果见表2,回归模型方差分析结果见表3。
表3 回归模型方差分析结果
Table 3 Variance analysis results of regression model
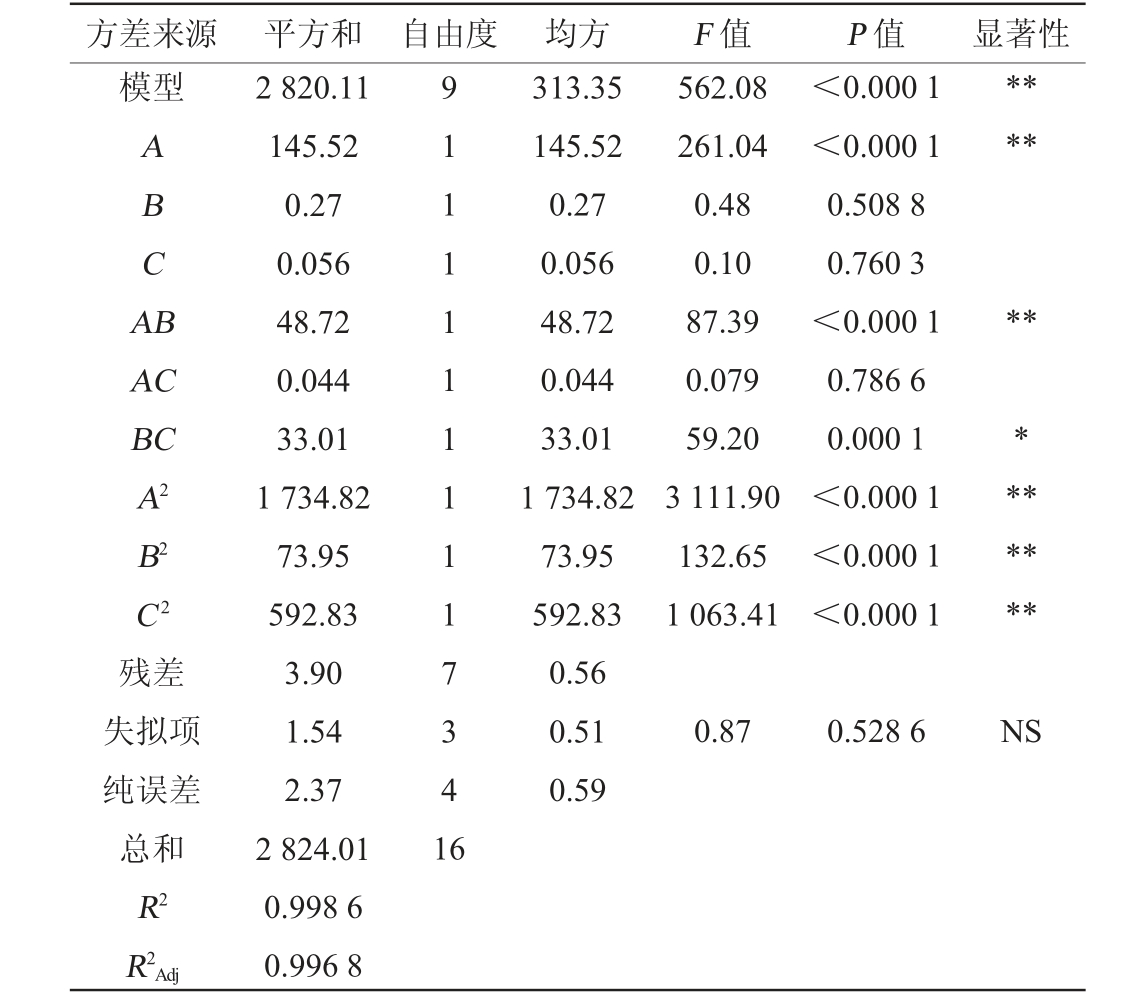
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B******AC BC A2 B2 C2残差失拟项纯误差总和R2 R2Adj 2 820.11 145.52 0.27 0.056 48.72 0.044 33.01 1 734.82 73.95 592.83 3.90 1.54 2.37 2 824.01 0.998 6 0.996 8 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 313.35 145.52 0.27 0.056 48.72 0.044 33.01 1 734.82 73.95 592.83 0.56 0.51 0.59 562.08 261.04 0.48 0.10 87.39 0.079 59.20 3 111.90 132.65 1 063.41<0.000 1<0.000 1 0.508 8 0.760 3<0.000 1 0.786 6 0.000 1<0.000 1<0.000 1<0.000 1*******0.87 0.528 6 NS
运用Desgin-Expert 8.0.6分析试验结果,对数据进行多元二次回归拟合,得到二次元回归方程为
由表3可知,模型的P<0.000 1,表明模型具有极显著性,失拟项P=0.526 8>0.05,不显著,表明方程拟合度较好。决定系数R2=0.998 6,说明实际值与预测值相关性较高。因此,该模型能较好地反应发酵培养过程中各因素变化与响应值的关系并预测最佳发酵条件。 由P值可知,一次项A、交互项AB和所有二次项对结果影响均为极显著(P<0.01),交互项BC对产酶影响显著(P<0.05),其余因素对结果影响不显著(P>0.05)。由F 值可知,三个因素对最终产酶的影响顺序为:A>B>C,即魔芋粉添加量>硝酸钠添加量>初始pH。
等高线由响应面在水平方向向下投影而成,等高线呈椭圆形,表明这两种因素有较显著的交互作用,呈圆形则不显著[23],运用Desgin-Expert 8.0.6软件做出各因素之间交互作用对酶活影响的等高线及响应面图,结果见图5。

图5 各因素之间交互作用对菌株D-1产酶影响的等高线图及响应面图
Fig.5 Response surface plots and contour lines of effect of interaction between various factors on enzyme production by strain D-1
由图5可知,当硝酸钠添加量不变时,随着魔芋粉含量的增加,酶活力出现了先增大后减小的趋势。当pH不变时,随着魔芋粉添加量的增加,酶活力也出现了明显先增大后减小的趋势,且曲面呈钟罩型,说明两者之间交互作用显著。当pH不变时,随着硝酸钠含量的增加,对酶活影响较小,当硝酸钠含量固定,随着pH的升高酶活仍呈现先升高后降低的趋势。
通过Design-Expert 8.0.6软件对试验数据进行优化预测,得到菌株D-1产甘露聚糖酶的最优发酵条件为魔芋粉30.53 g/L,NaNO3 5.03 g/L,pH=7.0,在30 ℃的培养条件下酶活预测值可达148.71 U/mL。 结合实际操作条件,发酵条件修正为魔芋粉31 g/L,NaNO3 5.0 g/L,K2HPO4 1 g/L,MgSO4 0.25 g,pH=7,在30 ℃的培养条件下发酵24 h,在此条件下进行3次验证试验,酶活实际值达到148.88 U/mL,与预测值较为接近,是优化前的12.21倍,说明该模型可用于菌株D-1产酶条件优化。
3 结论
该研究从大豆种植基地土壤中分离筛选出一株高产β-甘露聚糖酶菌株D-1,该菌株被鉴定为枯草芽孢杆菌(Bacillus subtilis)。 通过单因素及响应面试验优化得到菌株D-1最适产酶发酵条件为魔芋粉31 g/L、NaNO3 5 g/L、K2HPO4 1 g/L、MgSO4 0.25 g/L、pH=7、30 ℃发酵24 h。在此条件下,酶活力可达到148.88 U/mL,是优化前的12.21倍,研究结果为后续工业化生产和应用提供了支持。
[1]YANG M,CAI J,WANG C,et al.Characterization of endo-β-mannanase from Enterobacter ludwigii MY271 and application in pulp industry[J].Bioprocess Biosyst Eng,2017,40(1):35-43.
[2]秦玲丽.β-甘露聚糖酶产生菌株的筛选、基因克隆与表达及酶学性质研究[D].广州:华南理工大学,2018.
[3]COVRTOIS J E, KADA T, PETEK F.Recherches sur les galactomannanes.II.Action de la taka-diastase sur la galactomannane de Luzerne[J].Biochimie,1958,40(12):2031-2037.
[4]张建新,宋宜乐,冯军厂,等.微生物β-甘露聚糖酶的研究进展[J].中国酿造,2019,38(4):7-10.
[5]龚劲松,李恒,刘恒霞,等.碳氮源对枯草芽孢杆菌发酵产β-甘露聚糖酶的影响[J].食品与发酵工业,2015,41(10):34-39.
[6]DAWOOD A,MA K.Applications of microbial β-mannanases[J].Front Bioeng Biotechnol,2020,15(8):598-630.
[7]NORIZAN N A B M,HALIM M,TAN J S,et al.Enhancement of β-mannanase production by Bacillus subtilis ATCC11774 through optimization of medium composition[J].Molecules,2020,25(15):3516.
[8]SONI H, RAWAT H K, AHIRWAR S, et al.Screening, statistical optimized production,and application of β-mannanase from some newly isolated fungi[J].Eng Life Sci,2016,17(4):392-401.
[9]郑豪蕾,王晓倩,李玉梅,等.微生物来源的β-甘露聚糖酶的研究与应用进展[J].聊城大学学报(自然科学版),2023,36(2):79-90.
[10]BLIBECH M, ELLOUZ GHORBEL R, CHAARI F, et al.Improved mannanase production from Penicillium occitanis by fed-batch fermentation using acacia seeds[J].ISRN Microbiol,2011,2011:938347.
[11]WANG P,PEI X,ZHOU W,et al.Research and application progress of microbial β-mannanases:A mini-review[J].World J Microb Biot,2024,40(6):169-177.
[12]DAVID A,CHAUHAN P,KUMAR A,et al.Coproduction of protease and mannanase from Bacillus nealsonii PN-11 in solid state fermentation and their combined application as detergent additives[J].Int J Biol Macromol,2018,108:1176-1184.
[13]THOMBARE N, JHA U, MISHRA S, et al.Guar gum as a promising starting material for diverse applications:A review[J].Int J Biol Macromol,2016,88:361-372.
[14]王佰涛,刘德海,陈晓飞,等.高产β-甘露聚糖酶黑曲霉菌株的分离与鉴定[J].中国酿造,2022,41(5):101-105.
[15]李盛前,侯颖,范鑫诺,等.枯草芽胞杆菌甘露聚糖酶发酵条件优化[J].微生物学杂志,2022,42(6):39-45.
[16]王烁,季海蕊,那瑞莹,等.干酪乳杆菌(Lactobacillus casei)3MP-5-3产β-甘露聚糖酶条件优化[J].黑龙江大学工程学报,2022,13(2):84-90.
[17]宋萍.压裂液破胶酶制取及破胶效果评价[D].青岛:中国石油大学(华东),2023.
[18]袁蕊,王学江,李峰.一株枯草芽孢杆菌的分离鉴定及其发酵条件优化[J].化学与生物工程,2019,36(7):35-38.
[19]熊玉华,周蕾,杨世忠,等.低温β-甘露聚糖酶的酶学性质及破胶性能[J].应用化学,2023,40(1):134-145.
[20]VIJAYARAGHAVAN P,RAJENDRAN P,PRAKASH VINCENT S G,et al.Novel sequential screening and enhanced production of fibrinolytic enzyme by Bacillus sp.IND12 using response surface methodology in solid-state fermentation[J].BioMed Res Int,2017,2017:3909657.
[21]孙金梦,涂宗财,王辉,等.鱼蛋白胶芒果糕的制备工艺优化及品质分析[J].食品工业科技,2022,43(20):189-195.
[22]YOU J,LIU J F,YANG S Z,et al.Low-temperature-active and salt-tolerant β-mannanase from a newly isolated Enterobacter sp.strain N18[J].J Biosci Bioeng,2016,121(2):140-146.
[23]LEVIN L,HERRMANN C,PAPINUTTI V L.Optimization of lignocellulolytic enzyme production by the white-rot fungus Trametes trogii in solid-state fermentation using response surface methodology[J].Biochem Eng J,2008,39(1):207-214.
[24]曲丽娜,王瑞明,肖静,等. β-甘露聚糖酶高产菌株发酵条件优化[J].食品与发酵工业,2012,38(12):64-69.
[25]覃宝山,何海燕,李燕婷,等.β-葡萄糖苷酶产生菌的筛选鉴定及其粗酶液酶学性质研究[J].中国酿造,2024,43(8):128-132.