灰霉菌(Botrytis cinerea),又称灰葡萄孢,归类于半知菌纲下的丛梗孢目、丛梗孢科及葡萄孢属,它不仅导致葡萄灰霉病,也是贵腐病的致病因素[1]。 这种霉菌在特定条件下能侵染成熟的葡萄果实,为酿造珍贵的天然贵腐葡萄酒提供原料。然而,贵腐葡萄原料产生的自然条件较为苛刻,这种侵染过程极为挑剔,受到葡萄品种、地理位置及局部气候等多重因素的严格制约,且感染时机难以控制,因此难以普遍实现。只有当温度、湿度环境恰到好处,白昼晴朗干燥,形成独特的干湿循环,灰葡萄孢才能适度感染果实,促使葡萄在树上自然浓缩[2]。
贵腐作用(Noble Rot)是一种特殊的自然现象,由真菌引发,它在特定气候条件下对葡萄产生积极作用,利用灰葡萄孢在成熟葡萄浆果上的贵腐作用,使浆果含糖量提高,同时在生长过程中产生一些次生代谢物质,最终酿造成的浓甜葡萄酒[3]。 安荣艳[4]研究发现,灰霉菌侵染的贵腐葡萄所酿贵腐酒的香气成分中酯类、内酯类和呋喃类等香气物质的含量均有不同程度的增加。因灰葡萄孢表达代谢存在差异,从而丰富了葡萄的风味[5],使其酿造出来的贵腐葡萄酒香气和口感独特,特有的贵腐风味,如柑橘、葡萄柚、蜂蜜、焦糖等香气,受到越来越多的消费者青睐。
国内外已陆续有关于人工贵腐酒的研究,为了稳定地生产相对价廉物美的贵腐葡萄酒,在条件可控的室内对已采摘的葡萄进行灰霉菌的接种[6]。 尽管人工贵腐酒的研究在国内外已经逐渐展开[7-8],黄露莉等[9]以玫瑰蜜葡萄为原料,通过人工接种灰霉菌的方法来获得贵腐葡萄,结果表明,玫瑰蜜人工贵腐酒含有更多种类的酯类和醛酮类化合物,具有典型的香气成分,更加丰富和复杂的香气特征。王超萍等[10]从贵腐菌的特性、贵腐酒、贵腐酒的香气特征等方面进行分析总结,为进一步揭示贵腐作用提供参考。JACKSON R S[11]研究指出,使用葡萄浆果和葡萄汁均可接种灰霉菌来酿造贵腐酒。 李玮等[12-13]发明一种贵腐葡萄的培育方法及贵腐葡萄的制备方法。
本研究基于贺兰山东麓产区威代尔(Vidal)葡萄在自然条件下具有贵腐特征的潜力,采用人工接种灰霉菌技术对威代尔葡萄果实进行处理,同时以自然感染灰霉菌的威代尔葡萄及健康威代尔葡萄为对照,进行威代尔贵腐葡萄酒的酿造,采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)结合气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)技术和感官品评,对威代尔贵腐葡萄酒香气成分和香气特征进行研究,为贺兰山东麓威代尔贵腐葡萄酒的酿造、香气改善、工艺创新和新产品研发提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和原料
灰霉菌(Botrytis cinerea) Botrytis-T:2023年6-9月,从宁夏贺兰山东麓产区代表性酒庄采集感染葡萄灰霉病果实,采用组织分离法分离病原菌获得的葡萄灰霉病菌。 酿酒酵母(Saccharomyces cerevisiae):保定卓越生物工程技术有限公司。 威代尔葡萄:2023年贺兰山东麓产区森淼兰月谷酒庄。
1.1.2 试剂
NaCl(分析纯):国药集团化学试剂有限公司;无水乙醇(色谱纯):上海阿拉丁试剂有限公司;C8~C20正构烷烃(均为色谱纯)、香气物质标准品(均为色谱纯):美国Sigma公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g/L,葡萄糖20.0 g/L,琼脂粉15.0 g/L,定容至1.0 L。121 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
PAL3自动进样器:瑞士CTC Analytics公司;DVB/CAR/PDMS萃取头(50/30μm,1cm):美国Supelco公司;DB-WAX色谱柱(60 m×250 μm×0.25 μm)、7890B-7000D气相色谱-质谱联用仪:美国Agilent公司。
1.3 方法
1.3.1 灰霉菌菌悬液制备
挑取直径5 mm的灰霉菌饼接放入1 L无菌水里,匀速振荡3 h后用四层纱布过滤,装入无菌喷壶。
1.3.2 人工接种灰霉菌
在威代尔葡萄果实总糖含量220 g/L左右,总酸含量6~7 g/L时,对试验葡萄果实进行人工接种灰霉菌(实验组)。将灰霉菌菌悬液经过3~4层的纱布过滤后,在傍晚对试验葡萄果实进行人工喷洒,每天喷洒一次,注意喷洒时需均匀喷在葡萄果实表面,只喷洒果实,尽量避开周围的植株部分。 当葡萄果实还原糖含量≥300 g/L,观察受灰霉菌葡萄孢侵染的葡萄果实具备贵腐特征时,停止喷洒灰霉菌悬液。以同一时期未接种灰霉菌正常葡萄果实(CK组)和自然感染灰霉菌的葡萄果实(自然组)作为对照。 喷洒后、喷洒中期及采收期的葡萄果实形态见图1。

图1 喷洒后(a)、喷洒中期(b)及采收期(c)的葡萄果实形态
Fig.1 Morphology of grape fruits after spraying (a), mid-term spraying (b) and harvest period (c)
1.3.3 威代尔葡萄酒加工工艺流程及操作要点
威代尔葡萄总糖含量(300 g/L)达标后同时采收,采用5 L和10 L广口玻璃瓶容器酿造,CK组、实验组和自然组葡萄果实同时采收,采取相同工艺流程酿造,保证酿造条件的一致。
威代尔葡萄→采摘、分选→榨汁→入罐→酶解澄清→皂土净化→控温发酵→终止发酵→添加SO2和山梨酸钾→低温陈酿→灌装→威代尔葡萄酒
操作要点:采摘后威代尔葡萄用自制小型压榨机对果实进行快速压榨取汁,压榨过程中不断添加干冰,通过分次加入以降温及隔绝氧气。 压榨后果汁无需过滤,通过小型压榨机出汁口直接流入充满CO2的广口瓶,入瓶后立即添加60 mg/L的SO2防止果汁氧化,并抑制杂菌生长,同时分次添加果胶酶30 mg/L进行澄清,保持与葡萄果汁混合均匀。 葡萄果汁室温下静置24 h后,将活化皂土(将其充分溶解在60 ℃水中,不断搅拌,静置24 h,使用前再搅拌10~15 min)加入果汁中,皂土添加量为1.5 g/L。广口瓶密封后于4~5 ℃下静置24 h;待果汁澄清后分离出上清液,通过人工升温至16~18 ℃时,接种200 mg/L酿酒酵母(事先加入其10倍质量的35~40 ℃温水活化30 min),添加时控制酵母液与果汁的温差≤10 ℃,酒精发酵温度控制在18~22 ℃;监测还原糖含量为100 g/L时,将酒温降至0 ℃以下,添加200 mg/L的SO2及200 mg/L山梨酸钾终止发酵,混合均匀后分离酒脚,将原酒降温至0 ℃低温贮藏。待酒样稳定后装瓶进行品质分析检测。
1.3.4 挥发性香气成分测定
使用HS-SPME-GC-MS法检测葡萄酒香气成分。
样品前处理:将1.5gNaCl至于20mL顶空瓶中,吸取5mL酒样加入顶空瓶后将质量浓度为1.0083 g/L的4-甲基-2-戊醇内标溶液滴入顶空瓶,立即密封瓶口。以250 r/min振荡样品,萃取头老化温度为250 ℃,时间10 min,在40 ℃预热5 min后再萃取30 min。
GC条件:DB-WAX色谱柱(60 m×250 μm×0.25 μm),进样口温度230 ℃;升温程序为起始柱温50 ℃,保持1 min,3 ℃/min升温到220 ℃,保持5 min;载气为高纯氦气(He)(纯度≥99.999%),流速1 mL/min,不分流进样。
MS条件:电子电离(electronic ionization,EI)源;电子能量70 eV,传输线温度235 ℃,离子源温度230 ℃,接口温度250 ℃,扫描范围30~500 amu。
定性定量方法:利用MassHunter Qualitative navigator 10.0软件提取香气成分质谱图,并通过美国国家标准技术研究所(National Institute of Standards and Technology,NIST)17谱库、C8~C20烷烃混合标准品的保留时间(retention time,RT)比对进行定性分析;利用内标法进行定量分析。
1.3.5 感官品评
组织10位贺兰山东麓葡萄酒产区相关专家组成感官品评小组(其中男性5名,女性5名,年龄在24~60岁),参考相关文献[14-15]对贵腐葡萄酒香气浓郁度、平衡度和纯正度3个方面及威代尔品种10种主要香气特征(菠萝味、柑橘味、梨子味、桃子味、杏子味、蜂蜡味、焦糖味、香草味、果酱味、香料味)进行品评打分,每项采用10分制(0分表示无此类香气、1~3分表示微弱且较难分辨、4~6分表示能分辨但比较微弱、7~9分表示能分辨且强烈、10分非常强烈)。 每组数据去除最大值和最小值后统计最终平均得分。
1.3.6 气味活性值的计算
采用气味活性值(odor activity value,OAV)法,参考文献[16]的计算方法,气味活性值为香气成分质量浓度与其对应阈值的比值。 通常以OAV>1作为关键风味物质的筛选依据,且OAV越大,说明该物质的香气贡献越大。
1.3.7 数据处理
采用Microsoft Excel 2021软件统计数据,结果以“平均值±标准差”表示;采用Origin Pro2024b软件进行柱状图及雷达图的绘制。
2 结果与分析
2.1 威代尔葡萄酒香气种类及含量
对CK组、实验组及自然组威代尔葡萄酿造的3种葡萄酒香气成分进行检测,结果见表1。 由表1可知,3种葡萄酒共检出50种挥发性风味成分,其中醇类12种、酯类22种、酸类5种、醛类6种、萜烯类5种。CK组共检出48种挥发性风味成分,其中醇类11种、酯类21种、酸类5种、醛类6种、萜烯类5种;实验组共检出50种挥发性风味成分,其中醇类12种、酯类22种、酸类5种、醛类6种、萜烯类5种;自然组共检出47种挥发性风味成分,其中醇类10种、酯类21种、酸类5种、醛类6种、萜烯类5种。
表1 3种葡萄酒挥发性风味成分含量检测结果及关键香气物质的气味活性值
Table 1 Determination results of volatile flavor components contents in three kinds of wine and odor activity values of key aroma substances
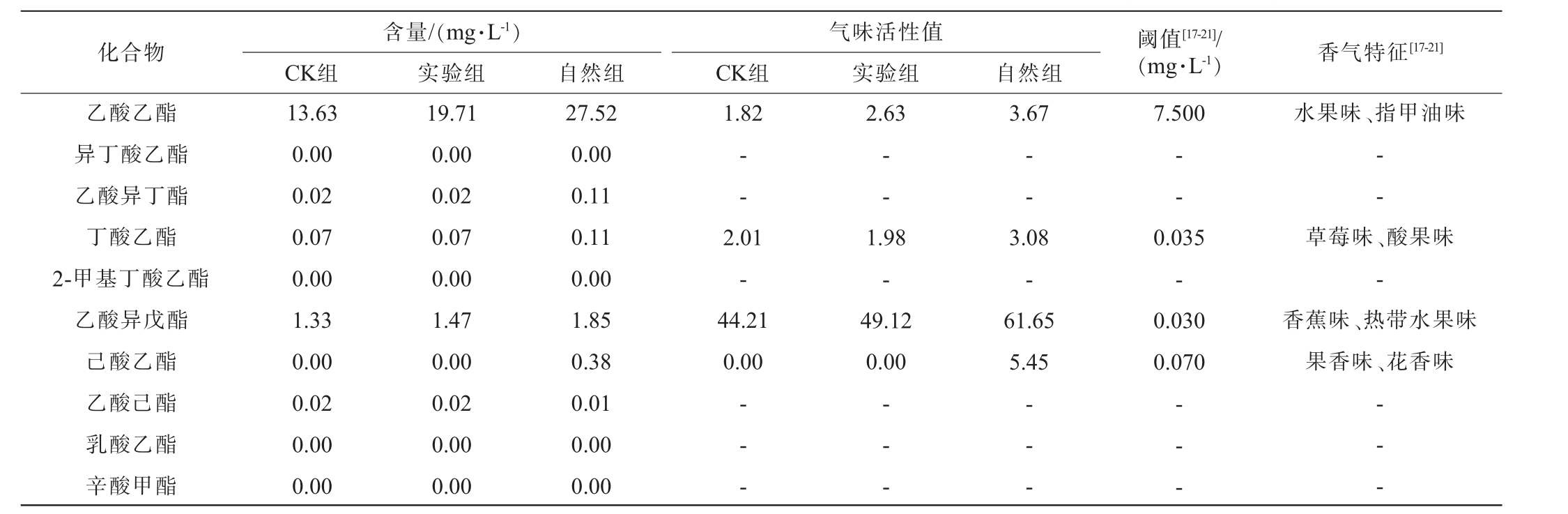
含量/(mg·L-1)CK组 实验组化合物 阈值[17-21]/(mg·L-1) 香气特征[17-21]气味活性值CK组 实验组 自然组乙酸乙酯异丁酸乙酯乙酸异丁酯丁酸乙酯2-甲基丁酸乙酯乙酸异戊酯己酸乙酯乙酸己酯乳酸乙酯辛酸甲酯13.63 0.00 0.02 0.07 0.00 1.33 0.00 0.02 0.00 0.00 19.71 0.00 0.02 0.07 0.00 1.47 0.00 0.02 0.00 0.00自然组27.52 0.00 0.11 0.11 0.00 1.85 0.38 0.01 0.00 0.00 1.82 2.63 3.67 7.500水果味、指甲油味————--2.01-44.21 0.00 1.98-49.12 0.00 3.08-61.65 5.45 0.035-0.030 0.070草莓味、酸果味-香蕉味、热带水果味果香味、花香味-- --- --- --- --- -
续表
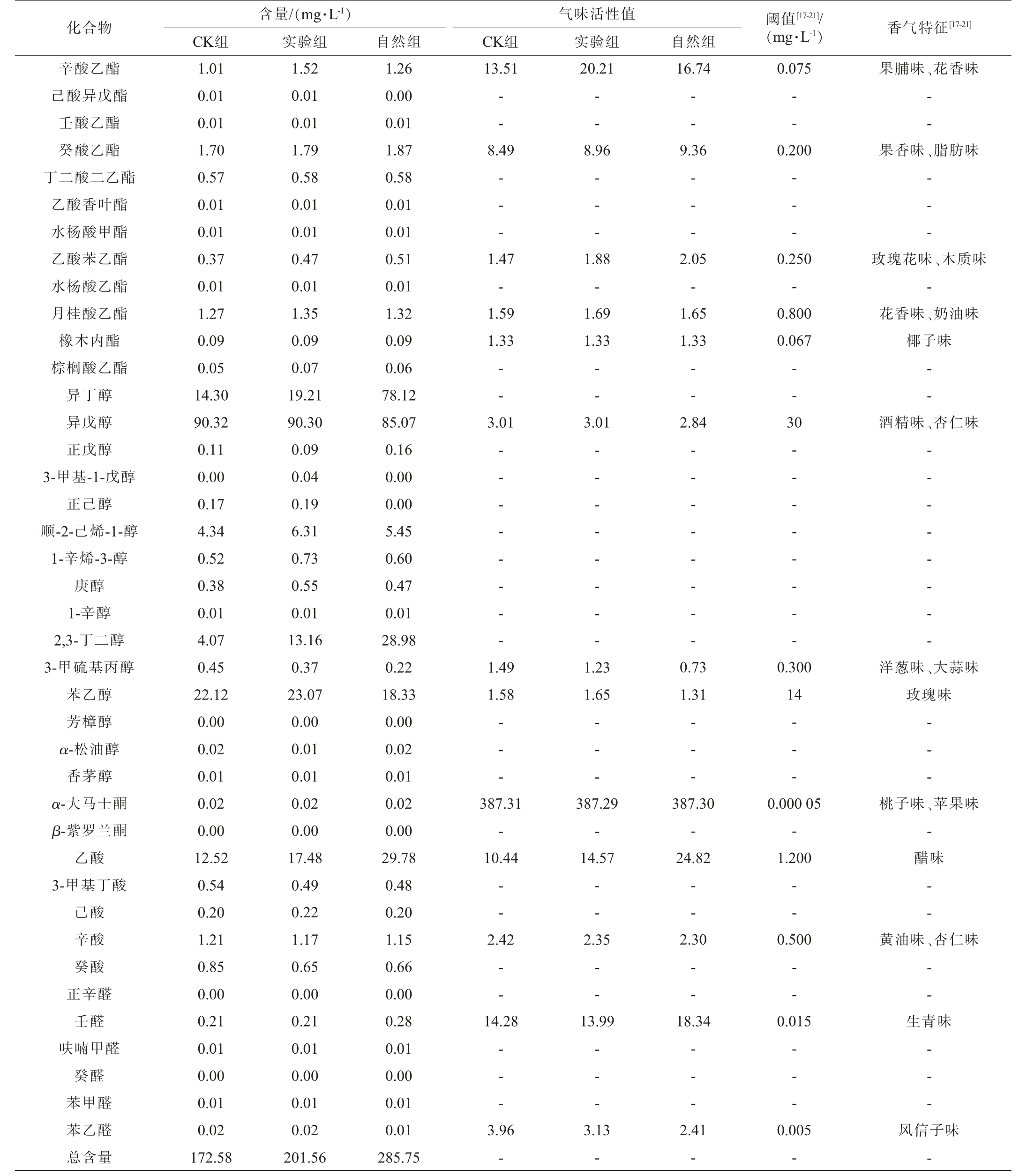
注:“-”暂为无相关阈值的香气成分。
?
由表1可知,自然组的葡萄酿造出的葡萄酒香气成分总量达285.75 mg/L,高于实验组和CK组酿造出的葡萄酒香气成分总含量。 表明人工接种灰葡萄孢的威代尔葡萄酿造出的贵腐葡萄酒香气成分总含量在一定程度上高于正常健康的威代尔葡萄酿造出的葡萄酒,但不及自然感染灰霉菌的威代尔葡萄酿造出的贵腐葡萄酒。 可能是由于人工接种在感染过程和条件上达不到自然感染的效果。贵腐酒中特征性酯类物质在一定情况下进行组合才会赋予酒体热带水果的甜香味等特征[22]。人工接种虽然可以模拟灰葡萄孢的感染,但往往难以完全复制自然条件下的感染过程,自然感染灰葡萄孢的葡萄浆果,其感染过程更为复杂,可能涉及到多种微生物的相互作用,这些微生物在感染过程中可能产生一些特定的酶或代谢产物[5],从而影响葡萄酒的香气成分。同时,自然条件下,灰葡萄孢的感染往往伴随着其他微生物的生长和繁殖,如野生酵母、细菌等,这些微生物与灰葡萄孢之间的相互作用可能产生一些独特的香气成分[23]。而人工接种可能无法完全模拟这种微生物群落结构,导致香气成分总含量相对较低。
醇类物质不仅是贵腐葡萄酒中含量较高的香气类型,也是大多数葡萄酒中含量最高的香气成分类型[2]。由表1可知,CK组、实验组和自然组中醇类物质含量分别为136.78 mg/L、154.03 mg/L和217.41 mg/L。CK组与实验组中OAV>1的关键醇类化合物有3种,分别为异戊醇、3-甲硫基丙醇和苯乙醇;自然组中OAV>1的关键醇类化合物只有2种,分别为异戊醇和苯乙醇。3-甲硫基丙醇具有硫醇类特有的强烈气味(洋葱味、大蒜味),这类气味往往不被消费者所喜爱,自然组中的3-甲硫基丙醇OAV为0.73,低于CK组与实验组,说明自然组在洋葱味、大蒜味的挥发程度低于其他2组。
酯类物质主要来源于微生物发酵阶段,它们的阈值较低,容易被人们感知到,能为贵腐葡萄酒带来丰富的热带水果等气味特征[24],由表1可知,CK组、实验组和自然组中酯类物质含量分别为20.17 mg/L、27.21 mg/L和35.71 mg/L。CK组与实验组中OAV>1的关键酯类化合物有8种,分别为乙酸乙酯、丁酸乙酯、乙酸异戊酯、辛酸乙酯、癸酸乙酯、乙酸苯乙酯、月桂酸乙酯和橡木内酯,实验组中辛酸乙酯和月桂酸乙酯表现出较高的OAV,均高于自然组和CK组,为葡萄酒带来更浓郁的烤水果味和奶油味[25];而自然组中OAV>1的关键酯类化合物有9种,在上述基础上多了己酸乙酯,同时乙酸乙酯、丁酸乙酯、乙酸异戊酯、己酸乙酯、癸酸乙酯和乙酸苯乙酯也表现出较高的OAV,均高于实验组和CK组,为葡萄酒贡献更浓郁的热带水果味、果香味、花香味和香蕉味。
酸类物质不仅影响口感,还参与葡萄酒香气的构成,尤其是乙酸,形成于某些细菌被酒精的氧化,或被醋酸菌污染后产生,其在贵腐酒中大量存在[8],由表1可知,CK组、实验组和自然组中酸类物质含量分别为15.32 mg/L、20.01 mg/L和32.27 mg/L。 CK组、实验组和自然组中OAV>1关键酸类化合物有2种,均为乙酸和辛酸,而自然组中乙酸OAV远大于其他2组,其含量达到了29.78 mg/L,这也是贵腐酒中典型香气成分。
CK组、实验组和自然组中醛类物质含量分别为0.25mg/L、0.26 mg/L和0.31 mg/L。壬醛和苯乙醛作为CK组、实验组和自然组中OAV>1的关键醛类化合物,使得葡萄酒中具有生青味,同时能表现出风信子的香气[26]。
CK组、实验组和自然组中萜烯类物质含量分别为0.05 mg/L、0.04 mg/L和0.04 mg/L。 萜烯类物质主要以结合态的形式存在于果实表皮中,也被称为品种香气,其含量相对较少,阈值也比较低,根据贵腐作用程度不同,葡萄酒中萜烯类物质种类和含量一般较果实阶段会出现下降[27]。CK组、实验组和自然组中OAV>1的关键萜烯类化合物只有α-大马士酮,正是它的存在,使贵腐酒具有浓郁的桃子味和苹果味香气特征。
综上,通过人工接种灰葡萄孢的威代尔葡萄所酿造的贵腐葡萄酒,在醇类、酯类和酸类成分的含量上,均不及自然感染灰葡萄孢的威代尔葡萄所酿造的贵腐酒,但高于CK组。 进一步分析发现,实验组的醛类物质含量最低,相较于自然组生青味特征可能更低;而萜烯类物质含量最高,在一定程度上品种香气的保留优于自然组;同时实验组的乙酸含量远低于自然组,这能明显降低葡萄酒中的醋酸味,这种气味往往会严重影响酒体平衡。
2.2 感官分析
CK组、实验组及自然组威代尔葡萄酿造的3种葡萄酒香气感官品评雷达图见图2。
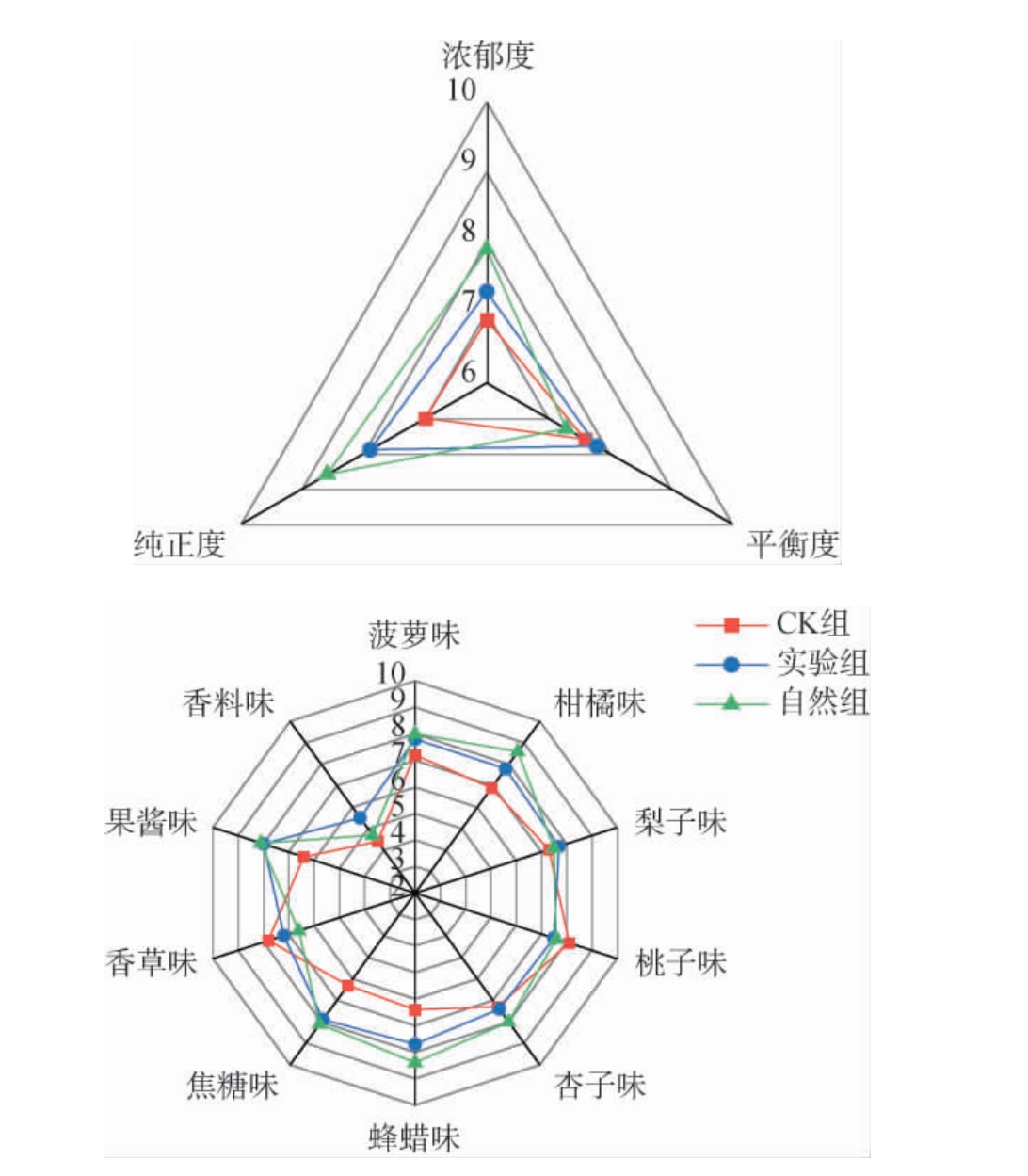
图2 3种葡萄酒感官特征雷达图
Fig.2 Sensory feature radar map of three kinds of wine
由图2可知,从香气浓郁度、纯正度和平衡度来看,自然组的浓郁度和纯正度得分均高于实验组和CK组,这可能与其香气成分含量最高有关,尤其是醇类物质与酯类物质的含量;同时,实验组的香气浓郁度和纯正度得分均高于CK组,平衡度高于自然组和CK组,说明人工接种灰葡萄孢对威代尔贵腐葡萄酒香气有一定的影响,人工接种灰葡萄孢酿造的贵腐葡萄酒在平衡度上表现更突出。
从威代尔贵腐葡萄酒香气特征来看,实验组贵腐葡萄酒在菠萝味、梨子味、桃子味、焦糖味和果酱味这5种特征上得分较为相近,但在柑橘味、杏子味和蜂蜡味特征上得分仍然不如自然组。对CK组而言,其香草味和桃子味特征得分高于其他2种处理的贵腐葡萄酒。综上,实验组贵腐葡萄酒香气特征上与自然组贵腐葡萄酒表现相近,但在浓郁度及纯正度上不及自然组贵腐葡萄酒。
3 结论
本研究采用人工接种灰霉菌技术对威代尔葡萄果实进行威代尔贵腐葡萄酒酿造,采用顶空固相微萃取(HS-SPME)结合气相色谱-质谱(GC-MS)技术和感官品评,对威代尔贵腐葡萄酒香气成分和香气特征进行研究。 结果表明,贵腐葡萄酒香气成分总含量高于CK组,但明显低于自然感染灰霉菌的葡萄酒,其中醇类、酯类和酸类物质含量也表现如此。说明人工接种灰霉菌的威代尔葡萄所酿造的贵腐葡萄酒在香气浓郁度上并不能完全代替自然感染灰霉菌的葡萄酒,但在一些品种香气与生青味、醋酸味等香气的释放上表现优于自然感染灰霉菌的葡萄酒,且香气与正常健康的威代尔葡萄所酿造的葡萄酒有所差别。感官分析结果表明,人工接种的贵腐葡萄酒在香气浓郁度与纯正度上得分优于正常健康的葡萄所酿造的葡萄酒却不及自然感染灰霉菌的贵腐葡萄酒,但在平衡度上优于自然感染灰霉菌的贵腐葡萄酒。在菠萝、梨、桃、焦糖及果酱风味上,其评分接近自然感染灰霉菌的贵腐葡萄酒;然而,在柑橘、杏子及蜂蜡风味上,其得分仍不及自然感染灰霉菌的贵腐葡萄酒。该研究可为贺兰山东麓威代尔人工接种灰霉菌的威代尔葡萄酿造贵腐葡萄酒的香气改善、品质提升提供参考。
[1]张亮亮,张文,陈尚武,等.接种灰霉葡萄孢对葡萄酒发酵及挥发性物质的影响[J].食品科学,2008,29(6):259-263.
[2]WANG X J,TAO Y S,WU Y,et al.Aroma compounds and characteristics of noble-rot wines of Chardonnay grapes artificially botrytized in the vineyard[J].Food Chem,2017,226(7):41-50.
[3]MODESTI M, ALFIERI G, CHIEFFO C, et al.Destructive and non-destructive early detection of postharvest noble rot(Botrytis cinerea)in wine grapes aimed at producing high-quality wines[J].J Sci Food Agr,2024,104(4):2314-2325.
[4]安荣艳.人工贵腐霞多丽葡萄酒的酿造及其品质分析[D].杨凌:西北农林科技大学,2016.
[5]OTTO M,GEML J,HEGYI Á I,et al.Botrytis cinerea expression profile and metabolism differs between noble and grey rot of grapes[J].Food Microbiol,2022,106(9):104037.
[6]MAGYAR I.Botrytized wines[J].Adv Food Nutr Res,2011,63(1):147-206.
[7]CSOMA H,ACS-SZABO L,PAPP L A,et al.Characterization of Zygosaccharomyces lentus yeast in Hungarian botrytized wines[J].Microorganisms,2023,11(4):852.
[8]陶永胜,刘吉彬,兰圆圆,等.人工贵腐葡萄酒香气的仪器分析与感官评价[J].农业机械学报,2016,47(2):270-279.
[9]黄露莉,杨宽,邵建辉,等.人工贵腐玫瑰蜜葡萄酒的酿造及香气成分分析[J].食品工业科技,2020,41(9):49-54.
[10]王超萍,华玉波,严战伟,等.贵腐酒及其研究进展[J].酿酒科技,2021(6):102-107.
[11]JACKSON R S.Wine Tasting: A Professional Handbook[M].London:Academic Press,2009:214-215.
[12]李玮,张瑛,林玲,等.一种贵腐葡萄的培育方法:CN104255384B[P].2016-03-30.
[13]李玮,文仁德,张劲,等.一种贵腐葡萄的制备方法:CN 104263573[P].2016-09-14.
[14]朱袁正鸿,石方舟,张众,等.微氧处理下赤霞珠葡萄酒香气的外源多酚基质效应[J].食品与发酵工业,2024,50(17):111-119.
[15]HE Y,WANG X,LI P,et al.Research progress of wine aroma components:A critical review[J].Food Chem,2023,402(2):134491.
[16]易子程,常腾文,司慧宁,等.本土非酿酒酵母对混合发酵威代尔冰酒风味及品质影响的比较分析[J].食品与发酵工业,2025,51(12):215-225.
[17]CLARKE R J,BAKKER J.葡萄酒风味化学[M].徐岩,译.北京:中国轻工业出版社,2013:93-96.
[18]刘思宇,吴杨鹏,时同华,等.河北碣石山产区‘小味儿多’葡萄果实和葡萄酒发酵过程中的香气物质的变化[J].中国酿造,2024,43(9):50-59.
[19]朱袁正鸿,张众,杨慧,等.不同容器陈酿对赤霞珠葡萄酒瓶储香气的影响[J].核农学报,2024,38(11):2143-2154.
[20]夏鸿川,张众,孙丽君,等.混菌发酵对贺兰山东麓‘赤霞珠’干红葡萄酒香气的影响[J].食品科学,2022,43(14):165-175.
[21]孙丽君.贺兰山东麓赤霞珠和美乐干红葡萄酒香气典型性研究[D].银川:宁夏大学,2022.
[22]LONGO R,CAREW A,SAWYER S,et al.A review on the aroma composition of Vitis vinifera L.Pinot noir wines: Origins and influencing factors[J].Crit Rev Food Sci Nutr,2021,61(10):1589-1604.
[23]侯雨君,余仲谋,周慧敏,等.武汉和宁夏地区‘威代尔’干白葡萄酒挥发性风味物质差异分析[J].中国酿造,2024,43(3):109-115.
[24]汪蕾.宁夏贺兰山东麓威代尔贵腐葡萄特征研究[D].银川:宁夏大学,2017.
[25]PATI S,CRUPI P,SAVASTANO M L,et al.Evolution of phenolic and volatile compounds during bottle storage of a white wine without added sulfite[J].J Sci Food Agr,2020,100(2):775-784.
[26]张铭铭,尹洪旭,邓余良,等.基于HS-SPME/GC×GC-TOFMS/OAV不同栗香特征绿茶关键香气组分分析[J].食品科学,2020,41(2):244-252.
[27]王陶,徐姿静,张文学,等.三个品种猕猴桃贵腐酒的香气特征分析[J].中国酿造,2023,42(1):65-71.