桑葚(Fructus Mori)又名桑椹,是桑科桑属多年生木本植物桑树的果实,属药食同源植物[1-2],含有多种人体必需的蛋白质、碳水化合物、维生素、矿物质等营养物质[3]和多糖、多酚、生物碱、黄酮等活性成分[4],其中,多糖含量约为25%,具有抗氧化[5-8]、抗炎、抗疲劳[9-10]、抗肿瘤和免疫调节[11]等作用,可作为功能性食品原料及食品添加剂,改善食品的质地、口感和营养价值[12]。
目前,植物多糖的提取方法主要有热水回流法[13]、超声波法[14]、微波法[15]和水提醇沉法[16]等。其中热水回流法提取温度高,提取率较低;超声波法和微波法有引起糖苷键断裂的可能;水提醇沉法得到的多糖色泽深重,后续分离纯化和活性鉴定困难,也影响其作为功能产品的外观品质;而酶提法能在比较温和的条件下分解植物组织,加速多糖的释放[17],且有研究表明复合酶法提取多糖的提取率显著优于其他方法[18]。 侯相竹等[19]结果表明,在酶解时间2.1 h、酶解pH 6.0、料液比1∶53(g∶mL)、酶解温度49 ℃条件下,复合酶(木瓜蛋白酶240 mg、果胶酶170 mg、纤维素酶160 mg)提取刺五加多糖的得率为14.21%。张会佳等[20]在最佳复合酶配比为木瓜蛋白酶88 000 U、果胶酶65 000 U、纤维素酶6 000 U的条件下,酶解黄芪多糖的得率可达22.79%。殷澳等[21]采用复合酶(果胶酶8 000 U/g、纤维素酶17 600 U/g、木瓜蛋白酶900 U/g)提取淫羊藿多糖的得率为16.95%,比水提法高3.86%,具有更强的体外抗氧化活性。但目前,还未见复合酶提取桑葚多糖的相关研究报道。
本研究采用复合酶法提取桑葚多糖,运用单因素和正交试验优化其提取工艺条件;采用红外光谱、扫描电子显微镜(scanning electron microscopy,SEM)等对桑葚多糖进行结构表征,并建立体外消化模型模拟桑葚多糖的体外消化过程探究其生物有效性,以期为桑葚的资源开发奠定基础,为桑葚多糖的进一步开发和应用提供理论基础。
1 材料与方法
1.1 材料与试剂
桑葚粉(40目):购自云南普洱某公司;葡萄糖、乙醇、氢氧化钠、硫酸、苯酚(均为分析纯):天津市大茂化学试剂厂;正丁醇、三氯甲烷、碳酸氢钠、磷酸二氢钠、氯化钠、氯化钙、氯化钾(均为分析纯):天津市风船化学试剂科技有限公司;硫氢酸钾(分析纯):天津市光复科技发展有限公司;柠檬酸、磷酸氢二钠(均为分析纯):云南景锐科技有限公司;甲醇(色谱纯):西陇科学股份有限公司;木瓜蛋白酶、碱性蛋白酶、果胶酶、纤维素酶(酶活100 000 U/g):南宁东恒华道生物科技有限责任公司;唾液淀粉酶、胃蛋白酶、胰蛋白酶(生化试剂):上海源叶生物科技有限公司;岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡萄糖醛酸、甘露糖醛酸、古罗糖醛(纯度均>98%):美国Sigma公司。
1.2 仪器与设备
GL1204C电子天平:上海佑科仪器仪表有限公司;BJ-800A多功能粉碎机:德清拜杰电器有限公司;UV2600紫外-可见分光光度计:上海精密仪器科学有限公司;SC-3616低速离心机:安徽中科中住科学仪器有限公司;HH-S28s恒温水浴锅:常州市金坛大地自动化仪器厂;Thermo Scientific Nicolet iS20傅立叶红外光谱仪:日本Thermo公司;7890A-5977B气质联用仪、Aglient 1200高效液相色谱仪:美国安捷伦公司;Riga Smart Lab SEX射线衍射仪:日本Riga公司;ICS-5000+离子色谱仪:美国Varian公司。
1.3 方法
1.3.1 桑葚多糖的提取工艺
新鲜桑葚去梗,沥干水分,自然晒干,粉碎后过40目筛,得桑葚样品。 称取一定量桑葚样品,以料液比1∶80(g∶mL)添加柠檬酸-柠檬酸钠缓冲溶液(pH 5),按纤维素酶添加量2.0%,酶解温度60 ℃,酶解时间50 min进行提取。 提取结束后,沸水浴灭活10 min,减压过滤,得桑葚多糖提取液。
1.3.2 酶添加量条件优化
单因素试验:称取一定量桑葚样品,以料液比为1∶40(g∶mL)添加柠檬酸-柠檬酸钠缓冲溶液(pH 5),固定酶解时间40 min,酶解温度40 ℃,分别将木瓜蛋白酶、纤维素酶、果胶酶和碱性蛋白酶按添加量0.2%、0.8%、1.4%、2.0%、2.6%、3.2%进行单因素试验,考察不同酶添加量对桑葚多糖得率的影响。
正交试验:在酶添加量单因素试验结果的基础上,以桑葚多糖得率为评价指标,纤维素酶添加量(A)、果胶酶添加量(B)、碱性蛋白酶添加量(C)和木瓜蛋白酶添加量(D)为考察因素,设计L9(34)正交试验优化酶添加量,正交试验因素与水平见表1。
表1 酶添加量条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for enzymatic addition condition optimization
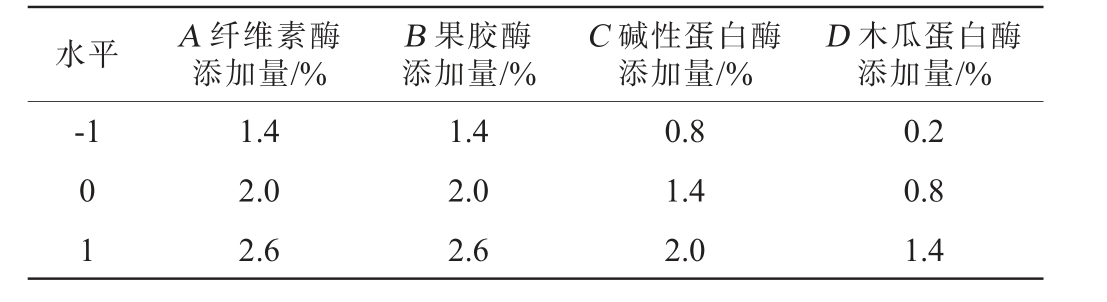
水平 A 纤维素酶添加量/%D 木瓜蛋白酶添加量/%-1 B 果胶酶添加量/%C 碱性蛋白酶添加量/%0 1 1.4 2.0 2.6 1.4 2.0 2.6 0.8 1.4 2.0 0.2 0.8 1.4
1.3.3 桑葚多糖提取工艺条件优化
单因素试验:在最佳复合酶添加量的基础上,以桑葚多糖得率为评价指标,分别考察酶解时间(20 min、40 min、60 min、80 min、100 min、120 min)、酶解温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃)、料液比(1∶20、1∶40、1∶60、1∶80、1∶100、1∶120(g∶mL))和酶解pH值(3、4、5、6、7、8)4个因素对桑葚多糖得率的影响。
正交试验:根据单因素试验结果,以桑葚多糖得率为评价指标,酶解时间(A)、酶解温度(B)、料液比(C)和酶解pH值(D)为考察因素,设计L9(34)正交试验优化桑葚多糖提取工艺,正交试验因素与水平见表2。并将最佳复合酶工艺条件下的多糖得率与单一酶提取法和热水浸提法提取的多糖得率进行比较。
表2 桑葚多糖提取工艺优化正交试验因素与水平
Table 2 Factors and levels of orthogonal experiments for mulberry polysaccharides extraction process optimization
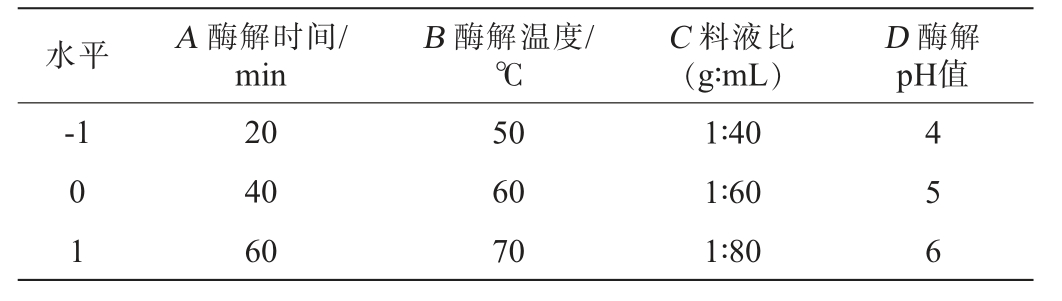
水平 A 酶解时间/min D 酶解pH值-1 B 酶解温度/℃C 料液比(g∶mL)0 1 20 40 60 50 60 70 1∶40 1∶60 1∶80 4 5 6
1.3.4 桑葚多糖含量的含量测定
葡萄糖标准曲线的绘制:参照温文娟等[22]的苯酚-硫酸法并适当修改,准确称取0.010 0 g葡萄糖,加蒸馏水溶解,定容至100 mL,得到0.1 mg/mL葡萄糖标准溶液,分别移取0、0.20 mL、0.40 mL、0.60 mL、0.80 mL、1.00 mL、1.20 mL葡萄糖标准溶液,加蒸馏水补足至2.00 mL,加1.00 mL 5%苯酚溶液,再加5.00 mL 98%硫酸,振荡摇匀,沸水浴15 min,取出后冷却至室温,于波长490 nm条件下测定吸光度值,以葡萄糖质量浓度(X)为横坐标,吸光度值(Y)为纵坐标,绘制标准曲线,获得葡萄糖的标准曲线回归方程为:Y=0.065 7X+0.018 4,相关系数R2=0.998 9。
样品中葡萄糖含量的测定:根据上述方法测定桑葚多糖提取液中多糖含量,多糖得率计算公式如下[23]:
式中:C为样液质量浓度,mg/mL;V为测试液体积,mL;n为稀释倍数,m为样品质量,g。
1.3.5 桑葚多糖的提取分离纯化
参照肖瑞希等[24-25]的方法,取桑葚粉末40 g,按照料液比1∶40(g∶mL)加1 600 mL pH 5的柠檬酸-柠檬酸钠缓冲溶液,最佳复合酶添加量条件下超声(功率150 W、温度90 ℃)水浴1 h,3 000 r/min离心3 min,收集上清液,浓缩至体积约为200 mL,按提取液:体积分数95%乙醇(1∶4)的体积比添加乙醇,静置过夜,3 000 r/min离心10 min,收集沉淀,溶于少量超纯水中,多次添加Sevage试剂(氯仿∶正丁醇)(4∶1,V/V)100 r/min振荡10 min,静置分层,直至下层溶液为无色透明状。将上层多糖溶液装入截留3 500 Da分子质量的透析袋,超纯水环境透析72 h,期间每隔12 h换水1次,冷冻干燥得桑葚多糖。
1.3.6 桑葚多糖的结构表征
桑葚多糖红外光谱扫描:取0.1 g桑葚多糖样品,添加10 g溴化钾粉末,充分研磨,压片,以溴化钾为对照采集背景,400~4 000 cm-1波数范围扫描32次。
桑葚多糖分子质量测定:配制1.00 mg/mL桑葚多糖溶液,先采用凝胶色谱分离多糖样品,进而利用示差检测器根据其折光强度检测样品的浓度信息,利用多角度激光光散射仪检测大分子的光散射信号(散射光强度与物质的分子量大小成正比)、差信号(响应值取决于柱后流出液折射率的变化,与物质的类型、浓度和分子质量均有关),根据两种信号和马克·霍温克方程(Mark-Houwink Equation)拟合计算组分对应的重均分子质量(Mw)和数均分子质量(Mn),再根据分散指数Mw/Mn分析多糖分子质量分布宽度[26-27]。
桑葚多糖单糖组成测定:精确称量5 mg桑葚多糖,加2.00 mol/L三氟乙酸(trifluoroacetic acid,TFA)溶液1.00 mL,121 ℃加热2 h后通氮气(N2)吹干,甲醇清洗2~3次,加水溶解,以单糖标准品为对照,采用DionexTMCarbo PacTMPA10(250×4.0 mm,10 μm)液相色谱柱和Thermo ICS5000+离子色谱系统,以目标化合物在分析柱上的保留时间确定单糖组成;以标准品的质量浓度为横坐标,峰面积为纵坐标,根据相应化合物的峰面积计算各单糖含量[28]。
桑葚多糖X射线衍射(X-ray diffraction,XRD)扫描:取桑葚多糖样品置于载玻片,采用X射线衍射仪在30~90°范围,Cu-Kα射线光源,40 kV电压和40 mA电流条件下扫描测定桑葚多糖的结晶性能。
桑葚多糖扫描电镜:采用刘利娜[29]的方法,取微量样品粘到导电胶上,喷金处理后设定电压3 kV,加速电压15 kV,使用电子显微镜SE2二次电子探测器扫描拍摄500、1 000、2 000、5 000倍镜下桑葚多糖的样品形貌。
1.3.7 桑葚多糖生物有效性
固定酶解时间20 min,酶解温度50 ℃,料液比1∶80(g∶mL),提取pH值5,分别采用热水浸提法(未加酶)、单一酶解法(2.0%纤维素酶)和复合酶解法(最佳复合酶添加量)提取桑葚多糖,分别检测各自多糖提取液的多糖含量,再按下列方法以桑葚多糖生物利用度评估三种桑葚多糖提取液的生物有效性。 取3.00 mL桑葚提取液,加3.00 mL口腔模拟液,37 ℃振荡6 min,盐酸溶液调pH至1.5,加5.00 mL胃模拟液,37 ℃振荡1.5 h,NaOH溶液调pH至7.0,加肠模拟液10.00 mL,37 ℃振荡1.5 h。3 000 r/min离心3 min,取3.00 mL上清液测定其多糖含量[30],桑葚多糖生物利用度计算公式如下:

2 结果与分析
2.1 不同酶添加量优化
2.1.1 不同酶添加量优化单因素试验
不同酶添加量对多糖得率的影响见图1。由图1可知,随着不同酶添加量在0.2%~3.2%范围内的增加,多糖得率变化趋势一致,均呈先增加后下降的趋势。当纤维素酶、果胶酶、碱性蛋白酶及木瓜蛋白酶添加量分别为2.0%、2.0%、1.4%、0.8%时,多糖得率达最大值,分别为38.71%、37.11%、37.62%、36.58%。因此,确定纤维素酶、果胶酶、碱性蛋白酶及木瓜蛋白酶最适添加量分别为2.0%、2.0%、1.4%、0.8%。
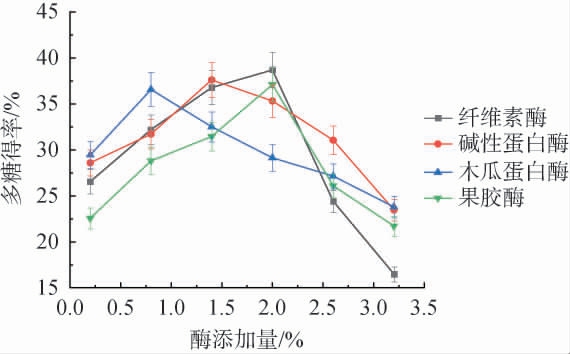
图1 不同酶添加量对多糖得率的影响
Fig.1 Effect of different enzymes addition on polysaccharide yield
2.1.2 不同酶添加量优化正交试验
以多糖得率为评价指标,以纤维素酶添加量(A)、果胶酶添加量(B)、碱性蛋白酶添加量(C)、木瓜蛋白酶添加量(D)为考察因素,设计4因素3水平的正交试验,试验结果与分析见表3。
表3 酶添加量优化正交试验结果及分析
Table 3 Results and analysis of orthogonal experiments for enzymes addition optimization
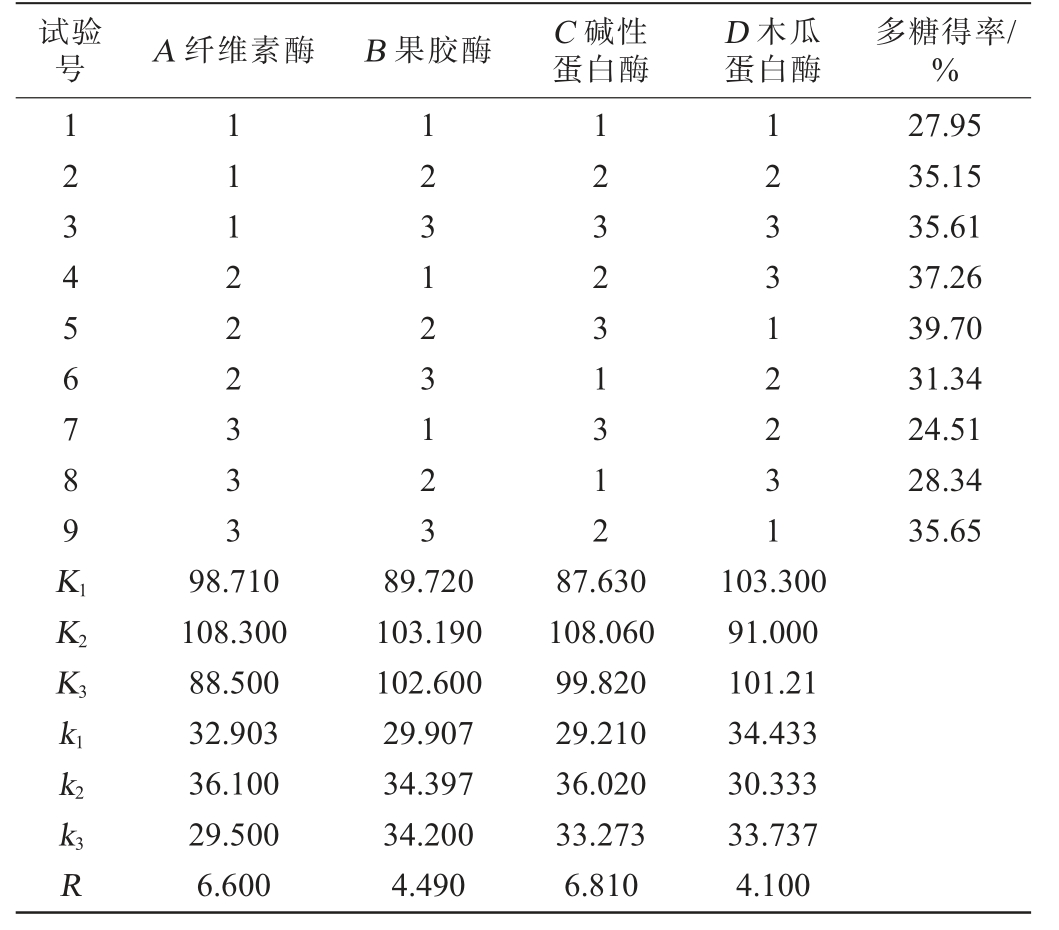
试验号 A 纤维素酶 B 果胶酶 C 碱性蛋白酶D 木瓜蛋白酶多糖得率/%123456789K1K2K3 111222333 123123123 123231312 123312231 27.95 35.15 35.61 37.26 39.70 31.34 24.51 28.34 35.65 k1 k2 k3R 98.710 108.300 88.500 32.903 36.100 29.500 6.600 89.720 103.190 102.600 29.907 34.397 34.200 4.490 87.630 108.060 99.820 29.210 36.020 33.273 6.810 103.300 91.000 101.21 34.433 30.333 33.737 4.100
由表3可知,影响多糖得率的复合酶添加量主次顺序为C>A>B>D,即碱性蛋白酶添加量>纤维素酶添加量>果胶酶添加量>木瓜蛋白酶添加量,桑葚多糖提取的最佳酶添加量组合为A2B2C2D1,即纤维素酶添加量2.0%、果胶酶添加量2.0%、碱性蛋白酶添加量1.4%、木瓜蛋白酶添加量0.2%。在此优化条件下,进行3次平行验证试验,获得桑葚多糖得率为40.41%,高于试验组5。因此,确定桑葚多糖提取的最佳复合酶添加量组合为纤维素酶添加量2.0%、果胶酶添加量2.0%、碱性蛋白酶添加量1.4%、木瓜蛋白酶添加量0.8%。
2.2 桑葚多糖酶法提取工艺条件优化单因素试验结果
2.2.1 酶解时间的确定
酶解时间对桑葚多糖得率的影响见图2。
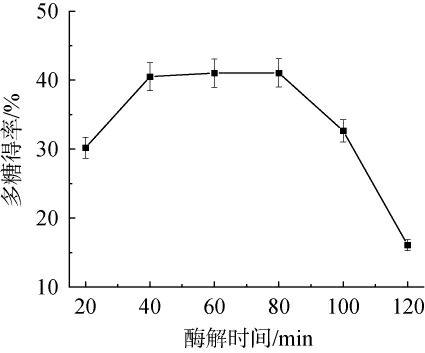
图2 酶解时间对多糖得率的影响
Fig.2 Effect of enzymolysis time on polysaccharide yield
由图2可知,随着酶解时间在20~40 min范围内增加,桑葚多糖得率逐渐增加;当酶解时间为40 min时,多糖得率趋于最高值,为40.5%;酶解时间在40~80 min范围内,多糖得率基本平稳;当酶解时间>80 min之后,多糖得率下降。 因此,确定最佳酶解时间为40 min。
2.2.2 酶解温度的确定
酶解温度对多糖提取率的影响见图3。
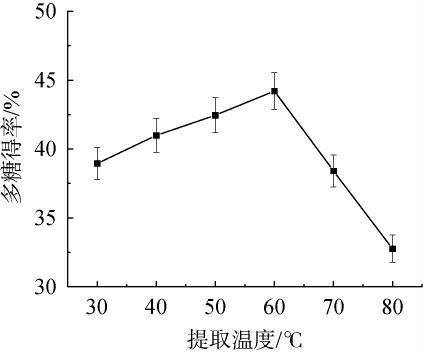
图3 酶解温度对多糖得率的影响
Fig.3 Effect of enzymolysis temperature on polysaccharide yield
由图3可知,随着酶解温度在30~60 ℃范围内增加,桑葚多糖得率逐渐增加;当酶解温度为60 ℃时,多糖得率最大,为44.21%;当酶解温度>60℃之后,多糖得率下降。可能是由于反应温度过低酶的活性受抑制,温度过高则酶失活。因此,确定最佳酶解温度为60 ℃。
2.2.3 料液比的确定
料液比对多糖得率的影响见图4。
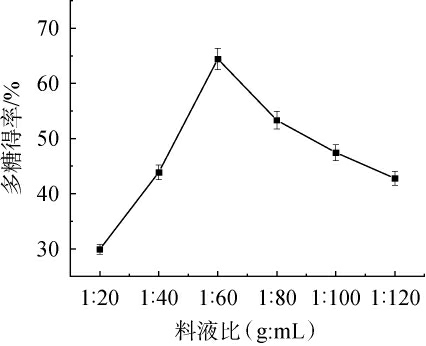
图4 料液比对多糖得率的影响
Fig.4 Effect of solid-liquid ratio on polysaccharides yield
由图4可知,当料液比为1∶20、1∶40、1∶60(g∶mL)时,桑葚多糖得率增加;当料液比为1∶60(g∶mL)时,多糖得率最大,为64.43%;当料液比为1∶60、1∶80、1∶100、1∶120(g∶mL)时,多糖得率下降。 可能是因为料液比增加,底物浓度降低,其与酶的结合力也随之降低。因此,确定最佳料液比为1∶60(g∶mL)。
2.2.4 酶解pH值的确定
酶解pH值对多糖含量的影响见图5。
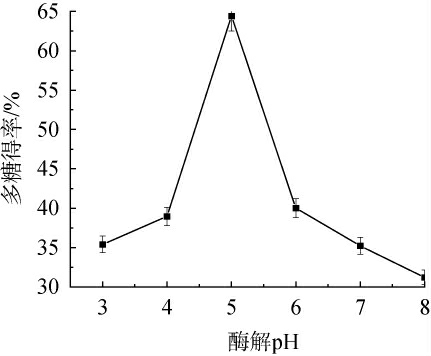
图5 酶解pH值对多糖得率的影响
Fig.5 Effect of enzymatic pH value on polysaccharide yield
由图5可知,随着酶解pH值在3~8范围内增加,桑葚多糖得率呈增加趋势;当酶解pH值为5时,多糖得率达到最高值,为64.44%;当酶解pH值>5时,多糖得率下降。pH过高或过低,酶的活性都会受到影响,从而影响多糖得率。因此,确定酶解pH值为5。
2.3 桑葚多糖酶法提取工艺优化正交试验结果
以桑葚多糖得率为评价指标,以酶解时间(A)、酶解温度(B)、料液比(C)、酶解pH值(D)为考察因素,设计4因素3水平的正交试验,试验结果与分析见表4。
表4 桑葚多糖提取工艺优化正交试验结果与分析
Table 4 Results and analysis of orthogonal experiments for mulberry polysaccharides extraction process optimization
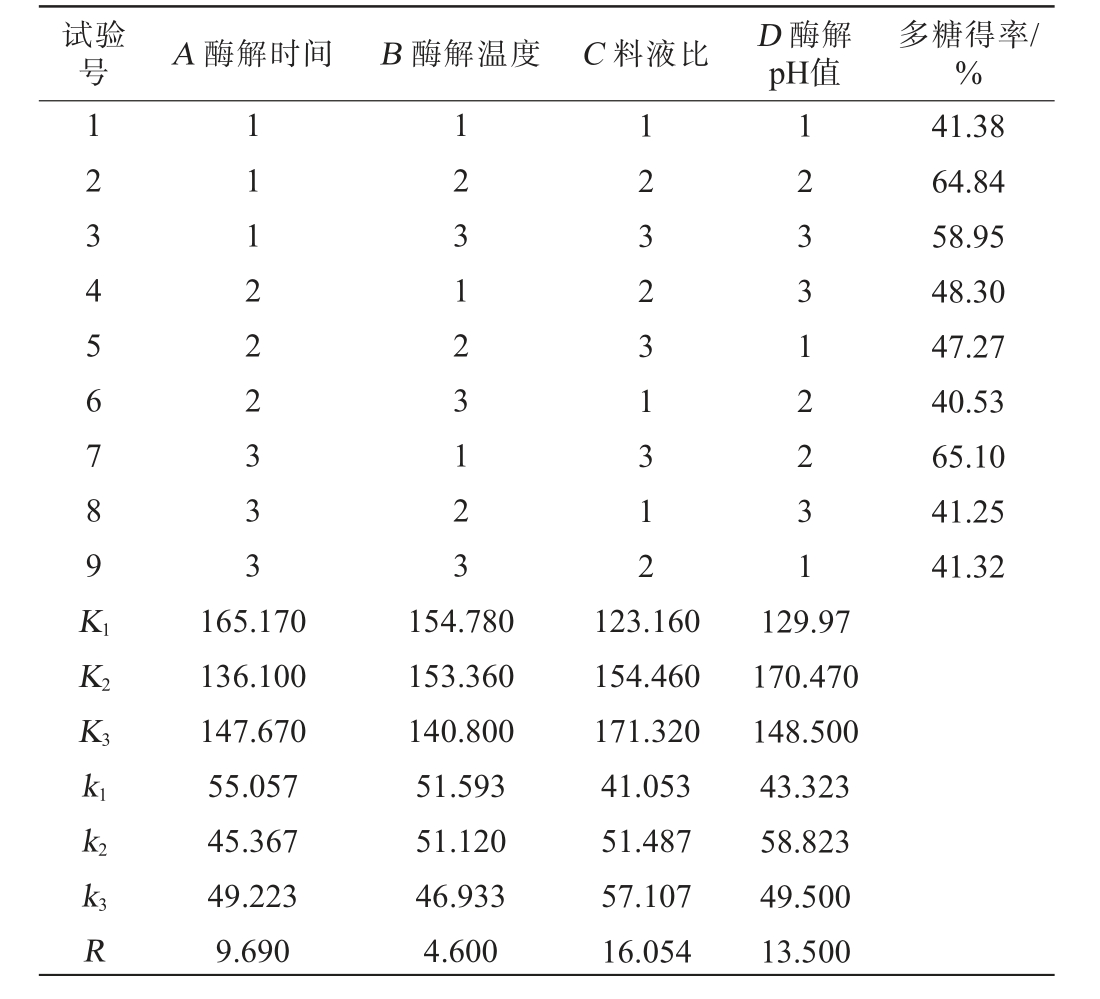
试验号 A 酶解时间 B 酶解温度 C 料液比 D 酶解pH值多糖得率/%123456789K1K2K3 111222333 123123123 123231312 123312231 41.38 64.84 58.95 48.30 47.27 40.53 65.10 41.25 41.32 k1 k2 k3R 165.170 136.100 147.670 55.057 45.367 49.223 9.690 154.780 153.360 140.800 51.593 51.120 46.933 4.600 123.160 154.460 171.320 41.053 51.487 57.107 16.054 129.97 170.470 148.500 43.323 58.823 49.500 13.500
由表4可知,影响多糖得率的因素主次顺序为C>D>A>B,即料液比>酶解pH值>酶解时间>酶解温度,酶法提取桑葚多糖的最佳条件组合为A1B1C3D2,即酶解时间20 min、酶解温度50 ℃、料液比1∶80(g∶mL)、酶解pH值5。在此优化条件下进行3次平行验证试验,桑葚多糖得率为65.64%。因此,确定桑葚多糖提取的最佳组合条件为酶解时间20 min、酶解温度50 ℃、料液比1∶80(g∶mL)、酶解pH值5。该法提取的桑葚多糖得率亦大于单一酶提取的得率(见图1)和热水浸提法提取的得率(29.37%),说明此工艺条件可行且高效。
2.4 桑葚多糖结构表征
2.4.1 桑葚多糖红外光谱扫描
桑葚多糖红外光谱图见图6。由图6可知,3 331 cm-1是O-H键的伸缩振动吸收峰,可能参与了多糖的水合作用[31];2 924 cm-1为C-H键的伸缩振动吸收峰,特别是甲基(-CH3)和亚甲基(-CH2-)的对称和非对称伸缩振动,表明脂肪酸链或其他烷基结构的存在;1 723 cm-1是酮基C=O的伸缩振动峰;1 618 cm-1是羧基C=O的伸缩振动峰,1 020 cm-1是C-O-C伸缩振动峰,是吡喃糖的特征峰[32]。
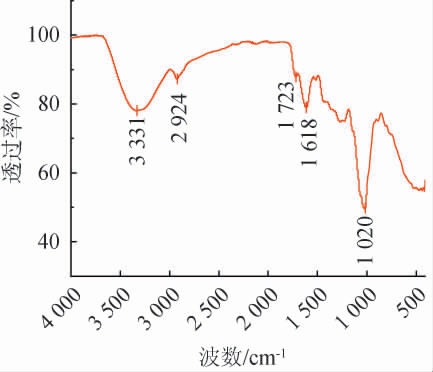
图6 桑葚多糖红外光谱图
Fig.6 Infrared spectrum of mulberry polysaccharides
2.4.2 桑葚多糖分子质量的测定
桑葚多糖绝对分子质量分布图见图7。由图7可知,桑葚多糖样品中主要存在5个色谱峰且不对称。该多糖的Mn、Mw分别为72.63 kDa、250.14 kDa,分散指数Mw/Mn为3.444,表明桑葚多糖不是均一纯多糖[33]。
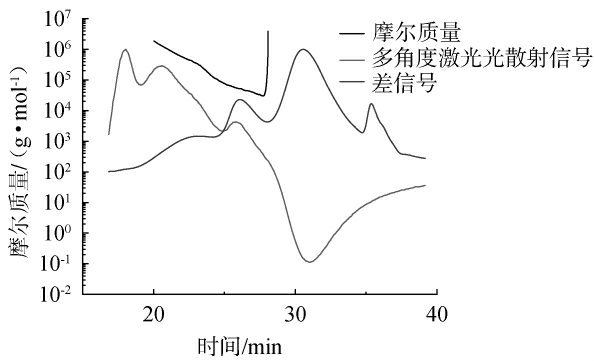
图7 桑葚多糖分子质量分布图谱
Fig.7 Molecular mass distribution map of mulberry polysaccharides
2.4.3 桑葚多糖单糖组成分析
桑葚多糖水解液与单糖标准品的对比色谱图见图8。由图8可知,桑葚多糖主要由葡萄糖(Glc)、半乳糖(Gal)、阿拉伯糖(Ara)、鼠李糖(Rha)和半乳糖醛酸(Gal-UA)组成。定量分析确定多糖中含量最高的单糖为葡萄糖(27.42%),其次为半乳糖(26.32%)和阿拉伯糖(17.86%)。多糖中Glc、Gal、Ara、Rha和Gal-UA的摩尔比为26.25∶25.20∶20.52∶18.12∶9.91。
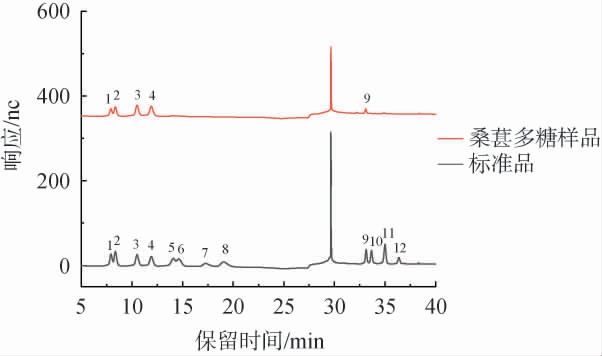
图8 桑葚多糖水解液与单糖标准品的对比色谱图
Fig.8 Comparative chromatogram of mulberry polysaccharides hydrolysate and monosaccharide standard
1.鼠李糖(Rha);2.阿拉伯糖(Ara);3.半乳糖(Gal);4.葡萄糖(Glc);5.木糖(Xyl);6.甘露糖(Man);7.果糖(Fru);8.核糖(Rib);9.半乳糖醛酸(Gal-UA);10.古罗糖醛酸(Gul-UA);11.葡萄糖醛酸(Glc-UA);12.甘露糖醛酸(Man-UA)。
2.4.4 桑葚多糖XRD扫描
X-射线衍射是分析高聚物以及化合物的重要方法,主要用来检测物质是否为结晶状态,结晶状态决定多糖的柔韧性和溶解性[34]。 桑葚多糖X射线衍射图谱见图9。 由图9可知,得桑葚多糖在30~90°范围内无明显吸收峰,仅有极小的不明显衍射峰存在,表明桑葚多糖的结晶性低,在消化道中可能更容易被酶分解,生物利用度较高。
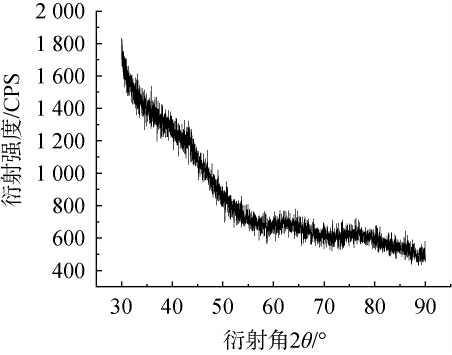
图9 桑葚多糖X射线衍射图谱
Fig.9 X-ray diffraction pattern of mulberry polysaccharides
2.4.5 桑葚多糖扫描电镜结果
桑葚多糖扫描电镜图见图10。由图10可知,扫描电镜得放大500倍和1 000倍时,多糖形状不规则,结构致密。放大2 000倍时,多糖呈现层状结构,表面相对光滑平整。多糖的形态结构受到原料来源或提取工艺的影响,放大5 000倍时,桑葚多糖有大量粗糙纹路和孔隙,可能是超声波产生的强剪切力使多糖形态粗糙多孔[35]。
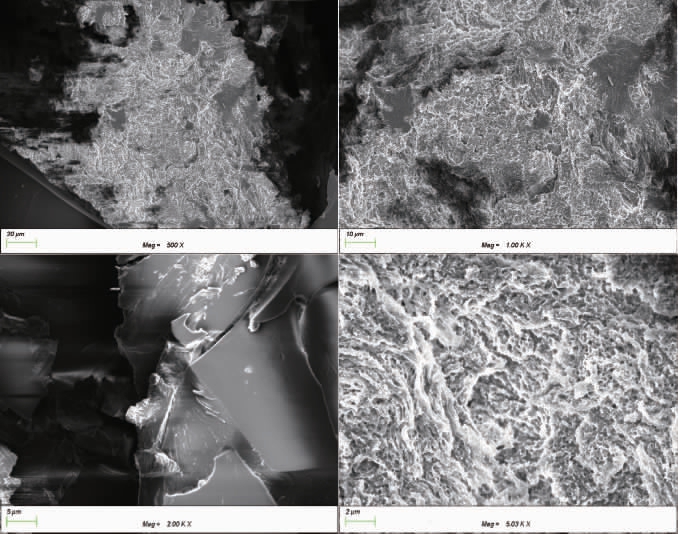
图10 桑葚多糖扫描电镜图
Fig.10 Scanning electron microscope of mulberry polysaccharide
2.5 桑葚多糖不同提取工艺对生物有效性的影响
在复合酶提取最佳工艺条件下,选择热水浸提法和单一酶(纤维素酶)提取作为对照,对桑葚多糖生物有效性进行评价,结果见图11。由图11可知,复合酶解法、单一酶法、热水浸提法获得桑葚多糖的生物利用度分别为37.6%、25.32%、17.53%。 复合酶解法提取多糖的生物有效性显著优于单一酶(纤维素酶)提取法和热水浸提法,该结果与聂杨根等[30]的研究结果一致。
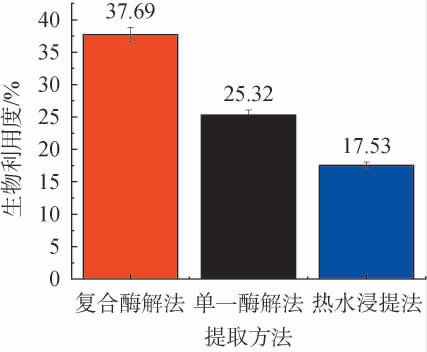
图11 桑葚多糖不同提取工艺的生物利用度
Fig.11 Bioavailability of mulberry polysaccharides by different extraction process
3 结论
试验以桑葚为原料,优化了复合酶解法对桑葚多糖的提取工艺,并对其生物有效性进行了探究。 得桑葚多糖复合酶提取的最佳条件为:纤维素酶添加量2.0%,果胶酶添加量2.0%,碱性蛋白酶添加量1.4%,木瓜蛋白酶添加量0.2%,料液比1∶80(g∶mL)、酶解pH 5、酶解时间20 min、酶解温度50 ℃。在此最佳工艺条件下,获得桑葚多糖得率达65.64%。纯化的桑葚多糖不是均一多糖,桑葚多糖分子质量为250.139 kDa,主要由葡萄糖(26.25%)和半乳糖(25.20%)构成,形态结构为层状和孔隙结构,不具备晶体结构。 生物有效性分析表明,复合酶解法制备桑葚多糖生物利用度(37.69%)优于单一酶提取法(25.32%)、热水浸提法(17.53%)。 本研究结果能够为桑葚多糖的深入研究和开发利用提供一定的理论支撑。
[1]黄媛媛.桑葚多糖的提取、分离纯化、结构表征及生物活性研究[D].贵阳:贵州师范大学,2023.
[2]马识淳,韩伟.襄荷桑葚复合饮料研制及其抗运动疲劳作用研究[J].中国食品添加剂,2021,32(8):67-75.
[3]唐敏,刘刚,王雪力,等.桑葚酵素复合与自然发酵的功效成分、感官评价与抗氧化活性比较[J].四川师范大学学报(自然科学版),2022,45(1):73-78.
[4]舒广文,邱韵涵,付千,等.桑葚总多糖对对乙酰氨基酚诱导小鼠急性肝损伤的保护作用[J].中南民族大学学报(自然科学版),2019,38(3):377-382.
[5]HUANG Y Y,XIE W,TANG T,et al.Structural characteristics,antioxidant and hypoglycemic activities of polysaccharides from Mori Fructus based on different extraction methods[J].Front Nutr,2023,10:1125831.
[6]DENG Q F,ZHOU X,CHEN H G.Optimization of enzyme assisted extraction of Fructus Mori polysaccharides and its activities on antioxidant and alcohol dehydrogenase[J].Carbohydr Polym,2014,111:775-782.
[7]廖传仙,黄建国,陆萍,等.黑木耳桑葚魔芋代餐粉复合多糖的抗氧化活性研究[J].安徽农业科学,2020,48(16):162-164,253.
[8]刘富饶,郭子萌.桑葚中性多糖结构及其对D-半乳糖致衰老小鼠的抗氧化作用[J].中成药,2024 ,46(1):246-250.
[9]刘兵.桑葚多糖对小鼠抗疲劳作用及其机制研究[J].河南农业大学学报,2014,48(4):465-469.
[10]靳铁柱.响应面法优化桑葚多糖纯化工艺及不同产物的抗运动疲劳活性比较[J].保鲜与加工,2022,22(4):67-73.
[11]黎智慧,何欣怡,孙蓉,等.桑葚中产花青素内生真菌的筛选及其抗氧化活性的研究[J].食品与发酵科技,2023,59(2):50-53,119.
[12]袁云香.桑葚在食品加工中的应用[J].食品工业,2013,34(2):171-173.
[13]SONG H Y, LIANG L Q.Extraction process of polysaccharide from Gentianascabra Bge[J].Technol Develop Chem Ind,2016,45(9):28-31.
[14]钱燕芳,石晨莹,陈贵堂.桑葚多糖超声提取、脱色工艺优化及其抗氧化活性分析[J].食品工业科技,2022,43(16):201-210.
[15]唐长波,刘臣.响应面法优化微波提取桑葚多糖工艺研究[J].食品研究与开发,2013,34(18):12-15.
[16]钱燕芳,石晨莹,陈贵堂.桑葚多糖超声提取、脱色工艺优化及其抗氧化活性分析[J].食品工业科技,2022,43(16):201-210.
[17]沈晨露,孔昊,郭嘉文,等.复合酶法提取石莲花多糖及其护肤特性研究[J].医药工艺与工程,2022,43(1):41-45.
[18]刘晓露,刘胜利,郭立强,等.酶法提取桑葚多糖的工艺研究[J].中国野生植物资源,2012,31(1):30-32.
[19]侯相竹,张会佳,殷澳,等.刺五加多糖的复合酶提取工艺及其对α-葡萄糖苷酶的抑制活性研究[J].中国食品添加剂,2024,35(11):111-120.
[20]张会佳,侯相竹,张涵,等.黄芪多糖复合酶提取工艺优化及其α-葡萄糖苷酶抑制活性[J].食品工业科技,2024,45(17):181-189.
[21]殷澳,张涵,侯相竹,等.朝鲜淫羊藿多糖复合酶提工艺优化及抗氧化活性研究[J].食品科技,2024,49(1):191-200.
[22]温文娟,刘珊,黄远丽.苯酚硫酸法与蒽酮硫酸法测定香菇多糖含量比较[J].现代食品,2020(21):177-179.
[23]叶美芝,伍紫仪,吴金松,等.山药皮多糖的分离纯化、结构特征及体外抗氧化活性研究[J].食品工业科技,2023,44(19):78-85.
[24]肖瑞希.弱极性分级醇沉桑葚多糖结构表征及其抗急性酒精性肝损伤作用研究[D].贵阳:贵州师范大学,2019.
[25]XIANG W,XU L,ZHENG L,et al.Purification,structural characterization,and immunoregulatory activity of a polysaccharide from mulberry branch[J].Chem Biol Technol Agr,2024,11(1):39.
[26]杨娇,赵兴秀,何义国,等.黄水多糖的分离纯化、结构表征及益生性研究[J].酿酒科技,2023(4):116-120,125.
[27]LI R L,ZHOU J N,ZHANG X Y,et al.Isolation,structural characterization and cholesterol-lowering effects of a novel polysaccharide from mulberry(Morus alba L.)leaf[J].Ind Crops Prod,2023,202:117010.
[28]金岳.母草多糖的分离纯化、结构表征及其生物活性探究[D].桂林:广西师范大学,2023.
[29]刘利娜.桑黄多糖分离纯化、结构表征及其活性研究[D].合肥:安徽中医药大学,2023.
[30]聂杨根,刘艾芬,董霞,等.铁皮石斛花多糖的复合酶解法提取及生物有效性研究[J].食品研究与开发,2022,43(10):102-110.
[31]乔赛凤,宋璐杉,刘会平,等.积雪草多糖制备、结构表征及其抗氧化活性[J].食品研究与开发,2023,44 (21):1-9,32.
[32]许梦粤,丁泽宇,李锦鹏,等.大豆多糖与纳豆多糖结构特征和主要生物活性比较[J].食品科学,2024,45(7):78-86.
[33]张静,冯潮,王胜威,等.龙眼多糖的结构表征及其激活巨噬细胞的作用[J].食品科学,2023,44(5):103-111.
[34]程亚楠.多花黄精多糖提取纯化、结构表征及其体外益生活性研究[D].南昌:南昌大学,2023.
[35]HU T G,ZOU Y X,LI E N,et al.Effects of enzymatic hydrolysis on the structural,rheological,and functional properties of mulberry leaf polysaccharide[J].Food Chem,2021,355(29):129608.