随着我国居民生活水平的不断提高,饮食结构也在发生改变,高脂食物的摄入比例不断增加,从而增加血液中胆固醇浓度,胆固醇过多会导致高脂血症、心血管疾病和过早死亡[1-2],在我国血脂异常患者已达1.6亿人,中国是全球心脑血管病死亡率最高的国家[3]。
目前,高脂血症的常见治疗策略分为非药物治疗和药物治疗,非药物治疗措施的关键是运动和饮食,然而,对于严重的高脂血症患者还需配合降血脂药物才能达到效果;他汀类药物作为一线治疗药物,已广泛应用于高脂血症治疗[4]。他汀药物降脂机制是竞争性抑制3-羟基-3-甲基戊二酸单酰辅酶A(hydroxy methylglutaryl coenzyme A,HMGCoA)还原酶(胆固醇合成的限速酶)的活性,以减少胆固醇的自体合成,特异性降低血清胆固醇,由此对动脉粥样硬化和冠心病的防治产生作用[5-8]。尽管他汀类药物的疗效已得到证实,但这类降血脂药物的毒副作用大,容易造成肌痛、头痛、胃肠不适与肝肾功能损害等副作用[9]。 并且服用这些药物时,个体反应存在显著的不一致[10],药物的依从性也会随着时间的流逝而逐渐降低。 鉴于此,研发开发具有降脂降低胆固醇作用的安全、经济的的非药物疗法,成为国内外研究的热点。
乳酸菌[11-12]与其发酵制品[13-14]不仅能够调节肠道菌群平衡,还可以降低机体的胆固醇水平,从而降低心脑血管疾病发病的风险。乳酸菌降脂机理主要有共沉淀作用[15]、同化作用[16]、抑制肝脏内胆固醇的合成[17]、胆盐水解酶的解耦联作用等来降低胆固醇水平[18]。显然它的降脂机制和他汀类药物存在着本质的差别。 该课题组前期通过体外实验,已经证明植物乳杆菌(Lactobacillus plantarum)、戊糖乳杆菌(Lactobacillus pentosus)对于胆固醇有较强的降解作用[19],而解脂亚罗酵母菌(Yarrowia lipolytica)具有较高的甘油三酯降解作用[20]。为了考察三株菌结合是否可以互补增强降脂效果,该研究以前期研究成果为基础,利用具有降脂降胆固醇功能的乳酸菌和具有高效降甘油三酯效果的酵母菌制备复合菌剂,对比其与辛伐他汀在高脂小鼠体内的降血脂效果,为菌株资源化利用提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
植物乳杆菌(Lactobacillus plantarum)EAM-ZL010T(保藏编号CGMCC 7425)、戊糖乳杆菌(Lactobacillus pentosus)EAM-ZL016T(保藏编号CGMCC 7426)、解脂亚罗酵母(Yarrowialipolytica)EAM-ZT003T(保藏编号CGMCC7427):均为西北民族大学厌氧微生物实验室自行分离菌株。
1.1.2 培养基
麦氏培养基:葡萄糖1 g、酵母粉2.5 g、氯化钾1.8 g、醋酸钠8.2 g,蒸馏水1 000 mL,pH自然,121 ℃灭菌20 min。
MRS改良培养基:蛋白胨10 g、牛肉膏10 g、酵母粉5 g、葡萄糖20 g、麦芽糖5 g、无水乙酸钠5 g、吐温-80 1 mL、柠檬酸二胺2 g、磷酸氢二钾2 g、硫酸镁0.58 g、硫酸锰0.25 g、蒸馏水1 000 mL,pH 6.6~6.8。121 ℃灭菌20 min。MRS固体培养基另加琼脂18 g/L。
1.1.3 试剂
胆固醇:杭州汇普化工有限公司;辛伐他汀(规格10 mg/片):浙江海正药业股份有限公司;总胆固醇(total cholesterol,TC)测定试剂盒、高密度脂蛋白-胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒、低密度脂蛋白-胆固醇(low density lipoprotein cholesterol,LDL-C)测定试剂盒和甘油三酯(triglycerides,TG)测定试剂盒:上海荣盛生物技术有限公司。
1.1.4 实验动物及饲料
无特定病原体动物(specific pathogen free,SPF)级雌性小白鼠(8周龄),体质量18~22 g:兰州领先生物技术有限公司,分笼饲养,自然光照,定期更换垫料。 动物伦理审批编号为xbmu-sm-2020010。
基础饲料、灭菌刨花垫料:沈阳茂华生物科技有限公司。其中基础饲料配方为玉米、豆粕、面粉、麸皮、稻谷、秘鲁鱼粉、鸡肉粉、酵母粉、豆油、磷氨酸钙、石粉、食盐、多种维生素、氨基酸、矿物质及微量元素。
高脂饲料配方为:猪油12%,胆固醇1%,猪胆盐0.2%,86.8%基础饲料混匀造粒,在进动物房前,通过紫外线灭菌30 min。
1.2 仪器与设备
BX51T-32P01数码光学显微镜:日本奥林巴斯公司;MLS-3750全自动高压灭菌器:日本三洋公司;PB-10 pH仪:赛多利斯科学仪器(北京)有限公司;GL-21M高速冷冻离心机:赛特湘仪离心机仪器有限公司;Arium 611VF超纯水蒸馏机:德国赛多利斯公司;1285 生物安全柜:美国热电公司;DHG-9140A新型电热恒温鼓风干燥箱:宁波江南仪器厂;HH.B11.600-BS-II 电热恒温培养箱:上海跃进医疗器械厂;DNM-9606酶标分析仪:北京普朗新技术有限公司。
1.3 方法
1.3.1 菌株拮抗实验
参考KUERMAN M等[21]的方法,在MRS改良培养基中加入稀释到一定梯度的菌液0.2 mL,涂布均匀,将无菌牛津杯放置在培养基上,杯中加入另两种菌液各0.1 mL,35 ℃条件下培养24 h,考察菌株之间的拮抗作用。
1.3.2 高脂血症小鼠模型建立
挑选80只小鼠适应性饲养2 d,自由饮水进食。 将80只小鼠随机分为两组,10只小鼠每天以5 g的量饲喂基础饲料,作为对照组;其余70只为高脂饲料组,每天以5 g的量饲喂高脂饲料,两组小鼠全部自由进水,连续饲喂35 d,每周记录小鼠体质量。 对照组小鼠全部处死,高脂造模组小鼠随机抽取10只,断头采血,分离血清,分别测定小鼠体质量、小鼠血清总胆固醇、甘油三酯、高密度脂蛋白-胆固醇和低密度脂蛋白-胆固醇的含量。
1.3.3 复合菌剂制备
将斜面保藏的菌株EAM-ZL010T、EAM-ZL016T 和EAM-ZT003T各勾取一环接种于改良MRS液体培养基中,37 ℃恒温培养48 h,吸取EAM-ZL010T、EAM-ZL016T菌液各1 mL分开接于改良MRS液体培养基中,吸取EAM-ZT003T菌液1 mL接于麦氏培养基中,37 ℃静置培养24 h,8 000 r/min离心10 min,去掉上清液,用无菌水洗涤两次,8 000 r/min离心10 min,将菌体浓度调整到约108 CFU/mL,用于小鼠灌胃。
1.3.4 复合菌株与辛伐他汀在小鼠体内降脂降胆固醇效果对比
将造模成功的高脂血症小鼠随机分成3组(包括复合菌组、辛伐他汀组和自然降脂组),每组20只。 复合菌组每日灌胃复合菌剂0.3 mL(菌株EAM-ZL010T、EAM-ZL016T和EAM-ZT003T活化液各0.1 mL,各菌液浓度均为1×108 CFU/mL),为了保证菌体溶液中一定的活菌数,每天灌胃都采用新鲜处理的菌株。 辛伐他汀组每日灌胃0.045 mg辛伐他汀生理盐水悬浊液0.3 mL(给药量根据人与动物之间的给药剂量换算得出)。自然降脂组每日灌胃生理盐水0.3mL。各组小鼠每日每只饲喂基础饲料5 g,自由进水,每周记录体质量。35 d后,断头采血,分离血清,利用各指标测试试剂盒分别测定TC、HDL-C、LDL-C和TG的含量。
1.3.5 小鼠体内毒性试验
将30只SPF级小鼠随机分成3组,辛伐他汀组小鼠每只每天食用3.33 mg辛伐他汀,复合菌组小鼠用高浓度复合菌液(菌株ZL010、ZL016和EAM-ZT003T活化液各0.1 mL,菌液浓度均为1×1010 CFU/mL),以每天0.3 mL的量灌胃,对照组小鼠正常饮食。为了保证菌体溶液中一定的活菌数,每次饲喂都采用新鲜处理的菌株。 每天自由进水,每周记录体质量。在给药42 d后,解剖小鼠,观察内脏外观变化,计算各组小鼠脏器指数,并做肝脏、肾脏组织切片,观察内脏是否存在病变[22-23]。脏器指数计算公式如下:
1.3.6 数据处理
试验数据以“平均值±标准差”表示,用SPSS 26.0软件进行单因素方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 菌株拮抗实验结果
由于菌株为乳酸菌和酵母菌,菌株产生的胞外分泌物不同,可能相互间存在一定的抑制作用,对本实验所选3株菌之间的拮抗效果进行测定,结果见表1。由表1可知,3株菌之间无拮抗效应,可用于制备复合菌剂。
表1 菌株间拮抗能力分析
Table 1 Analysis of antagonism between strains
注:“+”表示有拮抗,“-”表示无拮抗,“/”表示菌株间未进行检测。
菌株名称 EAM-ZL010T EAM-ZL016T EAM-ZT003T EAM-ZL010T EAM-ZL016T EAM-ZT003T/- --/ --- /
2.2 高脂血症小鼠模型的建立
2.2.1 高脂造模小鼠体质量变化
高脂饲料饲喂35 d内小鼠的体质量变化见图1。 由图1可知,高脂饲料对小鼠体质量增加影响明显,高脂造模小鼠体质量增加很快,其中第三周体质量增加最快,第四周增加变得缓慢,第五周体质量基本维持,不再增加,造模35 d内小鼠体质量平均增加约11 g。
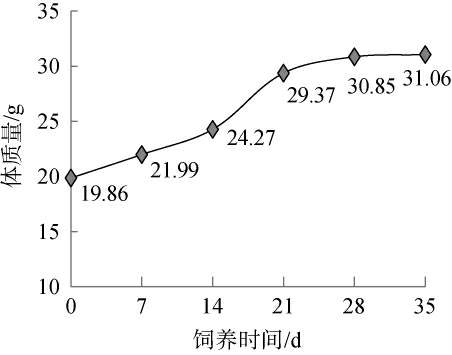
图1 高脂造模小鼠体质量变化
Fig.1 Changes of body mass of high-fat model mice
2.2.2 高脂造模小鼠血脂指标变化
饲喂高脂饲料35 d后,随机抽取高脂饲料组小鼠和基础饲料组小鼠各10只,断头采血,分离血清,各组小鼠血清指标测定结果见表2。 由表2可知,高脂饲料组小鼠血清中的总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白-胆固醇(LDL-C)含量显著高于基础饲料组(P<0.05),二者高密度脂蛋白-胆固醇(HDL-C)含量差异不显著(P>0.05)。说明饲喂高脂饲料后,造成了小鼠的脂类代谢失调,血清中的胆固醇水平升高,产生了高脂血症。
表2 高脂造模小鼠的血脂指标测定结果
Table 2 Detection results of blood lipid indexes of high-fat model mice
mmol/L
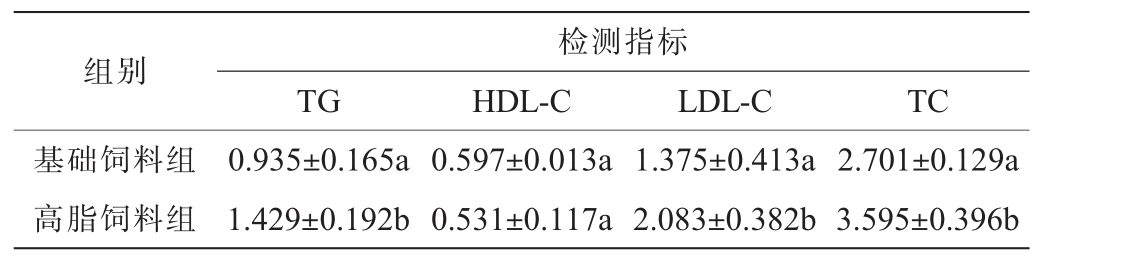
注:同列数据不同字母表示差异显著(P<0.05),相同小写字母或无字母表示差异不显著(P>0.05),下同。
组别检测指标TG HDL-C LDL-C TC基础饲料组高脂饲料组0.935±0.165a 1.429±0.192b 0.597±0.013a 0.531±0.117a 1.375±0.413a 2.083±0.382b 2.701±0.129a 3.595±0.396b
2.2.3 高脂造模小鼠动脉硬化指数变化
动脉硬化指数(atherogenlcindex,AI)反映了LDL-C和HDL-C之间的比值,是衡量心血管疾病易患程度的一个指标。该指数的增加意味着血液中LDL的相对浓度增高,HDL相对浓度降低,血液循环中胆固醇的量增加,从而导致心血管疾病的易患程度增加。 高脂造模后,高脂饲料组小鼠的动脉硬化指数为1.691 1,而基础饲料组仅为0.566 2,高脂饲料组与基础饲料组相比AI值显著升高(P<0.05),从而进一步说明高脂造模成功。
2.3 复合菌剂与辛伐他汀在小鼠体内降脂降胆固醇效果对比
2.3.1 小鼠体质量变化
降脂实验期间,各组小鼠体质量变化见图2。由图2可知,各组小鼠体质量均呈下降趋势,对照组小鼠通过改变饮食,在不采取任何措施的情况下,体质量有所下降,辛伐他汀组小鼠体质量下降中等,复合菌组小鼠平均体质量下降最多,由33.38g降低为28.47g,由于饲料的改变,各组小鼠体质量均有所下降,但同时灌胃复合菌剂具有更好的降体质量效果。
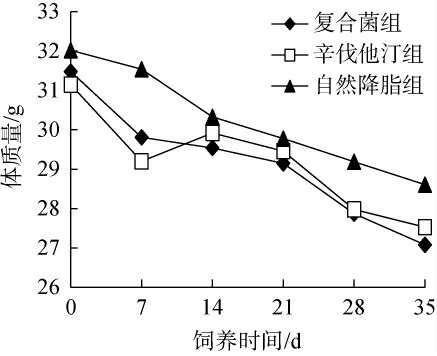
图2 各组小鼠体质量变化曲线
Fig.2 Changes curves of body mass of mice in each group
2.3.2 小鼠血脂指标变化
不同处理对小鼠血脂指标的测定结果见表3。由表3可知,复合菌处理组小鼠血清中甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白-胆固醇(HDL-C)、低密度脂蛋白-胆固醇(LDL-C)指标与高脂造模组对比差异显著(P<0.05),辛伐他汀药物组与高脂造模组对比,血清TG、LDL-C和TC差异显著(P<0.05),辛伐他汀药物组小鼠血清中TG、LDL-C、TC与高脂造模组对比,分别下降24%、36%和33%,而复合菌组分别下降45%、34%和32%。自然降脂组与高脂造模组对比,血清中各项指标均有所降低,但除HDL-C和LDL-C差异显著(P<0.05)外,其余均无显著差异(P>0.05)。
表3 小鼠血脂指标测定结果
Table 3 Detection results of blood lipid indexes in mice
mmol/L
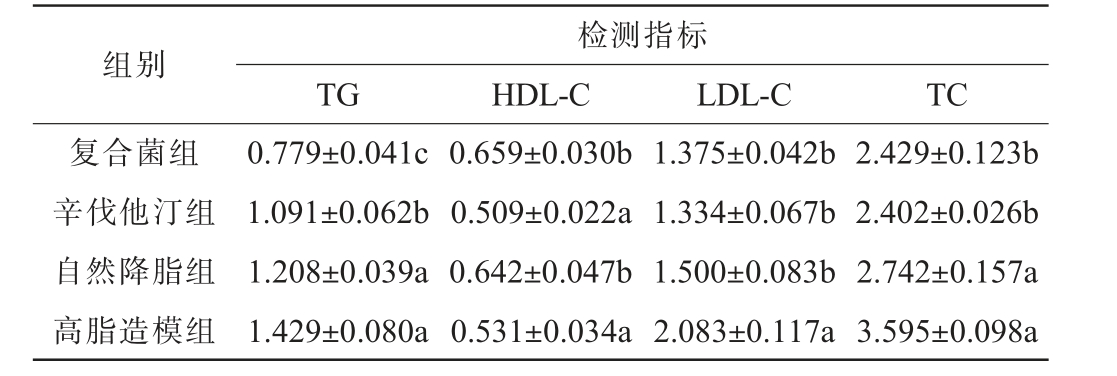
组别检测指标TG HDL-C LDL-C TC复合菌组辛伐他汀组自然降脂组高脂造模组0.779±0.041c 1.091±0.062b 1.208±0.039a 1.429±0.080a 0.659±0.030b 0.509±0.022a 0.642±0.047b 0.531±0.034a 1.375±0.042b 1.334±0.067b 1.500±0.083b 2.083±0.117a 2.429±0.123b 2.402±0.026b 2.742±0.157a 3.595±0.098a
自然降脂组小鼠自身存在一定的免疫调节,通过低脂饮食,可降低血清中各项血脂指标,但由于饲喂的高脂饲料中含有相当数量的胆固醇,在小鼠缺乏治疗的情况下,各项测定值均高于复合菌组和辛伐他汀组;复合菌组与自然降脂组小鼠血清TG、TC含量存在显著差异(P<0.05),复合菌组显著低于自然降脂组。复合菌组与辛伐他汀药物组对比,TG和HDL-C存在显著差异(P<0.05),复合菌组在降低TG、提升HDL-C方面优于辛伐他汀组,HDL-C浓度的升高,可以将血液中多余的胆固醇转运回肝脏并在肝脏中通过酯化作用使胆固醇便于降解[24-25],LDL-C和TC两者差异不显著(P>0.05)。由此可知,复合菌具有优于辛伐他汀药物的降脂效果。
2.4 小鼠体内毒性试验
2.4.1 小鼠体质量与脏器指数测定结果
使用辛伐他汀和高浓度复合菌液进行毒性试验,小鼠体质量变化情况见表4,取脏器称质量并计算脏器指数,结果见表5。
表4 毒性试验小鼠的体质量变化
Table 4 Changes of body mass of mice in toxicity tests
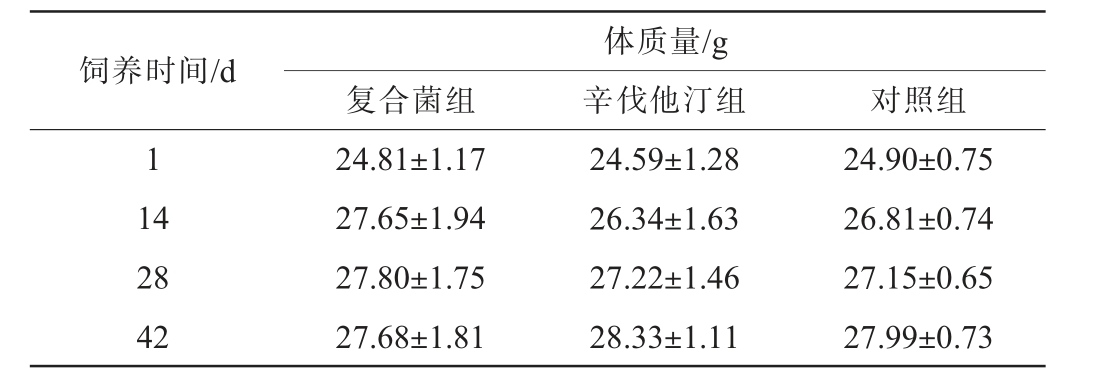
饲养时间/d 复合菌组体质量/g辛伐他汀组 对照组1 14 28 42 24.81±1.17 27.65±1.94 27.80±1.75 27.68±1.81 24.59±1.28 26.34±1.63 27.22±1.46 28.33±1.11 24.90±0.75 26.81±0.74 27.15±0.65 27.99±0.73
表5 毒性试验小鼠的脏器指数测定结果
Table 5 Determination results of viscera indexes of mice in toxicity tests
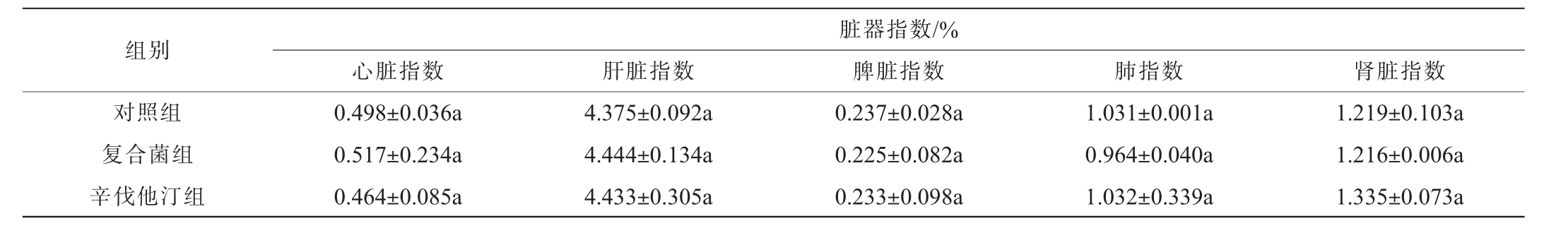
组别心脏指数 肝脏指数脏器指数/%脾脏指数 肺指数 肾脏指数对照组复合菌组辛伐他汀组0.498±0.036a 0.517±0.234a 0.464±0.085a 4.375±0.092a 4.444±0.134a 4.433±0.305a 0.237±0.028a 0.225±0.082a 0.233±0.098a 1.031±0.001a 0.964±0.040a 1.032±0.339a 1.219±0.103a 1.216±0.006a 1.335±0.073a
各组小鼠毛色光洁,食欲正常。 由表4可知,各组小鼠体质量增加平稳,体质量无显著差异(P>0.05),各组小鼠饲喂42 d未出现异常体征,未发现异常死亡。 小鼠处死解剖,各脏器表面光滑、形态完整、色泽正常。由表5可知,各组小鼠脏器指数虽略有区别,但与对照组对比,无显著差异(P>0.05),复合菌组小鼠脏器指数与辛伐他汀组对比,亦无显著差异(P>0.05)。说明复合菌株对小鼠体质量和脏器指数无明显毒副作用。
2.4.2 小鼠肝脏肾脏组织染色结果
选取复合菌组小鼠肝脏、肾脏组织制作冰冻切片,苏木精-伊红(hematoxylin-eosin staining,HE)染色后观察组织切片,结果见图3。
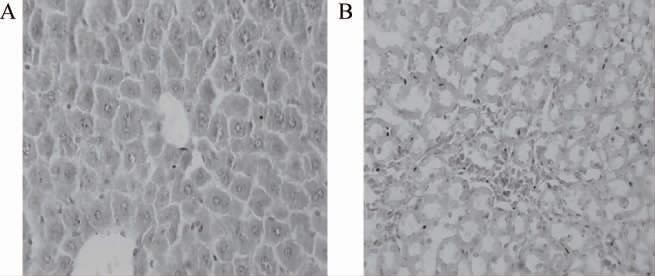
图3 小鼠肝脏(A)及肾脏(B)组织HE染色结果
Fig.3 HE staining results of liver (A) and kidney (B) tissue of mice
由图3可知,小鼠肝小叶结构清楚,完整,肝细胞排列整齐、紧密,无肝细胞气球样变或炎症细胞浸润;小鼠肾脏切片镜下结构正常,肾小球大小和形态正常,说明复合菌株对小鼠无明显的毒副作用。
3 结论
对高脂造模成功的小鼠进行体内降脂试验,发现乳酸菌与酵母菌组成的复合菌剂具有很好的降脂作用,复合菌组与自然降脂组对比TG、TC含量存在显著差异(P<0.05),复合菌组显著低于自然降脂组。复合菌组与辛伐他汀药物组比较,小鼠血清TG和HDL-C存在显著差异(P<0.05),复合菌组在降低TG、提升HDL-C方面优于辛伐他汀组,血清中LDL-C和TC两者差异不显著(P>0.05)。 毒性试验证明,复合菌剂对小鼠无明显毒副作用,小鼠饲喂42 d未出现异常体征,未发现异常死亡,小鼠各脏器形态完整、肝脏和肾脏病理切片正常,综上所述,复合菌剂具有优于辛伐他汀药物的TG降低作用和HDL-C提升作用,LDL-C、TC与辛伐他汀药物基本持平,且复合菌剂对动物无毒无害,具有高度开发价值。
[1]NELSON R.H.Hyperlipidemia as a risk factor for cardiovascular disease[J].Primary Care,2013,40(1):195-211.
[2]SABATINE M S, GIUGLIANO R P, KEECH A C, et al.Evolocumab and clinical outcomes in patients with cardiovascular disease[J].N Engl J Med,2017,376(18):1713-1722.
[3]PAN X,WANG L,PAN A.Epidemiology and determinants of obesity in China[J].Lancet Diabet Endocrinol,2021,9(6):373-392.
[4]BRUGTS J,YETGIN T,HOEKS S,et al.The benefits of statins in people without established cardiovascular disease but with cardiovascular risk factors:meta-analysis of randomised controlled trials[J].BMJ,2009,30(1):338.
[5]WANG N,FULCHER J,ABEYSURIYA N,et al.Intensive LDL cholesterol-lowering treatment beyond current recommendations for the prevention of major vascular events: A systematic review and meta-analysis of randomised trials including 327 037 participants[J].Lancet Diabet Endocrinol,2020,8(1):36-49.
[6]刘宜平.高血脂合并动脉粥样硬化性脑梗死的治疗观察[J].中国继续医学教育,2019,11(21):122-124.
[7]陈超,王立颖,肖娴.二甲双胍联合辛伐他汀对非酒精性脂肪肝患者血脂、血糖及肝功能的干预作用[J].医学综述,2016,22(24):4923-4926.
[8]纪利利,李美杰,姚丽娜,等.他汀类药物治疗急性脑梗死对患者颈动脉粥样硬化斑块及炎症反应的影响[J].现代中西医结合杂志,2018,27(22):2491-2494.
[9]ROSSI M,FABRIS E,BARBISAN D,et al.Lipid-lowering drug therapy:Critical approach for implementation in clinical practice[J].Am J Cardiovasc Drugs,2022,22(2):141-155.
[10]AKYEA RK,KAI J,QURESHI N,et al.Sub-optimal cholesterol response to initiation of statins and future risk of cardiovascular disease[J].Heart,2019,105(13):975-981.
[11]QU T,YANG L,WANG Y,et al.Reduction of serum cholesterol and its mechanism by Lactobacillus plantarum H6 screened from local fermented food products[J].Food Funct,2020,11(2):1397-1409.
[12]LEE C S,PARK M H,KIM S H.Selection and characterization of probiotic bacteria exhibiting antiadipogenic potential in 3T3-L1 preadipocytes[J].Probiot Antim Prot,2022,14(1):72-86.
[13]REZAZADEH L, ALIPOUR B, JAFARABADI M A, et al.Evaluation of the effects of probiotic yoghurt on inflammation and cardiometabolic risk factors in subjects with metabolic syndrome: A randomised controlled trial[J].Int Dairy J,2020,101:104577.
[14]DALIRI E B M,KIM Y,DO Y,et al.In vitro and in vivo cholesterol reducing ability and safety of probiotic candidates isolated from Korean fermented soya beans[J].Probiot Antim Prot,2022,14(1):87-98.
[15]ANILA K,KUNZES A,BHALLA T C.In vitro cholesterol assimilation and functional enzymatic activities of putative probiotic Lactobacillus sp.isolated from fermented foods/beverages of North West India[J].J Nutr Food Sci,2016,6(2):467.
[16]丁小萌,李明星,赵芃,等.一株高效降胆固醇乳酸菌的筛选与特性研究[J].中国微生态学杂志,2024,36(4):401-407,413.
[17]TIAN L,LIU R M,ZHOU Z W,et al.Probiotic characteristics of Lactiplantibacillus plantarum N-1 and its cholesterol-lowering effect in hypercholesterolemic rats[J].Probiot Antim Prot,2022,14(2):337-348.
[18]JIANG J C,WU C E,ZHANG C C,et al.Strain-specific effects of Bifidobacterium longum on hypercholesterolemic rats and potential mechanisms[J].Int J Mol Sci,2021,22(3):1305.
[19]吴慧昊,牛锋,钟琦,等.高效降胆固醇降甘油三酯乳酸菌的分离鉴定和功能分析[J].食品工业科技,2019,40(14):157-162.
[20]吴慧昊,牛锋,徐红伟,等.解脂亚罗酵母菌体外降甘油三酯降胆固醇效果研究[J].微生物学杂志,2019,39(4):58-64.
[21]KUERMAN M,BAO Y H,GUO Y,et al.Effects of prebiotic carbohydrates on the growth promotion and cholesterol-lowering abilities of compound probiotics in vitro[J].LWT-Food Sci Technol,2019,118(3):108703.
[22]JEUN J,KIM S,CHO S,et al.Hypocholesterolemic effects of Lactobacillus plantarum KCTC3928 by increased bile acid excretion in C57BL/6 mice[J].Nutrition,2010,26(3):321-330.
[23]关媛媛,刘美怡,王立英,等.一种改良的餐后高三酰甘油血症小鼠模型的建立[J].实验动物科学,2024,41(5):1-8.
[24]SHIN H S, PARK S Y, LEE D K, et al.Hypocholesterolemic effect of sonication-killed Bifidobacterium longum isolated from healthy adult Koreans in high cholesterol fed rats[J].Arch Pharm Res,2010,33(9):1425-1431.
[25]EL-WASEIF A,GABER H S,EWAIS E A.Hypocholesterolemic operating parameters of novel probiotics in vitro[J].Res J Pharmacy Technol,2021,10:5197-5201.