甜型葡萄酒是指还原糖含量高于45 g/L的葡萄酒,包括冰酒和贵腐酒等[1]。加强型甜葡萄酒是甜型葡萄酒的一种,它通常是在葡萄酒的发酵过程中采用中性酒精或白兰地(Brandy)提前终止发酵,保留葡萄醪中的还原糖从而生产的甜型酒,例如葡萄牙的波特酒(Port)和西班牙的雪莉酒(Sherry)等[2]。高品质加强型葡萄酒具有颜色稳定性强、香气优雅复杂性高、口感醇厚绵长性好等感官质量特征,同时具有可长期陈酿、价格高昂和文化收藏价值高等鲜明的特色[3-4]。在世界很多著名葡萄酒产区中,高陈酿能力的葡萄酒可以陈酿10~30年,甚至更久。研究表明,高陈酿能力的葡萄酒具有高糖、高酸、高酚类物质(高丹宁)或/和高酒精度的特征[5-9]。而高陈酿品质的红葡萄酒具有色深、烘烤类香气浓郁、高丹宁、高总酚、高花色苷或/和高非花色苷酚含量特征[10-13]。然而在我国西北产区,包括陕西、宁夏、甘肃、新疆和内蒙古等地,部分红葡萄酒的陈酿品质较低,表现出颜色不稳定、香气不优雅、口感不醇厚等问题,一般需要在2~4年内饮用,仅少数高品质陈酿型红葡萄酒可陈酿5~7年。与世界高品质的陈酿型葡萄酒相比,我国高品质陈酿型葡萄酒的陈酿品质仍然有很大的提升空间。
酿酒酵母是葡萄酒生产过程中的关键菌种,能快速将糖类转化为酒精和二氧化碳,发酵效率高,在发酵过程中除了产生酒精和二氧化碳外,还能产生多种香气和风味物质,如酯类、醇类、醛类等。研究表明,良好的酵母菌种应当拥有出色的整体耐受能力,包括高的酒精含量、高SO2含量、高糖含量、低pH值以及对高温的耐受能力[14]。除此之外,酵母在葡萄酒稳定性方面起着至关重要的作用。它能够通过生成与花色苷有相互作用的代谢物、调整发酵基质的pH值和极性、激活β-葡萄糖苷酶的活性,以及吸附和自溶等多种方式对葡萄酒中花色苷的演化进程产生影响,从而进一步改变葡萄酒的整体颜色和陈酿过程中的稳定性。但是,由不同酵母菌制作的葡萄酒在品质上存在差异,这主要是受到酵母的特性所影响,例如其释放各种代谢产物的能力和对酒中成分的吸收能力等。已经有研究表明,酵母XR是广受好评的酿酒商业酵母,对SO2耐受性及高酒精度的耐受性良好[15];酵母CECA作为一种中国本土的商业酵母,其酿造的葡萄酒具有发酵速度快、富含多种花香果香等复杂香气的特点[16];酵母RC212酿造的果酒对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率较高,表明其可以通过氢原子或电子稳定自由基减缓氧化反应[17]。
因此,该研究采用酵母XR、CECA和RC212进行加强型甜红葡萄酒的酿造,在发酵结束、陈酿6个月、陈酿12个月时进行基本理化指标、有机酸、颜色、花色苷、生物胺、挥发性风味化合物和感官品质分析,以分析这三种酵母的差异,为选用不同酵母酿造不同特色的加强型甜红葡萄酒提供理论依据,满足更广泛的消费需求。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
实验用材料为赤霞珠葡萄,于2022年9月15日采摘自宁夏。还原糖含量为220.65 g/L(以葡萄糖计),可滴定酸含量为6.67 g/L(以酒石酸计)。
1.1.2 试剂
NaOH、NaHCO3、HCl、葡萄糖标准溶液、甲基蓝指示液、(NH4)2SO4、KH2PO4、MgSO4、NaCl、MnSO4、SO2:广东光华科技股份有限公司;苹果酸、酒石酸、琥珀酸和柠檬酸标准品(色谱级,纯度≥98%)、果胶酶(50 000 U/g):上海源叶生物科技有限公司;二甲花翠素-3-O-葡萄糖苷标准品、8种单体酚标准品(色谱级,纯度>98%):瑞芬思生物科技有限公司。
1.1.3 菌种
酵母XR:法国诺盟公司(Lamothe-Abiet);酵母CECA:安琪酵母股份有限公司;酵母RC212:法国拉曼公司(Lallemand)。
1.2 仪器与设备
LB 32T手持式糖度计:广州铭睿电子科技有限公司;RAPid ![]() 真空快速蒸发仪:美国Labconco公司;UV1800紫外分光光度计、LC-20AT高效液相色谱(high performance liquid chromatogram,HPLC)仪(二极管阵列检测器)、QP2010Ultra气相色谱质谱联用(gas chromatography-mass spectrometry,GC-MS)仪:日本岛津公司。
真空快速蒸发仪:美国Labconco公司;UV1800紫外分光光度计、LC-20AT高效液相色谱(high performance liquid chromatogram,HPLC)仪(二极管阵列检测器)、QP2010Ultra气相色谱质谱联用(gas chromatography-mass spectrometry,GC-MS)仪:日本岛津公司。
1.3 方法
1.3.1 加强型甜红葡萄酒的酿造
去除变质的葡萄后,加入60 mg/L的二氧化硫搅碎,将其转移到带有温度控制系统的100 L不锈钢储罐中,加入30 mg/kg果胶酶浸渍3 d。将其分为三组,分别接种250 mg/L的酵母XR、CECA和RC212启动酒精发酵。浸渍和酒精发酵同时进行,发酵温度保持在(18±1)℃。在发酵过程中,每天早晚分别测定样品的含糖量。当酒样中含有80 g/L残留糖时,加入120 mg/L二氧化硫终止发酵,在4±1 ℃下继续浸渍7d。人工压榨葡萄渣,加入白兰地,将酒精度提高到20%vol。每个处理重复两次。
1.3.2 葡萄酒基本理化指标的测定
还原糖、酒精度、挥发酸、总酸和总酚的测定参考GB 15038—2006《葡萄酒、果酒通用分析方法》[18]。
1.3.3 葡萄酒CIELab颜色分析
葡萄酒样使用0.45 μm滤膜过滤,1 cm光程的石英比色皿测定透光率,以去离子水为空白检测440 nm、530 nm、600 nm波长处的透光值,计算CIELab参数红色/绿色(a*值)、黄色/蓝色(b*值)、亮度(L*值)、色调角(hab)、色度(Cab*),所有测量均重复3次[19]。
1.3.4 有机酸含量的测定
在离心后的葡萄酒中加入去离子水,稀释5倍,用0.22μm微孔滤膜过滤后进行HPLC分析。HPLC的色谱条件参照成冰等[20]的方法:色谱柱Synergi C18柱(250 mm×4.6 mm,4 μm),流动相0.02 mol/L KH2PO4-甲醇(97∶3)溶液,添加H3PO4将pH调为2.30,流速1.00 mL/min,柱温30 ℃,进样量10 μL,检测波长210 nm。
1.3.5 单体花色苷的测定
采用HPLC和光电二极管阵列检测器以定性定量葡萄酒中的花色苷,以二甲基-3-O-葡萄糖苷的当量表示每种花色苷的浓度。流动相A为甲酸∶乙腈∶水=2.5∶10∶80;流动相B为甲酸∶乙腈∶水=2.5∶50∶40。梯度洗脱程序为0~45 min,0%~35% B;45 ~46 min,35%~100% B;46 ~50 min,100%B;50~51 min,100%~0%B;51~55 min,0%B。分析条件如下:流速1 mL/min;柱温35 ℃;进样量20 μL;检测波长为520 nm[21]。绘制单体花色苷的标准曲线,并根据标准曲线计算各花色苷含量。
1.3.6 单体酚测定
向10 mL离心管中加入1 mL的葡萄酒、1 mL乙酸乙酯和0.5 mL乙腈。将混合物涡旋10 s,然后以8 000 r/min的速度离心5 min以收集上清液。重复提取两次,合并上清液,用旋转蒸发器蒸发,然后重新溶解在0.5 mL甲醇中用于HPLC分析。配置流动相A(水∶乙腈∶乙酸=80∶10∶0.1)和流动相B(水∶乙腈∶乙酸=40∶50∶0.1)。洗脱程序为0~45 min,0%~35%B;45~46 min,35%~100%B;46~50 min,100%B;50~51 min,100%~0%B;51~55 min,0%B。通过外标法进行定量[21]。
1.3.7 生物胺测定
在5 mL的烧瓶中加入葡萄酒样品、丹璜酰氯溶液(10 mg/mL)、碳酸氢钠缓冲液(pH=10)以及丙酮,比例为2∶2∶6∶5。在45 ℃的温度下振荡(750 r/min,5 min),加入100 μL的25%氨溶液搅拌30 s,并在避光的条件下静置15 min[22]。
1.3.8 挥发性化合物的测定
样品前处理:取5 mL的葡萄酒样品和1 g氯化钠于顶空瓶中,再加入10 μL 3-壬酮作为内标物。
气相色谱条件:色谱柱升温程序为初始温度50 ℃维持1 min后以3 ℃/min速率升温至220 ℃后保持5 min。选择电子电离(electronic ionization,EI)模式,电离能量70 eV,质谱信号采集范围覆盖25~350 amu。进样口、质谱接口及离子源温度分别设置为250 ℃、280 ℃和230 ℃,载气选用高纯氦气,并采用不分流模式,流速控制为1 mL/min。通过比对标准样品保留时间及特征质谱碎片,结合美国国家标准技术研究所(national institute of standards and technology,NIST)14.L质谱数据库进行物质定性。定量分析采用内标法,选取4-甲基-2-戊醇作为内标物,通过建立目标物与内标的峰面积比值进行浓度计算[23]。
1.3.9 感官品评
来自西北农林科技大学葡萄酒学院的12名品酒小组成员(年龄22~26岁,男女比例1∶1)参与了对实验葡萄酒的感官评估。品评过程中,小组成员根据外观(A)(包括澄清度、亮度和色度)、香气(O)(包括纯正度、浓郁度和优雅度)和味道(M)(包括甜味、酸味、苦味、收敛性、酒精感、协调性和余味)对葡萄酒进行9分制评分。分数越高,此特性被感受到的强度就越高[5-6]。
1.3.10 数据分析
采用Minitab 19.0 软件程序进行单因素方差分析(ANOVA),采用Turkey检验确定显著性差异(P<0.05)。采用GraphPad Prism 8和Origin 2021绘图。采用正交偏最小二乘-判别分析(partial least squares-discrimination analysis,OPLS-DA)和SIMCA 14.1软件计算(variable importance in the projection,VIP)值对GC-MS定量结果进行分析。
2 结果与分析
2.1 酵母种类对葡萄酒基本理化指标的影响
酵母种类对葡萄酒基本理化指标的影响见图1。由图1可知,本实验的加强型甜红葡萄酒样品的酒精度均在19%vol~21%vol之间,还原糖含量均处于50~70 g/L之间。在发酵结束时,酵母CECA酿造的葡萄酒的酒精度和还原糖含量显著高于其他处理组,而在陈酿12个月时,酵母种类对葡萄酒的酒精度、还原糖含量、总酸含量和挥发酸含量均无显著影响(P>0.05)。
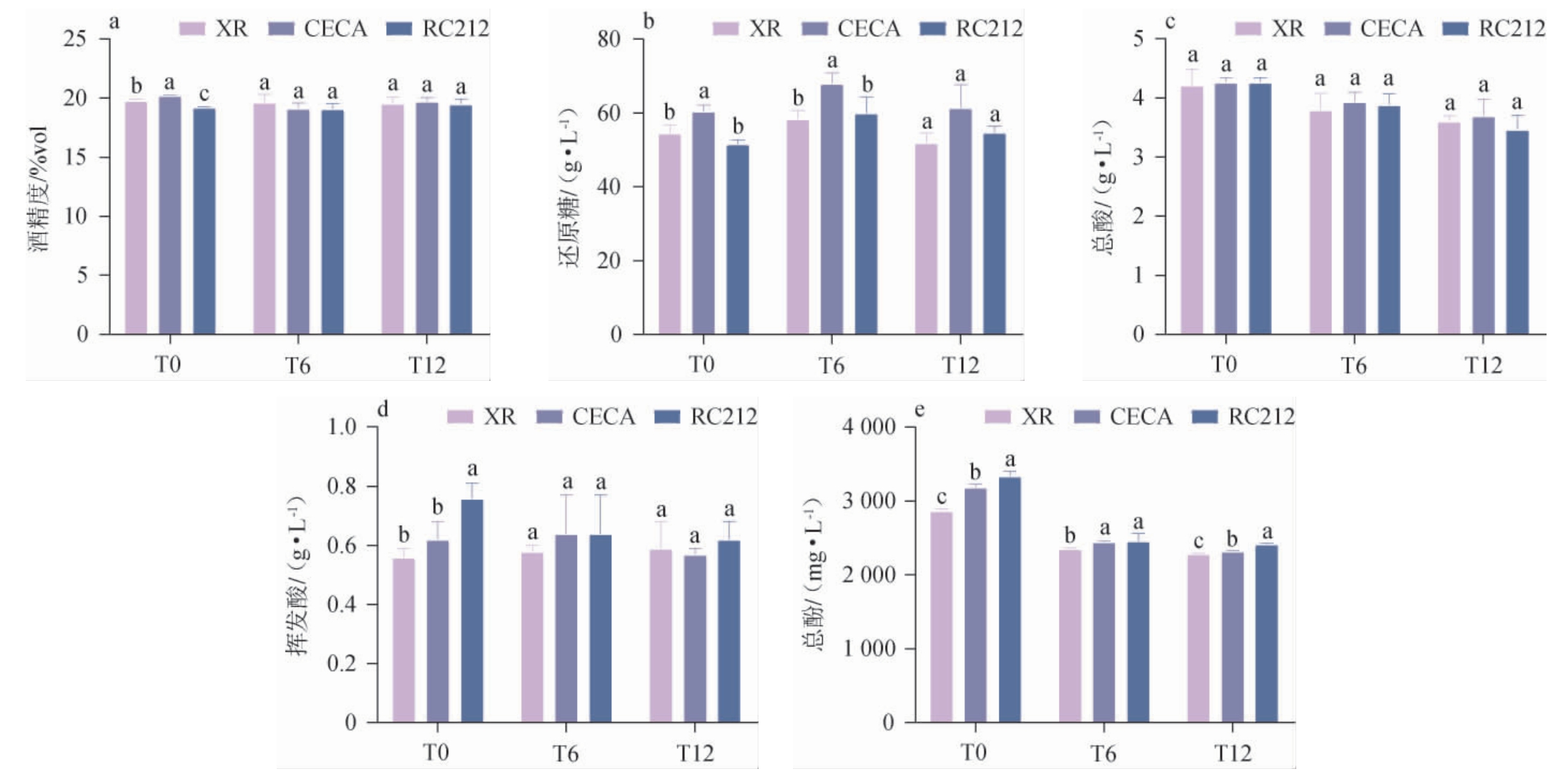
图1 酵母种类对葡萄酒基本理化指标的影响
Fig.1 Effect of yeast types on the basic physiochemical parameters of wines
不同字母表示处理组间差异显著(P<0.05)。T0:发酵结束;T6:陈酿6个月;T12:陈酿12个月;下同。
在陈酿过程中,总酚含量逐渐下降,在发酵结束和陈酿12个月时,接种酵母RC212的葡萄酒中总酚含量显著高于其他组(P<0.05)。与发酵结束时相比,用酵母XR、CECA和RC212发酵的葡萄酒的总酚含量在陈酿12个月时分别降低了583.30 mg/L、863.27 mg/L和919.22 mg/L,下降了20.31%、27.10%和27.54%,这可能是由于在陈酿期间葡萄酒的内在因素、微生物和环境的协同作用导致的酚类物质的水解、缩合和氧化[25]。接种酵母RC212的葡萄酒中总酚含量在陈酿各时期均大于其他酵母处理组,因此接种酵母RC212可以有效抑制加强型甜红葡萄酒总酚的降解速度,这对葡萄酒的颜色和感官品质起重要作用。
2.2 酵母种类对葡萄酒有机酸的影响
由图2可知,从实验组中共检测到4种有机酸,分别为苹果酸、酒石酸、琥珀酸和柠檬酸。随着陈酿时间的延长,不同处理组的葡萄酒有机酸含量均呈下降趋势。在陈酿12个月后有机酸的总量最低,XR、CECA、RC212组分别为6.73 g/L、6.51 g/L、6.56 g/L,同比下降了23.61%、26.72%、25.45%。
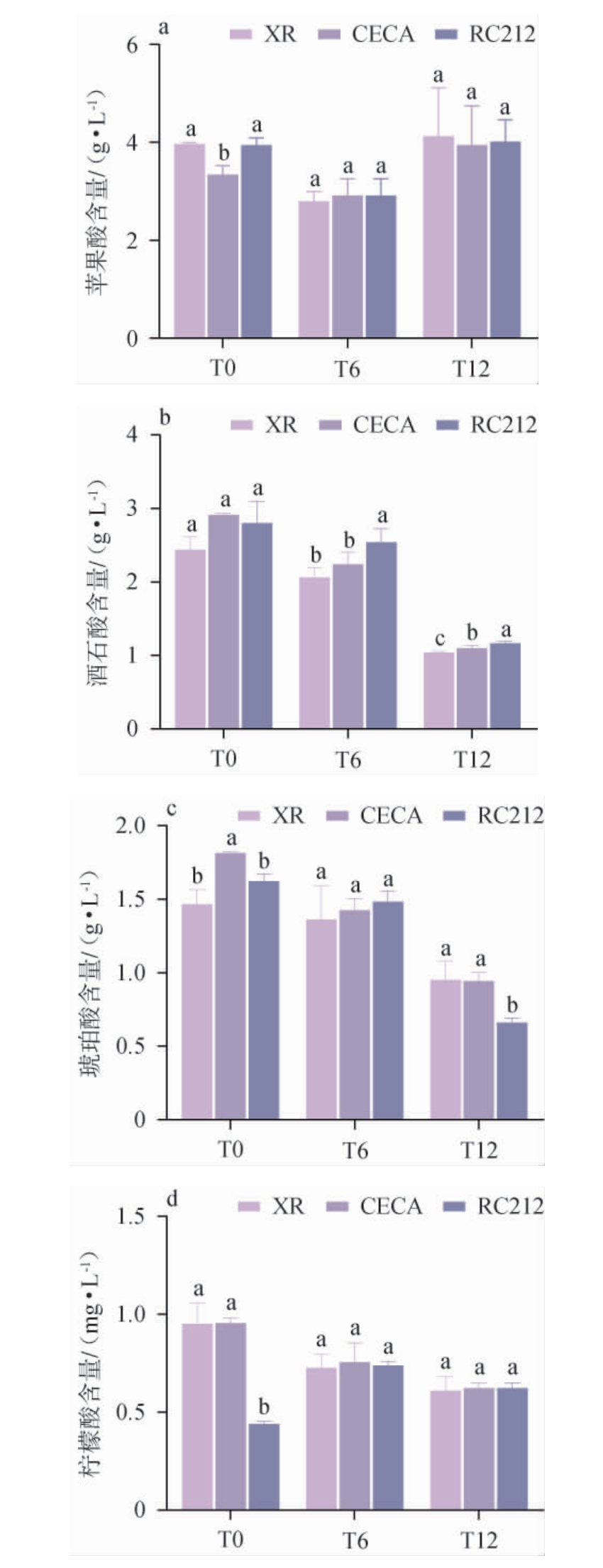
图2 酵母种类对葡萄酒有机酸的影响
Fig.2 Effect of yeast types on the organic acids of wines
由图2a可知,在发酵结束时,酵母CECA发酵葡萄酒的苹果酸含量显著低于其他组(P<0.05),由此可得在发酵结束时酵母CECA的苹果酸降解能力相对较高。研究表明,在低pH值(pH<4.5)时,苹果酸的降解是首先进行的,且几乎不消耗葡萄糖或柠檬酸[26]。酒石酸是葡萄的特征酸,随着陈酿的进行,由于低温的影响,其溶解度下降,主要沉淀为酒石酸钾和酒石酸氢钾[27-28]。由图2b可知,在陈酿6个月和陈酿12个月时,接种RC212的葡萄酒酒石酸含量显著高于其他酵母组(P<0.05),这表明酵母RC212可以减缓酒石酸的沉淀过程。琥珀酸具有独特的风味特征并且相对柔和。由图2c可知,接种酵母CECA的葡萄酒琥珀酸含量较高,陈酿12个月时接种酵母RC212的葡萄酒琥珀酸含量较低。柠檬酸能调整葡萄酒整体的酸度水平,也具备一定的抗氧化能力,可以延缓葡萄酒的氧化进程,减少葡萄酒中一些氧化反应导致的风味劣变和色泽改变等不良现象。由图2d可知,在发酵结束时,RC212处理的葡萄酒中柠檬酸含量显著低于其他酵母发酵葡萄酒(P<0.05),但随着陈酿时间的延长,各酵母处理组之间无显著差异(P>0.05)。综上所述,对于年轻葡萄酒,酵母CECA可以有效降低苹果酸含量并提高琥珀酸含量,而酵母RC212可以降低柠檬酸含量;对于陈酿型葡萄酒,酵母RC212有利于提高葡萄酒酒石酸的含量并降低琥珀酸含量。
2.3 酵母种类对葡萄酒CIELab颜色参数的影响
研究表明,葡萄酒在陈酿时,明亮度L*值往往会降低,红色色调a*值也随之降低,但黄色色调b*值会增大[29]。酵母自溶释放的成分也可能和色素发生化学反应,改变葡萄酒的颜色深度和色调。有些情况下,这些反应会使葡萄酒的颜色稍微变浅,但同时也会使颜色变得更加柔和、复杂。酵母种类对葡萄酒颜色参数的影响结果见图3。由图3可知,随陈酿时间的延长,酵母XR、CECA、RC212酿造葡萄酒样品的L*值分别降低了15.76%、17.15%和21.50%,这表明酵母RC212可以加速葡萄酒颜色变暗的进程。在发酵结束时,接种酵母CECA的葡萄酒a*值、b*值、Cab*值和hab值均显著大于其他酵母组(P<0.05);而在陈酿12个月时,接种RC212的葡萄酒a*值、b*值、Cab*值和hab值均显著大于其他酵母组(P<0.05)。这表明,对于新鲜葡萄酒或短期陈酿的葡萄酒,接种酵母CECA的葡萄酒颜色更鲜艳;而对于陈酿型葡萄酒,接种酵母RC212使葡萄酒颜色更稳定。
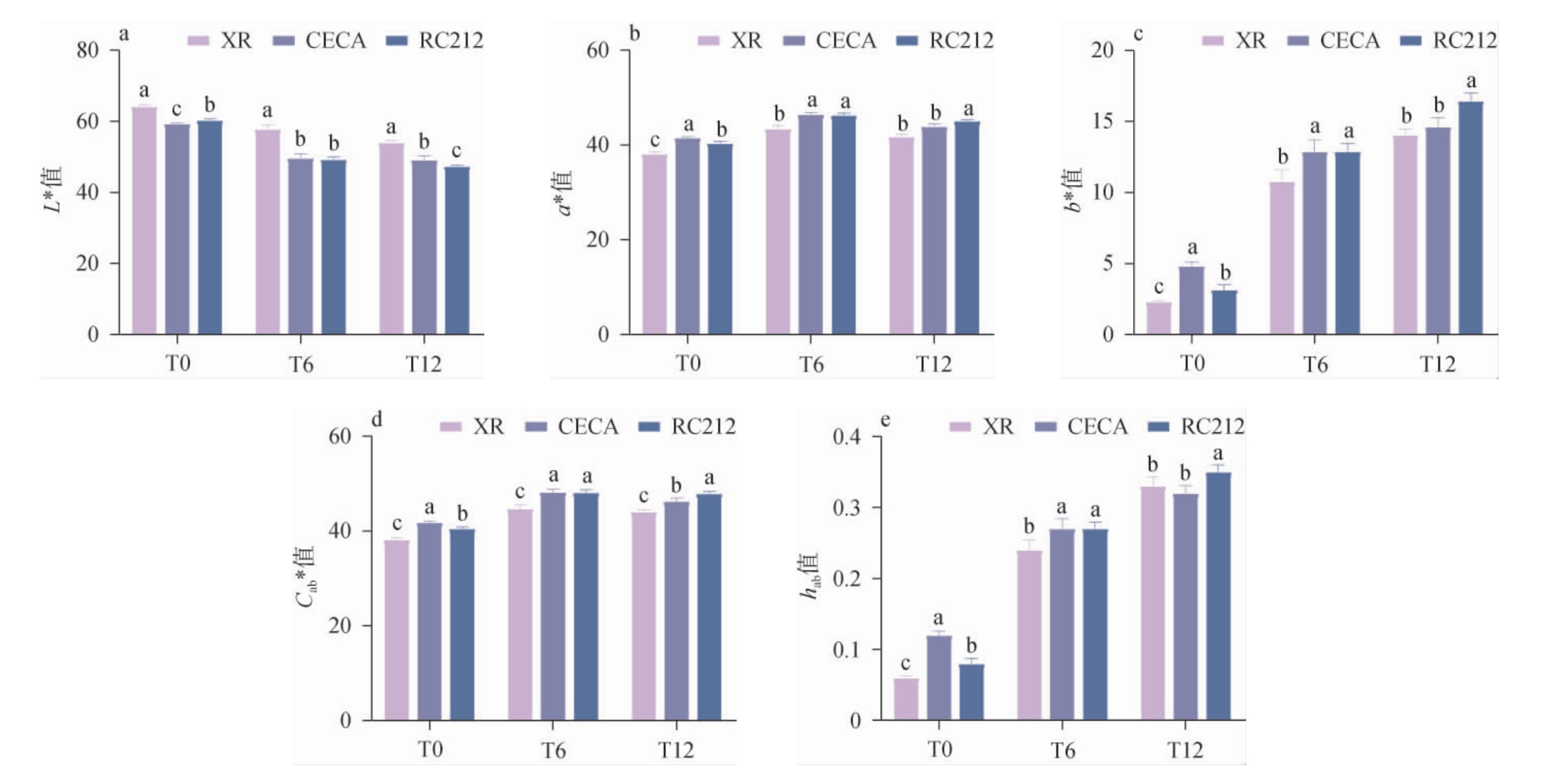
图3 酵母种类对葡萄酒颜色参数的影响
Fig.3 Effect of yeast types on the color parameters of wines
2.4 酵母种类对葡萄酒花色苷的影响
通过HPLC分析,共检测出9种单体花色苷单体,分别是花翠素-3-O-葡萄糖苷(Dp-3-O-Glu)、花青素-3-O-葡萄糖苷(Cy-3-O-Glu)、甲基花翠素-3-O-葡萄糖苷(Pt-3-O-Glu)、甲基花青素-3-O-葡萄糖苷(Pn-3-O-Glu)、二甲花翠素-3-O-葡萄糖苷(Mv-3-O-Glu)、甲基花青素-3-O-(6'-O-乙酰化)-葡萄糖苷(Pn-3-acetylglc)、二甲花翠素-3-O-(6'-O-乙酰化)-葡萄糖苷(Mv-3-acetylglc)、甲基花青素-3-O-(6'-O-反式对香豆酰化)-葡萄糖苷(Pn-3-p-coumglc trans)、二甲花翠素-3-O-(6'-O-反式对香豆酰化)-葡萄糖苷(Mv-3-p-coumglc trans)。酵母种类对葡萄酒花色苷的影响结果见图4。

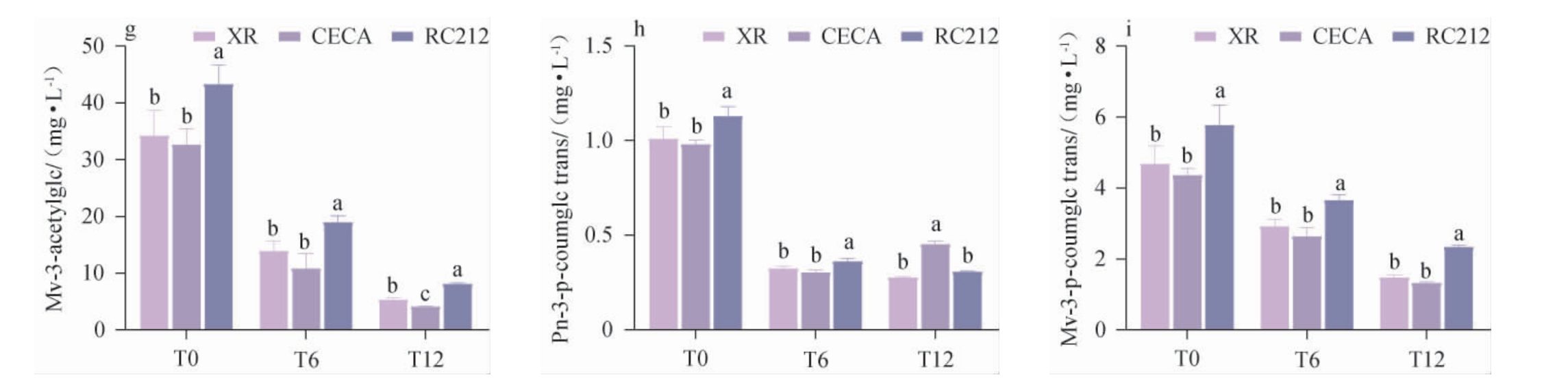
图4 酵母种类对葡萄酒单体花色苷含量的影响
Fig.4 Effect of yeast types on the monomeric anthocyanins contents of wines
由图4可知,每一种单体花色苷的含量随着陈酿时间的延长均降低,这可能是陈酿过程中单体花色苷发生氧化、缩聚和聚合等反应[30-31]。在陈酿12个月时,酵母XR、CECA、RC212处理的葡萄酒总花色苷含量分别为75.83 mg/L、77.40 mg/L、104.99 mg/L,较发酵结束时下降了60.31%、62.25%和53.78%,由此可知酵母RC212可以延缓单体花色苷的降解速率。研究表明,酵母对花色苷的吸附也是影响花色苷演化的因素之一,各菌株对花色苷的吸附率变化范围为1.60%~5.85%[32]。接种酵母RC212的葡萄酒中,陈酿的各个阶段Dp-3-O-Glu、Pt-3-O-Glu、Pn-3-O-Glu、Mv-3-O-Glu、Pn-3-acetylglc、Mv-3-acetylglc和Mv-3-p-coumglc trans的含量始终高于其他处理组,这表明酵母RC212相较于酵母XR和CECA有利于延缓葡萄酒大部分单体花色苷的降解速度。
2.5 酵母种类对葡萄酒单体酚的影响
酚类物质不仅影响葡萄酒的香气和口感,也影响葡萄酒的颜色[33],许多单体酚具有抗氧化性,它们能够清除体内的自由基,减少自由基对人体细胞的损伤。不同酵母种类对葡萄酒中单体酚含量的影响结果见图5。由图5可知,葡萄酒样品中共检测出8种单体酚,分别为没食子酸、表儿茶素、绿原酸、丁香酸、咖啡酸、香草酸、对香豆酸和阿魏酸,在发酵结束时,接种酵母XR的处理组香草酸和对香豆酸的含量显著低于其他处理组(P<0.05),接种酵母RC212的葡萄酒丁香酸和香草酸的含量显著低于其他处理组(P<0.05),接种酵母CECA的香草酸含量显著高于其他处理组(P<0.05);在陈酿六个月后,结果与发酵结束时相似;然而,经过12个月的陈酿后,酵母RC212处理组中的没食子酸、绿原酸和丁香酸的含量显著高于其他处理组,酵母XR处理组中咖啡酸含量高于其他处理组。由此可知,对于新红葡萄酒接种酵母CECA可以显著提高丁香酸和香草酸的含量;对于陈酿型葡萄酒RC212可以提高没食子酸、绿原酸和丁香酸的含量,而接种酵母XR可以显著提高咖啡酸和香草酸含量。

图5 酵母种类对葡萄酒单体酚含量的影响
Fig.5 Effect of yeast types on the mono-phenols contents of wines
2.6 酵母种类对葡萄酒生物胺的影响
生物胺是一类具有生物活性的含氮有机化合物,主要包括组胺、酪胺、尸胺、腐胺、苯乙胺等,它们的化学结构中含有氨基(-NH2)。生物胺在食品尤其是发酵食品中广泛存在,当人体摄入高浓度的生物胺时,可能会引发过敏反应、导致心血管问题、影响神经系统功能或造成胃肠道不适[34]。
酵母种类对强化甜红葡萄酒中的生物胺含量的影响见图6。
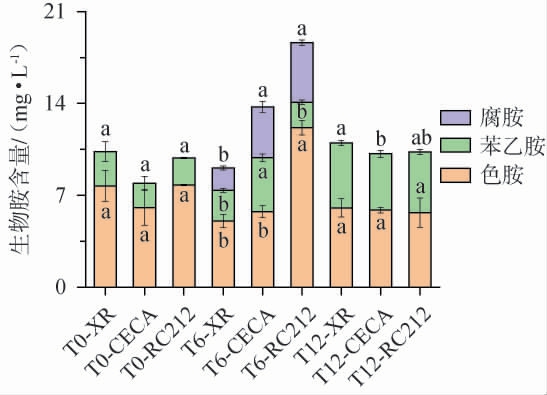
图6 酵母种类对葡萄酒生物胺含量的影响
Fig.6 Effect of yeast types on the bioamine contents of wines
由图6可知,在实验中检测到葡萄酒样本中存在腐胺、色胺和苯乙胺三种生物胺,且色胺占主要成分。在发酵结束时,酵母CECA的生物胺含量较少,约为7.91 mg/L。在陈酿6个月时,样品中增加了腐胺从而导致生物胺总含量的增高,且RC212处理的葡萄酒生物胺含量最多,约为10.30 mg/L。在陈酿12个月时,生物胺总量下降并且各酵母处理组之间无显著差异(P<0.05)。由此可知,对于短期陈酿的葡萄酒,选择酵母CECA发酵可以提高葡萄酒的健康质量。
2.7 酵母种类对葡萄酒挥发性化合物的影响
对三种酵母发酵的葡萄酒中的挥发性风味成分进行测定,并根据结果进行正交偏最小二乘-判别分析(OPLS-DA),并对结果经过200次的置换测试以验证OPLS-DA模型的稳定性和可靠性。通常将VIP值>1作为筛选差异挥发性风味化合物的依据。当某个变量的VIP值>1时,意味着该变量在区分不同样本组方面具有较高的影响力,极有可能是造成组间差异的关键因素[35-36]。三种酵母对加强型甜红葡萄酒中共有的挥发性风味物质34种,对挥发性化合物进行OPLS-DA,结果见图7。
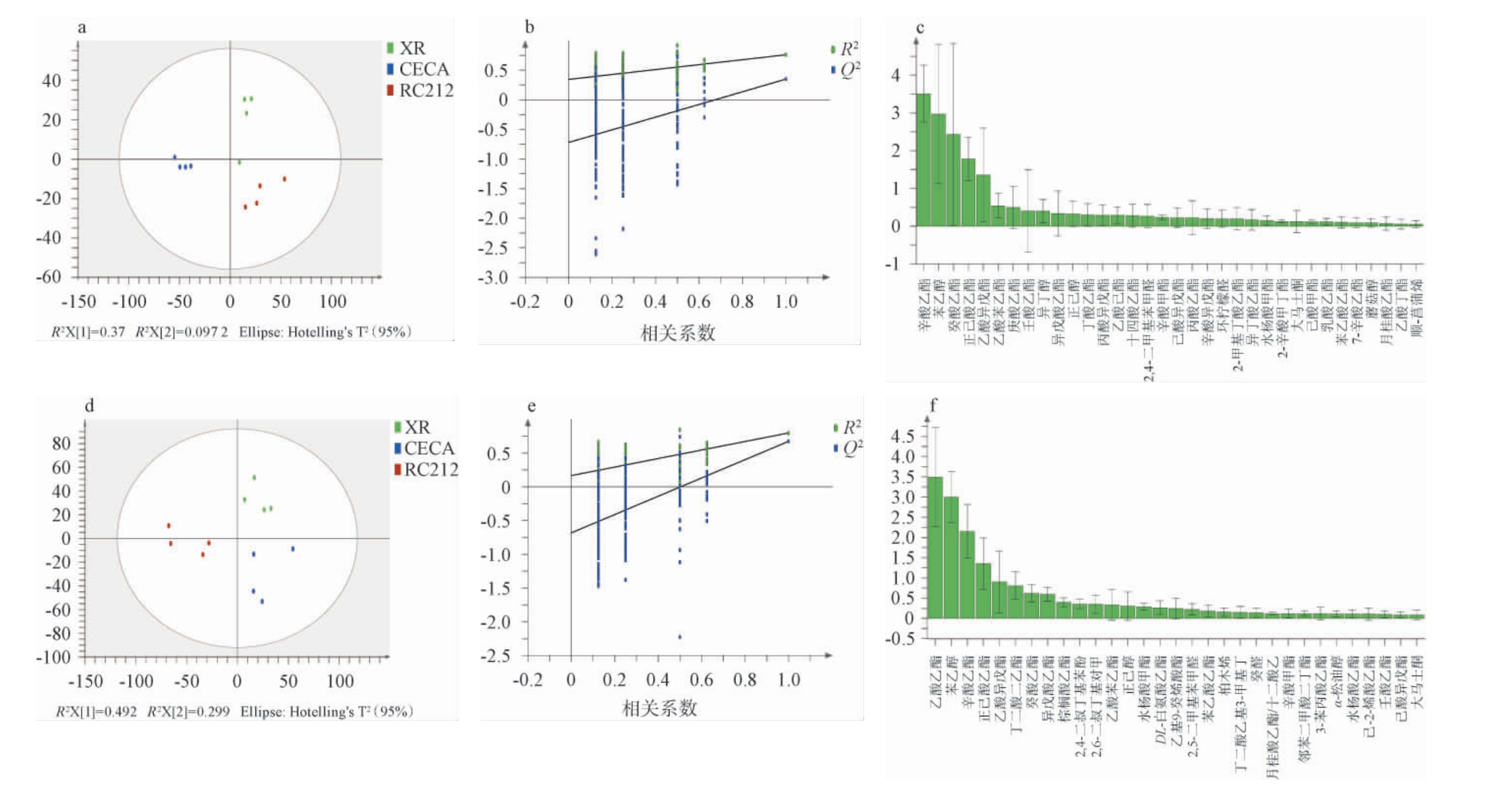
图7 不同酵母种类酿造葡萄酒的挥发性风味物质正交偏最小二乘-判别分析(a,d)、置换检验结果(b,e)及变量重要性投影值(c,f)
Fig.7 Orthogonal partial least squares discriminant analysis of volatile flavor compounds in wine brewed with different yeast types (a,d),permutation tests results (b,e) and variable importance in the projection value (c,f)
a,d:OPLS-DA得分图;b,e:OPLS-DA模型200次置换检验结果;c,f:VIP值;abc表示发酵结束;def表示陈酿12个月。
由图7a可知,发酵结束时,本次分析中的自变量拟合指数(R2X)为0.37,因变量拟合指数(R2Y)为0.0927,模型预测指数(Q2)为-0.723(图7a),R2和Q2超过0.5表示模型拟合结果可接受,且OPLS-DA能将三种酵母发酵的年轻葡萄酒进行区分。由图7b可知,经过200次置换检验,Q2回归线与纵轴的相交点<0,说明模型不存在过拟合,模型验证有效,认为该结果可用于葡萄酒香气的鉴别分析。三种酵母处理组中辛酸乙酯、苯乙醇、癸酸乙酯、正己酸乙酯和乙酸异戊酯的VIP值>1(图7c),表明这五种化合物对香气的影响最为显著。
由图7d可知,在陈酿12个月时,自变量拟合指数(R2X)为0.492,因变量拟合指数(R2Y)为0.299,模型预测指数(Q2)为-0.685,R2和Q2超过0.5表示模型拟合结果可接受,且OPLS-DA能将三种酵母发酵的陈酿葡萄酒进行区分。由图7e可知,经过200次置换检验,Q2回归线与纵轴的相交点<0,且处理组辛酸乙酯、苯乙醇、乙酸乙酯和正己酸乙酯的VIP值>1(图7f),表明这四种化合物对香气的影响最为显著。
为进一步探索不同酵母酿造葡萄酒的风味差异,根据34种挥发性风味物质含量绘制热图,直观展示各物质在不同葡萄酒中的分布规律,结果见图8。
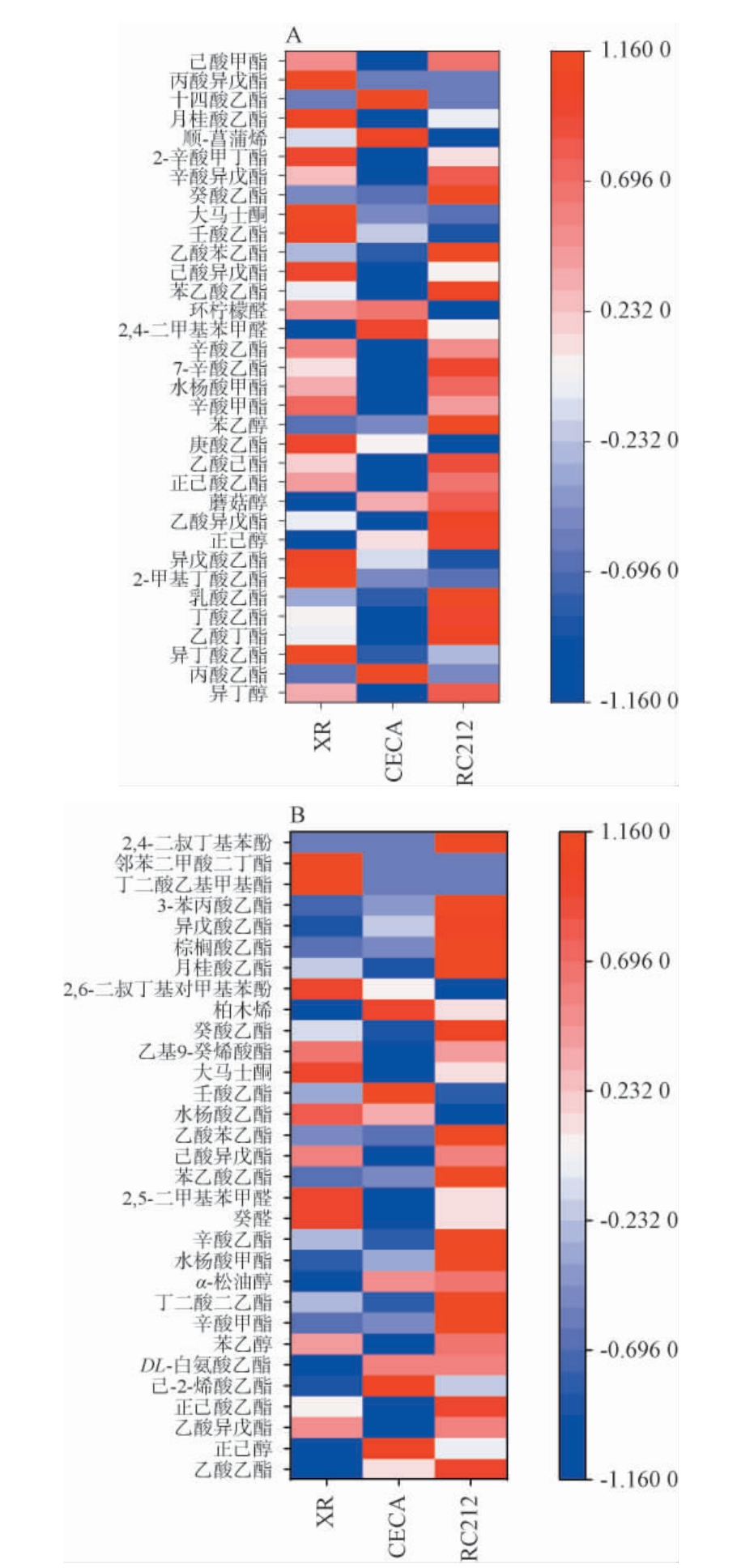
图8 年轻葡萄酒(A)和陈酿12个月的葡萄酒(B)的挥发性风味物质聚类分析热图
Fig.8 Heatmap of cluster analysis of volatile flavor components of young wine (A) and aged 12 month wine (B)
由图8A可知,不同酵母酿造的年轻葡萄酒之间分类效果较好,酵母CECA处理组含有较少的酯类化合物,明显区分于另外两种酒样,异戊酸乙酯、庚酸乙酯和乳酸乙酯等在三种葡萄酒中含量差异较大;由图8B可知,不同酵母酿造的陈酿葡萄酒之间分类效果较好,酵母RC212处理组中检测到更多的酯类,酵母XR和CECA处理组中酯类物质较少,乙酸乙酯、正己酸乙酯、辛酸甲酯、丁二酸二乙酯等在三种葡萄酒中含量差异较大;表明接种酵母RC212更有利于年轻及陈酿葡萄酒产生更多的酯类挥发性化合物。
2.8 酵母种类对葡萄酒感官品质的影响
为了更深入地了解葡萄酒的品质,对不同酵母发酵的葡萄酒进行了感官评价,结果见图9。

图9 酵母种类对加强型甜红葡萄酒感官品质的影响
Fig.9 Effect of yeast types on the sensory quality of wines
(a):发酵结束;(b):陈酿6个月;(c):陈酿12个月。
由图9可知,在发酵结束时,接种酵母RC212的葡萄酒展现出更高的色度、纯正度和澄清度,接种酵母XR的葡萄酒的浓郁度和苦味更高,而接种酵母CECA的葡萄酒收敛性更加明显。在陈酿6个月时,接种酵母XR的葡萄酒的澄清度、亮度、纯正度、浓郁度、优雅度和酒精感都更高,而接种酵母CECA的葡萄酒亮度和甜度更高。在陈酿12个月时,接种酵母XR的葡萄酒比其他酵母组在酒体澄清度、香气纯正度和香气浓郁度方面更加优秀。综合看来,对于年轻葡萄酒酵母RC212有利于提高葡萄酒外观的优良特性,对于陈酿葡萄酒,酵母XR有利于提高葡萄酒的香气。
3 结论
该实验主要研究了三种酵母CECA、XR和RC212对加强型甜红葡萄酒品质的影响。结果表明,在颜色方面,对于年轻葡萄酒而言,酵母CECA有利于提高葡萄酒的颜色质量,但对于陈酿型葡萄酒而言,接种酵母RC212可以更好地提高葡萄酒颜色的稳定性。在有机酸方面,酵母CECA可以有效降低年轻葡萄酒苹果酸含量并提高琥珀酸含量,酵母RC212有利于提高陈酿型葡萄酒酒石酸的含量并降低琥珀酸含量;在单体酚方面,酵母RC212有利于提高陈酿后期葡萄酒食子酸、绿原酸和丁香酸的含量,而接种酵母XR可以显著提高咖啡酸和香草酸含量;陈酿12个月时接种酵母RC212的葡萄酒产生更多的酯类挥发性化合物;在感官品质方面,接种酵母RC212有利于提高新红葡萄酒的色度、纯正度和澄清度,接种酵母XR有利于提高香气浓郁度而接种酵母CECA有利于增加葡萄酒的收敛性;酵母XR有利于提高陈酿葡萄酒的香气浓郁度。因此,在我国西北产区发展加强型甜红葡萄酒,针对年轻的新红加强型甜红葡萄酒优先考虑选择酵母CECA,而酵母RC212则可以使葡萄酒更好的发挥陈酿潜力。
[1]NISBET M A, MARTINSON T E, MANSFIELD A K.Accumulation and prediction of yeast assimilable nitrogen in New York winegrape cultivars[J].Am J Enol Viticult,2014,65(3):325-332.
[2]BERTHELS N J,CORDERO OTERO R R,BAUER F F,et al.Discrepancy in glucose and fructose utilization during fermentation by Saccharomyces cerevisiae wine yeast strains[J].FEMS Yeast Res,2004,4(7):683-689.
[3]INGLEDEW W M,MAGNUS C A,SOSULSKI F W.Influence of oxygen on proline utilization during the wine fermentation[J].Am J Enol Viticult,1987,38(3):246-248.
[4]MUNOZ E,INGLEDEW W M.Effect of yeast hulls on stuck and sluggish wine fermentations:Importance of the lipid component[J].Appl Environ Microbiol,1989,55(6):1560-1564.
[5]BAI Y Y,CHEN Q M,LIU X Y,et al.Effect of exogenous organic acids on chemical compositions and sensory attributes of fortified sweet wines from dehydrated grapes[J].Food Chem,2024,445:138745.
[6]BAI Y Y,ZHANG W,LI Y L,et al.Glass volume or shape influence the aroma attributes of Cabernet Sauvignon dry red wine[J].J Sensory Stud,2023,38(4):12828.
[7]ALEIXANDRE-TUDO J L,TOIT W D.A chemometric approach to the evaluation of the ageing ability of red wines[J].Chem Intell Lab Syst,2020,203:104067.
[8]CHIRA K,PACELLA N,JOURDES M,et al.Chemical and sensory evaluation of Bordeaux wines(Cabernet-Sauvignon and Merlot)and correlation with wine age[J].Food Chem,2011,126(4):1971-1977.
[9]JAFFRE J,VALENTIN D,DACREMONT C,et al.Burgundy red wines:Representation of potential for aging[J].Food Qual Preference,2009,20(7):505-513.
[10]JEANDET P,HEINZMANN S S,ROULLIER-GALL C,et al.Chemical messages in 170-year-old champagne bottles from the Baltic Sea:Revealing tastes from the past[J].P Natl Acad Sci,2015,112(19):5893-5898.
[11]LANGLOIS J,BALLESTER J.,CAMPO E,et al.Combining olfactory and gustatory clues in the judgment of aging potential of red wine by wine professionals[J].Am J Enol Viticult,2010,61(1):15-22.
[12]PICARIELLO L,RINALDI A,MARTINO F,et al.Modification of the organic acid profile of grapes due to climate changes alters the stability of red wine phenolics during controlled oxidation[J].J Grapevine Res,2019,58(5):127-133.
[13]PRATA-SENA M,CASTRO-CARVALHO B M,NUNES S, et al.The terroir of Port wine:Two hundred and sixty years of history[J].Food Chem,2018,257:388-398.
[14]胡江南,高熳熳,马立娟,等.葡萄酒发酵优良酵母的筛选、鉴定及应用[J].中国酿造,2023,42(7):43-50.
[15]周桂珍,杨伟明,杨建兴,等.宁夏贺兰山东麓葡萄酒酵母菌的筛选及应用[J].微生物学通报,2023,50(2):553-572.
[16]ZHANG J,WANG X,ZHANG F.Influence of an indigenous yeast,CECA, from the Ningxia wine region of China, on the yeast community dynamics and aroma of Cabernet Sauvignon wines[J].LWT-Food Sci Technol,2023,189:115506.
[17]李丽梅,冯云霄,何近刚,等.不同酵母菌株对发酵雪花梨酒酚类物质和抗氧化能力的影响[J].食品科技,2019,44(4):7-11.
[18]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[19]李运奎,韩富亮,张予林,等.基于CIELAB色空间的红葡萄酒颜色直观表征[J].农业机械学报,2017,48(6):296-301.
[20]成冰,张京芳,徐洪宇,等.不同品种酿酒葡萄有机酸含量分析[J].食品科学,2013,34(12):223-228.
[21]YANG P, YUAN C L, WANG H, et al.Stability of anthocyanins and their degradation products from cabernet sauvignon red wine under gastrointestinal pH and temperature conditions[J].Molecules,2018,23:354.
[22]LIU L,LOIRA I,MORATA A,et al.Shortening the ageing on lees process in wines by using ultrasound and microwave treatments both combined with stirring and abrasion techniques[J].Eur Food Res Technol,2015,242:559-569.
[23]ZIÓŁKOWSKA E,W SOWICZ H H,JELEN′.Differentiation of wines according to grape variety and geographical origin based on volatiles profiling using SPME-MS and SPME-GC/MS methods[J].Food Chem,2016,213:714-720.
SOWICZ H H,JELEN′.Differentiation of wines according to grape variety and geographical origin based on volatiles profiling using SPME-MS and SPME-GC/MS methods[J].Food Chem,2016,213:714-720.
[24]李华.葡萄酒品尝学[M].北京:科学出版社,2006.
[25] 戚一曼,樊明涛,程拯艮,等.猕猴桃酒主发酵过程中多酚及抗氧化性的研究[J].食品研究与开发,2016,37(24):6-12.
[26]VILGAKAINEN S K,LAAKSO S V.The use of malolactic Oenococcus oeni(ATCC 39401)for deacidification of media containing glucose,malic acid and citric acid[J].Eur Food Res Technol,2000,211(6):438-442.
[27]MENDES-FERREIRA A,MENSES-FAIA A.The role of yeasts and lactic acid bacteria on the metabolism of organic acids during winemaking[J].Foods,2020,9(9):1-9.
[28]WHITING G C.Organic acid metabolism of yeasts during fermentation of alcoholic beverages:A review[J].J I Brewing,1976,82(2):84-92.
[29]王琳,赵裴,刘洋,等.干化处理对霞多丽葡萄酒质量的影响[J].食品与发酵工业,2020,46(7):83-88.
[30]MORATA A, ESCITT C, LOIRA I, et al.Influence of Saccharomyces and non-Saccharomyces yeasts in the formation of pyranoanthocyanins and polymeric pigments during red wine making[J].Molecules, 2019,24(24):4490.
[31]刘丽媛,苑伟,刘延琳.红葡萄酒中花色苷辅助呈色作用的研究进展[J].中国农业科学,2010,43(12):2518-2526.
[32]MORATA A,GOMEZ-CORDOVES M C,COLOMO B,et al.Cell wall anthocyanin adsorption by different Saccharomyces strains during the fermentation of Vitis vinifera L.cv Graciano grapes[J].Eur Food Res Technol,2004,220(3-4):341-346.
[33]张国栋,胡博然.不同发酵工艺对红葡萄酒酚类物质和抗氧化性的影响[J].食品科技,2015,40(2):56-60.
[34]SCHWARZ M,RODRIGUEZ M C,GUILLEN D A,et al.Evolution of the colour,antioxidant activity and polyphenols in unusually aged Sherry wines[J].Food Chem,2012,133(2):271-276.
[35]ZHANG Z L,XIONG F,WANG Y,et al.Fermentation of Saccharomyces cerevisiae in a one liter flask coupled with an external circulation ultrasonic irradiation slot:Influence of ultrasonic mode and frequency on the bacterial growth and metabolism yield[J].Ultrason Sonochem,2019,54:39-47.
[36]LIU H,YU Y,ZOU B,et al.Evaluation of dynamic changes and regularity of volatile flavor compounds for different green plum varieties during the ripening process by HS-GC-IMS with PLS-DA[J].Foods,2023,12(3):551.