灰葡萄孢菌(Botrytis cinerea)为一种植物病原真菌,其对作物的危害极为严重且分布广泛,被评为世界第二大植物病原真菌[1-2],隶属于真菌界子囊菌门核盘菌科葡萄孢属,能够侵染草莓、葡萄、番茄等多种重要经济作物,其强大的适应性和遗传变异性使其成为农业生产中的重要威胁,尤其在植物衰老或成熟阶段,其破坏力极强[3-4]。灰葡萄孢菌不仅可以侵染生长期的果蔬,还可入侵采后果蔬的表皮或伤口,孢子在低温环境下萌发生长,导致果蔬腐烂变质,进而缩短贮藏期[5],严重影响果蔬的鲜食及加工品质,因此寻求有效的防治措施尤为关键。
防治灰葡萄孢菌侵染果蔬的方法,目前主要以化学防治手段为主,然而化学药剂的过度滥用会使病原菌具有耐药性,降低防治效果,还会造成环境污染,农药残留对果蔬的食用安全性也存在潜在威胁[6-7]。与化学防治相比,生物防治不仅能够有效控制病害,还具有保护生态环境,提高农产品安全性和经济效益的优点[8]。随着人们对食品安全和健康关注度的不断提升,微生物防治作为一种绿色、高效、可持续的防治技术[9],在实现绿色食品生产中发挥着越来越重要的作用。解淀粉芽孢杆菌(Bacillus amyloliquefaciens)为革兰氏阳性细菌,广泛分布于土壤及水体环境中,具有形成内生孢子的能力,产生的抑菌物质能够抑制或杀死多种植物病原菌,因其抗逆性强、防治效果好,成为生防菌剂的优势资源[10]。解淀粉芽孢杆菌不仅能够有效防治植物病害,还具有改善土壤结构,促进植物生长,增强作物抗逆性,延长果蔬保鲜期等作用[11-12],在农业、食品和环保等领域有良好的应用前景。
解淀粉芽孢杆菌通过多种机制发挥其抑菌作用,如分泌抑菌物质、破坏病原菌细胞结构、诱导植物系统性抗性等。杨蕊等[13]研究发现,解淀粉芽孢杆菌PB-1对新月弯孢霉(Curvularia lunata)、灰葡萄孢菌、大斑凸脐蠕孢(Exserohilum turcicum)、胶孢炭疽菌(Colletotrichum gloeosporioides)菌丝生长均有抑制作用,抑制率分别为70.7%、63.5%、63.4%、34.5%。朱晓琴等[14]以解淀粉芽孢杆菌SQ-6 菌株50%无细胞滤液处理胶孢炭疽菌(Colletorichum gloeosporioides)后,菌丝体扭曲变形,呈现断裂、皱缩及畸形状。刘超等[15]研究发现,解淀粉芽孢杆菌BA-26菌株的代谢产物A6-15,对灰葡萄孢菌的孢子有抑制萌发的作用。张淑静等[16]从山东省内14处湿地累计分离到具拮抗作用的生防菌143株,其中拮抗作用较强的包括5株解淀粉芽孢杆菌、4株枯草芽孢杆菌(Bacillus subtilis)以及较为少见的沙福芽孢杆菌(Bacillus safensis)、南海芽孢杆菌(Bacillus nanhaiensis)各1株。选择对灰霉菌菌丝生长抑制力最强的解淀粉芽孢杆菌JQ-3,初步调查其防病促生作用,发现该菌能较好地预防葡萄果实感染灰霉病,在花生幼苗盆栽试验中表现出对白绢病的预防作用,并能促进幼苗根系生长。赵新贝等[17]通过解淀粉芽孢杆菌TD-7菌株发酵滤液对番茄灰霉病进行防效评价,结果表明温室盆栽防效为80.61%,田间大棚防效为87.70%,均有明显的防治效果。解淀粉芽孢杆菌抑菌谱广,作为生物防治的优质微生物资源具有广阔的开发应用潜力。
本实验以解淀粉芽孢杆菌(Bacillus amyloliquefaciens)HRH317为研究对象,通过采用牛津杯抑菌法初步评估菌株HRH317对灰葡萄孢菌(Botrytis cinerea)的抑菌效果,在此基础上以扫描电子显微镜(scanning electron microscope,SEM)、透射电子显微镜(transmission electron microscope,TEM)及激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM)为技术手段,进一步探究菌株HRH317发酵上清液对灰葡萄孢菌菌体形态超微结构的影响,并通过离体防效试验评价菌株HRH317发酵上清液对采后草莓灰霉病的防治效果。旨在从细胞、亚细胞水平层面探究菌株HRH317对灰葡萄孢菌的抑菌机制,并探究其对采后草莓灰葡萄病的防治效果,以期为进一步挖掘生防菌剂资源及保障食品安全奠定理论基础和提供技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和材料
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)HRH317:本课题组自山西农业大学玉米田中分离筛选获得,前期毒理学证实该菌株安全无毒,保藏于中国微生物菌种保藏管理委员会普通微生物中心(China General Microbiological Culture Collection Center,CGMCC)(编号CGMCC No.7314);灰葡萄孢菌(Botrytis cinerea):广东省微生物菌种保藏中心(Guangdong Microbial Culture Collection Center,GDMCC)(编号GDMCC3.47)。草莓:购于当地市场;铜网:中镜科仪集团公司。
1.1.2 化学试剂
碘化丙锭(propidiumiodide,PI)溶液(1 mg/mL)C0080:北京索莱宝科技有限公司;磷酸盐缓冲液(phosphate buffer solution,PBS):赛百慷(上海)生物技术股份有限公司;电镜固定液:北京索莱宝科技有限公司;SPI-Pon812环氧树脂包埋试剂盒:海德创业(北京)生物科技有限公司;锇酸:美国Ted Pella公司;醋酸双氧铀:上海吉至生化科技有限公司;柠檬酸铅:上海麦克林生化科技股份有限公司;其余试剂均为国产分析纯。
1.1.3 培养基
营养琼脂(nutrient agar,NA)培养基:牛肉膏5.0 g/L、蛋白胨10.0 g/L、氯化钠5.0 g/L、琼脂15.0 g/L、蒸馏水1 000 mL,pH 7.2。0.1 MPa灭菌20 min。
种子培养基:牛肉膏5.0 g/L、蛋白胨10.0 g/L、氯化钠5.0 g/L、蒸馏水1 000 mL,pH 7.2。0.1 MPa灭菌20 min。
发酵培养基:牛肉膏5.0 g/L、蛋白胨10.0 g/L、葡萄糖10.0 g/L、氯化钠5.0 g/L、蒸馏水1 000 mL,pH 7.0。0.1 MPa灭菌20 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯浸粉5.0 g/L、葡萄糖20.0 g/L、氯霉素0.1 g/L、琼脂20.0 g/L、蒸馏水1 000 mL,pH 7.2。0.1 MPa灭菌20 min。
1.2 仪器与设备
UltimMax 40探测器:牛津仪器集团公司;300型扫描电子显微镜:卡尔·蔡司股份公司;Leica UC7型超薄切片机:德国徕卡显微系统公司;Diatome Ultra 45°型钻石切片刀:瑞士Diatome公司;7800型生物透射电子显微镜:日本日立公司;FV1200型激光共聚焦显微镜:日本奥林巴斯有限公司;SPARK10M型多功能酶标仪:瑞士TECAN公司;UV-1601型紫外分光光度计:北京北分瑞利分析仪器(集团)有限责任公司;BKQ-B50II型高压蒸汽灭菌锅:山东博科消毒设备有限公司;BBS-DDC型超净工作台:济南鑫贝西生物技术有限公司;TGL-16WS型高速离心机:湖南湘仪实验室仪器开发有限公司;YJY-200B摇床:上海跃进医疗器械有限公司;SPX-450B生化培养箱:杭州绿博仪器有限公司;RE-3000旋转蒸发仪:上海亚荣生化仪器厂;牛津杯[外径(7.8±0.1)mm,内径(6.0±0.1)mm,高(10.0±0.1)mm]:上海精密仪器仪表有限公司。
1.3 方法
1.3.1 解淀粉芽孢杆菌HRH317菌株种子液、发酵液及发酵上清液的制备
种子液的制备:挑取斜面保存的菌株HRH317在NA平板培养基上划线2~3次,37 ℃静置培养24 h,从平板上挑取单菌落,接种于装液量为50 mL/250 mL的种子培养基中,37 ℃、150 r/min,摇床振荡培养24 h,4 000 r/min条件下离心20 min后弃去无菌上清液,并收集菌体,用无菌生理盐水配制菌悬液,浓度调至1.0×106 CFU/mL,将菌悬液接种于装液量为50mL/250mL的种子培养基中,接种量4%(V/V),37 ℃、150 r/min,摇床振荡培养24 h,即得种子液。
发酵液的制备:将种子液接种至装液量为50mL/250 mL的发酵培养基中,接种量2%(V/V),37 ℃、150 r/min 摇床振荡培养24 h,即得发酵液。
发酵上清液的制备:发酵液在4 ℃、10 000 r/min条件下,离心20 min,弃掉菌体的发酵液经0.22 μm微孔滤膜过滤,即得发酵上清液,4 ℃保存备用。
1.3.2 灰葡萄孢菌孢子悬液的制备
挑取斜面保存的灰葡萄孢菌菌株于PDA斜面培养基活化,28 ℃静置培养5 d,吸取5 mL无菌生理盐水加入活化后的斜面,轻轻刮取斜面孢子,将孢子悬液置于已灭菌的50 mL锥形瓶中,无菌脱脂棉过滤,以无菌生理盐水冲洗滤渣2~3次,收集滤液,将孢子悬液用无菌生理盐水调至浓度为1.0×106个/mL,4 ℃保存备用。
1.3.3 解淀粉芽孢杆菌HRH317对灰葡萄孢菌抑菌活性的测定
吸取0.2 mL灰葡萄孢菌孢子悬液于PDA平板中,无菌涂布器均匀涂布,无菌镊子夹取牛津杯置于平板中心位置,取0.2 mL 菌株HRH317发酵上清液加入牛津杯中,以无菌水为对照,将培养皿平稳放至于4 ℃静置24 h后,转置于28 ℃静置培养5 d,取出培养皿,测量抑菌圈直径(mm),每组试验重复3次取平均值,以抑菌圈直径为评价指标表征抑菌活性的大小[18]。
1.3.4 扫描电镜观察解淀粉芽孢杆菌HRH317对灰葡萄孢菌菌丝形态的影响
吸取灰葡萄孢菌孢子悬液5 mL接种于装液量为50 mL/250 mL的PDA液体培养基中,28 ℃、140 r/min条件下振荡培养48 h,得到孢子悬液。吸取10 mL孢子悬液于无菌试管中,将调至pH 7.0、浓缩5倍的菌株HRH317发酵上清液以10%(V/V)接种量加入试管中为处理组,对照组为发酵培养基,在28 ℃、140 r/min条件下分别振荡培养12 h、24 h、36 h,离心收集处理组和对照组的菌丝体。
使用2.5%戊二醛溶液在4 ℃条件下固定菌丝体样品12 h,然后用PBS漂洗3次;用1%锇酸溶液固定样品1 h,然后再次用PBS冲洗3次;采用梯度体积分数(30%、50%、70%、80%、90%、95%)乙醇各脱水15 min,再用无水乙醇脱水两次,每次10 min;脱水后,样品经过临界点干燥和喷金处理,扫描电子显微镜观察进行图像收集和分析。
1.3.5 透射电镜观察解淀粉芽孢杆菌HRH317对灰葡萄孢菌细胞形态和超微结构的影响
吸取灰葡萄孢菌孢子悬液5 mL接种于装液量为50 mL/250 mLPDA液体培养基中,28 ℃、140 r/min条件下振荡培养48 h,吸取10 mL孢子悬液于无菌试管中,将调至pH7.0、浓缩5倍的HRH317菌株发酵上清液以10%(V/V)接种量加入试管中为处理组,对照组为发酵培养基,在28 ℃、140 r/min条件下分别振荡培养48 h、72 h,收集处理组和对照组的菌丝体进行如下处理:
固定:处理组和对照组菌丝体装至2.5%戊二醛1.5 mL离心管中,放入冰箱4 ℃固定24 h。
脱水、包埋及聚合:菌丝体用1%的锇酸溶液继续固定2h,小心取出锇酸废液,0.1 mol/L磷酸盐缓冲液(PBS)(pH7.4)漂洗3次,每次15 min。
梯度脱水:固定后的菌丝体依次用体积分数30%、50%、70%、80%、95%的丙酮溶液进行脱水,每次10 min,最后用100%丙酮脱水2次,每次20 min,备用。
渗透包埋:脱水后的菌丝体按顺序先后以不同体积比的包埋剂渗透处理:①丙酮与包埋剂体积比3∶1,37 ℃渗透包埋1 h;②丙酮与包埋剂体积比1∶1,37 ℃渗透包埋3 h;③纯包埋剂37 ℃渗透包埋过夜。
聚合:将渗透包埋后的菌丝体倒入包埋板,于60 ℃烤箱聚合48 h。
切片:取出树脂块,用超薄切片机把树脂块切成70~90 nm 超薄切片,然后用铜网捞片。
染色:醋酸双氧铀染色15 min,柠檬酸铅染色10 min,干燥后透射电镜观察。
1.3.6 激光共聚焦显微镜观察解淀粉芽孢杆菌HRH317对灰葡萄孢菌细胞膜的影响
吸取灰葡萄孢菌孢子悬液5 mL接种于装液量为50 mL/250 mLPDA液体培养基中,28 ℃、140 r/min条件下振荡培养48 h,吸取10 mL孢子悬液于无菌试管中,将pH值调至7.0、浓缩5倍的菌株HRH317发酵上清液以10%(V/V)接种量加入试管中为处理组,对照组为发酵培养基,在28℃、140 r/min条件下分别振荡培养12 h、24 h、36 h,离心收集处理组和对照组的菌丝体。
配制质量浓度为2 μg/mL的PI染色工作液,取200 μL染色工作液滴加于样品表面染色,37 ℃避光孵育15 min。染色完成后,用PBS冲洗2次,洗去染色液。将样品放于盖玻片上,放于激光共聚焦显微镜上观察。
1.3.7 解淀粉芽孢杆菌HRH317对草莓灰霉病的离体防效测试
选取新鲜无腐烂、大小一致的草莓果实,次氯酸钠表面消毒,无菌水反复冲洗数次,晾干,采用伤口法测试防治效果[19]。设置4组不同处理方式的试验:①草莓果实浸泡于无菌水30 min,用无菌手术刀片在果实中心处划十字伤口,取20 μL无菌水加至伤口处;②草莓果实浸泡于菌株HRH317发酵上清液30 min,用无菌手术刀片在果实中心处划十字伤口,取20 μL菌株HRH317发酵上清液加至伤口处;③草莓果实浸泡于无菌水30 min,用无菌手术刀片在果实中心处划十字伤口,取20 μL灰葡萄孢菌孢子悬液接种至伤口处(对照病情组);④草莓果实浸泡于菌株HRH317发酵上清液30 min,用无菌手术刀片在果实中心处划十字伤口,取20 μL灰葡萄孢菌孢子悬液接种至伤口处(处理病情组)。将处理后的草莓果实放入无菌培养皿,皿内铺有无菌水浸润的滤纸,25 ℃恒温培养箱中暗培养6 d观察草莓果实发病情况,每组处理15个草莓,重复3次。
草莓灰霉病病害分级标准[20]见表1。病情指数=100×∑(各级病果数×对应各级数值)/(调查总果数×最高级数值),相对防效=[(对照病情指数-处理病情指数)/对照病情指数]×100%
表1 草莓灰霉病病害分级标准
Table 1 Grading standards for strawberry gray mold

病害级数 病斑面积占比/% 病害症状0 1 2 3 4 0 0~25 25~50 50~75 75~100无症状轻微腐烂或发病腐烂发病,有明显病斑腐烂发病较重全部腐烂
2 结果与分析
2.1 解淀粉芽孢杆菌HRH317对灰葡萄孢菌的抑菌活性
以无菌水为空白对照,菌株HRH317发酵上清液为处理组,灰葡萄孢菌在PDA平板培养5 d,空白对照和处理组灰葡萄孢菌菌落形态见图1。由图1A可知,牛津杯周围长满白色绒毛状菌丝,菌丝在培养基表面形成密集的网状结构,无抑菌圈。由图1B可知,加入菌株HRH317发酵上清液的牛津杯,其周围出现明显的抑菌圈,平均直径为(34.67±0.12)mm,表明解淀粉芽孢杆菌HRH317对灰葡萄孢菌有显著抑菌活性。
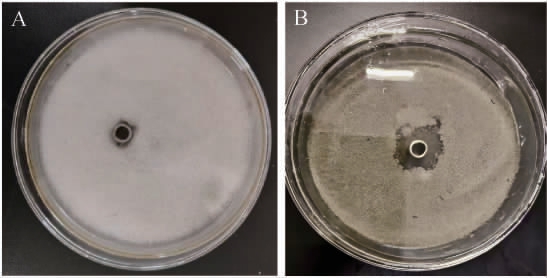
图1 解淀粉芽孢杆菌HRH317对灰葡萄孢菌的抑菌活性
Fig.1 Inhibitory activity of Bacillus amyloliquefaciens HRH317 against Botrytis cinerea
A:空白对照组;B:HRH317菌株发酵上清液处理组。
2.2 扫描电镜观察解淀粉芽孢杆菌HRH317对灰葡萄孢菌菌丝形态的影响
分别以3 000倍数(3 μm)和2 00倍数(50 μm)扫描电镜观察HRH317对灰葡萄孢菌菌丝形态的影响,结果见图2。

图2 解淀粉芽孢杆菌HRH317对灰葡萄孢菌菌丝形态的影响
Fig.2 Effects of Bacillus amyloliquefaciens HRH317 on mycelial morphology of Botrytis cinerea
由图2可知,对照组在不同处理时间下,灰葡萄孢菌菌丝表面光滑,菌体形态完整,呈现较笔直的管状结构;菌株HRH317发酵上清液处理的实验组,处理12 h的灰葡萄孢菌菌丝表面开始呈现轻微粗糙状,随着处理时间延长,菌丝表面粗糙程度加剧,处理36 h时,放大200倍观察显示菌丝体出现不规则的扭曲,菌体干瘪严重变形。朱娜等[21]以解淀粉芽孢杆菌TS-1203发酵液处理苹果炭疽叶枯病菌(Colletotrichum),扫描电镜观察发现,病原菌菌丝出现畸形、膨大、缢缩、断裂等现象,研究结果与本实验结果相似,表明菌株HRH317对灰葡萄孢菌具有明显抑制作用。相关研究表明,解淀粉芽孢杆菌可通过菌体代谢产物破坏真菌结构,从而抑制真菌生长[22],如DUAN Y N等[23]研究发现,解淀粉芽孢杆菌OSB-6产生的含苯环有机酸酯类化合物1,2-苯二甲酸、苯乙酸和3-羟基甲酯对层出镰刀菌(Fusarium proliferatum)菌丝生长有较强的抑制作用,造成菌丝肿胀、萎缩、破裂;HU J L等[24]研究发现,解淀粉芽孢杆菌LYZ69生成的环脂肽化合物(cyclic lipopeptides,CPs)能显著影响炭疽病菌菌丝形态,诱导其菌丝内部活性氧的积累,进而造成细胞凋亡。本实验前期研究表明,以菌株HRH317发酵上清液制备的抗菌蛋白粗提液可有效抑制禾谷镰孢菌菌丝体生长,使菌体扭曲变形[25],但解淀粉芽孢杆菌产生的蛋白类抗菌物质种类较多[17]。因此,还需进一步研究解淀粉芽孢杆菌HRH317抑制灰葡萄孢菌产生的抑菌物质种类。
2.3 透射电镜观察解淀粉芽孢杆菌HRH317对灰葡萄孢菌细胞形态和超微结构的影响
利用透射电镜观察菌株HRH317发酵上清液对灰葡萄孢菌细胞形态和超微结构的影响,结果见图3。由图3可知,发酵培养48 h,对照组细胞完整,细胞壁光滑,线条流畅,厚度均一,细胞膜结构完好,无质壁分离现象,细胞质均匀,细胞器结构清晰;菌株HRH317发酵上清液处理的菌体细胞壁粗糙,部分边界模糊不光滑,内部出现空腔,胞外出现颜色较深的渗透物。发酵培养72 h,对照组灰葡萄孢菌仍保持较完整的细胞结构,细胞壁线条清晰,细胞膜、细胞器完好;灰葡萄孢菌经菌株HRH317发酵上清液处理后,其菌体形态扭曲变形严重,出现质壁分离现象,细胞器受损与细胞质混合,导致空腔面积增大,胞外有渗透物出现。张宝龙等[26]以解淀粉芽孢杆菌YN-J3菌株代谢产物处理禾生炭疽菌(Colletotrichum cereal),透射电镜观察发现其不正常附着胞出现细胞壁疏松、质膜崩溃、细胞器解体等现象。付瑞敏等[27]研究发现,利用解淀粉芽孢杆菌BA-16-8发酵液分离纯化的脂肽物质芬枯草菌素,处理扩展青霉(Penicillium expansum),其细胞器发生明显变化,细胞核、线粒体等部分或完全受损。与本研究菌株HRH317发酵上清液的抑菌效果较一致。结果表明,菌株HRH317发酵上清液中某些代谢物可抑制灰葡萄孢菌的生长。
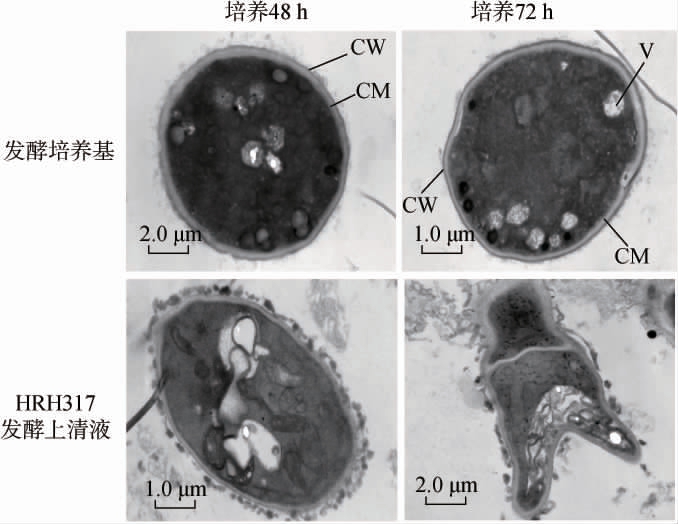
图3 解淀粉芽孢杆菌HRH317对灰葡萄孢菌细胞形态和超微结构的影响
Fig.3 Effects of Bacillus amyloliquefaciens HRH317 on cell morphology and ultrastructure of Botrytis cinerea
CW:细胞壁:CM:细胞膜;V:液泡。
2.4 激光共聚焦显微镜观察解淀粉芽孢杆菌HRH317对灰葡萄孢菌细胞膜的影响
碘化丙啶(PI)能够穿透受损的菌丝体细胞膜进入细胞内与脱氧核糖核酸(deoxyribonucleic acid,DNA)结合,发出红色荧光。利用激光共聚焦显微镜观察解淀粉芽孢杆菌HRH317对灰葡萄孢菌细胞膜的影响结果见图4。由图4可知,处理12 h时,发酵培养基对照组红色荧光极少,灰葡萄孢菌细胞膜完整性保持较好,几乎未受到破坏,而菌株HRH317发酵上清液处理组,部分菌体细胞膜开始出现轻微破坏,PI少量穿透细胞膜进入细胞内部,呈现微弱的红色荧光,说明细胞膜已受到一定程度的破坏;处理24 h时,对照组略有极微弱红色荧光出现,细胞膜仍保持较完整状态,菌株HRH317发酵上清液处理组,灰葡萄孢菌细胞膜受损程度呈加剧趋势,红色荧光面积明显增加;处理36 h时,对照组极少量菌体自身衰亡,细胞膜受损出现微弱的红色荧光,菌株HRH317发酵上清液处理组,菌体细胞膜遭到严重破坏,导致PI染料大量进入细胞内,红色荧光面积扩增,菌丝顶端不断膨大,形成泡状结构且有空腔,表明解淀粉芽孢杆菌HRH317发酵上清液能使灰葡萄孢菌细胞膜受损,且随处理时间延长,破坏程度增强。宛甜甜[28]研究发现,经解淀粉芽孢杆菌SN16-1无菌上清液处理的稻瘟病菌(Magnaportheoryzae)GUY11菌丝体呈现红色荧光,细胞膜遭到破坏,通透性增强。解淀粉芽孢杆菌CP2014-CFE无菌培养滤液处理的桃吉尔霉(Gilbertella persicaria)MT108,随着作用时间延长,MT108被染料PI 染成红色的菌丝越多,处理24 h菌丝彻底破坏[29],与本研究结果均较一致。LV J等[30]研究发现,解淀粉芽孢杆菌C-1产生的表面活性素Surfactin、伊枯草菌素Iturin、芬枯草菌素Fengycins能够破坏艰难梭菌(Clostridium difficile)的细胞膜完整性,PI染液大量进入细胞内,与DNA结合产生红色荧光。ZHANG B等[31]研究发现,解淀粉芽孢杆菌产生的芽孢杆菌素(bacillomycin)L,可诱导真菌细胞膜通透性增强,其抗真菌活性还与真菌细胞内靶点的相互作用有关。对比以上研究结果,解淀粉芽孢杆菌分泌的抑菌物质存在一定的差异,表现出抑菌的灵活性,能够针对不同病原菌发挥其抑菌功能,相关研究表明产生抑菌物质差异的原因可能与菌株基因组中不同功能基因的调节有关[9]。
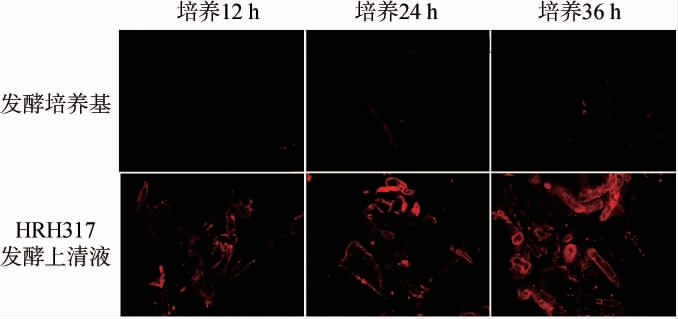
图4 解淀粉芽孢杆菌HRH317对灰葡萄孢菌细胞膜的影响
Fig.4 Effects of Bacillus amyloliquefaciens HRH317 on cell membrane of Botrytis cinerea
2.5 解淀粉芽孢杆菌HRH317对草莓灰霉病的离体防效评价
室内条件下,通过伤口法测试菌株HRH317发酵上清液对灰葡萄孢菌引发的草莓灰霉病离体防治效果,结果见图5。由图5可知,接种灰葡萄孢菌HRH317的草莓果实,伤口处明显长出灰白色霉层病斑,说明灰葡萄孢菌可引起草莓灰霉病的产生。由图5A和图5B可知,培养6 d后结果表明,浸泡于无菌水后在伤口处接种无菌水处理组,和浸泡于菌株HRH317发酵上清液伤口处接种菌株HRH317发酵上清液处理组草莓果实较饱满,大小、色泽均无明显变化,伤口处无病斑出现,果实未有腐烂现象,证明菌株HRH317发酵上清液对草莓果实未产生侵害。由图5C可知,浸泡于无菌水在伤口处接种灰葡萄孢菌悬液处理组的草莓果实,伤口处明显出现灰色霉层,周围有大面积灰白色病斑,且草莓果实呈干瘪皱缩、趋于腐烂状。由图5D可知,浸泡于菌株HRH317发酵上清液伤口处接种灰葡萄孢菌悬液处理组的草莓果实形态较正常,伤口处有较少灰色霉层出现,果实表现轻微病症,病斑面积较小,表明解淀粉芽孢杆菌HRH317能够有效降低灰葡萄孢菌的侵染,对草莓灰霉病有较好的生防效果,可起到一定的防腐保鲜作用。

图5 解淀粉芽孢杆菌HRH317对草莓灰霉病的防治效果
Fig.5 Control effect of Bacillus amyloliquefaciens HRH317 on strawberry gray mold
A:无菌水处理组;B:HRH317菌株发酵上清液处理组;C:无菌水+接种灰葡萄孢菌处理组;D:HRH317菌株发酵上清液+接种灰葡萄孢菌处理组。
不同处理方式对草莓灰霉病的防治效果见表2。由表2可知,无菌水浸泡后接种灰葡萄孢菌的病情指数为70.56,对比发现,菌株HRH317发酵上清液浸泡后接种灰葡萄孢菌的病情指数显著降低,为23.89(P<0.05),相对防效为66.18%,表明解淀粉芽孢杆菌HRH317对草莓灰霉病具有一定的防治效果。采后草莓在储藏期间极易感染灰葡萄孢菌进而引发灰霉病[32],而目前针对解淀粉芽孢杆菌防治草莓灰霉病多为盆栽或田间试验,草莓灰霉病离体防效研究较少。严浩等[33]研究发现,解淀粉芽孢杆菌ZXY-1发酵液可延缓草莓灰霉病发病时间,具有明显保鲜作用,与本研究结果相似。通过草莓离体防效实验,菌株HRH317发酵上清液处理的草莓灰霉病病果,可减缓草莓腐烂程度,采后6 d相对防效达66.18%,因此解淀粉芽孢杆菌HRH317对离体草莓灰霉病具有良好的生防效果。
表2 不同处理方式对草莓灰霉病的防治效果
Table 2 Control effect of different treatments on strawberry gray mold

注:同列不同小写字母表示经Duncan氏新复极差法检验差异显著(P<0.05)。
处理 病情指数 相对防效/%无菌水HRH317菌株发酵上清液HRH317菌株发酵上清液+接种灰葡萄孢菌无菌水+接种灰葡萄孢菌----23.89±2.55b 70.56±2.55a 66.18±2.72-
3 结论
本研究利用前期分离筛选的解淀粉芽孢杆菌HRH317为生防菌,菌株HRH317发酵上清液对灰葡萄孢菌有明显的抑菌活性,抑菌圈直径为34.67 mm。菌株HRH317发酵上清液处理后的灰葡萄孢菌,菌体表面呈现粗糙褶皱状,菌体扭曲变形,细胞器受损,菌丝顶端不断膨大,形成泡状结构且有空腔,菌体细胞膜通透性遭到破坏,细胞壁外沉积大量渗透物,且随菌株HRH317发酵上清液处理时间延长,灰葡萄孢菌菌体形态和超微结构的破坏程度也随之加剧,进一步从细胞及亚细胞水平证实了菌株HRH317对灰葡萄孢菌菌体生长具有显著的抑制作用。通过草莓离体防效试验表明,菌株HRH317发酵上清液对采后6 d的草莓灰霉病的病情指数与对照组相比显著降低,由70.56降低至23.89,相对防效为66.18%,具有良好的防治效果。因此,解淀粉芽孢杆菌HRH317在生物防治中具有潜在的应用前景和开发价值,未来还需对菌株HRH317代谢产物中不同种类的有效抑菌成分进行深入探索。
[1]BI K,LIANG Y,MENGISTE T,et al.Killing softly:a roadmap of Botrytis cinerea pathogenicity[J].Trends Plant Sci,2023,28(2):211-222.
[2]ZHANG X Q,TANG X Y,ZHAO C C,et al.A pH-responsive MOF for sitespecific delivery of fungicide to control citrus disease of Botrytis cinerea[J].Chem Eng J,2022.431:133351.
[3]DEANR R,VAN KAN J A L,PRETORIUS Z A,et al.The top 10 fungal pathogens in molecular plant pathology[J].Mol Plant Pathol,2012, 13(4):414-430.
[4]VALERI M C,NOVIG,WEITS D A,et al.Botrytis cinerea induees local hypoxia in Arabidopsis leaves[J].New Phytol,2021,229(1):173-185.
[5]杜静婷,蔺楠,施俊凤.酥梨采后灰霉病生防菌株的鉴定及抑菌作用[J].保鲜与加工,2024,24(3):53-60.
[6]王华弟,沈颖,赵帅锋.草莓灰霉病发病流行规律与综合防治技术研究[J].浙江农业科学,2017,58(12):2239-2241,2245.
[7]陈丽萍,吴长兴,苍涛,等.8种杀菌剂对草莓灰霉病菌的室内毒力[J].浙江农业科学,2018,59(9):1535-1537.
[8]PRIYA P S, ANGIDI S, THERA U K, et al.Management of strawberry grey mold disease using biocontrol agents andplant extracts[J].Am J Plant Sci,2024,15(7):538-551.
[9]王世伟,王卿惠,翟丽萍,等.解淀粉芽胞杆菌抗真菌活性研究进展[J].中国微生态学杂志,2020,32(8):971-978,982.
[10]王伟宸,赵进,黄薇颐,等.芽孢杆菌代谢产物防治三种常见植物病原真菌的研究进展[J].生物技术通报,2023,39(3):59-68.
[11]汪静杰,赵东洋,刘永贵,等.解淀粉芽孢杆菌SWB16菌株脂肽类代谢产物对球孢白僵菌的拮抗作用[J].微生物学报,2014,54(7):778-785.
[12]葛文沛,王洪玲,崔欣然,等.茄腐镰刀菌拮抗菌株M1的抑菌机理及其促生作用研究[J].中国酿造,2024,43(10):142-148.
[13]杨蕊,石红利,郎剑锋,等.解淀粉芽孢杆菌PB-1对灰葡萄孢的抑菌机理[J].江苏农业科学,2024(16):149-155.
[14]朱晓琴,方树贤,刘冬梅,等.辣椒炭疽病生防菌株的筛选,鉴定及其抑菌机理[J].植物保护学报,2023,50(4):913-922.
[15]刘超,刘洪伟,汪步青,等.解淀粉芽孢杆菌BA-26抗菌物质分离及对灰葡萄孢抑菌作用研究[J].生物技术通报,2019,35(7):83-89.
[16]张淑静,张淑凤,杨萍,等.山东湿地生防菌筛选及解淀粉芽孢杆菌JQ-3的防病促生作用[J].中国植保导刊,2024,44(5):16-21.
[17]赵新贝,王娟,上官妮妮,等.番茄灰霉病生防细菌TD-7的鉴定、发酵条件优化及其防治效果[J].中国生物防治学报,2019,35(2):226-239.
[18]孙长花,王征远,刘俊,等.八角茴香提取液的抑菌效果及稳定性探讨[J].食品工业,2020,41(12):189-192.
[19]刘萍.草莓灰霉病拮抗真菌的筛选及活性物质的分离鉴定[D].保定:河北大学,2024.
[20]焦甜甜,沈凤英,王娇,等.咯菌腈与解淀粉芽胞杆菌X-119复配对葡萄灰霉病的防效[J].植物保护学报,2024,51(3):698-708.
[21]朱娜,张树武,徐秉良,等.解淀粉芽孢杆菌TS-1203对苹果炭疽叶枯病菌的抗生作用[J].植物保护,2021,47(4):46-51.
[22]王文迪,赵婷婷,马红霞,等.解淀粉芽孢杆菌抗菌机制的研究进展[J].中国兽医杂志,2023,59(8):88-92.
[23]DUAN Y N, CHEN R, ZHANG R, et al.Isolation, identification, and antibacterial mechanisms of Bacillus amyloliquefaciens QSB-6 and its effect on plant roots[J].Front Microbiol,2021,12:746799.
[24]HU J L,ZHENG M Z,DANG S Z,et al.Biocontrol potential of Bacillus amyloliquefaciens LYZ69 against anthracnose of alfalfa (Medicago sativa)[J].Phytopathology,2021,111(8):1338-1348.
[25]秦楠.解淀粉芽孢杆菌HRH317抗菌蛋白鉴定及抑菌机理研究[D].晋中:山西农业大学,2015.
[26]张宝龙,郑成忠,徐振朋,等.解淀粉芽孢杆菌YN-J3对禾生炭疽菌孢子萌发和附着胞形成的影响[J].中国生物防治学报,2024,40(5):1045-1053.
[27]付瑞敏,常慧萍,陈五岭.Bacillus amyloliquefaciens BA-16-8 所产fengycin对扩展青霉细胞的抑制机制研究[J].食品科技,2017,42(5):7-13.
[28]宛甜甜.解淀粉芽孢杆SN16-1对水稻稻瘟病的防治作用及其诱抗机理研究[D].上海:华东理工大学,2023.
[29]王璐.萎缩芽孢杆菌CP 297和解淀粉芽孢杆菌CP 2014对毛桃致腐霉菌的抑菌机理及保鲜应用[D].晋中:山西农业大学,2019.
[30]LV J, DA R, CHENG Y, et al.Mechanism of antibacterial activity of Bacillus amyloliquefaciens C-1 lipopeptide toward anaerobic Clostridium difficile[J].Biomed Res Int,2020,2020:3104613.
[31]ZHANG B,DONG C J,SHANG Q M,et al.New insights into membraneactive action in plasma membrane of fungal hyphae by the lipopeptide antibiotic bacillomycin L[J].Biochim Biophys Acta, 2013, 1828(9):2230-2237.
[32]施俊凤,孙常青,李静.草莓采后灰霉病生防菌Burkholderiacontaminans培养基优化分析[J].农学学报,2017,7(1):32-38.
[33]严浩,于佳乐,朱强,等.草莓灰霉病病原菌分离鉴定及拮抗微生物筛选[J].江苏海洋大学学报(自然科学版),2024,33(1):16-23.