白酒(又称烧酒)作为一种以粮食为原料经固态发酵和蒸馏而成的高酒精度烈性酒,具有浓郁的香味,是我国传统酒类之一[1-2]。白酒酿造工艺较为复杂,主要包括原料选择、制曲、发酵、蒸馏和储存等。复杂的工艺和地域特点导致白酒香型众多[3],其中,浓香型和酱香型作为中国较为典型的酒体风格,深受广大消费者的喜爱[4]。在浓香型和酱香型白酒的酿造过程中,高温和中高温大曲的制作和品质是白酒生产中最为关键的一步[5]。作为白酒发酵过程中一种最常见的发酵剂,大曲不仅可以将原料中的淀粉分解成可发酵的糖分,产生各种酶类和氨基酸,还可以改善酒体的风味和口感,防止有害微生物的生长[6]。王国峥等[7]研究也证实大曲的主要作用是赋予白酒发酵体系中微生物群落和酶类,并对白酒的风味做出特殊的贡献。
大曲在制作过程中不仅可以使生产环境中的微生物在酒醅中大量富集和增殖[8],而且通过微生物代谢可以产生如醇类、有机酸和酯类等香味物质和香味物质的前体,为白酒的入窖发酵提供良好的发酵原材料,并最终赋予酒体所特有的风味[9]。刘冰冰等[10]通过纯培养的手段对酒曲中的微生物结构进行解析,初步探究酒曲中微生物在发酵过程中的作用。然而,随着测序技术的出现,越来越多的科研人员通过扩增子和宏基因组测序技术对发酵食品和环境中微生物的多样性和结构进行解析[11],为食品安全和品质稳定提供了有效的解决方案。近年来,超高深宏基因组测序也逐渐被应用到传统发酵食品体系中,为传统发酵食品中微生物结构的分析提供了重要的手段,其不仅可以在基因组水平上对微生物多样性和功能进行解析,还可以观察环境中存在的病毒序列和水平基因转移情况[12]。值得注意的是,发酵过程中涉及细菌的噬菌体感染是导致发酵失败的一个常见因素[13]。因此,通过多组学分析技术解析不同温度大曲中微生物群落结构具有重要的意义。
尽管超高深测序技术能够准确对大曲样本中微生物的情况进行解析,但无法对大曲的整体品质进行评价,而这对于评价微生物对大曲品质的影响是十分必要的。因此,本研究采集了中高温大曲和高温大曲各5份,基于超高深测序技术结合理化指标检测、仿生学技术分别对大曲的微生物群落结构及功能、理化性质、感官品质进行综合评价和关联分析,以期通过多组学联合分析的手段探究温度对大曲品质的影响,为白酒品质的提升和工艺的改良提供必要的数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 大曲样品
大曲样品均于2023年11月17日采集自湖北省宜昌市某酒厂,分别采集5份中高温大曲和高温大曲,编号分别为ZG1~ZG5和G1~G5。两种大曲除发酵温度存在差异外,其他工艺基本一致。
1.1.2 试剂
QIAGEN DNeasy mericon Food Kit脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:德国QIAGEN公司;Illumina Illumina Xten高通量测序平台配套试剂:美国Nano Drop公司;无水乙酸钠、乙醇、氢氧化钠(均为分析纯):国药集团化学试剂上海有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Illumina Xten高通量测序平台:美国Illumina公司;ND-2000C微量紫外分光光度计:德国QIAGEN公司;Dell PowerEdge R930机架式服务器:美国Dell公司;SA402B型电子舌(5个传感器):日本Insent公司;PEN3型电子鼻(10个传感器):德国Airsense公司;Veriti FAST梯度基因扩增仪:美国ABI公司;UltraScan PRO全自动多功能色度仪:美国Hunterlab公司;NMI20-025V-I型核磁共振成像分析仪:上海纽迈电子科技有限公司;TA.XT Plus物性测试仪:英国Stable Micro System公司。
1.3 方法
1.3.1 样品前处理
将大曲样本置于无酶的研钵中研磨为粉末,混合均匀后于-80 ℃的冰箱中储存备用。
1.3.2 理化指标分析
根据QB/T 4257—2011《酿酒大曲通用分析方法》对大曲样品的酸度、灰分、淀粉含量和氨基酸态氮含量、发酵力、液化力等进行测定。
1.3.3 微生物指标分析
根据GB 4789.2—2022《食品微生物学检验 菌落总数测定》、GB 4789.35—2016《食品微生物学检验 乳酸菌检验》、GB 4789.15—2016《食品微生物学检验霉菌和酵母计数》分别对大曲样品中的菌落总数、乳酸菌以及真菌活菌数进行测定。
1.3.4 感官指标分析
气味分析:准确称取12 g大曲粉至电子鼻专用测试瓶中,密封,45 ℃水浴加热30 min,室温平衡20 min,备用。将电子鼻测试探头插入测试瓶中,并使用电子鼻的W1C(对芳香类物质灵敏)、W5S(对氮氧化物灵敏)、W3C(对氨气、芳香类物质灵敏)、W6S(对氢气有选择性)、W5C(对烷烃、芳香类物质灵敏)、W1S(对甲烷灵敏)、W1W(对有机硫化物、萜类物质灵敏)、W2S(对乙醇灵敏)、W2W(对有机硫化物灵敏)、W3S(对烷烃灵敏)10个金属测试电极对大曲的气味品质进行分析。电子鼻在每次测试前进行60 s的自动清洁后,进行90 s的测试,且在测试期间每秒生成一个响应值。选取45 s、47 s和49 s响应值的平均值作为测试数据[4]。
滋味分析:准确称取30 g大曲粉溶于150 mL蒸馏水中,拌匀后过滤,收集滤液。滤液经10 000 r/min离心15 min后,将上清液倒入电子舌测试杯中,采用电子舌对所有大曲粉的酸、苦、涩、咸、鲜、后味A(涩味的回味)、后味B(苦味的回味)和丰度(鲜味的回味)的相对强度进行分析。每份样本平行测定4次,取后3次数据的平均值为样本的测试值。
颜色参数分析:采用全自动多功能色度仪分别对大曲样品的色泽相关指标进行分析[4]。
1.3.5 微生物群落分析
超高深宏基因组测序:称取约0.5g左右的大曲粉于2 mL无酶的离心管中,参照QIAGEN DNeasy mericon Food Kit DNA提取试剂盒说明书提取样本中微生物的宏基因组DNA,以其为模板,参照文献[12]进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,并利用1%琼脂糖凝胶电泳进行检测。参考SATTIN E等[13]的方法构建DNA文库后,基于Illumina Xten测序平台进行测序。
生物信息学分析:运用KneadData(v 0.11.0)对下机数据进行质量控制,去除人类基因组序列[14]。基于Metaphlan 3.0进行物种注释[15]。基于MegaHit(v 1.1.2)将高质量序列组装成contigs并构建序列集[16];基于Sembin2和Maxbin2分别对构建的contigs序列集进行数据分箱以获得宏基因组组装基因组(metagenome assembly genomes,MAGs),并使用Das tool(v 1.0.0)和CheckM(v 1.1.x)对MAGs进行合并和质量评估[17-19];使用FastANI(v 1.3.3)将MAGs与人体肠道微生物的基因组集(unified human gastrointestinal genome,UHGG)和国家生物技术信息中心(National center for biotechnology information,NCBI)中的非冗余核苷酸序列数据库进行比对,以获得注释信息。同时基于碳水化合物活性酶(carbohydrate-active enzymes,CAZy)等数据库对MAGs的功能进行注释,功能包括抗生素抗性基因(antibiotic resistance genes,ARGs)、蛋白直系同源基因簇(cluster of orthologous groups of proteins,COG)。
1.3.6 数据处理与统计分析
每个试验进行3次重复,采用Excel 2021软件处理数据,结果用“平均值±标准差”表示;使用R.studio(v 4.3.2)中“vegan”包对微生物多样性进行分析;基于Wilcoxon秩和检验对各指标在两组间的差异进行检验;采用Spearman秩相关性分析对两组大曲样品中差异优势菌种和差异品质指标进行分析;其他多元统计分析和数据可视化均使用R软件完成。
2 结果与分析
2.1 中高温和高温大曲样品品质差异分析
2.1.1 理化及微生物指标
对中高温和高温大曲样品的理化及微生物指标进行测定,结果见表1。由表1可知,在理化指标方面,有6个指标在两种大曲样品之间存在显著差异(P<0.05),其中,中高温大曲样品的密度(0.69 g/m3)显著低于高温大曲样品(0.77 g/m3)(P<0.05);而发酵力(6.62 U)、液化力(3.27 U)、酯化力(385.20 U)、糖化力(606.20 U)和酸度(11.50 mmol/10 g)均显著高于高温大曲样品(4.38 U、0.34 U、76.20 U、41.40 U和14.18 mmol/10 g)(P<0.05)。在微生物指标方面,中高温大曲样品中的菌落总数对数值(6.71)、乳酸菌活菌数对数值(6.33)、霉菌和酵母总活菌数对数值(6.34)均显著高于高温大曲(5.34、5.16和5.34)(P<0.05)。
表1 中高温和高温大曲的理化及微生物指标
Table 1 Physicochemical and microbiological indicators of mediumhigh-temperature and high-temperature Daqu
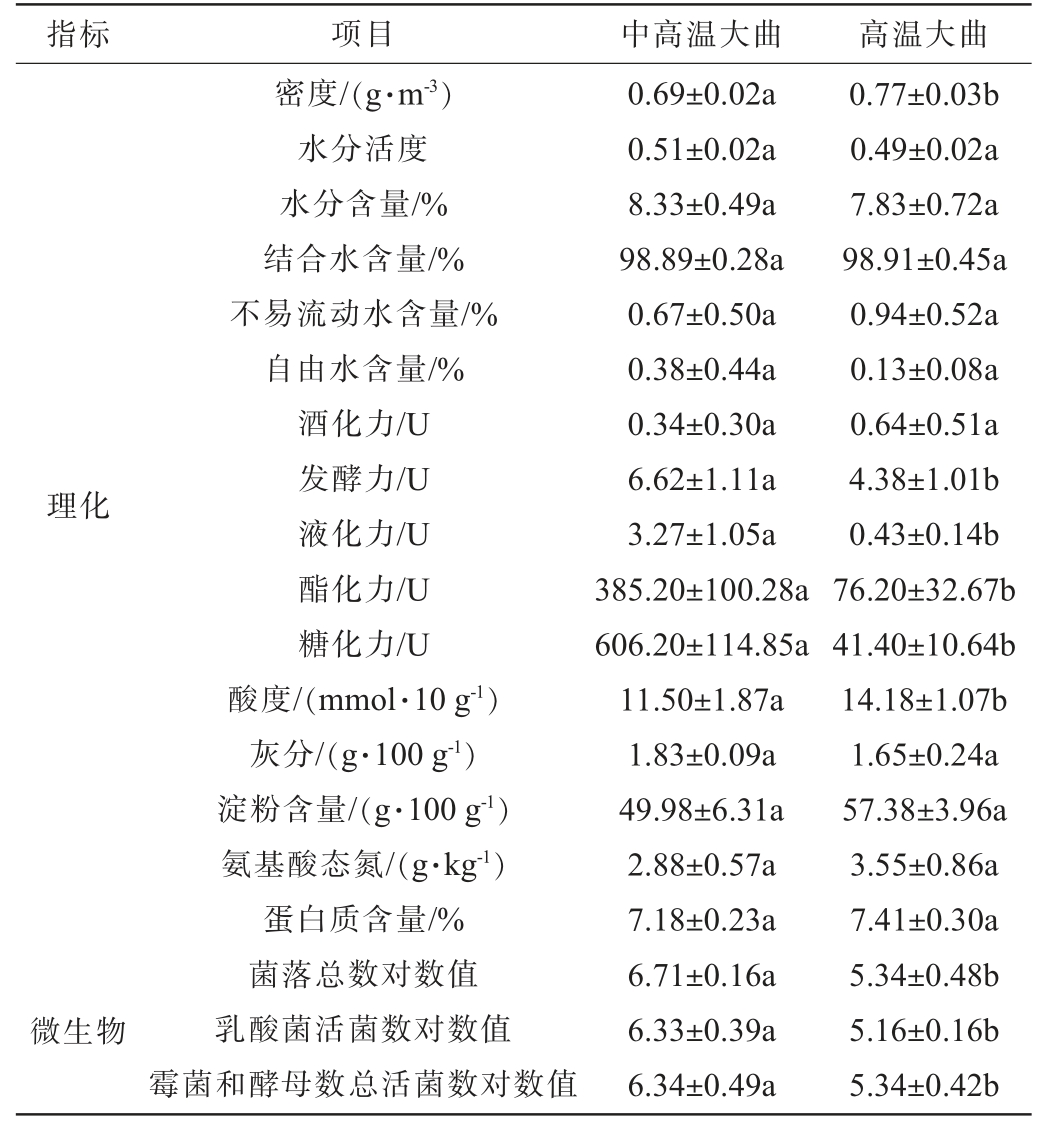
注:同行不同字母表示差异显著(P<0.05)。
微生物指标 项目 中高温大曲 高温大曲密度/(g·m-3)水分活度水分含量/%结合水含量/%不易流动水含量/%自由水含量/%酒化力/U发酵力/U液化力/U酯化力/U糖化力/U酸度/(mmol·10 g-1)灰分/(g·100 g-1)淀粉含量/(g·100 g-1)氨基酸态氮/(g·kg-1)蛋白质含量/%菌落总数对数值乳酸菌活菌数对数值霉菌和酵母数总活菌数对数值理化0.69±0.02a 0.51±0.02a 8.33±0.49a 98.89±0.28a 0.67±0.50a 0.38±0.44a 0.34±0.30a 6.62±1.11a 3.27±1.05a 385.20±100.28a 606.20±114.85a 11.50±1.87a 1.83±0.09a 49.98±6.31a 2.88±0.57a 7.18±0.23a 6.71±0.16a 6.33±0.39a 6.34±0.49a 0.77±0.03b 0.49±0.02a 7.83±0.72a 98.91±0.45a 0.94±0.52a 0.13±0.08a 0.64±0.51a 4.38±1.01b 0.43±0.14b 76.20±32.67b 41.40±10.64b 14.18±1.07b 1.65±0.24a 57.38±3.96a 3.55±0.86a 7.41±0.30a 5.34±0.48b 5.16±0.16b 5.34±0.42b
2.1.2 感官品质
通过仿生设备及全自动多功能色度仪对中高温和高温大曲的气味、滋味及颜色参数进行检测,结果见图1和图2,并基于感官指标对中高温和高温大曲样品进行主成分分析,结果见图3。由图3可知,主成分1(principal component 1,PC1)的方差贡献率为47.78%,PC2的方差贡献率为22.33%,累计方差贡献率为70.11%,说明前两个主成分能代表大部分的感官品质信息。中高温大曲主要集中在右上方,而高温大曲则主要集中在左下方,两组大曲呈现明显的分离趋势(P<0.05),说明两组大曲的感官品质存在差异。由图1和图2可知,中高温大曲的L*值、W6S和后味B的强度均显著高于高温大曲(P<0.05),而W1C、鲜味和丰度均显著低于高温大曲(P<0.05),这些指标可能是导致两种大曲品质差异的主要因素。
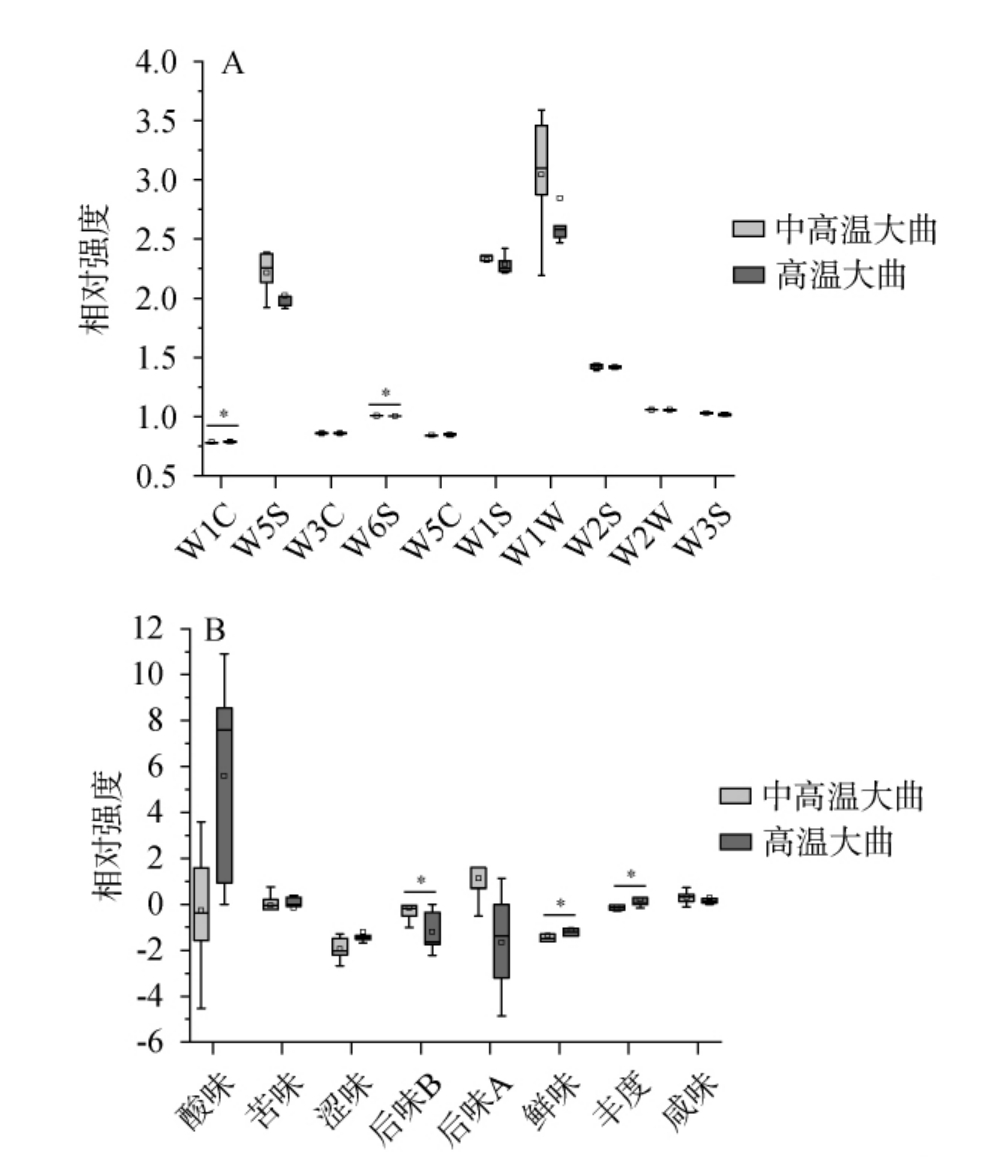
图1 中高温和高温大曲的气味(A)和滋味(B)测定结果
Fig.1 Determination results of the odor (A) and taste (B) of mediumhigh-temperature and high-temperature Daqu
“*”表示差异显著(P<0.05)。下同。
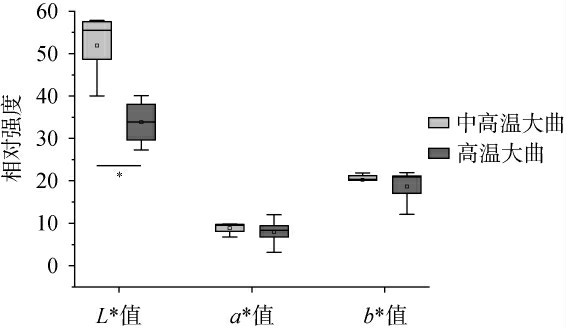
图2 中高温和高温大曲的颜色参数测定结果
Fig.2 Determination results of color parameters of medium-hightemperature and high-temperature Daqu
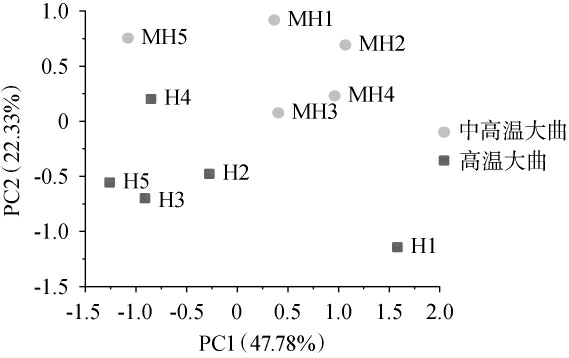
图3 基于感官指标中高温和高温大曲样品的主成分分析结果
Fig.3 Principal component analysis results of medium-hightemperature and high-temperature Daqu samples based on sensory indicators
2.2 中高温和高温大曲中微生物多样性分析
微生物在白酒的发酵过程中至关重要,其主要通过酒曲进入白酒的发酵体系中[5]。因此,对于大曲样品中微生物的多样性进行解析是十分必要的。中高温和高温大曲样品中的微生物多样性分析结果见图4。由图4A可知,中高温大曲样品中微生物的Shannon指数(2.53)显著高于高温大曲样品(1.09)(P<0.05),说明中高温大曲和高温大曲的物种多样性存在显著差异,且中高温大曲的微生物多样性较高。
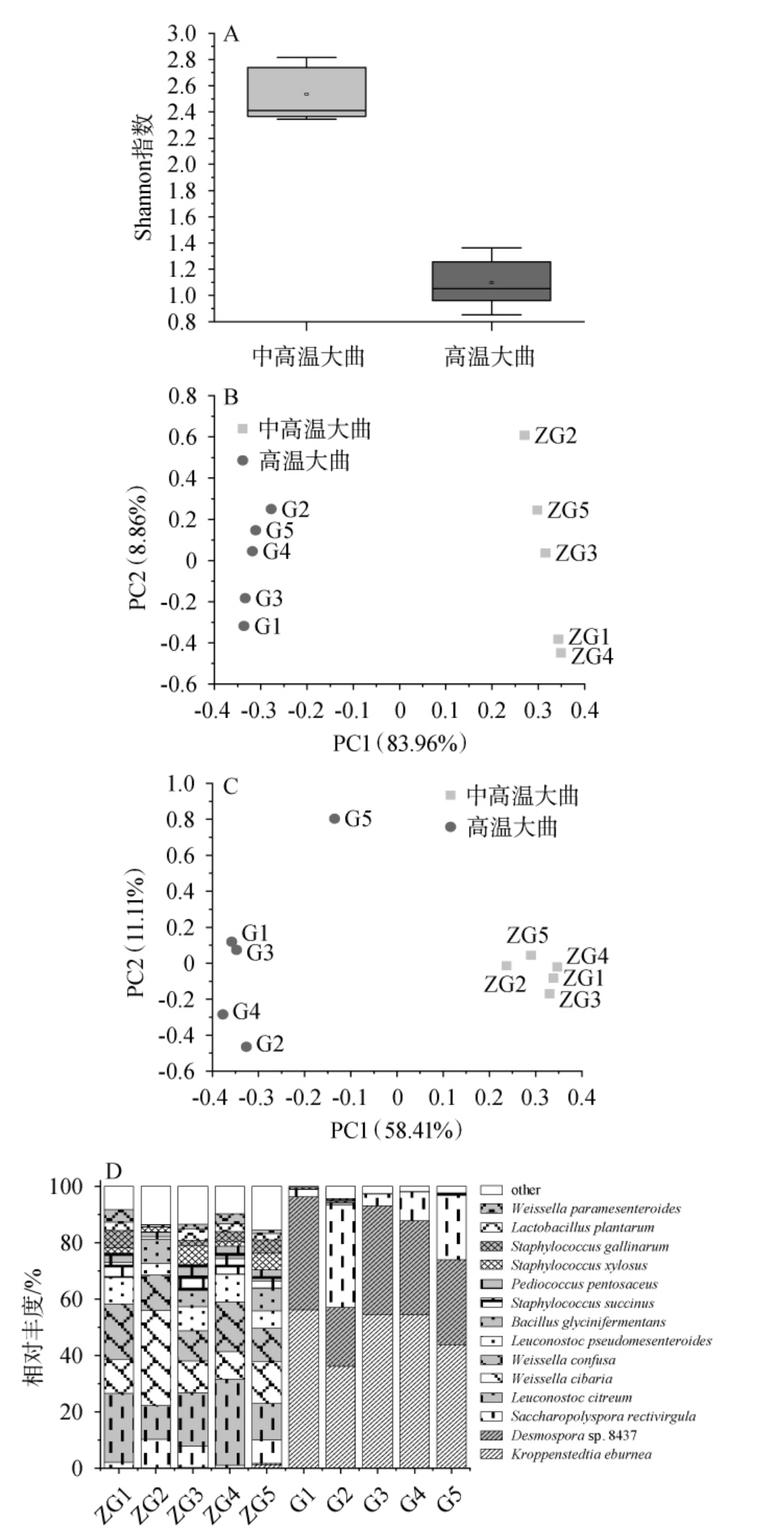
图4 中高温和高温大曲中微生物多样性分析结果
Fig.4 Analysis results of microbial diversity in medium-hightemperature and high temperature Daqu
A为α多样性指数;B、C分别为在微生物种水平下基于加权和非加权的Uni-Frac距离的主坐标分析;D为基于种水平微生物菌群结构分析。
由图4B可知,PC1的方差贡献率为83.96%,PC2的方差贡献率为8.86%,累计方差贡献率为92.82%;由图4C可知,PC1的方差贡献率为58.41%,PC2的方差贡献率为11.11%,累计方差贡献率为69.52%;说明前两个主成分能代表大部分微生物种的信息。中高温大曲样品均位于X轴正半轴,而高温大曲样品则均位于X轴负半轴,两组大曲样品呈现明显的分离趋势,说明中高温大曲和高温大曲微生物群落结构存在差异。由图4D可知,两种大曲样品中共注释到14个优势菌种(平均相对丰度>1.0%),累计平均相对丰度高达92.80%。其中平均相对丰度排前4的菌种分别为象牙克罗彭斯特菌(Kroppenstedtia eburnean)(24.66%)、链孢杆菌属(Desmospora sp.)8437(16.34%)、直杆糖多孢菌(Saccharopolyspora rectivirgula)(10.53%)、嗜柠檬酸明串珠菌(Leuconostoc citreum)(10.02%)。在14种优势菌种中,除直杆糖多孢菌(Saccharopolyspora rectivirgula)和鸡葡萄球菌(Staphylococcus gallinarum)在两组大曲样品中相对丰度无显著差异外(P>0.05),12种优势菌种在两组大曲样品中存在显著差异(P<0.05),其中,K.eburnean和Desmospora sp.8437在高温大曲中的相对丰度较高,而L.citreum、食窦魏斯氏菌(Weissella cibaria)和融合魏斯氏菌(Weissella confusa)等10个优势菌种在中高温大曲中的相对丰度较高。
2.3 中高温和高温大曲样品中微生物MAGs及其功能分析
大曲微生物种类和功能对酒体风味的形成至关重要,为了发掘该大曲中潜在功能微生物[12],进一步进行MAGs及功能分析,结果分别见图5和图6。
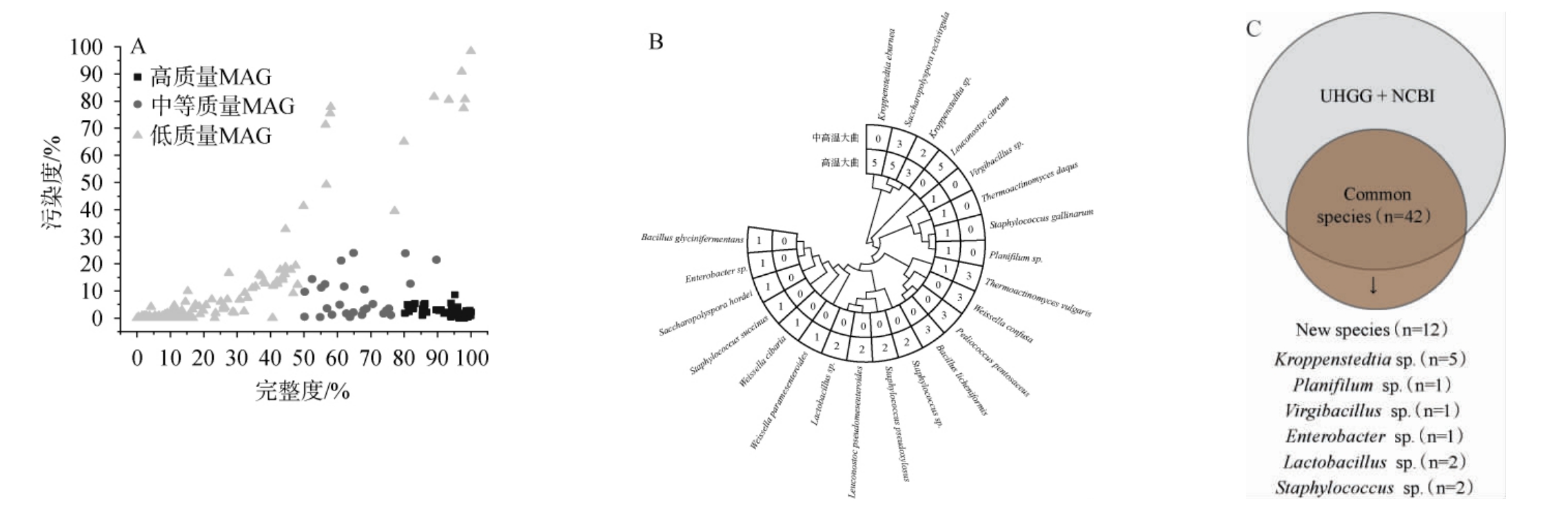
图5 中高温和高温大曲中微生物宏基因组组装基因组分析结果
Fig.5 Genomic analysis results of microbial metagenomic assembly in medium-high-temperature and high-temperature Daqu
A为MAGs的完整度和污染率;B为中高温大曲和高温大曲样品中MAGs注释信息;C为大曲样品中的疑似新物种。

图6 中高温和高温大曲中微生物宏基因组组装基因组的功能分析结果
Fig.6 Functional analysis results of microbial metagenomic assembly genomes in medium-high-temperature and high-temperature Daqu
A为高质量MAGs中ARGs的数量;B为高质量MAGs的COGs的注释信息;C为中高温大曲和高温大曲样品中氧化还原酶和碳水化合物酯酶比较分析。
由图5A可知,大曲样品中共组装出719个MAGs,其中,高质量MAGs共有54个,在中高温大曲和高温大曲样品中分别有36个、18个。由图5B可知,高温大曲样品中高质量MAGs主要注释为Kroppenstedtia eburnea 和Saccharopolyspora rectivirgula等,而中高温大曲中高质量MAGs主要注释为Leuconostoc citreum和地衣芽孢杆菌(Bacillus licheniformis)等,且中高温大曲样品中多种物种并未在高温大曲中被组装和鉴定到。由图5C可知,54个高质量MAGs中有42个可以在NCBI数据和UHGG数据库中被注释,剩余12个MAGs与数据库已知基因组的平均核苷酸相似度较低(<95%),可定义为疑似新种。所有疑似新种分别被注释到归属于克氏棒状杆菌(Kroppenstedtia sp.)、葡萄球菌(Staphylococcussp.)、污泥扁平丝菌(Planifilum sp.)、肠杆菌(Enterobacter sp.)、乳杆菌(Lactobacillus sp.)和枝芽胞杆菌属(Virgibacillus sp.)。
由图6A可知,在部分MAGs中注释到了大量的ARGs,两组大曲样品中ARGs数量存在明显差异,高温大曲样品中仅在5个物种中鉴定到ARGs,而中高温大曲样品中却在8个物种中鉴定到ARGs。由图6B可知,中高温大曲样品中微生物在氨基酸转运与代谢、能量生产与转换和脂质转运与代谢等5个方面的能力显著低于高温大曲(P<0.05)。由图6C可知,中高温大曲样品中微生物在氧化还原酶和碳水化合物酯酶方面亦显著低于高温大曲(P<0.05)。
2.4 中高温大曲和高温大曲间差异优势菌种与差异品质的相关性分析
两组大曲样品中差异优势菌种和差异品质指标间相关性分析结果见图7。
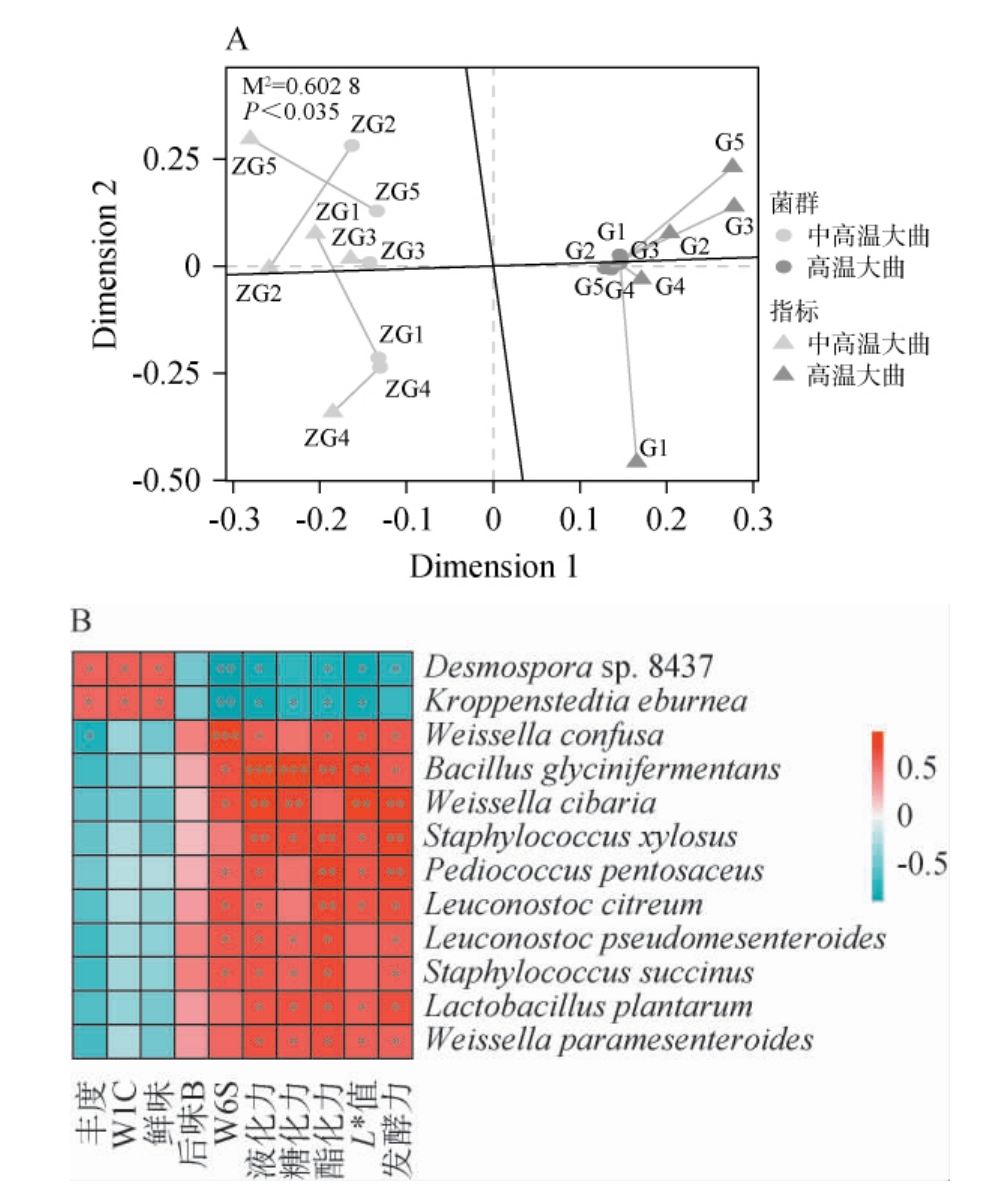
图7 中高温大曲与高温大曲中差异优势菌种与差异指标间相关性分析
Fig.7 Correlation analysis between difference dominant strains and difference indexes in medium-high-temperature and hightemperature Daqu
A为普氏分析结果;B为差异优势菌种与差异品质指标之间的相关性分析结果。
由图7A可知,两组大曲中差异优势菌种与差异品质指标之间存在显著的一致性(P<0.05)。由图7B可知,Desmospora sp.8437和Kroppenstedtia eburnean与丰度、W1C和鲜味之间存在显著正相关(P<0.05),而Leuconostoc citreum、Weissella cibaria和Weissella confusa等与发酵力、酯化力、糖化力和液化力等均存在显著正相关(P<0.05),表明不同大曲特定微生物可能影响大曲最终的感官及理化品质。
3 讨论
大曲作为白酒发酵过程中的最重要的添加剂和发酵剂之一,在白酒生产中发挥着极其重要的作用[20]。发酵温度是影响微生物生长发育最重要的因素之一[2]。本研究采用超高深宏基因组测序技术结合品质指标分析研究了温度对大曲中微生物群落及其品质的影响。
温度升高直接影响大曲中微生物的构成[21]。发酵温度升高导致大曲中菌落总数、乳酸菌数、霉菌和酵母数明显下降,而对大曲的理化特性进行分析发现,发酵温度的升高使得成品大曲的发酵性能出现明显的下降。有研究表明,大曲的发酵性能主要由其所富含的微生物和酶类物质所决定[22]。在白酒的发酵过程中,霉菌和酵母主要负责原料的糖化和发酵,加快发酵进程[23]。由此可见,较高的发酵温度会影响大曲中发酵性能。大曲作为发酵剂,其自身的感官品质与成品酒的品质有着紧密的联系[24]。本研究发现不同温度大曲的风味之间存在较大的差异,且主要集中在芳香类物质、后味B和鲜味上。酵母在发酵过程中会产生酯类物质,而较高的发酵温度通常有助于酯的产生,提高其果香味[25]。有研究证实,苦味可能与酵母的过度活动或某些酶的活性有关,适宜的温度可能导致酵母菌的过度生长或增加酶的活性,从而产生大量苦味化合物[26]。
传统培养结果表明,高温可能使得大曲中微生物的数量和种类减少。宏基因组测序结果亦发现高温大曲中微生物多样性和丰度明显低于中高温大曲,且其优势物种与低丰度物种均与中高温大曲存在明显差异。由此可见,温度的变化会明显影响大曲中的微生物结构。K.eburnean和Desmospora sp.8437在高温大曲中显著富集,这可能与其耐高温特性有关,而L.citreum、W.cibaria和W.confusa等在中高温大曲中显著富集,这可能与其最适生长温度有关。大曲中含有较多的疑似新物种,其中Virgibacillus sp.和Planifilum sp.仅在高温大曲中被鉴定出,而Staphylococcus sp.、Lactobacillus sp.和Enterobacter sp.仅在中高温大曲中被鉴定出。由此可见,特殊的发酵基质和温度可能富含着丰富微生物资源,为酒用微生物的保藏提供菌株来源。进一步分析发现,中高温大曲中鉴定到更多的抗性基因,且种类与高温大曲差异明显。温度的变化可以影响基因的表达水平,某些抗性基因可能在特定的温度下更活跃,这可能提升其水平转移的几率[27]。同时,本研究发现,高温大曲中具有更高的氨基酸转运与代谢和能量代谢的表达水平。有报道证明,氨基酸可以在饮料和食物中发挥重要的作用,特别是对香味(谷氨酰胺酸)和鲜味(芳香族氨基酸)的贡献[28]。高温大曲中微生物在氨基酸转运和代谢的高表达,可能是使得其香味和鲜味较高的重要因素之一。
4 结论
该研究采用超高深宏基因组测序结合生理生化测定和仿生学技术解析了宜昌地区高温和中高温大曲的产品品质。高温大曲的发酵力、液化力、酯化力和糖化力、L*值分别为4.38 U、0.43 U、76.20 U、41.40 U、34,均显著低于中高温大曲(P<0.05);密度、菌落总数、乳酸菌数、霉菌和酵母数对数值分别为0.77 g/m、5.43、5.16和5.34,亦均显著低于中高温大曲(P<0.05)。然而,高温大曲的芳香味、鲜味和丰度的相对强度显著高于中高温大曲(P<0.05),而苦味的回味强度显著较低(P<0.05)。超高深宏基因组测序结果表明,高温大曲中微生物菌群的香农指数(2.53)显著低于中高温大曲(P<0.05),且两种大曲中的微生物结构存在差异,其中12种优势菌种存在显著差异(P<0.05);高温大曲中有5个物种鉴定出抗性基因,而中高温大曲中有8个物种鉴定出抗性基因。此外,高温大曲中微生物的氨基酸转运与代谢、能量生产与转换等5个方面显著高于中高温大曲(P<0.05),而氧化还原酶和碳水化合物酯酶水平显著低于中高温大曲(P<0.05)。该研究充分评价了高温和中高温大曲大曲的微生物群落、理化和感官品质,可为大曲的生产提供更全面和科学的指导,对于推进白酒发酵技术的发展具有重要意义。
[1]XU Y Q,SUN B G,FAN G S,et al.The brewing process and microbial diversity of strong flavour Chinese spirits:A review[J].J I Brewing,2017,123(1):5-12.
[2]JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Tech,2017,63:18-28.
[3]WEI Y, ZOU W, SHEN C H, et al.Basic flavor types and component characteristics of Chinese traditional liquors: A review[J].J Food Sci,2020, 85(12):4096-4107.
[4]黎婷玉,李文鹏,田龙新,等.基于仿生学技术对中国十二大香型白酒品质差异的研究[J].中国酿造,2022,41(11):39-44.
[5]WANG X X, FAN W L, XU Y.Comparison on aroma compounds in Chinese soy sauce and strong aroma type liquors by gas chromatographyolfactometry, chemical quantitative and odor activity values analysis[J].Eur Food Res Technol,2014,239:813-825.
[6]WANG Y R,CAI W C,WANG W P,et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Sci Nutr,2021,9(2):1003-1016.
[7]王国峥,陈笔,卢建军,等.基于宏基因组学测序技术分析3个轮高温大曲微生物群落[J].食品科学,2023,44(16):220-227.
[8]LI Z J,FAN Y,HUANG X N,et al.Microbial diversity and metabolites dynamic of light-flavor Baijiu with stacking process[J].Fermentation,2022,8(2):67.
[9]WANG M Y,YANG J G,ZHAO Q S,et al.Research progress on flavor compounds and microorganisms of maotai flavor Baijiu[J].J Food Sci,2019,84(1):6-18.
[10]刘冰冰,刘正宇,宋豪锋,等.宋河浓香型白酒酒醅纯培养霉菌群落的组成及功能酶筛选[J].现代食品科技,2019,35(12):197-207.
[11]邱显平,黄桥,杨静,等.浓香型白酒在新、老窖池发酵过程中酒醅微生物群落结构差异分析[J].中国酿造,2024,43(1):50-56.
[12]WANG Y R,GAI J S,HOU Q C,et al.Ultra-high-depth macrogenomic sequencing revealed differences in microbial composition and function between high temperature and medium-high temperature Daqu[J].World J Microb Biot,2023,39(12):337.
[13]SATTIN E, ANDREANI N A, CARRARO L, et al.A multi-omics approach to evaluate the quality of milk whey used in ricotta cheese production[J].Front Microbiol,2016,7(8):1272.
[14]ANYASO-SAMUEL S,SACHDEVA A,GUHA S,et al.Bioinformatics pre-processing of microbiome data with an application to metagenomic forensics[J].Stat Anal Microb Data,2021,24(4):45-78.
[15]NOUSIAS O, MONTESANTO F.Metagenomic profiling of host-associated bacteria from 8 datasets of the red alga Porphyra purpurea with MetaPhlAn3[J].Mar Genom,2021,59(10):100866.
[16]LI D,LIU C M,LUO R,et al.MEGAHIT:An ultra-fast single-node solution for large and complex metagenomics assembly via succinct de Bruijn graph[J].Bioinformatics,2015,31(10):1674-1676.
[17]PAN S,ZHU C,ZHAO X M,et al.Semibin:Incorporating information from reference genomes with semi-supervised deep learning leads to better metagenomic assembled genomes(mags)[J].BioRxiv,2021,16(8):456517.
[18]MAGUIRE F,JIA B,GRAY K L,et al.Metagenome-assembled genome binning methods with short reads disproportionately fail for plasmids and genomic islands[J].Microb Genom,2020,6(10):436.
[19]SIEBER C M K,PROBST A J,SHARRAR A,et al.Recovery of genomes from metagenomes via a dereplication,aggregation and scoring strategy[J].Nat Microbiol,2018,3(7):836-843.
[20]HE G Q,HUANG J,WU C D,et al.Bioturbation effect of fortified Daqu on microbial community and flavor metabolite in Chinese strong-flavor liquor brewing microecosystem[J].Food Res Int,2020,129(3):108851.
[21]ZHU M,ZHENG J,XIE J,et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Res Int,2022,153(3):110955.
[22]ZENG Y,WANG Y,CHEN Q,et al.Dynamics of microbial community structure and enzyme activities during the solid-state fermentation of Forgood Daqu:A starter of Chinese strong flavour Baijiu[J].Arch Microbiol,2022,204(9):577.
[23]PU S C, ZHANG Y, LU N, et al.Yeasts from Chinese strong flavour Daqu samples: Isolation and evaluation of their potential for fortified Daqu production[J].AMB Express,2021,11(1):176.
[24]王玉荣,侯强川,田龙新,等.酱香白酒第四轮次窖池不同分层酒醅微生物群落与理化性质差异分析[J].现代食品科技,2023,39(2):180-187.
[25]XU Y Q,ZHAO J R,LIU X,et al.Flavor mystery of Chinese traditional fermented Baijiu: The great contribution of ester compounds[J].Food Chem,2022,369(2):130920.
[26]SAKANDAR H A, HUSSAIN R, KHAN Q F, et al.Functional microbiota in Chinese traditional Baijiu and Mijiu Qu(starters):A review[J].Food Res Int,2020,138(12):109830.
[27]CERVINI C, VERHEECKE-VAESSEN C, FERRARA M, et al.Interacting climate change factors (CO2 and temperature cycles) effects on growth,secondary metabolite gene expression and phenotypic ochratoxin a production by Aspergillus carbonarius strains on a grape-based matrix[J].Fungal Biol,2021,125(2):115-122.
[28]TAMURA Y,IWATOH S,MIYAURA K,et al.Metabolomic profiling reveals the relationship between taste-related metabolites and roasted aroma in aged pork[J].LWT-Food Sci Technol,2022,155(2):112928.