酱油是一种发酵调味品,因其香气浓郁、滋味鲜美而深受消费者欢迎。酱油酿造主要包括制曲和发酵两个阶段,即原料在曲霉和细菌分泌的酶系作用下分解为各种氨基酸、短肽及糖类等化合物,这些物质再经由微生物代谢和化学反应,生成酸、酯、醛、酚等物质,形成具有特殊色泽、香气和口感鲜咸的酱油[1]。微生物酶系的催化作用是推进酱油发酵进程的重要动力,酶的种类与活力对酱油的品质有着直接的影响[2]。
随着居民生活水平的提高,人们的消费理念正在发生改变,高品质的酱油更能赢得消费者的喜爱。制曲是传统酱油酿造的关键环节,因成曲质量可直接影响酱油的口感、色泽和香气等。现阶段我国酱油生产以使用米曲霉(Aspergillus oryzae)沪酿3.042制曲为主,具有操作简便、生产快速的优点,但也会产生成曲酶系相对单一、原料不能得到充分发酵等问题,进而影响酱油品质和风味[3]。多菌株混合制曲可以提供多样化的酶系,能使酱油原料中营养成分更充分地释放,在提高酱油品质和强化风味方面极具潜力。研究证实,紫色红曲霉(Monascus purpureus)与米曲霉复合发酵成曲的酸性蛋白酶、氨肽酶、糖化酶、木聚糖酶和纤维素酶的酶活力均显著高于米曲霉单菌发酵成曲[4];采用米曲霉和黑曲霉(Aspergillus niger)混合制曲能使酱醪的氨基酸态氮生成率、全氮利用率分别提高5%和10%[5]。黑曲霉具备高产酸性蛋白酶和纤维素酶的特性,通常被认为是安全的(generally recognized as safe,GRAS)微生物,常被应用于酱、米酒、食醋等发酵食品的生产[6]。此外,曲霉混菌发酵可改善果胶酶、β-糖苷酶活力,促进植物细胞壁多糖水解,增加整体基质的孔隙率,从而有利于酚类物质的释放[7]。因此,多菌株混合制曲具有改善酱油品质的潜力。目前,混菌制曲以额外添加非米曲霉的曲霉为主,探究成曲中曲霉与乳酸菌混合制曲对酱油发酵品质影响的研究鲜见报道。
本研究以米曲霉沪酿3.042为主要制曲菌株,添加黑曲霉3.350和戊糖足球菌(Pediococcus pentosaceus)WT9进行多菌株协同制曲,并采用高盐稀态发酵工艺酿造酱油,探究其对成曲及酱油品质的影响,以期为提高酱油发酵品质和营养价值提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
黄豆:黑龙江琢光食品有限公司;面粉:中粮集团有限公司;米曲霉(Aspergillus oryzae)(沪酿3.042曲精):久味科技有限公司;黑曲霉(Aspergillus niger)(3.350曲精):上海佳民酿造食品有限公司;戊糖足球菌(Pediococcus pentosaceus)WT9:分离自酱醪,保藏于本实验室。
1.1.2 试剂
食盐(未加碘):江苏省银保盐业有限公司;蛋白胨、酵母浸提物(均为生化试剂):英国Oxoid公司;有机酸、氨基酸标准品(均为分析纯):美国Sigma公司;乙腈、甲醇(均为色谱纯):中国上海默克化工技术有限公司;真菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
LB液体培养基[8]:胰蛋白胨10 g,酵母浸提物5 g,氯化钠10 g,蒸馏水1 000 mL。LB固体培养基:LB液体培养基中添加琼脂粉15 g,121 ℃高压蒸汽灭菌20 min。
MRS肉汤培养基[8]:英国Oxoid公司。MRS固体培养基:MRS肉汤培养基添加琼脂粉15 g,118 ℃高压蒸汽灭菌20 min。
孟加拉红液体培养基[8]:蛋白胨5 g,葡萄糖10 g,磷酸氢二钾1 g,硫酸镁0.5 g,氯霉素0.1 g,蒸馏水1 000 mL。孟加拉红固体培养基:孟加拉红液体培养基中添加琼脂粉15 g,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
UV-1240紫外可见分光光度计:日本岛津公司;HHWS-II恒温恒湿培养箱:上海跃进医疗器械厂;5424R型离心机:德国Eppendorf公司;HPLC-1260高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Agilent公司;ProFlexTM 96孔聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Thermo Fisher公司。
1.3 方法
1.3.1 戊糖足球菌WT9的培养
从平板上挑取戊糖足球菌WT9单菌落接种于MRS液体培养基中,37 ℃条件下静置活化培养至OD600 nm值为2.0,以2%(V/V)的接种量转接至MRS液体培养基中,37 ℃条件下静置培养10~12 h至对数生长期,备用。
1.3.2 高盐稀态酱油发酵工艺
制曲:将黄豆用3倍的水浸泡10 h,沥除水分,在121 ℃条件下灭菌15 min。室温环境冷却后,将蒸煮后的大豆与面粉以质量比6∶4混合均匀。按照原料质量接种米曲霉沪酿3.042(曲精)、黑曲霉3.350(曲精)和戊糖足球菌WT9,在30 ℃和95%湿度下培养48 h,适时翻曲,待曲料表面长满黄绿色孢子即为成曲。单菌制曲(A)组仅添加1.6‰米曲霉沪酿3.042(曲精)进行制曲;双菌制曲(AA)组为同时添加1.6‰米曲霉沪酿3.042(曲精)和0.4‰黑曲霉3.350(曲精)进行制曲;三菌制曲(AAP)组为同时添加1.6‰米曲霉沪酿3.042(曲精)、0.4‰黑曲霉3.350(曲精)和6×106 CFU/g戊糖足球菌WT9进行制曲。
发酵:将540 mL20%盐水与成曲按照质量比1.8∶1.0混合,置于烧杯中搅拌均匀,密封后放置在30 ℃恒温培养箱中发酵35 d。发酵第1周每天搅拌1次,第2~5周则每3天搅拌1次。从发酵第0天起,定时取样。
1.3.3 微生物活菌数的测定
真菌和细菌活菌数的检测均采用平板计数法[8-9]。称取10 g样品放入盛有90 mL无菌生理盐水的250 mL锥形瓶中混匀,按10倍梯度稀释后分别涂布到LB固体培养基平板、MRS固体培养(含10 g/L山梨酸)平板和孟加拉红固体培养基平板上,分别于37 ℃和30 ℃条件下培养2~3 d后计数。LB固体培养基平板用于非乳酸菌的细菌计数;MRS固体培养基(含10 g/L山梨酸)平板用于乳酸菌的计数;孟加拉红固体培养基平板用于真菌(米曲霉、黑曲霉和酵母菌)计数。
其中,米曲霉与黑曲霉活菌数的计数需结合菌落形态和分子生物学技术。菌落形态:黑曲霉的菌丝呈现黑褐色,米曲霉菌丝则一般呈现黄绿色。分子生物学鉴定:挑取稀释梯度适宜平板上的所有菌落进行分子生物学鉴定。霉菌的菌丝经过液氮研磨后,用试剂盒提取基因组DNA,以其为模板,采用真菌通用引物ITS1(5'-TTCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')PCR扩增ITS rDNA基因序列,PCR扩增体系及条件参照文献[10]。PCR扩增产物由生工生物工程(上海)股份有限公司纯化后测序,随后将测序结果提交到美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,利用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比较。
1.3.4 分析检测方法
中性蛋白酶活、酸性蛋白酶活的测定:参考SB/T10317—1999《蛋白酶活力测定》[11];淀粉酶活的测定:参考文献[12];纤维素酶活的测定:参考文献[13]。
pH的测定:采用精密pH计;总酸和氨基酸态氮含量的测定:采用滴定法[14];还原糖含量的测定:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[15]。
游离氨基酸和有机酸的测定:采用高效液相色谱法[15]。
总酚含量的测定:采用福林酚比色法[16];总黄酮含量的测定:采用氯化铝比色法[17]。抗氧化能力的测定:采用1,1-二 苯 基-2-三 硝 基 苯 肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法和铁离子还原/抗氧化能力(ferric reducing antioxidant power,FRAP)测定[18]。
1.3.5 数据处理与统计分析
所有实验均重复3次,实验数据使用Excel 2022、SPSS 19.0和Origin 2022软件处理。
2 结果与分析
2.1 多菌株协同制曲对成曲品质的影响
2.1.1 接种不同菌株制曲过程中微生物活菌数的动态变化
接种不同菌株制曲过程中主要微生物活菌数的变化见图1。由图1可知,接种不同菌株制曲的过程中,米曲霉的活菌数均呈先上升后稳定的趋势;黑曲霉活菌数变化均不明显,在制曲过程中保持稳定数量,在42 h后明显下降;而乳酸菌的活菌数均呈先升高后下降的趋势。制曲至42 h时,AA组成曲与AAP组成曲的米曲霉活菌数分别比A组低0.30和0.48个数量级,而AAP组成曲中黑曲霉的活菌数比AA组高0.13个数量级,说明在制曲过程中添加黑曲霉3.350与戊糖足球菌WT9对米曲霉沪酿3.042的生长有影响,黑曲霉和米曲霉之间可能存在竞争关系,并且添加戊糖足球菌WT9还能促进黑曲霉3.350的生长。AA组成曲中乳酸菌活菌数低于A组1.63个数量级,但AAP组成曲乳酸菌活菌数则比A组高2.35个数量级。这可能是因为黑曲霉3.350与米曲霉发生竞争时,影响了成曲中乳酸菌的生长代谢,而AAP组的戊糖足球菌能够快速适应制曲环境,成为成曲中的优势乳酸菌。有研究表明,黑曲霉通过快速生长可能辅助降低曲料局部氧气浓度,为乳酸菌创造更适宜的微环境[19]。因此,利用黑曲霉3.350和戊糖足球菌WT9协同米曲霉沪酿3.042进行混菌制曲可以显著提高成曲中功能微生物的活菌数,为酱油的发酵提供一定的微生物基础。
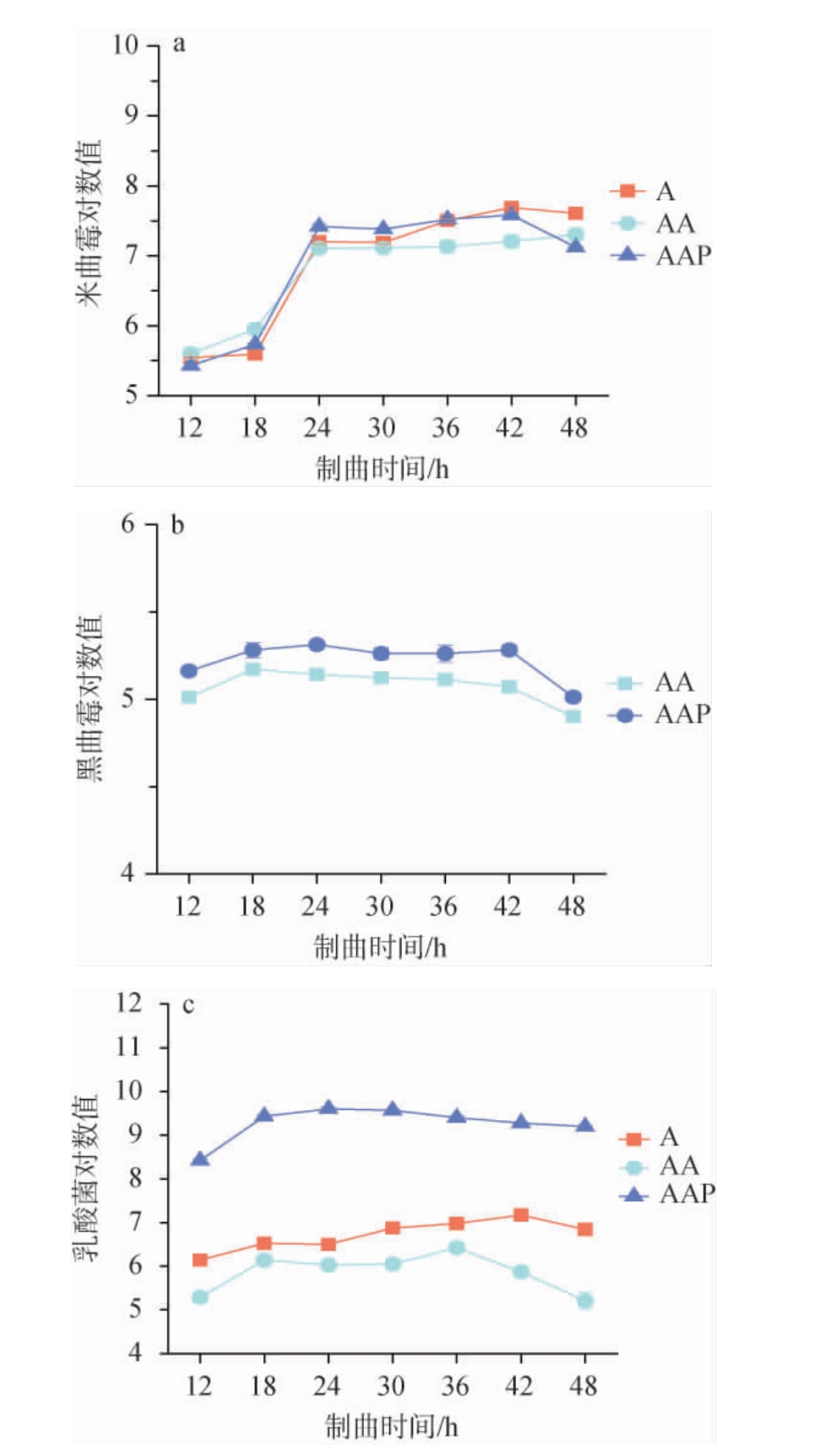
图1 接种不同菌株制曲过程主要微生物活菌数的变化
Fig.1 Changes in viable counts of main microorganisms during the process of koji-making by inoculating different strains
2.1.2 接种不同菌株制曲过程中酶系的动态变化
接种不同菌株制曲过程中酶系的变化见图2。由图2可知,接种不同菌株制曲过程中,蛋白酶活力均呈先升高后下降的趋势,纤维素酶活力则持续上升,淀粉酶活力变化并不明显。当制曲至48 h时,与A组相比,AA组和AAP组成曲的中性蛋白酶活力分别提高了34.40%和27.73%,酸性蛋白酶活力分别提高了18.68%和27.52%,淀粉酶活力则分别提高了109.21%和79.53%,纤维素酶活力分别比A组高8.74%和7.46%。此外,与AA组成曲相比,AAP组成曲的淀粉酶活力较低,其他酶活力差异较小。结果表明,通过戊糖足球菌WT9和黑曲霉3.350协同米曲霉沪酿3.042制曲,能够提高成曲中性蛋白酶、酸性蛋白酶、淀粉酶和纤维素酶的活力水平,有助于促进酱油发酵过程原料中蛋白质和碳水化合物的分解。
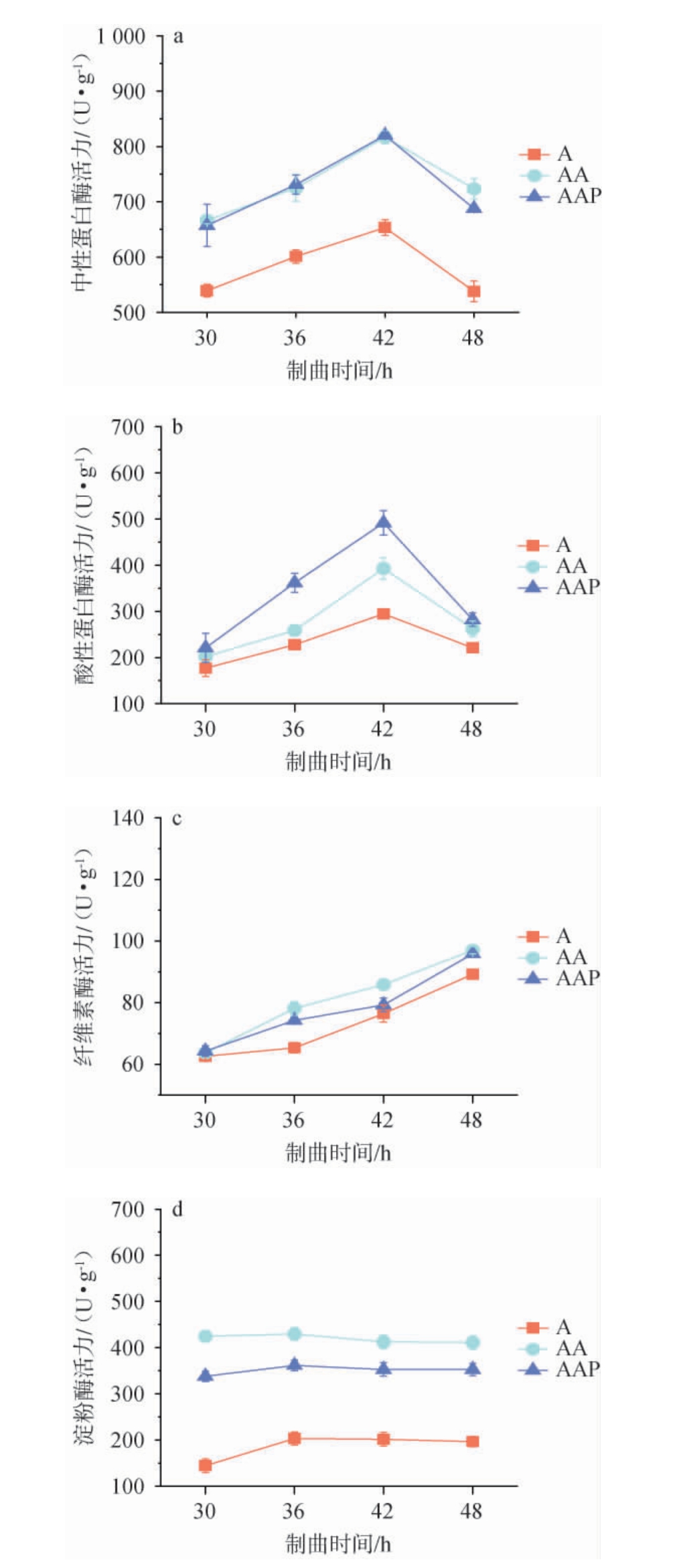
图2 接种不同菌株制曲过程中酶活力的变化
Fig.2 Changes in enzyme activities during the process of koji-making by inoculating different strains
2.1.3 接种不同菌株制曲过程中总酚和总黄酮含量的变化
接种不同菌株制曲过程中总酚和总黄酮含量的变化见图3。由图3可知,接种不同菌株制曲过程中,总酚和总黄酮含量均呈升高趋势,且AAP组成曲总酚和总黄酮含量均最高。与A组和AA组相比,AAP组的总酚含量分别提高了9.65%和6.02%,总黄酮含量则分别提高了11.04%和22.76%。结果表明,通过黑曲霉3.350与戊糖足球菌WT9协同米曲霉沪酿3.042进行制曲,能够明显提高成曲中总酚和总黄酮含量,从而增加酱油中的功能组分。这可能是由于混菌制曲使得成曲中酶系种类增多或相关水解酶活力的提高,有助于原料中的酚酸物质的释放[20]。孙莉等[21]研究也发现,融合魏斯氏菌(Weissella confusa)与米曲霉混合制曲发酵的酱油中多酚和总黄酮含量均得到了显著提高,本研究结果与其相一致。
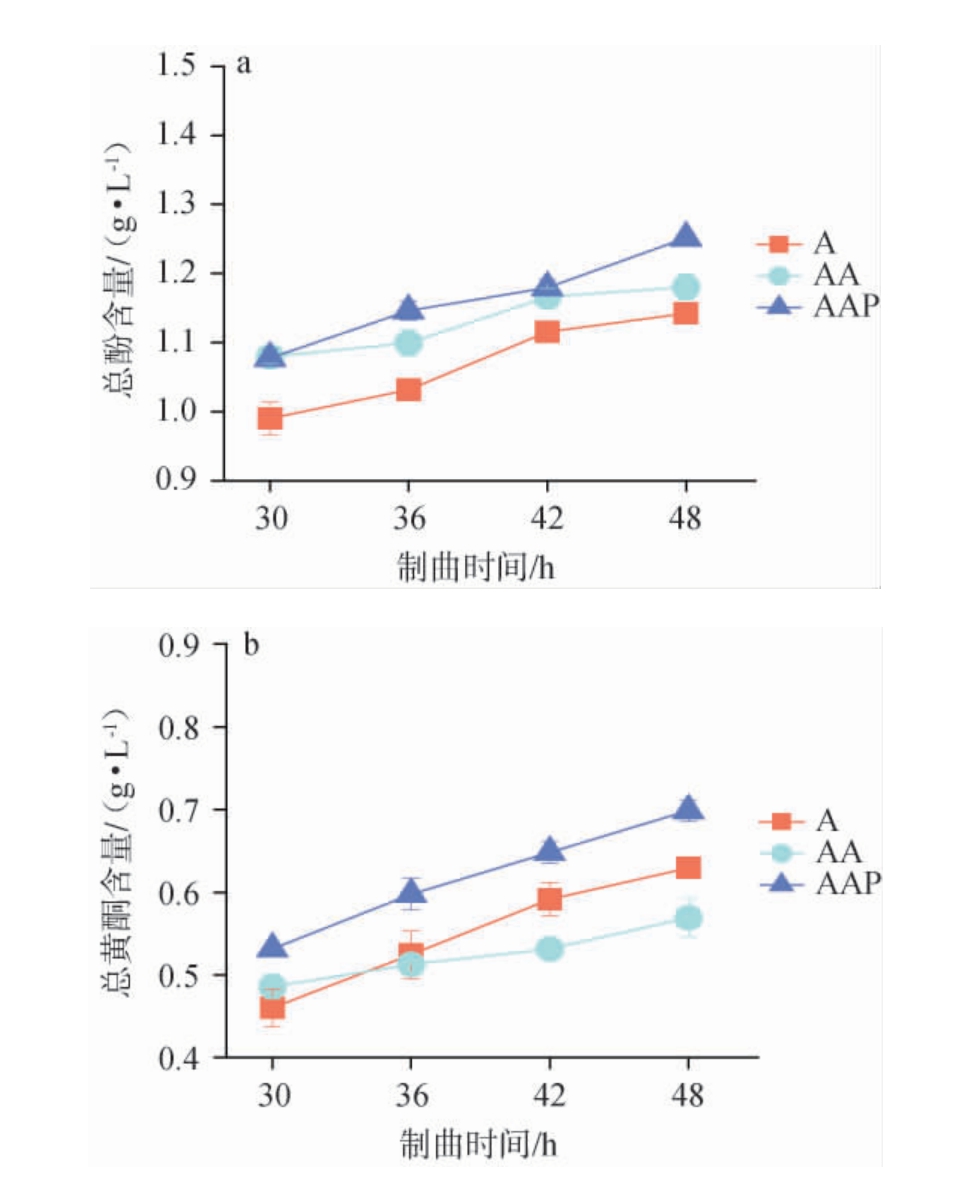
图3 接种不同菌株制曲过程中总酚及总黄酮含量的变化
Fig.3 Changes in total phenols and total flavonoids contents during the process of koji-making by inoculating different strains
2.2 多菌株协同制曲对酱油品质的影响
2.2.1 多菌株协同制曲对酱油微生物活菌数的影响
不同菌株协同制得的成曲投入盐水发酵后,对酱油发酵过程中主要微生物活菌数的变化见图4。由图4可知,采用不同成曲发酵酱油过程中,总细菌活菌数均在发酵初期略有波动后趋于稳定,而乳酸菌活菌数均在发酵初期迅速上升,随后逐渐下降,尤其是在发酵20 d后A组和AA组的乳酸菌活菌数急剧下降,酵母菌活菌数均呈先升高后趋于稳定的趋势。AAP组的总细菌数最高,其次是AA组和A组,AA组酱油发酵过程中总细菌活菌数与A组没有明显差异;AAP组乳酸菌活菌数高于AA组和A组,且在发酵20 d前AA组高于A组;发酵30 d之后,AAP组及AA组酵母菌活菌数高于A组,且AAP组高于AA组。结果表明,黑曲霉3.350协同米曲霉沪酿3.042制曲对酱油发酵过程总细菌活菌数没有明显影响,黑曲霉3.350和戊糖足球菌WT9协同米曲霉沪酿3.042制曲可增加酱油发酵体系内乳酸菌活菌数,并对酱醪酵母菌的生长有促进作用。因此,通过戊糖足球菌协同制曲可显著增加酱醪体系中乳酸菌的活菌数,有助于优化酱油发酵过程中的微生物群落结构,增强乳酸菌的代谢作用,从而提高酱油发酵品质[9]。
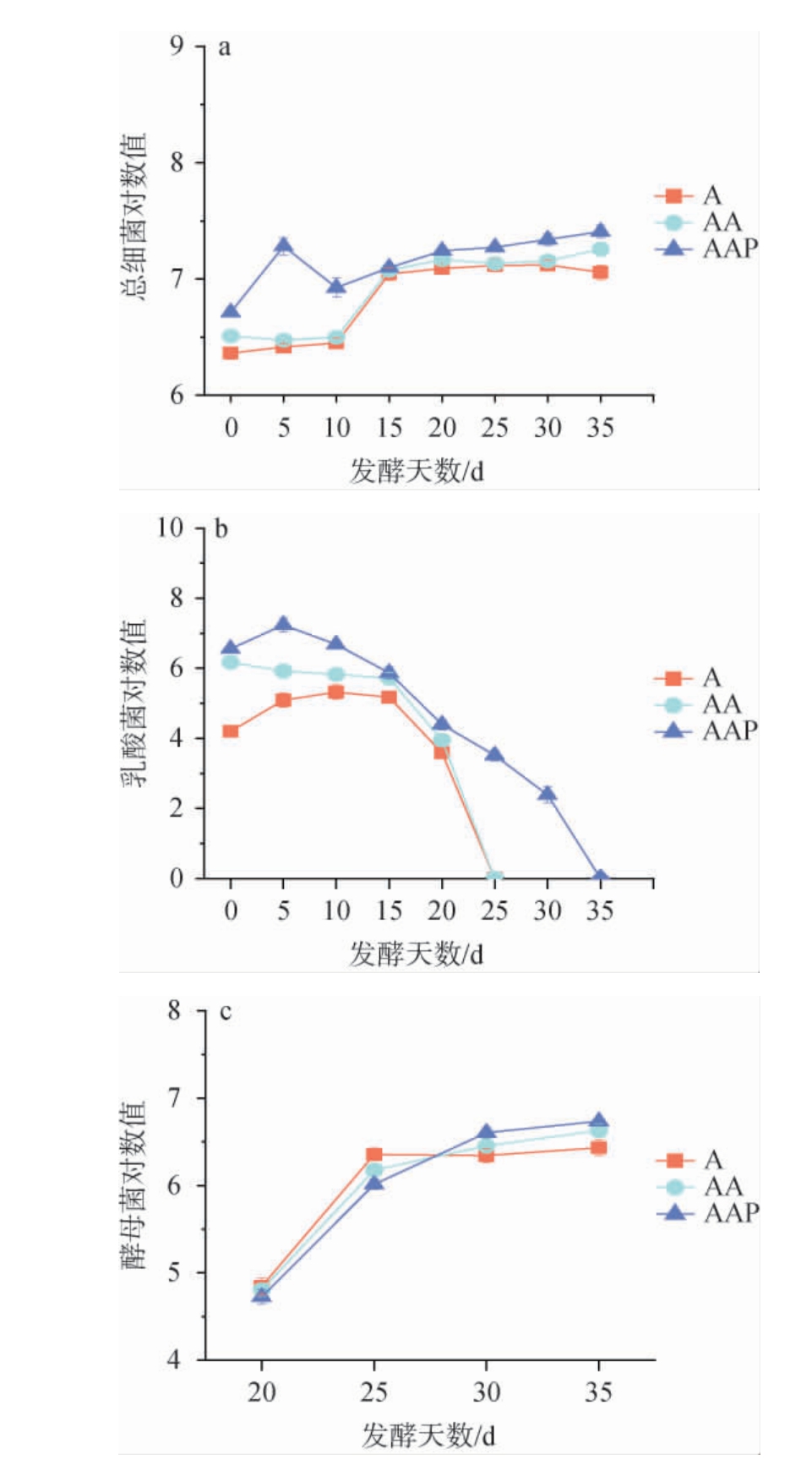
图4 多菌株协同制曲对酱油微生物活菌数的影响
Fig.4 Effect of multi-strain collaborative koji-making on the viable microorganisms counts in soy sauce
2.2.2 多菌株协同发酵对酱油基本理化指标的影响
不同菌株协同制得的成曲投入盐水发酵后,对酱油发酵过程中总酸含量、氨基酸态氮含量、pH和还原糖含量的变化见图5。

图5 多菌株协同制曲对酱油基本理化指标的影响
Fig.5 Effect of multi-strain collaborative koji-making on the basic physiochemical indicators of soy sauce
由图5可知,在酱油发酵过程中,总酸含量均随时间延长而上升,其中AAP组增长最快,至发酵35 d达到最高值;氨基酸态氮含量均在发酵初期迅速上升后趋于稳定,AAP组在发酵20 d后略高于A组和AA组;pH值均在发酵初期迅速下降后趋于稳定,AAP组pH值最低;还原糖含量均呈先升高后下降的趋势,均在发酵20 d时达到峰值,且AAP组的峰值最高。发酵结束时,AAP组的总酸含量分别比A组、AA组高12.50%、5.50%,氨基酸态氮含量则分别高19.61%、4.84%,还原糖含量则分别高69.23%、9.54%。结果表明,添加黑曲霉3.350和戊糖足球菌WT9协同米曲霉沪酿3.042制曲能使得酱油原料中的营养物质更加充分释放,增加酱油的总酸、氨基酸态氮和还原糖含量。这可能是由于混菌制曲使得成曲中酶系种类增多或相关水解酶活力的提高,促进酱油发酵过程原料中营养物质的分解和转化。有研究证明,米曲霉B-2与黑曲霉FND-A47进行混菌制曲发酵时,其还原糖含量较米曲霉B-2单菌发酵提高了40.56%[3];米曲霉、黑曲霉进行双菌种组合发酵,其氨基酸态氮含量较米曲霉发酵组也提高了9.48%[22],本研究结果与其相一致。
2.2.3 多菌株协同制曲对酱油有机酸和游离氨基酸含量的影响
不同菌株协同制得的成曲投入盐水发酵后,对酱油有机酸和游离氨基酸含量的影响见图6。
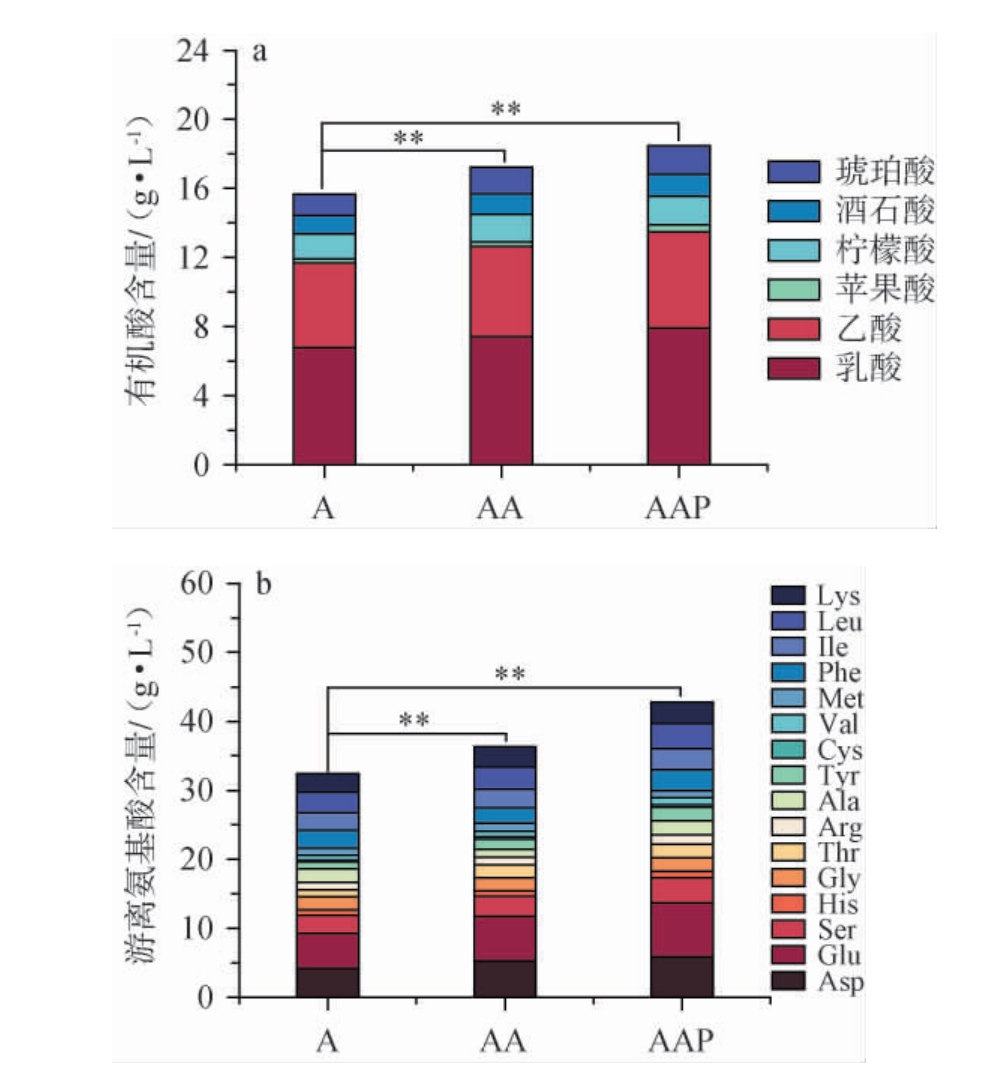
图6 多菌株协同制曲对酱油中有机酸和游离氨基酸含量的影响
Fig.6 Effect of multi-strain collaborative koji-making on the contents of organic acids and free amino acids in soy sauce
“**”表示差异极显著(P<0.01)。下同。
由图6可知,各组别的有机酸和游离氨基酸含量存在极显著差异(P<0.01)。AAP组的有机酸含量最高,AA组次之,A组最低。AAP组的有机酸含量分别比A组和AA组提高了16.25%和7.20%。AAP组的游离氨基酸总量最高,AA组次之,A组最低。AAP组的游离氨基酸含量分别比A组和AA组提高了31.87%和17.85%,其中鲜味氨基酸(谷氨酸、天冬氨酸)则分别提高39.23%、18.74%,甜味氨基酸(丝氨酸、丙氨酸、苏氨酸和甘氨酸)分别提高34.22%、28.72%。上述结果表明,添加黑曲霉3.350和戊糖足球菌WT9协同米曲霉沪酿3.042制曲能够增加酱油有机酸和游离氨基酸含量,提高酱油发酵品质。有研究利用米曲霉和黑曲霉混合制曲,可使酱油的游离氨基酸和谷氨酸含量分别提高了5.97%和10.40%[23],本研究结果与其相一致。
2.2.4 多菌株协同制曲对酱油总酚、总黄酮含量和抗氧化能力的影响
不同菌株协同制得的成曲投入盐水发酵后,对酱油总酚、总黄酮含量和抗氧化活性的影响见图7。
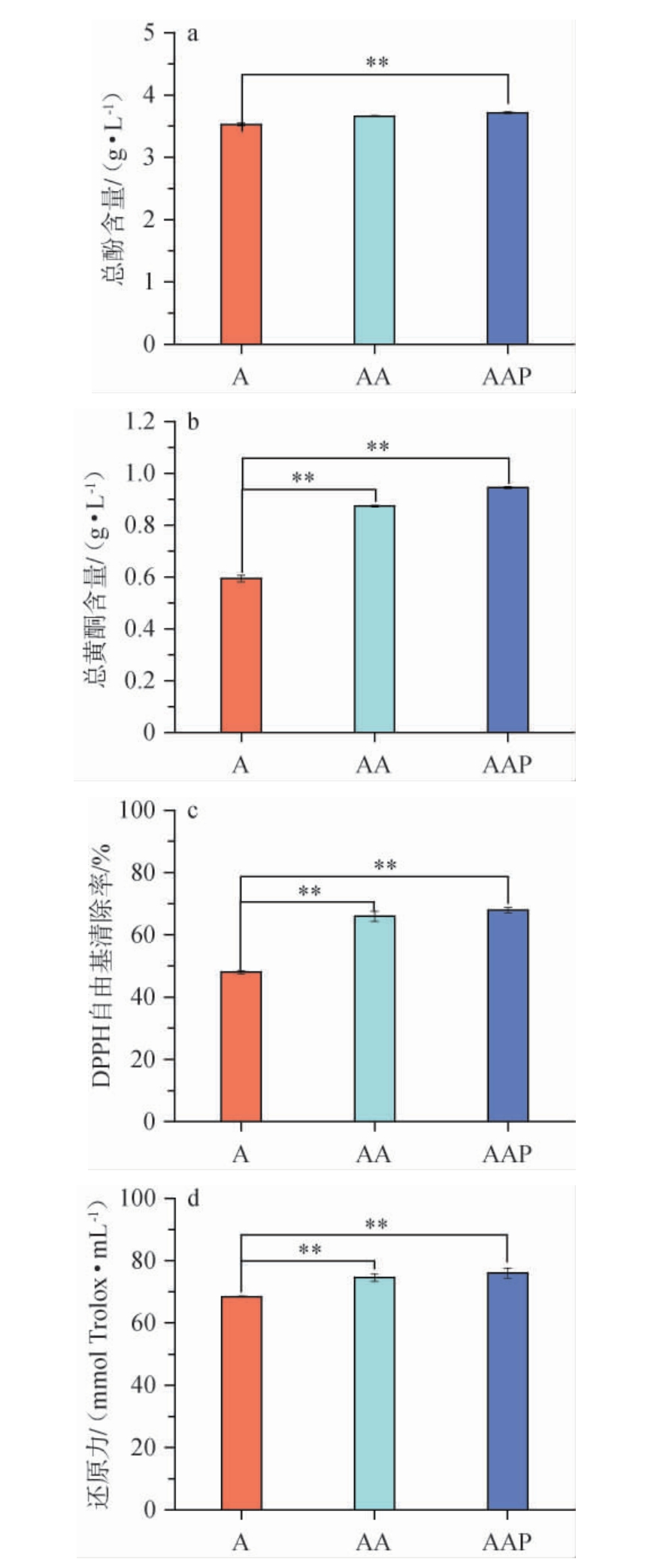
图7 多菌株协同制曲对酱油总酚、总黄酮含量及抗氧化能力的影响
Fig.7 Effect of multi-strain collaborative koji-making on the contents of total phenols, total flavonoids and antioxidant capacity in soy sauce
由图7可知,除AA组总酚含量与AAP组和A组无显著差异外(P>0.05),其他指标均为AAP组、AA组极显著高于A组(P<0.01),且AAP组极显著高于AA组(P<0.01)。AAP组的总酚含量分别比A组和AA组高8.12%和1.71%,总黄酮分别高59.09%和8.13%,DPPH自由基清除率分别高41.79%和3.01%,还原力分别高10.95%和1.91%。结果表明,添加黑曲霉3.350和戊糖足球菌WT9协同米曲霉沪酿3.042制曲不仅能显著增加酱油的总酚和总黄酮含量,还可以有效增强酱油的抗氧化能力,AAP组的效果最佳。这可能是因为添加黑曲霉3.350和戊糖足球菌WT9协同米曲霉沪酿3.042制曲后产生的丰富酶系有助于酱油原料的酚酸和黄酮的转化和释放。酱油中的总多酚和总黄酮的含量与其抗氧化性之间存在着明显的正相关性[24]。有研究利用利用植物乳杆菌(Lactobacillus plantarum)和米曲霉进行混菌制曲,其发酵所得酱油的总酚与总黄酮含量分别提高了28.68%、121.50%[25],本研究结果与其相一致。
3 结论
本研究采用黑曲霉3.350与戊糖足球菌WT9协同米曲霉沪酿3.042制备的成曲及酱油综合品质最好,与单一米曲霉沪酿3.042制备的成曲相比,其成曲中性蛋白酶、酸性蛋白酶、淀粉酶、纤维素酶活力分别提高27.73%、27.52%、79.53%、7.46%,总酚和总黄酮含量分别提高9.65%、11.04%。与单一米曲霉沪酿3.042制曲发酵酱油相比,其酱油中总酸、氨基酸态氮及还原糖含量分别提高12.50%、19.61%和69.23%,有机酸和游离氨基酸含量分别提高16.25%和31.87%,总酚、总黄酮含量分别提高8.12%和59.09%,DPPH自由基清除率与还原力分别提高41.79%和10.95%,综上,利用米曲霉沪酿3.042、黑曲霉3.350与戊糖足球菌WT9进行协同制曲,能够提高成曲的酶系活力,进而促进酱油发酵过程中营养物质的释放与转化,提升酱油的发酵品质和抗氧化能力。该研究可为优化酱油生产工艺和改善酱油品质提供理论参考。
[1]赵炫.酱油鲜味肽的分离鉴定及其定向酶解制备研究[D].广州:华南理工大学,2019.
[2]LIU Y H,SUN G,LI J,et al.Starter molds and multi-enzyme catalysis in koji fermentation of soy sauce brewing:A review[J].Food Res Int,2024,184:114273.
[3]郑博.混菌制曲发酵对酱油品质影响的研究[D].天津:天津科技大学,2016.
[4]林涵玉.紫红曲霉改善高盐稀态酱油风味作用及机理分析[D].广州:华南理工大学,2020.
[5]李琴,杜风刚.双菌种制曲在酱油生产中的应用[J].中国调味品,2003(12):36-38.
[6]王宪斌,冯霞,刘义,等.多菌种制曲在酱油发酵中的研究进展[J].食品与发酵科技,2016,52(3):60-64.
[7]PENG M Y,LIU J Y,HUANG Y,et al.Effects of a mixed koji culture of Aspergillus oryzae HG-26 and Aspergillus niger HG-35 on the levels of enzymes, antioxidants and phenolic compounds in soy sauce during the fermentation process[J].Int J Food Sci Technol,2017,52(7):1585-1593.
[8]中华人民共和国国家卫生和计划生育委员会.GB 4789.15—2016 食品安全国家标准 食品微生物学检验 霉菌和酵母计数[S].北京:标准出版社,2016.
[9]李佳莲.耐盐乳酸菌的益生特性及其在食品发酵中的应用[D].无锡:江南大学,2023.
[10]范林旭.高产蛋白酶米曲霉的筛选及其在豆瓣酱中的应用[D].无锡:江南大学,2022.
[11]国家国内贸易局.SBT 10317—1999 蛋白酶活力测定[S].北京:中国标准出版,1999.
[12]周佳慧,林礼钊,吴惠贞,等.酱醪中耐盐高产酶菌株的筛选、分离和鉴定及其生化特性分析[J].中国调味品,2022,47(12):1-6,12.
[13]党敏娜.高盐稀态酱油发酵菌种的选育及工艺改良研究[D].广州:暨南大学,2005.
[14]中华人民共和国国家卫生和计划生育委员会.GB 5009.235—2016 食品中氨基酸态氮的测定[S].北京:中国标准出版社,2016.
[15]HU G Y,CHEN J,FANG F,et al.Moromi mash dysbiosis trigged by salt reduction is relevant to quality and aroma[J].Food Chem, 2023, 406:135064.
[16]ATTRI P, JODHA D, GANDHI D, et al.In vitro evaluation of Pediococcus acidilactici NCDC 252 for its probiotic attributes[J].Int J Dairy Technol,2015,68(4):533-542.
[17]DO T K, DUNG T N, ELZAAWELY A A, et al.Phenolic profiles and antioxidant activity of germinated legumes[J].Foods,2016,5(2):27.
[18]冯拓,单培,盛明健,等.5种不同酱油抗氧化活性的对比分析[J].现代食品科技,2022,38(3):159-167,313.
[19]梁昌聪,汪军,黄俊生,等.一种黑曲霉和乳酸菌复合发酵的方法CN202311801582.9[P].2024-03-29.
[20]曾小波,宋小焱,朱新贵,等.高盐稀态法酿制酱油的抗氧化研究[J].中国酿造,2009,28(1):131-133.
[21]孙莉,胡文康,黄瑶,等.非耐盐乳酸菌与米曲霉共生酿造酱油的研究[J].中国调味品,2020,45(5):13-18.
[22]程会欣.不同米曲霉和黑曲霉菌株组合发酵酱油的研究[D].保定:河北大学,2010.
[23]GAO X L,ZHAO H F,FENG Y Z,et al.A comparative study on physicochemical properties of Chinese-type soy sauces prepared using pure koji and mixed kojis[J].Afr J Biotechnol,2010,9:6740-6747.
[24]杨春晖,王文平,续丹丹,等.不同原料酿造酱油功能成分及抗氧化活性比较[J].食品工业科技,2023,44(14):318-325.
[25]ZHANG X,LIU Z,KANG B,et al.Effect of Lactobacillus plantarum or Enterococcus faecalis as co-inoculants with Aspergillus oryzae in koji making on the physicochemical properties of soy sauce[J].J Food Sci,2022,87(2):714-727.