酿酒酵母(Saccharomyces cerevisiae)作为第一个完成基因组测序的真核生物,也是目前应用广泛的真核模式生物。由于其易于培养、生长迅速、遗传操作简单,以及绿色安全的特点,目前在合成生物学应用领域当中,被认为是最佳的工程细胞之一[1]。研究高葡萄糖环境下酿酒酵母的生存能力并筛选长寿菌种,可为工业高密度发酵、生物乙醇生产等场景的工程菌种开发提供理论支持。酿酒酵母具有良好的生长特性和发酵能力,可在恶劣环境条件下生长,并对温度、pH值等胁迫压力有较好的耐受性,因此常用作高密度发酵(high cell density culture,HCDC)的菌种,高密度发酵作为提高微生物工业发酵生产效率、产量的重要培养技术,所用菌种多为基因工程菌,生产高附加值物质,具有高效率,短周期,高产量,低成本的特性[2]。
在以酿酒酵母为模式生物的衰老研究体系中,时序寿命(chronological lifespan,CLS)定义为静止期细胞处于营养耗竭的非增殖状态下维持活性的时间,它反映了非分裂细胞的生存能力,类似高等动物的静止细胞(如神经等)衰老,与复制寿命(母细胞分裂次数)不同。研究酵母时序寿命有助于揭示衰老的基本分子机制(如营养感知、氧化应激),因其简单、经济、遗传操作方便。许多在酵母中发现的衰老路径(如TOR、p38 MAPK)在高等生物中保守,为理解人类衰老和开发干预策略提供基础[3]。
在高葡萄糖培养条件下,可以培养更多的酵母数,获得更多有益代谢物,如更多的生物乙醇等,从而应对气候变化和推动环境可持续发展。但酵母菌在高葡萄糖环境下,其糖酵解途径(glycolysis)反应失衡,中间产物积累和三磷酸腺苷(adenosine triphosphate,ATP)生成减少[4];由高糖浓度触发的渗透胁迫会导致细胞结构受损、代谢途径中断和细胞功能障碍[5-6];产生的高浓度乙酸和乙醇等物质,会抑制酶活性,影响代谢途径,诱导氧化应激等[7-8]。因此,高葡萄糖环境下酿酒酵母生长速度降低,延滞期变长,糖利用不完全[9],严重缩短酵母的存活率,大大降低发酵生产效率,进而影响高密度发酵所能达到的最大细胞密度,降低高密度发酵的效率,直接制约着高葡萄糖环境下高密度发酵的应用和经济效益。
适应性实验室进化(adaptive laboratory evolution,ALE)与代谢工程相比,适应性实验室进化不需要考虑胞内复杂的代谢网络,只需根据目标设计对应的干扰因素,因而具有适用性广和实用性强的优点[10-11],该技术已筛选出可持续生产生物乙醇的酵母[12],耐醋酸酿酒型[13]与提高酿酒酵母生产类胡萝卜素的能力[14]的酵母等,但仍存在自然突变率低、进化周期长、遗传背景不清[15-16]等问题。
本研究通过在实验室条件下对酿酒酵母施加长时间的高糖胁迫,进行为期一个月的驯化,筛选得到耐高葡萄糖培养环境的长寿酿酒酵母菌种。通过酵母时序寿命检测方法,验证酵母在高葡萄糖培养环境下的存活率,是酵母寿命的重要指标。采用邻甲苯胺法与微量法检测发酵液内葡萄糖和酒精的含量,通过酶标仪测定波长660 nm处吸光度值(OD660nm值)分析酵母细胞在酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)、合成营养缺陷(synthetic dropout,SD)和高糖SD培养基中的生长速度和总生物量,对比野生型酿酒酵母BY4742,综合评估高糖环境下筛选的酵母菌种的时序寿命、生长特性与发酵能力,最终得到高葡萄糖培养环境下的长寿酿酒酵母菌种。本研究旨在为高糖环境下筛选长寿酵母菌种提供新的思路及研究方法,提高酵母工业发酵的生产效益。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
YSC1054 MATα BY4742单基因敲除酿酒酵母库(包含5 055个单基因敲除的菌株)、野生型酿酒酵母BY4742:美国Dharmacon公司。
1.1.2 化学试剂
葡萄糖(分析纯):上海阿拉丁生物试剂公司;葡萄糖检测试剂盒(O-toluidine法):上海碧云天生物技术有限公司;乙醇含量检测试剂盒(微量法):北京博奥森生物技术有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:葡萄糖100 g/L,蛋白胨20 g/L,酵母浸粉10 g/L。121 ℃灭菌20 min。
YPD固体培养基:葡萄糖100 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,琼脂20 g/L。121 ℃灭菌20 min。
SD液体培养基:酵母基础氮源1.7 g/L,硫酸铵5 g/L,尿嘧啶100 mg/L、L-组氨酸100 mg/L、L-亮氨酸300 mg/L、L-赖氨酸盐酸盐150mg/L、腺嘌呤80mg/L、L-精氨酸40mg/L、L-天冬氨酸100 mg/L、L-谷氨酸100 mg/L、L-蛋氨酸80 mg/L、L-苯丙氨酸50 mg/L、L-丝氨酸400 mg/L、L-苏氨酸200 mg/L、L-色氨酸200 mg/L、L-酪氨酸40 mg/L、L-缬氨酸150 mg/L、L-异亮氨酸60 mg/L。使用前加入葡萄糖溶液,终葡萄糖质量浓度为20 g/L。121 ℃灭菌20 min。
高糖SD液体培养基:SD液体培养基使用前加入葡萄糖溶液(600 g/L葡萄糖),终葡萄糖质量浓度为300 g/L。121 ℃灭菌20 min。
1.2 仪器与设备
Pico17型微量离心机:美国赛默飞世尔公司;H1850型小型离心机:湖南湘仪实验室仪器开发有限公司;T100型PCR热循环仪:美国BIO-RAD公司;MQD-S2HR型振荡培养箱:上海旻泉仪器有限公司;HW-200G型微孔板恒温振荡器:上海沪析实业有限公司;Master-S15UVF型实验室纯水系统:上海和泰仪器有限公司;EPOCH2型酶标仪:美国安捷伦公司;VORTEX-5型旋涡混合器:海门其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 高葡萄糖培养环境下酿酒酵母菌种的筛选
从-80 ℃冰箱取出野生型酿酒酵母BY4742和包含5 055个单基因敲菌株混合酵母库,取5 μL分别接种至1 mL YPD培养基,在30 ℃、220 r/min摇床条件培养48 h。取5 μL接种至1 mL高糖SD培养基,在30 ℃、220 r/min摇床条件下振荡培养30 d。根据预实验结果,从第14天开始,每隔4 d取样稀释10倍后平板涂布在YPD固体培养基上,30 ℃恒温箱培养48 h,观察并统计菌群数量。培养30 d后,对第30天YPD固体培养基上的菌落总数进行排序,在野生型酿酒酵母BY4742组与单基因敲除酵母库组中,各选取单菌落最多的培养皿,分别挑选4、8个单菌落,作为第一轮适应性实验室进化筛选得到的酿酒酵母菌种。
使用第一轮适应性实验室进化筛选得到的菌种,按照上述方法,继续进行第二轮筛选。培养36 d后,对第30天YPD固体培养基上的单菌落数进行排序,选取单菌落最多的两个培养皿,分别挑选4、6个单菌落共10个单菌落,作为高葡萄糖培养环境下酿酒酵母初步筛选菌种。
1.3.2 种子液的制备
取出冻存的野生型酿酒酵母BY4742和初步筛选酿酒酵母菌种,分别划线接种至YPD固体培养基上,30 ℃静置培养48 h。挑选单菌落接种至1 mL YPD液体培养基,在30 ℃、220 r/min摇床条件下振荡培养48 h,使用去离子水稀释10倍,再将11个菌种稀释到OD660 nm值为0.2,即得种子液,4 ℃冰箱保存。
1.3.3 酵母时序寿命、生长延滞时间和数量倍增时间分析
使用本实验室开发的酵母寿命测定高通量方法[17-18]。取5μL种子液,接种至1mL高糖SD培养基,在30℃、220r/min摇床条件下振荡培养。第5、10天取5 μL菌液,使用96孔板,接种至100 μL YPD液体培养基上,使用酶标仪在30 ℃、567 r/min线性振荡条件下,每隔5 min在660 nm波长处测定OD660nm值,将得到的数据进行酵母时序寿命分析,得出菌种在第5、10天的相对存活率,生长延滞时间(lag time)和数量倍增时间(doubling time),以野生型酿酒酵母BY4742为对照组,比较连续两次适应性实验室进化得到的酿酒酵母菌种在高葡萄糖培养环境下的时序寿命差异和其他特性差异。
相对存活率、生长延滞时间和数量倍增时间计算公式如下[17]:
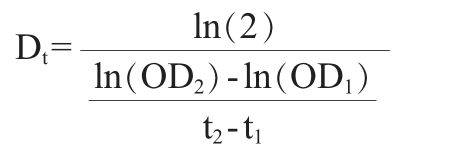
式 中:Dt为 数 量 倍 增 时 间,min;OD1、OD2为 间 于0.2~0.4的OD660 nm值;t1为检测OD1的时间点,min;t2为检测OD2的时间点,min。
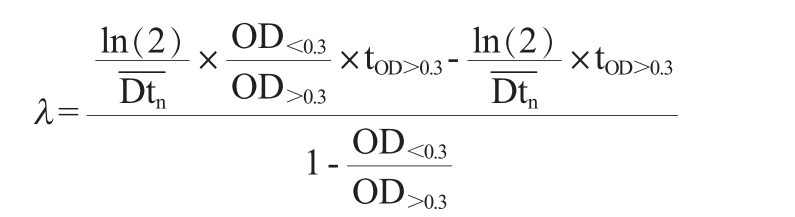
式中:λ为生长延滞时间,min;OD>0.3为OD660 nm值首次高于0.300 1的具体OD660nm值;OD<0.3为OD660nm最后一次低于0.300 1的具体OD660 nm值;tOD>0.3为检测的时间点,min;tOD<0.3为检测的时间点,min;Dtn为数量倍增时间,min。
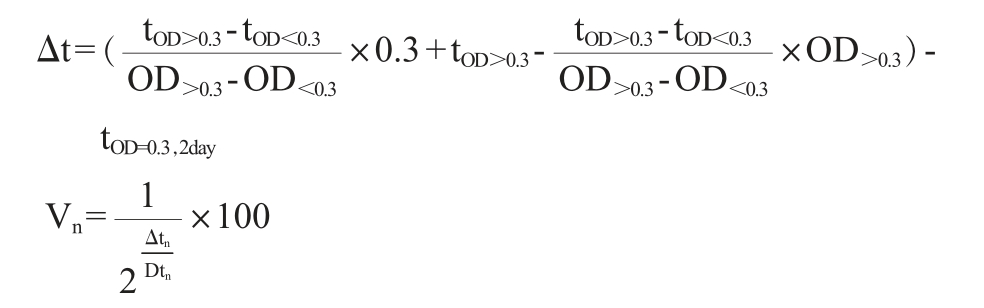
式中:Δt为从初始时间点到OD值达到0.3的时间差(用以量化细胞的延迟时间),min;tOD=0.3,2day为OD660 nm值为0.3的初始时间点,min;Vn为第n天的相对存活率,%。
1.3.4 发酵体系葡萄糖含量测定
葡萄糖含量使用葡萄糖检测试剂盒测定。
葡萄糖标准曲线绘制:使用质量浓度为200 g/L葡萄糖标准溶液,用去离子水梯度稀释至葡萄糖质量浓度分别为20 g/L、16 g/L、12 g/L、8 g/L、4 g/L、2 g/L、1 g/L,涡旋混合后加入检测试剂,95 ℃反应8 min后冷却至4 ℃,使用酶标仪在630 nm波长处测定OD630 nm值。以葡萄糖质量浓度(x)为横坐标,OD630nm值(y)为纵坐标绘制葡萄糖标准曲线,得到标准曲线回归方程y=1 181x-125.86,相关系数R2=0.990 2。
根据上述标准曲线回归方程计算出相应发酵体系内的葡萄糖含量。以野生型酵母BY4742为对照组,比较连续两次适应性实验室进化得到的菌种在消耗葡萄糖能力上是否与野生型有差异。
1.3.5 发酵体系乙醇含量测定
使用乙醇含量检测试剂盒(微量法)。取检测葡萄糖含量的同高糖SD培养基体系中的菌液20 μL,离心并取上清液,用去离子水稀释100倍并涡旋混合均匀,检测其体系内同期第1、4、10天的酒精含量。根据说明书检测步骤以试剂盒内同体积标准乙醇样品为标准样,同体积去离子水为空白样,加入反应液后37 ℃避光孵育10 min,使用酶标仪,在波长450 nm处测定反应前后OD450nm值,将得到的数据代入公式(乙醇含量(μmol/mL)=(ΔOD450 nm测定-ΔOD450 nm空白)×0.5÷(ΔOD450nm标准-ΔOD450nm空白)×F(F为稀释倍数)),计算出相应发酵体系内的乙醇含量。以野生型酿酒酵母BY4742为对照组,比较连续两次适应性实验室进化得到的菌种在发酵产生酒精能力上是否与野生型有差异。
1.3.6 生长速度测定
取5 μL种子液,使用96孔板,分别接种至100 μL YPD培养基、100 μL SD培养基和100 μL高糖SD培养基,使用酶标仪在30 ℃、567 r/min振荡条件下,每隔5 min在波长660 nm处测定OD660nm值,以时间为横坐标,OD660 nm值为纵坐标,绘制生长曲线。以野生型酿酒酵母BY4742为对照组,比较筛选菌种在三种培养基中的生长特性差异。
1.3.7 总生物量测定
取5 μL种子液,使用96孔板,分别接种至100 μL YPD培养基、100 μL SD培养基和100 μL高糖SD培养基,在30 ℃、1 000 r/min微孔板振荡培养4 d。第2、3、4天,使用酶标仪在660 nm波长处测定OD660nm值,以野生型酿酒酵母BY4742为对照组,比较筛选菌种在该3种培养基内的总生物量。
1.3.8 数据处理与统计分析
使用Excel 2019、GraphPad Prism 9.0软件对数据进行分析处理。每种菌种进行4组生物学重复,结果以“平均值±标准差”形式表示。
2 结果与分析
2.1 高葡萄糖培养环境下长寿酿酒酵母菌种的筛选
完成连续两轮适应性实验室进化的筛选后,得到存活菌落数最多的单基因敲除酵母库、野生型酿酒酵母BY4742的筛选菌株,第一批及第二批筛选酿酒酵母菌种的菌落形态见图1。由图1A、1B可知,第一批筛选得到的菌株,在第30天时,存活菌落分为12、11个;由图1C、1D可知,第二轮筛选得到的菌株较第一轮的同系菌株在第30天的存活菌落数分别提升了100、10倍,以野生型酿酒酵母BY4742为原材料的菌株菌落多于以单基因敲除酿酒酵母库为原材料的菌株;由图1E、1F可知,这两系菌株在第36天仍有存活菌落,且以野生型酿酒酵母BY4742为原材料的菌株菌落远远多于以单基因敲除酿酒酵母库为原材料的菌株,单基因敲除酵母库系仅有3个存活菌落,而野生型酿酒酵母BY4742系有上百个存活菌落,其生存能力远远超过了单基因敲除酵母,猜测野生型酿酒酵母BY4742系在高糖环境下发生了多基因突变从而很好适应了高葡萄糖环境。
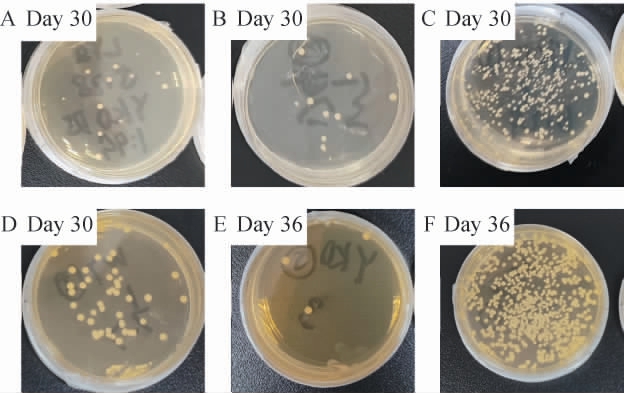
图1 第一批及第二批筛选酿酒酵母菌种的菌落形态
Fig.1 Colony morphology of the first batch and the second batch screening Saccharomyces cerevisiae strains
A:第一批筛选以单基因敲除酿酒酵母库为原材料的菌株;B:第一批筛选以野生型酿酒酵母BY4742为原材料的菌株;C,F:第二批筛选以野生型酿酒酵母BY4742为原材料的菌株;D,E:第二批筛选以单基因敲除酿酒酵母库为原材料的菌株。
这个现象验证了单基因敲除不能改善高葡萄糖环境下酿酒酵母的存活率,与单基因敲除会破坏酿酒酵母分布式鲁棒性(distributed robustness)的推测是吻合的[19]:敲除某个重要基因,酵母基因组中无相似功能的基因进行功能代偿,导致酵母的生存能力严重下降;敲除某个功能冗余基因,酵母基因组功能代偿的能力下降,导致酵母生存能力部分下降。后续实验以野生型酿酒酵母BY4742系中存活菌落数最多的两个子系中分别挑选4、6个单菌落,编号为W2-1~W2-10,得到筛选的高葡萄糖培养环境下长寿酿酒酵母菌种。
2.2 酵母时序寿命、生长延滞时间和数量倍增时间分析
以野生型酿酒酵母BY4742为对照组,对酵母菌株W2-1~W2-10进行时序寿命、生长延滞时间和数量倍增时间分析,结果见图2。
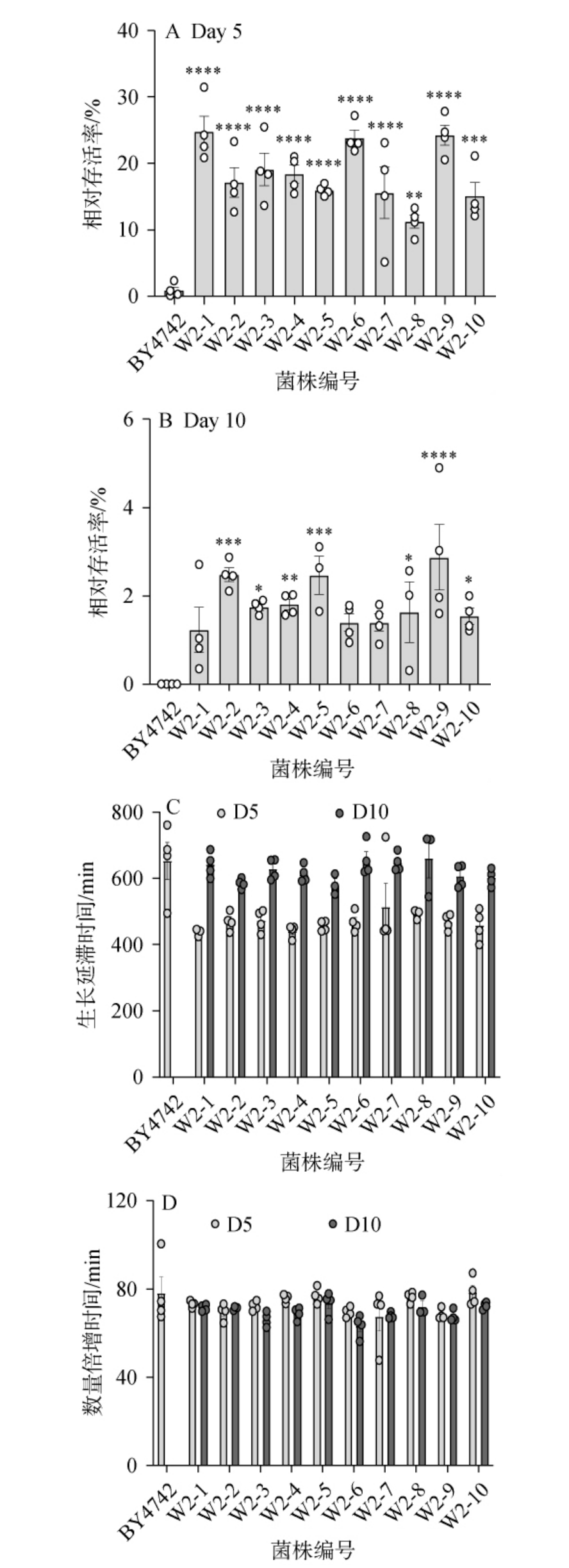
图2 筛选酵母的时序寿命分析结果
Fig.2 Analysis results of chronological lifespan of the screened yeast strains
A:酵母在300 g/L葡萄糖环境下第5天的相对存活率;B:酵母在300 g/L葡萄糖环境下第10天的相对存活率;C:酵母第5、10天的生长延滞时间;D:酵母第5、10天的数量倍增时间。
“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01);“***”表示差异高度显著(P<0.001);“****”表示差异非常显著(P<0.000 1)。下同。
由图2A可知,在高葡萄糖环境下培养第5天时,菌株BY4742的相对存活率仅有(1.23±0.89)%,所有第二批得到的酵母的相对存活率,均为BY4742组的10倍以上,W2-8差异极显著(P<0.01),W2-10差异高度显著(P<0.001),其余菌种差异非常显著(P<0.000 1)。
由图2B可知,在高葡萄糖环境下培养第10天时,BY4742已不能检出相对存活率数值(<0.1%),菌株W2-2,W2-5,W2-9组的相对存活率仍>2%。这表明该条件下菌株W2系的活力强于菌株BY4742,时序寿命大于菌株BY4742,说明通过适应性实验室进化,可以筛选得到耐高葡萄糖环境的长寿酵母菌种。
由图2C可知,由于第10天BY4742组在培养20 h后OD660nm<0.2,无法得到生长延滞时间(lag time)的数据,其余组在第10天时的生长延滞时间均较第5天的同种酵母有显著上升,W2-7、W2-8差异显著,W2-5、W2-10差异极显著,其余菌种差异高度显著,这说明W2系酵母适应新环境能力会随着高糖培养时间增长而显著下降,也说明长时间高糖环境培养会导致酵母适应能力、活力显著下降,但仍优于野生型酿酒酵母BY4742。
由图2D可知,第10天菌株BY4742组在培养20 h后OD660 nm值<0.2,无法得到数量倍增时间(doubling time)数据,高葡萄糖环境下,W2系酵母数量倍增时间不随高糖培养时间增长而显著变化,W2系各种酵母菌种间数量倍增的时间无显著差异,说明这些酵母的生长速度不随高糖环境筛选、高糖培养时间而发生显著变化。
2.3 高葡萄糖发酵体系的葡萄糖及酒精含量分析
以野生型酿酒酵母BY4742为对照组,测定酵母菌株W2-1~W2-10高糖SD培养基发酵体系中的葡萄糖含量及酒精浓度,结果见图3。
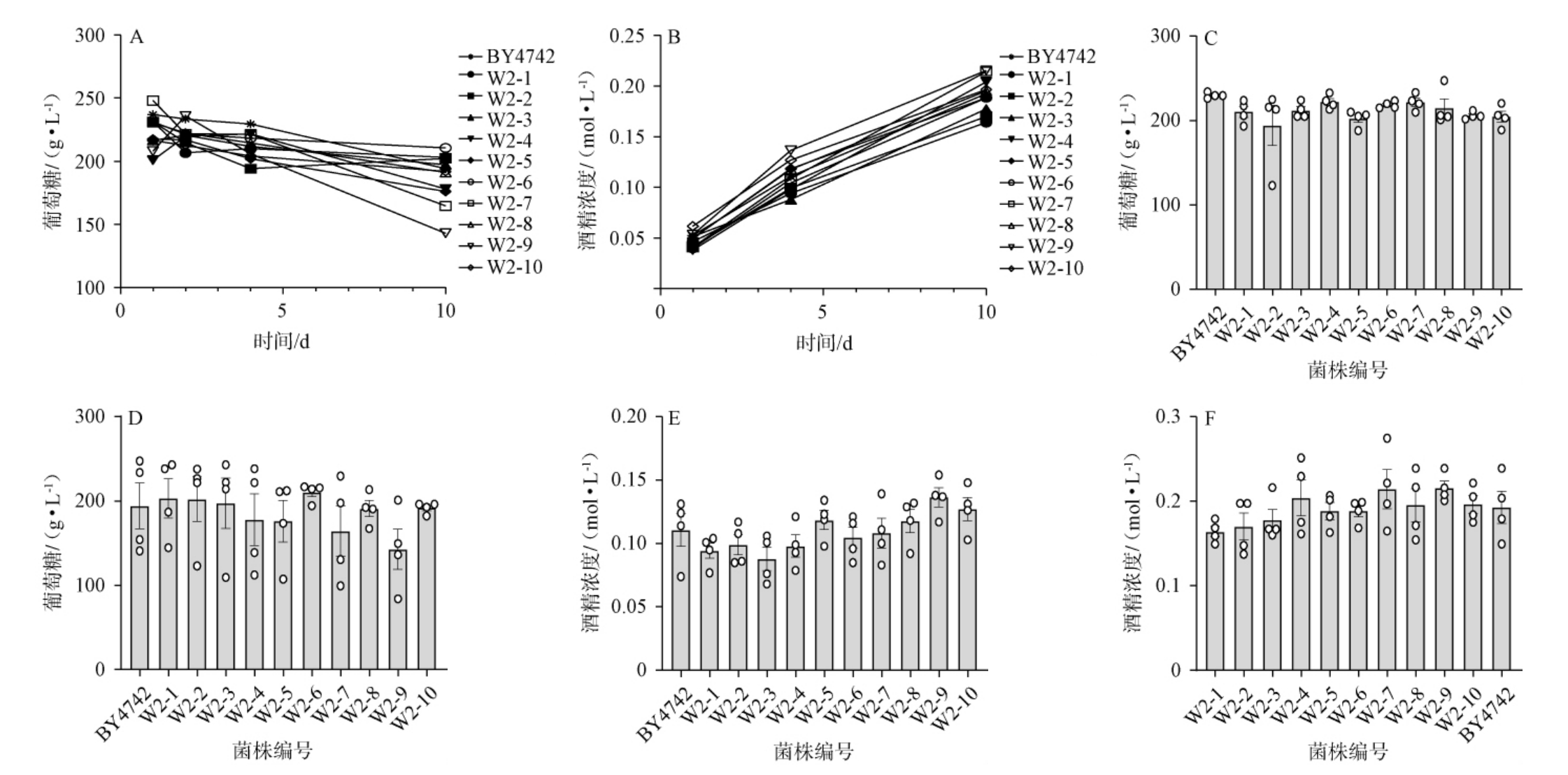
图3 高葡萄糖发酵体系中葡萄糖含量及酒精度
Fig.3 Glucose contents and alcohol content in high-concentration glucose fermentation system
A:葡萄糖含量变化曲线;B:酒精浓度变化曲线;C、D:发酵第4、10天葡萄糖含量;E,F:发酵第4、10天酒精浓度。
由图3A可知,发酵体系内葡萄糖含量均在第1天大幅下降,在第2、4天以后趋于平稳,呈现相似的趋势,葡萄糖变化曲线反映了酵母葡萄糖消耗的强弱,葡萄糖含量在第1天和第2天有较大的差异,可能是菌种的生长特性和进入稳定期的时间导致的。这也说明高葡萄糖发酵体系下筛选菌种代谢葡萄糖的能力没有下降。
由图3B可知,发酵体系内的酒精浓度均在前四天快速上升,第4天到第10天上升速度减缓,各菌种酒精浓度曲线呈现相同的趋势,说明筛选菌种在高葡萄糖发酵体系中发酵产生酒精的能力与野生型酵母并无显著差异。在相同时间下,筛选菌种的产生酒精能力略强于野生酵母,这也与葡萄糖的消耗速度曲线互为佐证。
由图3C可知,在第4天时,除W2-2组发酵体系内的葡萄糖含量为194 g/L,其余组发酵体系内的葡萄糖含量略高于200 g/L,野生型酿酒酵母BY4742组葡萄糖含量最高,为230 g/L。
由图3D可知,在第10天时,W2-1、W2-2、W2-6组发酵体系内的葡萄糖含量分别为203 g/L、203 g/L、210 g/L,其余组组发酵体系内的葡萄糖含量<200 g/L,W2-9组葡萄糖含量最低,为137 g/L。
由图3E可知,在第4天时,W2-1、W2-2、W2-3、W2-4组发酵体系内的酒精浓度低于0.1 mol/L,其余组发酵体系内的酒精浓度均高于0.1 mol/L,W2-9组发酵体系内的酒精浓度最高,为0.137 mol/L。
由图3F可知,在第10天时,所有发酵体系内的酒精浓度均高于0.15 mol/L,野生型酿酒酵母BY4742组发酵体系内的酒精浓度最低,为0.164 mol/L,W2-9组发酵体系内的酒精浓度最高,为0.216 mol/L。
综上可知,通过适应性实验室进化筛选得到的长寿酿酒酵母,并会略微增强酵母的葡萄糖发酵能力。
2.4 不同培养环境下酵母生长速度比较分析
以野生型酿酒酵母BY4742为对照组,比较酵母菌株W2-1~W2-10在YPD培养基、SD培养基和高糖SD培养基三种发酵体系中的生长速度,结果见图4。

图4 筛选组酵母在不同培养基条件下的生长曲线、生长延滞时间和数量倍增时间
Fig.4 Growth curves, growth lag time and quantity doubling time of the screened yeast strains under different medium conditions
A:在YPD培养基中的生长曲线;B:在SD培养基中的生长曲线;C:在高糖SD培养基中的生长曲线;D:酵母生长延滞时间;E:酵母数量倍增时间。
由图4A可知,在YPD培养基中,各菌种进入对数期,稳定期的时间大致相似,各生长曲线之间的趋势是相似的,仅有菌株W2-9在到达稳定期后,OD660 nm值仍保持小幅上升并高于其他同期菌种。由图4B可知,在SD培养基中,除菌株W2-1以外,其他菌种的生长曲线的趋势是相似的,相同时间内各菌种间OD660nm值仅有很小的差距,都在接近20 h时进入稳定期,而菌株W2-1在20 h后仍然处在对数生长期。由图4C可知,在高糖SD培养基中,除菌株W2-1以外,各菌种各生长曲线之间的趋势是类似的,但由于高葡萄糖环境影响,所有菌种均有更长的延滞期,都未能进入稳定期,W2-1组受到的影响最大。由图4D可知,除W2-1、W2-5,其余菌种在YPD培养基中的生长延滞时间均略长于SD培养基内,更快适应SD培养基环境。由图4E可知,所有菌种的数量倍增时间在YPD培养基中的均极显著短于SD培养基(P<0.01),YPD培养基更有利于这些菌种的分裂。
综上,所有筛选均在YPD培养基中生长速度最快,高糖SD培养基中生长最慢。与野生型酿酒酵母BY4742相比,筛选菌株除W2-1组外,在三种培养基,均有相似的生长曲线,筛选菌种生长速度大部分都略慢于菌株BY4742,也说明这些酵母需要更长时间才能完成一次分裂,在消耗葡萄糖速度并不降低的情况下,这些长寿酵母菌种可能会因积累更多保护性物质,有更多的响应机制,而有稍长的细胞周期。这与长寿酵母细胞将更多能量分配给维持和修复机制,导致细胞周期延长,较野生型酵母生长更慢的结论吻合[20-21]。
2.5 不同培养环境下酵母总生物量比较分析
以野生型酿酒酵母BY4742为对照组,比较酵母菌株W2-1~W2-10在YPD培养基、SD培养基和高糖SD培养基三种发酵体系中的不同时间OD660nm值,代表对应菌株的总生物量,结果见图5。由图5A和5B可知,在YPD培养基中,筛选菌种在第2、3天的OD660 nm值总体上略低于野生型BY4742,除菌株W2-1组在第2、3天OD660nm值高度显著低于菌株BY4742(P<0.001),其余菌种在第2、3天的OD660 nm值均与野生型酿酒酵母BY4742无显著差异(P>0.05)。由图5C和5D可知,在SD培养基中,部分筛选菌株第2天的OD660 nm值显著高于菌株BY4742组(P<0.05);第3天的OD660 nm值,除菌株W2-9组显著低于BY4742组(P<0.05),其余菌种并无显著差异(P>0.05)。根据培养液中葡萄糖浓度的分析推测,可能是SD培养基中葡萄糖快速耗尽导致的酵母自噬的结果。由图5E和5F可知,在高糖SD培养基中,菌株W2-6、W2-10组的OD660 nm值在第2、3天均显著高于菌株BY4742(P<0.05),其余菌种的均值也都高于野生型酿酒酵母BY4742。
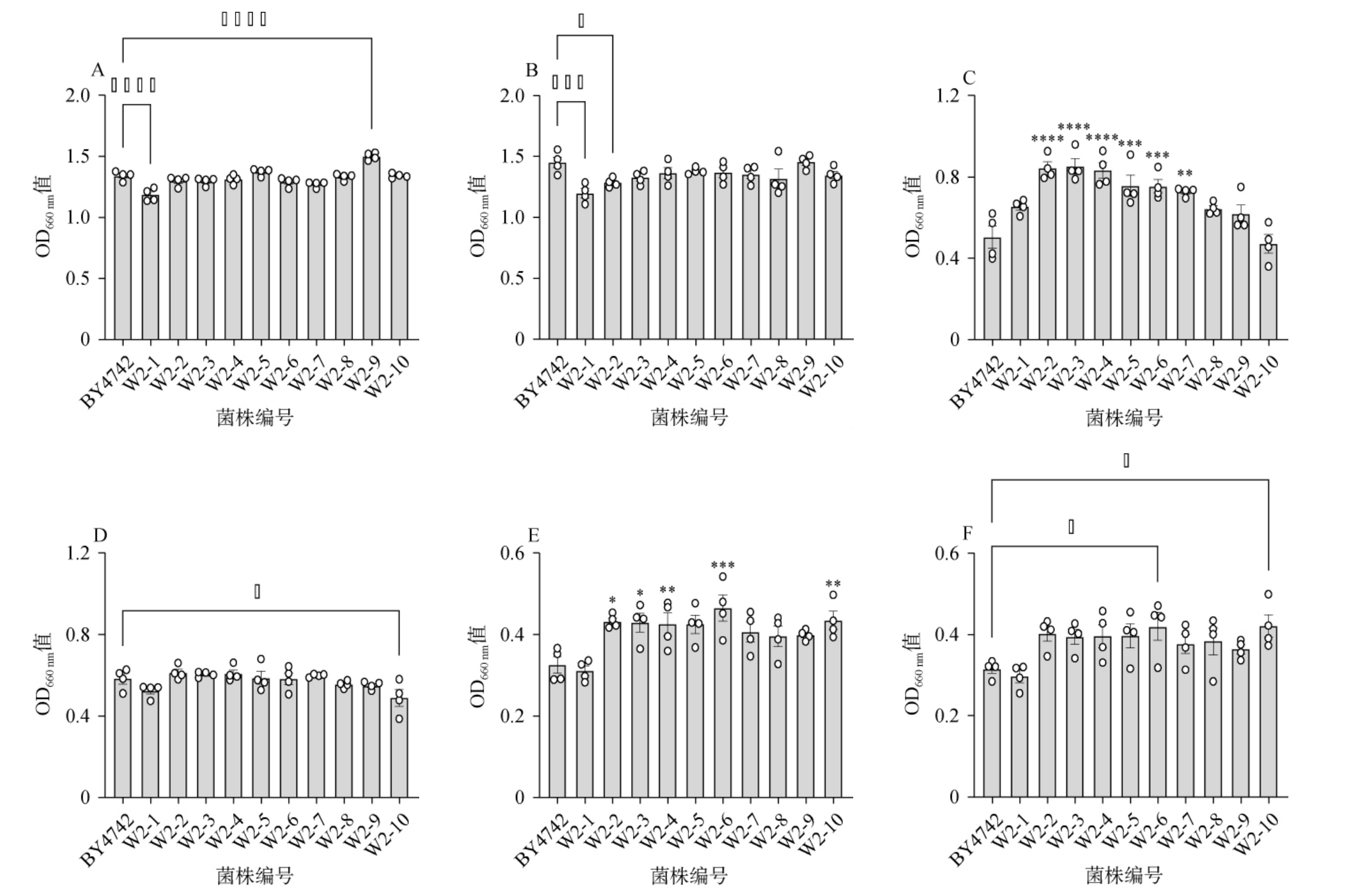
图5 不同培养基条件下筛选酵母的总生物量
Fig.5 Total biomass of the screened yeast strains under different medium conditions
A和B:酵母在YPD培养基中培养第2、3天的OD660 nm值;C和D:酵母在SD培养基中培养第2、3天的OD660 nm值;E和F:酵母在高糖SD培养基中培养第2、3天的OD660 nm值。
综上,筛选菌种在SD及高糖SD培养基中总生物量高于野生型,而YPD培养基中则无显著差异,说明这些菌种更适应类SD培养基环境,这可能是适应性实验室进化在SD培养基环境下驯化得到的优势。高糖SD培养基总生物量的优势说明这些筛选菌种可以达到更大的总生物量,这对高密度发酵等工业生产实践的菌种选育具有积极意义。
3 讨论
经过连续两轮适应性实验室进化的筛选,得到了能在高浓度葡萄糖的SD培养基环境下生存的10个长寿菌株,对菌株进行了时序寿命、生长特性和葡萄糖发酵能力测定分析,这些筛选酵母在第5天较野生型酿酒酵母BY4742的存活率平均提高了20.43倍,其中菌株W2-9存活率最高,是野生型的26.74倍;在发酵10 d时,野生型酿酒酵母BY4742已不能检测出相对存活率,而筛选酵母相对存活率平均可达1.79%,其中菌株W2-9相对存活率最高,为(2.88±1.28)%。同时筛选菌种的生长特性和葡萄糖发酵能力较野生型并无显著变化,在高糖SD培养基中的总生物量平均为野生型酿酒酵母BY4742的1.25倍,这表明适应性实验室进化可以有效筛选出高糖环境下的长寿酿酒酵母,并提高生物量。
这些长寿酵母能在高浓度葡萄糖胁迫下保持生长和发酵,对高密度发酵等工业生产具有重要应用价值。自然驯化、适应性实验室进化作为重要的耐高糖酵母筛选办法[22],同样适合高葡萄糖培养环境下长寿菌种的筛选。本研究发现,适应性实验室进化技术在筛选长寿酵母的效果显著;而在筛选酵母的生长速度、代谢和发酵能力上的效果并不显著;同时也在提高酵母的适应力和总生物量方面,有较好的效果。相比野生型酵母,这些高葡萄糖培养环境下长寿酿酒酵母菌种,可能会产生更严重的葡萄糖阻遏作用,降低利用其他碳源的效率[23]。
适应性实验室进化可能通过关键基因的多拷贝化增强菌株的鲁棒性,如HSP家族基因扩增[24],从而增强了酵母对应环境的适应能力[25-26]。多拷贝数基因,也可能导致更复杂的高葡萄糖胁迫响应机制,使酵母有更长的细胞周期,关键代谢路径受到影响,降低葡萄糖发酵能力。分解葡萄糖的糖酵解途径,也可能因基因改变而被打破[27]。这些长寿菌株背后的机理仍需进一步探索。传统的基因编辑育种技术,如Tup1基因缺失[28],过表达ELM1基因[29]等来增强酵母应对高糖胁迫的能力,筛选面不够广而费时费力,同时单基因敲除缓解高糖胁迫的能力有限。而适应性实验室进化过程中可能存在的问题包括:自然突变率低、进化周期长、遗传背景不清晰等,同样降低了筛选特定环境下酵母的效率。适应性实验室进化应与全基因组测序相结合,可为微生物学基础研究和微生物育种提供广阔前景,也是相关研究未来的可能方向之一。
4 结论
以野生型酿酒酵母BY4742为进化材料,通过两轮适应性实验室进化,得到了10株在高葡萄糖培养环境下的长寿菌种。在高葡萄糖环境下筛选菌株的生存能力和适应能力显著提升,在第5天的存活率是野生型酿酒酵母BY4742的20.43倍,并在第10天仍保持平均1.79%的相对存活率,同时筛选菌株的生长特性和葡萄糖发酵能力较野生型酿酒酵母并无显著变化,在高糖环境总生物量可达为野生型酿酒酵母的1.25倍。W2-9组在第5天的存活率可达野生型酿酒酵母BY4742的26.74倍,并在第10天保持最高的相对存活率,可达2.88%,同时在第4天、第10天分别为发酵体系内生产酒精最多(0.216 mol/L)与剩余葡萄糖最少(137 g/L)的菌种。本研究结果表明,适应性实验室进化可高效筛选耐高糖长寿酿酒酵母菌株,为工业发酵中高糖胁迫环境下的菌种选育提供了可推广的技术路径。本研究选择出的最优菌株,值得进一步的开发研究。
[1]LIU Z H,ZHANG Y P,NIELSEN J.Synthetic biology of yeast[J].Biochemistry,2019,58(11):1511-1520.
[2]董胜胜,陈鹏.酿酒酵母高密度发酵技术的研究进展[J].饲料研究,2022,45(5):146-149.
[3]POWERS R W,KAEBERLEIN M,CALDWELL S D,et al.Extension of chronological life span in yeast by decreased TOR pathway signaling[J].Genes Dev,2006,20(2):174-184.
[4]VAN HEERDEN J H, WORTEL M T, BRUGGEMAN F J, et al.Nongrowing cells lost in transition: start-up of glycolysis yields subpopulations of nongrowing cells[J].Science,2014,343(6174):987.
[5]CHEN A Q,QU T Z,SMITH J R,et al.Osmotic tolerance in Saccharomyces cerevisiae:Implications for food and bioethanol industries[J].Food Biosci,2024,60:104451.
[6]GOMAR-ALBA M, MORCILLO-PARRA M Á, DEL OLMO M·L.Response of yeast cells to high glucose involves molecular and physiological differences when compared to other osmostress conditions[J].FEMS Yeast Res,2015,15(5):fov039.
[7]AZHAR S H M,ABDULLA R,JAMBO S A,et al.Yeasts in sustainable bioethanol production:A review[J].Biochem Bioph Rep,2017,10:52-61.
[8]LAM F H,GHADERI A,FINK G R,et al.Biofuels.Engineering alcohol tolerance in yeast[J].Science,2014,346(6205):71-74.
[9]PIDDOCKE M P,KREISZ S,HELDT-HANSEN H P,et al.Physiological characterization of brewer's yeast in high-gravity beer fermentations with glucose or maltose syrups as adjuncts[J].Appl Microbiol Biotechnol,2009,84(3):453-464.
[10]王光路,王梦园,刘兰茜,等.适应性实验室进化在工业生产菌种选育中应用的进展[J].微生物学通报,2022,49(1):306-322.
[11]DRAGOSITS M, MATTANOVICH D.Adaptive laboratory evolutionprinciples and applications for biotechnology[J].Microb Cell Fact,2013,12:64.
[12]HEMANSI,HIMANSHU,PATEL A K,et al.Development of multiple inhibitor tolerant yeast via adaptive laboratory evolution for sustainable bioethanol production[J].Bioresource Technol, 2022, 344(Part B):126247.
[13]SÁNCHEZ-ADRIÁ I E,SANMARTÍN G,PRIETO J A,et al.Adaptive laboratory evolution for acetic acid-tolerance matches sourdough challenges with yeast phenotypes[J].Microbiol Res,2023,277:127487.
[14]GARRIGÓS V, PICAZO C, MATALLANA E, et al.Activation of the yeast retrograde response pathway by adaptive laboratory evolution with S-(2-aminoethyl)-L-cysteine reduces ethanol and increases glycerol during winemaking[J].Microb Cell Fact,2024,23:231.
[15]GODARA A,RODRIGUEZ M A G,WEATHERSTON J D,et al.Beneficial mutations for carotenoid production identified from laboratoryevolved Saccharomyces cerevisiae[J].J Ind Microbiol Biot, 2019, 46(12):1793-1804.
[16]MIRISOLA M G,LONGO V D.Yeast chronological lifespan:longevity regulatory genes and mechanisms[J].Cells,2022,11(10):1714.
[17]WU Z Y,SONG L X,LIU S Q,et al.A high throughput screening assay for determination of chronological lifespan of yeast[J].Exp Gerontol,2011,46(11):915-922.
[18]WANG L P,WU Z Y.A simple high-throughput technology for microorganism detection and quantitative analysis[J].Foods,2024,13(18):2954.
[19]GRAHAM J H,ROBB D T,POE A R.Random phenotypic variation of yeast (Saccharomyces cerevisiae) single-gene knockouts fits a double pareto-lognormal distribution[J].PLoS One,2012,7(11):e48964.
[20]MAIR W,DILLIN A.Aging and survival:The genetics of life span extension by dietary restriction[J].Annu Rev Biochem,2008,77:727-754.
[21]FONTANA L, PARTRIDGE L, LONGO V D.Extending healthy life span-from yeast to humans[J].Science,2010,328(5976):321-326.
[22]朱宝生,刘功良,白卫东,等.耐高糖酵母筛选及其高糖胁迫机制的研究进展[J].中国酿造,2016,35(6):11-14.
[23]吴迪,程艺超,姜娇,等.酵母中葡萄糖阻遏作用机制研究进展[J].微生物学,2023,63(9):3409-3427.
[24]CONDIC N,AMIJI H,PATEL D,et al.Selection for robust metabolism in domesticated yeasts is driven by adaptation to Hsp90 stress[J].Science,2024,385(6707):eadi3048.
[25]兰雪,张斯童,李哲,等.微滴数字PCR技术在多拷贝木聚糖酶酿酒酵母工程菌筛选中的应用[J].食品科学,2018,39(10):179-184.
[26]董聪,高庆华,王玥,等.基于联合策略提高FAD依赖的葡萄糖脱氢酶的酵母表达[J].生物技术通报,2023,39(6):316-324.
[27]QIN N,LI L Y,JI X,et al.Flux regulation through glycolysis and respiration is balanced by inositol pyrophosphates in yeast[J].Cell,2023,186(4):748-763.
[28]陈英,芦志龙,张穗生.Tup1基因缺失对酿酒酵母耐高糖性状的影响[J].广西科学,2020,36(3):338-343.
[29]李建,孔婧,李圣龙,等.适应性实验室进化技术在微生物育种中的应用进展[J].生物工程学报,2021,37(1):130-141.