木质纤维素类生物质(lignocellulosic biomass,LCB)是地球上丰富的可再生资源,主要包括农业废弃物、林业残余物以及专门的能源作物等,其中,中国秸秆产量较大达到10亿t/年[1]。因LCB非常稳定的多聚物结构,难以进行有效预处理,其转化利用受到很大限制[2-4]。目前,LCB原料预处理方法主要有粉碎与研磨、高温处理、碱处理、生物处理和组合预处理等[5],不同方式导致转化效率差异很大[6]。其中大部分预处理方式均需要添加酸、碱、氨、有机溶剂或离子液体等化学试剂,且需要一定高温高压条件和相应特殊反应设备[7],过程中产生甲酸、乙酸和糠醛等抑制物,不仅预处理成本过高,且不利于生物质工业化转化[8]。
生物处理主要利用细菌、真菌和放线菌等微生物代谢活动,分泌内切葡萄糖苷酶、β-葡萄糖苷酶和β-1,4内切木聚糖苷酶,破坏生物质细胞壁结构[9-10],具有强度低、耗能少等特点,可有效降低成本[11],但存在转化限制的阻碍。有效解决此问题的手段主要是通过将纤维素类聚合物单独水解成可发酵糖,降低原料利用与转化过程中所需纤维素酶的负荷[12]。FANG X X等[13]开发出合成微生物群落DM-1(包括天山中慢生根瘤菌属(Mesorhizobium),纤维化纤维菌属(Cellulosimicrobium),痰潘多拉菌属(Pandoraea),无色杆菌属(Achromobacter)和嗜麦芽窄食单胞菌属(Stenotrophomones)),能有效降解树木中的木质素和纤维素,降解率分别为28.7%和10.2%。FELIPUCI J P等[14]利用密褐褶菌(Gloeophyllum trabeum)CBMAI 0872和粉孢革菌(Coniophora puteana)CBMAI 0870对甘蔗渣进行生物预处理,低聚木糖转化率达到78.56%。中温大曲是中国传统白酒酿造中的核心糖化发酵剂,含有丰富微生物群落(如霉菌、酵母菌、细菌)和酶系(如淀粉酶、蛋白酶、纤维素酶等),可以将酿造原料中纤维素转化为可发酵性糖,还能破坏原料细胞壁结构促使淀粉释放[15]。因此,中温大曲在LCB生物转化领域具有一定的应用潜力。
为降低成本、减少化学品使用及降低处理强度,达到高效转化的目的,本研究将中温大曲接种至干玉米秸秆(dry corn stover,DCS)中,采用厌氧发酵方式对DCS进行预处理以降解DCS的木质纤维素,并对预处理过程(0~28 d)中的有机酸、pH值及纤维素组分进行检测,通过高通量测序分析木质纤维素降解过程中细菌和真菌菌群,对其结果进行主坐标分析(principal co-ordinates analysis,PCoA),并通过单因素和响应面试验对大曲厌氧预处理干玉米秸秆进行酶解工艺条件优化,旨在评估大曲在干玉米秸秆预处理方面的可行性,为木质纤维素生物质的高效、环保转化奠定理论基础。
1 材料与方法
1.1 材料与试剂
中温大曲(Q):河南漯河贾湖酒业集团有限责任公司提供;干玉米秸秆(纤维素(33.09±1.21)%,半纤维素(18.44±0.19)%,酸溶木质素(28.68±0.93)%,酸不溶木质素(3.12±0.02)%,灰分(3.33±0.03)%,其他(12.68±0.36)%):河南省荥阳市玉米地收集,粉碎过100目筛保存备用。
柠檬酸、柠檬酸三钠、硫酸(均为分析纯):郑州市利研仪器有限公司;葡萄糖、木糖、甲酸、乙酸、丙酸、丁酸(均为色谱纯):上海阿拉丁生化科技股份有限公司;Cellic Ctec2纤维素酶(总滤纸酶活120 FPU/mL):Novozyme(中国)生物技术有限公司;Hieff ![]() MaxUp II 脱氧核糖核酸(deoxyribonucleic acid,DNA)建库试剂盒(12200ES96):上海翌圣生物科技公司。
MaxUp II 脱氧核糖核酸(deoxyribonucleic acid,DNA)建库试剂盒(12200ES96):上海翌圣生物科技公司。
1.2 仪器与设备
LDZM-60L-T立式高压蒸汽灭菌锅:上海申安医疗器械厂;TDZ5-WS低速台式离心机:湖南湘仪实验室仪器开发有限公司;LRH-150-2B生化培养箱、DHG-9140A鼓风干燥箱、SX2-2.5-10NP箱式电阻炉:上海一恒科学仪器有限公司;FE28 pH计:梅特勒托利多国际有限公司;HH-S恒温水浴振荡器:郑州科华仪器设备有限公司;Agilent 1260高效液相色谱仪:美国安捷伦科技公司;SHZ-D循环水式真空泵(上翻水):巩义市予华仪器有限责任公司;UV-2012PC紫外分光光度计:尤尼柯(上海)仪器有限公司。
1.3 方法
1.3.1 中温大曲厌氧预处理干玉米秸秆
以DCS与无菌水质量比为4∶5加水,中温大曲添加量为5 g/kg DCS。将混合物料分别装入5个玻璃泡菜坛中进行生物预处理,坛子顶部加水密封,确保发酵过程无空气进入。室温下发酵35 d,每隔7 d取出1坛(实验组),共5个发酵样品(编号为QDCS1~QDCS5)。其中,空白组不接种中温大曲,其他处理相同,共5个发酵样品(编号为DCS1~DCS5)。
1.3.2 干玉米秸秆预处理过程中微生物菌群分析
对干玉米秸秆(DCS)、中温大曲(Q)、自然发酵秸秆(空白组样品DCS1~DCS5)和中温大曲厌氧处理干玉米秸秆(实验组样品QDCS1~QDCS5))进行DNA提取、聚合酶链式反应(polymerase chain reaction,PCR)扩增及高通量测序。
DNA提取:根据E.Z.N.A.Soil DNA Kit 说明书提取总群落基因组DNA,测定DNA浓度和纯度。釆用紫外分光光度计分别检测总DNA在波长260 nm和280 nm处的吸光度值,得到总DNA浓度和OD260 nm/OD280 nm比值,比值在1.6~1.8之间,说明样品DNA纯度较高,无蛋白质和RNA污染。
PCR扩增:以提取的基因组DNA为模板,分别以细菌341F引 物(5'-CCTACGGNGGCWGCAG-3')和805R 引 物(5'-GACTACHVGGGTATCTAATCC-3')对细菌16S rRNA基因V3~V4可变区进行PCR扩增,以真菌ITS1F引物(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R引物(5'-GCTGCGTTCTTCATCGATGC-3')对真菌ITS1~ITS2区进行PCR扩增。PCR扩增体系(30 μL):PCR Master Mix 15 μL,Bar-PCR primer 1 μL,Primer R 1 μL,DNA模板20 ng,添加超纯水补足至30 μL。PCR扩增体系:95 ℃预变性3 min;95 ℃变性30 s,45 ℃退火30 s,72 ℃延伸30 s,20次循环;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,72 ℃再延伸5 min。PCR扩增产物进行琼脂糖电泳检测。检测合格的PCR产物在Illumina NovaSeq 6000平台进行高通量测序和生物信息学分析。
1.3.3 预处理干玉米秸秆酶解工艺
称取定量预处理干玉米秸秆(QDCS4)(底物质量分数9%)置于三角瓶中,在高压蒸汽灭菌锅中加热到121 ℃维持20 min,冷却至室温后加入适量pH 4.8柠檬酸缓冲液和纤维素酶(纤维素酶添加量23 FPU/g纤维素),混合均匀后将三角瓶置于50 ℃恒温振荡水浴中,200 r/min振荡酶解(酶解时间60 h)。
1.3.4 预处理干玉米秸秆酶解工艺优化
单因素试验:考察底物质量分数(5.0%、7.5%、10.0%、12.5%、15.0%)、纤维素酶添加量(5 FPU/g纤维素、10 FPU/g纤维素、15 FPU/g纤维素、20 FPU/g纤维素、25 FPU/g纤维素,30FPU/g纤维素)和酶解时间(12 h、24 h、36 h、48 h、60 h、72 h、84 h)对纤维素酶解率的影响。
响应面试验:在单因素试验结果的基础上,以纤维素酶解率(Y)为响应值,以酶解时间(X1)、底物质量分数(X2)和纤维素酶添加量(X3)为自变量,利用Design Expert 8.0.6软件设计3因素3水平响应面试验,试验因素与水平见表1。
表1 酶解工艺条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for enzymatic hydrolysis process conditions optimization
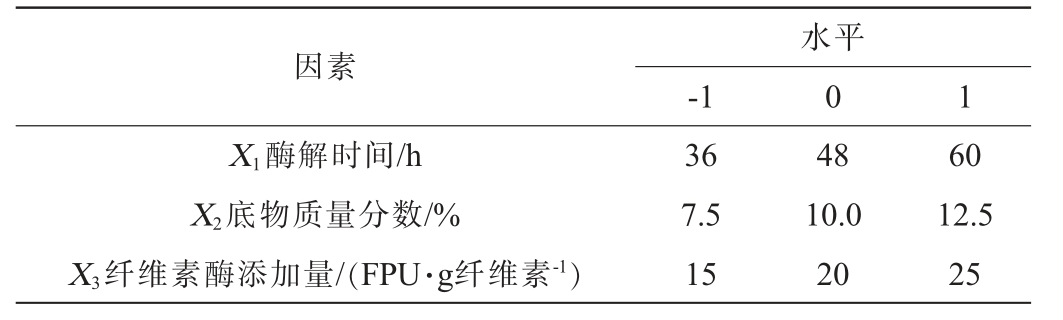
因素-1水平0 1 X1酶解时间/h X2底物质量分数/%X3纤维素酶添加量/(FPU·g纤维素-1)36 7.5 15 48 10.0 20 60 12.5 25
1.3.5 理化指标测定
(1)纤维素酶解率测定
将酶解液加热至100 ℃后维持10 min,对纤维素酶进行灭活处理,离心(5 000 r/min、10 min)后取上清液用0.45 μm滤膜过滤,利用高效液相色谱分析产物葡萄糖含量[16]。计算纤维素酶解率,其计算公式如下:
式中:Y为纤维素酶解率,%;W葡萄糖为酶解液中葡萄糖总含量,g;W纤维素为原料纤维素总含量,g;1.11为纤维素转化葡萄糖系数。
(2)纤维素成分测定
纤维素、半纤维素、酸溶木质素和酸不溶木质素含量采用美国国家可再生能源实验室(National renewable energy laboratory,NREL)提供的两步水解法进行测定[17]。
(3)有机酸和pH测定
称取预处理干玉米秸秆样品2~3 g,按照料液比1∶10(g∶mL)加入无菌水,振荡(转速150 r/min)反应0.5 h后采用pH计测定反应体系pH值,离心(5 000 r/min、10 min)取上清液用0.45 μm滤膜过滤,利用高效液相色谱仪测定滤液中的有机酸(甲酸、乙酸、丙酸和丁酸)[11]。
1.3.6 数据分析
本研究所有处理均重复3次,结果用“平均值±标准差”表示。使用Origin Pro 9.1软件进行统计分析并绘制图表。使用Design Expert 8.0.6软件进行试验设计及模型数据分析。
2 结果与分析
2.1 厌氧预处理干玉米秸秆样品有机酸和pH值测定结果
厌氧预处理干玉米秸秆样品有机酸和pH值测定结果见表2。由表2可知,DCS原料中乳酸、丁酸未检出,随着发酵进行,空白组(DCS)及实验组(QDCS)样品中乳酸、乙酸含量整体均呈增加趋势。当发酵21 d之后,DCS及QDCS样品中检出丁酸;当发酵结束时,乳酸含量分别为(2.86±0.01)%和(3.85±0.02)%;乙酸含量分别为(1.14±0.01)%和(0.91±0.01)%;丁酸含量分别为(0.35±0.01)%和(0.03±0.00)%。甲酸在DCS、QDCS1及DCS1~DCS4样品均检出,其含量分别为(0.14±0.00)%、(0.29±0.00)%、(0.39±0.00)%、(0.43±0.00)%、(0.48±0.00)%和(0.34±0.00)%。丁酸通常是厌氧处理不当出现异味的常见指标[20],说明不接种中温大曲的自然发酵处理过程不易控制,主要是因为DCS自身附着微生物数量较少,不足以在厌氧处理过程中形成优势菌群,导致有害微生物生长繁殖[21]。在发酵过程中,空白组(DCS)及实验组(QDCS)样品pH值均呈下降趋势,发酵结束时,其pH值分别为5.70±0.15和4.75±0.16,其原因可能是反应过程中微生物代谢消耗了原料中的部分可溶性碳水化合物,产生了各种有机酸(以乳酸、乙酸为主)[18]。发酵体系中较低pH值可以维持发酵过程稳定,避免不良微生物代谢活动[19]。
表2 干玉米秸秆预处理过程中有机酸和pH变化
Table 2 Changes in organic acids and pH during pretreatment process of dry corn stover
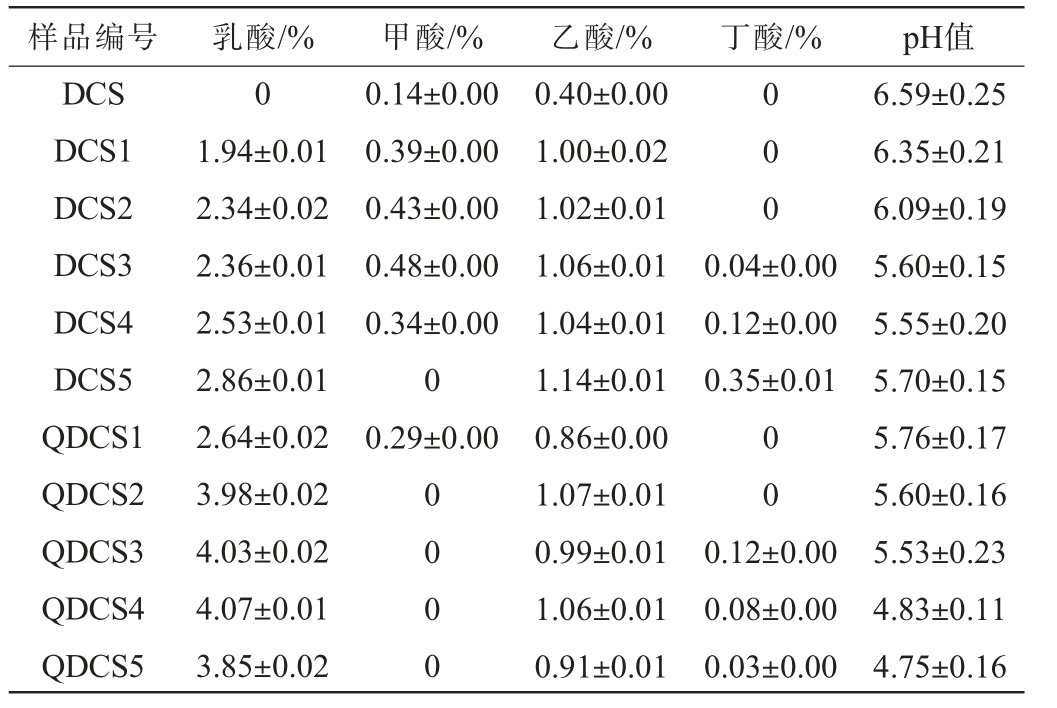
样品编号 乳酸/% 甲酸/% 乙酸/% 丁酸/% pH值DCS DCS1 DCS2 DCS3 DCS4 DCS5 QDCS1 QDCS2 QDCS3 QDCS4 QDCS5 0 1.94±0.01 2.34±0.02 2.36±0.01 2.53±0.01 2.86±0.01 2.64±0.02 3.98±0.02 4.03±0.02 4.07±0.01 3.85±0.02 0.14±0.00 0.39±0.00 0.43±0.00 0.48±0.00 0.34±0.00 0 0.29±0.00 0 0 0 0.04±0.00 0.12±0.00 0.35±0.01 0 0 0 0 0.40±0.00 1.00±0.02 1.02±0.01 1.06±0.01 1.04±0.01 1.14±0.01 0.86±0.00 1.07±0.01 0.99±0.01 1.06±0.01 0.91±0.01 0 0 0.12±0.00 0.08±0.00 0.03±0.00 6.59±0.25 6.35±0.21 6.09±0.19 5.60±0.15 5.55±0.20 5.70±0.15 5.76±0.17 5.60±0.16 5.53±0.23 4.83±0.11 4.75±0.16
2.2 厌氧预处理干玉米秸秆样品纤维素组成的测定结果
干玉米秸秆厌氧预处理过程中纤维素组成的变化见图1。由图1可知,DCS原料中纤维素和半纤维素含量分别为(33.09±1.21)%和(18.44±0.19)%,随着发酵进行,空白组(DCS)及实验组(QDCS)样品中纤维素和半纤维素含量均呈降低趋势。当发酵结束时,纤维素含量分别为(31.23±1.18)%和(30.21±1.15)%,半纤维素含量分别为(17.53±0.22)%和(16.98±0.19)%。半纤维素是木质纤维素中最容易受到酶或酸/碱水解的组分[22]。半纤维素含量降低可能是由大曲微生物和有机酸(乳酸、乙酸等)的共同作用造成的,说明预处理过程破坏了DCS的内部结构,将有利于后续酶解过程中纤维素酶可及性[23]。同时预处理过程保留了绝大部分纤维素类组分,将有利于后续纤维素再利用转化。有些观点认为木质素对生物质的酶促转化起到抑制作用,主要是由于木质素网络结构的空间位阻作用降低了纤维素与纤维素酶之间的有效接触,因此通常研究大量去除木质素以提高酶解效率的方法[24]。但是,有研究表明木质素结构破坏可以显著提高酶解效率,而无需复杂预处理手段降低其含量[25]。本研究中,酸不溶木质素和酸溶木质素含量都没有明显改变,酶解效率实验结果也证明了这一点。综上,发酵28 d预处理干玉米秸秆组分均趋于稳定,故后续工艺过程采用QDCS4作为酶解底物。
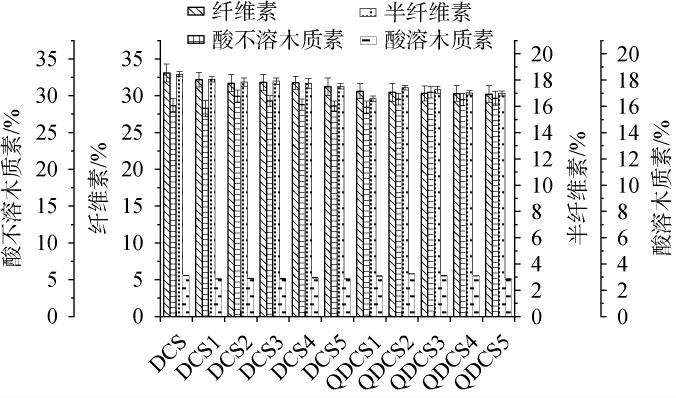
图1 干玉米秸秆预处理过程中纤维素组成的变化
Fig.1 Changes in cellulose composition during pretreatment process of dry corn stover
2.3 干玉米秸秆预处理过程中微生物群落组成分析
2.3.1 干玉米秸秆预处理过程中真菌群落组成分析
基于门和属水平对样品中的真菌群落结构进行分析,并将平均相对丰度>1.0%的门和属定义为优势门和优势属,结果见图2。
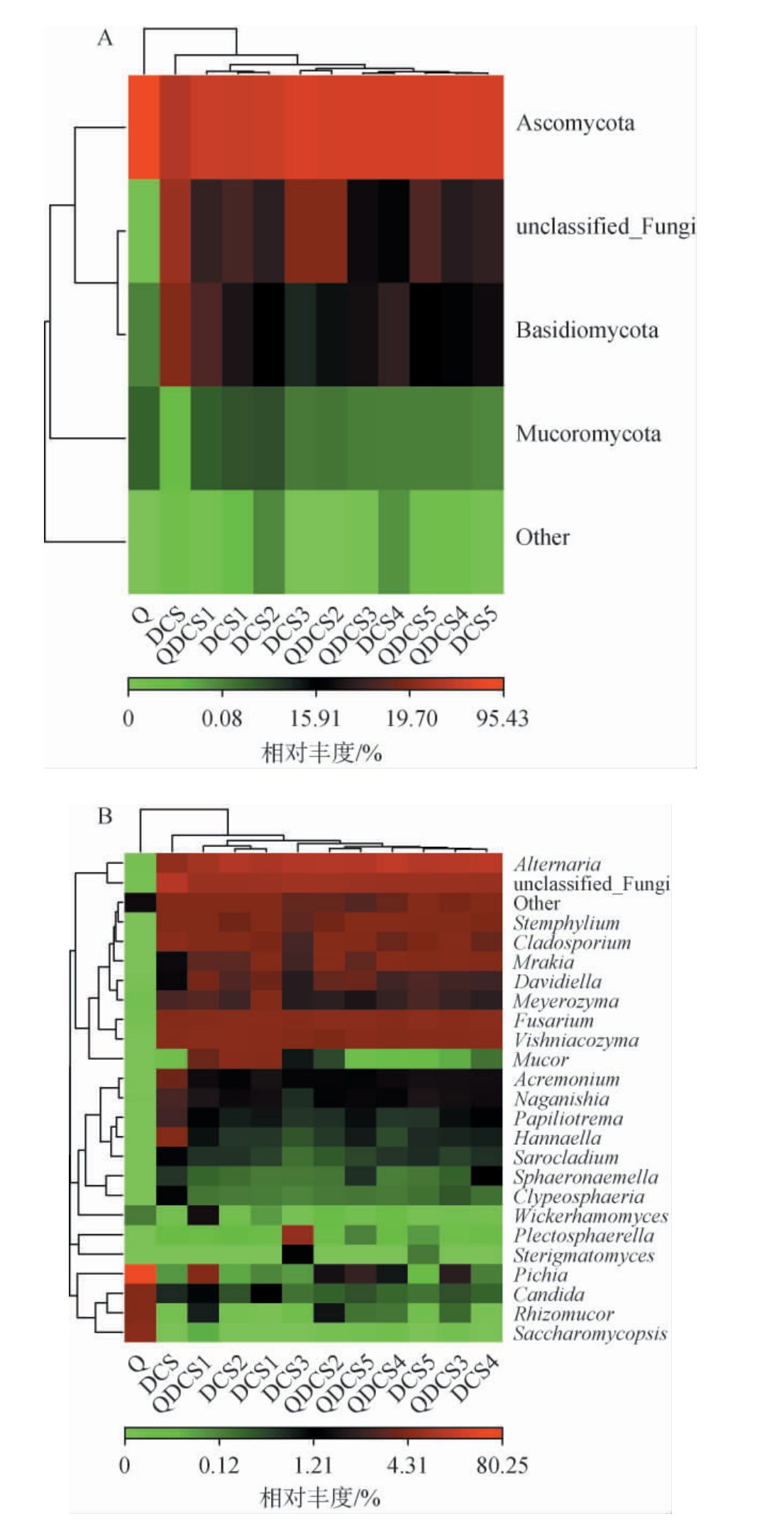
图2 基于门(A)、属(B)水平干玉米秸秆预处理过程中真菌菌群结构
Fig.2 Structure of fungal community during pretreatment process of dry corn stover at phylum level (A) and genus level (B)
由图2A可知,在门水平上,所有样品中分别检出子囊菌门(Ascomycota)、毛霉亚门(Mucoromycota)、担子菌门(Basidiomycota)和被孢霉门(Mortierellomycota)。中温大曲和干玉米秸秆中优势真菌门均为子囊菌门,相对丰度分别为95.43%和46.61%,其在QDCS4和QDCS5样品中相对丰度较高,分别为66.45%和65.42%。担子菌门在DCS样品中相对丰度为20.05%,发酵过程中降低,其在QDCS4和QDCS5样品中分别为15.99%、15.77%。由图2B可知,在属水平上,分别检出链格孢霉属(Alternaria)、毕赤酵母属(Pichia)、镰孢霉属(Fusarium)、维多利亚维希尼克氏酵母属(Vishniacozyma)、枝孢霉属(Cladosporium)和匐柄霉属(Stemphylium)等。由于本研究中干玉米秸秆预处理过程属于厌氧发酵,所以好氧的真菌微生物受到一定程度地抑制。中温大曲样品中优势真菌属为酿酒酵母属(相对丰度8.65%),在DCS、DCS1~DCS5样品中均未检出,在QDCS4样品中相对丰度为0.02%。DCS样品中链格孢霉属(相对丰度11.57%)为发酵过程中的优势真菌属,其在QDCS4样品中相对丰度为38.85%。维多利亚维希尼克氏酵母属(Vishniacozyma)、枝孢霉属(Cladosporium)和匐柄霉属(Stemphylium)在中温大曲中均未检出,说明干玉米秸秆自身携带的部分微生物,在预处理过程中发挥了一定程度地作用。
2.3.2 干玉米秸秆预处理过程中细菌群落组成分析
基于门和属水平对样品中的细菌群落结构进行分析,并将平均相对丰度>1.0%的门和属定义为优势门和优势属,结果见图3。

图3 基于门(A)、属(B)水平干玉米秸秆预处理过程中细菌菌群结构
Fig.3 Structure of bacterial community during pretreatment process of dry corn stover at phylum level (A) and genus level (B)
由图3A可知,在门水平上,所有样品中分别检出厚壁菌 门(Firmicutes)、变 形 菌 门(Proteobacteria)、拟 杆 菌 门(Bacteroidetes)和放线菌门(Actinobacteria)等。中温大曲中优势细菌门为厚壁菌门(相对丰度为93.40%),在DCS样品中相对丰度为1.03%,其在QDCS4和QDCS5样品中相对丰度分别为59.97%和56.61%。DCS中优势细菌门为变形菌门(78.76%),发酵过程受到抑制,在QDCS4和QDCS5样品中分别为37.19%、39.87%。由图3B可知,在属水平上,所有样品中分别检出片球菌属(Pediococcus)、肠杆菌属(Enterobacter)、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、农杆菌属(Agrobacterium)等。片球菌属在QDCS4和QDCS5样品中相对丰度分别为25.37%、32.36%。DCS样品中马赛菌属(Massilia)相对丰度最高,为13.96%,在QDCS样品中平均相对丰度<0.5%,说明该菌属微生物在预处理过程中受到抑制。DCS样品中乳酸杆菌属(Loigolactobacillus)(0.004%)、乳球菌属(Lactococcus)(0.01%)和肠球菌属(Enterococcus)(0.02%)在QDCS4样品中相对丰度分别为6.13%、1.26%和1.71%。乳酸杆菌属是大曲中非常重要的微生物之一,可起到维护与保持反应体系微生态环境的作用[26]。乳球菌属和肠球菌属能降低原料pH值并提高乳酸的量,特别是在发酵早期[27]。由此可看出,接种大曲预处理干玉米秸秆过程中,由于微生物代谢产生有机酸导致反应体系pH值降低是维持发酵体系相对稳定的主要原因,一定程度上也起到了破坏干玉米秸秆细胞的作用。
2.3.3 干玉米秸秆预处理过程中微生物多样性差异分析
主坐标分析(PCoA)是一种研究数据相似性或差异性的可视化方法。通过PCoA可以观察个体或群体间的差异,如果样品距离越接近,表示物种组成结构越相似,因此群落结构相似度高的样品倾向于聚集在一起,群落差异很大的样品则会远远分开[28]。基于属水平干玉米秸秆预处理过程中细菌及真菌菌群主坐标分析结果见图4。由图4A可知,2个主坐标轴解释了69.18%的差异,其中PCoA1占51.83%,PCoA2占17.35%。DCS1、QDCS1和QDCS2样品距离较远,说明发酵前14 d,自然发酵和接种大曲发酵样品中细菌群落结构差异较大,随着发酵进行,样品中细菌群落结构逐渐稳定,且然发酵和接种大曲发酵样品细菌组成相似。由图4B可知,2个主坐标轴解释了56.37%的差异,其中PCoA1占39.79%,PCoA2占16.58%。DCS3、DCS4和DCS5样品距离较远,说明自然发酵14 d后样品真菌群落结构差异较大。实验组QDCS样品紧密聚集,说明样品真菌群落结构一直保持相对稳定。结果表明,干玉米秸秆样品在开放式接种大曲发酵条件下,随着时间延长,固态发酵过程微生物多样性逐渐趋于稳定(特别是发酵28 d之后),而自然发酵干玉米秸秆微生物组成(特别是真菌)不能保持一致。
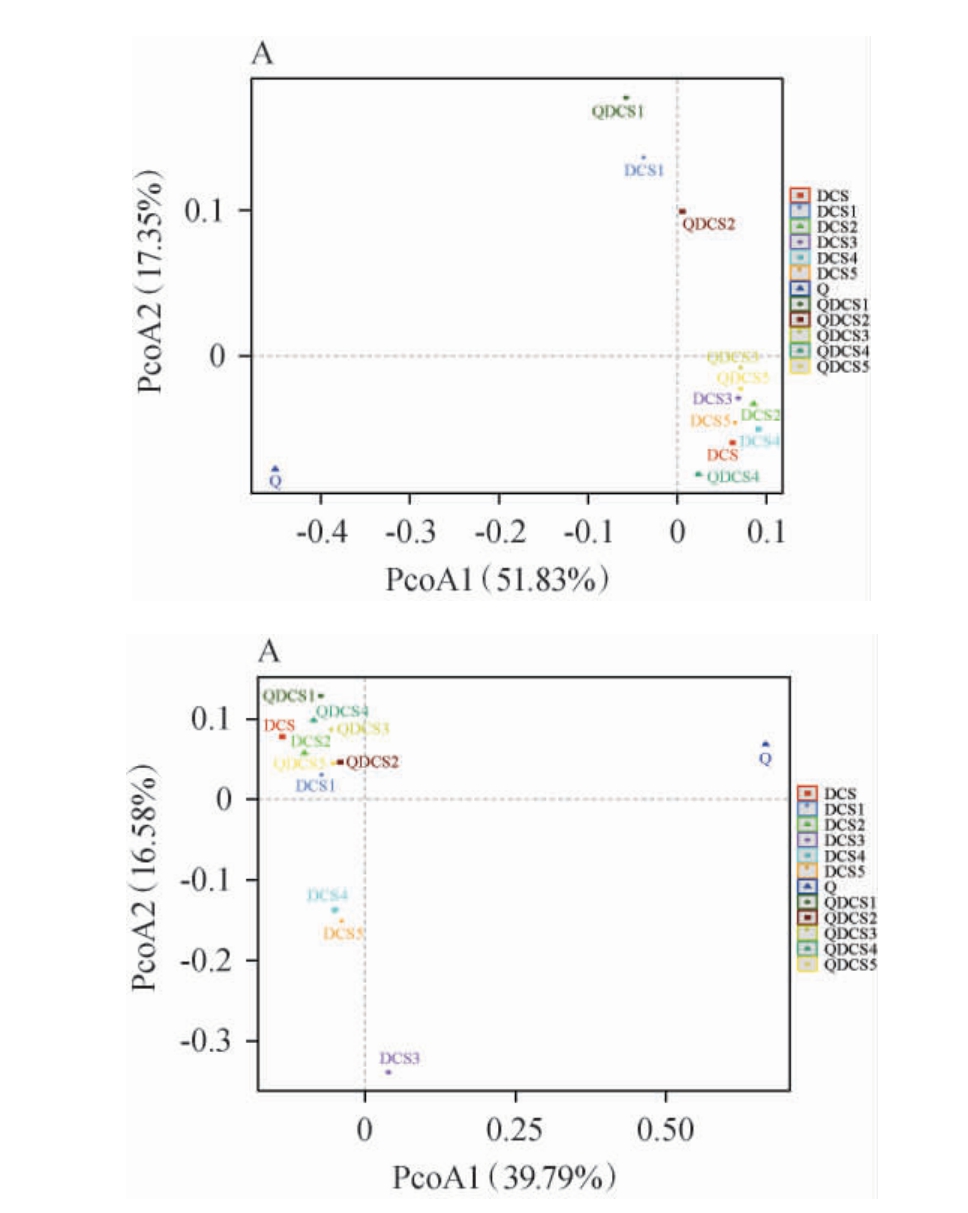
图4 基于属水平干玉米秸秆预处理过程中细菌(A)及真菌(B)菌群主坐标分析结果
Fig.4 Principal coordinate analysis results of bacterial (A) and fungal (B) community during pretreatment of dry corn stover at genus level
综合上述结果,发酵28 d预处理干玉米秸秆组分和微生物群落均趋于稳定,选择样品QDCS4为研究对象,研究大曲厌氧预处理条件下的纤维素酶解效率。
2.4 预处理干玉米秸秆酶解工艺优化单因素试验
2.4.1 酶解时间的确定
酶解时间对纤维素酶解率及葡萄糖质量浓度的影响见图5。
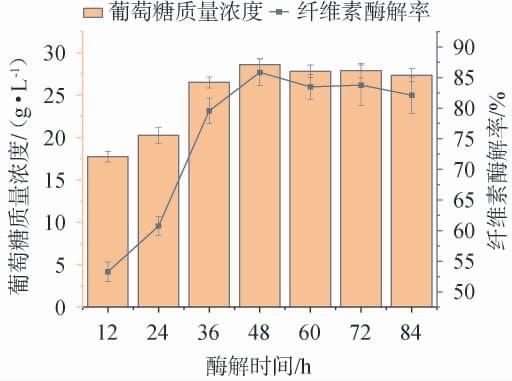
图5 酶解时间对纤维素酶解率及葡萄糖质量浓度的影响
Fig.5 Effects of enzymatic time on the enzymatic hydrolysis rates of cellulose and mass concentration of glucose
由图5可知,随着酶解时间在12~48 h内增加,葡萄糖质量浓度及纤维素酶解率逐渐增加;当酶解时间为48 h,葡萄糖质量浓度及纤维素酶解率达到最高,分别为(28.62±0.73)g/L、(85.86±2.17)%;当酶解时间>48 h,葡萄糖质量浓度及纤维素酶解率有所下降。其原因可能是,随着时间延长,葡萄糖积累对纤维素酶产生了产物抑制作用,导致酶解效率下降[29]。另外,随着酶解进行,水解反应发生在纤维素结晶区,比在纤维素无定形区困难,速率低于前期[30]。因此,确定最佳酶解时间为48 h。
2.4.2 底物浓度的确定
底物浓度对纤维素酶解率及葡萄糖质量浓度的影响见图6。
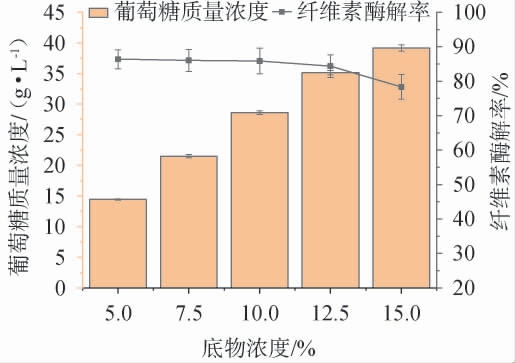
图6 底物浓度对纤维素酶解率及葡萄糖质量浓度的影响
Fig.6 Effects of substrate concentration on the enzymatic hydrolysis rates and mass concentration of glucose
由图6可知,随着底物质量浓度在5%~15%范围内的提高,反应体系中葡萄糖浓度一直呈上升趋势。当底物浓度为5%~10%时,纤维素酶解率保持平稳;当底物浓度为10%时,葡萄糖质量浓度为(28.61±0.97)g/L,纤维素酶解率为(85.86±3.76)%;当底物浓度>10%时,纤维素酶解率下降。底物浓度较低,反应体系均匀,酶解效率高,但产物浓度偏低,不利于后续转化利用;底物浓度较高,反应体系粘度大造成酶解反应不均匀,产物浓度虽偏高,但酶解效率低下导致纤维素利用率不高[31]。因此,确定最佳底物浓度为10%。
2.4.3 纤维素酶添加量的确定
纤维素酶添加量对纤维素酶解率及葡萄糖质量浓度的影响见图7。
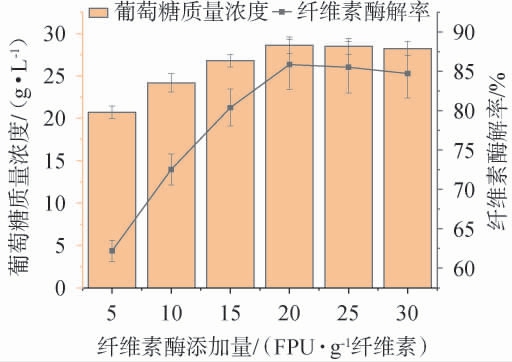
图7 纤维素酶添加量对纤维素酶解率及葡萄糖质量浓度的影响
Fig.7 Effects of cellulose addition on the enzymatic hydrolysis rates and mass concentration of glucose
由图7可知,随着纤维素酶添加量在5~20 FPU/g纤维素范围内提高,葡萄糖质量浓度和纤维素酶解率呈上升趋势;当纤维素酶添加量为20 FPU/g纤维素时,葡萄糖质量浓度和纤维素酶解率最高,分别为(28.61±0.97)g/L、(85.86±3.16)%;当纤维素酶添加量>20 FPU/g纤维素时,葡萄糖质量浓度和纤维素酶解率逐渐下降。由于酶结合位点有限,纤维素酶过量添加会产生饱和现象,导致酶制剂无效使用[32]。因此,确定最佳纤维素酶添加量为20 FPU/g纤维素。
2.5 预处理干玉米秸秆酶解工艺优化响应面试验
在单因素试验结果的基础上,以纤维素酶解率(Y)为响应值,以酶解时间(X1)、底物质量分数(X2)和纤维素酶添加量(X3)为自变量,根据BBD试验设计原理设计3因素3水平响应面试验,响应面试验设计及结果见表3,回归模型方差分析见表4。
表3 酶解工艺条件优化响应面试验设计及结果
Table 3 Design and results of response surface tests for enzymatic hydrolysis process conditions optimization
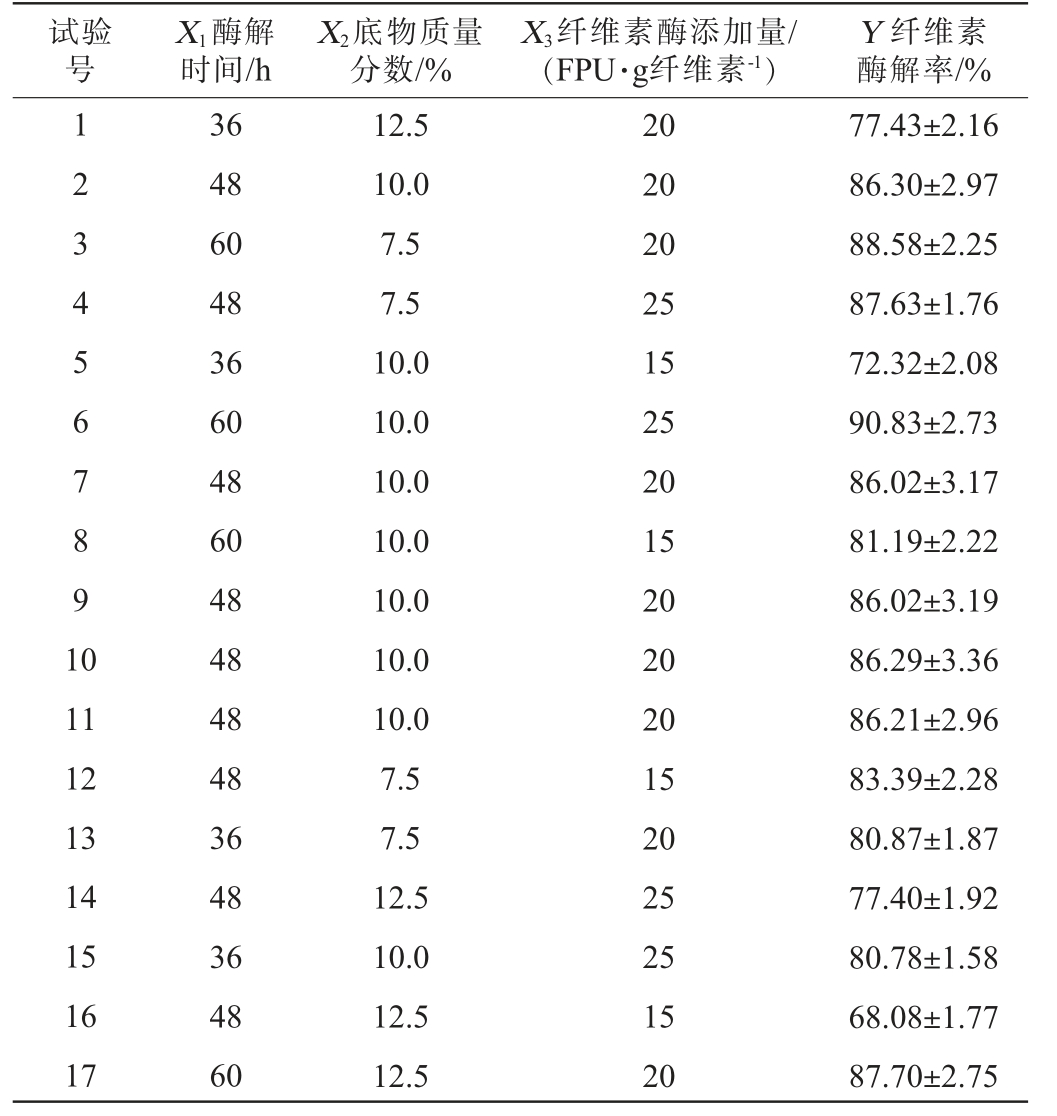
试验号X1酶解时间/h X2底物质量分数/%X3纤维素酶添加量/(FPU·g纤维素-1)Y 纤维素酶解率/%1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 36 48 60 48 36 60 48 60 48 48 48 48 36 48 36 48 60 12.5 10.0 7.5 7.5 10.0 10.0 10.0 10.0 10.0 10.0 10.0 7.5 7.5 12.5 10.0 12.5 12.5 20 20 20 25 15 25 20 15 20 20 20 15 20 25 25 15 20 77.43±2.16 86.30±2.97 88.58±2.25 87.63±1.76 72.32±2.08 90.83±2.73 86.02±3.17 81.19±2.22 86.02±3.19 86.29±3.36 86.21±2.96 83.39±2.28 80.87±1.87 77.40±1.92 80.78±1.58 68.08±1.77 87.70±2.75
表4 回归模型方差分析
Table 4 Variance analysis of regression model
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
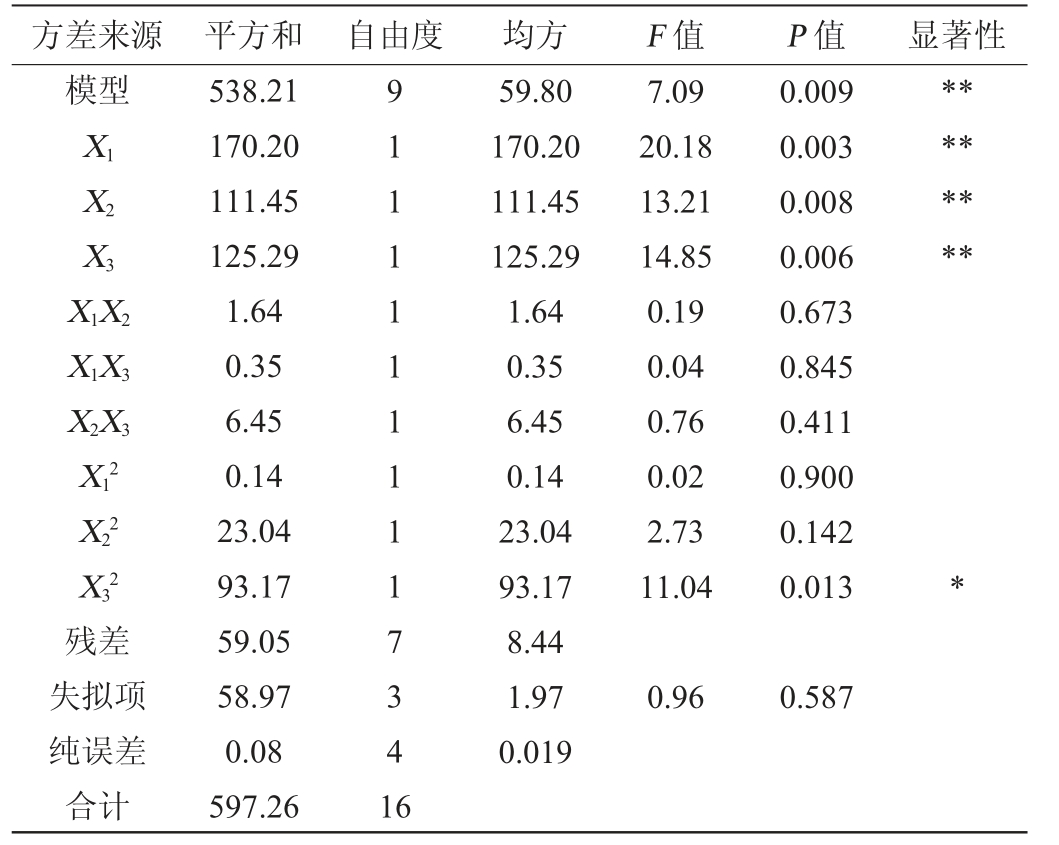
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型X1 X2 X3 X1X2 X1X3 X2X3 X12 X22 X32残差失拟项纯误差合计538.21 170.20 111.45 125.29 1.64 0.35 6.45 0.14 23.04 93.17 59.05 58.97 0.08 597.26 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 59.80 170.20 111.45 125.29 1.64 0.35 6.45 0.14 23.04 93.17 8.44 1.97 0.019 7.09 20.18 13.21 14.85 0.19 0.04 0.76 0.02 2.73 11.04 0.009 0.003 0.008 0.006 0.673 0.845 0.411 0.900 0.142 0.013*********0.96 0.587
利用Design Expert 8.0.6软件对表3试验结果进行多元二次回归拟合分析,得到二次多项式回归方程如下:
Y=86.17+4.61X1-3.73X2+3.96X3+0.64X1X2+0.29X1X3+1.27X2X3-0.18X12-2.34X22-4.70X32
由表4可知,模型极显著(P<0.01),失拟项不显著(P>0.05),该模型回归方程决定系数R2=0.975 4,校正决定系数R2=0.901 1,表明该模型可靠,拟合程度良好。由P值可知,一次项X1、X2和X2对纤维素酶解率影响极显著(P<0.01),二次项X32对纤维素酶解率影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。由F值可知,对纤维素酶解率影响因素顺序为酶解时间(X1)>纤维素酶添加量(X3)>底物质量分数(X2)。
利用Design Expert 8.0.6软件得出最优酶解条件为:酶解时间60 h,底物质量分数8.91%,纤维素酶添加量22.88 FPU/g纤维素。在此优化条件下,纤维素酶解率预测值为91.12%。为方便实际操作,将酶解工艺条件修正为:酶解时间60 h,底物质量分数9%,纤维素酶添加量23 FPU/g纤维素。在此优化条件下进行3次验证试验,得到纤维素酶解率实际值为(91.87±3.12)%,与预测值接近,验证了模型有效性。
3 结论
本研究以干玉米秸秆(DCS)为原料,将中温大曲添加至DCS样品中,采用厌氧发酵方式对DCS进行预处理35 d。结果表明,DCS预处理过程中的乳酸、乙酸含量整体均呈增加趋势,pH值、纤维素和半纤维素含量均呈下降趋势;DCS预处理28 d时,其优势菌群较丰富,优势真菌属为链格孢霉属(Alternaria)(相对丰度38.85%),优势细菌属为乳酸杆菌属(Loigolactobacillus)、乳球菌属(Lactococcus)和肠球菌属(Enterococcus)(相对丰度均>1%)。PCoA结果表明,采用中温大曲预处理DCS的过程中微生物群落结构保持相对稳定。中温大曲预处理28 d的DCS最佳酶解条件为:酶解时间60 h,底物质量分数9%,纤维素酶添加量23 FPU/g纤维素。在此优化条件下,纤维素酶解率达到91.87%。后续可考虑通过生物信息学方法鉴定预处理过程中起到关键作用的核心功能微生物,提高干玉米秸秆预处理效果。
[1]GUO X,AN Y J,LU F P,et al.Optimization of synergistic degradation of steam exploded corn straw by lytic polysaccharide monooxygenase R17L and cellulase[J].Ind Crop Prod,2022,182:114924.
[2]BYEONGCHAN A,CHULHWAN P,LIU J J,et al.Maximizing the utilization of lignocellulosic biomass:Process development and analysis[J].Renew Energ,2023,215:119004.
[3]CHEN X M,LI Y H,LI X,et al.Exploring the potential of multiple lignocellulosic biomass as a feedstock for biobutanol production[J].Fuel,2024,357:129697.
[4]DENG W P,FENG Y C,FU J, et al.Catalytic conversion of lignocellulosic biomass into chemicals and fuels[J].Green Energy Environ,2023,8(1):10-114.
[5]YUAN X C,SHEN G N,CHEN S T,et al.Elucidating the mechanism of densifying lignocellulosic biomass with acidic chemicals (DLC) for lignocellulosic biorefinery[J].Green Chem,2023,25:6759-6773.
[6]LIU J B,JIANG X Y,LI Z H,et al.Parametric studies on pretreatment of lignocellulosic biomass via deep eutectic solvents: Enhancing densified pellet quality[J].Ind Crop Prod,2024,208:117850.
[7]KHAN M F S,AKBAR M,XU Z,et al.A review on the role of pretreatment technologies in the hydrolysis of lignocellulosic biomass of corn stover[J].Biomass Bioenerg,2021,155:106276.
[8]SUN S L,WEN J L,MA M G,et al.Enhanced enzymatic digestibility of bamboo by a combined system of multiple steam explosion and alkaline treatments[J].Appl Energ,2014;136:519-526.
[9]LIU S,XU F Q,GE X M,et al.Comparison between ensilage and fungal pretreatment for storage of giant reed and subsequent methane production[J].Bioresource Technol,2015,209:246-253.
[10]CHEN J M, CAI Y F, WANG Z, et al.Construction of a synthetic microbial community based on multiomics linkage technology and analysis of the mechanism of lignocellulose degradation[J].Bioresource Technol,2023,389:129799.
[11]KHOLIF A E,ELGHANDOUR M M Y,RODRÍGUEZ G B,et al.Anaerobic ensiling of raw agricultural waste with a fibrolytic enzyme cocktail as a cleaner and sustainable biological product[J].J Clean Prod,2017,142:2649-2655.
[12]LILLINGTON S P, LEGGIERI P A, HEOM K A, et al.Nature's recyclers:anaerobic microbial communities drive crude biomass deconstruction[J].Curr Opin Biotech,2020,62:38-47.
[13]FANG X X, LI Q M, LIN Y Q, et al.Screening of a microbial consortium for selective degradation of lignin from tree trimmings[J].Bioresource Technol,2018,254:247-255.
[14]FELIPUCI J P, DE FREITAS C, SANCHES A O, et al.Efficient production of cellooligosaccharides and xylooligosaccharides by combined biological pretreatment and enzymatic hydrolysis process[J].Biomass Convers Bioref,2024,15:8881-8893.
[15]刘延波,刘莹莹,赵志军,等.张弓老酒大曲中高产纤维素酶菌株的分离鉴定[J].基因组学与应用生物学,2020,39(9):4031-4040.
[16]YANG X,SHI Z Y,WANG T Y,et al.Fermentative L-lactic acid production using Bacillus coagulans from corn stalk deconstructed by an anaerobic microbial community[J].Fermentation,2023,9(7):611.
[17]SLUITER A,HAMES B,RUIZ R,et al.Determination of structural carbohydrates and lignin in biomass[R].Colorado: National Renewable Energy Laboratory,2011.
[18]YANG X,LI H L,CHANG C,et al.The integrated process of microbial ensiling and hot-washing pretreatment of dry corn stover for ethanol production[J].Waste Biomass Valori,2018,9:2031-2040.
[19]MEGIAS M D,HERNÁNDEZ F,GALLEGO J A,et al.Effects of different additives on the cell wall and mineral fractions of artichoke(Cynara scolymus L.)and orange(Citrus aurantium L.)by-product silage[J].J Sci Food Agr,1998,76(2):173-181.
[20]AMBYE-JENSEN M,THOMSEN S T,KÁDÁR Z,et al.Ensiling of wheat straw decreases the required temperature in hydrothermal pretreatment[J].Biotechnol Biofuels,2013,6:116-125.
[21]GOHAR V, SRIVASTAVA R, MISHRA D, et al.Xylanase and lactic acid bacteria mediated bioconversion of rice straw co-ensiled with pea waste and wet brewers' grains as potential livestock feed[J].Biomass Convers Biorefin,2025,15:671-686.
[22]HE L W, LV H J, WANG C, et al.Dynamics of fermentation quality,physiochemical property and enzymatic hydrolysis of high-moisture corn stover ensiled with sulfuric acid or sodium hydroxide[J].Bioresource Technol,2020,298:122510.
[23]LI X L,WANG X,LI P,et al.Fungal combined with ammoniation pretreatment to promote enzymatic hydrolysis of corn stove[J].Biomass Convers Biorefin,2025,15:9111-9122.
[24]ZHAO X X,WANG J H,LAN K,et al.Integrated nondestructive spectroscopic technology to reveal the influence mechanism of lignins from pretreated corn stover on cellulose saccharification[J].ACS Sustain Chem Eng,2024,12(7):2871-2880.
[25]WEN J L,SUN S N,YUAN T Q,et al.Fractionation of bamboo culms by autohydrolysis, organosolv delignification and extended delignification: Understanding the fundamental chemistry of the lignin during the integrated process[J].Bioresource Technol,2013,150:278-286.
[26]杨旭,马歌丽,王光路,等.高通量测序解析白酒中高温大曲细菌和真菌群落结构[J].中国酿造,2020,39(6):119-123.
[27]ZHAO C,WANG L H,MA G M,et al.Cellulase interacts with lactic acid bacteria to affect fermentation quality,microbial community,and ruminal degradability in mixed silage of soybean residue and corn stover[J].Animals,2021,11(2):334.
[28]曾椿淋,朱琳,高凤,等.不同天然奶酪发酵剂和非发酵剂微生物多样性的高通量测序研究[J].现代食品科技,2018,34(10):117-125.
[29]DUFF S J B,MURRAY W D.Bioconversion of forest products industry waste cellulosics to fued ethanol: a review[J].Bioresource Technol,1996,55(1):1-33.
[30]SONG J L,YANG F,ZHANG Y,et al.Interactions between fungal cellulases and films of nanofibrillar cellulose determined by a quartz crystal microbalance with dissipation monitoring(QCM-D)[J].Cellulose,2017,24:1947-1956.
[31]蒋康杰,吴文娟,黄丽菁,等.不同材种木质素影响底物吸附纤维素酶的水解机制[J].林业科学,2024(7):140-148.
[32]KIM E S,LEE H J,BANG W G,et al.Functional characterization of a bacterial expansin from Bacillus subtilis for enhanced enzymatic hydrolysis of cellulose[J].Biotechnol Bioeng,2010,102(5):1342-1353.