酱香型白酒是中国四大基础香型白酒之一。2022年,酱香型白酒产量为70万kL,占据白酒总产量的10.43%,总销售额的31.69%[1]。酱香型白酒具有色泽微黄,酱香突出,入口柔绵醇厚,幽雅细致,空杯留香持久等典型的风格特点[2]。
高温堆积是指上甑、蒸馏、摊凉、撒曲后酒醅收堆于酿酒车间的晾堂上,目的是能够提高入窖温度和集中网罗大曲和环境中的微生物如酵母菌、细菌、放线菌和霉菌等[3]。高温堆积后酒醅中酵母菌比例增长最为显著,促进由糖化向发酵为主的过渡,为窖内发酵提供原始动力[4-7]。产酶微生物不断的分泌酶类资源如糖化酶、液化酶和酯化酶等,开始特异性的分解酒醅中大分子物质,形成还原糖和氨基酸等单体物质。小分子物质被芽孢杆菌、阿姆斯特丹散囊菌等生香微生物利用形成的酱香型香气成分或者前体物质[8]。各类微生物在酒醅上进行大量繁殖、代谢,带来一定量的生物热,造成酒醅迅速升温,超过50 ℃之后,不耐高温的微生物开始消亡。因此,微生物的生命活动造成理化因子和风味物质的动态变化。同时,后者的改变也是对微生物种类重新选择的开始。开展对酱香型白酒堆积酒醅中微生物、理化因子以及风味物质复杂体系的研究有助于揭示高温堆积工艺的科学性和内在驱动力。
本文系统综述了堆积酒醅发酵中产酶和产香微生物以及不同轮次堆积酒醅发酵过程中优势真菌及细菌的动态变化,阐述了不同轮次堆积酒醅发酵过程中理化因子和风味物质的变化,并分析了堆积酒醅发酵过程中微生物、理化因子以及风味物质之间的关系。以期为解析堆积发酵机理提供参考,对白酒质量提升和精准调控具有重要意义。
1 酱香型白酒堆积酒醅发酵过程中微生物组成结构与功能
1.1 堆积酒醅发酵过程中的产酶微生物
微生物及其酶系在酿造中发挥了重要的作用,同时也是各类香型白酒风味特征形成的关键要素。液化酶、糖化酶、淀粉酶、蛋白酶、酯化酶等构成了酱香型白酒酿造过程中主要的水解酶系[9-10]。堆积酒醅发酵中产酶微生物代表菌株、作用条件及作用效果见表1。
表1 堆积酒醅发酵过程中产酶菌株的作用条件及效果
Table 1 Action conditions and effects of enzyme-producing strains during the fermentation process of stacking fermented grains
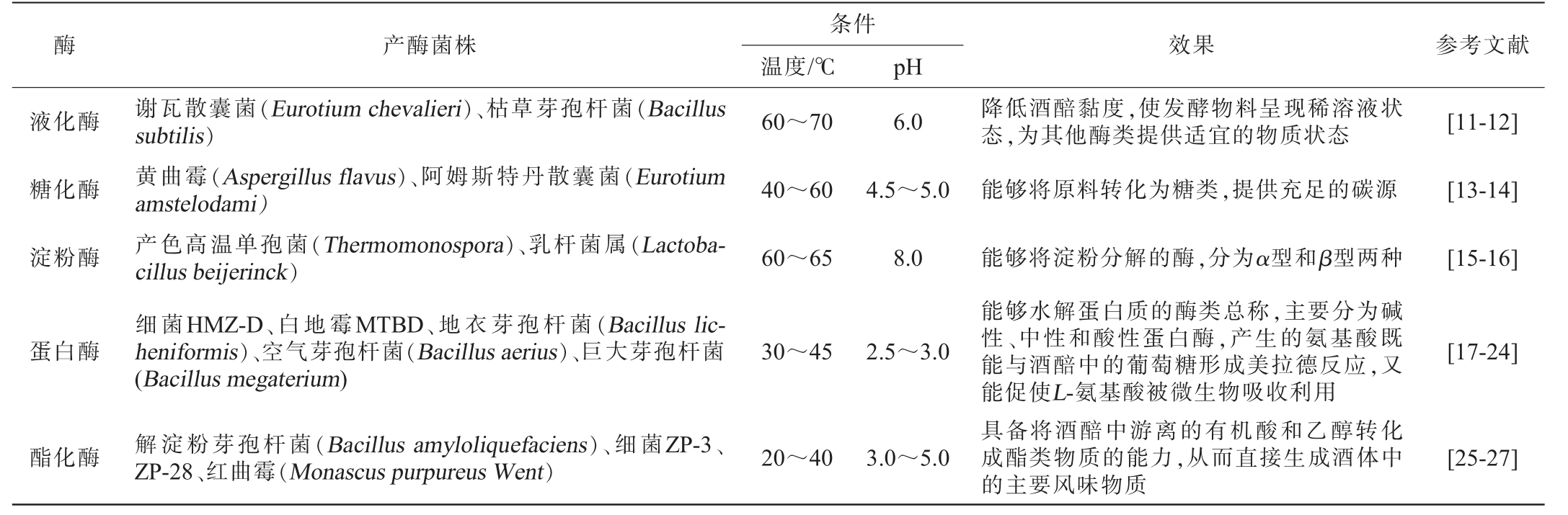
条件温度/℃ pH液化酶酶产酶菌株 效果 参考文献60~70 6.0降低酒醅黏度,使发酵物料呈现稀溶液状态,为其他酶类提供适宜的物质状态[11-12]糖化酶40~60 4.5~5.0能够将原料转化为糖类,提供充足的碳源[13-14]淀粉酶60~65 8.0[15-16]蛋白酶谢瓦散囊菌(Eurotium chevalieri)、枯草芽孢杆菌(Bacillus subtilis)黄曲霉(Aspergillus flavus)、阿姆斯特丹散囊菌(Eurotium amstelodami)产色高温单孢菌(Thermomonospora)、乳杆菌属(Lactobacillus beijerinck)细菌HMZ-D、白地霉MTBD、地衣芽孢杆菌(Bacillus licheniformis)、空气芽孢杆菌(Bacillus aerius)、巨大芽孢杆菌(Bacillus megaterium)30~45 2.5~3.0[17-24]酯化酶 解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、细菌ZP-3、ZP-28、红曲霉(Monascus purpureus Went)20~40 3.0~5.0能够将淀粉分解的酶,分为α型和β型两种能够水解蛋白质的酶类总称,主要分为碱性、中性和酸性蛋白酶,产生的氨基酸既能与酒醅中的葡萄糖形成美拉德反应,又能促使L-氨基酸被微生物吸收利用具备将酒醅中游离的有机酸和乙醇转化成酯类物质的能力,从而直接生成酒体中的主要风味物质[25-27]
酶的产生机制遵守中心法则,即脱氧核糖核酸(deoxyribonucleic acid,DNA)经过转录形成核糖核酸(ribonucleic acid,RNA),再通过翻译、加工等成为各类成熟蛋白质。在酿造体系中,谢瓦散囊菌和枯草芽孢杆菌代谢产生的液化酶活力高并且稳定。在酱香型堆积发酵酒醅中,黄曲霉和阿姆斯特丹散囊菌高产糖化酶,在提高出酒率的同时也能降低高级醇的含量,改善白酒的风味和品质。酒醅中地衣芽孢杆菌、产色高温单孢菌、Lactobacillus beijerinck与淀粉酶活力呈现正向关联关系,在酱香型白酒酿造过程中发挥着重要作用。酱香型白酒酒醅中酸含量较高,促使酸性蛋白质占有较大比重。黄永光等[17]向酒醅中添加酸性蛋白酶发现,其能够提高成品酒中乙醇、总酸含量以及挥发性物质,同时对于杂油醇的降低有着重要的作用。细菌HMZ-D、白地霉MTBD、地衣芽孢杆菌、空气芽孢杆菌、巨大芽孢杆菌、产色高温单孢菌等微生物高产蛋白酶,影响着酒醅的颜色、外观、风味物质以及香气。陈剑等[24]研究表明,酯化酶的生成来源于多种微生物,如解淀粉芽孢杆菌、细菌ZP-3、ZP-28、红曲霉、根霉等菌株拥有高产酯化酶的能力。
1.2 堆积酒醅发酵过程中的产香微生物
堆积酒醅发酵过程中产香菌株及特征香气物质见表2。
表2 堆积酒醅发酵过程中产香菌株及特征香气物质
Table 2 Aroma-producing strains and characteristic aroma substances during the fermentation process of stacking fermented grains

主要菌株 特征香气物质 香气 参考文献高温放线糖莱斯菌(Laceyellasacchari)、Bacillus licheniformis、Bacillus subtilis粟酒裂殖酵母(Schizosaccharomyces pombe)MT-14拜耳接合酵母(Zygosaccharomyces bailii)、库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)阿姆斯特丹散囊菌(Eurotium amstelodami)、扣囊复膜酵母(Saccharomycopsis fibuligera)苯乙醇、4-甲基吡嗪、4-乙基愈创木酚、4-甲基愈创木酚乙醇、丙醇、己醇、丁醇乙酸乙酯、己酸乙酯、丁酸乙酯戊醛、苯甲酸、异戊酸、乙酸异戊酯酱香醇香酯香花果香[28-30][31][32-34][35]
生香微生物代谢产生香气机制有两种:一是直接生成香气单体物质;二是利用酶类资源分解酒醅体系中的原料形成单体后与其他物质反应生成独特的香气成分。芽孢杆菌、地衣芽孢杆菌、产香枯草芽孢杆菌、高温放线菌(Thermoactinomyces)能促进、强化美拉德反应从而生成大量酱香物质,如4-甲基吡嗪、4-乙基愈创木酚、4-甲基愈创木酚等,可应用于高温大曲的增香提质,赋予酱香型白酒独特的风格及健康因子。高温放线糖莱斯菌发酵生成的吡嗪类物质呈现酱香风味[28-30]。粟酒裂殖酵母MT-14低产高级醇,其赋予白酒特殊香气、并在减小苦涩味等方面有着重要的作用[31]。拜耳接合酵母、库德里阿兹威氏毕赤酵母、德尔布有孢圆酵母(Torulaspora)、热带假丝酵母、东方伊萨酵母(Issatchenkia orientalis)是高产乙醇、乙酸乙酯的功能菌,具有丰富的酯香。乳酸菌能利用糖类产生乳酸、乙酸等有机酸,使酒体带入丰富的酸性风味,同时能与多种醇类反应生成酯类物质,增加酯香[32-34]。阿姆斯特丹散囊菌和扣囊复膜酵母固态发酵时生成苯甲酸、苯乙酮、戊醛、己醇、辛醇、异戊酸、异戊酯、乙酸异戊酯等物质,使得酒醅具有很强花香和果蔬香[35]。
2 不同轮次堆积酒醅发酵过程中优势微生物变化规律
2.1 不同轮次堆积酒醅发酵过程中优势真菌的动态变化
真菌能提供酶类资源和发酵动力,同时在堆积前后变化幅度较大。下沙轮次酒醅酵母菌(Saccharomyces)数量随着堆积时间逐渐增加,至入窖前酵母菌数量达到107~108 CFU/g[36]。在酱香型白酒2轮次堆积发酵酒醅中共检出4个门,分别为子囊菌门、接合菌门、担子菌门和壶菌门,46个属包括曲霉属(Aspergillus)、假丝酵母菌属(Candida)等[37]。2轮次堆积过程酒醅绝对优势真菌属有热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)、Candida、Aspergillus[38]。3轮次堆积发酵中心酒醅样品中优势真菌依次为曲霉菌属、热子囊菌属、红曲属等[39]。4轮次堆积酒醅主要优势菌有拟青霉属、假丝酵母属、念珠菌属和红曲霉属[40]。5轮次堆积第1天,Thermoascus和Thermomyces的相对丰度均高于Issatchenkia orientalis,堆积第3天和第5天显著下降;6轮次中,Issatchenkia、Thermoascus和Thermomyces为优势真菌属[41]。郭敏等[42]研究发现,在7轮次堆积样品中隐球菌属则是最优势菌属。
郝飞等[43]研究发现,下沙、造沙轮次以Pichia kudriavzevii为绝对优势酵母菌,1~5轮次酒醅中优势酵母菌的种类增多,主要的优势酵母菌有Pichia kudriavzevii、盔形毕赤酵母(Pichia manshurica)、Zygosaccharomyces bailii等。堆积酒醅的细菌、酵母、霉菌数量均在第3轮时达到峰值且总体先增加后减少;同一轮次堆积酒醅的细菌、酵母、霉菌数量中、下层高于上层[44]。张瀚之等[45]在酱香型白酒机械化酿造7个轮次堆积酒醅中共检出真菌4个门,102个属。嗜热真菌属、嗜热子囊菌属、曲霉属等是堆积过程中的重要真菌属。山其木格等[46]利用聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denatured gradient gel electrophoresis,PCR-DGGE)生物技术揭示微生物种群在各个轮次堆积过程的变化规律,发现下沙微生物种类较少,糙沙逐渐增多,2轮次最丰富。堆积酒醅中最主要的酵母菌为Zygosaccharomyces bailii、酿酒酵母(Saccharomyces cerevisiae)。不同轮次堆积前期酵母含量差别达452倍,但在下窖时在10倍以内[27]。白地霉(Geotrichum candidum)和Saccharomyces cerevisiae是5轮次的优势真菌,群落结构稳定性优于7轮次,同时在发酵前期酵母总量是第7轮的2~5倍[47]。徐佳等[48]研究表明,各轮次堆积表层的霉菌数量多于堆心。姜明慧等[49]研究发现,堆积过程中8个时间节点检测的真菌优势菌属均为生香酵母。米曲霉(Aspergillus oryzae)和宛氏拟青霉(Paecilomyces varioti)是发酵过程中的优势霉菌,在堆积开始之后持续增加,后期生物量下降[50]。席德州[51]从堆积酒醅中检出真菌132个属,优势菌属为Thermomyces、Troulaspora、丝衣霉菌(Byssochlamys)等。堆子上层酵母菌在堆积第2天生物量达到最大值,随着堆积时间的延长而减少。堆子中层酵母菌第3天达到最大值,随后逐渐减少。底层酵母菌生长较平稳。堆子边缘酵母菌数量显著多于堆子上、中和下层[52]。综上所述,堆积酒醅发酵时,富集到的真菌微生物是以酵母菌和霉菌为主,并且其中一部分来自环境微生物。因此,在研究堆积酒醅发酵中真菌微生物的演替规律时,加强对酿造区域气候及空气中菌群结构的研究具有重大的意义。
2.2 不同轮次堆积酒醅发酵过程中优势细菌的动态变化
酱香型白酒堆积发酵中细菌在产香、产酶、风味物质前体等方面具有重要的作用。下沙轮次堆积发酵过程中细菌优势菌属为乳酸菌,占比可达85%以上。下沙、造沙堆积酒醅优势微生物为埃希氏菌属、乳酸杆菌属、链球菌属等。在下沙、造沙轮次堆积酒醅细菌的数量逐渐增加,至入窖前细菌数量达到107~108 CFU/g。1轮次酒醅优势细菌属有13个,其中乳酸杆菌属、埃希氏菌属和芽孢杆菌属占主导地位[53]。2轮次堆积发酵过程酒醅中芽孢杆菌(Bacillus)、粪肠球菌(Enterococcus)、乳酸球菌(Lactococcus)、乳杆菌(Lactobacillus)为优势细菌属。3轮次堆积发酵酒醅中乳球菌属、醋酸杆菌属等为优势微生物[54]。孙利林等[55]研究表明,4轮次堆积发酵主要优势细菌是芽孢杆菌科。5、6轮次的堆积发酵中,Lactobacillus、海洋芽孢杆菌(Oceanobacillus)、枝芽孢杆菌(Virgibacillus)均为优势菌属。王云胜等[56]利用高通量测序技术研究7轮次堆积过程中主要细菌菌群结构变化发现,厚壁菌门和变形菌门为优势门;克罗彭斯特菌属、芽孢杆菌属等为优势细菌属。
王欢等[31]利用高通量测序技术分析机械化酿造车间7个轮次堆积酒醅细菌组成,共检测出14个门,456个属;其中优势细菌门为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Firmicutes),核心细菌属为放线菌属(Acinetobacter)、Bacillus等。程才璎等[57]运用PCRDGGE技术解析7个轮次堆积酒醅细菌群落结构发现,多样性指数随着轮次的增加而逐渐降低,堆积后期大于堆积前、中期。2~7轮次堆积酒醅中最主要的细菌为Bacillus licheniformis、Bacillus amyloliquefaciens,增殖倍数为1.3~5.5倍[58]。堆上细菌数量较少,在第2天时生物量达到最大值,随着堆积时间延长,生物量逐渐减少;中层酒醅堆积前期大量繁殖,第3天出现峰值;底层酒醅细菌生长较平稳。堆边细菌数量显著多于上层、中层、下层。Lactobacillus homohiochii是酱香型白酒发酵过程中丰度最高的乳酸菌[59]。韩兴林等[60]系统分析了高温堆积酒醅中原核微生物结构,共检出原核类微生物7个门,73个属,1 427个种,不同位置的微生物多样性排序为表层>面层>堆心。在机械化酿造堆积酒醅中共检出细菌496个属,优势属为Acinetobacter、Lactobacillus、Bacillus等。高温大曲中产香和产酶等细菌被带入到酒醅中,通过堆积发酵的方式,使其酱香浓郁、酯香突出,并带有水果香气。主要网罗到的细菌微生物是乳酸菌和芽孢杆菌,但是不同位置的酒醅富集效果具有显著差异。因此,缩小不同位置酒醅堆积差异,提高发酵的均一性值得更深层次的研究。
3 不同轮次堆积酒醅发酵过程中理化因子和风味物质的变化
3.1 不同轮次堆积酒醅发酵过程中理化因子的变化
控制重要理化指标在正常范围内波动是保证酱香型白酒窖内糖化与发酵顺利进行的核心。下沙轮次堆积发酵酒醅升温过程由内向外,表层温度变化曲线为“S”型。2轮次酒醅水分含量为47%~50%;粗蛋白、还原糖呈上升的趋势;淀粉含量逐渐下降;酸度在堆积发酵前期缓慢上升,堆积后期呈下降趋势;顶温达到50 ℃。3轮次堆积酒醅水分含量为42%~46%;表层温度最高,升温幅度最大;淀粉、蛋白质含量降低;还原糖含量升高[61]。4轮次堆积酒醅水分、酸度、淀粉及还原糖含量基本维持恒定;40 cm的堆子表层温度可达50℃,堆心温度缓慢升温,幅度远低于堆表层。7轮次堆积发酵过程酒醅酸度呈上升趋势,水分和淀粉含量下降,并且下降幅度较大。堆积发酵酒醅水分随着轮次的增加显著增加;酸度先增加后降低,在5轮次达到峰值;3、4轮次与1、6、7轮次还原糖含量存在显著性差异;淀粉含量随着轮次的增加显著降低。张永燕等[62]研究结果发现,酒醅的淀粉含量呈下降趋势;酸度为1.5~3.5 mmol/10 g;还原糖含量先增加后降低;水分含量在第3~7轮次下窖酒醅中均维持在45%~50%。孙炜方[63]发现同一轮次随着堆积时间的延长,乙醇、酸度、温度含量升高;水分、还原糖、淀粉含量减少。
3.2 不同轮次堆积酒醅发酵过程中风味物质的变化规律
堆积发酵助力独特酱香风味形成。经堆积产出的酒酱香明显、醇甜、产酒较多,反之则酱香不突出、风格不典型。张春林等[37]研究表明,在堆积发酵期间,酯类和醛类含量下降,酸类、酮类、呋喃类含量呈现上升趋势。酸类化合物在堆积第3天含量达到最大值随后下降;酚类和含氮化合物变化不大。尚柯等[64]研究表明,不同的堆积时间点(第1天、第4天和第9天)和空间点(堆子表层、近表层、堆心以及堆底)3轮次酒醅中的挥发性物质种类数量具有差异。随着堆积时间的延长,种类呈现渐升的趋势;而不同空间点则变化不明显。相对含量方面,醇类在堆积过程中较高,呈现先下降后升高的趋势,同时表层和堆底较低,近表层和堆心部位略高。醛和酸类相对含量均较低,堆积发酵过程中几乎不变化。面层有机酸类明显高于其他位置点,而醛类化合物则相反。酯类物质相对含量呈现先明显升高后降低的趋势。吴成等[40]在4轮次堆积前期、中期和末期节点不同深度酒醅中共检出23种风味化合物,其中醛类和酸类风味物质含量急剧下降,酯类和醇类风味物质含量基本维持不变。堆积发酵前期和中期酒醅风味结构相似,主要以酸类、酯类和醛类物质为主;发酵末期则以醇类物质为主。胡春红等[65]在智能、传统车间下沙~4轮次丢堆完成、翻堆后和下窖时3个时间点的酒醅样品中检测到95种共有风味物质;相对含量方面,智能车间堆积酒醅以酯类和酸类物质为主导(占48.37%、21.66%)而传统车间酒醅酯类和醇类物质为特征成分(占60.45%、23.42%)。酯类、醇类物质相对含量均呈现先增加后降低再上升的趋势。酸类物质相对含量的动态变化,在1轮次达到最大值。韩兴林等[66]在8个堆积轮次堆子不同部位混合酒醅样品中检出挥发性风味化合物83种,其中第3、4和5轮次种类最多,醇类物质在第3和4轮次种类较多,7和8轮次相对含量高于其他;醛类风味物质主要在第4轮检出较多,相对含量均较低;而有机酸种类和相对含量主要在第5轮次较高;酯类风味物质种类平均,相对含量在第6和7轮次明显高于其他轮次。
4 堆积酒醅发酵过程中微生物、理化因子以及风味物质之间的关系
4.1 堆积酒醅发酵过程中微生物与理化因子之间的关系
理化因子与核心细菌、真菌之间具有密切的相关性,对微生物生长具有紧密的调控作用,共同推动发酵过程的菌群演替,促进酿造的正常进行。王欢等[31]研究发现,Bacillus、Thermoactinomyces、片球菌属(Pediococcus)和魏斯氏菌(Weissella)均与淀粉含量呈显著正相关,柄杆菌属(Caulobacter)、鞘鞍醇单胞菌(Sphingomonas)与淀粉含量显著负相关。主要是因为Bacillus能产生蛋白酶与淀粉酶等水解酶类,水解原料形成丰富的发酵前体物质,而Thermoactinomyces具有糖化力、液化力和较高的蛋白质分解力,可降解酿酒原料中的淀粉、蛋白质等生成香味物质。Caulobacter和Sphingomonas与水分呈显著正相关,而Bacillus、Thermoactinomyces、Pediococcus与水分显著负相关。Sphingomonas与酸度呈显著正相关,而Bacillus、Thermoactinomyces、Pediococcus与酸度呈显著负相关。其原因为,Sphingomonas等代谢产生或促进产酸,而酸度提高的同时又抑制Bacillus、Thermoactinomyces和Pediococcus的生长和代谢。吴成等[67]研 究 表 明,Lactobacillus、醋 酸 菌(Acetobacter)、Pichia 和Saccharomyces与酒醅温度和葡萄糖含量呈正相关关系,与水分呈显著负相关,表明造沙轮次堆积发酵主要是由以上4种优势微生物驱动。倪冰倩等[68]研究发现,酒醅的水分、酸度与Bacillus、Lacotobacillus及生丝毕赤酵母属(Hyphopichia)、Torulaspora等呈极显著的正相关关系;淀粉、还原糖与细菌属Pediococcus、克雷伯菌属(Klebsiella)和真菌属Thermomyces、Aspergillus呈极显著的正相关。可能是因为Thermomyces和Thermoascus能产生大量降解碳水化合物的嗜热酶,而Lacotobacillus可以产生供酵母菌酯化的乳酸。陈博超[69]研究表明,总酸、水分和温度和Lactobacillus呈显著正相关,而Oceanobacillus、Virgibacillus、Kroppenstedtia能产生大量淀粉酶,因此与淀粉呈负相关。
4.2 堆积酒醅发酵过程中微生物与风味物质之间的关系
微生物代谢是白酒中风味化合物的重要来源。黄慧芹等[70]研究表明,Lactobacillus与乳酸乙酯、琥珀酸二乙酯和苯乙酸乙酯等呈显著正相关,在酱香型白酒发酵过程中具有重要的酯类合成作用。Virgibacillus与苯甲酸呈显著正相关,与乳酸乙酯和琥珀酸二乙酯呈显著负相关;克罗彭施泰特氏菌(Kroppenstedtia)与琥珀酸单乙酯和苯甲醇呈显著正相关。在关键真菌群落中,Thermoascus与十八乙二醇单十二烷基醚呈正相关,与癸酸乙酯和棕榈酸乙酯呈负相关。Aspergillus与乳酸乙酯呈显著正相关,与苯甲醇呈负相关。可能是因为,曲霉菌通过产酯化酶提升酒醅中乳酸乙酯、己酸乙酯等酯类含量。Issatchenkia与4-乙基愈创木酚呈正相关,与丁酸呈显著负相关。郭松波等[71]研究结果发现,异戊酸乙酯、乙酸异戊酯、戊酸乙酯等23种风味物质受劳尔氏菌属(Ralstonia)、Lactobacillus和Saccharomyces的影响较大;甲酸乙酯、乙酸乙酯和丁酸乙酯等11种风味物质受Kroppenstedtia、Pichia和Issatchenkia的影响较大,庚酸乙酯、苯乙酸乙酯和正己醇等8种风味物质受Oceanobacillus影响较大。任婷婷[72]研究发现,乙酸和乙醇与Weissella和Oceanobacillus均呈显著负相关,而与威克汉姆酵母属(Wickerhamomyces)、Lactobacillus和Aspergillus呈极显著正相关,可能是Aspergillus和Lactobacillus具有产生有机酸的能力。Aspergillus与辛酸乙酯、琥珀酸二乙酯、γ-壬内酯和油酸乙酯呈正相关。
5 结论
堆积酒醅通过富集微生物进行发酵生成风味或风味前体物质,从而影响窖池内菌群组成结构、轮次基酒的产量和质量。微生物、风味物质和理化因子在白酒酿造中起着重大的作用。因此,开展对酱香型白酒堆积发酵过程菌系、物系、酶系的研究有利于揭示微生物组成结构、功能特性和最适生长理化环境。目前,针对堆积酒醅的研究集中在微生物和代谢产物方面,但对于不同轮次、不同空间位置、不同堆积时间的酒醅以及酿造环境中的菌群组成和理化因子的变化规律总体研究较为欠缺。未来关于堆积发酵的研究将朝着利用高新技术多维度解析酒醅以及酿造环境中微生物、风味物质、酶活力和理化因子组成变化规律,并将其与基酒产量和质量进行关联分析,从而深度探明影响白酒发酵的主要和次要因素。同时实现在堆积阶段利用功能菌剂等改善发酵异常的酒醅,保证酱香型白酒高质量、一致性产出。
[1]张瀚之,席德州,王欢,等.酱香型白酒机械化酿造不同轮次堆积发酵酒醅真菌群落结构多样性研究[J].中国酿造,2021,40(12):64-69.
[2]MENG X,WU Q,WANG L,et al.Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai-flavor liquor making[J].J Ind Microbiol Biot,2015,42(12):1601-1608.
[3]YANG L,XIAN C,LI P,et al.The spatio-temporal diversity and succession of microbial community and its environment driving factors during stacking fermentation of Maotai-flavor Baijiu[J].Food Res Int,2023,169:112892.
[4]DONG W,ZENG Y,CUI Y.Retraction notice to unraveling the composition and succession of microbial community and its relationship to flavor substances during Xin-flavor Baijiu brewing[J].Int J Food Microbiol,2022,372:109679.
[5]戴奕杰,田志强,黄家岭,等.酱香型白酒生物化学及微生物学研究进展[J].酿酒科技,2016(3):100-105.
[6]尚柯.酱香型白酒高温堆积工艺机理的初步研究[D].乌鲁木齐:新疆农业大学,2016.
[7]HUANG Y, WANG Y, XU Y.Purification and characterisation of an acid protease from the Aspergillus hennebergii HX08 and its potential in traditional fermentation[J].J I Brewing,2017,123:432-441.
[8]HAO F,TAN Y W,LV X B,et al.Microbial community succession and its environment driving factors during initial fermentation of maotai-flavor Baijiu[J].Front Microbiol,2021,12:669201.
[9]YANG L,ZENG S,ZHOU M,et al.Comprehensive genomic and metabolomic analysis revealed the physiological characteristics and pickle like odor compounds metabolic pathways of Bacillus amyloliquefaciens ZZ7 isolated from fermented grains of Maotai-flavor Baijiu[J].Front Microbiol,2023(14):1295393.
[10]戴奕杰,李宗军,田志强.酱香型白酒酒醅酶活性和轮次酒理化指标分析[J].中国酿造,2019,38(2):31-36.
[11]班世栋,王晓丹,陈孟强,等.酱香型大曲中具产酶功能霉菌的分离筛选[J].酿酒,2014,41(4):31-36.
[12]ZHANG W Q,SI G R,DU H,et al.Directional design of a starter to assemble the initial microbial fermentation community of Baijiu[J].Food Res Int,2020,134:109255.
[13]黄永光.酱香型白酒酿造中Aspergillus hennebergii及其分泌酸性蛋白酶的研究[D].无锡:江南大学,2014.
[14]王晓丹,徐佳,周鸿翔,等.酱香型大曲中分离到的阿姆斯特丹散囊菌产酶产香特性[J].食品科学,2016,37(11):154-159.
[15]白成松,陈莉,卢红梅,等.茅台地区酱香型酒糟中高温放线菌的分离鉴定[J].食品工业科技,2017,38(8):199-202.
[16]戴奕杰,李宗军,田志强.酱香型白酒酒醅酶活性和轮次酒理化指标分析[J].中国酿造,2019,38(2):31-36.
[17]杨国华,邱树毅,黄永光.酱香大曲中产香细菌发酵产蛋白酶的条件优化[J].中国酿造,2011(12):47-50.
[18]杨国华,黄永光,邱树毅,等.酱香白酒酿造过程HMZ-D发酵风味产物研究[J].酿酒科技,2013(2):38-41.
[19]吴生文,张志刚,李旭晖.大曲微生物在大曲酒生产中的研究开发现状及发展前景[J].中国酿造,2011(5):8-13.
[20]张倩,赵华,张美艳,等.与产酱香有关细菌的分离及在酒醅堆积中的作用[J].酿酒科技,2014(7):54-56.
[21]ZHANG R,WU Q,XU Y.Aroma characteristics of Moutai-flavor liquor produced with Bacillus licheniformis by solid-state fermentation[J].Lett Appl Microbiol,2013,57(1):11-18.
[22]彭素琴,吴群,徐岩.产酱香地衣芽孢杆菌CGMCC 3963耐受特征及基于转录组学的耐受机制分析[J].微生物学通报,2014,41(12):2395-2403.
[23]周莲,陈莉,卢红梅,等.茅台地区酱香型酒糟中高温细菌的分离鉴定[J].中国酿造,2016,35(3):61-65.
[24]陈剑,蒋英丽,程伟,等.酱香型白酒酒糟中耐酸产酯香细菌的筛选[J].酿酒科技,2016(2):61-64.
[25]黄永光,徐岩.真菌Aspergillus hennebergii酸性蛋白酶小麦固态发酵性能研究[J].食品工业科技,2014,35(21):135-139.
[26]杨维建,王会,邓勇,等.高温红曲霉的生物学特性研究[J].酿酒科技,2013(10):48-50.
[27]吴徐建,吴群,徐岩.一株耐受酒精解淀粉芽孢杆菌(Bacillus amyloliquefaciens CGMCC 6262)的研究[J].工业微生物,2014,44(4):7-12.
[28]王西,沈毅,张亚东,等.产香枯草芽孢杆菌在酱香型白酒生产中的应用[J].酿酒科技,2018(7):70-75.
[29]尤小龙,黄永光,黄蕴利,等.一株酱香白酒放线菌代谢产物活性及其对酿造环境中功能菌的作用[J].酿酒科技,2018(8):17-23.
[30]罗小叶.酱香型大曲高温放线菌的特性研究[D].贵阳:贵州大学,2017.
[31]王欢,席德州,黄永光,等.酱香型白酒机械化酿造不同轮次堆积发酵细菌菌群结构多样性分析[J].食品科学,2020,41(2):188-195.
[32]罗小叶,邱树毅,陆安谋,等.酱香大曲产香酵母的分离及鉴定[J].食品与发酵工业,2016,42(12):26-31.
[33]陈梦圆,刘学彬,汪平,等.产酯香功能菌对酱香型酒醅的影响[J].食品科学,2018,39(10):199-205.
[34]王莉,陈良强,杨帆,等.酱香型白酒耐乳酸酵母的筛选及特性研究[J].中国酿造,2018,37(12):28-32.
[35]庄孝杰,吴群,徐岩.酱香型白酒酿造拜耳接合酵母生理代谢特征及其与地衣芽孢杆菌相互作用[J].微生物学通报,2017,44(2):251-262.
[36]涂昌华,郝飞,汪地强,等.酱香型白酒下沙、造沙轮次堆积发酵过程中酒醅温度与微生物的变化规律分析[J].酿酒科技,2020(2):60-64.
[37]张春林,杨亮,李喆,等.酱香型白酒二轮次堆积酒醅微生物群落与理化指标相关性研究[J].中国酿造,2021,40(11):31-36.
[38]黄蕴利,黄永光,胡建峰,等.酱香型白酒第二轮次酒发酵过程微生物多样性研究[J].中国酿造,2017,36(9):30-35.
[39]赵才贤.酱香型白酒大曲和酒醅的微物群落结构特征及其变化规律研究[D].贵阳:贵州大学,2021.
[40]吴成,程平言,谢丹,等.酱香型白酒4轮次堆积发酵理化因子、风味物质与微生物群落相关性分析[J].食品科学,2023,44(2):240-247.
[41]WANG W H, XU Y, HUANG H.Correlation between microbial communities and flavor compounds during the fifth and sixth rounds of sauceflavor baijiu fermentation[J].Food Res Int,2021,150(Pt A):110741.
[42]郭敏,黄永光,邱树毅,等.高通量测序在酱香白酒微生态多样性研究中的应用[J].中国酿造,2017,36(5):146-151.
[43]郝飞,吕锡斌,吴耀领,等.酱香型白酒酿造酒醅中酵母菌多样性研究[J].菌物学报,2019,38(5):620-630.
[44]万勇,张兆丰,熊翔,等.不同轮次酱香型酒醅微生物变化规律研究[J].中国食品工业,2022(2):98-100.
[45]张瀚之,席德州,王欢,等.酱香型白酒机械化酿造不同轮次堆积发酵酒醅真菌群落结构多样性研究[J].中国酿造,2021,40(12):64-69.
[46]山其木格,梁慧珍,张长霞,等.糟醅堆积过程中微生物种群的变化规律[J].食品与生物技术学报,2016,35(3):330-335.
[47]邵明凯,王海燕,徐岩,等.酱香型白酒发酵中酵母群落结构及其对风味组分的影响[J].微生物学通报,2014,41(12):2466-2473.
[48]徐佳,邱树毅,胡宝东,等.酱香型白酒酿造过程中霉菌的功能性研究[J].酿酒,2015,42(5):32-38.
[49]姜明慧,许玲,于文娟,等.高通量测序技术分析酱香型白酒下沙轮次堆积过程的微生物多样性[J].酿酒,2020,47(4):51-55.
[50]陈笔.酱香型白酒酿造过程中霉菌群落结构以及霉菌与酵母相互作用的研究[D].无锡:江南大学,2014.
[51]席德州.酱香型白酒机械化酿造过程中的微生物群落结构研究[D].贵阳:贵州大学,2018.
[52]杜新勇,范志勇,赵殿臣,等.北方酱香型白酒生产过程微生物及温度变化规律分析[J].酿酒科技,2013(5):51-55.
[53]胡小霞,黄永光,涂华彬,等.酱香型白酒1轮次酿造细菌的菌群结构[J].食品科学,2020,41(14):175-182.
[54]李欣,王彦华,林静怡,等.高通量测序技术分析酱香型白酒酒醅的微生物多样性[J].福建师范大学学报(自然科学版),2017,33(1):51-59.
[55]孙利林,李立郎,胡萍,等.酱香型白酒第四轮次酒酿造过程中细菌多样性分析[J].中国酿造,2020,39(5):35-39.
[56]王云胜,辛健康,陈银翠,等.酱香白酒第七轮次堆积发酵过程中细菌群落的动态变化[J].基因组学与应用生物学,2022,41(6):1244-1253.
[57]程才璎,刘晓风,袁月祥,等.酱香型白酒酒曲和连续七轮次堆积酒醅的细菌群落结构[J].应用与环境生物学报,2014,20(5):825-831.
[58]吴徐建.酱香型白酒固态发酵过程中酵母与细菌群落结构变化规律的研究[D].无锡:江南大学,2013.
[59]吴莉莉,王海燕,徐岩,等.酱香型与清香型白酒发酵过程中乳酸菌菌群的差异性分析[J].微生物学通报,2013,40(12):2182-2188.
[60]韩兴林,潘学森,尚柯,等.酱香高温堆积酒醅中原核微生物构成的分析[J].酿酒,2017,44(1):22-27.
[61]尚柯,韩兴林,潘学森,等.酱香型白酒高温堆积过程相关理化参数变化情况的初步分析[J].酿酒科技,2015(10):1-4.
[62]张永燕,黄业传,腾刚,等.不同轮次酱香型酒醅的理化指标及风味物质变化规律研究[J].宁夏师范学院学报,2018,39(4):28-35.
[63]孙炜方.麸曲酱香白酒生产工艺及堆积发酵对风味物质影响的研究[D].沈阳:沈阳农业大学,2019.
[64]尚柯,韩兴林,王德良,等.酱香白酒高温堆积酒醅挥发性风味物质的检测分析[J].中国酿造,2016,35(2):139-143.
[65]胡春红,李新涛,卢君,等.酱香型白酒酒醅堆积过程酵母菌、酶活力及代谢产物变化规律[J].中国酿造,2024,43(6):66-73.
[66]韩兴林,尚柯,王德良,等.酱香白酒堆积发酵过程中代谢风味生成规律的分析[J].酿酒,2018,45(4):37-44.
[67]吴成,杨龙飞,胡峰,等.酱香型白酒造沙轮次堆积发酵微生物及理化指标演替规律[J].食品科技,2023,48(6):9-15.
[68]倪冰倩,夏韩硕,闵伟红,等.Pichia kudriavzevii生物强化对酱香型白酒酒醅微生物群落结构及挥发性风味组分的影响[J].食品科学技术学报,2024,42(2):93-108.
[69]陈博超.北方酱酒第五轮次细菌群落解析与功能研究[D].天津:天津科技大学,2023.
[70]黄慧芹,徐友强,李微微,等.北京地区酱香型白酒第四轮次入窖酒醅中微生物及风味物质的变化[J].食品工业科技,2024,45(1):97-107.
[71]郭松波,谢三款,张娇娇,等.茅台地区酱香大回酒轮次发酵机理分析[J].中国酿造,2022,41(7):38-44.
[72]任婷婷.洞酿酱香酒下沙轮次微生物多样性及风味品质形成研究[D].贵阳:贵州大学,2023.