发酵果汁是指将果肉榨汁后,由微生物发酵制成的果汁[1]。果汁发酵既可以最大限度地保留水果中的营养成分,又能经过发酵产生抑菌物质[2]。此外,发酵果汁还具有降低脂肪和胆固醇、延缓细胞衰老、调节肠道菌群平衡、促进消化吸收、润肠通便等功效[3]。
发酵果汁的生产过程中,主要采用酒精脱除工艺和限制发酵工艺来达到低醇或无醇的目的[4]。其中限制发酵工艺中特种酵母法是指采用专门的产香酵母,以达到低产乙醇、高产香的目的,是一种绿色、经济的提高发酵果汁品质的方法[5]。酿酒酵母(Saccharomyces cerevisiae)在发酵过程中产生的主要发酵产物是酒精和二氧化碳,这些产物可能对果汁的风味和口感产生负面影响[6]。非酿酒酵母(non-Saccharomyces yeast)多存在于水果表皮[7],其在发酵过程中能对产品产生积极作用[8]。BADURA I等[9]研究发现,大部分非酿酒酵母能够产生合成芳香化合物的酶和丰富的酯类,如己酸乙酯(香蕉、苹果气味)、乙酸乙酯(果香和甜味),这些酯类对葡萄酒的风味有很大的贡献;刘景等[10]研究发现,与原果汁相比,采用非酿酒酵母发酵的苹果汁,在口感、香气和感官品质上都有较大的提升;研究发现,由非酿酒酵母发酵后不仅可以减少果汁中的氧化反应,保持果汁的新鲜度和品质,还可以提高果汁中的维生素C(vitaminC,VC)含量和抗氧化活性,增加果汁的营养价值[11]。与酿酒酵母相比,非酿酒酵母发酵时产生的酒精较少,且在发酵过程中会产生更多的香气物质和胞外酶,这表明非酿酒酵母可能更适用于果汁发酵[12]。
因此,需要进一步研究和开发新的优势酵母,以更加经济的方式提高发酵果汁的品质。本研究以不产乙醇、高产酯的酵母菌株G4为研究对象,采用形态学观察及分子生物学技术对其进行菌种鉴定。以菌株G4为出发菌株,通过常压室温等离子体(atmospheric room temperature plasma,ARTP)诱变复合紫外诱变选育低产乙醇、高产酯菌株,并对其遗传稳定性、耐受性及溶血安全性进行研究,为开发发酵果汁提供菌种资源,降低生产成本。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
樱桃:山东泉灵酒庄有限公司;树莓:临夏市山河农业科技发展有限公司;酵母菌株G4:分离自葡萄皮,保藏于本实验室,具有较强的产酯能力;商业安琪产香酵母AQ:安琪股份有限公司。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[13]:20 g/L葡萄糖,20 g/L蛋白胨,10 g/L酵母浸膏。YPD固体培养基:YPD培养基中添加20 g/L琼脂。121 ℃高压蒸汽灭菌20 min。
产酯培养基[14]:20 g/L马铃薯,20 g/L葡萄糖,20 g/L琼脂,4 g/L三丁酸甘油酯。121 ℃高压蒸汽灭菌20 min。
哥伦比亚血琼脂平板:南京全隆生物技术有限公司。
1.1.3 试剂
葡萄糖(分析纯):天津市凯通化学试剂有限公司;蛋白胨(生化试剂):北京奥博星生物技术有限公司;酵母浸膏(生化试剂):广东环凯微生物科技有限公司;琼脂(生化试剂):南京茂捷微生物科技有限公司;三丁酸甘油酯(纯度≥98.0%):广东云门生物技术有限公司;无水乙醇(分析纯):国药集团化学试剂有限公司;酵母基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司。
1.2 仪器与设备
DM2500显微镜:德国徕卡有限公司;UV-2600紫外分光光度计:日本岛津有限公司;ARTP-II型常压室温等离子体诱变仪:北京思清源生物科技有限公司;SPX-288生化培养箱:宁波江南仪器厂;MQD-S2NR摇床:上海旻泉有限公司;85-2A恒温磁力搅拌器:金坛区西城新瑞仪器厂;PHS-25 pH计:上海仪电科学仪器有限公司;A600聚合酶链式反应(polymerase chain reaction,PCR)仪:杭州朗基科学仪器有限公司;GCMS-QP2020气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用仪:日本岛津有限公司。
1.3 方法
1.3.1 菌株G4的鉴定
形态学观察[15]:将菌株G4划线接种于YPD固体培养基,28 ℃条件下倒置培养48 h,肉眼观察菌株的菌落形态,并采用显微镜观察细胞形态。
分子生物学鉴定:参照BAO Y等[16]的方法提取菌株G4的基因组DNA,并对其26S rDNA基因序列进行PCR扩增,将PCR扩增产物送至金唯智生物科技有限公司进行序列测定,将测序结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索,选取同源性较高的模式菌株的26S rDNA基因序列,采用MEGA 7.0软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.2 菌株G4的生长曲线
将菌株G4接种于YPD培养基,于28 ℃、150 r/min条件下培养24 h得到种子液。将种子液按4%(V/V)的接种量接种至YPD培养基中。28 ℃、150 r/min条件下培养30 h,从培养第4小时开始,每隔2 h取样,采用紫外分光光度计测定菌液在波长600 nm处的吸光度值(OD600nm值),并以培养时间为横坐标,OD600nm值为纵坐标,绘制菌株G4的生长曲线[17]。
1.3.3 ARTP诱变
取对数期生长期的菌株G4发酵液,于6 000 r/min离心10 min,收集菌体。使用无菌水洗涤菌体3次,去除杂质,采用无菌水将菌体重悬,并制备成菌体细胞浓度为1×108CFU/mL的菌悬液。使用氦气(He)作为工作气体,调节常压室温等离子体诱变仪的气流量为10 L/min,电源功率为120 W,取10 μL菌悬液滴在已灭菌的金属载片上,分别诱变处理0(未处理)、3 min、6 min、9 min、12 min、15 min、18 min[18],采用无菌水对诱变处理样品进行适当稀释,并将其涂布于产酯培养基上,于28 ℃条件下培养2~3 d,采用平板计数法进行菌落计数,并计算致死率,其计算公式如下[19]:
式中:A表示未处理的总菌落数,CFU/cm2;B表示诱变处理后的总菌落数,CFU/cm2。
1.3.4 紫外诱变
以ARTP诱变筛选出的突变菌株为出发菌株培养至对数期生长期。在黑暗条件下,取10 mL菌液放入装有转子的无菌的培养皿中,一边旋转一边进行紫外照射,紫外照射条件分别为0、6 min、9 min、12 min、15 min、18 min、21 min。照射结束后,对诱变处理样品进行适当稀释,并将其涂布在产酯培养基上,于28 ℃条件下避光培养2~3 d,采用平板计数法进行菌落计数并计算致死率。
1.3.5 诱变菌株的筛选
初筛[20]:挑取透明圈较明显的单菌落点接于产酯培养基上,于28 ℃条件下培养,每天使用游标卡尺测量酵母菌落直径(d)和透明圈直径(D),直至透明圈不再增大,计算D/d值。
复筛:将初筛得到的菌株接种于YPD培养基中,28 ℃、150 r/min条件下培养24 h,作为种子液,然后按4%(V/V)的接种量将种子液接种于装液量为100 mL/250 mL的YPD培养基中,于28 ℃、150 r/min条件下培养3 d。采用皂化中和法测定发酵液中的总酯含量[21]。
1.3.6 筛选菌株产乙醇能力的测定
将樱桃、树莓分别榨汁,用白砂糖将果汁的可溶性固形物含量调至12°Bx,于88 ℃条件下灭菌15 min,备用。果汁中按5%的接种量分别接种商业安琪产香酵母AQ(对照)和筛选菌株,于28 ℃条件下静置发酵5 d,参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定乙醇含量。
1.3.7 遗传稳定性试验
将筛选菌株种子液按4%(V/V)的接种量接种于装液量为100 mL/250 mL的YPD培养基,28 ℃、150 r/min条件下培养48 h,作为0代;连续传代培养8次,取第0、2、4、6、8次传代的发酵液测定总酯含量,考察诱变菌株产酯能力的遗传稳定性。
1.3.8 耐受性试验
将筛选菌株的种子液按5%的接种量分别接种于不同葡萄糖含量(10%、15%、20%、25%、30%)、乙醇体积分数(2%、4%、6%、8%、10%)、SO2质量浓度(50 mg/L、100 mg/L、150 mg/L、200 mg/L、250 mg/L)、pH(2.5、3.0、3.5、4.0、4.5)的YPD液体培养基中,于28 ℃、150 r/min条件下培养24 h,测定OD600 nm值,每个样品设置3组平行,考察筛选菌株对葡萄糖、乙醇、SO2及酸的耐受性。
1.3.9 溶血安全性试验
将筛选菌株接种到哥伦比亚血琼脂平板上,于28 ℃条件下培养2~3 d,观察其菌落周围是否有溶血圈出现。
1.3.10 数据处理与统计分析
每个试验重复3次,采用SPSS Statistics 27.0软件处理数据并进行统计学分析,结果用“平均值±标准差”表示,采用Origin 2021软件绘图。
2 结果与分析
2.1 菌株G4的鉴定
2.1.1 形态学观察
菌株G4的菌落及细胞形态见图1。由图1可知,菌株G4的菌落呈红色,表皮光滑,边缘规则,细胞呈卵圆状。
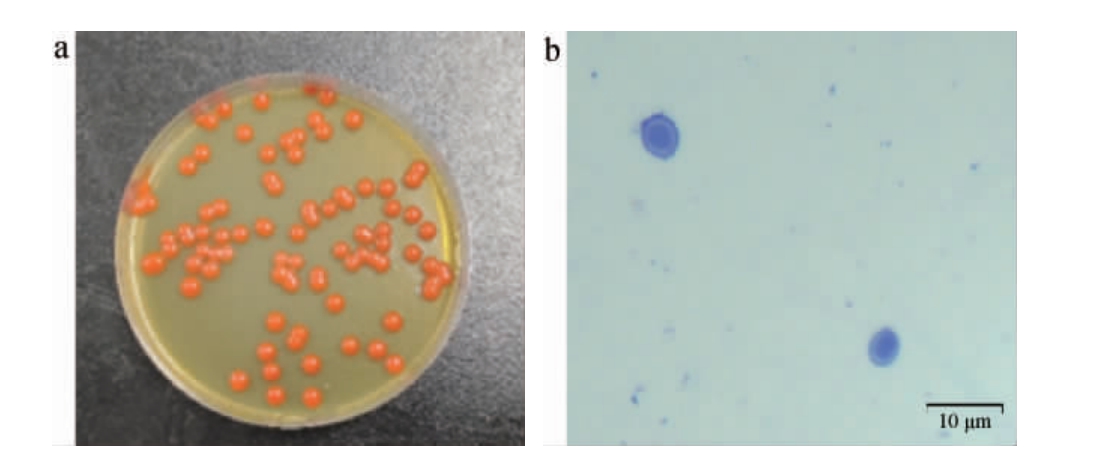
图1 菌株G4的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain G4
2.1.2 分子生物学鉴定
基于26S rDNA基因序列构建菌株G4的系统发育树,结果见图2。由图2可知,菌株G4与胶红酵母(Rhodotorula mucilaginosa)FK1聚于同一分支,亲缘关系最近,结合形态学观察结果,最终鉴定菌株G4为胶红酵母(Rhodotorula glutinosa)。
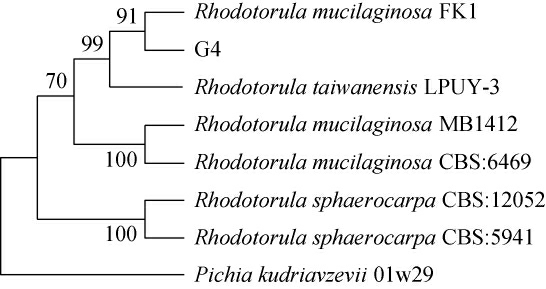
图2 基于26S rDNA基因序列菌株G4的系统发育树
Fig.2 Phylogenetic tree of strain G4 based on 26S rDNA gene sequences
2.2 胶红酵母G4的生长曲线
胶红酵母G4的生长曲线见图3。由图3可知,胶红酵母G4前期生长比较迟缓,0~10 h为迟缓期,10~22 h为对数生长期,在22 h后进入稳定期。因此,选取培养16 h左右的菌液进行诱变处理。
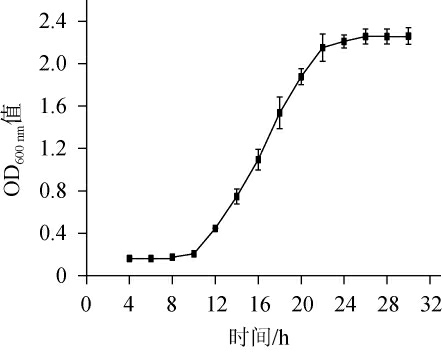
图3 胶红酵母G4的生长曲线
Fig.3 Growth curve of Rhodotorula glutinosa G4
2.3 胶红酵母G4的诱变
2.3.1 诱变时间的选择
胶红酵母G4经不同时间诱变后的致死曲线见图4。由图4a可知,随着ARTP诱变时间的不断延长,胶红酵母G4的致死率不断升高。当诱变时间达到12 min时,胶红酵母G4的致死率为81.1%,当ARTP诱变时间延长至15 min时,胶红酵母G4的致死率达到96.2%。研究表明,当菌株致死率在80%左右时,有着较高的正突变率,诱变效果较好[22],因此,选择ARTP诱变时间为12 min。由图4b可知,胶红酵母G4的致死率随着紫外诱变时间的延长而逐渐升高,当紫外诱变时间为18 min时,胶红酵母G4的致死率达到了83.3%,当紫外诱变时间延长至21 min时,致死率几乎达到100%。因此,选择紫外诱变时间为18 min。
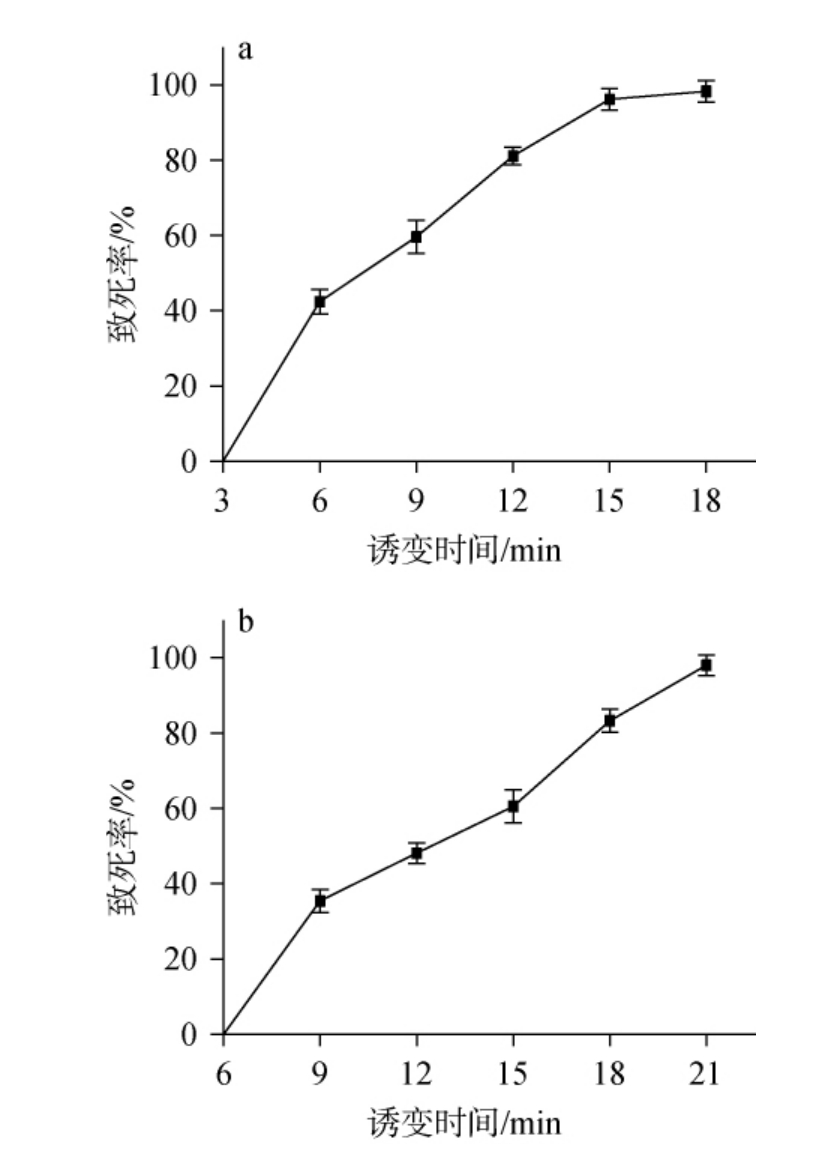
图4 常压室温等离子体(a)及紫外(b)诱变条件下胶红酵母G4的致死曲线
Fig.4 Lethal curve of Rhodotorula glutinosa G4 under atmospheric pressure and room temperature plasma (a) and ultraviolet (b)mutagenesis conditions
2.3.2 ARTP诱变菌株的筛选
部分诱变菌株在产酯培养基上的生长情况见图5,由图5可知,诱变菌株周围出现了透明圈,说明其可利用自身产生的酯酶将三丁酸甘油酯分解为甘油和脂肪酸,产生透明圈[23]。菌株产生的透明圈大小在一定程度上可表征菌株的产酯能力的强弱。一般来说,菌株产生的透明圈越大,产酯能力越强,反之则越弱。通过筛选最终得到10株D/d值较大的诱变菌株,结果见图6。

图5 部分常压室温等离子体诱变菌株在产酯培养基上的生长情况
Fig.5 Growth of some mutant strains by atmospheric pressure and room temperature plasma on ester-producing medium
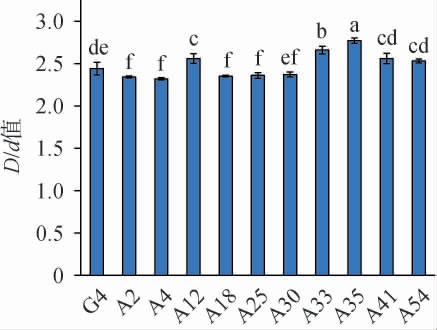
图6 出发菌株G4及常压室温等离子体诱变菌株的D/d值
Fig.6 D/d value of starting strain G4 and mutant strains by atmospheric pressure and room temperature plasma
不同小写字母表示差异显著(P<0.05)。下同。
由图6可知,出发菌株G4的D/d值为2.44,5株诱变菌株的D/d值大于出发菌株G4,其中诱变菌株A35的D/d值最大,达到了2.77,是出发菌株G4 D/d值的1.14倍。透明圈大小只是粗略表征菌株的产酯能力,因此,进一步测定出发菌株G4及10株诱变菌株的产酯能力,结果见图7。
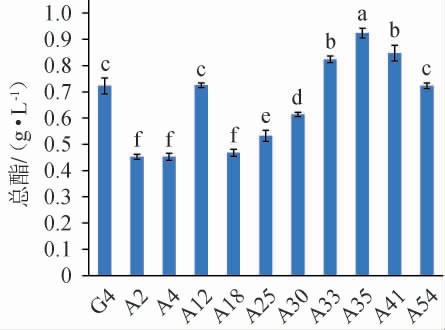
图7 出发菌株G4及常压室温等离子体诱变菌株的总酯含量
Fig.7 Total ester contents of starting strain G4 and mutant strains by atmospheric pressure and room temperature plasma
由图7可知,出发菌株G4的总酯含量为0.72 g/L,5株诱变菌株的总酯含量均高于出发菌株G4,其中诱变菌株A35的总酯含量最高,为0.92 g/L,是出发菌株G4总酯含量的1.28倍。因此,选取诱变菌株A35作为紫外诱变的出发菌株。
2.3.3 紫外诱变菌株的筛选
以ARTP诱变菌株A35为出发菌株进行紫外诱变,最终筛选出10株D/d值较大的诱变菌株,并进一步测定其产酯含量,结果见图8。
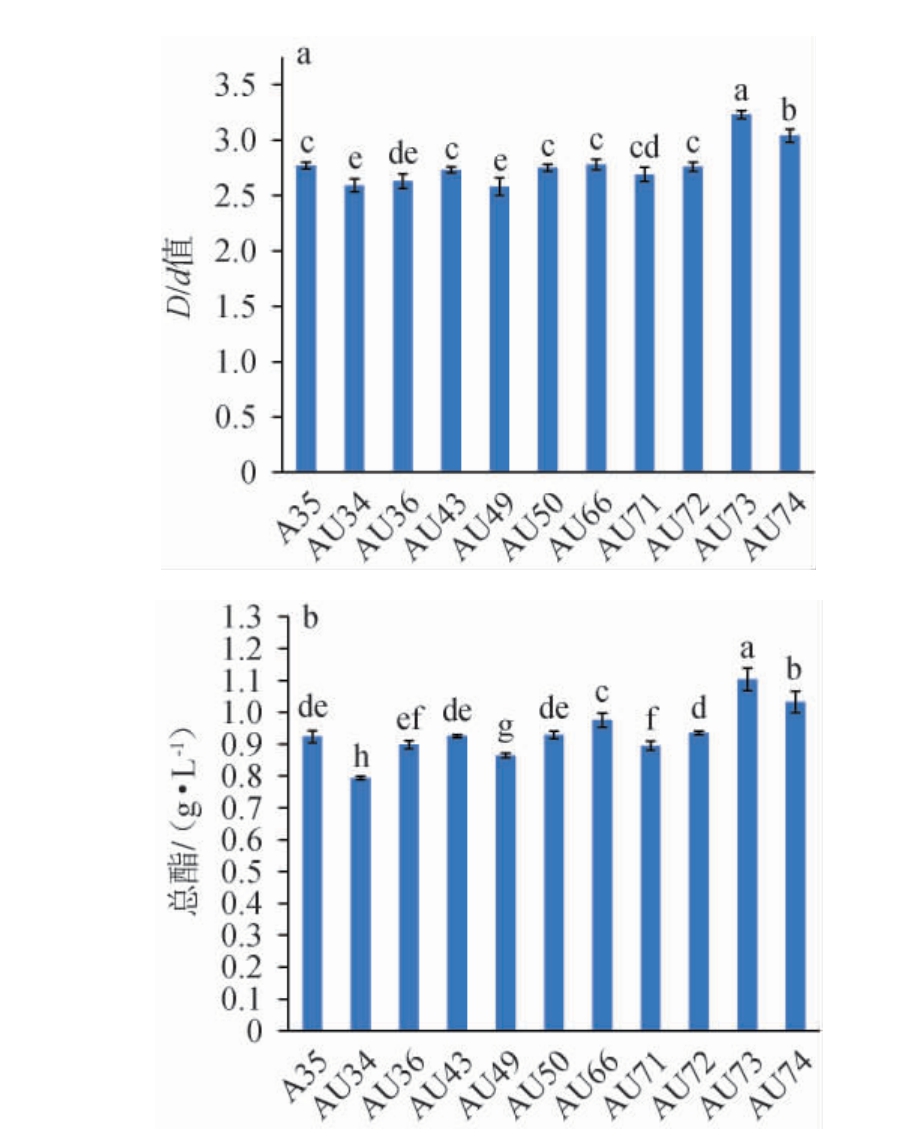
图8 出发菌株A35及紫外诱变菌株的D/d值(a)及总酯含量(b)
Fig.8 D/d value (a) and total ester content (b) of starting strain A35 and mutant strains by ultraviolet
由图8a可知,只有3株诱变菌株的D/d值比出发菌株A35大,其中诱变菌株AU73的D/d值最大,为3.23,分别是出发菌株A35和G4 D/d值的1.17倍和1.32倍。由图8b可知,出发菌株A35的总酯含量为0.92 g/L,4株诱变菌株的总酯含量高于出发菌株A35,其中诱变菌株AU73的总酯含量最高,为1.10 g/L,分别是出发菌株A35和G4总酯含量的1.19倍和1.53倍,因此,选取诱变菌株AU73为高产酯的优良菌株。
2.4 诱变菌株AU73的产乙醇能力分析
樱桃及树莓果汁中的乙醇含量均为(0.01±0.01)%,经商业安琪产香酵母AQ发酵后乙醇含量均显著增加(P<0.05),分别达到(1.17±0.04)%、(1.04±0.14)%,而经诱变菌株AU73发酵后,两种果汁中乙醇含量无显著变化(P>0.05),均为(0.01±0.01)%,说明该酵母在发酵过程中不产生乙醇。
2.5 诱变菌株AU73的遗传稳定性分析
诱变菌株AU73的遗传稳定性见表1。由表1可知,诱变菌株AU73传代8次后,总酯含量无显著差异(P>0.05),说明诱变菌株AU73产酯能力的遗传稳定性较好。
表1 诱变菌株AU73的遗传稳定性
Table 1 Genetic stability of mutant strain AU73
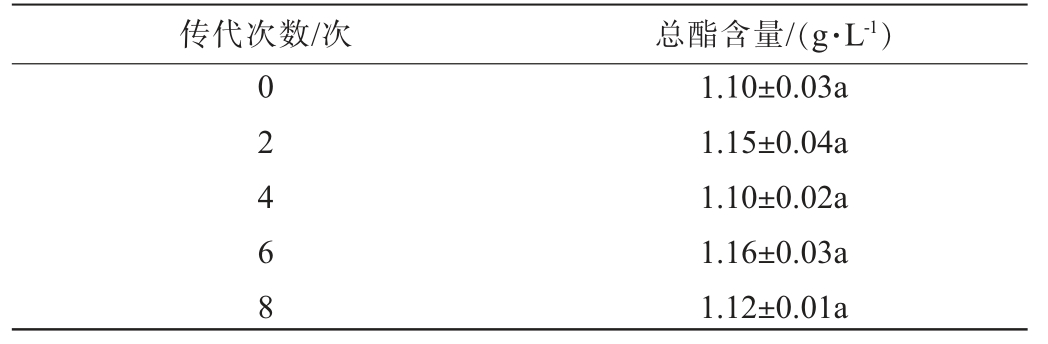
传代次数/次 总酯含量/(g·L-1)0 2 4 6 8 1.10±0.03a 1.15±0.04a 1.10±0.02a 1.16±0.03a 1.12±0.01a
2.6 诱变菌株AU73的耐受性分析
出发菌株G4和诱变菌株AU73对葡萄糖、乙醇、SO2及酸的耐受性见图9。
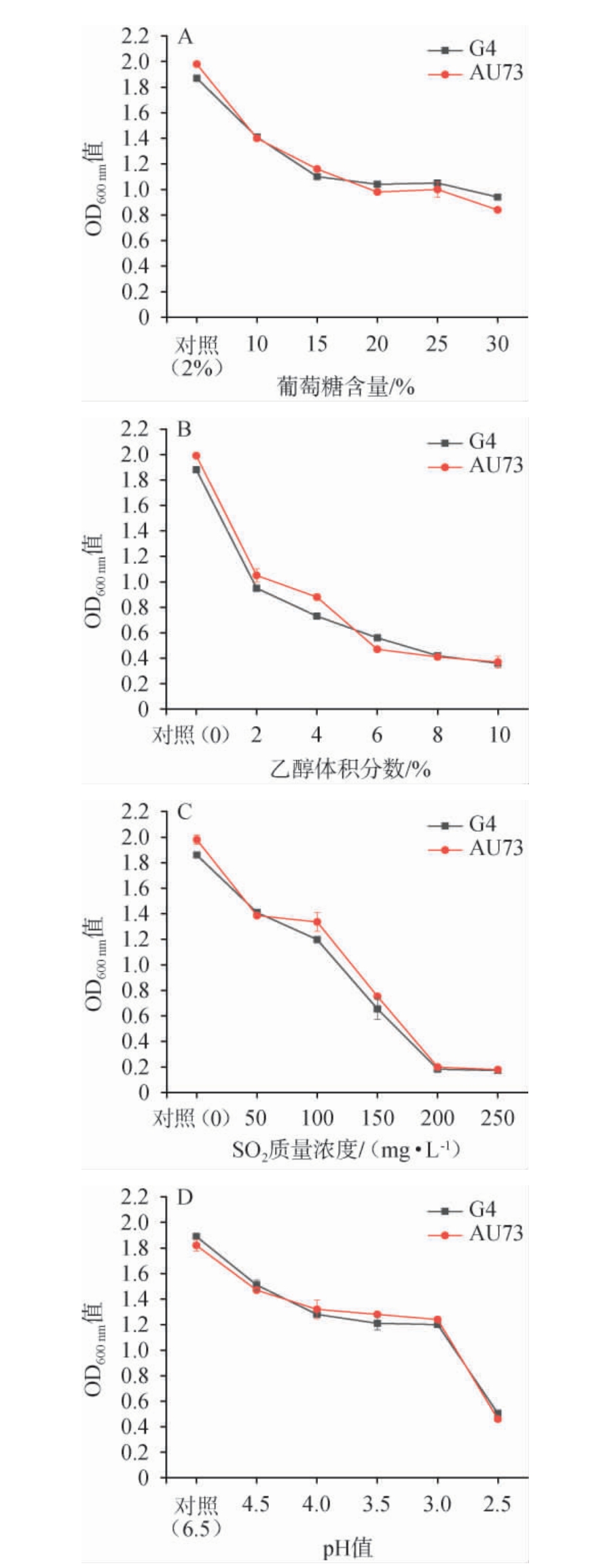
图9 出发菌株G4及诱变菌株AU73对葡萄糖(A)、乙醇(B)、SO2(C)及酸(D)的耐受性
Fig.9 Tolerance of starting strain G4 and mutant strain AU73 to glucose (A), ethanol (B), SO2(C) and acid (D)
由图9可知,出发菌株G4和诱变菌株AU73在不同葡萄糖含量、乙醇体积分数、SO2质量浓度及pH条件下的生长情况基本一致,均随着葡萄糖含量、乙醇体积分数、SO2质量浓度的升高及pH的减小,生长逐渐受到抑制。当葡萄糖含量为30%、乙醇体积分数为10%、SO2质量浓度为150 mg/L、pH为2.5时,出发菌株G4和诱变菌株AU73均能生长,当SO2质量浓度>150 mg/L之后,两菌株的OD600 nm值均<0.2,生长受到严重抑制,几乎不生长。果汁发酵工艺中含糖量约在12%~25%范围内变化,且随着部分发酵代谢产物的累积,发酵环境、pH、乙醇含量会发生变化[24]。综上,诱变菌株AU73具有较好的耐受性,具有发酵果汁的潜力。
2.7 诱变菌株AU73的溶血安全性分析
溶血现象是指菌株产生的溶血素导致自身细胞溶解的现象。虽然酵母是一种益生菌,但是部分酵母菌会出现溶血现象,对血小板、血细胞等有损伤,易导致一些血液疾病,因此对酵母菌进行溶血安全性试验是必要的[25]。溶血情况可分为3类:若菌落周围的培养基变成棕绿色,说明菌株为α溶血;若菌落周围出现透明圈,则说明菌株为β溶血;若培养基无变化,则菌株为γ溶血。α溶血和β溶血可能会诱发一些血液疾病,γ溶血说明无溶血现象,比较安全[26]。出发菌株G4和诱变菌株AU73的溶血试验结果见图10。由图10可知,出发菌株G4和诱变菌株AU73的培养基均无变化,说明两株菌株均为γ溶血,是较安全的菌株。
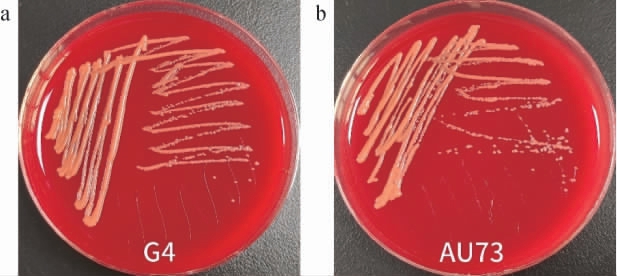
图10 出发菌株G4(a)和诱变菌株AU73(b)的溶血试验结果
Fig.10 Hemolysis test results of starting strain G4 (a) and mutant strain AU73 (b)
3 结论
高产酯类、低产乙醇的发酵果汁酵母对实现发酵果汁品质的提升和降低生产成本起重要作用,本研究以不产乙醇、高产酯的胶红酵母(Rhodotorula glutinosa)G4为出发菌株,通过ARTP诱变复合紫外诱变选育得到一株不产乙醇、高产酯的优良突变菌株AU73,其总酯产量为1.10 g/L,是出发菌株G4的1.53倍。该菌株具有较好的遗传稳定性、耐受性及安全性,可耐受pH值2.5、体积分数10%的乙醇、150 mg/L SO2、30%葡萄糖,为开发具有独特风味和较高营养价值的发酵果汁提供了优质菌种资源。
[1]RIVERO L D V,MATURANO C,RODRÍGUEZ-VAQUERO M J,et al.Utilization of Oenococcus oeni strains to ferment grape juice: Metabolic activities and beneficial health potential[J].Food Microbiol,2022,101:103895.
[2]李祎,王萍.龙葵果汁发酵工艺优化及其抗炎、抑菌活性评价[J].现代食品科技,2017,33(6):248-254,213.
[3]马路凯,卢晓丽,何秋璇,等.发酵果汁的研究进展与展望[J].食品研究与开发,2021,42(18):182-189.
[4]LI H,JINTAO H,YAQIN W,et al.Study on the nutritional characteristics and antioxidant activity of dealcoholized sequentially fermented apple juice with Saccharomyces cerevisiae and Lactobacillus plantarum fermentation[J].Food Chem,2021,363:130351.
[5]MOURET J,AGUERA E,PEREZ M,et al.Study of oenological fermentation:which strategy and which tools?[J].Fermentation,2021,7:155.
[6]成林,成坚,王琴,等.酒曲微生物菌群对酿造酒产品风味影响的研究进展[J].中国酿造,2020,39(10):1-4.
[7]WANG R, SUN J, LASSABLIERE B, et al.UPLC-Q-TOF-MS based metabolomics and chemometric analyses for green tea fermented with Saccharomyces boulardii CNCM I-745 and Lactiplantibacillus plantarum 299V[J].Curr Res Food Sci,2022,5:471-478.
[8]吴依然.非酿酒酵母对葡萄酒香气的影响[J].现代食品,2022,28(23):39-42.
[9]BELDA I,RUIZ J,ALASTRUEY-IZQUIERDO A,et al.Unraveling the enzymatic basis of wine "flavorome": a phylo-functional study of wine related yeast species[J].Front Microbiol,2016,7:12.
[10]刘景,王欣,辛红鸿,等.非酿酒酵母的筛选及其发酵低醇苹果汁的研究[J].中国食品学报,2017,17(1):134-140.
[11]黄丹,储玉龙,尚志超,等.大曲酯化酶根霉菌的分离及产酶条件研究[J].食品与发酵科技,2010,46(3):30-32.
[12]PARADISO M V,SANARICA L,ZARA I,et al.Cultivar-dependent effects of non-Saccharomyces yeast starter on the oenological properties of wines produced from two autochthonous grape cultivars in southern italy[J].Foods,2022,11:3373.
[13]GREENLAW A, TSUKIYAMA T.Acidic media promotes quiescence entry in Saccharomyces cerevisiae[J].bioRxiv,2023.doi: 10.1101/2023.11.20.567958.
[14]PARADISO M V,SANARICA L,ZARA I,et al.Cultivar-dependent effects of non-Saccharomyces yeast starter on the oenological properties of wines produced from two autochthonous grape cultivars in southern Italy[J].Foods,2022,11:3373.
[15]段晓玲,王金玲,吕长山.树莓果酒酿造酵母的分离、筛选[J].食品与发酵工业,2014,40(8):84-88.
[16]BAO Y,ZHANG M,CHEN W,et al.Screening and evaluation of suitable non-Saccharomyces yeast for aroma improvement of fermented mango juice[J].Food Biosci,2021,44:101414.
[17]杨凯环,相里加雄,曹苗文,等.清香型酒曲中高产乙酸乙酯酵母的筛选及鉴定[J].酿酒科技,2023(7):38-43.
[18]刘雅婷,刘宏娟,王艳萍,等.常压室温等离子体诱变粘红酵母筛选高产油脂菌株及发酵条件优化[J].中国油脂,2015,40(1):83-87.
[19]WANG Q,LIU D,YANG Q,et al.Enhancing carotenoid production in Rhodotorula mucilaginosa KC8 by combining mutation and metabolic engineering[J].Ann Microbiol,2017,67:425-431.
[20]马文瑞,孙志伟,石俊,等.非酿酒酵母Nakazawaea ishiwadae GDMCC 60786产乙酸乙酯的诱变菌株筛选及其安全性评价[J].食品科学,2023,44(10):165-172.
[21]陆振群.酒曲中生香酵母的分离及生理生化鉴定[J].酿酒科技,2012(3):37-39.
[22]刘冬,王盼亮,蒿洪欣,等.高产类胡萝卜素酵母菌的诱变选育[J].食品研究与开发,2015,36(20):156-160.
[23]KWAW E,MA Y,TCHABO W,et al.Effect of Lactobacillus strains on phenolic profile,color attributes and antioxidant activities of lactic-acidfermented mulberry juice[J].Food Chem,2018,250:148-154.
[24]焦媛媛.酵母菌—乳酸菌共发酵低醇梨酒的研制[D].天津:天津科技大学,2018.
[25]ARUMUGAM A,GUNASEKARAN N,PERUMAL S.In vitro antioxidant, anti-diabetic, cholinesterase and tyrosinase inhibitory potential of fresh juice from Citrus hystrix and C.maxima fruits[J].Food Science and Human Wellness,2014,3(1):16-25.
[26]魏梓晴,詹紫瑶,王阿利,等.酱油渣源副干酪乳杆菌体外安全性评价[J].食品与发酵工业,2022,48(11):80-86.