抗生素作为饲料添加剂够预防动物疾病、保持畜禽健康、改善饲料利用率、促进动物生长、提高养殖业的经济效益,为畜牧业的发展具有重要贡献[1-2]。农用抗生素是由细菌、真菌、放线菌等微生物在发酵过程中所产生的具有防治某些动物、植物有害生物的次级代谢产物,属于生物农药的范畴,因其具有高效、易分解、无残留、不污染环境等优点[3-4],逐渐成为化学农药的替代品[5-7]。
目前,常用的农用抗生素包括恩拉霉素、土霉素(oxytetracycline,OTC)、金霉素等[8-10]。恩拉霉素是一种多肽类抗生素,作为动物饲料添加剂对动物有很好的促生长作用[8]。唐慧慧[8]通过对恩拉霉素产生菌链霉菌(Streptomyces)BKSFJ06进行复合诱变,筛选得到1株高产恩拉霉素突变菌株ERS42-1,其最高摇瓶发酵效价达到(8 400±86)U/mL,相比出发菌株提高13.5%;进一步采用单因素试验及响应面试验确定突变菌株ERS42-1产恩拉霉素的最优发酵条件为种龄48 h、接种量10%、装液量40 mL/500 mL、初始pH值7.0、发酵温度30 ℃、培养时间10 d,最佳发酵培养基为玉米粉175 g/L、玉米浆1 g/L、麦芽糊精70 g/L、棉籽饼粉8.9 g/L、麸质粉55 g/L、磷酸二氢钾0.06 g/L、硫酸铵5 g/L、豆油20 g/L。在此优化条件下,突变菌株ERS42-1的摇瓶发酵效价提高至(12 066±106)U/mL;最后利用200 L发酵罐对突变菌株ERS42-1的产能进行验证,恩拉霉素的产量最高达到(12 000±96)U/mL。土霉素是龟裂链霉菌(Streptomyces rimosus)经发酵产生的抗生素,具有抗菌谱广、效能高的特点,可用作动物饲料添加剂[9]。王子竹[9]对产OTC龟裂链霉菌进行诱变育种和发酵工艺优化,结果龟裂链霉菌的OTC产量提高49.62%。金霉素是由金色链霉菌(Streptomyces aureus)发酵产生的一种四环类抗生素,用于饲料添加剂不仅可以有效预防常见的动物肠道疾病,还具有提高饲料利用率、增肥、增重等效果[10]。王玥[10]采用基因工程方法对金霉素生产菌株金色链霉菌(Streptomyces aureofaciens)JH4.568进行菌种改良,金霉素产量提高了12%。关于农用抗生素的研究多集中于菌种改良以及发酵工艺优化。然而,随着致病菌耐药性的不断增加,迫切需要研发出新型抗生素来应对耐药菌,分离并筛选出具有抑菌活性的放线菌,研制开发新型的动物用抗生素生防菌剂是当前动物病害防治的重要发展方向[11-14]。
本研究从广西壮族自治区河池市宜州区多处采集土壤样品,基于添加有重铬酸钾的高氏一号培养基采用稀释涂布平板法从土样中分离筛选农用抗生素产生菌,结合形态学观察、生理生化试验和分子生物学技术对其进行菌种鉴定,并以对厚垣镰孢霉(Fusarium chlamydosporum)的抑菌圈直径为响应值,通过单因素试验及响应面试验对其发酵条件进行优化,以期获得抑菌活性强且产能高的菌株,为后期抑菌活性的研究、抗菌活性成分的分离鉴定及发酵饲料的开发奠定一定的理论基础。
1 材料及方法
1.1 材料与试剂
1.1.1 材料与菌种
土样:在广西壮族自治区河池市宜州区的马玲湖水库、下枧河、南蛇山不同地点取土壤,每个地点随机采集3份土样,置于无菌袋保存,标签记录采集日期和位置。
棘孢曲霉(Aspergillus aculeatu)、大肠杆菌(Escherichia coli)、厚垣镰孢霉(F.chlamydosporum)、米曲霉(Aspergillus oryzae)、枯草芽孢杆菌(Bacillus subtilis):保存于河池学院微生物及植物资源开发利用广西高校重点实验室。
1.1.2 培养基
液体发酵培养基[13]:K2HPO4 0.5 g/L,葡萄糖1.0 g/L,酵母膏0.2 g/L,玉米粉20 g/L,可溶性淀粉5.0 g/L,NaCl 0.2 g/L,蛋白胨0.2 g/L,MgSO4 0.5 g/L,pH为7.2~7.4。
高氏一号琼脂培养基[14]:可溶性淀粉20 g/L,KNO3 1 g/L,NaCl 0.5 g/L,MgSO4 0.5 g/L,K2HPO4 0.5 g/L,FeSO4 0.01 g/L,琼脂粉13 g/L,pH 7.2~7.4。
马铃薯葡萄琼脂(potato dextrose agar,PDA)培养基[15-16]:去皮马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L。
LB固体培养基:蛋白胨10 g/L,酵母粉5 g/L,氯化钠10 g/L,琼脂粉20 g/L。
生理生化试验培养基:参照ABDULHUSSEIN ZR等[17-18]的方法制备。
以上培养基均在121 ℃高压蒸汽灭菌20 min。
1.1.3 试剂
酵母膏(生化试剂):广东环凯微生物科技有限公司;重铬酸钾(K2Cr2O7)(分析纯):汕头市西陇化工有限公司;琼脂(生化试剂):上海润捷化学制剂有限公司;牛肉膏(生化试剂):北京奥博生物科技有限公司;七水硫酸铁、硝酸钾、氯化钠、磷酸氢二钾、磷酸二氢钾、硫酸镁、七水硫酸镁、葡萄糖(均为分析纯):国药集团化学试剂有限公司;可溶性淀粉、蛋白胨(均为生化试剂):天津光复精细化工研究所;Biospin细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:杭州博日科技股份有限公司。其他试剂均为国产分析纯或生化试剂。
1.2 仪器与设备
BX51通用荧光显微镜:日本奥林巴斯显微镜公司;Infinite M200PRO全波长酶标仪:上海精密科学仪器有限公司;ZXSD-A1160生化培养箱、TS-2112F双层恒温培养振荡器:上海智城分析仪器制造有限公司;SW-CJ-1F超净工作台:苏净集团苏州安泰空气技术有限公司;JA2003B电子天平:上海越平科学仪器有限公司;HVE-50超高压灭菌锅:日本Hirayama公司;Micro-fuge 20R高速冷冻离心机:美国贝克曼库尔特有限公司:DHG-9075A电热鼓风干燥箱:上海一恒科学仪器有限公司;ProFlex聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:赛默飞世尔科技(中国)有限公司;ST2100 pH计:奥豪斯仪器(常州)有限公司。
1.3 方法
1.3.1 菌株的分离与纯化
将土壤置于烘箱,120 ℃烘干5 h,去除大部分细菌和真菌。取1 g土壤样品置于试管中,加入10 mL蒸馏水,混匀,按照10倍梯度系列稀释至10-7。分别取不同梯度的稀释液100μL涂布于含有50μg/mLK2Cr2O7的高氏一号琼脂培养基中,28℃条件下培养7 d。挑取单菌落进行反复划线纯化[15,17]。
1.3.2 产农用抗生素菌株的筛选
将分离得到的单菌落接种于高氏一号琼脂培养基,28℃条件下活化培养5 d,加无菌水洗脱孢子液。取1 mL孢子液接种于液体发酵培养基,装液量为100 mL/250 mL,在28 ℃、180 r/min条件下培养3 d。发酵液经4 000 r/min离心10 min,取上清液4 ℃保藏。
将厚垣镰孢霉接种至PDA培养基,用无菌镊子将牛津杯放到平板中央。取保藏的发酵上清液添加到牛津杯中,置于28 ℃条件下培养2 d。采用游标卡尺测量抑菌圈的直径,选取抑菌圈直径较大的菌株为高产农药抗生素的菌株[15,19]。
1.3.3 筛选菌株抑菌广谱性的测定
采用牛津杯法测定筛选菌株对厚垣镰孢霉(F.chlamydosporum)、棘孢曲霉(A.aculeatu)、大肠杆菌(E.coli)、米曲霉(A.oryzae)、枯草芽孢杆菌(B.subtilis)的抑菌活性,采用游标卡尺测量抑菌圈直径,对其抑菌广谱性进行研究[15,19]。
1.3.4 筛选菌株的鉴定
形态学观察[20]:将筛选菌株划线接种于高氏一号琼脂培养基,28 ℃条件下培养2 d,观察菌株的菌落形体,并进行革兰氏染色,采用显微镜观察菌株的细胞形态。
生理生化试验:参照文献[18,20]进行吲哚试验、V.P试验、甲基红试验、硫化氢产生试验、淀粉水解试验、接触酶反应试验、碳源利用试验、明胶液化试验。
分子生物学鉴定:采用Biospin细菌基因组DNA提取试剂盒提取筛选菌株的基因组DNA,以其为模板,利用通用引物27F(5'-AGAGTTTGATCCTGGCTAG-3')和1492R(5'-GGTTACCTTGTTACGACT-3')PCR扩增16S rDNA基因片段[20]。PCR扩增体系(40 μL):2×Phanta Max Master Mix 20 μL,引物27F 1 μL,引物1492R 1 μL,DNA模板1 μL,双蒸水(ddH2O)17 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸30 s,共35个循环;72 ℃再延伸5 min。采用2%琼脂糖凝胶电泳检测PCR扩增产物。将PCR扩增产物委托广州擎科生物技术有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)程序对序列进行同源性比对,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA 7.0软件中的邻接法(neighbor joinning,NJ)构建系统进化树。
1.3.5 产农用抗生素菌株发酵条件优化
单因素试验[21]:在方法1.3.2基础上,分别考察氮源种类(酵母膏、玉米粉、黄豆饼粉、蛋白胨)(添加量5 g/L)、发酵时间(3 d、5 d、7 d、9 d、11 d)、发酵温度(25 ℃、28 ℃、31 ℃、34℃、37℃)、初始pH值(6、7、8、9、10)、装液量(50 mL/250mL、75mL/250mL、100mL/250mL、125mL/250mL、150mL/250mL)、转速(160 r/min、180 r/min、200 r/min、220 r/min、240 r/min)对筛选菌株对厚垣镰孢霉抑制效果的影响。
响应面试验[21-22]:在单因素试验的基础上,选择影响较大的因素发酵时间(A)、初始pH值(B)、转速(C)为自变量,以对厚垣镰孢霉的抑菌圈直径(Y)为响应值,采用Design-Expert 8.0.6软件设计3因素3水平Box-Behnken响应面试验,试验因素与水平见表1。
表1 农用抗生素产生菌株发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for fermentation conditions optimization of agricultural antibiotic-producing strain
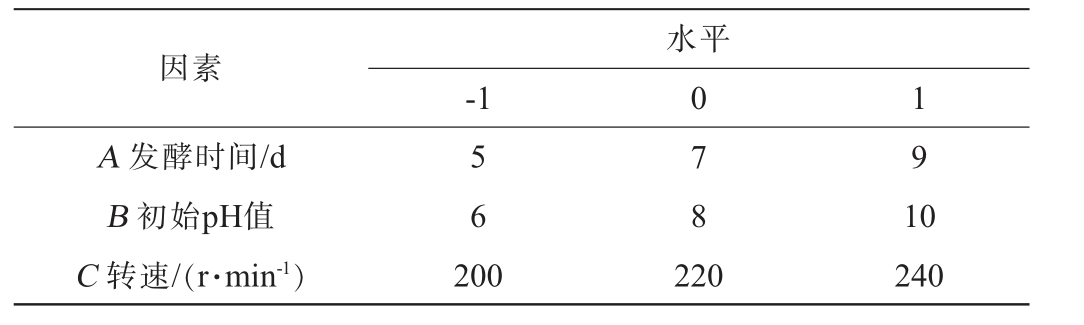
因素-1水平0 1 A 发酵时间/d B 初始pH值C 转速/(r·min-1)5 6 7 8 9 200 220 10 240
1.3.6 数据处理
每个试验重复3次,采用SPSS 29.0.2.0软件处理数据,结果用“平均值±标准差”表示。采用Design-Expert 8.0.6软件进行差异显著性分析,采用Origin 2021软件、MEGA 7.0软件绘图。
2 结果与分析
2.1 产农用抗生素菌株的筛选及抑菌广谱性测定
通过分离纯化及筛选最终从土壤样品中筛选得到一株对厚垣镰孢霉拮抗能力较强的菌株,将其命名为Ly,其对米曲霉(A.oryzae)、枯草芽孢杆菌(B.subtilis)没有抑菌作用,对厚垣镰孢霉(F.chlamydosporum)、棘孢曲霉(A.aculeatu)、大肠杆菌(E.coli)具有抑制作用,抑菌效果见图1。由图1可知,菌株Ly对厚垣镰孢霉、棘孢曲霉、大肠杆菌均具有抑菌效果,抑菌圈直径分别为23.11 mm、12.13 mm、6.80 mm,说明其抑菌具有广谱性。
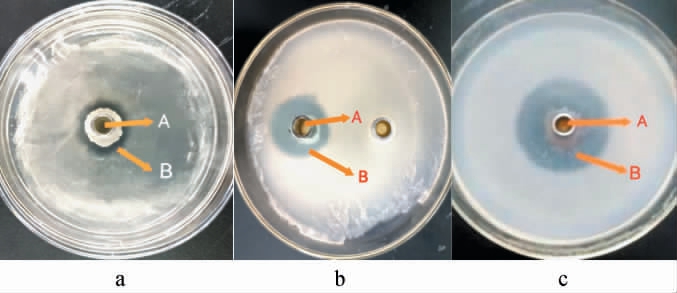
图1 菌株Ly对大肠杆菌(a)、棘孢曲霉(b)及厚垣镰孢霉(c)的抑菌效果
Fig.1 Antibacterial effect of strain Ly on Escherichia coli (a), Aspergillus aculeatu (b) and Fusarium chlamydosporum (c)
2.2 菌株Ly的鉴定
2.2.1 形态学观察
菌株Ly在高氏一号琼脂培养基的菌落及细胞形态见图2。由图2可知,菌株Ly的菌落呈椭圆形,浅粉红色,不易挑起,表面光滑且略有凸起;革兰氏染色呈红色,为革兰氏阴性细菌,细胞形态为短杆状。
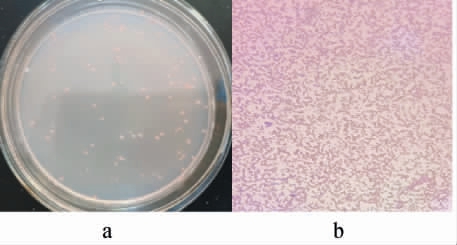
图2 菌株Ly的菌落(a)及细胞(b)形态
Fig.2 Morphology of colony (a) and cell (b) of strain Ly
2.2.2 生理生化试验
菌株Ly的生理生化试验结果见表2。由表2可知,甲基红试验、V.P试验及吲哚试验结果均呈阴性,不产淀粉酶、硫化氢,也不能使明胶溶解。接触酶试验结果为阳性,能利用可溶性淀粉、葡萄糖和麦芽糖,不能利用甘露醇。结合形态观察,参考文献[23]初步鉴定菌株Ly为节杆菌属(Arthrobacter sp.)。
表2 菌株Ly的生理生化试验结果
Table 2 Physiological and biochemical test results of strain Ly
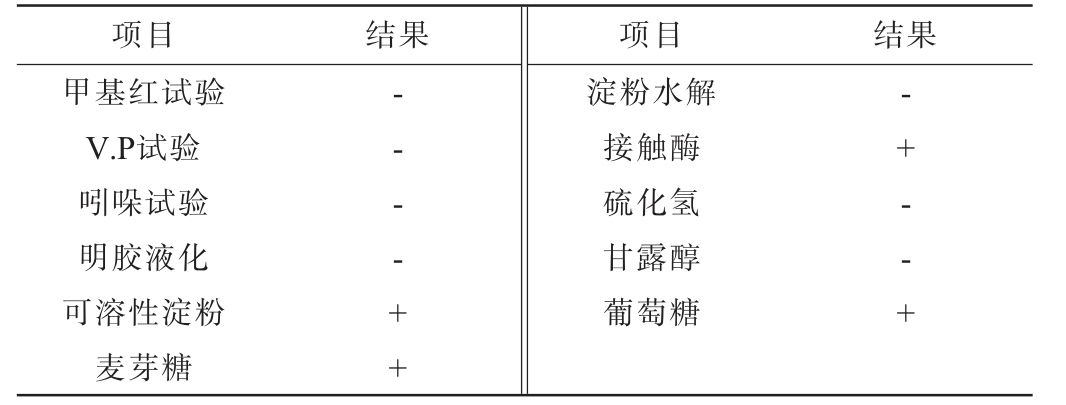
注:“-”表示结果呈阴性,“+”表示结果呈阳性。
项目 结果 项目 结果甲基红试验V.P试验吲哚试验明胶液化可溶性淀粉麦芽糖-- - - + +淀粉水解接触酶硫化氢甘露醇葡萄糖-+ - - +
2.2.3 分子生物学鉴定
基于16S rDNA基因序列构建菌株Ly的系统发育树,结果见图3。
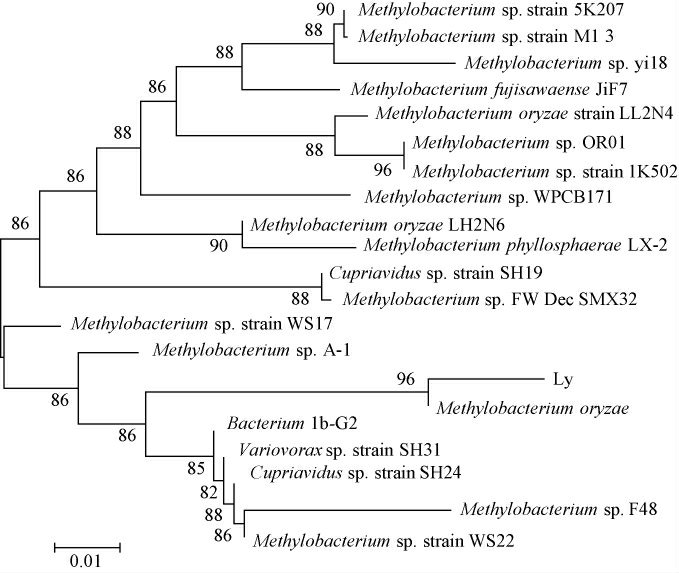
图3 基于16S rDNA基因序列菌株Ly的系统进化树
Fig.3 Phylogenetic tree of strain Ly based on 16S rDNA gene sequences
由图3可知,菌株Ly和水稻甲基杆菌(Methylobacterium oryzae)聚于一支,亲缘关系最近,结合形态学特征、生理生化试验结果,最终鉴定菌株Ly为水稻甲基杆菌(M.oryzae)。
2.3 水稻甲基杆菌Ly产农用抗生素发酵条件优化
2.3.1 不同氮源对菌株Ly发酵液抑制厚垣镰孢霉效果的影响
不同氮源对菌株Ly发酵液抑制厚垣镰孢霉效果的影响见图4。由图4可知,当氮源为黄豆饼粉时,菌株Ly发酵液对厚垣镰孢霉菌的抑菌圈直径最大,为33.33 mm,其次为玉米粉,抑菌圈直径为17.42 mm。黄豆饼粉是黄豆榨油后经粉碎、炒制而得到的饼粉,豆饼中的蛋白质是一种通过豆类原料经特殊工艺加工而成的产品,其含量普遍介于50%~70%,其中包含的大豆蛋白动物消化率达92%以上,同时含有动物生长需要的全部必需氨基酸,是发酵工业中应用广泛的氮源[24]。因此,确定最佳氮源为黄豆饼粉。
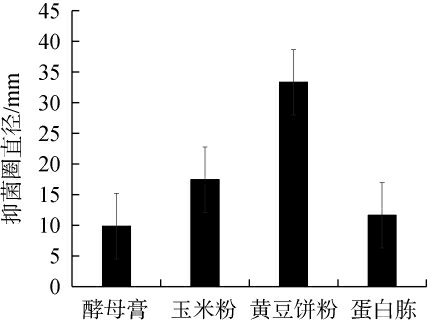
图4 氮源种类对菌株Ly发酵液抑制厚垣镰孢霉效果的影响
Fig.4 Effect of nitrogen source types on the inhibitory effect of Fusarium chlamydosporum by strain Ly fermentation broth
2.3.2 不同发酵时间对菌株Ly发酵液抑制厚垣镰孢霉效果的影响
不同发酵时间对菌株Ly发酵液抑制厚垣镰孢霉效果的影响见图5。
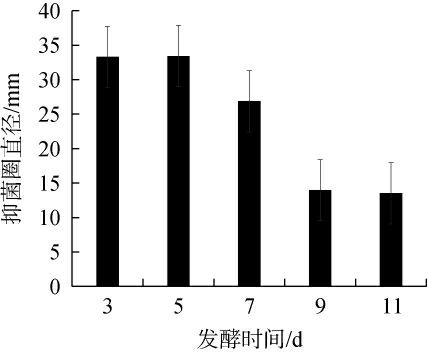
图5 发酵时间对菌株Ly发酵液抑制厚垣镰孢霉效果的影响
Fig.5 Effect of fermentation time on the inhibitory effect of Fusarium chlamydosporum by strain Ly fermentation broth
由图5可知,随着发酵时间的延长,菌株Ly发酵液对厚垣镰孢霉的抑菌圈直径呈先升高后下降的趋势,当发酵时间为5 d时,抑菌圈直径最大,为33.43 mm。分析原因可能是发酵时间过短,微生物可能没有到合成代谢产物时间,产量会很低;发酵时间过长,发酵底物逐渐耗尽、抑制物质积累,导致酶的失活,进而影响代谢产物的产量。因此,确定最佳发酵时间为5 d。
2.3.3 不同发酵温度对菌株Ly发酵液抑制厚垣镰孢霉效果的影响
不同发酵温度对菌株Ly发酵液抑制厚垣镰孢霉效果的影响见图6。由图6可知,随着发酵温度的升高,菌株Ly发酵液对厚垣镰孢霉的抑菌圈直径呈先升高后下降的趋势,当发酵温度为31 ℃时,抑菌圈直径最大,为33.75 mm。分析原因可能是,温度的升高将加速反应的进行,促进生长代谢,加速产物的形成,然而,随着温度的上升,酶失活速度增加,菌体易衰老,从而影响酶的生成,进而导致代谢产物产量降低[25-26]。因此,确定最佳发酵温度为31 ℃。
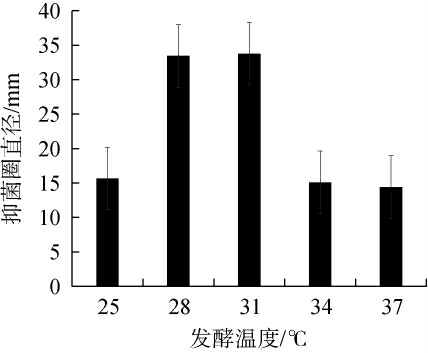
图6 发酵温度对菌株Ly发酵液抑制厚垣镰孢霉效果的影响
Fig.6 Effect of fermentation temperature on the inhibitory effect of Fusarium chlamdoysporum by strain Ly fermentation broth
2.3.4 不同初始pH值对菌株Ly发酵液抑制厚垣镰孢霉效果的影响
不同初始pH值对菌株Ly发酵液抑制厚垣镰孢霉效果的影响见图7。
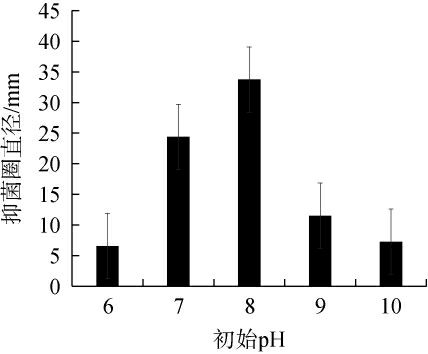
图7 初始pH值对菌株Ly发酵液抑制厚垣镰孢霉效果的影响
Fig.7 Effect of initial pH on the inhibitory effect of Fusarium chlamydosporum by strain Ly fermentation broth
由图7可知,随着初始pH值的升高,菌株Ly发酵液对厚垣镰孢霉的抑菌圈直径呈先升高后下降的趋势,当初始pH值为8时,抑菌圈直径最大,为33.74 mm。分析原因可能是不同微生物的最适生长pH值不同,pH可以通过对微生物的新陈代谢产生影响,从而对微生物的生长速率及酶活性产生一定的影响[27]。因此,确定最佳初始pH值为8。
2.3.5 不同装液量对菌株Ly发酵液抑制厚垣镰孢霉效果的影响
不同装液量对菌株Ly发酵液抑制厚垣镰孢霉效果的影响见图8。由图8可知,随着装液量的升高,菌株Ly发酵液对厚垣镰孢霉的抑菌圈直径呈先升高后下降的趋势,当装液量为100 mL/250 mL时,抑菌圈直径最大,为33.74 mm。分析原因可能是,装液量较低时,发酵液存在蒸发或菌体营养物质不充足,导致菌体死亡;装液量过高时,发酵液的溶氧量减小,不利于菌株生长及发酵产酶[25-28]。因此,确定最佳装液量为100 mL/250 mL。
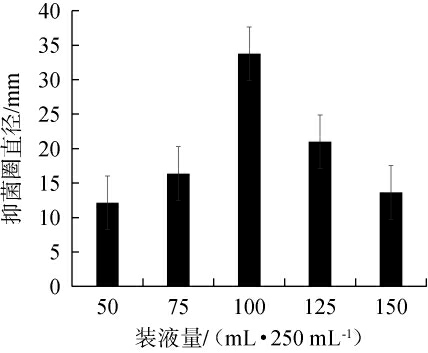
图8 装液量对菌株Ly发酵液抑制厚垣镰孢霉效果的影响
Fig.8 Effect of liquid loading volume on the inhibitory effect of Fusarium chlamydosporum by strain Ly fermentation broth
2.3.6 不同转速对菌株Ly发酵液抑制厚垣镰孢霉效果的影响
不同转速对菌株Ly发酵液抑制厚垣镰孢霉效果的影响见图9。
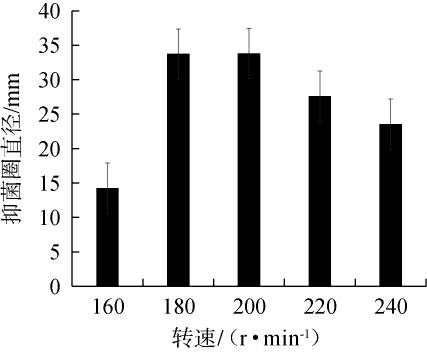
图9 转速对菌株Ly发酵液抑制厚垣镰孢霉效果的影响
Fig.9 Effect of rotational speed on the inhibitory effect of Fusarium chlamydosporum by strain Ly fermentation broth
由图9可知,随着转速的升高,菌株Ly发酵液对厚垣镰孢霉的抑菌圈直径呈先升高后下降的趋势,当转速为200 r/min时,抑菌圈直径最大,为33.80 mm。摇床转速会影响培养基中氧气的传递效率,由于不同发酵菌株有好氧或厌氧菌株代谢类型不同,摇床转速对菌株影响十分明显,转速过低,培养基溶氧量不足,会导致活菌数减少,进而影响菌株对酶合成和分泌的能力,转速过快可能会导致部分菌体损伤影响发酵结果[29]。因此,确定最佳转速为200 r/min。
2.3.7 响应面试验
在单因素试验结果的基础上,固定氮源为黄豆饼粉、发酵温度为31 ℃、装液量为100 mL/250 mL,选择对结果影响较大的发酵时间(A)、初始pH值(B)、转速(C)为自变量,以对厚垣镰孢霉的抑菌圈直径(Y)为响应值,采用Design-Expert 8.0.6软件设计3因素3水平的Box-Behnken响应面试验,试验设计及结果见表3,方差分析结果见表4。
表3 农用抗生素产生菌株Ly发酵条件优化响应面试验设计及结果
Table 3 Design and results of response surface tests for fermentation conditions optimization of agricultural antibiotic production strain Ly
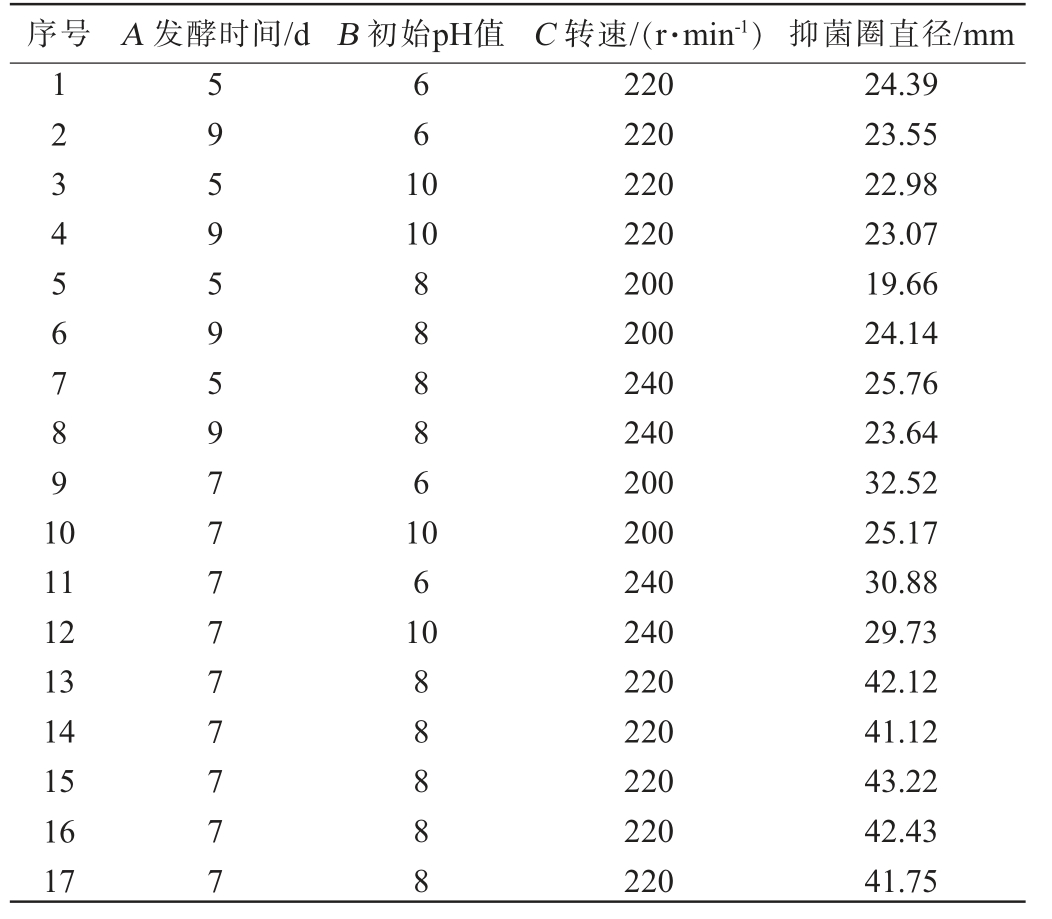
序号 A 发酵时间/d B 初始pH值 C 转速/(r·min-1)抑菌圈直径/mm 1 2 3 4 5 6 7 8 9 1 0 6 6 1 0 10 8 8 8 8 6 1 11 12 13 14 15 16 17 5 9 5 9 5 9 5 9 7 7 7 7 7 7 7 7 7 0 6 1 0 8 8 8 8 8 220 220 220 220 200 200 240 240 200 200 240 240 220 220 220 220 220 24.39 23.55 22.98 23.07 19.66 24.14 25.76 23.64 32.52 25.17 30.88 29.73 42.12 41.12 43.22 42.43 41.75
表4 回归模型方差分析
Table 4 Variance analysis of regression model
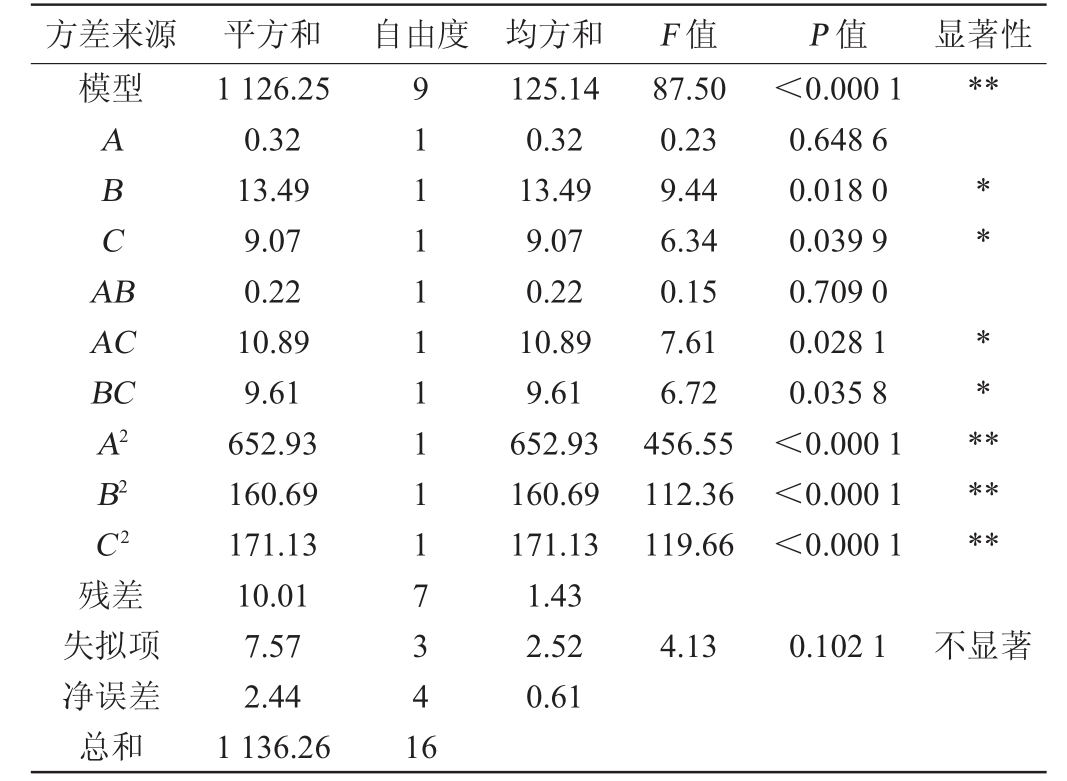
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方和 F 值 P 值 显著性模型**A B C A B AC BC A2 B2 C2残差失拟项净误差总和1 126.25 0.32 13.49 9.07 0.22 10.89 9.61 652.93 160.69 171.13 10.01 7.57 2.44 1 136.26 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 125.14 0.32 13.49 9.07 0.22 10.89 9.61 652.93 160.69 171.13 1.43 2.52 0.61 87.50 0.23 9.44 6.34 0.15 7.61 6.72 456.55 112.36 119.66<0.000 1 0.648 6 0.018 0 0.039 9 0.709 0 0.028 1 0.035 8<0.000 1<0.000 1<0.000 1** ********4.13 0.102 1不显著
采用Design-Expert 8.0.6软件对表3数据进行多元二次回归拟合,得到二次多项回归方程为:
Y=-979.961 81+52.295 25A+15.129 75B+7.044 78C+0.058 125AB-0.041 250AC+0.038 750BC-3.113 19A2-1.544 44B2-0.015 938C2
由表4可知,模型P<0.000 1,极显著,失拟项P=0.102 1>0.05,不显著,表明模型可靠。校正决定系数R2Adj=0.979 9,决定系数R2=0.991 2,两者相差不大,说明该模型拟合性好。变异系数(coefficient of variation,CV)为3.94%(<10%),说明数据准确度较高,具有可信度,模型拟合度好,模型具有统计学意义。该模型的信噪比为23.707(>4),表明该模型具有较好的分辨能力,可以用来预测试验结果的可靠性。由F值可知,3个因素对结果影响的主次次序为B>C>A,即初始pH值>转速>发酵时间。由P值可知,二次项A2、B2、C2对结果影响极显著(P<0.01),一次项B、C及交互项AC、BC对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。发酵时间与初始pH值、转速间交互作用对结果影响的响应面及等高线见图10。
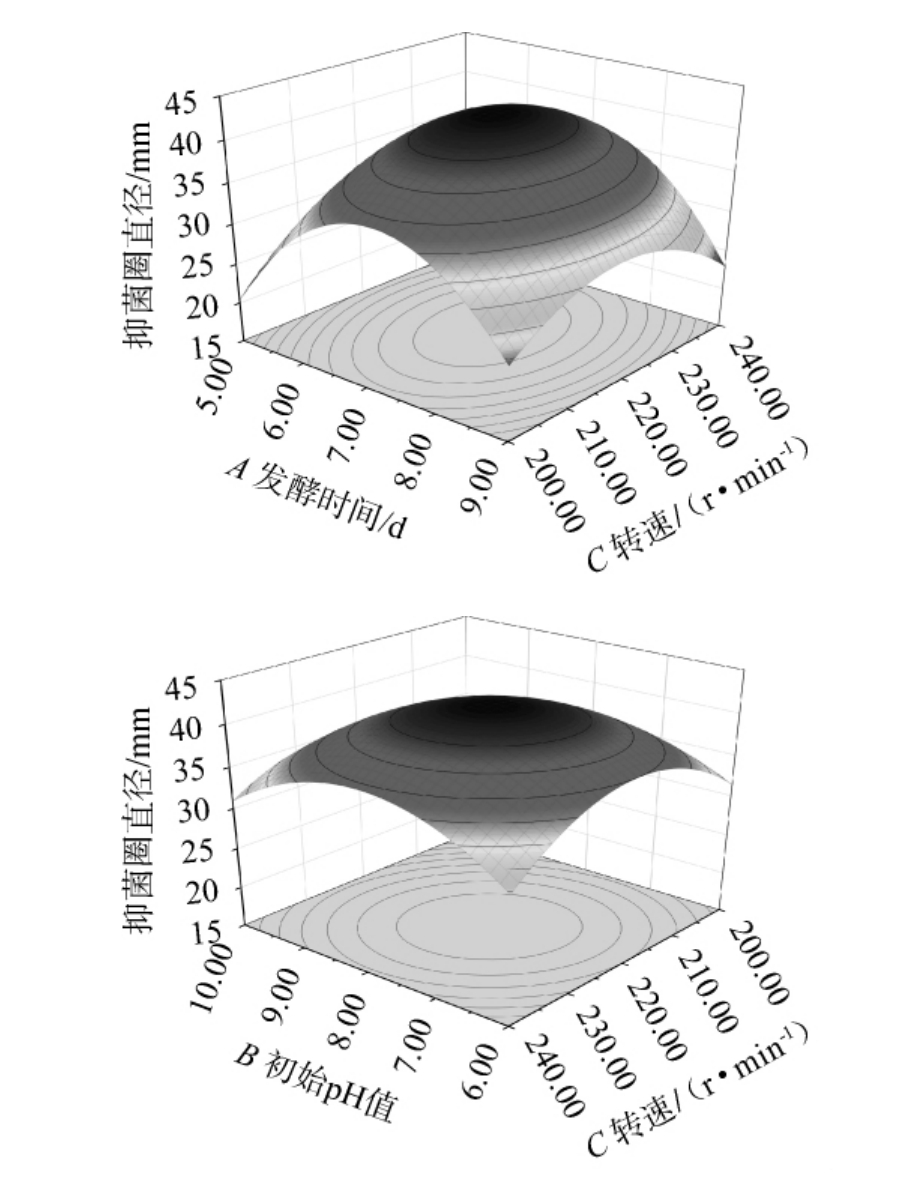
图10 发酵时间与初始pH值、转速间交互作用对厚垣镰孢霉抑菌圈直径影响的响应面及等高线
Fig.10 Response surface plots and contour lines of effect of interaction between fermentation time and initial pH,rotational speed on the diameter of the inhibition zone of Fusarium chlamydosporum
由图10可知,发酵时间与初始pH值、转速间交互作用对结果影响的响应面均呈凸面,存在最高点,且对结果影响的等高线趋于椭圆形,说明AC、BC对结果影响较大,这与方差分析结果一致。
通过Design-Expert 8.0.6软件对多元二次回归方程进行最优求解,得到最优发酵条件为发酵时间7 d、初始pH值7.81、转速221.44 r/min。在此条件下,预测的抑菌圈直径为42.23 mm。为便于实际操作,将最优发酵条件修订为发酵时间7 d、初始pH值8、转速220 r/min。在此条件下进行3次重复试验,实际抑菌圈直径为41.91 mm,这与理论预测值接近,表明由该理论模型具有一定的实际应用价值。
3 结论
本研究基于添加有重铬酸钾的高氏一号培养基采用稀释涂布平板法从土壤中筛选得到一株农用抗生素产生菌Ly,通过形态学观察、生理生化试验及分子生物学技术鉴定其为水稻甲基杆菌(Methylobacterium oryzae),该菌具有广谱抑菌性,对厚垣镰孢霉(F.chlamydosporum)、棘孢曲霉(A.aculeatu)、大肠杆菌(E.coli)均具有抑菌性,抑菌圈直径分别为23.11 mm、12.13 mm、6.80 mm。以对厚垣镰孢霉(Fusarium chlamydosporum)的抑菌圈直径为响应值,通过单因素试验及响应面试验优化得到Methylobacterium oryzae Ly产农用抗生素的最优发酵工艺条件为:黄豆饼粉作为氮源,装液量100 mL/250 mL,发酵温度31 ℃,转速220r/min,初始pH值8,发酵时间7 d。在此优化条件下,水稻甲基杆菌Ly对厚垣镰孢霉菌的抑菌圈直径为41.91 mm,是优化前抑菌圈直径(23.11 mm)的1.81倍,抑菌能力有大幅度提升。
[1]王乙茹,柳成东,白华毅,等.凝结芽孢杆菌与饲用抗生素组合使用对21~42日龄AA肉鸡生产性能的影响[J].中国畜牧杂志,2019,55(12):123-126.
[2]于佳民,陈振,齐秀晔,等.复合微生态制剂、饲用抗生素对肉鸡生长性能、肠道菌群数量和免疫性能的影响[J].中国畜牧兽医,2018,45(8):2219-2226.
[3]郭雪松.芒果蒂腐病拮抗菌的筛选、鉴定及生防机理研究[D].海口:海南大学,2021.
[4]朱昌雄,宋渊.我国农用抗生素的现状与发展趋势探讨[J].中国农业科技导报,2006,8(6):17-19.
[5]安康,韩兴,刘海涛,等.不同农用抗生素诱导烟草灰霉病抗性的研究[J].农药,2021,60(11):825-828.
[6]杨骁,任晋玮,徐利剑,等.海洋真菌Fusarium sp.HL21活性次级代谢产物研究[J].中国抗生素杂志,2023,48(8):879-884.
[7]赵俊杰,张龙,王靓,等.具有双重抗生素抗性的ε-聚赖氨酸高产菌株选育及生理特性[J].中国生物工程杂志,2018,38(8):59-68.
[8]唐慧慧.恩拉霉素高产菌株筛选及发酵条件优化[D].杨凌:西北农林科技大学,2017.
[9]王子竹.土霉素产生菌的筛选及诱变育种[D].大连:大连工业大学,2020.
[10]王玥.金霉素生产菌株选育与优化[D].天津:天津科技大学,2021.
[11]向莎莎,谢建平.分枝杆菌非典型错配修复及其在抗生素耐药中的研究进展[J].遗传,2023,45(11):1018-1027.
[12]王俊博,孔令新,乔永健,等.基于基因组挖掘的农抗120活性成分制霉菌素和丰加霉素的发现和鉴定[J].微生物学报,2021,61(10):3076-3086.
[13]瞿佳,门欣,陈锐,等.核桃黑斑病拮抗放线菌WMF106的筛选、鉴定及防效[J].微生物学通报,2021,48(10):3621-3631.
[14]刘文华,童朝阳,张艳霞,等.青稞穗腐病传播介体穗螨的可培养共生细菌多样性研究[J/OL].植物病理学报,1-17[2025-02-27].https://doi.org/10.13926/j.cnki.apps.001650.
[15]何海燕,黄舒琳,李东霖,等.产农用抗生素的菌种筛选鉴定及活性产物的初步研究[J].饲料研究,2021,44(18):67-72.
[16]廖鑫琳,郭鑫,杨季学,等.拮抗青枯雷尔氏菌的放线菌筛选及其防病作用[J].中国农业科学,2024,57(7):1319-1334.
[17]ABDULHUSSEIN Z R, ATIA S S.Antimicrobial effect of pyocyanin extracted from Pseudomonas aeroginosa[J].Eur J Exp Biol,2016,6(3):1-4.
[18]陈晓萌.生防Bacillus subtilis Z-14合成脂肽抗生素活性检测及发酵条件优化[D].保定:河北农业大学,2019.
[19]钱程,叶景,GALAI K E,等.一株柠檬内生细菌Z10的分离鉴定及其抑菌活性的发酵条件优化[J].微生物学通报,2024,51(5):1641-1658.
[20]金利容,许冬,王玲,等.云木香内生细菌的分离鉴定及其对大丽轮枝菌的抑制作用[J].植物保护,2024,50(3):46-54.
[21]LATHA S,SIVARANJANI G,DHANASEKARAN D.Response surface methodology: A non-conventional statistical tool to maximize the throughput of Streptomyces species biomass and their bioactive metabolites[J].Crit Rev Microbiol,2017,43(5):567-582.
[22]王晓青,曾洪梅,石义萍.农用抗生素2-16高产菌株选育及发酵优化组合研究[J].微生物学通报,2005(6):7-11.
[23]布坎南R E,吉本斯N E.伯杰细菌鉴定手册(第八版)[M].北京:科学出版社,1984:1037-1182.
[24]王津.一株具有抑菌活性的放线菌JN18的鉴定及发酵条件优化[D].南昌:江西农业大学,2021.
[25]魏振勇,于爽,迟雪梅,等.海洋来源成团泛菌Y-03产低温甾醇酯酶发酵条件优化[J].中国酿造,2025,44(1):219-225.
[26]阎耀东.单分散聚酰亚胺粒子的制备与表征[D].太原:太原理工大学,2010.
[27]唐睿,林俊芳,郭丽琼,等.银耳芽孢多糖发酵培养基配方、发酵条件的优化及其放大发酵试验[J].食品工业科技,2021,42(20):173-182.
[28]李秋晓,庞泽敏,张茹,等.高产乙酸乙酯酵母的筛选鉴定及发酵条件优化[J].中国酿造,2024,43(6):80-87.
[29]陈秋旭,卫春会,吴玲,等.浓香型酒醅中一株高产蛋白酶菌株的鉴定及产酶条件的优化[J].食品科技,2023,48(2):7-13.