食醋作为我国传统酿造调味品之一,其酿制及食用已有上千年的历史[1-2]。根据醋酸发酵方式的不同,酿造食醋可分为固态发酵食醋和液态发酵食醋两大类,其中镇江香醋是我国固态发酵食醋的典型代表。镇江香醋酿造过程主要包括酿酒、固态分层发酵制醅、封醅、淋醋、煎醋等工艺[3],其中在固态分层发酵环节众多微生物如醋酸菌、乳酸菌、芽孢菌共同作用[4],形成镇江香醋独特风味。有机酸是赋予镇江香醋独特风味的主要物质,以挥发性的醋酸与不挥发性的乳酸含量最多,其中不挥发性的乳酸具有柔和的酸味,能够缓冲食醋中醋酸刺激性酸感[5]。乳酸主要在固态分层发酵露底前期产生,这个阶段底部物料未经翻动,在发酵池底端形成了微氧或厌氧的条件,醋醅中的乳酸菌可利用酒醪、麦麸中的糖分等营养物迅速繁殖产生乳酸,乳酸进而与部分醇类反应生成各种酯类风味物质[6-7]。因此,对镇江香醋醋醅中的主要乳酸菌进行分离并应用,对食醋酿造风味的改善具有一定意义。
苹果醋是液态发酵食醋的主要品类,随着市场对苹果醋降低血糖[8]、延缓衰老[9-11]等功能的认可,苹果醋在我国液态醋市场上的占比越来越重,但苹果醋的酿造菌种相对单一,导致其不挥发酸质量浓度较低,入口刺激、风味寡淡。目前苹果醋的研究主要集中在其功能[10]、产酸速率、醋酸菌[12-13]应用等方面,而乳酸菌在苹果醋发酵中的应用研究较少。如杨辉等[12]利用酵母菌、醋酸菌在不同营养条件下混菌发酵苹果醋,使得苹果醋酿造周期明显缩短、酸味更佳柔和。李欢等[13]筛选得到一株高产醋酸的巴氏醋杆菌,通过流加方法得到总酸120 g/L的高酸度苹果醋。卢怡等[14]采用云南传统老醋生产所用的混合菌种进行苹果醋多菌种混合发酵,所制备的苹果醋风味较佳且发酵周期短。乳酸可有效促进苹果醋中风味物质的形成,使得果醋酸味柔和,提升消费者的进食欲望、促进人体消化[15],因此,筛选到能够有效增酸且具有优良发酵性能的耐酸乳杆菌对于提高苹果醋不挥发酸含量及感官品质具有重要意义。
本研究采用高通量测序技术和平板筛选法从镇江香醋醋醅中分离出主要的乳酸菌,对其生长特性进行研究,并进一步将其应用于苹果醋的发酵,对比分析乳酸菌参与发酵后苹果醋主要理化指标及挥发性风味物质差异,以期达到改善苹果醋风味品质的目标,为优质苹果醋酿造工艺提供指导。
1 材料与方法
1.1 材料与试剂
醋醅:取自镇江某传统香醋厂;浓缩苹果浊汁:安德利集团;酿酒高活性干酵母:安琪酵母股份有限公司;巴氏醋酸杆菌(沪酿1.01):上海迪发酿造生物制品有限公司;乙酸、乙醇、甲醇、亚铁氰化钾、硫酸锌、磷酸二氢钠(均为分析纯):国药集团化学试剂有限公司。
MRS 肉汤培养基:青岛高科园海博生物科技公司。
分离培养基:取66.2 g MRS 培养基,添加20 g碳酸钙、加热溶解于1 L蒸馏水中,分装,121 ℃高温灭菌15 min备用。
醋酸菌培养基:葡萄糖10.0 g/L,酵母粉5 g/L,115 ℃高压灭菌20 min,接种前加入3%(V/V)无水乙醇。
1.2 仪器与设备
H35厌氧培养箱:Don Whiteley Scientific 公司;5810R台式高速冷冻离心机:德国Eppendorf 公司;LC 1260高效液相色谱仪、Cary+60紫外分光光度计、US1541L442气相色谱-质谱联用仪(gaschromatography-massspectrometry,GC-MS):美国安捷伦公司;T100聚合酶链式反应仪(polymerase chain reaction,PCR):美国伯乐公司;YL-C3型组合式摇床:太仓市强文实验设备有限公司。
1.3 方法
1.3.1 醋醅高通量测序
取镇江某传统香醋厂发酵至第6天的醋醅,从醋醅表面自上而下等间距25 cm依次取样品A 50 g、样品B 50 g、样品C 50 g、样品D 50 g,取样后迅速存至于-80 ℃冰箱待测,细菌高通量测序和数据分析在苏州美吉生物科技有限公司进行。
1.3.2 乳酸菌的分离
取1.3.1中的醋醅样品各25 g分别加入225 mL无菌生理盐水中,摇匀后取1 mL加入9 mL无菌生理盐水中,在漩涡混合器上混和均匀后,再取1 mL稀释过的溶液加入9 mL生理盐水中,以此类推,进行梯度稀释。选取3个合适的稀释度依次涂布在MRS分离培养基固体平板上,30 ℃厌氧恒温条件下培养5 d,观察。依据乳酸菌形态特征和透明圈大小挑选长势优良的单菌落多次分离纯化、获得纯培养单菌落,接种到斜面保藏备用。
1.3.3 分离菌株的鉴定
分别挑取单菌落用革兰氏阳性细菌裂解液裂解,取上清液用无菌水稀释20倍得到脱氧核糖核酸(deoxyri bonucleic acid,DNA)模板,再通过PCR扩增[16],具体步骤如下:引物1(27F):(5'-AGAGTTTGATCCTGGCTCAG-3');引物2(1492R):(5'-TACGGCTACCTTGTTACGACTT-3')。本试验PCR扩增体系:12.5 μL的2×Phanta Max预混液、1 μL引物1、1 μL引物2、1 μL DNA模板,再加入9.5 μL无菌水得到25 μL体系。PCR扩增程序:95 ℃预变性4 min;95 ℃变性45 s,56 ℃退火45 s,72 ℃延伸90 s,34个循环;72 ℃终延伸5 min,4 ℃、时间无穷大。反应结束后PCR产物经过2%琼脂糖凝胶电泳验证,将最扩增终产物进行16S rDNA测序分析,测序结果在美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库中进行同源序列对比,初步确定物种的种属信息,选取相似度较高的菌株序列作为参考,利用MEGA 6.0分析软件制作系统发育树,与醋醅中多样性分析结果进行比较,筛分得到醋醅中主要的乳酸菌。
1.3.4 分离乳酸菌生长特性分析
乳酸菌种子液:取1环纯化后的乳酸菌种接种于100 mL MRS培养基中,在30 ℃条件下静置培养2 d作为种子液。
最适宜生长温度分析:按照10%(V/V)的接种量,将接种后的菌液分别置于25 ℃、30 ℃、35 ℃、40 ℃、42 ℃、45 ℃培养箱中静置培养5 d,在波长600 nm条件下测量吸光度值。
乙酸耐受性分析:在乙酸质量分数分别为0(对照)、2 g/100 mL、3 g/100 mL、4 g/100 mL、5 g/100 mL、7 g/100 mL、9 g/100 mL的培养基中,接入10%(V/V)种子液,30 ℃条件下静置培养5 d。以4 ℃储存的菌液为对照组,测量OD600nm值。
乙醇耐受性分析:在乙醇体积分数分别为0(对照)、7%、8%、9%、10%、11%的培养基中,接入10%(V/V)种子液,30 ℃条件下静置培养5 d。以4 ℃储存的菌液为对照组,测量OD600nm值。
产酸性能分析:向灭菌后的MRS肉汤培养基中接入10%(V/V)种子液,30 ℃培养11 d,每天分别取10 mL培养液,进行pH值、总酸、不挥发性酸的测定,总酸和不挥发酸参照GB/T 18187—2000《酿造食醋》[17]方法测定。
1.3.5 乳酸菌对液态苹果醋发酵品质的影响
浓缩苹果浊汁→稀释→苹果汁→酒精发酵(乳酸菌、酵母菌)→杀菌→醋酸发酵(沪酿1.01)→过滤→杀菌→成品
苹果汁:取一定量浓缩苹果浊汁,加入3倍质量水稀释得到苹果汁。
酒精发酵:将0.2 g/L酿酒高活性干酵母加入5 g/100 mL葡萄糖溶液中,37 ℃活化30 min。实验组加入1.3.4制备的5%(V/V)乳酸菌种子液,对照组加入5%(V/V)的无菌水,在30 ℃条件下发酵7 d,每天搅拌一次,加水稀释制备酒精度7.5%vol的苹果酒。
醋酸发酵:分别在5 L发酵罐中加入实验组、对照组苹果酒2.5 L,各加入0.5 L无菌水,接种3%(V/V)沪酿1.01醋酸菌种子液,在温度30 ℃、通气量为0.1 L/(L·min)条件下搅拌发酵,当发酵液中酒精度低于0.5%vol时,分割出1/3体积的发酵液,加入等体积的苹果酒继续发酵,开始计为发酵0 h,直至发酵液中酒精度低于0.3%vol发酵结束。采样时间点分别为发酵0 h、6 h、12 h、18 h、22 h、26 h、28 h、30 h、32 h、34 h过滤、杀菌后即得苹果醋成品。
1.3.6 苹果醋品质测定方法
有机酸含量:参考GB/T 18623—2011《地理标志产品镇江香醋》[18]。
挥发性风味物质检测:采用固相微萃取(solid-phase microextraction,SPME)联合GC-MS测定。样品处理:将5 mL醋样置于10 mL样品瓶中,加入1.5 g固体NaCl和20 μL内标(1 500 μg/mL的4-甲基-2-戊醇),50 ℃条件下用SPME萃取头顶空吸附40 min,搅拌转速250 r/min;气相色谱条件:DB-1701色谱柱(30 m×0.25 mm×0.25 μm),载气为氦气(He),流量1 mL/min,不分流,进样口温度250 ℃。柱温起始40 ℃,以3 ℃/min升温至120 ℃,再以10 ℃/min升温至250 ℃,保持10 min;质谱条件:接口温度250 ℃,离子源温度230 ℃,电离方式电子电离(electronic ionization,EI)源,电子能量70eV,扫描质量范围33~450amu,后续操作参照文献[19-20]进行测定分析;定性分析:将测得质谱图与美国国家标准技术研究所(national institute of standards and technology,NIST)14.L谱库进行检索比对,对各个色谱峰的化学成分进行定性;定量分析:内标法定量。
1.3.7 数据处理方法
实验采用SPSS17.0软件进行数据分析,P<0.05表示影响显著;利用Origin 2021进行主成分分析(principal components analysis,PCA)与绘制挥发性风味物质含量的热图。
2 结果与分析
2.1 醋醅高通量测序分析
发酵6 d的醋醅不同取样位置细菌种相对丰度如图1所示。由图1可知,此阶段醋醅细菌群中乳酸杆菌属(Lactobacillus)和醋酸杆菌属(Acetobacter)占据绝对优势地位,这与叶晓婷[21]对不同季节镇江香醋醋醅进行微生物结构检测结果相同。在不同位置醋醅样品中,醋醅乳杆菌属(Lactobacillus)均主要含有耐酸乳杆菌(Lactobacillus ace totolerans)、瑞士乳杆菌(Lactobacillus helveticus)、桥乳杆菌(Lactobacillus pontis),耐酸乳杆菌在4个不同位置醋醅样品中丰度均高于75%,因此可得出耐酸乳杆菌是该阶段醋醅中主要的乳酸菌种,而且越是在醋醅底层,其相对丰度越高。耐酸乳杆菌能利用葡萄糖、苹果酸和丙酮酸等作为生长的营养物质,生成乳酸和乙酸,有助于提高醋的质量[22]。
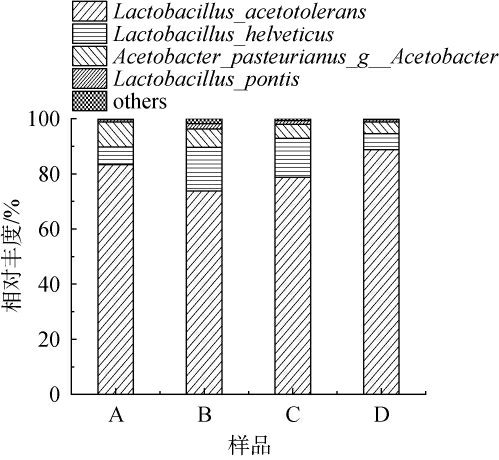
图1 基于种水平发酵6 d不同取样位置醋醅细菌相对丰度
Fig.1 Relative abundance of Cupei bacteria at different sampling positions after 6 d of fermentation based on the species level
2.2 乳酸菌的分离
从分离培养基中挑选得到优势菌株L(图2),其菌落呈微白色、湿润,边缘整齐,圆形,直径为2.0 mm。利用结晶紫染色,在光学显微镜下可以观察到该菌体呈杆状,菌体呈现单个或者多个连成链状,可知分离的菌株均与乳杆菌相似。
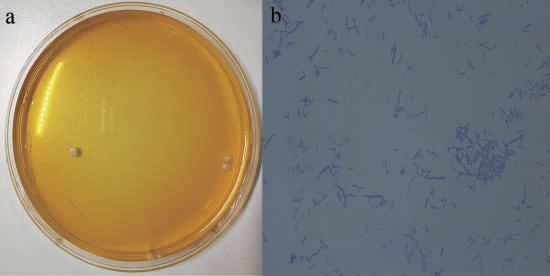
图2 分离菌种的形态学特征
Fig.2 Morphological characteristics of isolated strains
a为菌落形态;b为菌体形态。
2.3 分离乳酸菌鉴定
通过对筛选的菌株进行16S rDNA测序鉴定,将所测序列结果在NCBI数据库中进行对比,菌株对比结果相似度靠前的9株菌种将其DNA序列下载,用MEGA6.0软件作成系统发育树,结果见图3。
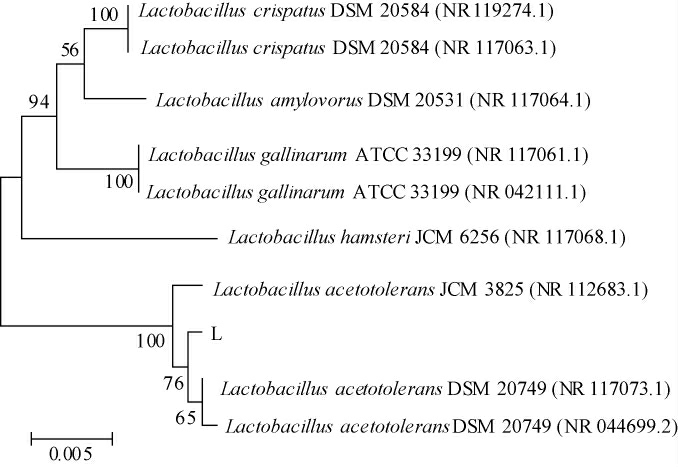
图3 分离菌株系统发育树
Fig.3 Phylogenetic tree of isolated strains
由图3可知,分离的菌种L与耐酸乳杆菌JCM 3825相似度为100%,菌种L可鉴定为耐酸乳杆菌(Lactobacillus acetotolerans),将其命名为耐酸乳杆菌L-1。通过图1可知醋醅中耐酸乳杆菌的丰度最高,后续选用耐酸乳杆菌L-1应用于苹果醋的发酵。
2.4 耐酸乳杆菌L-1最适生长温度
不同温度对耐酸乳杆菌L-1生长的影响见图4。由图4可知,随着温度的升高,耐酸乳杆菌L-1培养液的吸光度值先升高再降低。温度为30 ℃时,培养液吸光度值最高达到0.472±0.005,菌体浓度最高,最适宜耐酸乳杆菌L-1的生长繁殖。
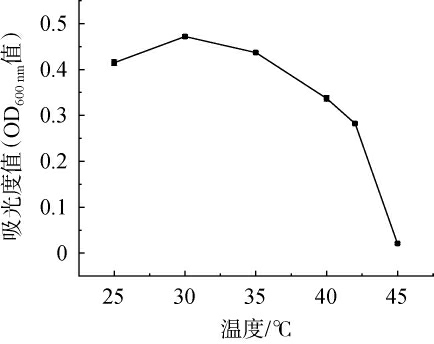
图4 不同温度对耐酸乳杆菌L-1生长的影响
Fig.4 Effect of different temperatures on the growth of Lactobacillus acetotolerans L-1
2.5 耐酸乳杆菌L-1的乙酸耐受性
耐酸乳杆菌L-1生长的乙酸耐受性见图5。由图5可知,耐酸乳杆菌L-1生长活力随着乙酸含量的升高而降低,当乙酸含量为2 g/100 mL时,耐酸乳杆菌L-1生长开始受到抑制,培养液吸光值较对照组降低了0.035;当乙酸含量为3 g/100 mL和4 g/100 mL时,培养液吸光值较对照组分别降了1.037和1.740,表明耐酸乳杆菌L-1生长受到严重抑制。因此,当乙酸含量<3 g/100 mL时,耐酸乳杆菌L-1生长活性虽然受到影响,但菌体浓度仍然保持了较高水平;但当乙酸含量达到3 g/100 mL以上时,耐酸乳杆菌L-1的活性严重降低甚至死亡,其在醋醅发酵后期对风味物质的生成贡献有限。
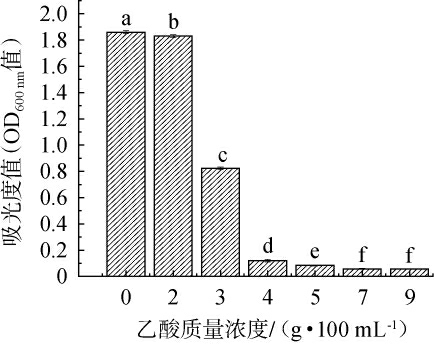
图5 不同乙酸质量浓度对耐酸乳杆菌L-1生长的影响
Fig.5 Effect of different mass concentrations of acetic acid on the growth of Lactobacillus acetotolerans L-1
2.6 耐酸乳杆菌L-1的乙醇耐受性
耐酸乳杆菌L-1的乙醇耐受性见图6。由图6可知,耐酸乳杆菌具有极强的耐乙醇特性,在乙醇含量>8%vol时,耐酸乳杆菌L-1菌液吸光度值显著下降(P<0.05)。在传统酿醋过程中,制酒阶段原料中的还原糖在酵母的作用下转化成乙醇,使酒醪的乙醇体积分数逐渐升高,一般达9%vol,在此条件下耐酸乳杆菌L-1仍可较好的生长。
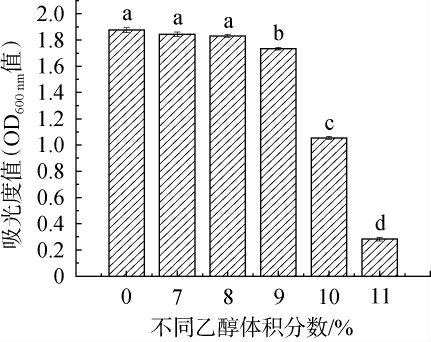
图6 不同乙醇体积分数对耐酸乳杆菌L-1生长的影响
Fig.6 Effect of different ethanol volume fractions on the growth of Lactobacillus acidophilus L-1
不同小写字母表示具有显著性差异(P<0.05)。
2.7 耐酸乳杆菌L-1产酸性能分析
耐酸乳杆菌L-1生长过程产酸情况见图7。由图7可知,pH由0 d的4.87降至3 d的3.78,其后pH变化浮动较小。总酸在第7天达到最高,为1.615 g/100 mL,不挥发酸则为1.624 g/100 mL,说明耐酸乳杆菌L-1产生的酸主要为不挥发性酸。在发酵至第11天时,总酸与不挥发酸分别降至1.406 g/100 mL和1.368 g/100 mL,可能是由于培养后期耐酸乳杆菌将有机酸作为营养物质被消耗所导致的[23]。邱婷等[24]从镇江香醋醋醅中分离得出一株耐乙酸乳杆菌JN500903,向MRS培养基中加入5%(V/V)的乙酸、40 g/L的葡萄糖,发酵10 d后乳酸含量可以达到16.1 g/L,与本研究筛分的菌株不挥发酸产量相当。
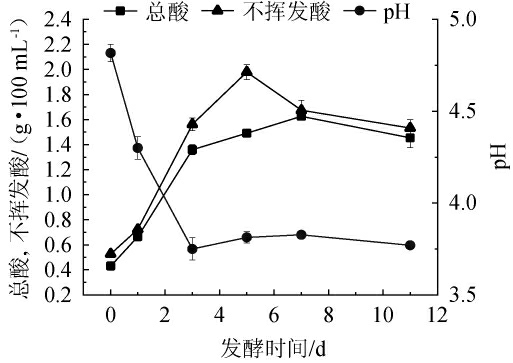
图7 不同发酵时间对耐酸乳杆菌L-1产酸的分析
Fig.7 Analysis of acid production by Lactobacillus acetotolerans L-1 with different fermentation time
2.8 耐酸乳杆菌L-1对液态发酵苹果醋品质的影响
2.8.1 耐酸乳杆菌L-1对液态发酵苹果醋总酸的影响
由图8可知,实验组和对照组苹果酒在醋酸发酵过程中经过第一次分割出1/3发酵液再加入等体积苹果酒继续发酵时,实验组起始总酸为5.208 g/100 mL,随着发酵的进行,总酸含量不断升高,在第34 h发酵结束时达到6.724 g/100 mL。对照组起始总酸为4.829 g/100 mL,较实验组低0.379 g/100 mL,这可能是由于苹果酒经耐酸乳杆菌发酵后,提高了其总酸含量,发酵34 h时总酸含量为6.635 g/100 mL。随着发酵的进行,实验组与对照组总酸含量的差异逐渐缩小,可能是醋酸发酵后期醋酸菌开始利用有机酸所导致。
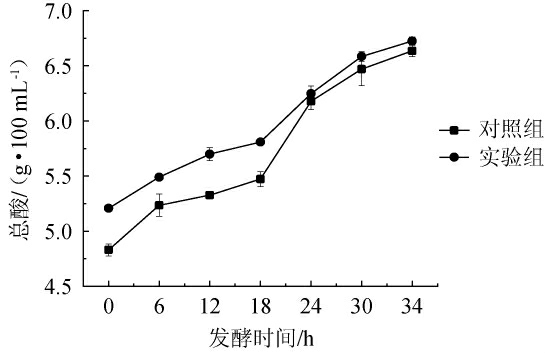
图8 苹果醋醋酸发酵过程总酸变化
Fig.8 Changes in total acid during acetic acid fermentation of apple cider vinegar
2.8.2 耐酸乳杆菌L-1对液态发酵苹果醋不挥发酸的影响
由图9可知,经过耐酸乳杆菌L-1发酵后,实验组不挥发酸在各阶段均高于对照组。发酵初始时实验组不挥发酸为0.693 g/100 mL,对照组为0.228 g/100 mL;发酵结束时实验组不挥发酸达到0.392g/100mL,较对照组(0.095g/100mL)高0.297 g/100 mL。食醋中的乳酸一部分来源于酒精发酵阶段,另一部分来源于醋酸发酵阶段后期[25],通过在苹果酒发酵阶段加入耐酸乳杆菌协同发酵,可以提高苹果醋中不挥发酸的质量浓度。不挥发酸是食醋重要的基础理化指标,其含量的高低对食醋的风味和柔和度有着密切的影响,不挥发酸含量越高,更加能够赋予食醋柔和的口感[26]。
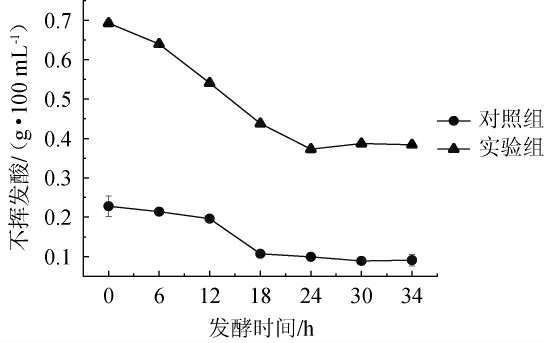
图9 苹果醋醋酸发酵过程不挥发酸含量变化
Fig.9 Changes in non-volatile acids content during acetic acid fermentation of apple cider vinegar
2.8.3 耐酸乳杆菌L-1对液态发酵苹果醋有机酸的影响
如表1所示,液态发酵苹果醋有机酸主要由挥发性酸(乙酸)和不挥发性酸(酒石酸、苹果酸、乳酸、琥珀酸等)组成,其中乙酸质量浓度占比最高。经耐酸乳杆菌L-1协同发酵的苹果醋,乳酸、乙酸、柠檬酸、琥珀酸含量较对照组显著增加(P<0.05),乳酸和琥珀酸质量浓度分别达到1.41 g/L和0.80 g/L。酒石酸和苹果酸变化差异不显著(P>0.05),草酸质量浓度均在0.01 g/L左右。
表1 苹果醋的有机酸组成
Table 1 Organic acid composition of apple cider vinegar
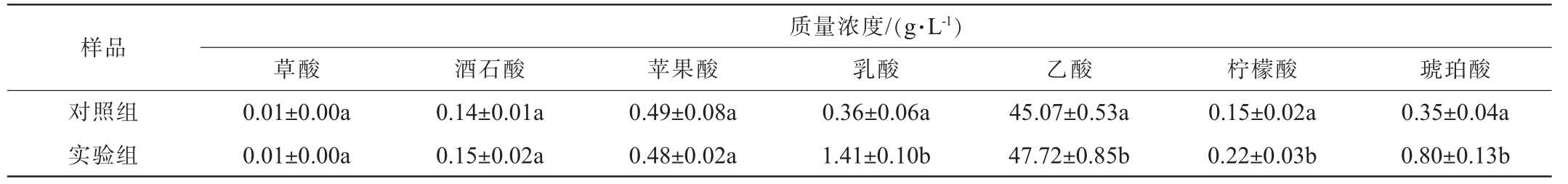
注:同列不同小写字母表示具有显著性差异(P<0.05)。
样品质量浓度/(g·L-1)草酸 酒石酸 苹果酸 乳酸 乙酸 柠檬酸 琥珀酸对照组实验组0.01±0.00a 0.01±0.00a 0.14±0.01a 0.15±0.02a 0.49±0.08a 0.48±0.02a 0.36±0.06a 1.41±0.10b 45.07±0.53a 47.72±0.85b 0.15±0.02a 0.22±0.03b 0.35±0.04a 0.80±0.13b
2.9 苹果醋挥发性风味物质分析
2.9.1 耐酸乳杆菌L-1对液态发酵苹果醋挥发性物质种类及含量的影响
由图10a可知,对照组苹果醋中共检测到34种挥发性风味物质,较实验组少4种,其中实验组中酯类物质种类较对照组多6种,质量浓度增加了2.801 mg/L,这可能是由于乳酸菌在发酵过程中产生更多的有机酸,促进醋酸发酵阶段醇类与酸类的反应,从而形成了更多的酯类化合物[27]。由图10b可知,经耐酸乳杆菌L-1协同发酵制备的苹果醋挥发性风味物质含量较对照组高5.87%,达到22.20 mg/L,其中酯类物质的种类与含量增加明显,尤其是具有花果香的乙酸异戊酯、乙酸苯乙酯、辛酸乙酯、癸酸乙酯等物质。
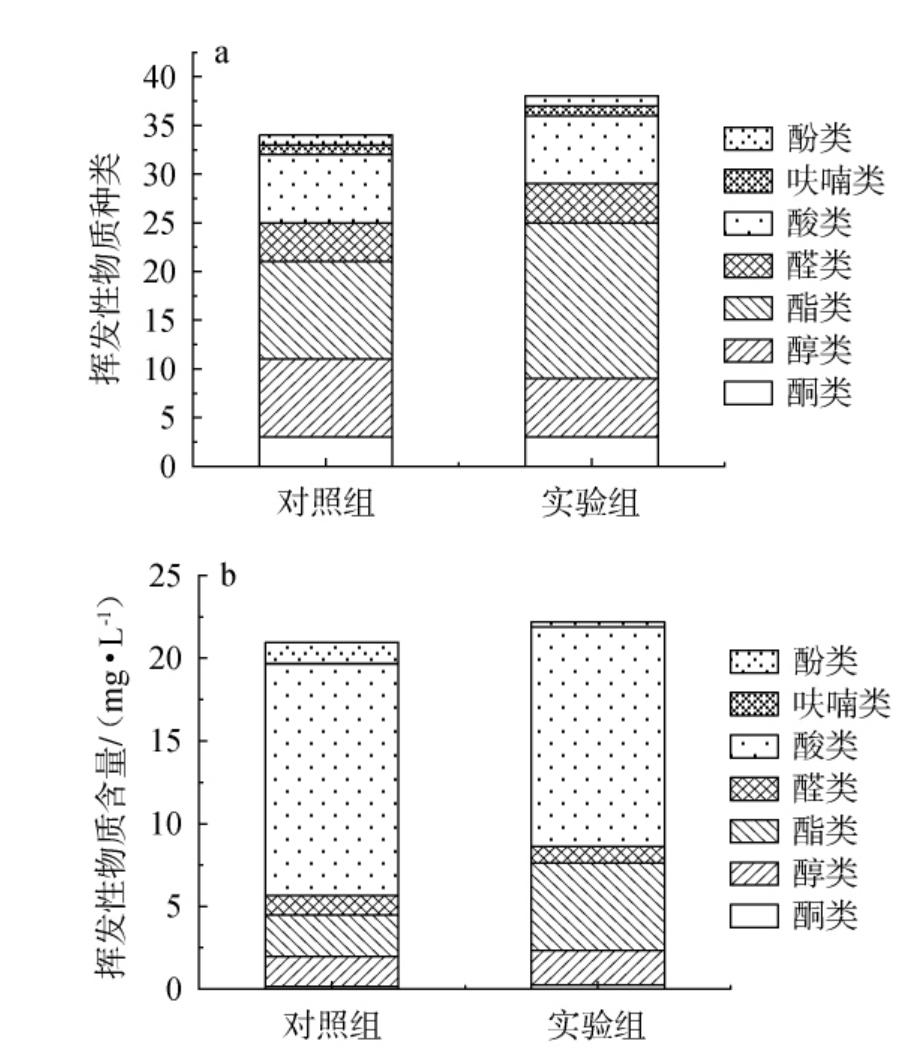
图10 耐酸乳杆菌L-1对液态发酵苹果醋挥发性风味物质种类(a)及含量(b)的影响
Fig.10 Effect of Lactobacillus acetotolerans L-1 on the types (a)and contents(b)of volatile flavor substances in liquid-state fermentation apple cider vinegar
2.9.2 耐酸乳杆菌L-1对液态发酵苹果醋挥发性风味物质主成分分析
将实验组和对照组苹果醋挥发性风味物质含量进行PCA分析,结果见图11。由图11可知,PC1、PC2的方差贡献率分别为54.4%、20.1%,累计方差贡献率为74.4%。实验组和对照组苹果醋能够明显被区分,表明实验组与对照组苹果醋样品之间的挥发性风味化合物存在差异。PCA载荷图反映了挥发性化合物对构建模型的贡献大小。由图11 b可知,在实验组中辛酸乙酯、辛酸异丁酯、癸酸甲酯等酯类化合物的位置与实验组在得分图中的位置相近,表明这些化合物是实验组苹果醋的主要挥发性物质,对分类起到重要作用。
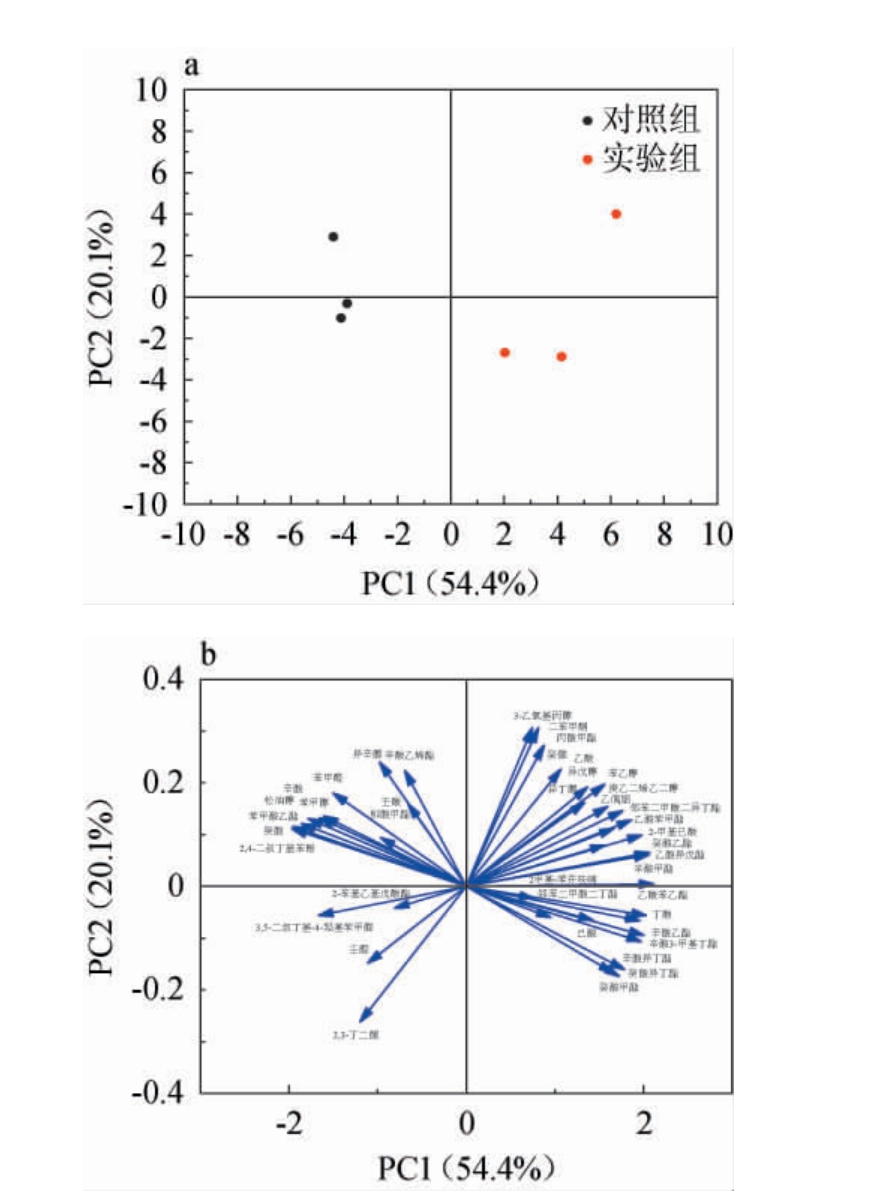
图11 液态发酵苹果醋挥发性风味物质含量的主成分分析得分图(a)和载荷图(b)
Fig.11 Principal component analysis score chart (a) and load chart(b) of volatile flavor substances contents in apple cider vinegar with liquid-state fermentation
2.9.3 液态发酵苹果醋中挥发性风味物质聚类热图分析
为了更加清晰直观地反映实验组与对照组苹果醋挥发性风味物质含量变化,基于GC-MS的定量结果进行聚类分析,如图12所示。
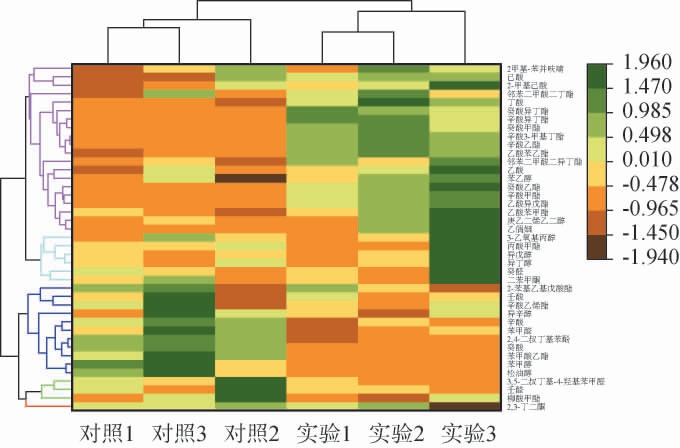
图12 液态发酵苹果醋中挥发性风味物质聚类分析热图
Fig.12 Cluster analysis heat map of volatile flavor compounds in apple cider vinegar with liquid-state fermentation
由图12可知,实验组和对照组苹果醋明显被分成两类。2,4-二叔丁基苯酚,癸酸,苯甲醇,松油醇在对照组中质量浓度较高,而己酸、丁酸、癸酸异丁酯、辛酸异丁酯、癸酸甲酯、辛酸乙酯、乙酸苯乙酯、乙偶姻在实验组中质量浓度较高,酯类物质种类及含量更佳丰富。乙偶姻是3-羟基-2丁酮,具有一种令人愉快的奶油香味[28-29],是生成食醋中功能性物质川芎嗪的前体物质[30],LU Z M等[28]利用巴斯德醋酸杆菌与短乳杆菌和发酵乳杆菌共同培养发酵时,乙偶姻的合成大幅度提高。因此通过耐酸乳杆菌L-1对苹果醋前期苹果酒进行发酵,有利于苹果醋风味物质的生成。
3 结论
本研究从镇江香醋醋醅中筛选、鉴定得出一株耐酸乳杆菌L-1,对其生长特性进行研究,结果表明,耐酸乳杆菌L-1适宜生长温度为30 ℃,在乙酸含量<3 g/100 mL、乙醇体积分数小于9%条件下仍能较好生长,具有较强的耐酸耐乙醇性能。将耐酸乳杆菌L-1应用于苹果醋发酵,发现所酿造的苹果醋中不挥发酸质量浓度更高,挥发性风味物质中酯类物质种类和含量均增多,风味更佳。本研究为乳酸菌强化改善液态发酵苹果醋风味提供了一定的理论指导,后续可进一步探究该耐酸乳杆菌L-1在液态米醋、乳制品等传统发酵食品中的应用。
[1]郑宇,程程,刘静,等.中国传统固态发酵食醋主要特征风味物质组成分析[J].中国食品学报,2020,20(8):237-247.
[2]张志燕,钱静亚,马真,等.镇江香醋醋醅中优势高产酸醋酸菌菌株的筛选[J].食品工业科技,2016,37(11):174-178.
[3]李信,陈雯,熊锋,等.不同封醅时间对镇江香醋品质的影响[J].食品工业科技,2022,43(17):33-42.
[4]孙红,柴丽娟,陆震鸣,等.镇江香醋核心酿造微生物醋酸杆菌和乳酸杆菌共培养对生长代谢的影响[J].微生物学报,2021,61(7):2065-2076.
[5]XU W,HUANG Z Y,ZHANG X J,et al.Monitoring the microbial community during solid-state acetic acid fermentation of Zhenjiang aromatic vinegar[J].Food Microbiol,2011,32(6):1175-1181.
[6]程荷芳.传统食醋酿造中微生物的研究进展[J].食品工业,2022,43(8):245-248.
[7]ZHENG Y,MOU J,NIU J,et al.Succession sequence of lactic acid bacteria driven by environmental factors and substrates throughout the brewing process of Shanxi aged vinegar[J].Appl Microbiol Biot,2018,102(17):2645-2658.
[8]KANNAN S,ANANDHASAYANAM A,NIRANJANA E S,et al.Apple cider vinegar effervescent tablets on gut health,obesity and user experience:An observation[J].Asian Food Sci J,2024,23(3):38-46.
[9]李雅楠,张晓娟,董艳林,等.不同来源的苹果醋理化指标,抗氧化活性和风味特性分析[J].中国酿造,2023,42(11):40-47.
[10]RUDKHANEEI K,AGHAJANINASAB M,ABBASI M,et al.Effect of apple cider vinegar on spermatogenesis and serum total antioxidant status in rats under high fat diet[J].Avicenna J Clin Med,2016,23(3):249-258.
[11]ASHCHYAN H,JEN M,ELENITSAS R,et al.Surreptitious apple cider vinegar treatment of a melanocytic nevus: Newly described histologic features[J].J Cutan Pathol,2018,45(4):34-37.
[12]杨辉,薛媛媛.苹果醋混合菌种发酵工艺研究[J].陕西科技大学学报:自然科学版,2016,34(6):135-140.
[13]李欢,毛健,刘双平,等.醋酸高产菌株的筛选及高酸度苹果醋的酿造[J].食品与生物技术学报,2019,38(5):7-14.
[14]卢怡,苏有勇.多菌混合发酵酿造苹果醋的工艺研究[J].中国调味品,2011,36(3):84-86.
[15]杨建红,张惠玲,张卫峰.多菌混合发酵鲜枣果醋的工艺研究[J].中国酿造,2015,34(8):155-157.
[16]陈卓,毛祥,于华,等.四川麸醋醋醅中乳酸菌的分离鉴定及产酸特性研究[J].中国调味品,2018,43(4):103-113.
[17]国家质量监督检验检疫总局,国家标准化管理委员会.GB/T 18187—2000 酿造食醋[S].北京:中国标准出版社,2000.
[18]国家标准化管理委员会,国家质量监督检验检疫总局.GB/T 18623—2011 地理标志产品镇江香醋[S].北京:中国标准出版社,2011.
[19]AL-DALALI,SAM Z,SUN F P,et al.Effects of different brewing processes on the volatile flavor profiles of Chinese vinegar determined by HS-SPME-AEDA with GC-MS and GC-O[J].LWT-Food Sci Technol,2020,133(1):1-10.
[20]WANG X J,LI Y K,SONG H C,et al.Phenolic matrix effect on aroma formation of terpenes during simulated wine fermentation-Part I:Phenolic acids[J].Food Chem,2021,341(2):1-12.
[21]叶晓婷.不同季节镇江香醋风味品质差异性及与微生物菌群演替的相关性研究[D].镇江:江苏科技大学,2023.
[22]NICOMRAT D, CHAMUTPONG S.Assorted lactic acid bacteria with yeasts in alcohol submerged fermentation step of vinegar production[J].Appl Mech Mater,2017,866:69-72.
[23]解寒,刘瑞山,张晓娟,等.乳杆菌有机酸耐受性及发酵果蔬汁性能分析[J].食品科学,2022,43(6):149-157.
[24]邱婷,邓永建,陆震鸣,等.耐乙酸乳杆菌的筛选及其产乳酸特性[J].微生物学通报,2019,46(12):3305-3311.
[25]畅功民,张春杰,张敏,等.高乳酸食醋酿造技术研究进展[J].中国酿造,2016,35(9):1-4.
[26]邓永建,陆震鸣,张晓娟,等.不同乳酸菌对液态发酵米醋总酸及风味物质的影响[J].食品科学,2020,41(22):97-102.
[27]SUN S Y,GONG H S,LIU W L,et al.Application and validation of autochthonous Lactobacillus plantarum starter cultures for controlled malolactic fermentation and its influence on the aromatic profile of cherry wines[J].Food Microbiol,2016,55:16-24.
[28]LU Z M,LIU N,WANG L J,et al.Elucidating and regulating the acetoin production role of microbial functional groups in multispecies acetic acid fermentation[J].Appl Environ Microbiol,2016,82(19):5860-5868.
[29]LU L,WEI X T,YU W P,et al.Enhancement of acetoin production from Bacillus licheniformis by 2,3-butanediol conversion strategy:Metabolic engineering and fermentation control[J].Proc Biochem,2017,57:35-42.
[30]YU H,ZHANG R Y,YANG F W,et al.Control strategies of pyrazines generation from Maillard reaction[J].Trends Food Sci Technol,2021,112(1):795-807.