我国作为稻米的种植大国,同时也作为稻米的消耗大国,有70%的人口以大米为主要食品[1]。大米含有糖类、蛋白质、矿物质和维生素等丰富的营养物质[2-3],因此米制品逐渐风靡世界。其中米乳饮料,因其特有的风味、优质的口感和高质量的营养价值而受到许多国家消费者的欢迎,且米乳饮料可被乳糖不耐、牛奶蛋白过敏、素质主义人群食用[4-8],因此,可作为一种新型发酵饮品,具有较好的市场前景。
大米乳因其富含大量淀粉,因此,在加工过程需要对大米进行液化和糖化处理。研究发现,一些细菌如乳酸菌具有降解淀粉能力[9-10],可利用这些细菌代替液化和糖化过程。同时,一些乳酸菌提高机体免疫、调节肠道菌群、改善机体代谢机能等生理功能[11-14]。采用乳酸菌发酵加工发酵米乳,不仅能提升其附加值,也符合国家提出大健康计划关于开发改善人体健康的功能性食品的发展方向。GHOSH K等[15]从印度传统发酵大米饮料中分离出一株产α-淀粉酶和α-葡萄糖苷酶的发酵乳杆菌(Lactobacillus fer mentum)KKL1,采用该菌株发酵的发酵米乳饮料中的代谢产物对1,1二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhy drazyl,DPPH)自由基具有显著清除能力。SANKAR G S等[16]从传统发酵米饮料中筛选出一株具有抑菌能力的植物乳杆菌(Lactobacillus plantarum)L7,采用该菌株制作的发酵米乳具有良好的风味且其代谢产物抗氧化活性较好。KANG G S等[17]采用短乳杆菌(Lactobacillus brevis)、Lactobacillus plantarum和肠膜明串珠菌(Leuconostoc mesenteroides)三株菌混合制作发酵米乳γ-氨基丁酸(γ-aminobutyric acid,GABA)含量显著提高。但目前,关于混菌发酵制备米乳饮料工艺条件优化鲜见报道。
本研究采用透明圈法从植物乳植杆菌(Lactiplantibacillus plantarum)(编号分别为YB9、YB36、LP-P2)、乳酸乳球菌(Lactococcus lactis)LLA6115,嗜酸乳杆菌(Lactobacillus acidophilus)AD125筛选具有降解淀粉能力的乳酸菌菌株并研究其发酵特性,并将菌株接种至大米乳中制备发酵米乳饮料,考察不同菌株复配比例、料液比、发酵温度和发酵时间对发酵米乳饮料的品质的影响。以期提高发酵米乳饮料品质,为发酵米乳产品的开发奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
大米:市售;植物乳植杆菌(Lactiplantibacillus plantarum)(编号分别为YB9、YB36、LP-P2)、乳酸乳球菌(Lactococcus lactis)(编号为LLA6115),嗜酸乳杆菌(Lactobacillus acidophilus)(编号为AD125):从传统发酵谷物制品中分离,哈尔滨商业大学食品工程学院保存。
1.1.2 试剂
蛋白胨、牛肉膏、酵母粉、琼脂:北京奥博星生物科技有限责任公司;苯酚:广州化学试剂厂;葡萄糖:天津市风船化学试剂有限公司;硫酸锰、K2HPO4、柠檬酸二铵、CH3COONa、硫酸镁、柠檬酸三铵、可溶性淀粉、碘、碘化钾、NaOH、酒石酸钾钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、无水亚硫酸钠、磷酸氢二钠、磷酸二氢钾、KCl:天津市天力化学试剂有限公司。所用试剂均为分析纯或生化试剂。
1.1.3 培养基
MRS液体培养基:蛋白胨10.0 g/L,牛肉膏10.0 g/L,葡萄糖20.0 g/L,吐温80 1.0 g/L,硫酸锰0.05 g/L,K2HPO4 2.0 g/L,柠檬酸二铵2.0 g/L,CH3COONa 5.0 g/L,硫酸镁0.2 g/L,水1 L,pH保持在6.5到6.8之间,121 ℃灭菌15 min。
MRS固体培养基:蛋白胨10.0 g/L,牛肉膏10.0 g/L,酵母粉5 g/L,葡萄糖20 g/L,硫酸镁0.1 g/L,柠檬酸三铵2 g/L,硫酸锰0.05 g/L,CH3COONa 5 g/L,吐温80 1 g/L,K2HPO4 2 g/L,琼脂15 g/L,水1 L,调节pH至6.6±0.2后,121 ℃高压蒸汽灭菌15 min。
淀粉液体培养基:蛋白胨10 g/L,K2HPO4 2 g/L,柠檬酸二铵2 g/L,可溶性淀粉10 g/L,吐温80 1 g/L,硫酸镁0.2 g/L,CH3COONa 5 g/L,硫酸锰0.05 g/L,水1 L。调节pH至6.6±0.2,121 ℃灭菌15 min。
淀粉固体培养基:蛋白胨10 g/L,柠檬酸二铵2 g/L,硫酸镁0.2 g/L,K2HPO4 2 g/L,硫酸锰0.05 g/L,吐温80 1 g/L,可溶性淀粉10 g/L,CH3COONa 5 g/L,琼脂粉18 g/L,水1 L。调节pH至6.6±0.2,121 ℃灭菌15 min。
1.2 仪器与设备
ALP CL-40L型高压蒸汽灭菌锅:广东东南科创科技有限公司;LC-LX-H165A型离心机:上海力辰仪器科技有限公司;PHS-25PHS-3C型pH计:上海雷磁仪器有限公司;JA1003型电子天平、THZ-98A型恒温振荡培养箱:上海尚普仪器设备有限公司;CX43型显微镜:北京瑞科中仪科技有限公司;INC 125 F digital恒温培养箱:艾卡(广州)仪器设备有限公司;712G-100紫外分光光度计:上海精科上分仪器有限公司。
1.3 方法
1.3.1 降解淀粉乳酸菌筛选
初筛:将乳酸乳球菌LLA6115,植物乳植杆菌YB9、YB36、LP-P2,嗜酸乳杆菌AD125活化液(108 CFU/mL)以3%(V/V)的接种量接种于200 mL MRS液体培养基中,37 ℃厌氧培养24 h。采用碘-淀粉显色法并通过淀粉透明圈直径、菌落直径和D/d值对具有降解淀粉能力乳酸菌进行初筛,将含3~5滴鲁哥氏碘液的淀粉固体培养基上用打孔器打三个孔,分别取50 μL乳酸菌菌液加入各孔中,在37 ℃厌氧条件下培养24 h,观察透明圈的显色情况,用游标卡尺测量菌落直径(d)和透明圈直径(D),并根据淀粉透明圈直径、透明圈直径和菌落直径比值(D/d值)筛选具有降解淀粉能力的乳酸菌。
复筛:将初筛得到的具有淀粉降解能力的菌株于37 ℃厌氧培养24 h,然后采用DNS法测定发酵过程(12 h、16 h、20 h、24 h、28 h、32 h、36 h)中的淀粉酶活力[18-19],将乳酸菌菌液于5 000 r/min离心10 min,取1 mL上清液与2.5 mL 1%淀粉磷酸缓冲盐溶液混合,于60 ℃水浴保温30 min。添加1 mL 0.4 mol/L NaOH,摇匀后加0.1 mL DNS试剂,于60 ℃水浴保温5 min后于在波长540 nm处测定吸光度值(A),以蒸馏水为对照。以葡萄糖质量浓度(x)为横坐标,波长520 nm处的吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,获得标准曲线回归方程:y=1.097x-0.023 8,相关系数R2=0.998 8。淀粉酶酶活定义:1 mL酶液每分钟水解淀粉产生1 μg葡萄糖所需酶量为一个酶活单位(U/mL)[20]。酶活力单位计算公式如下:
式中:A为通过试样吸光度值(OD540 nm值)计算出的葡萄糖含量,mg;B为反应放大倍数;C为菌液稀释倍数;t为反应时间,min。
1.3.2 筛选乳酸菌生长曲线和产酸能力的测定
取已活化乳酸菌液以2%(V/V)接种量接种于MRS液体培养基,以空白MRS液体培养基为对照,37 ℃培养箱静置培养24 h,每隔2 h取出菌液,用分光光度计测定其OD600nm值,同时采用pH计测定菌液的pH值,绘制菌株的生长曲线及产酸曲线。
1.3.3 筛选乳酸菌拮抗作用
活化后的乳酸菌液菌落数为108 CFU/mL,设置不同乳酸菌菌株比例 分别为LLA6115:LP-P2=1∶1、LLA6115:AD125=1∶1、LP-P2:AD125=1∶1和LLA6115:LP-P2:AD125=1∶1∶1,以2%(V/V)的接种量接种至MRS液体培养基中,以空白MRS液体培养基为对照,37 ℃培养箱静置培养24 h,每隔2 h取出菌液,采用分光光度计测定其OD600nm值。
1.3.4 发酵米乳饮料的制备及发酵条件优化
发酵米乳饮料的制备:取50 g大米用粉碎机进行粉碎并过80目筛,以料液比为1∶8(g∶mL)加水,采用磨浆机磨浆,将米浆放至90 ℃水浴锅中保温15 min后放入均质机于20 MPa的条件下均质5 min,所得米浆于85 ℃条件下灭菌30 min,然后,取上述活化乳酸菌液(108 CFU/mL)以3%(V/V)的接种量接种于大米乳中,于37 ℃发酵12 h,将发酵后的样品放入冰箱冷藏12 h,即制得发酵米乳饮料。
发酵条件优化:以感官评分、pH值和酸度为评价指标,对发酵时间、发酵温度、料液比(g∶mL)及菌株复配比例4个因素的水平进行组合,并去掉重复组别后,考察不同发酵条件对发酵米乳饮料感官品质的影响,其因素及水平设计见表1。
表1 发酵米乳饮料发酵条件优化试验因素及水平
Table 1 Factors and levels of experiments for fermentation conditions optimization of fermented rice milk beverage
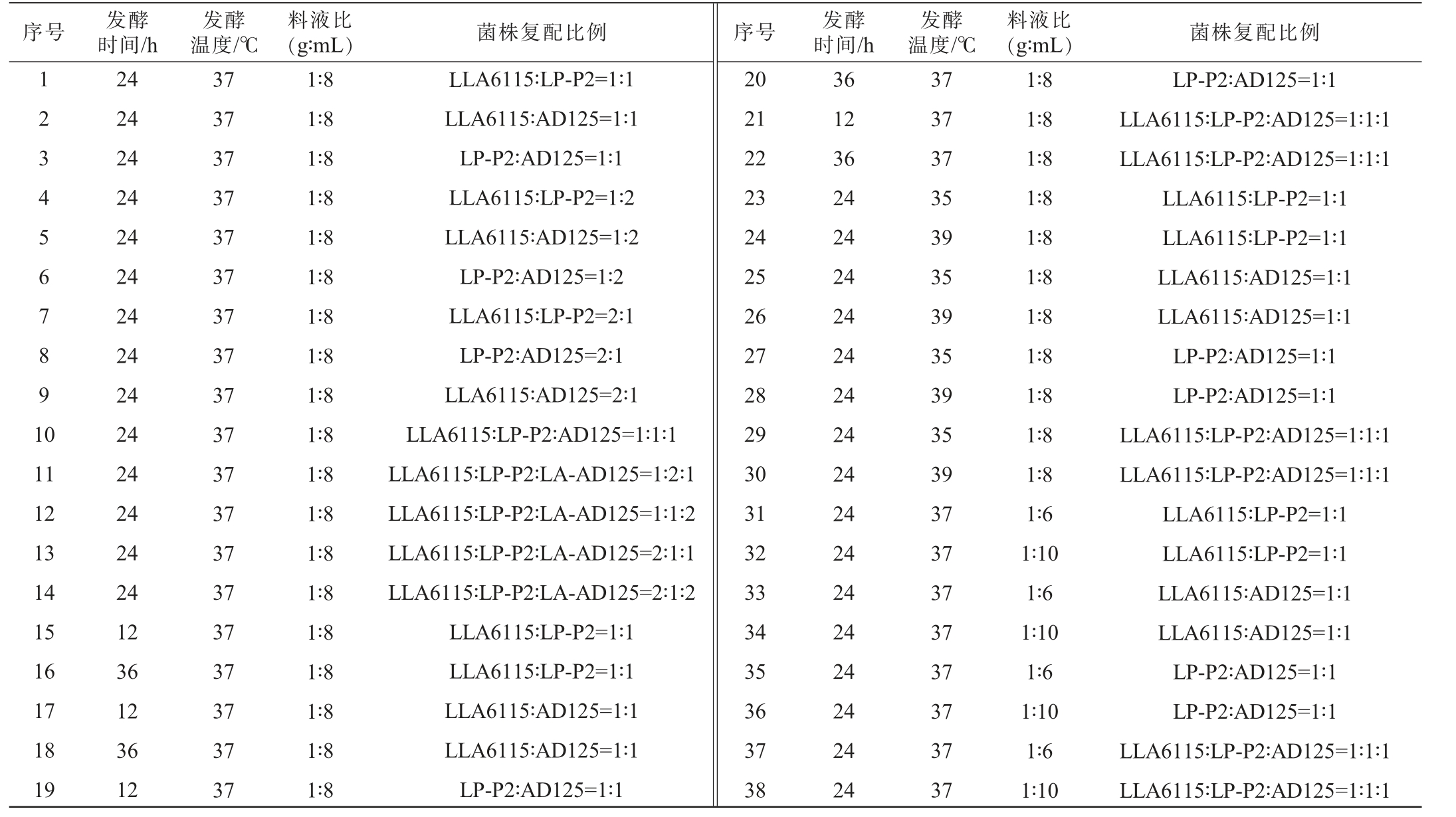
序号 发酵时间/h发酵温度/℃(g∶mL)菌株复配比例 序号 发酵时间/h料液比发酵温度/℃料液比(g∶mL)菌株复配比例1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 18 19 24 24 24 24 24 24 24 24 24 24 24 24 24 24 12 36 12 36 12 37 37 37 37 37 37 37 37 37 37 37 37 37 37 37 37 37 37 37 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 LLA6115∶LP-P2=1∶1 LLA6115∶AD125=1∶1 LP-P2∶AD125=1∶1 LLA6115∶LP-P2=1∶2 LLA6115∶AD125=1∶2 LP-P2∶AD125=1∶2 LLA6115∶LP-P2=2∶1 LP-P2∶AD125=2∶1 LLA6115∶AD125=2∶1 LLA6115∶LP-P2∶AD125=1∶1∶1 LLA6115∶LP-P2∶LA-AD125=1∶2∶1 LLA6115∶LP-P2∶LA-AD125=1∶1∶2 LLA6115∶LP-P2∶LA-AD125=2∶1∶1 LLA6115∶LP-P2∶LA-AD125=2∶1∶2 LLA6115∶LP-P2=1∶1 LLA6115∶LP-P2=1∶1 LLA6115∶AD125=1∶1 LLA6115∶AD125=1∶1 LP-P2∶AD125=1∶1 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 36 12 36 24 24 24 24 24 24 24 24 24 24 24 24 24 24 24 24 37 37 37 35 39 35 39 35 39 35 39 37 37 37 37 37 37 37 37 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶8 1∶6 1∶10 1∶6 1∶10 1∶6 1∶10 1∶6 1∶10 LP-P2∶AD125=1∶1 LLA6115∶LP-P2∶AD125=1∶1∶1 LLA6115∶LP-P2∶AD125=1∶1∶1 LLA6115∶LP-P2=1∶1 LLA6115∶LP-P2=1∶1 LLA6115∶AD125=1∶1 LLA6115∶AD125=1∶1 LP-P2∶AD125=1∶1 LP-P2∶AD125=1∶1 LLA6115∶LP-P2∶AD125=1∶1∶1 LLA6115∶LP-P2∶AD125=1∶1∶1 LLA6115∶LP-P2=1∶1 LLA6115∶LP-P2=1∶1 LLA6115∶AD125=1∶1 LLA6115∶AD125=1∶1 LP-P2∶AD125=1∶1 LP-P2∶AD125=1∶1 LLA6115∶LP-P2∶AD125=1∶1∶1 LLA6115∶LP-P2∶AD125=1∶1∶1
1.3.5 发酵米乳饮料pH和酸度的测定
pH 值的测定:采用pH 计;酸度的测定:按照GB 5009.239—2016《食品安全国家标准 食品酸度的测定》中的方法[21]。
1.3.6 感官评价
选取经过感官培训的15名评价员对发酵米乳饮料从色泽、乳清析出、硬度、香气、组织状态及酸味进行感官评价,满分为100分,发酵米乳饮料感官评价标准见表2。
表2 发酵米乳饮料感官评价标准
Table 2 Sensory evaluation criteria of fermented rice milk beverage
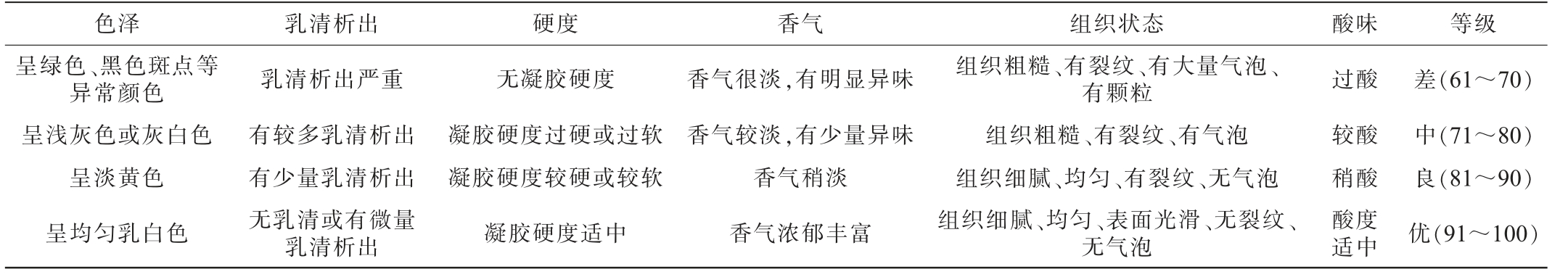
色泽 乳清析出 硬度 香气 组织状态 酸味 等级呈绿色、黑色斑点等异常颜色呈浅灰色或灰白色呈淡黄色呈均匀乳白色乳清析出严重有较多乳清析出有少量乳清析出无乳清或有微量乳清析出无凝胶硬度凝胶硬度过硬或过软凝胶硬度较硬或较软凝胶硬度适中香气很淡,有明显异味香气较淡,有少量异味香气稍淡香气浓郁丰富组织粗糙、有裂纹、有大量气泡、有颗粒组织粗糙、有裂纹、有气泡组织细腻、均匀、有裂纹、无气泡组织细腻、均匀、表面光滑、无裂纹、无气泡过酸较酸稍酸酸度适中差(61~70)中(71~80)良(81~90)优(91~100)
1.3.7 数据处理与统计分析
所有试验均重复3次,实验结果以“平均值±标准差”表示。实验数据采用SPSS 17.0 软件进行数据分析,Microsoft Excel 2023软件作图。
2 结果与分析
2.1 降解淀粉乳酸菌菌株的筛选结果
2.1.1 初筛
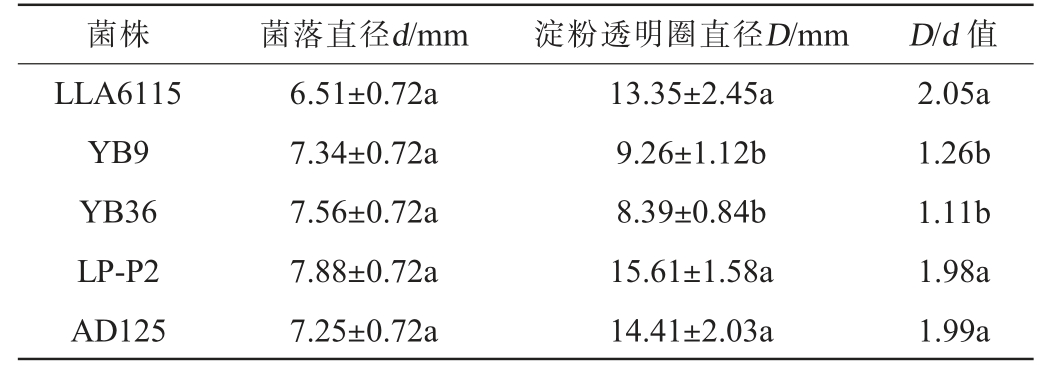
5株乳酸菌的菌落直径、淀粉透明圈直径和D/d值测定结果见表3。
表3 5株乳酸菌的菌落直径、淀粉透明圈直径和D/d值测定结果
Table 3 Colony diameter, starch transparent circle diameter, and D/d values of 5 strains of lactic acid bacteria
注:同列中不同小写字母表示差异显著(P<0.05)。下同。
菌株 菌落直径d/mm 淀粉透明圈直径D/mm D/d 值LLA6115 YB9 YB36 LP-P2 AD125 6.51±0.72a 7.34±0.72a 7.56±0.72a 7.88±0.72a 7.25±0.72a 13.35±2.45a 9.26±1.12b 8.39±0.84b 15.61±1.58a 14.41±2.03a 2.05a 1.26b 1.11b 1.98a 1.99a
由表3可知,在5株乳酸菌在淀粉固体培养基表面均有的淀粉透明圈,其中,菌株YB9和菌株YB36的淀粉透明圈较小,其直径分别为9.26 mm和8.39 mm。菌株LLA6115、菌株LP-P2和菌株AD125有明显的淀粉透明圈,其直径分别为13.35 mm、15.61 mm、14.41 mm。实验结果与王祯瑜等[22-24]的结果相似。透明圈直径与菌落直径的比值(D/d)>1.5说明菌株具有较强的淀粉降解能力[22]。在本研究中,菌株LLA6115、菌株LP-P2和菌株AD125的D/d值分别为2.05、1.98、1.99,而菌株YB9和菌株YB36的D/d值仅为1.26和1.11。因此,初步判断菌株LLA6115、LP-P2、AD125具有较强的降解淀粉能力。
2.1.2 复筛
为了确定初筛菌株的降解淀粉能力,考察了初筛菌株在不同发酵时间的淀粉酶活力变化,其检测结果见图1。
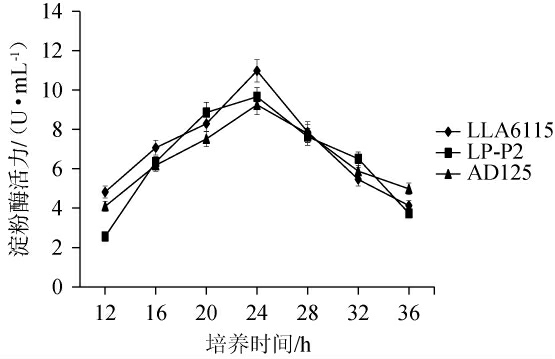
图1 初筛乳酸菌菌株所产淀粉酶的酶活力曲线
Fig.1 Enzyme activity curves of amylase produced by primary screening lactic acid bacteria strains
由图1可知,随着培养时间在12~36 h内的延长,3株菌所产淀粉酶活力呈先升高后降低的趋势,其中,当培养时间为24 h时,菌株LLA6115和菌株LP-P2、菌株AD125的淀粉酶活力均最大,分别为10.98 U/mL、9.66 U/mL和9.25 U/mL。此结果高于徐一涵[19]研究中乳酸菌的淀粉酶活力(9.23 U/mL),但低于王祯瑜等[22-23]的研究结果(66.58 U/mL、38.96 U/mL)。其淀粉酶活性下降可能是由于菌株生长繁殖速度较快、培养基营养成分供给不足、菌株产酸导致培养基pH值降低等原因,抑制了菌株淀粉酶的活性。综合考虑,筛选出具有较强降解淀粉能力的乳酸菌LLA6115、菌株LP-P2和菌株AD125。
2.3 乳酸菌生长曲线和产酸能力分析
生长曲线可以反映菌株的生长规律以及在不同时期的生长状态,而产酸曲线可以反映菌株在生长过程中的产酸能力[25]。3株乳酸菌的生长曲线和产酸曲线见图2。
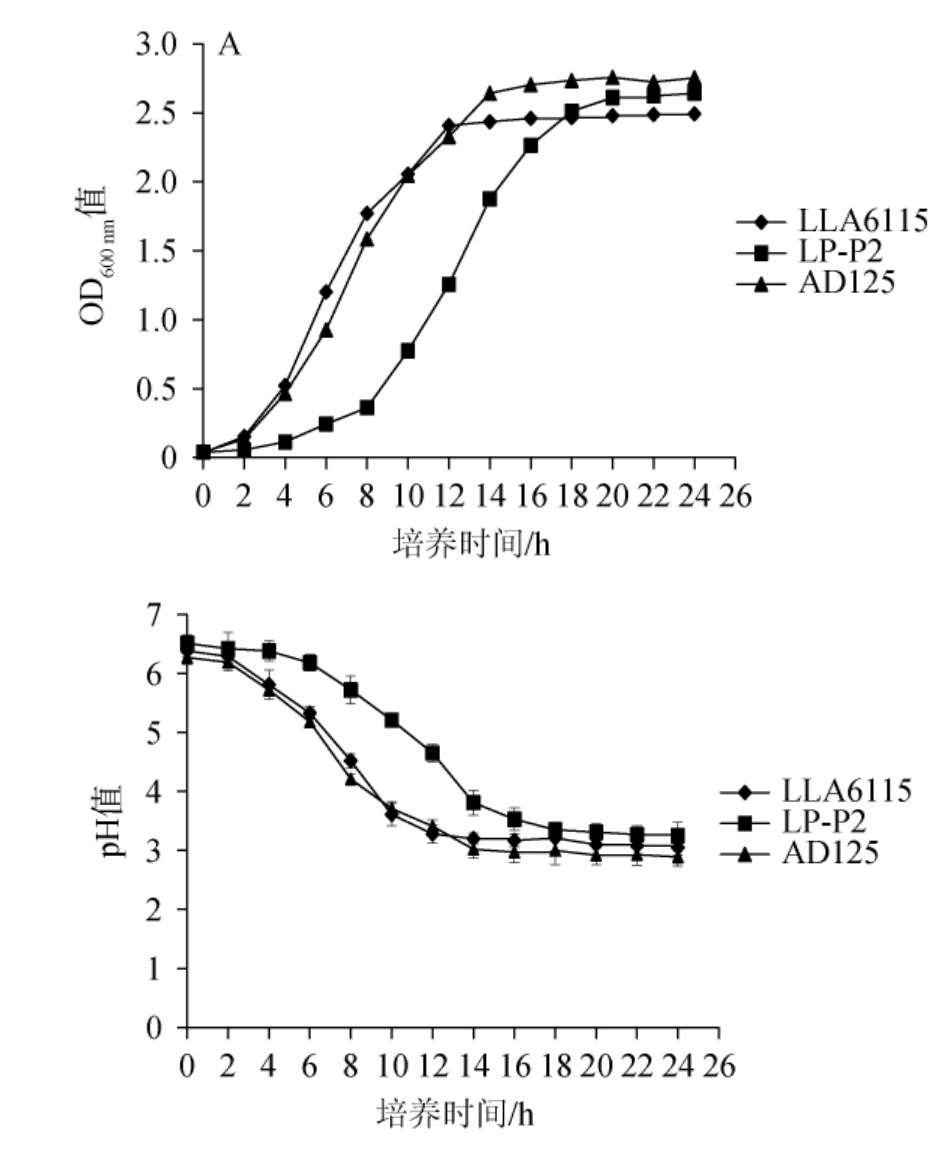
图2 筛选乳酸菌的生长曲线(A)和产酸曲线(B)
Fig.2 Growth curve (A) and acid production curve (B) of the screened lactic acid bacteria
由图2a可知,菌株LLA6115、LP-P2、AD125生长趋势大致相同,随着培养时间在0~4 h的延长,菌株生长均处于停滞期;分别在4 h、8 h和4 h时进入对数期;并在12 h、18 h和14 h时进入稳定期。因此,根据生长曲线结果,菌株LLA6115、菌株LP-P2和菌株AD125分别培养至12 h、18 h和14 h进行后续接种发酵。
由图2b可知,随着培养时间在0~24 h的延长,3株菌的pH值变化趋势相同,菌株LLA6115、菌株AD125在发酵6 h之后pH值开始大幅度下降,而菌株LP-P2在发酵10 h之后开始大幅度下降,这与3株菌进入对数期的时间相吻合。当3株菌分别培养至12 h、18 h和14 h后,pH值的下降趋势分别趋于平缓且pH值均<4,这也与先前研究中乳酸乳球菌、植物乳植杆菌和嗜酸乳杆菌的pH变化结果相似,表明3株菌具有较强的产酸能力[26-28]。此外,由于此阶段三株菌进入稳定期,说明3株菌也具有较好的耐酸能力。
2.4 乳酸菌拮抗作用分析
通常,大多数乳酸菌均可以共生,但有些乳酸菌之间仍有不同程度的拮抗抑制作用[29-30]。为了确定3株菌之间是否存在拮抗作用,对其进行共同培养24 h,测定菌液OD600 nm值,结果见图3。
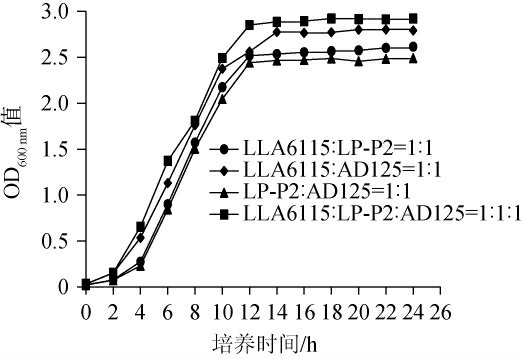
图3 乳酸菌菌株之间的拮抗作用
Fig.3 Antagonistic effects among lactic acid bacteria strains
由图3可知,随着培养时间在0~12 h的延长,菌株LLA6115和菌株LP-P2,菌株LLA6115和菌株AD125,菌株LP-P2和菌株AD125,菌株LLA6115、菌株LP-P2和菌株AD125的OD600 nm值呈上升趋势,并分别在发酵16 h、16 h、18 h和20 h后趋于平缓。以上结果说明,3株菌株在共培养过程中不存在相互拮抗作用,可通过菌株复配用于后续发酵。
2.5 发酵米乳饮料发酵条件优化
由表4可知,样品13、样品14、样品22、样品30、样品37的酸度>110°T,而样品19和样品27的酸度<70°T,先前的研究发现,消费者可接受的发酵饮品的酸度在70~110°T之间,这也与上述样品感官评分低于80的结果相吻合[31]。
表4 不同菌株复配比例和发酵条件下发酵米乳饮料pH、酸度和感官评分结果
Table 4 Results of pH, acidity and sensory score of fermented rice milk beverages under different ratios of compound strains and fermentation conditions

样品编号 pH值 酸度/°T 感官评分/分 样品编号 pH值 酸度/°T 感官评分/分1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 18 19 4.92±0.38b 4.90±0.51b 4.95±0.12b 4.32±0.22d 4.56±0.35cd 5.10±0.18ab 4.32±0.07d 4.82±0.22b 4.37±0.31d 4.68±0.18c 4.38±0.41d 4.44±0.44d 4.16±0.32e 4.35±0.15d 5.17±0.35b 4.31±0.41d 5.12±0.21ab 4.57±0.44cd 5.34±0.55a 102.6±2.6bc 103.5±1.1bc 103.2±1.5bc 106.2±2.2b 104.8±1.5bc 96.9±1.8b 108.6±2.2ab 95.5±0.8c 107.5±0.5ab 109.3±0.8b 107.3±1.1bc 107.0±2.5ab 115.7±3.1a 119.7±1.8cd 93.9±2.5de 107.2±1.5b 79.3±1.8e 107.3±2.8b 69.7±2.2f 86±4a 85±2a 84±3a 78±3b 81±1ab 81±2ab 79±1b 76±2b 75±1bc 82±2ab 77±3b 76±2b 76±3b 74±2c 84±3a 81±1ab 82±2ab 79±3b 78±4b 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 4.77±0.25b 4.66±0.22c 4.18±0.33e 5.07±0.27ab 4.55±0.39b 5.09±0.45ab 4.54±0.32ab 5.47±0.11a 4.43±0.15a 4.70±0.41c 4.11±0.22c 4.54±0.33cd 4.96±0.12b 4.67±0.21c 5.08±0.17ab 4.74±0.41c 5.21±0.33a 4.45±0.55cd 4.68±0.25c 102.6±0.6b 97.7±1.3c 116.6±1.1a 76.7±2.2e 99.2±1.8cd 73.1±0.5ef 106.4±2.8b 66.2±2.7f 108.5±3.1c 100.3±1.3c 112.5±2.2b 104.5±2.5b 89.7±0.5d 105.5±0.4b 78.7±0.8e 106.7±2.1b 81.2±1.1e 110.7±1.3ab 104.2±2.5bc 79±2b 76±3b 72±2c 78±3b 77±2b 75±1bc 73±3c 77±2b 73±2c 81±4ab 76±1b 82±3ab 83±3ab 77±1b 82±2ab 81±2ab 78±2b 79±2b 78±4b
随着发酵时间在12~36 h范围内的延长,发酵米乳饮料样品15、1、16的pH值由5.17下降至4.31,酸度由93.9上升至107.2°T,而感官评分呈先升高后降低的趋势,其中样品1的感官评分为86分,高于其他两个样品;样品17、2、18的pH值由5.12下降至4.57,酸度由79.3°T上升至107.3°T,而感官评分呈先升高后降低的趋势,其中样品2的感官评分为85分,高于其他两个样品;样品19、3、20的pH值由5.34下降至4.77,酸度由69.7°T上升至102.6°T,而感官评分呈先升高后降低的趋势,其中样品3的感官评分为84分,高于其他两个样品;样品21、4、22的pH值由4.66下降至4.18,酸度由97.7°T上升至116.6°T,而感官评分呈先升高后降低的趋势,其中样品4的感官评分为78分,高于其他两个样品。因此,发酵米乳饮料的最适发酵时间为24 h。
随着料液比在1∶6~1∶10(g∶mL)范围内的增加,发酵米乳饮料样品31、1、32的pH值由4.54上升至4.96,酸度由104.5°T下降至89.7°T,而感官评分呈先增加后降低的趋势,其中样品1的感官评分为86分,高于其他两个样品。样品33、2、34的pH值由4.67上升至5.08,酸度由105.5°T下降至78.7°T,而感官评分呈先增加后降低的趋势,其中样品2的感官评分为85分,高于其他两个样品;样品35、3、36的pH值有所升高,由4.74升至5.21,酸度有所下降,由106.7°T降至81.2°T,而感官评分呈先增加后降低的趋势,其中样品3的感官评分为84分,高于其他两个样品;样品37、4、38的pH值呈先下降再升高的趋势,酸度呈先升高再下降的趋势,而感官评分略有下降且差异不显著(P>0.05),其中样品37的感官评分为79°T,高于其他两个样品。因此,发酵米乳饮料的最适料液比为1∶8(g∶mL)。
随着发酵温度在35~39 ℃范围内的升高,发酵米乳饮料样品23、1、24的pH值由5.07下降至4.55,酸度及呈感官评分均呈先升高后降低的趋势,其中,样品1的酸度、感官评分分别为102.6°T、86分,高于其他两个样品;样品25、2、26的pH值由5.09下降至4.54,酸度由73.1°T下降至106.4°T,而感官评分呈先升高后降低的趋势,其中样品2的感官评分为85分,高于其他两个样品;样品27、3、28的pH值由5.47下降至4.43,酸度由66.2°T下降至108.5°T,而感官评分呈先升高后降低的趋势,其中样品3的感官评分为84分,高于其他两个样品;样品29、4、30的pH值由4.70下降至4.11,酸度由由100.3°T降至112.5°T,而感官评分有所下降,由81分降至76分。因此,发酵米乳饮料的最适发酵温度为37 ℃。
以发酵时间为24 h、料液比为1∶8(g∶mL)、发酵温度为30 ℃的发酵条件,接种3种乳酸菌复配的发酵米乳饮料样品10~14的pH值均较低、酸度均较高、感官评分均低于80分(除样品10外),感官品质较差。而菌株两两复配比例为1∶1的发酵米乳饮料(样品1、2、3)的pH值、酸度和感官评分均优于其他复配比例的发酵米乳,且菌株LLA6115与LP-P2复配的发酵米乳饮料感官品质优于LLA6115和AD125、LP-P2和AD125。因此,最适菌株及复配比例为LLA6115和LP-P2(1∶1)。
通过比较不同菌株复配比例、料液比、发酵时间和发酵温度对发酵米乳的pH、酸度和感官评分的影响,发现样品1的发酵米乳饮料具有较优的pH和酸度,感官评价最高。因此,发酵米乳饮料的最佳发酵工艺为:菌株LLA6115和菌株LP-的复配比例1∶1,料液比1∶8(g∶mL),发酵温度37 ℃,发酵时间24 h。在此条件下制备的发酵米乳饮料感官评分为86分,pH为4.92,酸度为102.6°T。
3 结论
本研究筛选出3株具有淀粉分解能力的乳酸菌:菌株LLA6115、植物乳植杆菌LP-P2以及嗜酸乳杆菌AD125,三株菌具有较好的产酸和耐酸能力,且共培养过程中不存在相互拮抗作用,以3株菌不同复配制作发酵米乳饮料,并考察不同发酵条件对发酵米乳pH酸度和感官评分的影响,最终确定发酵米乳饮料的最优工艺条件:菌株LLA6115与菌株LP-P2的复配比例为1∶1,米浆的料液比为1∶8(g∶mL),发酵温度为37 ℃,发酵时间24 h。在此优化条件下,发酵米乳饮料的感官评分86分,pH值4.92,酸度102.6°T。通过本研究旨在为发酵米乳产品的生产和品质改善提供一定的参考依据。
[1]孙佳齐,徐晓云,潘思轶,等.米饭蒸煮技术与装备研究进展[J].中国粮油学报,2024,39(10):216-225.
[2]黄靖,李泽腾,刘荣,等.大米结构及鉴别中红外光谱研究[J].江苏调味副食品,2022(4):39-44.
[3]阿木尔吉日嘎拉,王玉兰.石墨炉原子吸收法测定大米中的重金属镉、铅含量[J].黑龙江畜牧兽医,2015(15):287-288.
[4]GRAU-FUENTES E,RODRIGO D,GARZÓN R,et al.Understanding the marketed plant-based beverages:From ingredients technological function to their nutritional value[J].J Funct Foods,2023,106:105609.
[5]BOCKER R, SILVA E K.Innovative technologies for manufacturing plant-based non-dairy alternative milk and their impact on nutritional,sensory and safety aspects[J].Future Foods,2022,5:100098.
[6]KANDYLIS P,PISSARIDI K,BEKATOROU A,et al.Dairy and non-dairy probiotic beverages[J].Curr Opin Food Sci,2016,7:58-63.
[7]ZOR M,BULUT M, KARAGÖZ S G, et al.Use of hydrogen-rich water in rice milk preparation improves the nutritional and sensory properties of product[J].Food Chem,2024,437:137821.
[8]FENG D C,YIN S J,WEN X Y,et al.Heat treatment improves the dispersion stability of rice bran milk through changing the settling behavior[J].Food Chem,2024,450:139348.
[9]顾旭峰,郭雯莉,夏永军,等.水解淀粉乳酸菌的筛选[J].食品与发酵科技,2016,52(4):54-57,61.
[10]梁言,陈中,刘秉杰.3株乳杆菌发酵籼米粉浆及其产酶特性[J].食品科学,2020,41(4):161-168.
[11]罗茂妮.具有缓解腹泻和调节免疫功效乳酸菌的筛选及其菌粉制备[D].南昌:南昌大学,2024.
[12]刘晓卉,潘姝杉,魏小倩,等.植物乳杆菌P-8对小鼠免疫功能的调节作用研究[J].现代生物医学进展,2022,22(16):3005-3009.
[13]马新明,项芳琴,翟纯毅,等.复合乳酸菌改善小鼠肠道菌群功能的研究[J].食品与生物技术学报,2024,43(4):98-105.
[14]朱萌茜.调节糖,脂代谢乳酸菌的筛选及其功能评价[D].郑州:河南工业大学,2023.
[15]GHOSH K, RAY M, ADAK A, et al.Role of probiotic Lactobacillus fermentum KKL1 in the preparation of a rice based fermented beverage[J].Biores Technol,2015,188:161-168.
[16]SANKAR G S, SANKAR S S, SUBRATA S, et al.Use of a potential probiotic,Lactobacillus plantarum L7,for the preparation of a rice-based fermented beverage[J].Front Microbiol,2018,9:473.
[17]KANG G S, SIZIYA I N, SEO D H.Production of lab-fermented rice beverage with enhanced GABA content[J].Curr Topic in Lactic Acid Bacteria and Probiotics,2020,6(2):56-63.
[18]胡云瑶,谭鹏,杨婷,等.4种消食中药的质量生物活性测定方法研究;消化酶种类选择与活力效价测定[J].中草药,2023,54(7):2106-2113.
[19]徐一涵.产淀粉酶乳酸菌在马铃薯粉发酵中的应用[D].上海:上海交通大学,2019.
[20]王田,马宝林,古丽孜巴·格亚斯丁,等.吐曼河河水可培养功能菌株的筛选与生化初步鉴定[J].化工设计通讯,2023,49(4):173-177,81.
[21]中华人民共和国国家卫生和计划生育委员会.GB 5009.239—2016 食品安全国家标准食品酸度的测定[S].北京:中国标准出版社,2016.
[22]王祯瑜.产淀粉酶菌株的筛选与发酵条件的优化及其降解淀粉途径的探讨[D].大连:辽宁师范大学,2022.
[23]张晓瑞.烟草淀粉降解菌的筛选鉴定及发酵工艺研究[D].郑州:河南农业大学,2021.
[24]冯颖杰,王鹏飞,陈芝飞,等.烟叶中1株可高效降解淀粉的菌株筛选与作用效果研究[J].河南农业科学,2018,47(1):150-154.
[25]张慧娟,刘月月,罗永康,等.鲢鱼加工副产物的酶解产物对益生菌生长特性的影响[J].中国农业大学学报,2023,28(4):147-158.
[26]见玉文.镇巴腊肉源乳酸乳球菌益生特性及全基因组分析研究[D].汉中:陕西理工大学,2024.
[27]何航,周月珺,赵智远,等.泡菜盐水中植物乳杆菌的分离鉴定及发酵性能研究[J/OL].重庆工商大学学报(自然科学版),1-9[2025-06-04].http://kns.cnki.net/kcms/detail/50.1155.N.20240305.1708.003.html.
[28]雷昌贵,孟宇竹,陈锦屏,等.自然发酵五彩椒中具有益生特性乳酸菌的筛选及鉴定[J].中国酿造,2023,42(4):168-174.
[29]韦庆旭,张建鹏,梁煜晨,等.青贮用乳酸菌的分离鉴定及生物学特性评价[J].动物营养学报,2022,34(7):4737-4749.
[30]秦双霞,赵玲艳,邓放明.发酵辣椒乳酸菌混合发酵菌群的构建[J].中国酿造,2024,43(7):117-125.
[31]TAMIME A Y,ROBINSON R K.Yoghurt:Science and technology[J].Yoghurt Sci Tech,1985,14(1):83-108.