近年来,茶多糖(tea polysaccharides,TP)以其安全性及免疫调节活性而备受关注。研究发现,茯砖茶多糖可通过影响肠道微生物的丰度从而影响机体的免疫调节功能[1];六堡茶多糖可通过增强细胞的吞噬能力及一氧化氮(nitric oxide,NO)释放量,激活核因子κ-B细胞(nuclear factor kappa-B,NF-κ-B)信号通路和腺苷酸活化蛋白激酶(adenosine 5'-monophosphate-activated protein kinase,AMPK)信号通路,发挥其免疫调节功能[2];普洱熟茶中富含茶多糖,同样在增强免疫[3]、调节代谢[4-5]以及抗肿瘤[6]等多个领域表现出显著的生物学功效活性。其中,蒋成砚等[3]研究发现,普洱茶多糖能提高小鼠淋巴细胞转化率和E花环形成率发挥其增强免疫功效。
儿茶素(catechins,CA),作为茶叶中多酚类化合物的主体成分,约占茶多酚总量的80%[7],作为一种强效抗氧化剂,儿茶素在免疫调节方面有着重大作用。研究表明,儿茶素能通过清除自由基(如超氧离子清除率高达90%以上)和增强抗氧化酶活性,保护免疫细胞免受氧化损伤[8];GANESHPURKAR A等[9]研究发现,儿茶素具有通过细胞和体液机制调节免疫活性的潜力。此外,ZHAO Z J等[10]研究发现,没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)等儿茶素的抑制炎症和增强免疫系统的功能,主要体现在对T细胞的调控作用上。
普洱茶多糖单独调节免疫的功效及相关作用机制已经有较多研究报道及应用,但现代饮食追求配方设计的持续创新,2023年12月1日,国家卫生健康委员会正式将儿茶素列为新食品原料,引起业界开发热潮。本研究以Cy诱导的免疫抑制小鼠为研究对象,采用酶联免疫吸附测定(enzymelinked immunosorbent assay,ELISA)、苏木精-伊红(hematoxylin-eosin,HE)染色组织切片等方法初步探究普洱茶多糖与儿茶素(Pu-erh tea polysaccharides and catechins,TPC)复合物对免疫抑制小鼠免疫指标及代谢物组成的影响。采用正交偏最小二乘判别分析(orthogonal partial least squaresdiscriminant analysis,OPLS-DA)构建模型,利用变量投影重要性(variable importance in the projection,VIP)值及方差分析P值筛选关键差异代谢物,并进行京都基因与基因组百科全书(KyotoEncyclopedia of Genes and Genomes,KEGG)代谢通路分析。旨在添加儿茶素对普洱茶多糖食品进行营养强化以提高其生物活性,以期为茶类功能性成分在食品和健康产品中的开发和广泛应用提供重要参考。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物
无特定病原体(specific pathogen free,SPF)级BALB/c雌性小鼠130 只(5 周龄)购于湖南斯莱克景达试验动物有限公司,产品许可证编号SCXK(湘)2019-0004。所有动物实验均经湖南农业大学生物医学研究伦理委员会批准[批准号:伦审科2025第(10)号]。饲养环境条件温度为(24±2)℃,相对湿度为45%~55%,12 h光暗循环。
1.1.2 试剂
普洱茶多糖(纯度73.81%)、儿茶素(纯度90.05%):湖南艾嘉生物科技有限公司;环磷酰胺(cyclophosphamide,Cy)(no.PHR1404):Sigma-Aldrich(上海)有限公司;盐酸左旋咪唑(levamisole hydrochloride,LH):山东仁和堂药业有限公司;白介素-6(interleukin-6,IL-6)、干扰素-γ(interferon-γ,IFN-γ)、免疫球蛋白G(immunoglobulin-G,IgG)、免疫球蛋白M(immunoglobulin-M,IgM)酶联免疫吸附测定(ELISA)试剂盒:武汉华美生物工程有限公司。
1.2 仪器与设备
BSA323S型电子天平:瑞士Startorius公司;D3024R型台式高速冷冻离心机:北京大龙兴创实验仪器股份公司;MDF-86V6408型超低温冰箱:安徽中科都菱商用电器股份有限公司;MX-F型涡旋混合器:武汉赛维尔生物科技有限公司;Epoch酶标检测仪:美国BioTeK公司;高效液相色谱-四级杆飞行时间串联高分辨质谱联用(high performance liquid chromatography-quadrupole time-of-flight tandem mass spectrometry,HPLC-Q-TOF-MS/MS)仪:美国Agilent Technologies公司。
1.3 方法
1.3.1 普洱茶多糖调节免疫的最佳剂量筛选
适应性喂养一周后,将66只BALB/c雌性小鼠随机分为正常对照组(CK)、模型对照组(MD)、阳性对照组(LH)、低剂量普洱茶多糖组(LP)、中剂量普洱茶多糖组(MP)和高剂量普洱茶多糖组(HP),每组11 只。第8天开始,除正常对照组腹腔注射生理盐水[80 mg/(kg·d)]外,其余各组均腹腔注射环磷酰胺[80 mg/(kg·d)],进行为期3 d的造模。随后10 d,CK组和MD组灌胃纯水,LP组、MP和HP组分别灌胃普洱茶多糖(TP)100 mg/(kg·d)、200 mg/(kg·d)、和400mg/(kg·d),同时,LH组灌胃盐酸左旋咪唑[30mg/(kg·d)],其中LH添加量根据说明书中成人每日推荐剂量(2.5 mg/kg)进行人与小鼠间12.3的等效剂量系数换算而来。第14天用戊巴比妥钠水溶剂麻醉后处死小鼠。取血、胸腺、脾脏组织作进一步分析,选出调节免疫效果最佳的普洱茶多糖剂量。
1.3.2 普洱茶多糖与儿茶素复合物制备
确定调节免疫效果最佳的普洱茶多糖剂量后,将普洱茶多糖与儿茶素按质量比20∶3充分混匀得到普洱茶多糖与儿茶素复合物。其中,普洱茶多糖添加量(400 mg/kg)是根据剂量筛选实验得出,儿茶素添加量(60 mg/kg)根据《新食品原料安全性审查管理办法》(2023年10月版)中成人每日推荐剂量(300 mg/60 kg)进行人与小鼠间12.3的等效剂量系数换算而来。
1.3.3 普洱茶多糖与儿茶素复合物调节免疫实验
适应性喂养一周后,将60只BALB/c雌性小鼠随机分为正常对照组(CK)、模型对照组(MD)、普洱茶多糖组(TP),普洱茶多糖与儿茶素(TPC)复合物组和阳性对照组(LH)5 组,每组12 只。第8天开始,除正常对照组腹腔注射生理盐水[80 mg/(kg·d)]外,其余各组均腹腔注射环磷酰胺[80 mg/(kg·d)],进行为期3 d的造模。随后10 d,CK组和MD组灌胃纯水,TP组灌胃TP[400 mg/(kg·d)],TPC组灌胃TP[400 mg/(kg·d)]和CA[60 mg/(kg·d)],同时,LH组灌胃盐酸左旋咪唑[30 mg/(kg·d)]。第14天用戊巴比妥钠水溶剂麻醉后处死小鼠。取血、胸腺、脾脏作进一步分析。
1.3.4 分析检测
(1)脾脏、胸腺指数
对采集的胸腺和脾脏进行准确称质量,器官指数=器官质量(mg)/体质量(g)。
(2)血清生化指标
取各处理组小鼠血清,按照ELISA试剂盒说明书,检测小鼠血清中IL-6、IFN-γ、IgG和IgM水平。
(3)脾脏苏木精-伊红染色组织切片
取各处理组小鼠脾脏组织用4%多聚甲醛固定液固定,制成石蜡切片,采用苏木精-伊红(HE)染色方法,光镜下观察脾脏组织病理变化,并用扫描方法采集图像。
(4)血清代谢物分析
对各组小鼠血清代谢物进行非靶向代谢组学分析,采用超高效液相色谱-四级杆飞行时间串联高分辨质谱联用(HPLC-Q-TOF-MS/MS)仪检测血清代谢物。色谱条件:ACQUIY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);柱温25 ℃;流速0.5 mL/min;进样量2 μL;流动相A、B分别为水+25 mmol/L乙酸铵+25 mmol/L氨水和乙腈。质谱条件:喷雾气压60 psi;辅助气压60 psi;气帘气压30 psi;离子源温度600 ℃;离子源电压±5 500 V(正、负离子双模式);碰撞能量(35±15)eV。
原始数据经转换格式后,采用XCMS程序进行峰对齐、保留时间校正和提取峰面积。对于XCMS提取得到的数据进行代谢物结构鉴定、数据预处理后再通过(https://www.omicsmart.com/)网站对数据进行通路分析、单变量和多变量统计分析。
1.3.5 数据统计与分析
使用Excel 2019工作表进行数据处理,GraphPad Prism 9.0软件进行统计分析并作图,实验数据均以“平均值±标准差”表示。各组间数据比较采用单因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 普洱茶多糖调节免疫的最佳剂量筛选实验
2.1.1 不同剂量普洱茶多糖对Cy诱导免疫抑制小鼠器官指数的影响
由图1A与图1B可知,与CK相比,Cy处理使小鼠脾脏指数极显著增加(P<0.01),胸腺指数极显著降低(P<0.01),表示建模成功。与MD相比,LH、LP、MP、HP组脾脏指数均极显著降低(P<0.01);除LP外,LH、MP和HP的胸腺指数均极显著上升(P<0.01),其中HP的效果最佳。
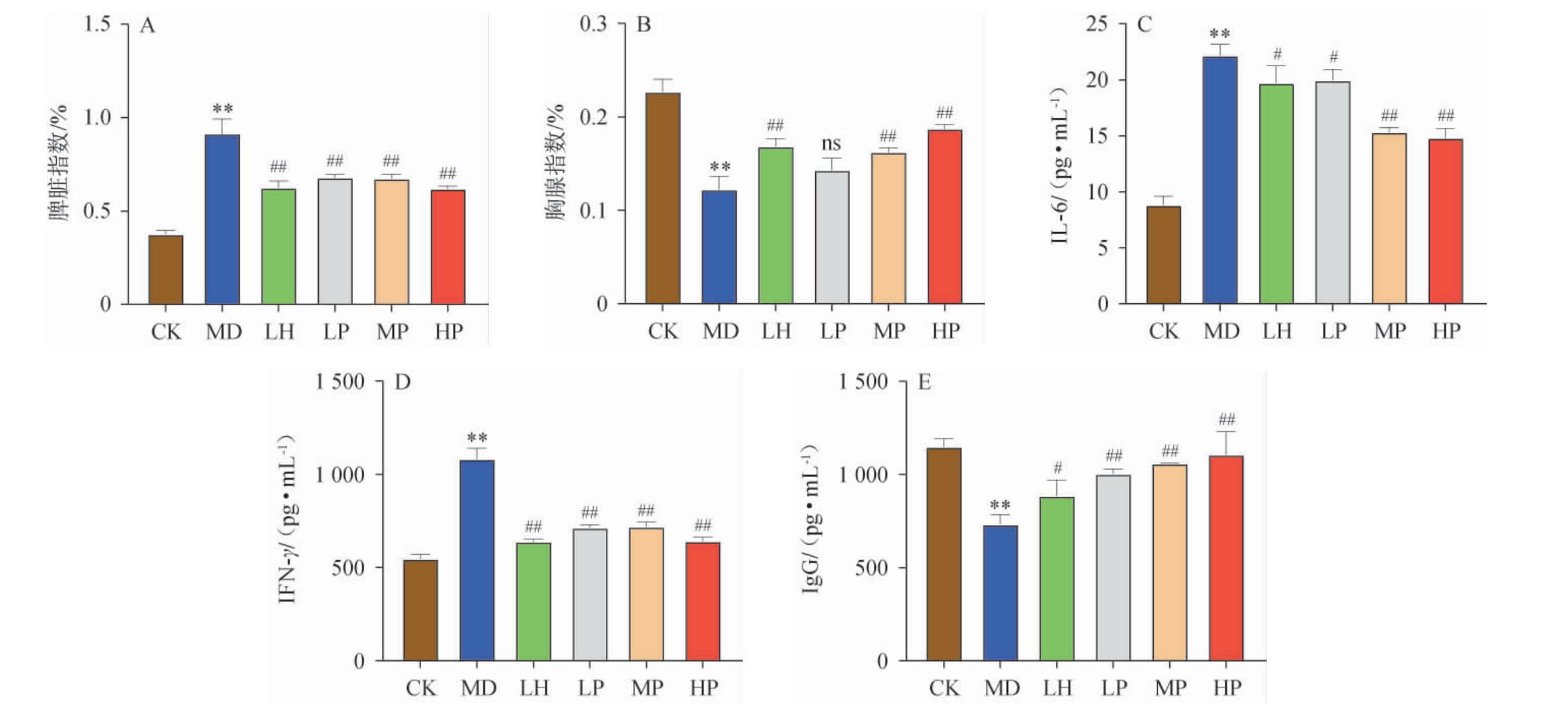
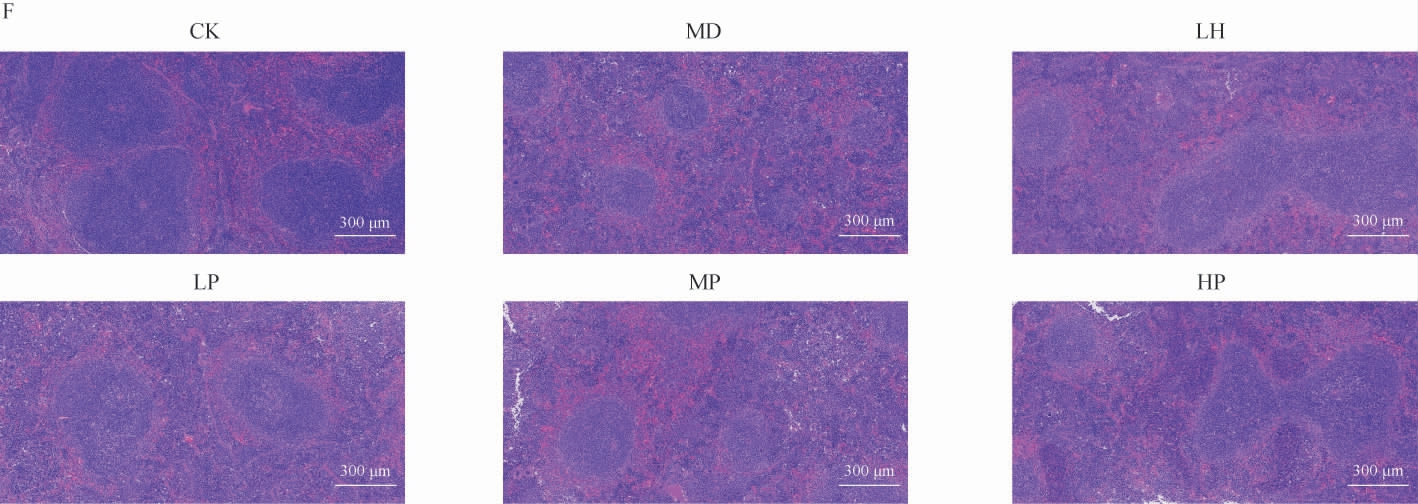
图1 普洱茶多糖调节免疫的最佳剂量筛选实验结果
Fig.1 Test results of the optimal dose of Pu-erh tea polysaccharide for regulating immunity
A:脾脏指数;B:胸腺指数;C:IL-6水平;D:IFN-γ水平;E:IgG水平;F:脾脏HE。与CK组比较,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01);与MD组比较,“#”表示差异显著(P<0.05),“##”表示差异极显著(P<0.01)。下同。
2.1.2 不同剂量普洱茶多糖对Cy诱导免疫抑制小鼠血清指标的影响
通过检测各组小鼠血清中的免疫因子变化,筛选调节免疫作用最佳的TP剂量。由图1C、1D及1E可知,与CK相比,Cy处理后血清中细胞因子IL-6与IFN-γ极显著上升(P<0.01),免疫球蛋白IgG极显著下降(P<0.01),表示建模成功。与MD比较,LH与LP的IL-6水平显著降低(P<0.05),MP与HP的IL-6水平极显著降低(P<0.01);LH、LP、MP与HP的IFN-γ水平均极显著降低(P<0.01);LH的免疫球蛋白IgG显著上升(P<0.05),而LP、MP和HP的免疫球蛋白IgG极显著上升(P<0.01),其中HP的效果最佳。
2.1.3 不同剂量普洱茶多糖对Cy诱导免疫抑制小鼠脾脏组织学的影响
脾脏是机体内重要的免疫器官,通过观察脾脏的组织学结构可评估小鼠的免疫状态。由图1F可知,正常对照组脾脏白髓体积大数量多,红白髓边界明显。模型对照组白髓体积小数量少,红白髓边界不明显。而经LP、MP、HP干预后白髓体积有所增加,且红白髓边界较模型对照组而且更明显。说明各剂量的TP都可以一定程度上恢复Cy对小鼠造成的免疫损伤,且LP与HP效果较好。
综合器官指数、血清中因子水平变化脾脏组织学结果发现,HP的免疫调节效果最佳,因此,选用高剂量的TP与儿茶素组合成复合物TPC进行研究。
2.2 普洱茶多糖与儿茶素复合物调节免疫实验
2.2.1 TPC复合物对Cy诱导免疫抑制小鼠器官指数的影响
由图2A与图2B可知,与CK相比,Cy处理使小鼠脾脏指数极显著增加(P<0.01),胸腺指数极显著降低(P<0.01),表示建模成功。与MD比较,LH、TP与TPC的脾脏指数均极显著下降(P<0.01);胸腺指数均极显著增加(P<0.01),且TPC效果略优于TP。
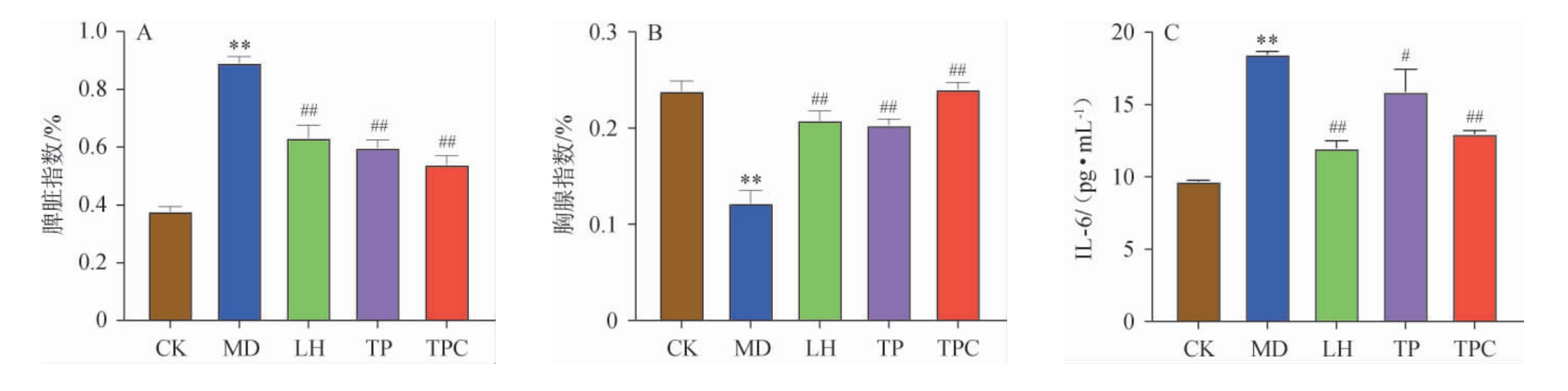

图2 普洱茶多糖与儿茶素复合物调节免疫实验结果
Fig.2 Test results of Pu-erh tea polysaccharide and catechins compound for regulating immunity
A:脾脏指数;B:胸腺指数;C:IL-6水平;D:IFN-γ水平;E:IgG水平;F:IgM水平;G:脾脏HE。
2.2.2 TPC复合物对Cy诱导免疫抑制小鼠血清指标的影响
由图2C~2F可知,Cy处理后血清中免疫因子IL-6与IFN-γ极显著上升(P<0.01),免疫球蛋白IgG、IgM极显著下降(P<0.01),表示建模成功。与MD比较,LH与TPC的IL-6水平极显著降低(P<0.01),TP组IL-6水平显著降低(P<0.05);LH与TP的IFN-γ水平极显著下降(P<0.01),TPC的水平显著下降(P<0.05);LH与TP组的IgG显著上升(P<0.05),TPC组的IgG极显著上升(P<0.01);TP与TPC组的IgM水平显著上升(P<0.05),LH的IgM水平极显著上升(P<0.01)。综合而言,除INF-γ水平外,其余免疫因子均显示TPC的效果略优于TP。
2.2.3 TPC复合物对Cy诱导免疫抑制小鼠脾脏组织学的影响
由图2G可知,正常对照组脾脏白髓体积大数量多,红白髓边界明显。模型对照组白髓体积小数量少,红白髓边界不明显。而经TP、TPC干预后白髓体积有所增加,红白髓边界较模型对照组更明显,且TPC组白髓体积与数量略优于TP组。说明TP与TPC都可以一定程度上恢复Cy对小鼠造成的免疫损伤,且TPC的效果更好。
综合器官指数、血清中因子水平变化脾脏组织学结果发现,TPC的免疫调节效果较TP而言更佳,因此推测儿茶素的添加强化了普洱茶多糖的调节免疫功效。
2.2.4 TPC复合物对Cy诱导免疫抑制小鼠代谢物组成的影响
为深入探究TPC复合物对Cy诱导免疫抑制小鼠代谢物组成的影响,采用HPLC-Q-TOF-MS/MS检测各处理组代谢物,并对结果进行正交偏最小二乘-判别分析(OPLS-DA),以VIP≥1.0,且P<0.05为标准筛选关键差异代谢物,MD与TPC关键差异代谢物的火山图及聚类分析结果见图3。由图3A和图3B可知,OPLS-DA能够明显区分各组样品。由图3C可知,MD组与TPC组间共筛选出130种关键差异代谢物,其中有43 种关键差异代谢物在TPC组中显著上调(P<0.05),有87 种关键差异代谢物在TPC组中显著下调(P<0.05)。
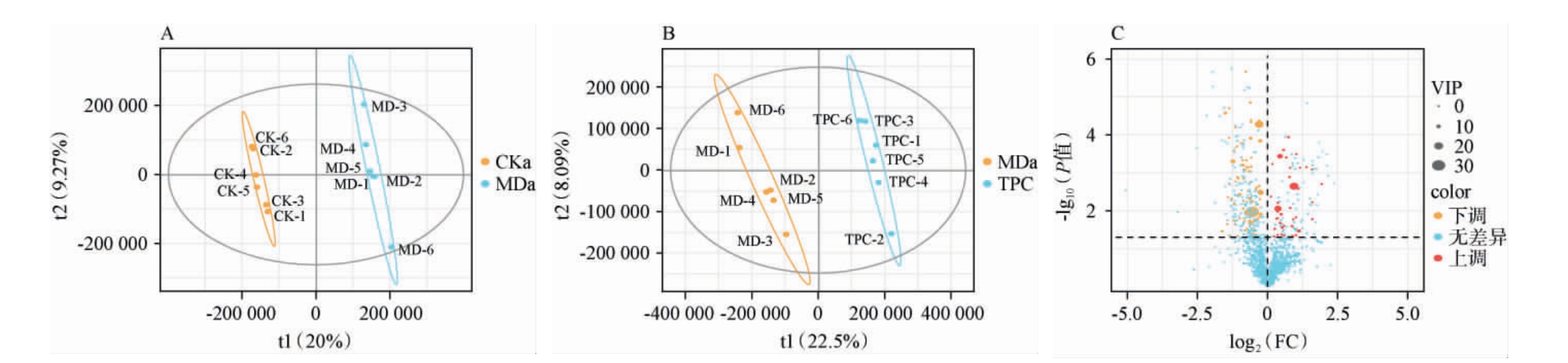
图3 关键差异代谢物正交偏最小二乘-判别分析得分图(A、B)及火山图(C)
Fig.3 Score plots of orthogonal partial least squares-discriminant analysis (A, B) and volcano plots (C) of key differential metabolites
A:CK与MD组OPLS-DA;B:MD与TPC组OPLS-DA;C:MD与TPC组差异代谢物火山图。
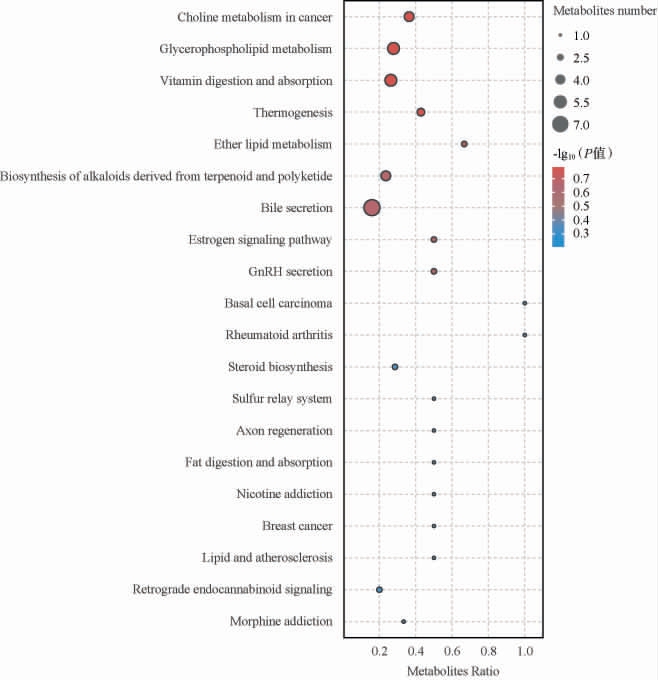
图4 MD与TPC组显著差异关键代谢物代谢通路气泡图
Fig.4 Bubble map of key differential metabolites with significant difference between MD and TPC groups
为了能够系统、全面了解普洱茶多糖与儿茶素对小鼠代谢影响的生物学变化,进一步对差异代谢物进行代谢通路富集分析,对显著富集的通路绘制气泡图见图5。由图5可知,MD组与TPC组之间的差异代谢物涉及了多条通路,在涉及的所有通路中,P<0.05的通路有9个,分别是胆碱在癌症中的代谢(Choline metabolism in cancer)、甘油磷脂代谢(Glycerophospholipid metabolism)、维生素消化与吸收(Vitamin digestion and absorption)、产热(Thermogenesis)、醚脂代谢(Ether lipid metabolism)、萜类/聚酮类生物碱的生物合成(Biosynthesis of alkaloids derived from terpenoid and polyketide)、胆汁分泌(Bile secretion)、雌激素信号通路(Estrogen signaling pathway)和GnRH分泌(GnRH secretion)。其中,代谢物富集且与免疫相关的途径有:胆碱在癌症中的代谢(Choline metabolism in cancer)和维生素的消化与吸收(Vitamin dgestion and absorption)等。
3 讨论
环磷酰胺(Cy)是一种免疫抑制剂,广泛运用于抗癌药物领域。然而Cy有很强的副作用,它会破坏DNA结构,干扰B细胞和T细胞的分化,从而降低机体的免疫力[11]。此外它还会引起肠粘膜炎症,造成肠道微生物失衡[12]。因此,Cy常被用于建立小鼠免疫抑制模型[13]。本研究以Cy诱导的免疫低下小鼠为研究对象,先对其进行低、中、高三个剂量普洱茶多糖的灌胃,经过脾脏、胸腺脏器指数,脾脏HE染色切片和血清中免疫相关因子水平的研究,筛选出其调节免疫的最佳剂量,再进行普洱茶多糖儿茶素复合物(TPC)的灌胃,对比正常对照组、模型对照组、阳性对照组组和普洱茶多糖组,从小鼠组织和血清中免疫因子2个方面的变化,研究TPC的调节免疫作用,再结合血清代谢组,探讨TPC对小鼠的调节免疫作用。
脾脏与胸腺是常见的机体免疫器官,脾脏作为外周免疫器官,为成熟免疫细胞提供了对免疫刺激做出反应的场所[14]。而胸腺是免疫细胞分裂、分化和成熟的地方[15]。因此,脾脏和胸腺指数是反映免疫能力的原始指标。本研究小鼠经过Cy腹腔注射处理后,脾脏指数显著上升,胸腺指数显著下降,免疫器官显著受损。在经过各剂量TP处理后,发现LP、MP、HP各组均能增强小鼠免疫器官指数,且HP组效果略好。另外,通过对脾脏的HE切片进一步研究发现,各剂量TP都能一定程度上恢复Cy造成的白髓损伤,红白髓边界不明显的现象。表明TP可以一定程度上恢复Cy造成的免疫器官损伤,且高剂量的效果最好。
细胞因子具有多种生物学功能,包括调节细胞生长、分化和免疫反应[16]。IL-6是一种细胞炎症因子,可以通过刺激B淋巴细胞成熟和免疫球蛋白的产生来调节免疫[17]。IFN-γ是一类糖蛋白,参与细胞介导的免疫反应,通过加工和提呈抗原、上调病原体识别、参与白细胞运输、抑制细胞增殖和凋亡[18-20]。实验结果显示,经Cy腹腔注射处理后,小鼠血清中的IL-6与IFN-γ水平显著异常,而与MD组相比,各剂量的TP可以一定程度上改善Cy诱导的免疫抑制小鼠中IL-6与IFN-γ水平,从而调节机体免疫,且高剂量的TP效果最好。
IgG和IgM是血清中较为常见的免疫球蛋白,其中IgG是血清的主要抗体成分,约占免疫球蛋白的75%,可用来治疗B细胞淋巴细胞增生性综合征[21];IgM是个体发育过程中最早合成和分泌的抗体,约占血清免疫球蛋白总量的5%~10%,是初次体液免疫应答中最早出现的抗体[22]。在实验过程中,发现小鼠经过Cy腹腔注射处理后,IgG水平显著下降。在经过各剂量TP处理后,IgG水平显著上升。通过上述实验发现各剂量的TP对Cy造成的小鼠免疫损伤有恢复作用,且高剂量的TP效果较为突出。因此,结合免疫组织的分析结果,选用高剂量普洱茶多糖与儿茶素复合物进行其免疫调节及机理研究。
研究结果表明,在经过TPC干预后,对比MD组,脾脏指数显著下降,胸腺指数显著上升,IL-6与IFN-γ水平显著下降,IgG与IgM水平显著上升,脾脏HE切片表明TPC组可以恢复Cy造成的白髓损伤,红白髓边界不明显的现象,且除INF-γ水平外,TPC组的其余免疫指标均略优于TP组,由此推测,添加CA可以强化TP的调节免疫作用。
血清作为体内多种营养物质和免疫细胞的活动场所,其中时刻发生着物质交换、信号识别与各种各样的免疫现象,是免疫发生的一大重要战场[23]。因此,在研究中进行血清代谢组分析,有助于了解小鼠体内正在进行中或者以后可能会发生的现象。研究结果发现,各组间的代谢物差异较为显著,且在差异代谢物筛选中,与MD组相比,TPC组有130 种差异代谢物发生显著变化。经过KEGG富集分析发现,这些化合物还涉及了多种代谢途径,包括胆碱在癌症中的代谢(Choline metabolism in cancer)、维生素的消化与吸收(Vitamin dgestion and absorption)等。其中,磷酸胆碱(Phosphorylcholine)作为胆碱代谢中的关键代谢物,是癌细胞生长的必需成分,与免疫调节息息相关[24];吡哆胺(Pyridoxamine)作为维生素B6的一种形式,与维生素的消化与吸收有关,过往研究表明吡哆胺有着抗炎的功效[25],而炎症与免疫相互关联,是免疫系统对病原体或损伤的一种防御反应。由此猜测,TPC可能通过胆碱在癌症中的代谢和维生素的消化与吸收等代谢途径参与机体的免疫调节。
4 结论
本研究通过对环磷酰胺诱导的免疫抑制小鼠进行酶联免疫吸附测定(ELISA)、脾脏苏木精-伊红(HE)染色切片等方法检测其免疫指标,筛选出调节免疫效果最佳的高剂量普洱茶多糖后,探究TPC复合物对免疫抑制小鼠免疫指标及代谢物组成的影响。通过OPLS-DA能明显区分CK、MD与TPC组间代谢物。以VIP≥1和P<0.05为标准,在MD与TPC组间共筛选出130种关键差异代谢物。KEGG富集分析发现,磷酸胆碱和吡哆胺分别与胆碱在癌症中的代谢和维生素消化与吸收等代谢途径有关。结果表明,TPC可通过调节血清中免疫因子与代谢物来进行小鼠的免疫调节功能。本研究从器官组织、血清免疫因子与血清代谢三个维度,揭示该复合物发挥免疫调节功能的科学机制,为普洱茶多糖功能性食品开发提供了重要理论依据。
[1]BAI Y X, ZENG Z Q, XIE Z Y, et al.Effects of polysaccharides from Fuzhuan brick tea on immune function and gut microbiota of cyclophosphamide-treated mice[J].J Nutr Biochem,2022,101:108947.
[2]孙仪征,王慧琴,李贝贝.六堡砖茶多糖制备及其免疫调节活性[J].食品工业科技,2024,45(14):327-334.
[3]蒋成砚,谢昆,薛春丽,等.普洱茶多糖增强免疫功能研究[J].江苏农业科学,2012,40(1):257-258.
[4]藏传刚,任珊,刘宇超,等.玉米须多糖与普洱茶多糖降血糖、降血脂作用研究[J].中国医学创新,2021,18(16):29-34.
[5]许凌凌,程旺开,周小楠.普洱茶多糖对健康小鼠短链脂肪酸代谢与肠道菌群组成的调节作用[J].食品与发酵工业,2021,47(21):115-122.
[6]吴以龙,税再坤,王燕,等.普洱茶多糖不同纯化组分的理化性质与体外抗氧化、抗肿瘤活性关系分析[J].食品工业科技,2025,46(12):1-10.
[7]邓洪燕,毛静春,毛建富,等.普洱茶中儿茶素研究进展[J].农学学报,2024,14(1):83-89.
[8]YANG C S, WANG X, LU G, et al.Cancer prevention by tea: animal studies,molecular mechanisms and human relevance[J].Nat Rev Cancer,2009,9(6):429-439.
[9]GANESHPURKAR A, SALUJA A K.Protective effect of catechin on humoral and cell mediated immunity in rat model[J].Int Immunopharmacol,2018,54:261-266.
[10]ZHAO Z J,FENG M Y,WAN J,et al.Research progress of epigallocatechin-3-gallate(EGCG)on anti-pathogenic microbes and immune regulation activities[J].Food Funct,2021,12(20):9607-9619.
[11]ALI M,ULLAH H,FAROOQUI N A,et al.NF-κB pathway activation by Octopus peptide hydrolysate ameliorates gut dysbiosis and enhances immune response in cyclophosphamide-induced mice[J].Heliyon,2024,10(19):e38370.
[12]KIM H,HONG J Y,LEE J,et al.Immune-boosting effect of Yookgongdan against cyclophosphamide-induced immunosuppression in mice[J].Heliyon,2024,10(2):e24033.
[13]LEE H Y, PARK Y M, SHIN D Y, et al.Immune-enhancing effect of fermented soybean food, Cheonggukjang on cyclophosphamide-treated immunosuppressed rat[J].Heliyon,2024,10(18):e37845.
[14]HUANG J,HUANG J L,LI Y,et al.Sodium alginate modulates immunity,intestinal mucosal barrier function, and gut microbiota in cyclophosphamide-induced immunosuppressed balb/c mice[J].J Agr Food Chem,2021,69(25):7064-7073.
[15]XU D H,XIE H Y,LI Y L,et al.Phyllanthus emblica polysaccharide(PEP)attenuates cyclophosphamide-induced immunosuppression through microbiota-dependent or-independent regulation of immune responses[J].J Funct Foods,2024,114(3):106065.
[16]SHAO Z Z, LI X L, ZHU H G, et al.Ovalbumin-digested peptides can reverse cyclophosphamide-induced immune dysfunction in mice[J].Food Biosci,2024,58(4):103642.
[17]LI J R,TAO W Y,ZHOU W Y,et al.Dendrobium officinale leaf polysaccharide has a dual effect of alleviating the syndromes of immunosuppressed mice and modulating immune system of normal mice[J].J Funct Foods,2024,113:105974.
[18]HU X Y,IVASHKIV L B.Cross-regulation of signaling pathways by interferon-γ: implications for immune responses and autoimmune diseases[J].Immunity,2009,31(4):539-550.
[19]DUNN G P,IKEDA H,BRUCE A T,et al.Interferon-gamma and cancer immunoediting[J].Immunol Res,2005,32(1-3):231-245.
[20]SCHRODER K,HERTZOG P J,RAVASI T,et al.Interferon-gamma:an overview of signals,mechanisms and functions[J].J Leukoc Biol,2004,75(2):163-189.
[21]ZHU Z P, LUO Y R, LIN L T, et al.Modulating effects of turmeric polysaccharides on immune response and gut microbiota in cyclophosphamide-treated mice[J].J Agr Food Chem,2024,72(7):3469-3482.
[22]KEYT B A,BALIGA R,SINCLAIR A M,et al.Structure,function,and therapeutic use of IgM antibodies[J].Antibodies,2020,9(4):53.
[23]BAUERMEISTER A, MANNOCHIO-RUSSO H, COSTALOTUFO L V,et al.Mass spectrometry-based metabolomics in microbiome investigations[J].Nat Rev Microbiol,2022,20(3):143-160.
[24]MOENS L,PICARD C,SHAHROOEI M,et al.Different immunological pathways underlie the immune response to pneumococcal polysaccharides[J].J Clin Immunol,2017,37(3):277-278.
[25]张欣.吡哆胺和辛伐他汀对糖尿病大鼠神经病理性疼痛及全身性炎症的影响[D].北京:北京协和医学院,2019.