酱香型白酒是中国传统的香型白酒之一,由于特殊的酿造工艺,大曲和糟醅中逐渐形成了独特的微生物群落,其中酱香大曲内的微生物对酱香风味的形成起到至关重要的作用[1]。酱香大曲是一种以生料制成的细菌曲,在制作过程中网罗富集了众多产香微生物,再经高温发酵,优化、筛选微生物结构[2-3]。细菌则是酱香大曲中研究最多也是最重要的微生物菌群,其能代谢多种酶,产生多种风味成分及其前体,使得酱香型白酒具有独特的酒体风格[4]。
近年来,随着酱香型白酒行业的发展,众多学者对产酱香细菌的筛选和应用展开了积极的探索。张倩等[5-6]分别从酱香大曲中分离和筛选出3株产酱香芽孢杆菌(Bacillus sp.),分别为地衣芽孢杆菌(Bacillus licheniformis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis);王小平[7]从酱香型大曲中分离得到3株产酱香明显的地衣芽孢杆菌,其液态发酵产物中的挥发性风味成分主要有4-乙基愈创木酚、2,3,5,6-四甲基吡嗪、乙偶姻等;张小龙等[8]从酱香大曲中分离得到2株解淀粉芽孢杆菌,采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)结合气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)分析其发酵产物,发现吡嗪类物质的含量最高,并含有2-戊基呋喃、庚醇、苯甲醛等多种挥发性风味成分。何猛超等[9]使用解淀粉芽孢杆菌制作强化曲,结果表明,添加菌液的强化曲在理化指标、微生物指标、挥发性风味成分方面都优于未添加菌液的对照曲;何琪等[10]在大曲物料中以不同添加方式添加解淀粉芽孢杆菌和蜡样芽孢杆菌(Bacillus cereus),结果表明,菌种发酵液有助于提高特级曲比例,提升酱香型大曲的品质。综上,酱香大曲中功能菌筛选鉴定以及强化曲制作方面的研究比较广泛,但大曲功能菌在酿酒生产上的应用研究较少,缺少不同窖池之间应用的对比数据。
本研究采用稀释涂布平板法、产蛋白酶及高温耐受性筛选和模拟固态发酵实验从酱香大曲中分离、筛选产酱香细菌,通过形态学观察、生理生化试验及分子生物学技术对其进行菌种鉴定。应用HS-SPME-GC-MS检测筛选菌株固体发酵产物中的挥发性风味成分,并使用筛选出的产酱香细菌制作成菌剂混合到糟醅中,将其置于不同窖池的上层进行发酵,探究添加产酱香菌株菌剂对不同窖池窖面糟醅与窖面酒造成的影响,为优化酱香型白酒的酿造工艺、提高基酒中风味成分含量提供数据支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 原料酱香大曲、干麦粉:取自贵州钓鱼台国宾酒业有限公司制曲车间。
1.1.2 试剂
蛋白胨、牛肉浸粉、酵母浸粉、琼脂粉(均为生化试剂):北京奥博星生物技术有限责任公司;磷酸二氢钾、氯化钠、丙三醇(均为分析纯)、无水葡萄糖(优级纯):天津科密欧化学试剂有限公司;叔戊醇(色谱纯)、氢氧化钠、福林酚(均为分析纯):上海麦克林生化科技股份有限公司;乙酸正丁酯(色谱纯):贵州省计量测试院;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京天根生化有限公司;革兰氏染色液(快速法):珠海贝索生物技术有限公司;其他试剂均为国产分析纯或生化试剂。
1.1.2 培养基
LB固体培养基[3]:酵母粉5 g,蛋白胨10 g,NaCl 10 g,琼脂粉15 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
种子培养基[5]:酵母粉5 g,蛋白胨10 g,NaCl 10 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
脱脂奶粉培养基[11]:A液(牛肉浸粉3 g,蛋白胨10 g,氯化钠15 g,蒸馏水1 000 mL)与B液(脱脂奶粉30 g,蒸馏水1 000 mL)分别在115 ℃高压蒸汽灭菌25 min,按3∶1(V/V)混匀。
液体发酵培养基[12]:无水葡萄糖10 g,蛋白胨5 g,酵母浸粉5 g,磷酸二氢钾3 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
小麦发酵培养基:选用干麦粉,用筛子分出皮块、沙粒及细粉部分,三者按比例(2∶2∶1)混匀,以5∶2的料水比加水浸泡过夜,沸水蒸40 min,稍待冷却后按5∶1加入蒸馏水,混匀,取50 g装入250 mL三角瓶中,121 ℃高压蒸汽灭菌20 min(灭菌后培养基水分在48%~50%)。
1.2 仪器与设备
LRH-250生化培养箱:天津市宏诺仪器有限公司;SW-CJ超净工作台:济南森亚实验仪器有限公司;UV-1780紫外/可见分光光度计:日本岛津仪器有限公司;BSA2202S-CW电子天平:赛多利斯科学仪器有限公司;LDZM-80L-I立式高压蒸汽灭菌器:上海申安医疗器械厂;TS-2102双层恒温摇床:常州金坛良友仪器有限公司;7890B气相色谱仪、8860-5977B气相色谱-质谱联用仪、50 μm/30 μm DVB/CAR/PDMS固相微萃取头:安捷伦科技有限公司;BX-43生物显微镜:北京奥林巴斯销售服务有限公司;ABI-2720聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Applied Biosystems公司;Mini Pro 300V Power Supply电泳仪:美国Major Science公司。
1.3 方法
1.3.1 细菌的分离纯化
参照王小平等[3]方法,将酱香大曲10 g加入90 mL无菌水中,37 ℃、150 r/min条件下振荡60 min,取上清液,按10倍梯度逐次稀释至10-3~10-6,各吸取100 μL涂布于LB固体培养基上,每个浓度重复3次,在37 ℃条件下倒置培养1~2 d。挑取不同形态的单菌落划线于LB固体培养基平板上,在37 ℃下培养1 d,重复纯化3次得到单菌落,将单菌落保存至甘油管中,置于-80 ℃条件下保藏。
1.3.2 产蛋白酶及耐高温细菌菌株的筛选
产蛋白酶菌株筛选:将分离菌株点接于脱脂奶粉培养基,37 ℃条件下培养1 d,若菌落产生透明圈,则表明该菌株能产生蛋白酶,采用透明直尺测定透明圈直径(D)与菌落直径(d),将D/d值>1.5的菌株定义为高产蛋白酶菌株。
耐高温菌株筛选:将高产蛋白酶菌株分别接种至种子培养基中,37 ℃、150 r/min条件下培养24 h制成种子液,吸取100 μL涂布于LB固体培养基上,50 ℃条件下培养1~2 d后,观察平板上的菌落长势,筛选出耐高温的菌株。
1.3.3 产酱香细菌菌株的筛选
模拟固态发酵:将高产蛋白酶且耐高温的菌株分别接种于种子培养基中,37 ℃、150 r/min条件下培养24 h制成种子液,将种子液按6%的接种量接种于小麦发酵培养基中,使用无菌玻璃棒搅拌,再按照37 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃的顺序进行梯度升温静置培养,每个温度需培养2 d。待培养结束后,通过评审小组(由1名男省级评委、3名男三级品酒师、2名女三级品酒师组成)对培养基的颜色、粘性和香气进行描述,筛选出产酱香风味稳定且香味较好的菌株。
蛋白酶活力测定:将筛选得到的产酱香菌株的种子液按2%的接种量接种于装有50 mL液体发酵培养基的100 mL锥形瓶中,于37 ℃、180 r/min条件下培养3 d后,参照GB/T 23527.1—2023《酶制剂质量要求 第1部分:蛋白酶制剂》中的福林法测定蛋白酶活力。
1.3.4 产酱香细菌菌株的鉴定
形态学观察:将产酱香菌株接种于LB固体培养基平板,37 ℃条件下培养24 h,观察其菌落形态特征。
生理生化实验:参考《伯杰氏细菌鉴定手册》[13]对其生理生化特征进行测定。包括糖发酵试验、产蛋白酶试验、淀粉水解试验、吲哚试验、V.P.试验和柠檬酸盐试验。
分子生物学鉴定:参照史洪丽等[14]的方法,使用细菌基因组DNA提取试剂盒提取菌株的基因组DNA,以其为模板,采用细菌16S rDNA通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')进行PCR扩增,PCR扩增体系(25 μL):引物1492R和27F各1.0μL,Mix12.5μL,DNA模板1.0μL,双蒸水(ddH2O)9.5 μL。PCR扩增程序:94 ℃预变性10 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,共31个循环;72 ℃再延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后委托生工生物工程(上海)股份有限公司进行测序,将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行序列同源性比对,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA 7.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.5 模拟固态发酵产物挥发性风味成分分析[15-16]
HS-SPME条件:称取1 g固态发酵产物加入3 mL饱和NaCl溶液,60 ℃加热15 min,插入50 μm/30 μm DVB/CAR/PDMS固相微萃取头萃取吸附30 min,在GC进样口250 ℃下解吸5 min。
GC条件:DB-WAX毛细管色谱柱(30 m×0.25 mm,0.25 μm);载气为高纯氦气(He),流速为1 mL/min;升温程序为起始温度40 ℃,保持3 min,以5 ℃/min速度升至80 ℃,再以10 ℃/min升至230 ℃/min,保持7 min;不分流进样。
MS条件:电子电离(electron ionization,EI)源,电子倍增器电压350 V,电子能量70 eV,发射电流200 μA,接口温度250 ℃,离子源温度230 ℃。
定性、定量方法:通过美国国家标准技术研究所(national institute of standards and technology,NIST)17.L数据库确定其挥发性化学成分,并采用峰面积归一化法进行相对定量。
1.3.6 产酱香细菌菌株在窖面酒生产中的应用
单一菌种效果有限,易对酿造微生态造成负面影响,所以生产上常使用复合菌液进行发酵[17]。从产酱香细菌菌株中选取4株在固体发酵产物中2,3,5,6-四甲基吡嗪相对含量和蛋白酶活较高的不同种菌株进行生产应用实验。参照卢君等[18]方法使用这4株产酱香菌株制作菌剂,制作完成后进行粉碎并等比例混合,再应用到窖面酒的生产过程中。在同一班组中选择3个窖池作为实验窖池,3个窖池为对照窖池,跟踪生产发酵过程,探究糟醅的理化指标变化和窖面酒挥发性风味成分的差异。具体操作如下:
实验组:糟醅350 kg,曲药50 kg,复合菌剂10 kg,配料酒7.5 kg;
对照组:糟醅350 kg,曲药60 kg,配料酒7.5 kg。
1.3.7 分析方法
糟醅的水分、酸度、还原糖含量分别根据T/CBJ 004—2018《固态发酵酒醅通用分析方法》中的恒温干燥法、中和滴定法、葡萄糖标准溶液反滴定法测定,窖面酒的挥发性风味成分根据GB/T 10345—2022《白酒分析方法》中的气相色谱法测定。
1.3.8 数据处理
通过SPSS 27对数据进行分析处理,利用Origin 2024绘图。
2 结果与分析
2.1 产酱香细菌菌株的筛选
2.1.1 初筛
经稀释涂布平板法从酱香大曲中共分离得到223株细菌,通过产蛋白酶实验筛选出142株高产蛋白酶细菌菌株,再对高产蛋白酶细菌菌株进行耐高温筛选,结果共筛选出95株能在50 ℃条件下生长的高产蛋白酶细菌菌株,部分菌株的实验结果见表1。
表1 部分细菌菌株的产蛋白酶活性及耐高温生长情况
Table 1 Proteinase production activity and high temperature tolerance growth of some bacterial strains
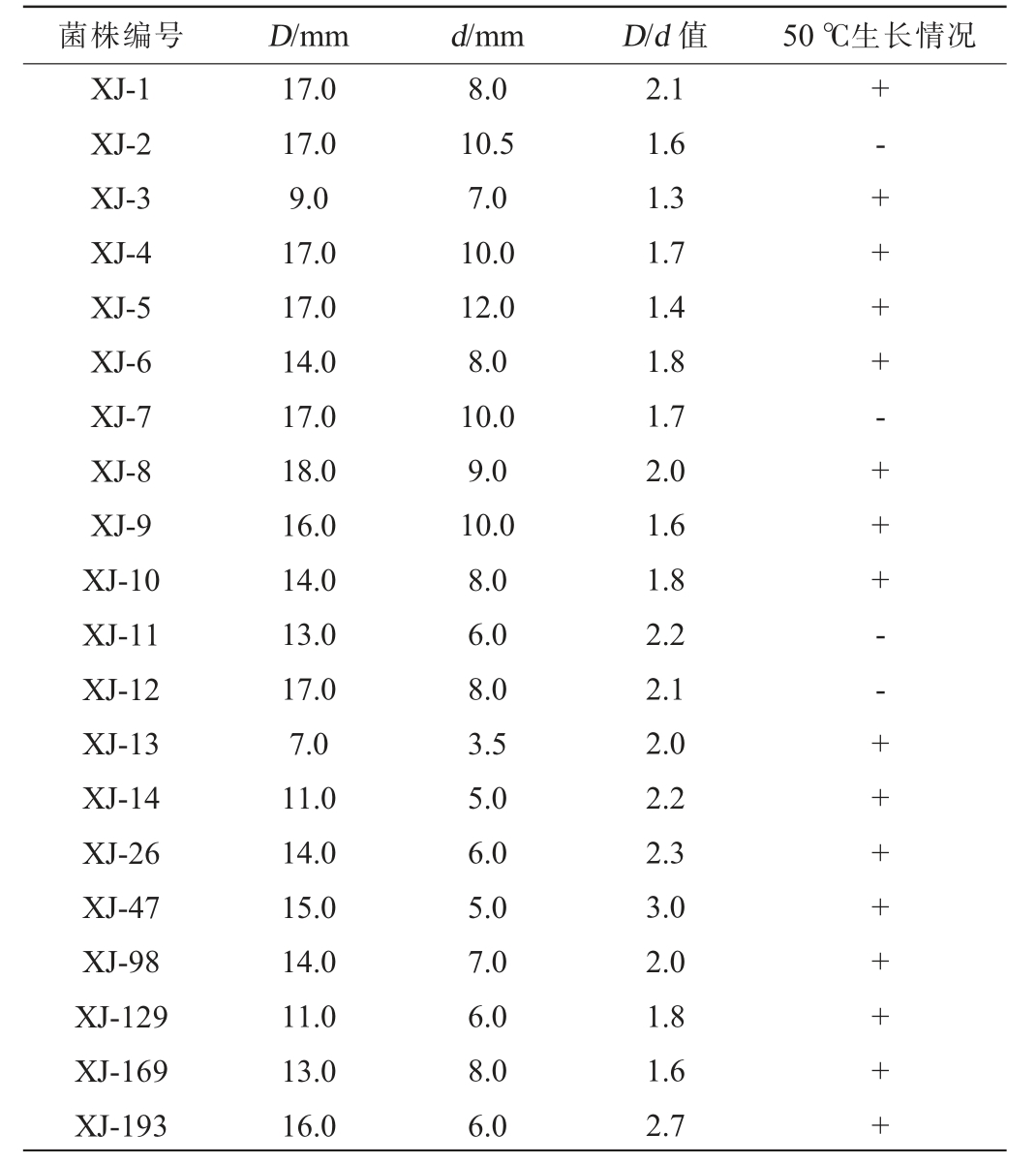
注:“+”表示菌株能在50 ℃生长,“-”表示生长较弱或者是不能生长。
菌株编号 D/mm d/mm D/d 值 50 ℃生长情况XJ-1 XJ-2 XJ-3 XJ-4 XJ-5 XJ-6 XJ-7 XJ-8 XJ-9 XJ-10 XJ-11 XJ-12 XJ-13 XJ-14 XJ-26 XJ-47 XJ-98 XJ-129 XJ-169 XJ-193 17.0 17.0 9.0 17.0 17.0 14.0 17.0 18.0 16.0 14.0 13.0 17.0 7.0 11.0 14.0 15.0 14.0 11.0 13.0 16.0 8.0 10.5 7.0 10.0 12.0 8.0 10.0 9.0 10.0 8.0 6.0 8.0 3.5 5.0 6.0 5.0 7.0 6.0 8.0 6.0 2.1 1.6 1.3 1.7 1.4 1.8 1.7 2.0 1.6 1.8 2.2 2.1 2.0 2.2 2.3 3.0 2.0 1.8 1.6 2.7+-++++-+++--++++++++
结合表1可知,在所分离的细菌菌株中,超过50%的菌株能产蛋白酶。蛋白酶可将酿酒原料中的蛋白质分解为蛋白胨、多肽和氨基酸,氨基酸在白酒中是重要的风味前体物质,也是酱香型白酒呈味丰富、口感饱满主要特征之一[19-20]。
2.1.2 复筛
采用模拟固态发酵实验从高产蛋白酶且耐高温的95株菌株中筛选得到7株产生酱香风味稳定且香味较好菌株,进一步测定其固态发酵产物的蛋白酶活性,具体结果见表2。
表2 产酱香细菌菌株的筛选结果
Table 2 Screening results of bacterial strains producing sauce-flavor

注:“+”表示具有粘性,“++”表示粘性较强。
菌株编号培养基颜色培养基粘性 发酵香味 蛋白酶活力/(U·mL-1)XJ-8 XJ-26 XJ-47 XJ-98 XJ-129 XJ-169 XJ-193深褐色黑褐色深褐色深褐色黑褐色黑褐色深褐色+++++++++++++酱香、甜香酱香、甜香酱香、甜香、焦糖香酱香、烘焙香酱香、焦香酱香、烘焙香、焦香酱香、甜香、曲香85.60±1.68 53.16±0.90 95.05±3.34 40.99±0.75 28.61±1.98 13.67±0.78 46.12±0.70
由表2可知,7株产酱香细菌菌株培养基的颜色为深褐色或黑褐色且具有一定粘性,发酵香味除酱香外,还伴有焦香、甜香、烘焙香、焦香等,其中,菌株XJ-47的蛋白酶活力最高为95.05 U/mL,这为高温发酵过程中发生羰氨反应进而产香和褐变提供了良好的条件。
2.2 产酱香细菌菌株的鉴定
2.2.1 形态学观察
7株产酱香细菌菌株的形态学特征见图1。由图1可知,菌株XJ-8、XJ-26的菌落均呈乳白色、圆形,质地湿润易挑起,菌株XJ-47、XJ-193的菌落均呈白色、柱状,质地粘稠易挑起,菌株XJ-98、XJ-129、XJ-169的菌落均呈橙色、不规则圆形,其中,菌株XJ-98、XJ-169质地湿润,菌株XJ-129质地干燥。7株产酱香细菌菌株均为革兰氏阳性菌,菌体呈杆状。
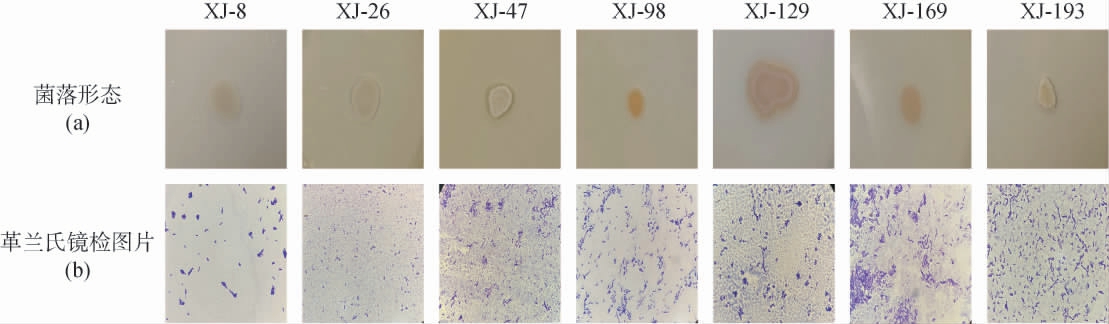
图1 产酱香细菌菌株的菌落形态(a)及革兰氏镜检结果(b)
Fig.1 Colony morphology (a) and Gram staining results (b) of bacteria strains producing sauce-flavor
2.2.2 生理生化实验
7株产酱香细菌菌株的生理生化实验结果见表3。
表3 产酱香细菌菌株的生理生化实验结果
Table 3 Experimental results of physiology and biochemistry of bacteria strains producing sauce-flavor

项目菌株编号XJ-8 XJ-26 XJ-47 XJ-98 XJ-129 XJ-169 XJ-193葡萄糖发酵淀粉水解++++++++++++++
续表
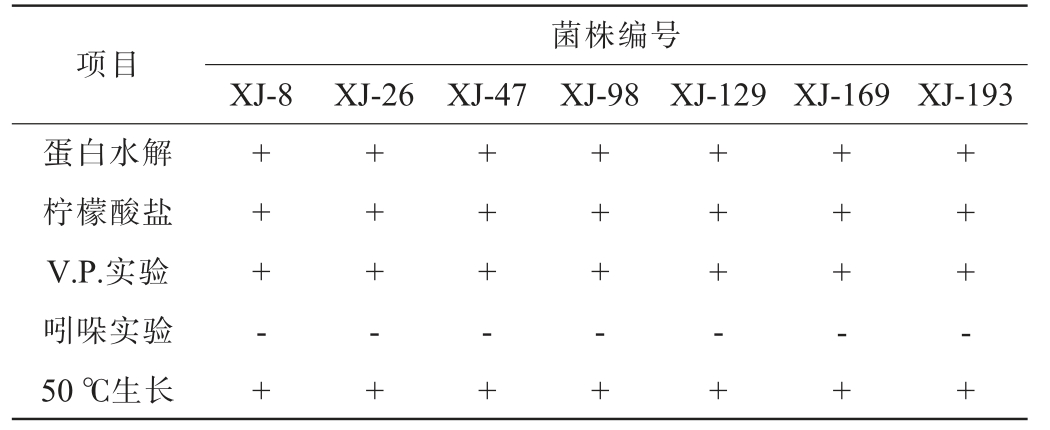
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
项目菌株编号XJ-8 XJ-26 XJ-47 XJ-98 XJ-129 XJ-169 XJ-193蛋白水解柠檬酸盐V.P.实验吲哚实验50 ℃生长+++- ++++- ++++- ++++-++++-+++ + - ++++-+
由表3可知,7株产酱香细菌菌株皆具有分解葡萄糖、淀粉和蛋白质的能力,V.P.实验结果均呈阳性,并均能在50 ℃条件下生长,但都不具有分解吲哚的能力,符合芽孢杆菌(Bacillus sp.)生物学特性[6]。
2.2.3 分子生物学鉴定
基于16S rDNA基因序列构建7株产酱香细菌菌株的系统发育树,结果见图2。
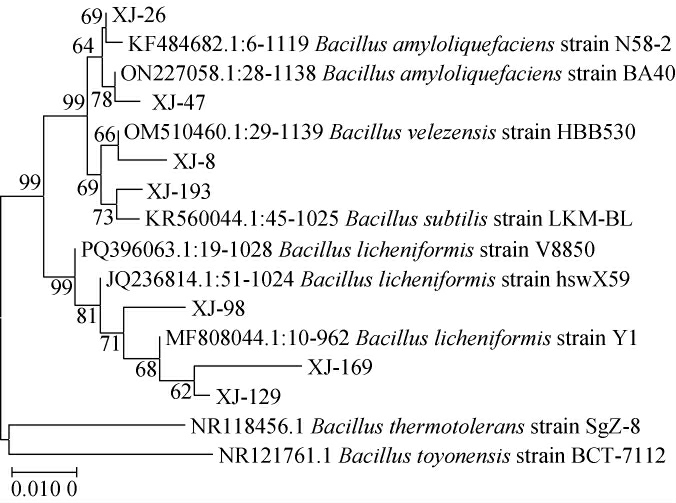
图2 基于16S rDNA基因序列产酱香细菌菌株的系统发育树
Fig.2 Phylogenetic tree of bacteria strains producing sauce-flavor based on 16S rDNA gene sequence
由图2可知,菌株XJ-98、XJ-129、XJ-169均与地衣芽孢杆菌(Bacillus licheniformis)亲缘关系最近,菌株XJ-26、XJ-47均与解淀粉芽孢杆菌(Bacillusamyloliquefaciens)亲缘关系最近,菌株XJ-8、XJ-193分别与贝莱斯芽孢杆菌(Bacillus velezensis)、枯草芽孢杆菌(Bacillus subtilis)亲缘关系最近。结合形态学特征及生理生化实验结果,最终鉴定菌株XJ-98、XJ-129、XJ-169均为地衣芽孢杆菌(Bacillus licheniformis),菌株XJ-26、XJ-47均为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),菌株XJ-8为贝莱斯芽孢杆菌(Bacillus velezensis),菌株XJ-193为枯草芽孢杆菌(Bacillus subtilis)。
2.3 产酱香细菌菌株模拟固态发酵产物挥发性风味成分分析
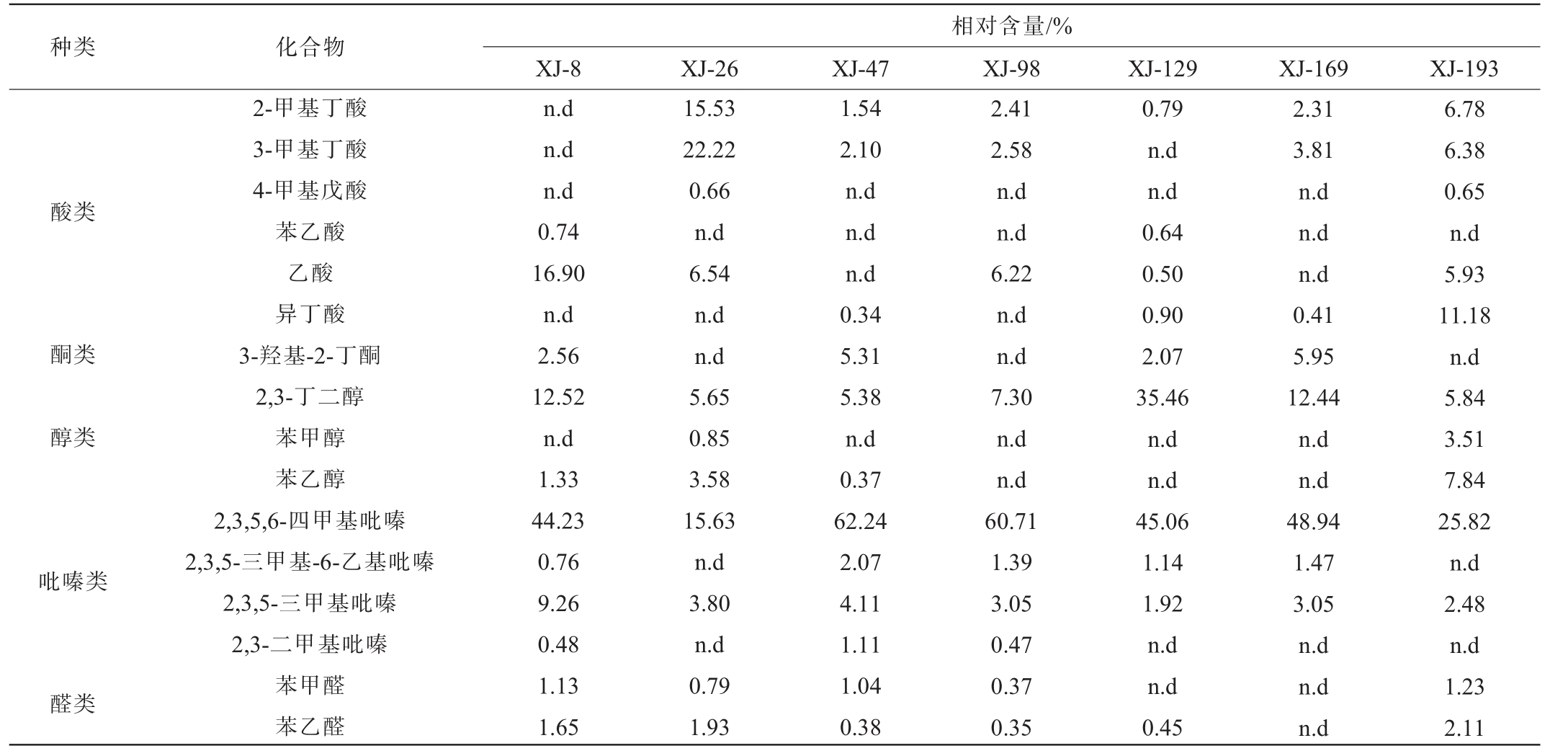
采用HS-SPME-GC-MS测定产酱香细菌菌株模拟固态发酵产物的挥发性风味物质,结果发现,不同菌株发酵产生的挥发性物质各不相同,从菌株XJ-8、XJ-26、XJ-47、XJ-98、XJ-129、XJ-169、XJ-193模拟固态发酵产物中分别检测出21种、26种、20种、26种、18种、17种、31种挥发性风味物质,主要挥发性风味成分见表4。
表4 产酱香细菌菌株模拟固态发酵产物中主要挥发性成分分析结果
Table 4 Analysis results of main volatile components in simulated solid-state fermentation products of bacteria strains producing sauce-flavor
相对含量/%XJ-8 XJ-26 XJ-47 XJ-98 XJ-129 XJ-169 XJ-193种类 化合物2-甲基丁酸3-甲基丁酸4-甲基戊酸苯乙酸乙酸异丁酸3-羟基-2-丁酮2,3-丁二醇苯甲醇苯乙醇2,3,5,6-四甲基吡嗪2,3,5-三甲基-6-乙基吡嗪2,3,5-三甲基吡嗪2,3-二甲基吡嗪苯甲醛苯乙醛酸类酮类醇类吡嗪类醛类n.d n.d n.d 0.74 16.90 n.d 2.56 12.52 n.d 1.33 44.23 0.76 9.26 0.48 1.13 1.65 15.53 22.22 0.66 n.d 6.54 n.d n.d 5.65 0.85 3.58 15.63 n.d 3.80 n.d 0.79 1.93 1.54 2.10 n.d n.d n.d 0.34 5.31 5.38 n.d 0.37 62.24 2.07 4.11 1.11 1.04 0.38 2.41 2.58 n.d n.d 6.22 n.d n.d 7.30 n.d n.d 60.71 1.39 3.05 0.47 0.37 0.35 0.79 n.d n.d 0.64 0.50 0.90 2.07 35.46 n.d n.d 45.06 1.14 1.92 n.d n.d 0.45 2.31 3.81 n.d n.d n.d 0.41 5.95 12.44 n.d n.d 48.94 1.47 3.05 n.d n.d n.d 6.78 6.38 0.65 n.d 5.93 11.18 n.d 5.84 3.51 7.84 25.82 n.d 2.48 n.d 1.23 2.11
续表
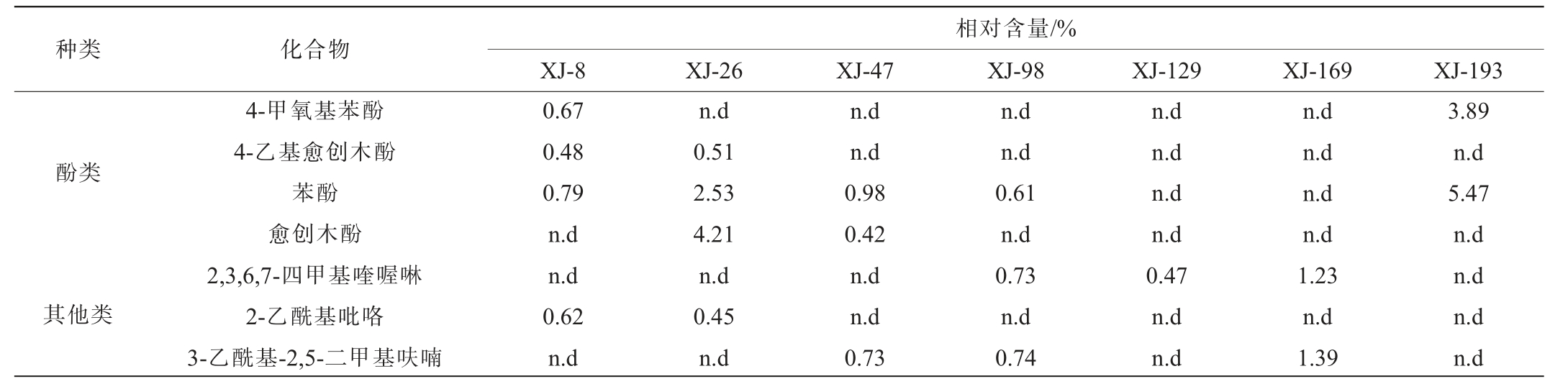
注:n.d表示未检出。下同。
相对含量/%XJ-8 XJ-26 XJ-47 XJ-98 XJ-129 XJ-169 XJ-193种类 化合物4-甲氧基苯酚4-乙基愈创木酚苯酚愈创木酚2,3,6,7-四甲基喹喔啉2-乙酰基吡咯3-乙酰基-2,5-二甲基呋喃酚类其他类0.67 0.48 0.79 n.d n.d 0.62 n.d n.d 0.51 2.53 4.21 n.d 0.45 n.d n.d n.d 0.98 0.42 n.d n.d 0.73 n.d n.d 0.61 n.d 0.73 n.d 0.74 n.d n.d n.d n.d 0.47 n.d n.d n.d n.d n.d n.d 1.23 n.d 1.39 3.89 n.d 5.47 n.d n.d n.d n.d
由表4可知,7株产酱香细菌菌株模拟固态发酵产生的共有主要优势挥发性风味成分是2,3,5,6-四甲基吡嗪、2,3,5-三甲基吡嗪和2,3-丁二醇,其中菌株XJ-47、XJ-98模拟固态发酵产生的四甲基吡嗪相对含量较高,分别为62.24%、60.71%,菌株XJ-129模拟固态发酵产生的2,3-丁二醇相对含量最高,为35.46%。吡嗪类化合物赋予了中国白酒有益健康的功能,为酒体提供了馥郁的烘焙和坚果香气,对酱香型白酒的粮香与酱香具有烘托作用[21-22],2,3丁二醇可作为生产风味增强剂如乙偶姻和双乙酰的中间体[23]。结合7株产酱香细菌菌株的产蛋白酶能力、模拟固体发酵产物的香味以及2,3,5,6-四甲基吡嗪相对含量,从同种菌株中筛选出4株优良的菌株即XJ-8、XJ-47、XJ-98、XJ-193进入后续生产应用实验。
2.4 产酱香细菌菌株在窖面酒生产中的应用
2.4.1 添加复合菌剂对糟醅理化指标的影响
入窖糟醅和出窖糟醅的理化性质见图3。由图3可知,随着入窖发酵的进行,糟醅的还原糖含量和水分含量均下降,酸度升高。出窖时,实验组糟醅的还原糖含量(0.61 g/100 g)和水分含量(54.2%)均显著低于对照组还原糖含量(1.39 g/100 g)和水分含量(57.1%)(P<0.05),分析原因可能是微生物繁殖代谢产生与消耗水分和营养物质速率不同有关[24];实验组糟醅的酸度(3.97 mmol/10 g)与对照组(3.84 mmol/10 g)无显著差异(P>0.05)。
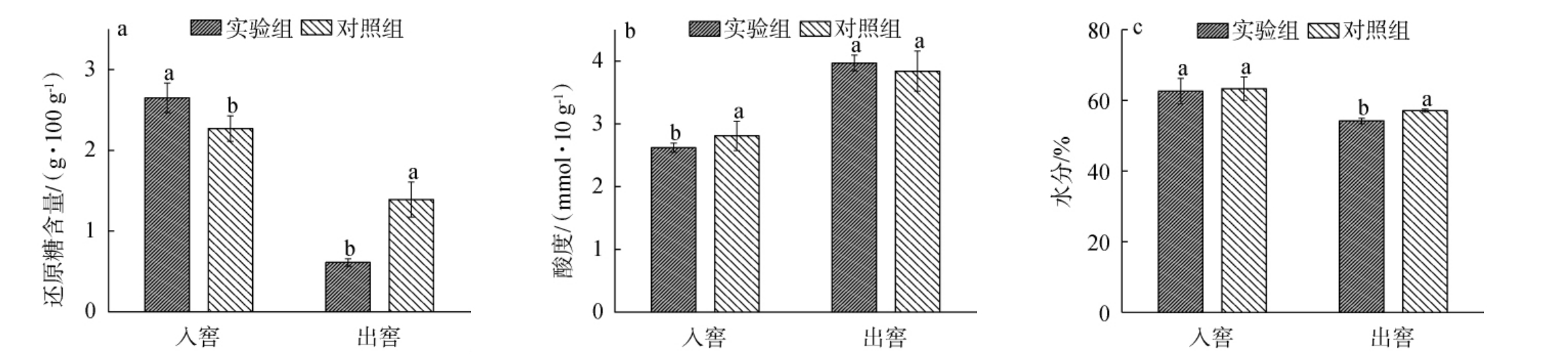
图3 入窖与出窖糟醅的还原糖含量(a)、酸度(b)及水分含量(c)测定结果
Fig.3 Determination results of reducing sugar contents (a), acidity (b) and moisture contents (c) of the fermented grains loading and unloading pit
不同字母表示同组数据差异显著(P<0.05)。
2.4.2 添加复合菌剂对窖面酒挥发性风味成分的影响
参考文献[25-26]分析窖面基酒中的含量较高的骨架风味成分物质,包括10种酯类,5种醛类,8种醇类,2种酸类。同时,因产酱香细菌固态发酵产物中吡嗪类物质相对含量较高,将四甲基吡嗪与三甲基吡嗪也作为关注指标。窖面酒的挥发性风味成分检测结果见表5。
表5 窖面酒挥发性风味成分检测结果
Table 5 Detection results of volatile flavor components in pit surface liquor
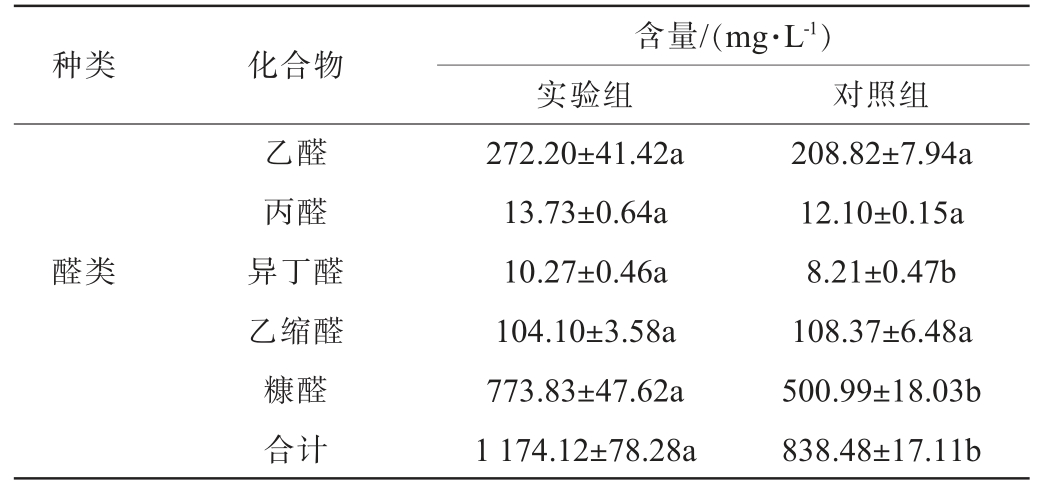
种类 化合物含量/(mg·L-1)实验组 对照组醛类乙醛丙醛异丁醛乙缩醛糠醛合计272.20±41.42a 13.73±0.64a 10.27±0.46a 104.10±3.58a 773.83±47.62a 1 174.12±78.28a 208.82±7.94a 12.10±0.15a 8.21±0.47b 108.37±6.48a 500.99±18.03b 838.48±17.11b
续表
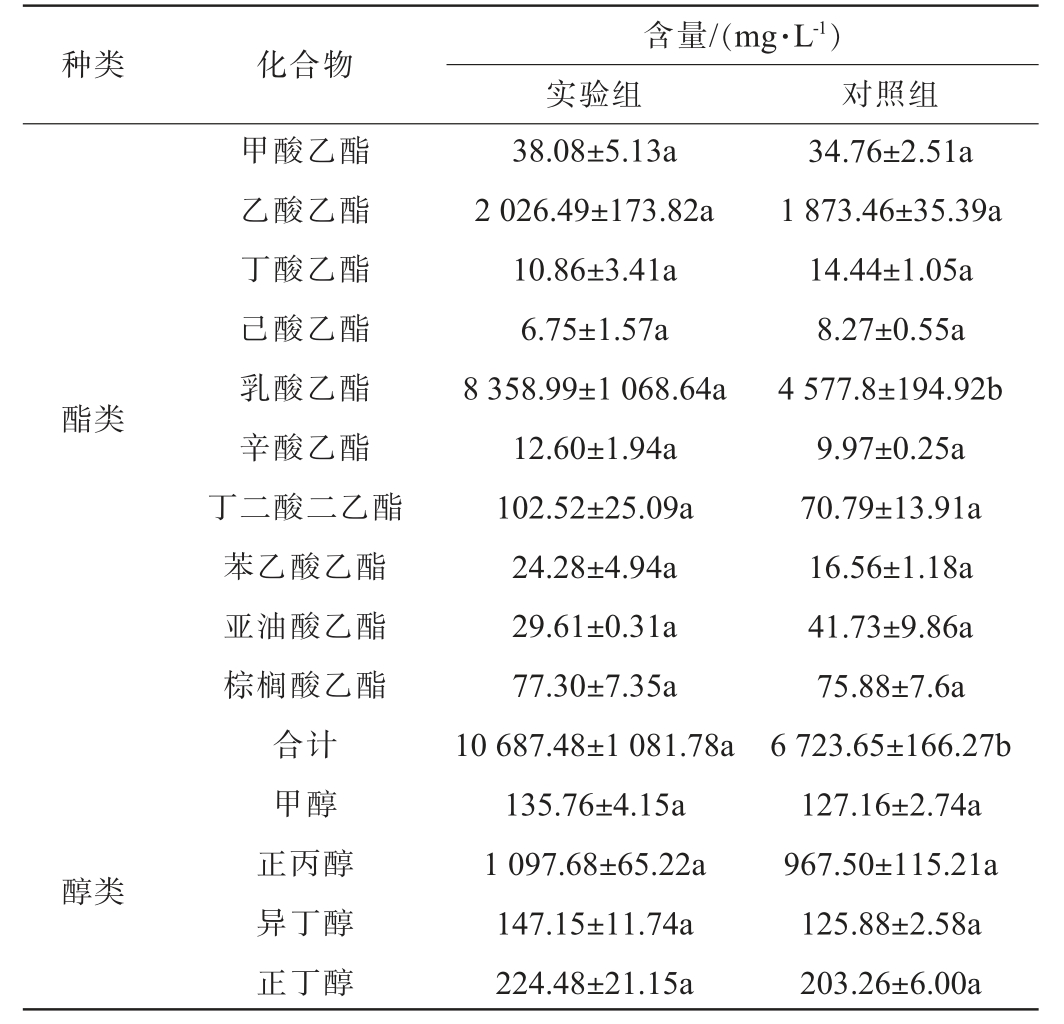
种类 化合物含量/(mg·L-1)实验组 对照组酯类醇类甲酸乙酯乙酸乙酯丁酸乙酯己酸乙酯乳酸乙酯辛酸乙酯丁二酸二乙酯苯乙酸乙酯亚油酸乙酯棕榈酸乙酯合计甲醇正丙醇异丁醇正丁醇38.08±5.13a 2 026.49±173.82a 10.86±3.41a 6.75±1.57a 8 358.99±1 068.64a 12.60±1.94a 102.52±25.09a 24.28±4.94a 29.61±0.31a 77.30±7.35a 10 687.48±1 081.78a 135.76±4.15a 1 097.68±65.22a 147.15±11.74a 224.48±21.15a 34.76±2.51a 1 873.46±35.39a 14.44±1.05a 8.27±0.55a 4 577.8±194.92b 9.97±0.25a 70.79±13.91a 16.56±1.18a 41.73±9.86a 75.88±7.6a 6 723.65±166.27b 127.16±2.74a 967.50±115.21a 125.88±2.58a 203.26±6.00a
续表
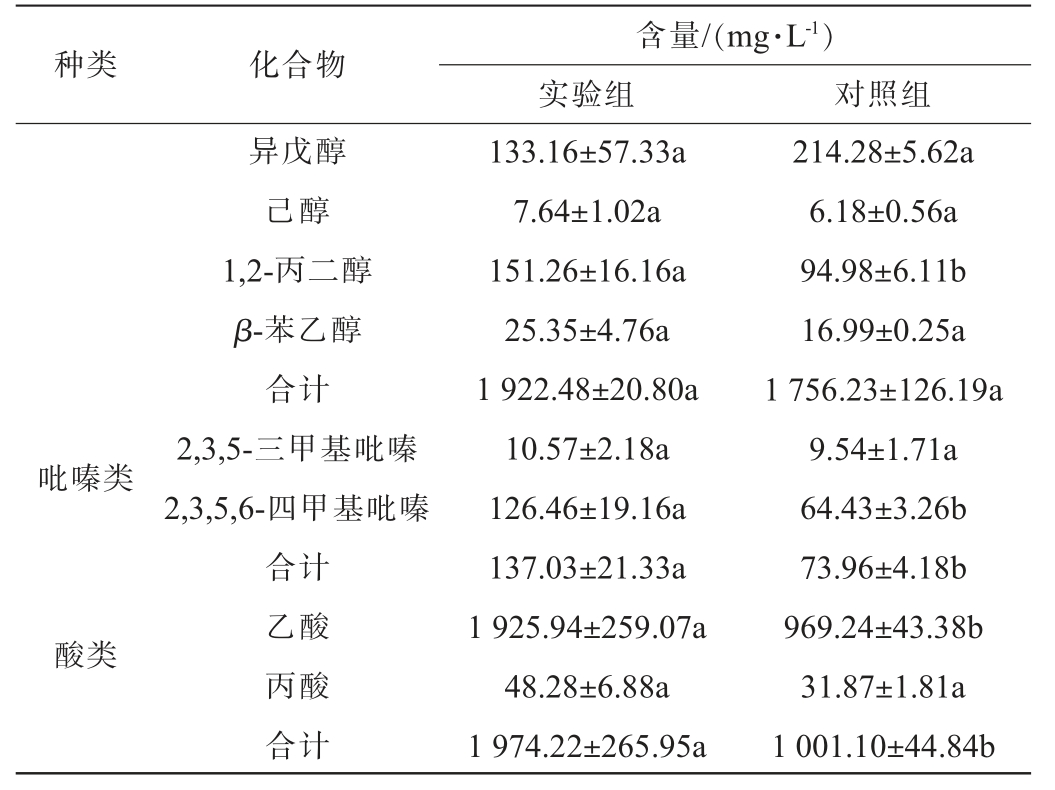
种类 化合物含量/(mg·L-1)实验组 对照组吡嗪类酸类异戊醇己醇1,2-丙二醇β-苯乙醇合计2,3,5-三甲基吡嗪2,3,5,6-四甲基吡嗪合计乙酸丙酸合计133.16±57.33a 7.64±1.02a 151.26±16.16a 25.35±4.76a 1 922.48±20.80a 10.57±2.18a 126.46±19.16a 137.03±21.33a 1 925.94±259.07a 48.28±6.88a 1 974.22±265.95a 214.28±5.62a 6.18±0.56a 94.98±6.11b 16.99±0.25a 1 756.23±126.19a 9.54±1.71a 64.43±3.26b 73.96±4.18b 969.24±43.38b 31.87±1.81a 1 001.10±44.84b
酯类物质是白酒中重要的呈香呈味物质,对花香、果香和甜香均有呈香作用[27]。醇类物质不仅能增强酒体层次感和醇甜感,还可以与酸类物质合成酯类物质[28]。醛类物质是酱香型白酒中的骨架风味成分,具有愉快的青草香气[29]。酸类物质主要由发酵过程中产酸微生物代谢产生,一些酸类物质既有香气又是呈味物质,含量适当的情况下有助香效果[30]。由表5可知,酒样中的酯类物质以乳酸乙酯为主,乙酸乙酯次之;醇类物质以正丙醇等高级醇为主;醛类物质以糠醛为主,乙醛和乙缩醛次之;吡嗪类物质以2,3,5,6-四甲基吡嗪为主;酸类物质以乙酸为主。实验组酒样中的酯类、醛类、吡嗪类和酸类物质含量均显著高于对照组酒样,且乳酸乙酯、糠醛、2,3,5,6-四甲基吡嗪和乙酸等主要挥发性风味成分含量分别比对照组酒样提高82.60%、54.46%、96.28%、98.71%。
3 结论
本研究通过稀释涂布平板法、产蛋白酶及耐高温筛选以及模拟固态发酵实验从酱香大曲中筛选出7株产酱香细菌,经形态学观察、生理生化试验及分子生物学鉴定,菌株XJ-26、XJ-47为解淀粉芽孢杆菌(Bacillus amylolique faciens),菌株XJ-98、XJ-129和XJ-169均为地衣芽孢杆菌(Bacillus licheniformis),菌株XJ-8和XJ-193分别为贝莱斯芽孢杆菌(Bacillus velezensis)、枯草芽孢杆菌(Bacillus subtilis)。通过对其模拟固态发酵产物的挥发性风味成分进行分析,发现这7株产酱香细菌菌株模拟固态发酵产物中的优势挥发性风味成分均为2,3,5,6-四甲基吡嗪、2,3,5-三甲基吡嗪和2,3-丁二醇,选择4株产酱香功能菌以菌剂的形式应用到窖面酒生产中,结果发现,与对照组相比,实验组出窖糟醅的还原糖及水分含量均显著下降(P<0.05),酸度无显著差异(P>0.05);实验组酒样中的酯类、醛类、吡嗪类和酸类物质含量均有显著升高(P<0.05),其中,乳酸乙酯、糠醛、四甲基吡嗪和乙酸含量分别提高82.60%、54.46%、96.28%、98.71%。该研究为优化酱香型白酒酿造工艺、提升基酒中挥发性风味成分含量提供理论和实践支持。
[1]张荣,徐岩,范文来,等.酱香大曲中地衣芽孢杆菌及其特征风味代谢产物的分析研究[J].工业微生物,2010,40(3):7-12.
[2]张春林,蒲春,白从广,等.高温大曲中产酱香风味细菌的筛选及其产香特性研究[J].食品科技,2022,47(5):1-6.
[3]王小平,黄永光,周文美.产酱香风味菌株的分离筛选及鉴定[J].食品与发酵工业,2020,46(10):179-184.
[4]周平,罗惠波,黄丹,等.中高温大曲中一株耐热地衣芽孢杆菌耐受性及产酶特性的初步研究[J].食品科技,2016,41(11):14-20.
[5]张倩,赵华,张美艳,等.与产酱香有关细菌的分离及在酒醅堆积中的作用[J].酿酒科技,2014(7):54-56.
[6]罗建超,谢和.大曲中产酱香芽孢杆菌的筛选及其代谢产香探析[J].酿酒科技,2012(5):35-40.
[7]王小平.酱香风味菌株筛选及其发酵代谢香气特性研究[D].贵阳:贵州大学,2021.
[8]张小龙,陆安谋,王晓丹,等.酱香大曲中产酱香细菌的分离与鉴定[J].酿酒科技,2013(11):4-8.
[9]何猛超,邬子璇,西玉玲,等.通过外源添加芽孢杆菌提升北方地区高温大曲的品质[J].食品工业科技,2024,45(1):145-154.
[10]何琪,张亚东,晏永,等.菌种发酵液添加对酱香型高温大曲品质的影响[J].酿酒科技,2025(3):65-70.
[11]任津莹,陈鹏.一株贝莱斯芽孢杆菌的分离鉴定及其生物学特性研究[J].饲料研究,2022,45(2):79-82.
[12]张清玫.浓香大曲微生物群落结构解析与功能微生物筛选[D].无锡:江南大学,2022.
[13]布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].北京:科学出版社,1984:744.
[14]史洪丽,李腊,郭翠梅,等.番茄灰霉病生防菌株TL1的分离、鉴定及其生防能力分析[J].园艺学报,2023,50(1):79-90.
[15]周习,云岭,邱声强,等.产酱香芽孢杆菌在酱香大曲中的生产应用研究[J].酿酒科技,2022(3):89-92.
[16]齐琦.黑糯米保健酒的工艺及品质研究[D].贵阳:贵州大学,2018.
[17]杜相林,吴任之,桑其明,等.功能菌在浓香型白酒生产中的应用现状[J].酿酒,2022,49(4):17-21.
[18]卢君,山其木格,王丽,等.应用功能微生物菌剂提高酱香白酒窖面酒质量的研究[J].酿酒科技,2018(8):73-79.
[19]李学思,侯小歌,李绍亮,等.中高温大曲中高产蛋白酶菌株的选育[J].酿酒,2017,44(2):47-51.
[20]李芳香,郭中欢,张稳,等.酱香型高温大曲中蛋白酶高产菌株的选育[J].酿酒科技,2024(8):43-48.
[21]孙细珍,熊亚青,倪兴婷,等.吡嗪类化合物对酱香型白酒香气特征的影响分析[J].食品与发酵工业,2025,51(1):305-311.
[22]丁海龙,沈小娟,宋川,等.中国白酒健康功能成分吡嗪类化合物研究进展[J].中国酿造,2022,41(9):8-12.
[23]SONG C W, PARK J M, CHUNG S C, et al.Microbial production of 2,3-butanediol for industrial applications[J].J Ind Microb Biot,2019,46(11):1583-1601.
[24]崔东琦,罗小叶,班世栋,等.强化曲的制备及其在酱香型白酒中的应用[J].食品与发酵工业,2022,48(7):78-84.
[25]吴兰,朱晓春,孙优兰,等.基于感官和化学分析技术解析酱香型典型体基酒风味特征[J/OL].食品与发酵工业,1-15[2025-01-13].https://doi.org/10.13995/j.cnki.11-1802/ts.041067.
[26]王金龙,程平言,陆伦维,等.基于DB-WAX UI色谱柱气相色谱法检测5种香型白酒中45种挥发性风味物质[J].中国酿造,2023,42(4):238-243.
[27]GUAN Q J,MENG L J,MEI Z L,et al.Volatile compound abundance correlations provide a new insight into odor balances in sauce-aroma Baijiu[J].Foods,2022,11(23):3916.
[28]LI W W,ZHANG H,WU R N,et al.Temporal profile of the microbial community and volatile compounds in the third-round fermentation of sauce-flavor Baijiu in the Beijing region[J].Foods,2024,5(13):22-28.
[29]许忠平,梁明锋,张娇娇,等.不同地区酱香型白酒风格特征及风味物质构成差异相关性研究[J].中国酿造,2024,43(2):35-42.
[30]蒙德俊,张娇娇,郭炳豪,等.酱香型白酒轮次基酒酸类风味物质与酒醅微生物的相关性分析[J].食品科技,2022,47(10):77-83.