中国传统泡菜采用浸泡腌渍盐水的方法,使蔬菜自然发酵,微生物利用原料营养成分作为底物产生多种代谢产物,使产品具有独特的香气、滋味和质构[1]。在发酵过程中,微生物菌群产生的有机酸等有助于抑制腐败菌生长,提高产品安全性[2],但有益微生物生长代谢受到环境条件、底物及其他微生物等多种因素影响[3],传统泡菜加工方法可能会存在发酵菌群不稳定的问题。通过控制发酵底物,形成稳定的发酵菌群,是实现泡菜稳定生产的可循途径之一。
乳清是奶酪加工过程中牛奶经酶或酸絮凝后滤出的副产物,是一种淡黄色、半透明状的稀薄液体。乳饼和乳扇是云南民族特色奶酪制品,其加工过程有大量乳清产生,每生产1 t乳饼约排出5 t乳清,乳清含有原料乳一半以上的营养成分,包括蛋白质、乳糖、脂肪及矿物质等,营养价值较高[4]。大部分乳清在生产中以废水的形式排放,不仅浪费资源,还造成环境污染[5]。目前,主要围绕发酵乳清的保健功效,如改善人体消化吸收等进行了研究[6],鲜见关于发酵乳清应用于泡菜制品的研究报道。
为探究乳清对泡萝卜品质及菌群多样性的影响,分别采用盐水、未发酵乳清和自然发酵乳清泡萝卜,对泡萝卜发酵过程pH值、总酸、亚硝酸盐含量和脆性变化进行测定,并通过高通量测序技术对未发酵及自然发酵乳清泡萝卜的菌群多样性进行分析。以期缩短泡菜发酵周期,为提高泡菜品质及促进乳清资源利用提供参考依据。
1 材料与方法
1.1 材料与试剂
春白玉萝卜:峨山翠嘎商贸有限公司;食盐、柠檬醋、鲜奶(蛋白质3.5%、脂肪3.9%、碳水化合物5.0%、钠0.06%、钙0.11%):市售;亚铁氰化钾(分析纯):天津市风船化学试剂科技有限公司;乙酸锌、冰乙酸、硼酸钠、对氨基苯磺酸、酚酞、氢氧化钠(均为分析纯):天津市致远化学试剂有限公司;盐酸(分析纯):四川西陇科学有限公司;盐酸萘乙二胺(分析纯):上海展云化工有限公司;亚硝酸钠基准试剂(纯度99.99%):上海麦克林生化科技有限公司;TGuideS96磁珠法土壤/粪便基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;KOD OneTM PCR Master Mix 聚合酶链式反应(polymerase chain reaction,PCR)预混液:北京百灵克生物科技有限责任公司。
1.2 仪器与设备
FE20 Plus pH计:梅特勒-托利多仪器(上海)有限公司;MULTISKAN GO酶标仪:美国Thermo Fisher Scientific公司;TMS-Touch质构仪:美国FTC公司;DHG-9140A鼓风干燥箱、HWS-24电热恒温水浴锅:上海一恒科学仪器有限公司;AUY220电子天平:岛津制作所;H/T 16MM台式高速离心机:湖南赫西仪器装备有限公司;SB-5200DTD超声仪:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 未发酵乳清及自然发酵乳清制备
将鲜奶加热到65 ℃,搅拌并慢慢加入鲜奶质量10%的柠檬醋,继续加热到85 ℃,趁热用已灭菌的无纺布袋去除凝乳,将乳清过滤至密封罐中,封好罐口,乳清温度降至室温后,去除上层脂肪和下层蛋白质沉淀[7]。将装有乳清的密封罐,95 ℃条件下杀菌5 min,得到未发酵乳清。将未发酵乳清静置于恒温培养箱中,20 ℃条件下发酵一周,至终点pH值为3.8,去除上层脂肪和下层蛋白质沉淀,得到自然发酵乳清。
1.3.2 泡萝卜制作工艺流程及操作要点
白萝卜→去皮→切块→放入腌渍母液→发酵→成品
操作要点:选取新鲜白萝卜1 kg,削去表皮,切成边长1 cm的正方体小块,将萝卜置于1 kg腌渍母液(食盐含量为80 g)中30 ℃发酵30 h,在发酵0 h、6 h、12 h、18 h、24 h及30 h时取样。其中,自然发酵乳清腌渍母液为75%(V/V)自然发酵乳清和25%(V/V)饮用水混合制成;未发酵乳清腌渍母液为75%(V/V)未发酵乳清和25%(V/V)饮用水混合制成;盐水腌渍母液为饮用水。发酵结束后即得泡萝卜成品。
1.3.3 泡萝卜理化指标的测定
pH值的测定:根据GB 5009.237—2016《食品安全国家标准 食品pH值的测定》;总酸的测定:根据GB 12456—2021《食品安全国家标准食品中总酸的测定》中第一法(酸碱指示剂滴定法);亚硝酸盐的测定:根据GB 5009.33—2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》中第二法(分光光度法)。
1.3.4 泡萝卜脆性的测定
使用方口轻型切刀探头和单刀剪切模式进行测试,随机取不同泡萝卜样品各10块。测量参数设置为:测前速度2 mm/s、测试速度2 mm/s及测后速度5 mm/s,测试距离为20 mm,触发力为0.1 N,触发类型为自动。
1.3.5 高通量测序
样品:分别在自然发酵乳清泡萝卜、未发酵乳清泡萝卜发酵0 h、12 h、30 h时各取样15 g,进行高通量测序。而盐水泡萝卜由于在发酵30 h后pH值仍>4,未达到食用要求,与其他两种泡萝卜菌群多样性对比的意义较小,故未对其样品进行测定。
DNA提取:利用DNA提取试剂盒提取泡萝卜中微生物基因组DNA,方法参照说明书。
PCR扩增:对细菌16S rDNA及真菌ITS基因全长分别进行PCR扩增,细菌引物为27F(5'-AGRGTTTGATYNTGGCTCAG-3')和1492R(5'-TASGGHTACCTTGTTASGACTT-3'),真菌引物为ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')。细菌、真菌PCR扩增体系均为30 μL,其中,基因组DNA均为1.5 μL,KOD OneTM PCR Master Mix PCR预混液均为15 μL,barcode引物对(3 μL、1.8 μL),采用无核酸酶水补足至30 μL。细菌PCR扩增程序为:95 ℃预变性2 min;98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸90 s,共25个循环;72 ℃再延伸2 min。真菌PCR扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共8个循环;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸45 s,共24个循环;72 ℃再延伸5 min。扩增产物使用1.8%琼脂糖凝胶电泳检测并切胶回收。
高通量测序:将得到的扩增产物送往北京百迈客生物科技有限公司,在PacBio测序平台,利用单分子实时测序(single-molecule sequencing in real time,SMRT)的方法,完成高通量测序。使用lima v1.7.0软件,通过barcode识别环形一致性测序(circular consensus sequencing,CCS)序列;使用cutadapt 1.9.1软件识别并去除引物序列,同时进行长度过滤;使用UCHIME v4.2软件鉴定并去除嵌合体序列;并使用Usearch软件对Reads在97.0%的相似度水平下进行聚类,获得操作分类单元(operational taxonomic units,OTU)。使用MOTHUR进行Alpha多样性分析,并利用R语言分析作图;使用SILVA132数据库(https://www.arb-silva.de)进行细菌16S rRNA分析,UNITE 8.0数据库(http://unite.ut.ee/index.php)进行真菌ITS分析。
1.3.6 数据处理与统计分析
采用Excel 2016整理数据,采用SPSS 26.0软件对实验数据进行单因素方差分析(analysis of variance,ANOVA),P<0.05为差异显著;使用Origin 2018绘图。
2 结果与分析
2.1 泡萝卜样品在发酵过程中理化指标的变化
2.1.1 pH值
不同泡萝卜样品在发酵过程中pH值的变化见图1。由图1可知,自然发酵乳清泡萝卜(F)起始pH值为4.41,在发酵6 h后降低至3.83,之后稳定在3.63~3.73。研究表明,自然发酵乳清中含有丰富的乳酸菌及其代谢产生的乳酸,可溶性酸通过渗透作用进入萝卜中,萝卜pH值快速降低,后期由于有机酸的积累使乳酸菌代谢受到一定抑制[8]。当泡菜的pH<4时可认为发酵成熟[9],样品F发酵6 h左右即可食用。未发酵乳清泡萝卜(N)和盐水泡萝卜(C)起始pH值分别为5.11、5.71,样品N在18 h之前pH值均低于样品C,发酵18 h后样品N和样品C的pH值变化趋势基本一致,发酵30 h的pH值为4,说明未发酵乳清在前期对发酵有一定促进作用,后期可能由于产酸优势菌群不稳定,pH值始终显著高于自然发酵乳清泡萝卜(P<0.05)。样品N和样品C较样品F成熟缓慢,发酵30 h后才可食用。因此,自然发酵乳清可促进泡萝卜发酵。
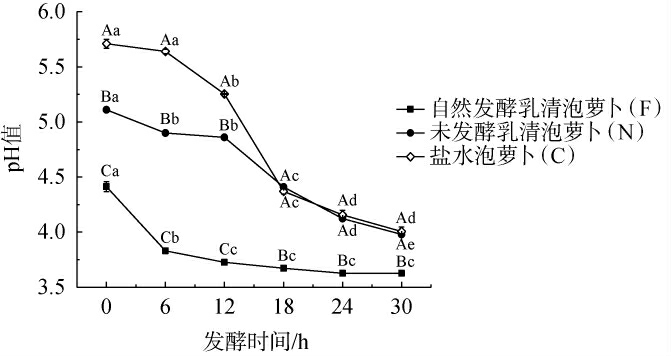
图1 不同泡萝卜样品在发酵过程中pH值的变化
Fig.1 Changes of pH value of different pickled radish samples during fermentation process
不同大写字母表示相同时间点不同腌渍母液的泡萝卜之间差异显著(P <0.05),不同小写字母表示相同腌渍母液的泡萝卜在不同时间点差异显著(P<0.05)。下同。
2.1.2 总酸
不同泡萝卜样品在发酵过程中总酸含量的变化见图2。由图2可知,随着发酵的进行,泡萝卜总酸的含量均有所增加,自然发酵乳清泡萝卜(F)在发酵前6 h总酸含量增速较快,之后缓慢上升。未发酵乳清泡萝卜(N)在发酵12 h后,总酸积累速度加快,发酵24 h后总酸含量超过样品F。盐水泡萝卜(C)总酸含量呈缓慢增加趋势,在发酵30 h后总酸含量达到0.51%。有研究发现泡菜中总酸含量在0.6%~0.8%范围时口感较佳[10],样品F能在6 h内较快速达到发酵成熟,但由于乳清中乳糖含量较高,并且自然发酵乳清中已具有较丰富的乳酸菌群,继续发酵将导致萝卜口感过酸,因此使用自然发酵乳清泡萝卜要控制在较短的发酵时间(3 h左右),但泡萝卜食用品质需结合其他指标综合评价。
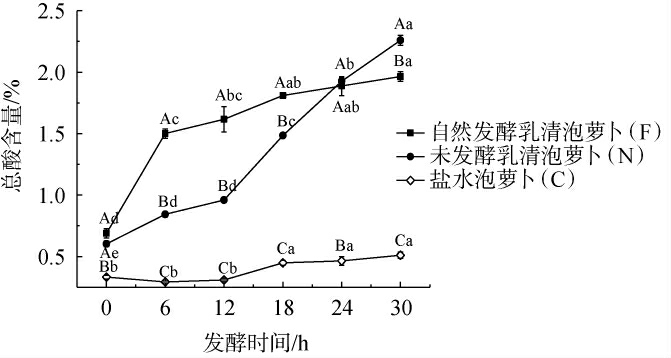
图2 不同泡萝卜样品在发酵过程中总酸含量的变化
Fig.2 Changes of total acid contents of different pickled radish samples during fermentation process
2.1.3 亚硝酸盐含量
腌制食品中的亚硝酸盐可能对人体健康造成不良影响,泡菜中亚硝酸盐含量呈先上升后下降趋势,形成亚硝峰[11]。不同泡萝卜样品在发酵过程中亚硝酸盐含量的变化见图3。由图3可知,自然发酵乳清泡萝卜(F)、未发酵乳清泡萝卜(N)在0 h检测到低浓度亚硝酸盐,其含量分别为4.39 mg/kg、1.61 mg/kg,发酵6 h时样品F、N均未检出亚硝酸盐,当发酵6~30 h时,样品F、N亚硝酸盐含量均在小范围波动,但始终低于NY/T 437—2012《绿色食品酱腌菜》中4 mg/kg的标准。这可能是由于乳清中含氮有机物较多,在微生物作用下生成了少量亚硝酸盐[12],后续发酵过程中亚硝酸盐又被微生物降解。盐水泡萝卜(C)在发酵0~12 h时,亚硝酸盐含量快速升高;当发酵12h时出现明显的亚硝峰(10.29mg/kg),之后亚硝酸盐含量快速下降。可能是由于发酵初期,尚未形成酸性环境,缺乏乳酸菌优势菌群,而低盐浓度对硝酸盐还原酶阳性菌抑制作用较弱,导致亚硝酸盐含量较快上升[13]。乳酸菌在发酵中后期逐渐成为优势菌群,其产生的乳酸有利于形成酸性环境,抑制硝酸盐还原酶阳性菌生长,同时部分具有亚硝酸盐还原酶的乳酸菌能将亚硝酸盐还原为一氧化氮等,使得亚硝酸盐含量下降[14]。样品F在发酵过程中没有出现亚硝酸峰,且6 h即能达到发酵成熟。因此,自然发酵乳清能在缩短发酵时间的基础上,降低泡萝卜中亚硝酸盐的含量。
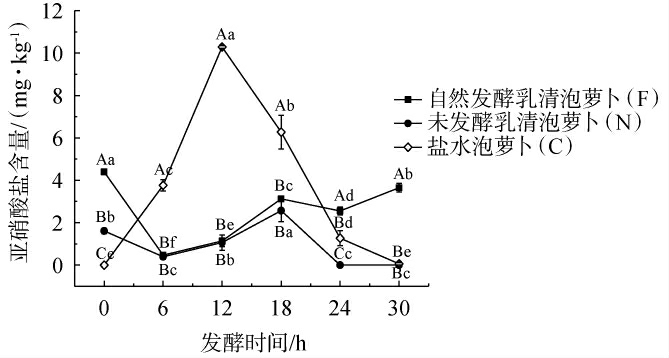
图3 不同泡萝卜样品在发酵过程中亚硝酸盐含量的变化
Fig.3 Changes of nitrite contents of different pickled radish samples during fermentation process
2.1.4 脆性
不同泡萝卜样品在发酵过程中脆性的变化见图4。由图4可知,在发酵时间0~30 h范围内,不同泡萝卜样品的脆性均呈先增加后稳定的趋势,且样品C的脆性始终低于样品F、N。当发酵0~6 h时,样品F、N的脆性无显著差异(P>0.05),脆性约为28 N;当发酵时间>6 h之后,样品N的脆性始终高于样品F,根据pH值,样品F发酵6 h时pH值即达到了可食用的范围,说明自然发酵乳清在萝卜发酵成熟时已提高了其脆性。对新鲜萝卜和发酵结束(发酵30 h)的不同泡萝卜样品进行钙含量测定发现,样品N钙含量最高(487.00 mg/kg),其次为样品F(378.67 mg/kg),而样品C中钙含量较低,与新鲜萝卜无显著差异(P>0.05)。对样本的脆性及其钙含量进行相关性分析,得到相关系数为0.965 8,呈较强的正相关关系。通过在泡菜加工过程中添加一些含有钙离子的化学添加剂如氯化钙等,可以提高泡菜的脆性[15]。乳清作为牛乳加工副产物,其中仍然存在一定含量的钙离子[16]。在发酵过程中可能自然发酵乳清泡萝卜(F)中较高浓度的钙与果胶酸发生反应生成果胶酸钙,使其在稳定且快速发酵的前提下,提升了萝卜脆度,同时可避免添加外源化学保脆剂。
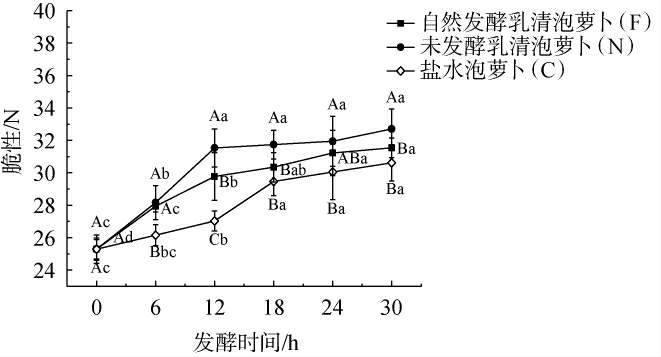
图4 不同泡萝卜样品在发酵过程中脆性的变化
Fig.4 Changes of brittleness of different pickled radish samples during fermentation process
2.2 泡萝卜样品在发酵过程中细菌菌群高通量测序结果
2.2.1 泡萝卜样品在发酵过程中细菌菌群测序数据质量评估及OTU分析
自然发酵乳清泡萝卜发酵0 h、12 h、30 h的样本F0、F12、F30,未发酵乳清泡萝卜发酵0 h、12 h、30 h的样本N0、N12、N30,这6个样品的识别CCS数(Raw-CCS)为4 505~7 580个,识别并去除引物后的序列数(Clean CCS)为4 228~7 102条;经长度过滤且去除嵌合体后用于后续分析的序列数(Effective-CCS)为4 189~7 042条;样品平均序列长度(AvgLen)为1 416~1 499 bp;Effective-CCS占Raw-CCS的百分比(Effective)为92.90%~94.38%。说明测序数据质量较好,可用于后续分析。
泡萝卜样品在发酵过程中细菌菌群OTU数目Venn图见图5。由图5可知,6个样本总OTU数目为31。其中,自然发酵乳清泡萝卜样本F0、F12、F30的OTU数目分别为5、5、3,未发酵乳清泡萝卜样本N0、N12、N30的OTU数目分别为23、17、6。未发酵乳清泡萝卜较自然发酵乳清泡萝卜的OTU数目更为复杂,随着发酵的进行,OTU数目呈逐渐减少的趋势。自然发酵乳清泡萝卜(F)和未发酵乳清泡萝卜(N)的共有OTU数目为3,两组样本各自特有的OTU数目分别为3、25。
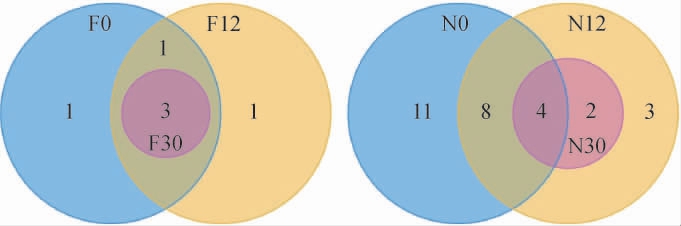
图5 不同泡萝卜样品在发酵过程中细菌菌群OTU数目Venn图
Fig.5 Venn diagram of OTU numbers of bacterial flora in different pickled radish samples during fermentation process
2.2.2 泡萝卜样品在发酵过程中细菌菌群Alpha多样性分析
Shannon指数和Simpson指数用来描述物种多样性;Chao1指数和Ace指数用来描述物种丰富度;Coverage描述测序对物种的覆盖率[17]。泡萝卜样品在发酵过程中细菌菌群Alpha多样性分析结果见表1。由表1可知,所有样本的覆盖率均>0.99,说明本次测序得到的数据基本能够真实反映样本的实际情况。整个发酵过程中,未发酵乳清泡萝卜和自然发酵乳清泡萝卜的Ace指数分别为6.00~23.28、3.00~5.00,Chao1指数分别为12.00~23.00、3.00~6.00,未发酵乳清泡萝卜的物种丰富度较自然发酵乳清泡萝卜要高。未发酵乳清泡萝卜和自然发酵乳清泡萝卜的Simpson指数分别为0.02~0.09、0.01~0.03,Shannon指数分别为0.08~0.44、0.07~0.13,未发酵乳清泡萝卜的物种多样性整体高于自然发酵乳清泡萝卜。随着发酵进行,未发酵乳清泡萝卜的Ace指数、Chao1指数、Simpson指数和Shannon指数均呈下降趋势,表明物种丰富度和多样性均降低。自然发酵乳清泡萝卜的Ace指数和Chao1有所下降,说明其物种丰富度逐渐降低,Simpson指数和Shannon指数先升高再降低,说明细菌多样性在发酵中期有所增加。
表1 不同泡萝卜样品在发酵过程中细菌菌群Alpha多样性分析结果
Table 1 Alpha diversity analysis results of bacterial flora of different pickled radish samples during fermentation process
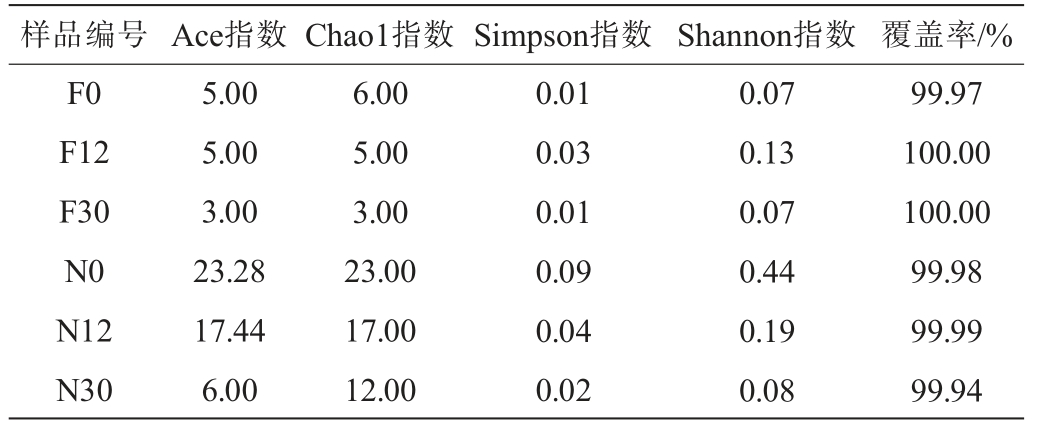
样品编号 Ace指数Chao1指数Simpson指数 Shannon指数 覆盖率/%F0 F12 F30 N0 N12 N30 5.00 5.00 3.00 23.28 17.44 6.00 6.00 5.00 3.00 23.00 17.00 12.00 0.01 0.03 0.01 0.09 0.04 0.02 0.07 0.13 0.07 0.44 0.19 0.08 99.97 100.00 100.00 99.98 99.99 99.94
2.2.3 泡萝卜样品在发酵过程中细菌菌群结构分析
泡萝卜样品在发酵过程中基于属、种水平的细菌菌群结构见图6。主要显示了平均相对丰度前十的物种,其他物种合并为Others,Unclassified代表未得到分类学注释的物种。
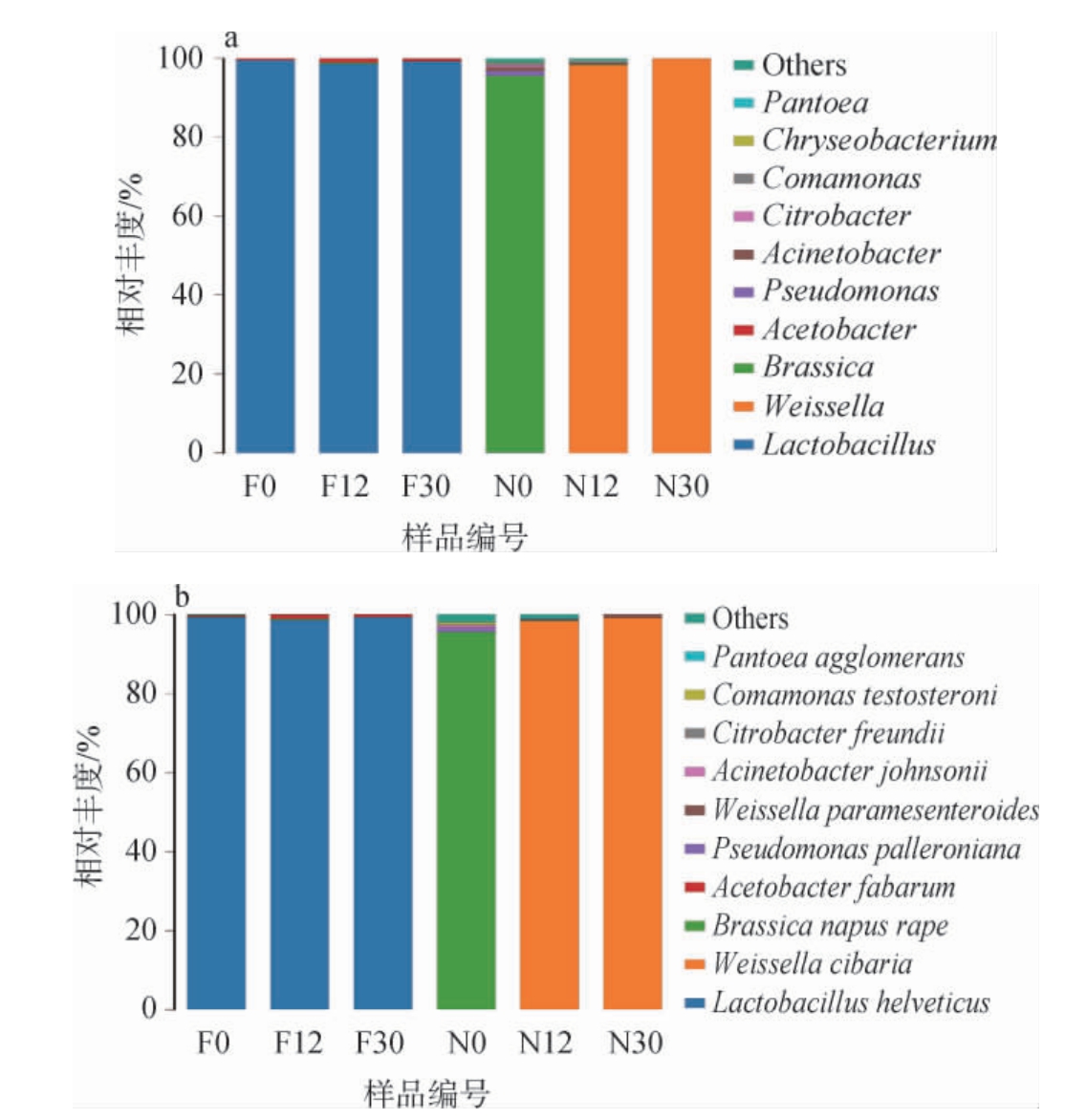
图6 基于属水平(a)及种水平(b)不同泡萝卜样品在发酵过程中的细菌群落结构
Fig.6 Bacterial community structure of different pickled radish samples during fermentation process based on genus level (a) and species level (b)
由图6a可知,自然发酵乳清泡萝卜中4个属分别为乳杆菌属(Lactobacillus)(99.11%),醋杆菌属(Acetobacter)(0.74%),芸 苔 属(Brassica)(0.14%),泛 菌 属(Pantoea)(0.01%)(相对丰度>1%为优势物种,相对丰度>95%为绝对优势物种[18])。乳杆菌属属于厚壁菌门(Firmicutes),厚壁菌门在泡菜中起着重要作用,其下属的多种乳酸菌是产酸和形成风味的主要菌属[19]。乳杆菌属是泡菜发酵的主要菌属之一,除了产酸、风味形成等主要作用外,还能减少有害代谢产物积累[20]。乳杆菌属具有较强的耐酸性,能在pH值较低的环境中生长繁殖[15],同时乳清中乳糖等成分为其生长提供了良好的营养基础,使乳杆菌属成为了自然发酵乳清泡萝卜中绝对优势菌属。未发酵乳清泡萝卜中细菌菌群主要由魏斯氏菌属(Weissella)(77.01%)和芸苔属(Brassica)(21.41%)组成,芸苔属是泡菜原料中植物的质体基因,所以魏斯氏菌属是未发酵乳清泡萝卜中的主要优势菌属。厚壁菌门和变形菌门(Proteobacteria)是未发酵乳清泡萝卜中微生物群落的主要组成部分。其中,魏斯氏菌属是厚壁菌门中产酸和产生风味物质的主要菌属之一,其可能产生的胞外多糖有改善泡菜质地等作用[21-22]。未发酵乳清泡萝卜具有低盐(4%盐含量)、厌氧且富含乳糖的特点,可能较适合魏斯氏菌属生长和繁殖[19],使魏斯氏菌属成为了未发酵乳清泡萝卜中的主要优势菌属。对比不同发酵时间段的菌群,在发酵起始(0 h)时,未发酵乳清泡萝卜中的绝对优势菌属为芸苔属(95.45%),优势菌属为假单胞菌属(Pseudomonas)(1.22%)和不动杆菌属(Acinetobacter)(1.04%),自然发酵乳清泡萝卜中绝对优势菌属为乳杆菌属(99.53%);发酵12 h时,未发酵乳清泡萝卜和自然发酵乳清泡萝卜的绝对优势菌属分别为魏斯氏菌属(98.35%)、乳杆菌属(98.60%);发酵30 h时,未发酵乳清泡萝卜和自然发酵乳清泡萝卜的绝对优势菌属分别为魏斯氏菌属(99.94%)、乳杆菌属(99.26%)。未发酵乳清泡萝卜由于在发酵起始时细菌总量较少,故检测到的主要为泡菜原料中植物质体基因,随着发酵的进行,魏斯氏菌属逐渐成为绝对优势菌群并持续至发酵结束,自然发酵乳清泡萝卜的绝对优势菌属从起始至发酵结束均为乳杆菌属。
由图6b可知,在自然发酵乳清泡萝卜中,瑞士乳杆菌(Lactobacillus helveticus)始终为相对丰度最高的细菌,在发酵0 h、12 h、30 h时的相对丰度分别为99.31%、98.54%、99.26%,始终保持在98%以上,整个发酵过程中有效抑制了其他杂菌的出现。研究团队前期对自然发酵乳清高通量测序结果也显示,其中稳定的细菌菌群以L.helveticus为主,可见其在泡萝卜发酵过程中仍能保持菌群结构稳定。而未发酵乳清泡萝卜中没有L.helveticus出现,起始阶段发酵体系中细菌浓度较低,减除植物质体基因后,检测到的细菌总体相对丰度约4.55%;发酵12 h和30 h时,食窦魏斯氏菌(Weissella cibaria)成为相对丰度最高的细菌,相对丰度分别为98.21%、99.06%。L.helveticus可提高发酵食品中乙醛和其他香气成分的含量[23],对人体健康有益[24-26],还有利于抑制加工过程中有害微生物的生长[27-28]。因此,自然发酵乳清泡萝卜有利于保持菌群稳定,在缩短发酵时间的基础上,使泡萝卜具有一定的风味和健康品质。
2.3 泡萝卜样品在发酵过程中真菌菌群高通量测序结果
2.3.1 泡萝卜样品在发酵过程中真菌菌群测序数据质量评估及OTU分析
自然发酵乳清泡萝卜发酵0 h、12 h、30 h的样本F0、F12、F30,未发酵乳清泡萝卜发酵0 h、12 h、30 h的样本N0、N12、N30,这6个样本的识别CCS数(Raw-CCS)为7 396~7 585个,识别并去除引物后的序列数(Clean CCS)为6 553~6 710条;经长度过滤且去除嵌合体后用于后续分析的序列数(Effective-CCS)为6 519~6 675条;样品平均序列长度(AvgLen)为521~594 bp;Effective-CCS占Raw-CCS的百分比(Effective)为87.67%~88.86%。说明测序数据质量较好,可用于后续分析。
泡萝卜样品在发酵过程中真菌菌群OTU数目花瓣图见图7。由图7可知,6个样本总的OTU数目为348,其中自然发酵乳清泡萝卜样本F0、F12、F30的OTU数目分别为99、83、193,未发酵乳清泡萝卜样本N0、N12、N30的OTU数目分别为85、101、80。自然发酵乳清泡萝卜样本F30的OTU数目最多,其余样本OTU数目为80~101。所有样本共有的OTU数目为9,N0、N12、N30、F0、F12、F30各个样本特有的OTU数目分别为46、23、18、15、17、93。
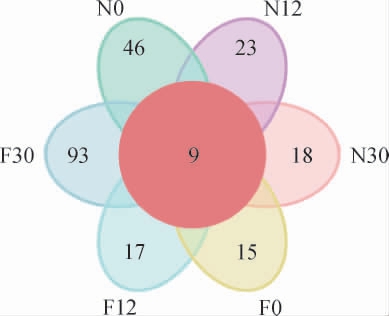
图7 不同泡萝卜样品在发酵过程中真菌菌群操作分类单元数目花瓣图
Fig.7 Petal diagram of operational taxonomic unit numbers of fungal flora in different pickled radish samples during fermentation process
2.3.2 泡萝卜样品在发酵过程中真菌菌群Alpha多样性分析
泡萝卜样品在发酵过程中真菌菌群Alpha多样性分析结果见表2。由表2可知,所有样本的覆盖率均>0.99,说明本次测序得到的数据基本能够真实反映样本实际情况。自然发酵乳清泡萝卜的Ace指数和Chao1指数呈先下降后上升趋势,在30 h时物种丰富度最高,Ace指数和Chao1指数分别达到了196.22和198.00,Simpson指数和Shannon指数则逐渐升高,变化范围分别为0.64~0.83、2.22~4.89,说明其物种多样性逐渐增高。未发酵乳清泡萝卜的Ace指数和Chao1指数呈先上升后下降趋势,但变化幅度不大,Simpson指数和Shannon指数升高后基本保持在稳定数值,分别为0.97和5.73,说明其物种多样性逐渐趋于稳定。总体上看,未发酵乳清泡萝卜物种多样性较自然发酵乳清泡萝卜高。
表2 泡萝卜样品在发酵过程中真菌菌群Alpha多样性分析结果
Table 2 Alpha diversity analysis results of fungal flora in different pickled radish samples during fermentation process
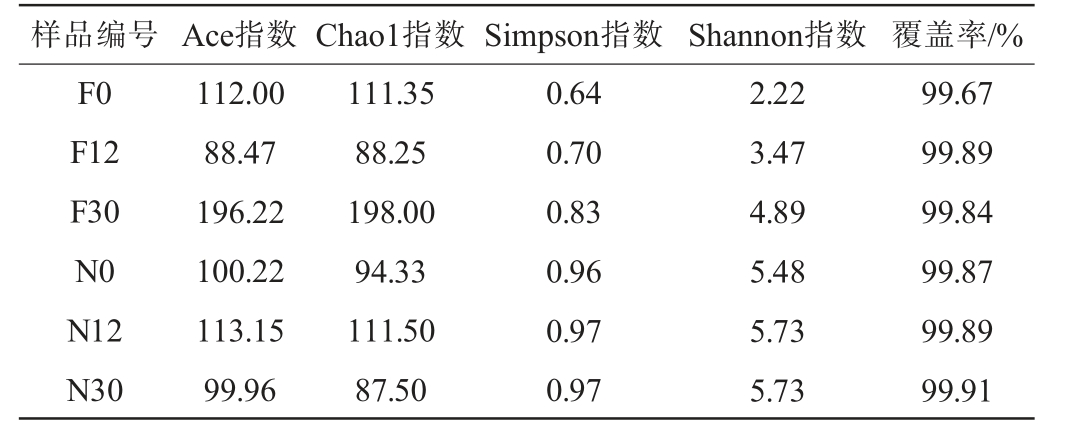
样品编号 Ace指数Chao1指数Simpson指数 Shannon指数 覆盖率/%F0 F12 F30 N0 N12 N30 112.00 88.47 196.22 100.22 113.15 99.96 111.35 88.25 198.00 94.33 111.50 87.50 0.64 0.70 0.83 0.96 0.97 0.97 2.22 3.47 4.89 5.48 5.73 5.73 99.67 99.89 99.84 99.87 99.89 99.91
2.3.3 泡萝卜样品在发酵过程中真菌菌群结构分析
泡萝卜样品在发酵过程中基于属、种水平的真菌菌群结构见图8。主要显示了平均相对丰度前十的物种,其他物种合并为Others,Unclassified代表未得到分类学注释的物种。由图8a可知,自然发酵乳清泡萝卜中平均相对丰度前3的真菌属分别为毕赤酵母属(Pichia)(49.99%)、假丝酵母属(Candida)(9.60%)、丝孢酵母属(Trichosporon)(5.14%),其他优势菌属(平均相对丰度>1%)有曲霉属(Aspergillus)(4.28%)、枝孢属(Cladosporium)(3.16%)、镰孢菌属(Fusarium)(2.36%)、红菇属(Russula)(1.92%)、被孢霉属(Mortierel la)(1.85%)、线黑粉菌属(Filobasidium)(1.09%)。其中,毕赤酵母属、假丝酵母属、曲霉属、枝孢属及镰孢菌属均属于子囊菌门(Ascomycota)。未发酵乳清泡萝卜中真菌物种较为复杂,平均相对丰度>1%的优势菌属为16种,其中,相对丰度排名前3的真菌属分别为镰孢菌属(7.23%),枝孢属(7.04%),红菇属(5.45%),其他优势菌属的平均相对丰度为1.01%~4.48%。这些菌属大部分属于子囊菌门和担子菌门(Basidiomycota)。对比不同发酵时间段的菌群,在发酵起始(0 h)时,未发酵乳清泡萝卜中的优势真菌属有23种,相对丰度最高的为桑帕约氏酵母属(Sampaiozyma)(11.91%),其余优势菌属如镰孢菌属、枝孢属及青霉属(Penicillium)等相对丰度为1.06%~8.91%,自然发酵乳清泡萝卜中优势菌属为毕赤酵母属(53.22%)、假丝酵母属(23.15%)和丝孢酵母属(15.40%);发酵12 h时,未发酵乳清泡萝卜中的优势菌属有18种,相对丰度最高的为红菇属(9.69%)和曲霉属(9.09%),其余优势菌属如枝孢属、镰孢菌属及假丝酵母属等相对丰度为1.04%~6.92%,自然发酵乳清泡萝卜中优势菌属有8种,毕赤酵母属相对丰度(54.45%)最高,其余优势菌属如枝孢属、曲霉属及红菇属等相对丰度为1.43%~5.76%;发酵30 h时,未发酵乳清泡萝卜中的优势菌属有18种,相对丰度最高的是枝孢属(8.89%),其余优势菌属如镰孢菌属、红菇属及假小囊菌属(Pseudaleuria)等相对丰度为1.05%~7.98%,自然发酵乳清泡萝卜中优势菌属有9种,毕赤酵母属(42.08%)相对丰度最高,其余优势菌属如曲霉属、假丝酵母属及镰孢菌属等相对丰度为1.06%~7.25%。未发酵乳清泡萝卜在整个发酵过程中优势菌属较多,自然发酵乳清泡萝卜在发酵过程中优势菌属逐渐增多,但毕赤酵母属始终为相对丰度最高的真菌属。
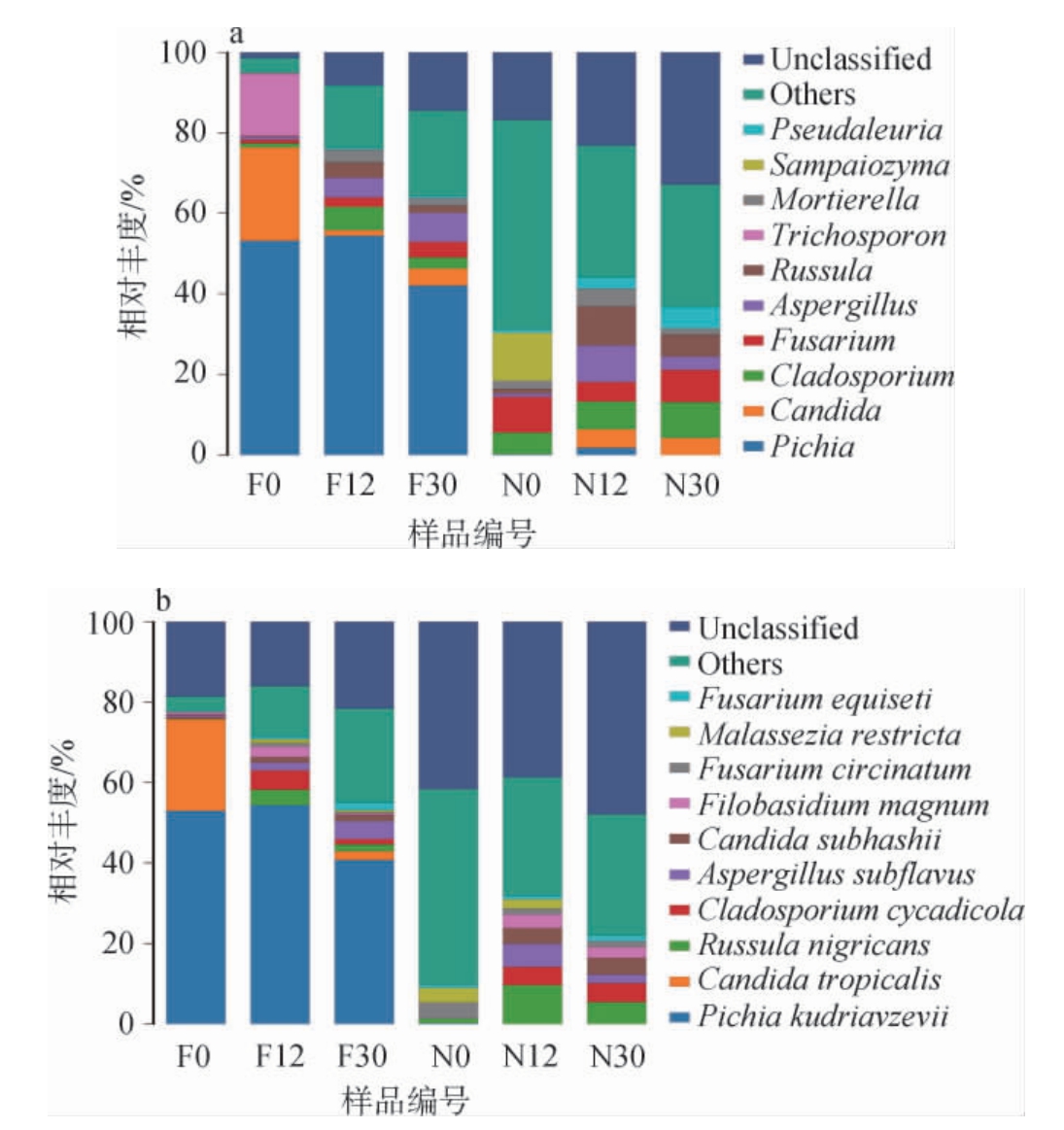
图8 基于属水平(a)及种水平(b)不同泡萝卜样品在发酵过程中的真菌群落结构
Fig.8 Fungal community structure of different pickled radish samples during fermentation process based on genus level (a) and species level (b)
由图8b可知,在自然发酵乳清泡萝卜中库德毕赤酵母(Pichia kudriavzevii)始终为相对丰度最高的真菌,研究团队前期对自然发酵乳清中真菌的高通量测序结果发现菌群以库德毕赤酵母为主,可见其在泡萝卜发酵过程中仍能维持菌群结构的稳定性。在发酵0 h、12 h、30 h时,P.kudriavzevii的相对丰度分别为53.00%、54.42%、40.80%,呈先少量增加后减少趋势,有效减少了其他杂菌。P.kudriavzevii有发酵风味多样化的特点[31-32],同时具有较强的耐渗透压、耐酸、耐高温和耐酒精等多重耐受性[33-34],还有去除生物胺、重金属等有害物质的潜力[35-36]。由于乳清中营养成分丰富,真菌生长条件好,发酵起始时(N0)松树脂溃疡病菌(Fusarium circinatum)(4.01%)、限制性马拉色菌(Malassezia restricta)(3.63%)、稀褶黑菇(Russula nigricans)(1.11%)及木贼镰刀菌(Fusarium equiseti)(0.64%)相对丰度较高,以上4种真菌在萝卜发酵中均不起关键作用[29-30]。未发酵乳清泡萝卜在发酵12 h和30 h时,Others和Unclassified的相对丰度之和分别为68%、78%。其几乎没有P.kudriavzevii。此外,热带假丝酵母(Candida tropicalis)仅在自然发酵乳清泡萝卜中出现,未发酵乳清泡萝卜整个发酵周期内均没有出现该物种,C.tropicalis能够产生柠檬酸、木糖醇等代谢产物,对于泡萝卜风味提升有一定作用[37]。由此可见,自然发酵乳清泡萝卜中真菌以P.kudriavzevii为主,菌群耐受度较好,能减少杂菌污染,避免有害代谢物产生,确保快速、可控的完成萝卜发酵,还能使产品获得多样化的风味。
通过对泡萝卜在发酵过程中微生物菌群结构和动态变化分析,发现自然发酵乳清泡萝卜中细菌以L.helveticus相对丰度最高,真菌以P.kudriavzevii为主,以这两种微生物构成的优势菌群使发酵体系具有更加稳定的菌群结构。L.helveticus产酸较快,发酵速率高,利于泡菜快速成熟,还能对人体健康有一定的有益效果,而P.kudriavzevii具有发酵风味多样化、多重耐受性的特点,还具有去除有害物质的潜力。结合团队前期研究,利用企业制作乳扇析出的乳清,经巴氏杀菌去除部分微生物后,在室温下自然发酵,经高通量测序发现其微生物菌群以L.helveticus和P.kudriavzevii为主要组成部分,故将自然发酵乳清运用于泡萝卜中,产生了有益效果。在乳制品自然发酵过程中乳酸菌和酵母共存并不偶然,酵母和乳酸菌在共同发酵时可能存在着相互促进生长和调节等作用机制,并且对食品风味有一定的提升效果[38]。但由于发酵原料、环境因素等差距,起到关键作用的菌种不尽相同,根据具体的发酵食品种类,针对酵母和乳酸菌的互作机制进行探索是下一步研究的方向。
3 结论
以盐水、未发酵乳清和自然发酵乳清泡萝卜(样品编号分别为C、N、F)为研究对象,对其发酵过程pH值、总酸、亚硝酸盐含量、脆性及微生物多样性进行测定和分析。结果发现样品F品质较好,发酵6 h可达发酵成熟(pH值<4),此时总酸含量为1.5%,脆性为28 N,未检出亚硝酸盐。微生物多样性分析结果表明,样品N细菌和真菌物种多样性均比样品F要高,样品F菌群结构较稳定。样品F发酵过程中绝对优势细菌属、种分别为乳杆菌属(Lactobacillus)、瑞士乳杆菌(Lactobacillus helveticus)(相对丰度>95%);优势真菌属为毕赤酵母属(Pichia)、假丝酵母属(Candida)、丝孢酵母属(Trichosporon)等(相对丰度>1%),优势真菌种为库德毕赤酵母(Pichia kudriavzevii)(相对丰度>40%)。自然发酵乳清能稳定泡萝卜菌群结构,减少杂菌,提高发酵效率,提升泡萝卜品质。
[1]ZHANG X R,LI Y X,ZHAO Y R,et al.Effect of Levilactobacillus brevis as a starter on the flavor quality of radish paocai[J].Food Res Int,2023,168:112780.
[2]BANGAR S P,SURI S,TRIF M,et al.Organic acids production from lactic acid bacteria:A preservation approach[J].Food Biosci,2022,46:101615.
[3]YANG X Z, HU W Z, XIU Z L, et al.Microbial community dynamics and metabolome changes during spontaneous fermentation of northeast sauerkraut from different households[J].Front Microbiol,2020,11:01878.
[4]GONZÁLEZ-WELLER D, PAZ-MONTELONGO S, BETHENCOURTBARBUZANO E,et al.Proteins and minerals in whey protein supplements[J].Foods,2023,12(11):2238.
[5]WUBSHET A W.Characterization of dairy waste whey and its'utilization for the production of ethanol[J].Am J Chem Eng,2021,9(5):112-118.
[6]GANTUMUR M A,SUKHBAATAR N,JIANG Q W,et al.Effect of modified fermented whey protein fortification on the functional,physical,microstructural,and sensory properties of low-fat yogurt[J].Food Control,2024,155:110032.
[7]丰贵江.大理乳扇酸乳清乳酸菌分离鉴定及生物活性研究[D].昆明:云南农业大学,2023.
[8]CUI H P,CHEN F,YU J Y,et al.Accurate pH decrease induced inactivation of myrosinase and polyphenol oxidase in salted radish for color improvement[J].Food Biosci,2023,53:102703.
[9]云琳,毛丙永,崔树茂,等.不同发酵方式对萝卜泡菜理化特性和风味的影响[J].食品与发酵工业,2020,46(13):69-75.
[10]王文建,闵锡祥,李兰英,等.川式泡菜、韩式泡菜发酵过程中理化特性及微生物变化比较[J].食品科技,2020,45(6):6-10,17.
[11]经骐源,李婷,曾凡坤,等.发酵剂对泡萝卜品质的影响[J].食品科学,2021,42(22):171-177.
[12]SALLAN S, YILMAZ ORAL Z F, KAYA M.A review on the role of lactic acid bacteria in the formation and reduction of volatile nitrosamines in fermented sausages[J].Foods,2023,12(4):702.
[13]王馨蕊,李宏,马伊然,等.云南新平腌菜发酵过程中品质变化规律[J].食品与机械,2022,38(1):200-204,216.
[14]王馨蕊,汤回花,刘毕琴,等.发酵蔬菜中亚硝酸盐的控制技术研究进展[J].云南农业科技,2021(5):62-64.
[15]刘鑫,王家旺,隋雨萌,等.中国传统发酵蔬菜中微生物多样性及其对品质形成影响研究进展[J].食品科学,2024,45(10):290-297.
[16]张雁斌,吴珊,李芷茜,等.黄油乳清组分分析与乳化特性评价[J].农业机械学报,2023,54(11):412-420.
[17]王悦,李丽娜,彭天舒,等.佤族水酒发酵过程中的微生物菌群结构分析[J].中国酿造,2024,43(5):75-80.
[18]宋建阳,岑定运,梁莉莹,等.南阳红谷黄酒发酵过程中挥发性风味物质与微生物群落相关性分析[J].中国酿造,2023,42(8):135-139.
[19]SUN X H,QI X,HAN Y D,et al.Characteristics of changes in volatile organic compounds and microbial communities during the storage of pickles[J].Food Chem,2023,409:135285.
[20]XIANG W L,ZHANG N D,LU Y,et al.Effect of Weissella cibaria coinoculation on the quality of Sichuan Pickle fermented by Lactobacillus plantarum[J].LWT-Food Sci Technol,2020,121:108975.
[21]ZHANG Y M,YAN H Y,XU X X,et al.Metagenomic/metaproteomic investigation of the microbiota in Dongbei Suaicai,a traditional fermented Chinese cabbage[J].Ferment,2024,10(4):185.
[22]张楠笛,祝林,许琴,等.食窦魏斯氏菌协同植物乳杆菌改善四川泡菜风味[J].食品科学,2020,41(14):102-108.
[23]SIÇRAMAZ H,GÜVEN O T,CAN A,et al.Impact of different starter cultures and Lactobacillus helveticus on volatile components, chemical and sensory properties of pasta filata cheese[J].Curr Res Food Sci,2022,5:1009-1016.
[24]ZAVIŠIC′ G,RISTIC′ S,RIKALOVIC′ M,et al.Beneficial effects of probiotic supplementation on glucose and triglycerides in a mouse model of metabolic syndrome[J].J Funct Foods,2022,95:105167.
[25]RODE J,CARLMAN H M T,KÖNIG J,et al.Probiotic mixture containing Lactobacillus helveticus,Bifidobacterium longum and Lactiplantibacillus plantarum affects brain responses toward an emotional task in healthy subjects:a randomized clinical trial[J].Front Nutr,2022,9:827182.
[26]WANG X M, XU M J, XU D L, et al.Structural and prebiotic activity analysis of the polysaccharide produced by Lactobacillus helveticus SNA12[J].Carbohydr Polym,2022,296:119971.
[27]ANGELESCU I R,GROSU-TUDOR S S,COJOC L R,et al.Isolation,characterization,and mode of action of a class III bacteriocin produced by Lactobacillus helveticus 34.9[J].World J Microbiol Biotechnol,2022,38(12):220.
[28]LIU G, KRAGH M L, AABO S, et al.Inhibition of virulence gene expression in Salmonella Dublin,Escherichia coli F5 and Clostridium perfringens associated with neonatal calf diarrhea by factors produced by lactic acid bacteria during fermentation of cow milk[J].Front Microbiol,2022,13:828013.
[29]谢胜军,郑诗倩,潘敬灵,等.柠檬醛对马拉色菌所致豚鼠皮肤感染的止痒作用[J].中国皮肤性病学杂志,2022,36(11):1240-1245.
[30]杨晓蕾,李建宏,姚拓,等.木贼镰刀菌拮抗菌株的筛选及特性[J].草业科学,2022,39(7):1333-1340.
[31]王德培,胡阳,焦富.库德里阿兹威氏毕赤酵母在发酵工业中的研究进展[J].酿酒科技,2021(6):95-101.
[32]张丽.产清香风味酵母菌株FJZ的筛选鉴定及应用研究[D].晋中:山西农业大学,2020.
[33]贾丽艳,张丽,李惠源,等.果香风味导向的库德毕赤酵母FJZ的分离鉴定及生物学特性研究[J].中国食品学报,2021,21(1):276-282.
[34]林良才,白茹,高滢,等.高耐性库德里阿兹威氏毕赤酵母的筛选及应用[J].食品与发酵工业,2023,49(3):60-67.
[35]朱翠翠,王海英,赵玉莹,等.鱼露中组胺降解菌的分离筛选及耐受性[J].食品与生物技术学报,2022,41(3):8-15.
[36]徐婉莹,戚晓雪,何晓霞,等.逆境对GST基因过表达库德毕赤酵母G43生长及脱镉能力的影响[J].食品安全质量检测学报,2022,13(11):3620-3626.
[37]曹华金,王艳菊.碳源类型对热带假丝酵母水解产有机酸性能的影响[J].河南科技,2020(22):102-105.
[38]廖一漠,敖晓琳,康海燕,等.传统发酵食品中乳酸菌与酵母菌互作机制研究进展[J].食品与发酵工业,2023,49(3):340-346.