浆面条是洛阳颇具浓厚地方特色的传统美食,因其不仅味道鲜美、制作简单,还能驱逐寒气、健胃消食,自古以来流传不衰[1-2]。浆面条与普通面条的区别是煮面条时用一种发酵的绿豆酸浆代替清水。洛阳酸浆面以绿豆磨浆除渣后经自然发酵而成,含有多种氨基酸、矿物元素及活性物质,营养丰富[3-4]。
绿豆酸浆水是通过多种微生物共同发酵而成的酸性食品,其中的优势菌群为乳酸菌和酵母菌等,发酵过程中所产生的各种代谢产物对浆水风味、口感等影响较大[5]。传统浆水发酵微生物菌系复杂,主要包括枯草芽孢杆菌、醋酸菌、乳酸菌、酵母菌、霉菌等,其中优势菌群为乳酸菌和酵母菌,且乳酸菌多为厌氧或兼性厌氧菌株[6-7]。范鑫诺等[8]对洛阳传统绿豆酸浆的细菌群落组成研究确定了优势的菌属为乳杆菌属(Lactobacillus)和乳球菌属(Lactococcus),优势菌种为植物乳植杆菌(Lactiplantibacillus plantarum)、弯曲乳杆菌(Lactobacillus curvatus)、食木薯乳杆菌(Lactobacillus manihotivorans)。
近年来,对浆水的研究主要集中在微生物的分离鉴定[9-10]、发酵过程控制[11-12]、发酵工艺以及营养成分的研究[13-14]等方面,ZHANG J等[15]采用传统纯培养、现代分子生物学技术研究发现,不同地区的浆水中优势菌群比较相似,但其菌种种类差别较大,各地区浆水组成并不一致。目前,浆水的制作以家庭自制为主,受环境因素影响较大,产品质量不稳定,可能存在腐败菌甚至致病菌污染的情况[16-17]。虽已有洛阳酸浆的发酵微生物群落组成的相关研究报道,但缺乏对于其优势发酵乳酸菌的发酵性能测定以及安全性评价的相关研究。分析不同来源传统浆水中微生物菌群组成,对于深度挖掘有益微生物资源具有重要现实意义。
本实验采用稀释涂布法,从洛阳地区自然发酵绿豆酸浆水中分离筛选乳酸菌菌株,对筛选菌株进行形态学观察及分子生物学鉴定,并对其进行生长特性、耐受性、体外抗氧化活性、产酸特性及安全性进行检测。以期为洛阳传统绿豆酸浆发酵菌种的高效安全生产提供具潜在应用价值的菌株,并为洛阳绿豆浆水的现代化发展给予理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
浆水:河南洛阳工业区小街锅贴浆坊(绿豆)、嵩县饭坡镇浆坊(红薯)、嵩县饭坡镇浆坊(绿豆)、嵩县饭坡镇浆坊(豌豆)、嵩县丁记卤肉浆坊(绿豆)、瀍河区浆坊(绿豆)、瀍河区静香阁浆坊(绿豆)、瀍河区张家浆坊(绿豆)、老河区浆坊采集(绿豆)。
1.1.2 试剂
酵母浸粉(生化试剂):安琪酵母有限公司;蛋白胨、琼脂、牛肉膏(均为生化试剂)、色氨酸、苯丙氨酸、组氨酸、赖氨酸、酪氨酸、精氨酸(均为色谱纯):北京奥博星生物技术有限责任公司;葡萄糖、磷酸氢二钾、乙酸钠、无水乙醇、溴甲酚紫、酚酞、吐温80(均为分析纯):天津市科密欧化学试剂有限公司;无水硫酸镁、氢氧化钠、氯化镁(均为分析纯):天津市德恩化学试剂有限公司;氯化铵、柠檬酸铵、硫酸锰、邻苯二甲酸氢钾(均为分析纯):国药集团化学试剂有限公司;磷酸吡哆醛(分析纯):上海麦克林生化科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力试剂盒、超氧阴离子自由基清除能力测定试剂盒、羟自由基清除能力测定试剂盒:南京建成生物工程研究所。
1.1.3 培养基
MRS肉汤培养基:1 000 mL蒸馏水、蛋白胨10 g、牛肉膏8 g、酵母浸粉4 g、葡萄糖20 g、柠檬酸铵5 g、硫酸镁0.2 g、乙酸钠5 g、磷酸氢二钾2 g、硫酸锰0.15 g、吐温80 1 mL、调pH值为6.0~6.4。115 ℃灭菌30 min。
1.2 仪器与设备
QYC-2112B全温培养摇床:上海新苗医疗器械制造有限公司;PHS-3C酸度计:上海仪电科学仪器股份有限公司;5430R高速大容量离心机:艾本德国际贸易有限公司;YXQLS-50SII立式压力蒸汽灭菌器、BPS-150生化培养箱:上海博迅医疗生物仪器股份有限公司;MP2002电子分析天平:上海舜宇恒平科技仪器公司;GZX-DH.400BS电热恒温干燥箱:上海跃进医疗器械有限公司;S1000聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;DYY-BC电泳仪:北京六一仪器厂;UV-2700i紫外可见分光光度计:日本岛津公司;Victor Nivo多模式读板仪:美国Perkinelmer公司;JY04S-3C凝胶成像仪:北京君意东方电泳设备有限公司;SCIENTZ-IID超声波细胞粉碎机:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 乳酸菌的分离
参考程驰新笑等[18]方法并稍作修改,在无菌条件下吸取适量浆水与无菌水混合,制成菌悬液后按10 倍梯度稀释,将菌悬液涂布于相应的培养基中,并于培养箱中培养48 h后挑选疑似乳酸菌菌落分离纯化2~3 次,对单菌落进行编号,并保藏备用。
活化菌种:超低温冰箱中取出菌种,迅速放入30 ℃水浴中快速解冻,以恢复细菌活性。将试验菌株按照1%的接种量接种于MRS 液体培养基,在37 ℃培养箱中培养活化,传至3代。
菌株菌悬液的制备:将活化菌株按照1%的接种量接种于MRS 液体培养基,在37 ℃培养箱中培养12 h,稀释调节OD600nm值为0.5左右,即得该菌株的菌悬液。
1.3.2 菌株形态学观察
根据胡此海等[19]的方法对乳酸菌的进行形态学观察鉴定。
1.3.3 菌株分子生物学鉴定
挑取纯化后的菌株接种于10 mLMRS培养基中,于30 ℃条件下静置培养16 h后,5 000×g离心5 min收集菌体,随后参照细菌基因组快速提取试剂盒的说明提取目标菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)。利用细菌16S rRNA 基因通用引物27F(5'-AGAGTTTGATC CTGGCTCAG-3')和1492R(5'-AGAGTTTGATCCTGGCTCAG-3')对其基因组进行PCR扩增。PCR扩增体系(50 μL):DNA模板(质量浓度为100 ng/μL)1 μL,上、下游引物(10 μmol/L)各2 μL,双蒸水(ddH2O)20 μL,2×phanta-Max Master Mix 25 μL。PCR扩增程序:95 ℃3 min;95 ℃15 s,55 ℃15 s,72 ℃90 s,循环30次;72 ℃5 min。PCR扩增得到的片段经凝胶电泳验证后,交由擎科生物科技有限公司测序。测序所得16SrRNA基因序列提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)中进行基本局部比对搜索工具(Basic Local Alignment Search Tool,BLAST)比对以进行同源性分析。筛选乳酸菌的16S rDNA基因序列在GenBank数据库中进行对比,用MEGA7.0软件中的Clustal W工具对最近类群的序列进行多重比较分析,并通过邻近(neighbor-joining,NJ)法构建系统发育树,确定各菌株分类地位。
1.3.4 生长曲线的测定
参考吕嘉伟等[20]的方法并稍作修改,将初筛的疑似乳酸菌菌株在MRS液体培养基中37 ℃培养24 h,每1 h 通过酶标仪于波长600 nm条件下测定吸光度值。
1.3.5 菌株耐受性测定
(1)耐盐性
参考胡此海等[19]的方法并稍作修改。在MRS肉汤培养基中加入2%、4%、6%、8%、10%NaCl,按1%接种量接种试验菌株菌悬液,37 ℃下静置培养15 h后于波长600 nm条件下测定各组的吸光度值(OD600nm值)。
(2)耐酸性
参考巴克尔拜的试验方法[21],将试验菌株菌悬液按照1%的接种量分别接入到pH值为5.0、4.5、4.0、3.5、3.0的MRS液体培养基中(1 mol/L 的盐酸调节pH值),在37 ℃静置条件下培养24 h,于波长600 nm条件下测定各组的OD600 nm值。以未接种相应pH值的MRS液体培养基作为对照,挑选对酸具有较好耐受能力的乳酸菌。
(3)耐人工胃肠液性
参考雷雪艳等[22]的方法并稍作修改。将纯化后获得的乳酸菌活化至3代,吸取1 mL含菌培养基于1.8 mL的无菌离心管中,经4 500 r/min离心4 min后,弃去上层培养基,加入1 mL无菌水混匀后再次进行4 500 r/min离心4 min制成菌体悬浮液,取500 μL将其进行梯度稀释,在10-5、10-6、10-7稀释度进行点样计数,将其按10%的接种量接种到模拟胃液(pH 值为3)混匀,37 ℃厌氧培养2 h,取500 μL将其进行梯度稀释,在10-4、10-5、10-6稀释度下点样计数。取上述人工胃液消化2 h后的溶液按10%的接种量接种到人工肠液中,37 ℃静置条件下培养4 h,进行梯度稀释,在10-3、10-4、10-5稀释度点样计数,计算其存活率,其计算公式如下:
式中:N1为经过人工胃肠液培养培养后的乳酸菌数,CFU/mL;N2为经过人工胃肠液培养后的乳酸菌数,CFU/mL;N3为未经过人工胃肠液培养的乳酸菌数,CFU/mL。
(4)耐胆盐性
参考刘震坤等[23]并稍作修改,将培养菌悬液以1%接种量分别接种于胆盐浓度为0、0.1%、0.2%、0.3%、0.4%、0.5%的MRS肉汤培养基中,37 ℃培养3 h,取样测定其OD600nm值,3组重复。
1.3.6 体外抗氧化能力测定
将在37 ℃,培养15 h的菌悬液以1%接种量接种于MRS肉汤中,37 ℃静置培养12 h,传至3代,得到供试菌液,备用。
样品处理:参考任香芸等[24-25]的方法并做稍作修改,供试菌液在4 ℃条件下经4 500 r/min离心4 min,收集上清液,即为菌株发酵液样本。供试菌液在4 ℃条件下经4 500 r/min离心4 min,弃上清,加入等体积无菌水,再经4 ℃条件下经4 500 r/min离心4 min,弃上清,再加入等量无菌水混匀,置于-20 ℃冻存,再解冻反复冻融3次,并用细胞破碎仪进行冰浴超声破碎(150 W,超声6 s,间歇4 s,破碎20 min),12 000 r/min离心10 min,收集上清液,即为无细胞提取物样本。
以0.3 mg/mL维生素C(vitamin,VC)溶液作为阳性对照、MRS肉汤培养基作为空白对照,根据DPPH、羟基自由基清除能力试剂盒测定筛选菌株的体外抗氧化活性。
1.3.7 产酸性能实验
根据ZHENG S S等[26]方法稍作修改。以2%的接种量将24株菌株接入到装有10 mL MRS液体培养基的离心管中37 ℃培养36 h,每间隔6 h测定其pH值,并通过酚酞指示剂法测定乳酸菌的产酸量,每株菌平行测定3 次,结果取平均值。
1.3.8 菌株抗生素敏感性检测
参考姚有莉等[27]方法,将150 mL尚未凝固,温度降至45 ℃的MRS固体培养基与20 mL待检测菌种的菌液混合均匀,倒入无菌平板。等待凝固后,将不同种类抗生素纸片按每个平板3个等距摆放在倒好的平板中,于37 ℃培养48 h后观察是否产生抑菌圈,采用游标卡尺测量抑菌圈直径大小。对照2012年美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)的标准判定菌株抗生素敏感性[28]。
1.3.9 乳酸菌溶血性测定
所有菌株在哥伦比亚血平板上划线,孵育24~48 h,观察菌落周围是否存在溶血圈(α-溶血、β-溶血和γ-溶血)的迹象[29],β-溶血(培养基基本无变化)、α-溶血(菌落周围培养基变为绿色环状)或γ-溶血(菌落周围形成一个清晰透明的环)。
1.3.10 数据处理
试验均进行3 次重复,结果以“平均值±标准差”表示,采用SPSS Statistics 26.0软件对数据进行分析,Origin 2022软件进行绘制图表。
2 结果与分析
2.1 菌株的分离鉴定
从洛阳市场收集到9个酸浆水样品,共分离得到36株菌株,分别编号为L11~L15、L21~L23、L31~L34、L41~L44、L51 ~L53、L61 ~L66、L71 ~L75、L81 ~L83、L91 ~L93。在分离菌株中,剔除形态相似的菌落,挑取形态呈圆形,乳白色,表面光滑,湿润,在MRS固体培养基上呈突起状,边缘整齐的疑似乳酸菌菌株共24株。其中,嵩县饭坡镇浆坊(绿豆)样品中分离得到4种形态不同的菌株,编号为L61、L62、L63、L64;工业区小街锅贴、嵩县饭坡镇浆坊(红薯)、瀍河区浆坊、老城区浆坊、嵩县饭坡镇浆坊(豌豆)五个样品中均分离到3种不同形态的菌株,分别编号为L11、L12、L13、L21、L22、L23、L31、L33、L34、L51、L52、L53、L71、L72、L73;嵩县丁记卤肉和瀍河区静香阁均分离到2种不同形态的菌株,分别编号L82、L83、L91、L93;在瀍河区张家浆坊只分离到1种形态的菌株,编号为L41。
将24株筛选乳酸菌进行菌落及细胞形态观察,代表乳酸菌菌落和细胞形态见图1。
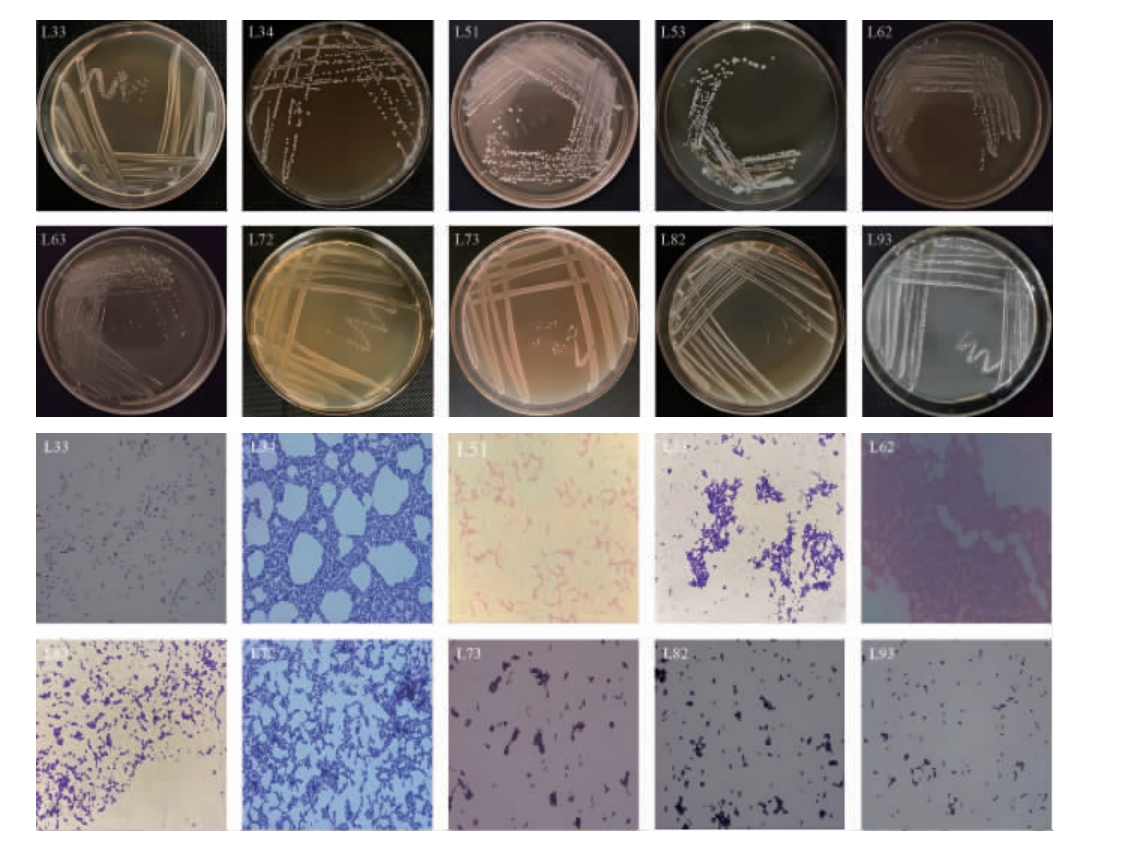
图1 代表菌株的细胞菌落及细胞形态
Fig.1 Colony and cell morphology of representative strains
将24株筛选乳酸菌通过PCR扩增及测序,得到24株乳酸菌的16S rRNA基因序列,结果见表1。由表1可知,经BLAST比对后发现,24株菌与标准菌株的序列相似性均达到99%以上。
表1 筛选菌株的16S rRNA基因序列分析结果
Table 1 Results of 16S rRNA gene sequence analysis of screened strains

样品来源 分离菌株编号 模式菌株 同源性/%工业区小街锅贴浆坊(绿豆)嵩县饭坡镇浆坊(红薯)瀍河区浆坊(绿豆)瀍河区张家浆坊(绿豆)老城区浆坊(绿豆)嵩县饭坡镇浆坊(绿豆)嵩县饭坡镇浆坊(豌豆)嵩县丁记卤肉浆坊(绿豆)瀍河区静香阁浆坊(绿豆)L11 L12 L13 L21 L22 L23 L31 L33 L34 L41 L51 L52 L53 L61 L63 L64 L62 L71 L72 L73 L82 L83 L91 L93戊糖乳酸杆菌(Lactiplantibacillus pentose)发酵乳酸杆菌(Limosilactobacillus fermentum)植物乳植杆菌(Lactiplantibacillus plantarum)植物乳植杆菌(Lactiplantibacillus plantarum)表皮葡萄球菌(Staphylococcus epidermidis)发酵乳酸杆菌(Limosilactobacillus fermentum)发酵乳酸杆菌(Limosilactobacillus fermentum)副干酪乳杆菌(Lacticaseibacillus paracasei)植物乳植杆菌(Lactiplantibacillus plantarum)发酵乳酸杆菌(Limosilactobacillus fermentum)哈尔滨施莱费尔氏乳杆菌(Schleiferilactobacillus harbinensis)植物乳植杆菌(Lactiplantibacillus plantarum)乳明串珠菌(Leuconostoc lactis)植物乳植杆菌(Lactiplantibacillus plantarum)戊糖乳酸杆菌(Lactiplantibacillus pentose)乳明串珠菌(Leuconostoc lactis)短乳杆菌(Levilactobacillus brevis)发酵乳酸杆菌(Limosilactobacillus fermentum)结壳乳杆菌(Companilactobacillus crustorum)乳酸乳球菌(Lactococcus lactis)人葡萄球菌(Staphylococcus hominis)发酵乳酸杆菌(Limosilactobacillus fermentum)副干酪乳杆菌(Lacticaseibacillus paracasei)发酵乳酸杆菌(Limosilactobacillus fermentum)99.93 100 100 100 99.72 100 100 100 99.93 99.93 100 100 100 100 100 100 100 99.73 100 100 100 99.86 99.93 99.73
通过BLAST 比对与系统发育树分析,得到洛阳酸浆中筛选菌株的分离鉴定结果见图2。由图2可知,9份样品中一共分离得到24株乳酸菌,包括10个属,12个种。10个属为乳球菌属(Lactococcus)、乳植杆菌属(Lactiplantibacillus)、乳酪杆菌属(Lacticaseibacillus)、促生乳杆菌属(Levilactobacillus)、粘液乳杆菌(Limosilactobacillus)、明串珠菌属(Leuconostoc)、葡萄球菌属(Staphylococcus)、施莱费尔氏乳杆菌属(Schleiferilactobacillus)、片球菌属(Pediococcus)、伴生乳杆菌属(Companilactobacillus)。12个种中发酵乳杆菌(Limosilactobacillus fermentum)占比最高为29.2%,在7个样品中均有出现;其次是植物乳植杆菌(Lactiplantibacillus plantarum)在5个样品中均有出现;再次是副干酪乳酸杆菌(Lacticaseibacillus paracasei),在2个样品中均有出现。其他菌种在各样品中均只出现一次。
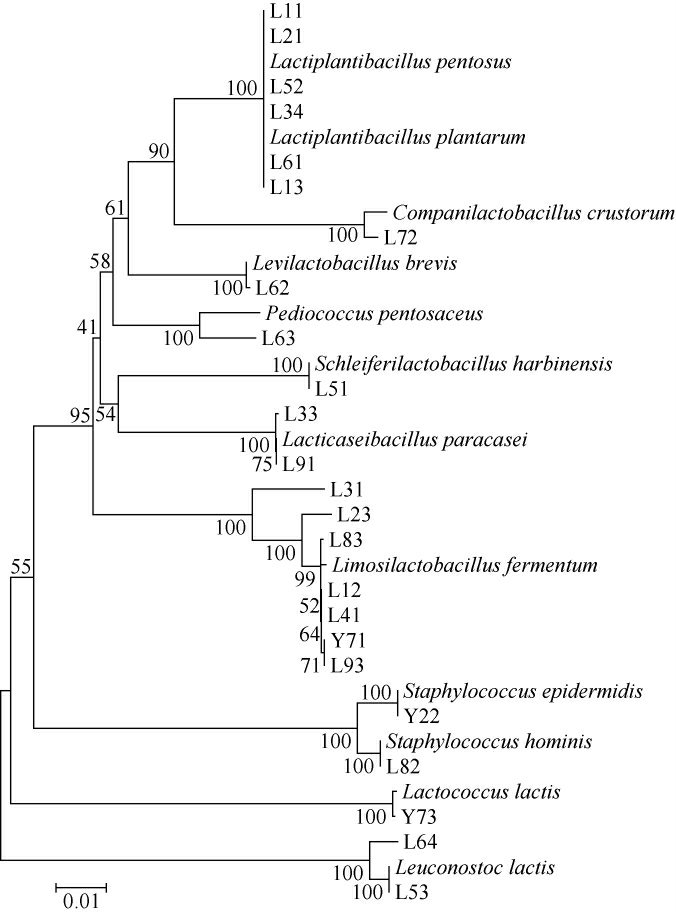
图2 分离乳酸菌菌株基于16S rRNA基因序列系统发育树
Fig.2 Phylogenetic tree of isolated lactic acid bacteria strains based on 16S rRNA gene sequences
2.2 菌株的生长曲线
为了解菌株生长情况,测定24株菌的生长曲线,结果如见图3。由图3可知,大部分菌株生长情况相似,其中菌株L52、L72、L83、L91在6 h后进入稳定期,菌株L12、L13、L21、L23、L31、L41、L51、L53、L61、L63、L64、L71、L73在10 h后进入稳定期,菌株L32、L33、L82在11h后进入稳定期,菌株L11、L22在14 h后进入稳定期。综上,菌株L52、L72、L83、L91进入稳定期时间短,表明其生长迅速。
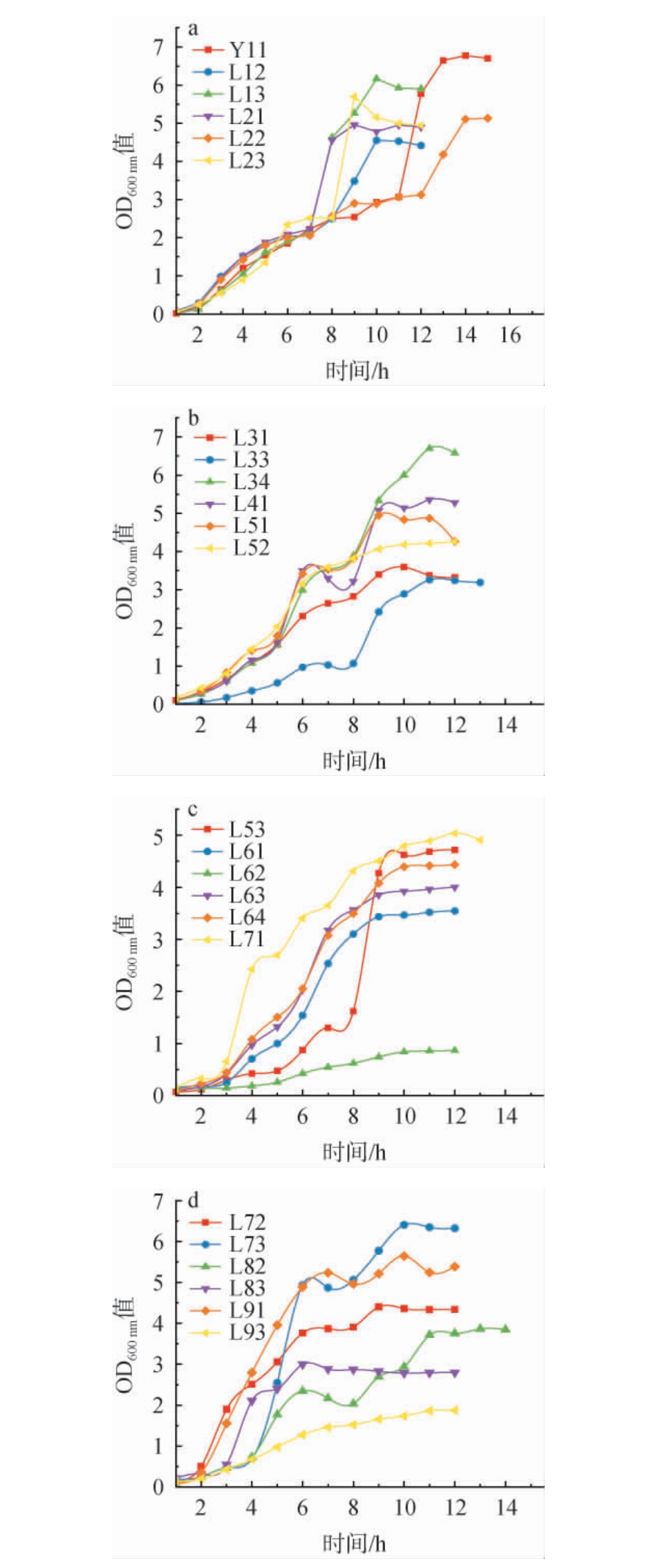
图3 筛选乳酸菌生长曲线
Fig.3 Growth curves of screened lactic acid bacteria
2.3 菌株的耐受性
2.3.1 菌株的盐耐受性
盐含量可以提高发酵液的渗透压,抑制腐败菌的生长,因此,发酵菌株对盐含量的耐受性非常重要[30]。24株乳酸菌盐耐受性试验结果见图4。由图4可知,随着渗透压的增大,各菌株的吸光度值随之下降,表明菌株的生长逐渐受到抑制。大多数菌株在NaCl含量4%左右吸光度值开始明显下降,在8%NaCl含量左右吸光度值接近于零,生长受到完全抑制。菌株L21、L62在NaCl含量6%开始明显下降,菌株L62耐渗透压能力相对较好,菌株L21菌株在NaCl含量10%时生长才受到完全抑制,耐盐能力最强。菌株L12、L52的OD600nm值在NaCl含量4%左右时已明显下降,由此可知菌株L12、L52的耐盐能力较差。
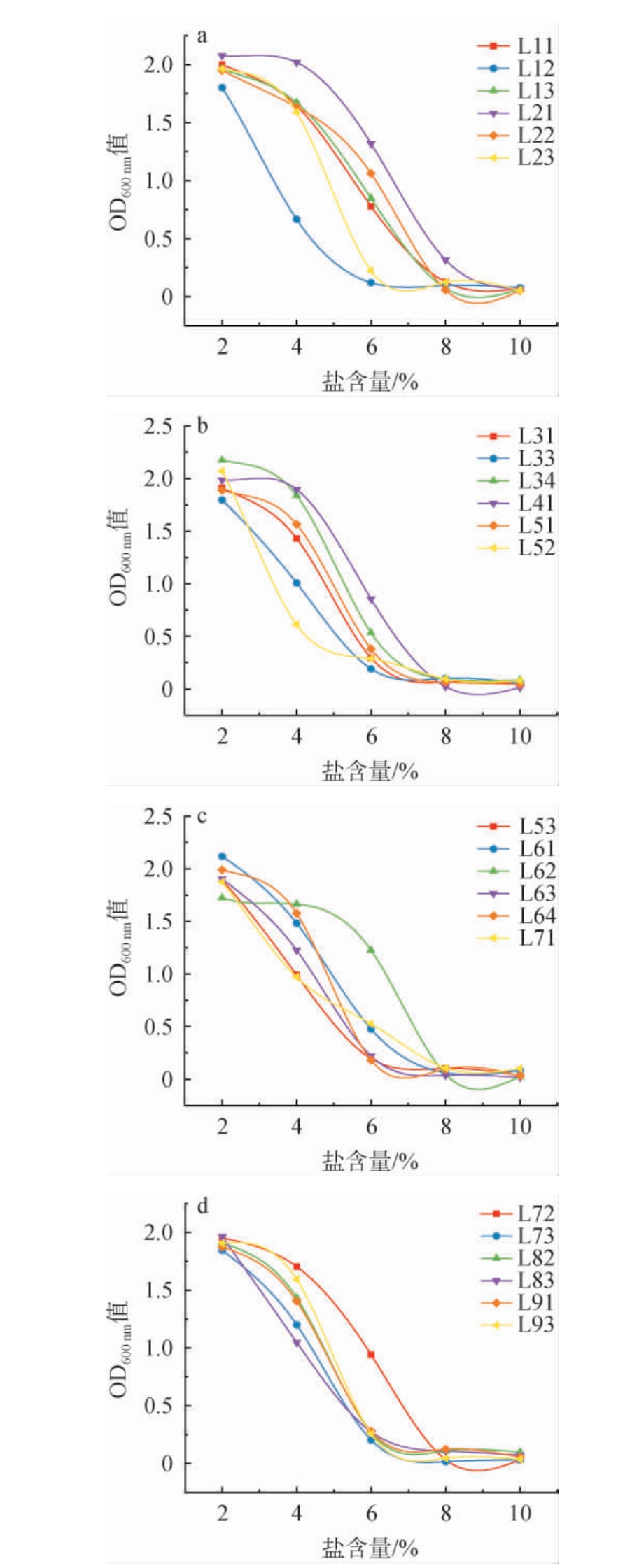
图4 筛选乳酸菌盐耐受性试验结果
Fig.4 Results of salt tolerance tests of screened lactic acid bacteria
2.3.2 菌株的胆盐耐受性
由于菌株或物种的特异性,乳酸菌胆盐耐受性存在显著差异,且高胆汁浓度的抵抗机制存在菌株和物种依赖性[31]。人体肠道内胆盐产生的渗透压会改变乳酸菌细胞膜通透性,使其生长繁殖受到抑制,因而乳酸菌必须具备一定的胆盐耐受性才能在肠道内顺利发挥益生作用[32]。24株乳酸菌胆盐耐受性试验结果见图5。
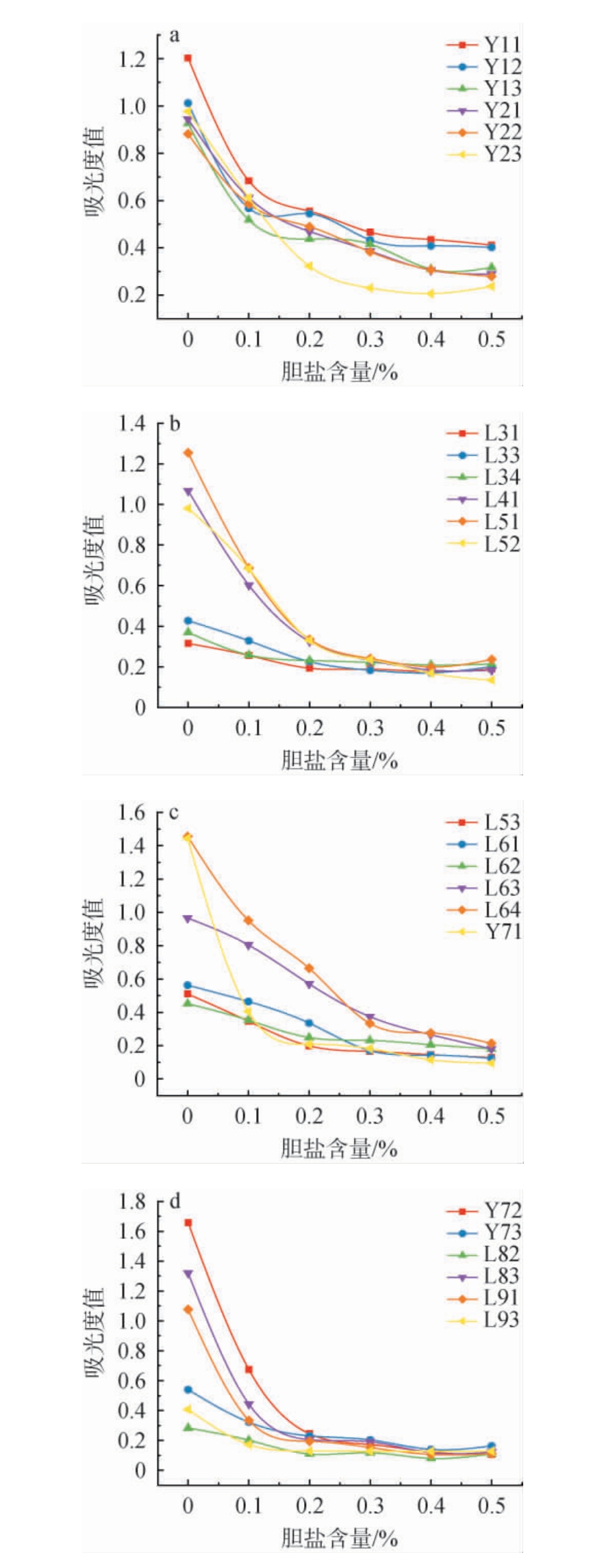
图5 筛选乳酸菌胆盐耐受性试验结果
Fig.5 Results of bile salt tolerance tests of screened lactic acid bacteria
由图5可知,随着胆盐含量的增加,菌体吸光度值逐渐降低,多数菌株在0.2%胆盐含量下生长逐渐受到影响,在0.3%胆盐含量的情况下生长受到完全抑制。菌株L11、L12、L13、L22、L63、L64在胆盐含量0.3%的情况下仍然有一定的生长,在胆盐含量为0.5%时菌株L11、L12的吸光度值明显高于其他株菌。综上,菌株L11、L12、L13、L22、L63、L64为胆盐耐受的优势菌株。
2.3.3 菌株的酸耐受性
乳酸菌作为肠道益生菌,发挥益生功能的基本要求是具备良好的耐酸能力[33]。因此,乳酸菌能够在低pH条件下存活的能力,成为评价其作为益生菌有效性的一个重要指标。24株乳酸菌酸耐受性试验结果见图6。由图6可知,随着pH值的逐渐降低,大部分菌株的吸光度值降低较为明显,显示生长逐渐受到抑制,在pH值为2.5的情况下所有菌株的生长都受到了抑制,大多数菌株在pH值为3.0时生长已受到抑制。菌株L23在pH值为3.5~5.0时吸光度值波动不明显,pH值低于3.5时吸光度值才开始下降,说明该菌株耐酸性较好;菌株L63和L64菌株的吸光度值变化趋势较为缓慢,也说明这两个菌株耐酸性相对来说较好。菌株L12、L13、L22、L53、L83在pH值为3.5时生长已受到抑制,耐酸性能较差。
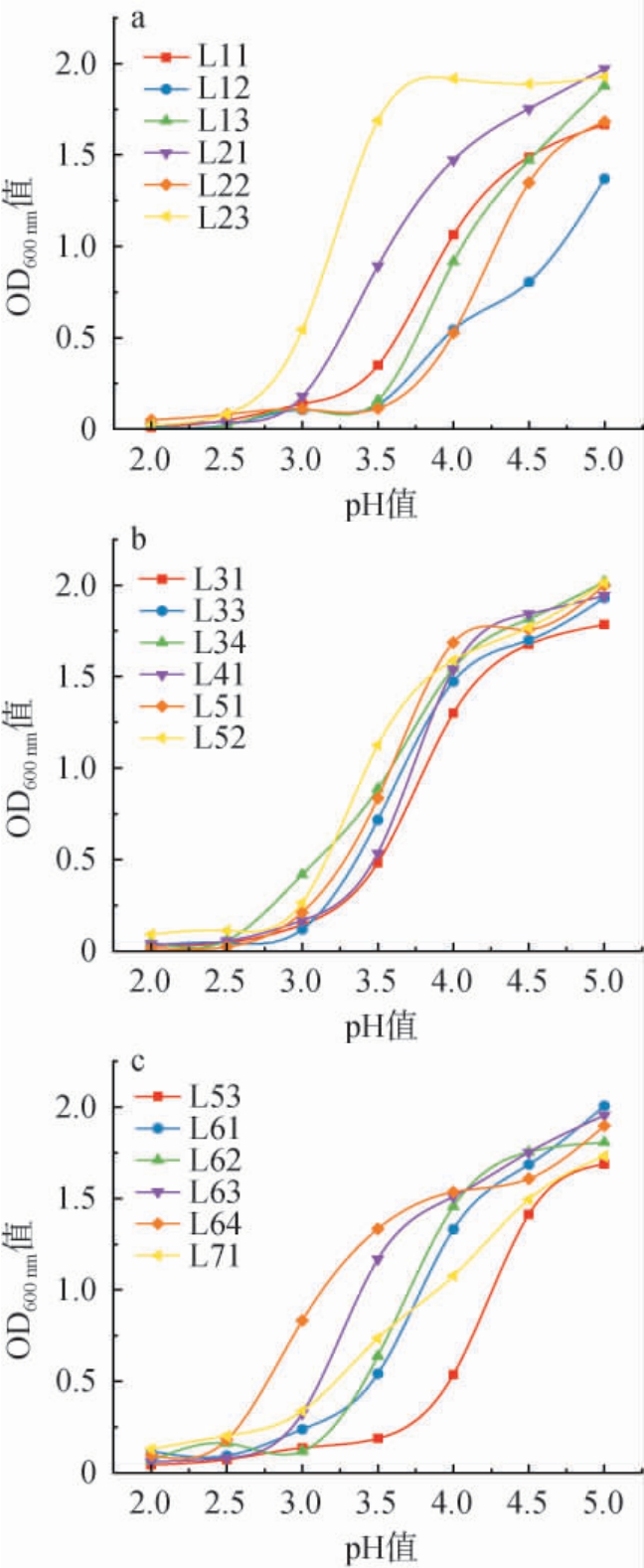
图6 筛选乳酸菌酸耐受性试验结果
Fig.6 Results of acid tolerance tests of screened lactic acid bacteria
2.3.4 菌株的耐人工胃肠液菌株性能测定
人体胃液是低酸性环境,肠液是弱碱性环境,且胃肠液中含有胃蛋白酶等消化酶都能够抑制乳酸菌的生长繁殖,阻碍菌株发挥功能特性[34-36],因而菌株在人体胃肠道内生存能力的强弱是评价乳酸菌益生特性的重要指标之一。对24株菌进行人工胃肠液耐受性试验结果见图7。
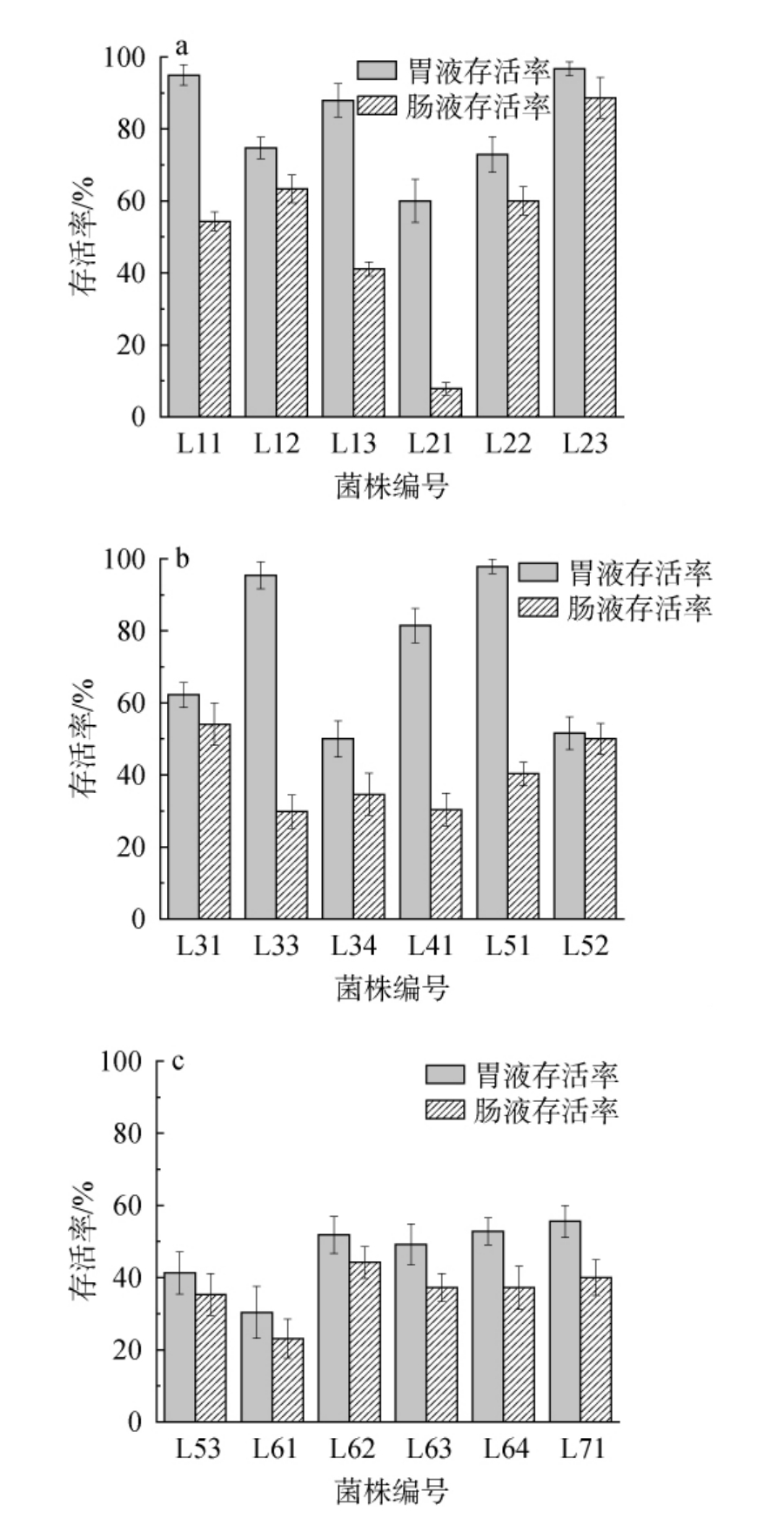
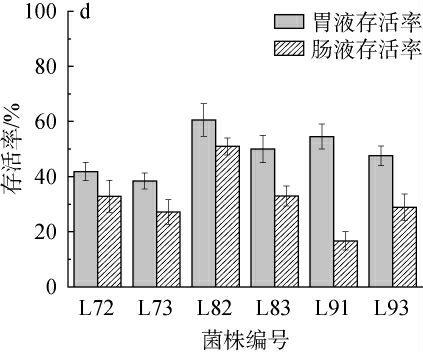
图7 筛选乳酸菌人工胃肠液耐受性试验结果
Fig.7 Results of artificial gastroenteric fluid tolerance tests of screened lactic acid bacteria
由图7可知,菌株在人工胃肠液处理下的存活情况相差较大,多数菌株存活率高于50%,其中菌株L13、L41存活率较高,都高于80%,菌株L51、L23、L32、L11存活率分别为97.9%、96.7%、95.4%、95.0%,耐受性最好。人工胃液处理后,菌株L53、L61、L63、L72、L73、L93存活率低于50%,耐受性较差。人工胃液处理后再经人工肠液处理,大部分菌株存活率低于50.0%,其中菌株L11、L12、L22、L23、L31、L52、L82的存活率高于50.0%,菌株L23的存活率最高,为88.6%,其次是菌株L12、L22,存活率分别为63.4%、60.0%。菌株L21的存活率仅为7.8%,人工胃肠液耐受性最差。综上,菌株L11、L12、L22、L31、L82经人工胃液和人工肠液处理后的存活率均在50%以上,具有良好人工胃肠液耐受能力。
2.4 菌株的体外抗氧化性能力测定
DPPH是一种稳定的自由基,其在波长517 nm条件下有最大吸收峰,已有研究表明DPPH清除率的大小与测定样品的抗氧化能力有关,DPPH 清除率越大,样品抗氧化活性越强[37]。因此,研究中常将DPPH自由基清除率作为测定样品抗氧化活性的指标之一。乳酸菌发酵上清液及无细胞提取物体外抗氧化活性测定结果见表2。由表2可知,在发酵上清液中DPPH自由基清除能力最高的为菌株L51,DPPH清除率达到99.93%,高于0.3 mg/mL VC的DPPH清除率(98.10%);菌株L61的清除率最低,仅为71.01%。其余菌株发酵上清的清除率均在84%以上。在无细胞提取物中DPPH清除较高的菌株为L22、L23、L31、DPPH自由基清除率分别为72.64%、66.34%、61.30%,最低的为菌株L73,DPPH自由基清除率仅为6.66%,其余菌株的自由基清除率均低于50%。与王小鹏等[38-39]的研究结论类似。结果表明,发酵上清液中DPPH清除率显著高于无细胞提取物,说明分离的多数菌株均有良好的胞外多糖分泌能力[40-41]。
表2 筛选乳酸菌发酵上清液及无细胞提取物体外抗氧化性测定结果
Table 2 Determination results of in vitro antioxidant activity of fermentation supernatant and cell-free extract of screened lactic acid bacteria
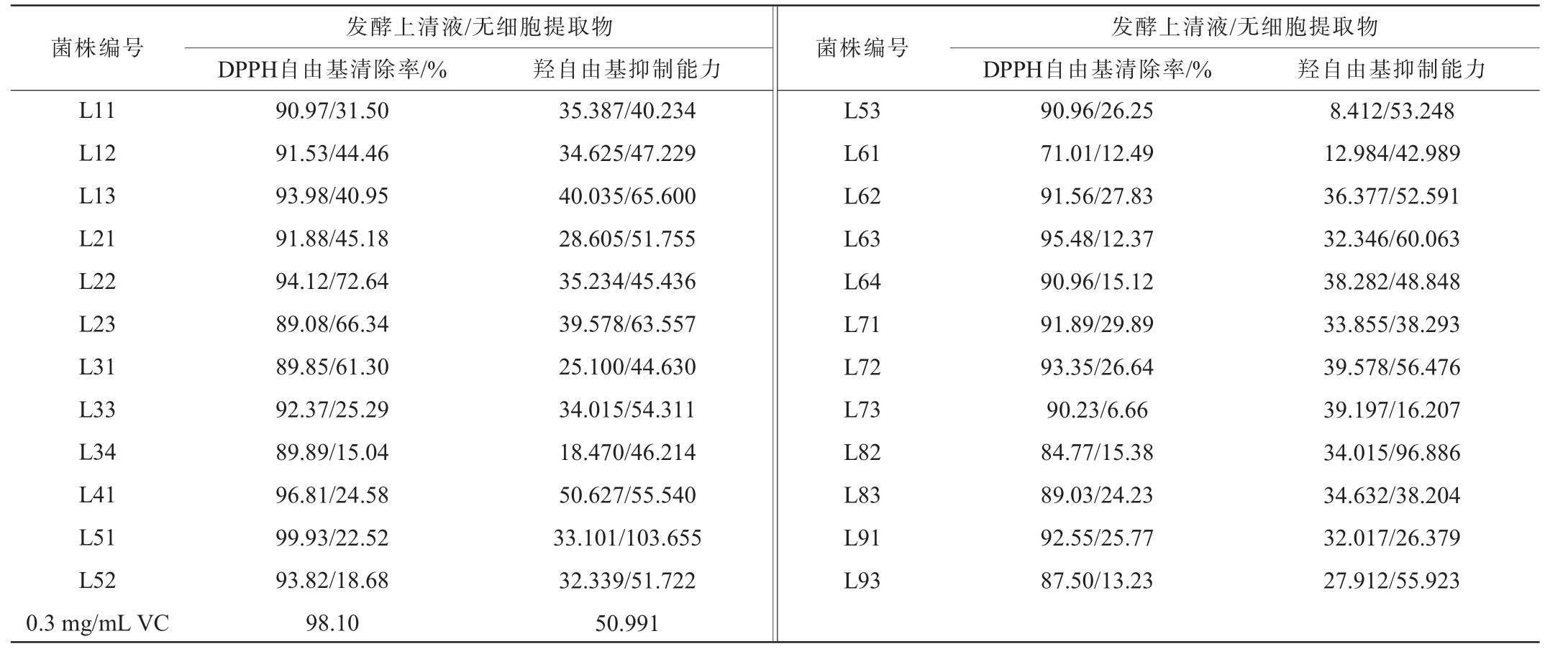
注:发酵上清液、无细胞提取物抑制能力单位分别为U/mL、U/mgprot。
发酵上清液/无细胞提取物DPPH自由基清除率/% 羟自由基抑制能力菌株编号 菌株编号发酵上清液/无细胞提取物DPPH自由基清除率/% 羟自由基抑制能力L11 L12 L13 L21 L22 L23 L31 L33 L34 L41 L51 L52 0.3 mg/mL VC 90.97/31.50 91.53/44.46 93.98/40.95 91.88/45.18 94.12/72.64 89.08/66.34 89.85/61.30 92.37/25.29 89.89/15.04 96.81/24.58 99.93/22.52 93.82/18.68 98.10 35.387/40.234 34.625/47.229 40.035/65.600 28.605/51.755 35.234/45.436 39.578/63.557 25.100/44.630 34.015/54.311 18.470/46.214 50.627/55.540 33.101/103.655 32.339/51.722 50.991 L53 L61 L62 L63 L64 L71 L72 L73 L82 L83 L91 L93 90.96/26.25 71.01/12.49 91.56/27.83 95.48/12.37 90.96/15.12 91.89/29.89 93.35/26.64 90.23/6.66 84.77/15.38 89.03/24.23 92.55/25.77 87.50/13.23 8.412/53.248 12.984/42.989 36.377/52.591 32.346/60.063 38.282/48.848 33.855/38.293 39.578/56.476 39.197/16.207 34.015/96.886 34.632/38.204 32.017/26.379 27.912/55.923
羟自由基具有很强的氧化能力,能对细胞造成氧化损伤,因而对羟自由基的清除能力成为研究菌株抗氧化活性的重要指标之一[42]。由表2亦可知,发酵上清液中,羟自由基抑制能力最强的菌株为L41,达到50.63 U/mL,接近0.3 mg/mL VC的羟自由基抑制能力(50.99 U/mL);最低的为菌株L53,羟自由基抑制能力仅为8.41 U/mL;其余菌株发酵上清液羟自由基抑制能力在12.98~40.04 U/mL之间。在无细胞提取物中,羟自由基抑制能力最高的为菌株L51,达到103.66 U/mg,其次为菌株L82,抑制能力为96.89 U/mg;菌株L13、L21、L23、L32、L41、L52、L53、L62、L63、L72、L93的羟自由基清除能力高于0.3 mg/mL VC的羟自由基抑制能力;菌株L73的羟自由基抑制能力最低,仅为16.207 U/mg。结果表明,无细胞提取物的羟自由基抑制能力显著高于发酵液上清。
2.5 菌株的产酸能力测定
产酸能力是乳酸菌活力良好的重要特征之一,高产酸菌株不仅可以缩短发酵周期,降低成本,并且乳酸菌利用自身生长代谢过程中产生的多种有机酸来抑制有害菌的生长,从而可提高发酵的安全性,使其在制作过程中避免受到腐败菌及致病菌的污染[43],且菌株增殖越快,产酸越多,对有害菌的抑制能力越强。筛选菌株产酸试验结果见图8。由图8可知,在相同的发酵条件下,菌株L63的产酸量最大,为24.83 g/L,其次是菌株L73、L33、L72、L34、L13,产酸量都在20 g/L以上。菌株L41、L71的产酸量最小,分别为3.16 g/L、6.79 g/L。综上,菌株L63、L73、L32、L72、L33、L13的为产酸优势菌株。
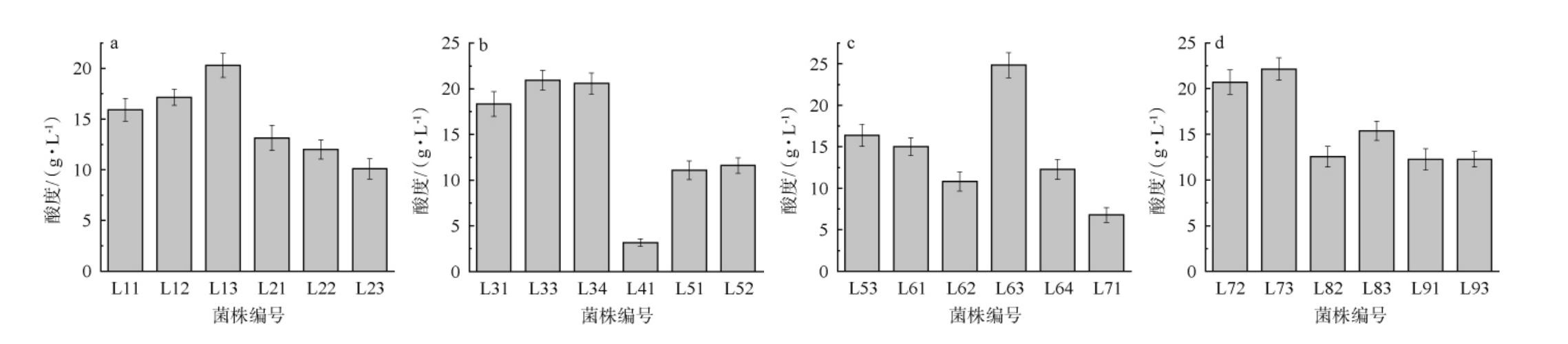
图8 筛选乳酸菌产酸性能试验结果
Fig.8 Results of acid production tests of screened lactic acid bacteria
2.6 菌株的安全性检测
2.6.1 菌株的抗生素敏感性
益生菌因具有转移抗生素抗性基因至致病菌中的潜在可能性,抗生素敏感试验作为益生菌安全性评价的重要指标加以考虑[44],对24株菌株进行耐药性试验,试验选用20种抗生素药敏纸片,结果如表3所示。
表3 筛选乳酸菌抗生素敏感性检测结果
Table 3 Results of antimicrobial susceptibility test of screened lactic acid bacteria
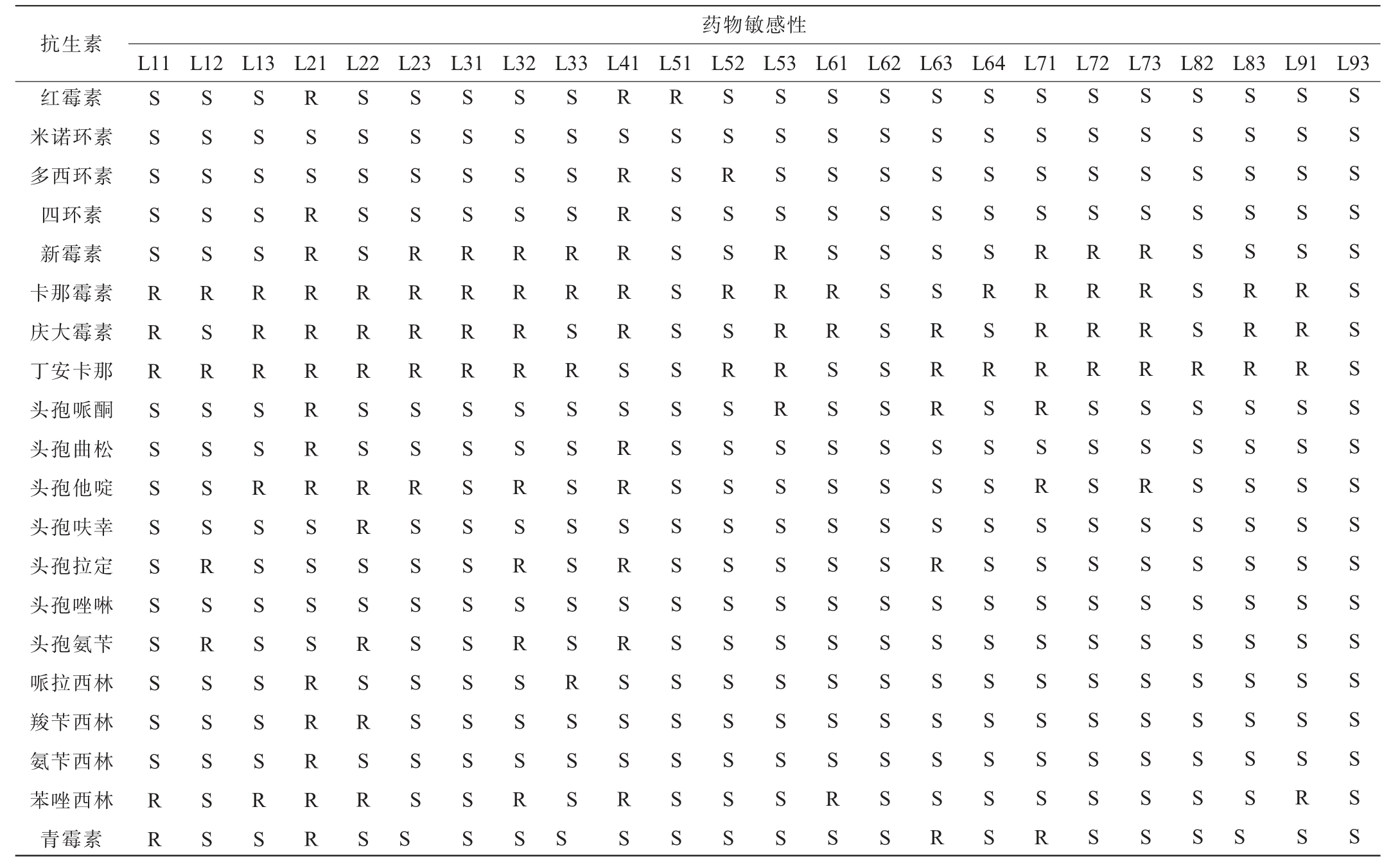
注:S代表抗生素敏感、R代表抗生素耐药。
抗生素红霉素米诺环素多西环素四环素新霉素卡那霉素庆大霉素丁安卡那头孢哌酮头孢曲松头孢他啶头孢呋幸头孢拉定头孢唑啉头孢氨苄哌拉西林羧苄西林氨苄西林苯唑西林青霉素药物敏感性L11 L12 L13 L21 L22 L23 L31 L32 L33 L41 L51 L52 L53 L61 L62 L63 L64 L71 L72 L73 L82 L83 L91 L93 S S S S S R R R S S S S S S S S S S R R S S S S S R S R S S S S R S R S S S S S S S S S S R R R S S R S S S S S S S R S R S S R R R R R R R R S S S S R R R R R S S S S S R R R S S R R S S R S R S R S S S S S R R R R S S R S S S S S S S S S S S S S R R R R S S S S S S S S S S S S S S S S R R R R S S R S R S R S S S R S S S S S R R S R S S S S S S S R S S S S R S R R R R R S S R R S R S R S S S R S R S S S S S S S S S S S S S S S S S S S S S R S S R S R S S S S S S S S S S S S S S S S R R R R R S S S S S S S S S S S S S S S S R R S S S S S S S S S S S R S S S S S S S S S S S S S S S S S S S S S S S S S S S R R R S S S R S S S S S S R S S S S S R S R S S S S S S S S S S S S S S S S R R R R R S R S S S S S S S S R S S S S R R R R S S S S S S S S S S S S S S S S R R R R S S R S S S S S S S S S S S S S S S S R S S S S S S S S S S S S S S S S S R R R S S S S S S S S S S S S S S S S S R R R S S S S S S S S S S R S S S S S S S S S S S S S S S S S S S S S
24株菌中,菌株L62和L93对所有抗生素均敏感,菌株L51对除红霉素外的所有抗生素敏感,菌株L82对除丁安卡那除外的所有抗生素敏感,菌株L64对除卡那霉素和丁安卡那除外的所有抗生素敏感,菌株L83对除卡那霉素、庆大霉素和丁安卡那除外的所有抗生素敏感,菌株L31、L53、L72对除新霉素、卡那霉素、庆大霉素和丁安卡那除外的所有抗生素敏感。据报道很多乳酸菌对卡那霉素、万古霉素具有天然的抗性,这种耐药性一般不会转移传递给致病菌[45]。其余菌株都包含有针对两种以上类型的抗生素抗性,特别是菌株L21和L41,分别对14种和11种抗生素有抗性,包含了5种抗生素类型;菌株L22、L33、L71也包含7种以上抗生素抗性,也包含了5种抗生素类型。洛阳酸浆中分离到的乳酸菌多数携带多种抗生素抗性基因,具有一定的抗生素耐药性扩散风险。结果表明,初步认为菌株L62、L64、L82、L83、L93菌株在抗生素药敏性方面具有较好的安全性。
2.6.2 菌株的溶血性检测
溶血性细菌对人类健康造成危害,联合国粮农组织[46]规定,食品中的益生菌不允许有溶血性。溶血素可以溶解细胞,引起红细胞的内在缺陷与抗原抗体反应,进而引起败血症。溶血性可分3类:α-溶血(部分溶血)、β-溶血(完全溶血)、γ-溶血(不溶血)。结果表明,菌株L12、L13、L34、L52、L53、L61、L71、L72、L73表现为完全溶血,菌株L11、L21、L22、L23、L33、L41、L62、L63、L64、L83、L91表现为部分溶血,菌株L31、L51、L82、L93为不溶血。因此,菌株L31、L51、L82、L93的溶血安全性优于部分溶血的11株菌。出现完全溶血的9株菌溶血安全性较差。洛阳酸浆中分离到的乳酸菌多数菌株具有对人体危害较大的β-溶血性或具有一定危害的α-溶血性,存在第一定的溶血性风险。
3 结论
本研究从洛阳地区的浆水样品中成功分离出24株菌株,经鉴定其隶属于10个属12个种,其中占优势的为发酵乳杆菌(Limosilactobacillus fermentum)、植物乳植杆菌(Lactiplantibacillus plantarum)和副干酪乳酸杆菌(Lacticaseibacillus paracasei)。经生产性能测定筛选出10株生长迅速,环境耐受性好,产酸能力强,并具有较好的产抗氧化物质能力的菌株。在此基础上,经安全性能测定筛选出3株生产性能优异且抗性基因携带少,对溶血性安全的菌株,短乳杆菌(Levilactobacillus brevis)L62、乳明串珠菌(Leuconostoc lactis)L64、人葡萄球菌(Staphylococcus hominis)L82。本研究分离得到的具有生长迅速、产酸能力高、抗氧化活性好、应用安全的短乳杆菌(Levilactobacillus brevis)L62、乳明串珠菌(Leuconostoc lactis)L64、人葡萄球 菌(Staphylococcus hominis)L82菌株具备开发成酸浆发酵直投式菌剂的优良潜力,为洛阳酸浆的安全规范化生产提供参考。
[1]李慧玲,王彦儒,刘亚平浆水菜制作及深加工研究进展[J].农产品加工,2020(22):82-86.
[2]苗君甫.洛阳美食「漿」面條[J].内蒙古林业,2017(2):32.
[3]王立,任思,周素梅,等.绿豆发酵制品及其功能活性研究[J].食品与机械,2019,35(2):231-236.
[4]李璇,韩四海,李鑫玲,等.洛阳传统绿豆酸浆营养成分分析与品质多样性[J].食品与发酵工业,2020,46(14):228-233.
[5]孟宪刚,张丽珂,周鸽鸽.传统发酵食品—浆水研究概况及发展前景展望[J].食品工业科技,2010,31(10):402-404.
[6]赵虎威,陈燕飞,燕平梅.泡菜发酵中微生物的研究[J].中国调味品,2022,47(1):211-216.
[7]胡莹莹,赵丽,史力学,等.浆水发酵中的优势乳酸菌分离鉴定[J].甘肃农业科技,2021,52(4):43-48.
[8]范鑫诺,李海阳,郑毅恒,等.洛阳传统绿豆酸浆细菌群落组成分析和功能预测[J].中国食品学报,2024,24(6):369-379.
[9]陈亚军,霍亚宁,班世栋.传统发酵食品浆水和甜醅中酵母菌的分离与鉴定[J].工业微生物,2024,54(6):197-200.
[10]石学梅,李婉萌,林剑.藜麦酸浆中淀粉絮凝菌的分离鉴定及在藜麦蛋白提取中的应用[J].食品工业科技,2023,44(6):193-200.
[11]刘朔,武岩,詹小吉,等.HACCP体系在秦安浆水(酸菜)生产质量控制中的应用[J].农产品加工,2024(14):92-96.
[12]李璇,李中雨,舒林焱,等.洛阳传统绿豆酸浆工艺优化及发酵特性分析[J].中国粮油学报,2024,39(6):76-85.
[13]陶祥婕,胡萍.复合菌种发酵黄浆水的风味品质分析[J].食品与发酵工业,2024,50(11):308-318.
[14]李毅昊,赵仕达,李海阳,等.几种传统酸浆的制作工艺、应用及研究进展[J].食品与发酵工业,2024,50(19):388-396.
[15]ZHANG J,WU S H,ZHAO L H,et al.Culture-dependent and independent analysis of bacterial community structure in Jiangshui,a traditional Chinese fermented vegetable food[J].LWT-Food Sci Technol,2018,96:244-250.
[16]徐斯雅,贠建民,郭伟红,等.兰州浆水优势发酵菌株鉴定及其发酵性能评价[J].食品与发酵工业,2024,50(21):102-111.
[17]何玲,杨公明.浆水芹菜自然和接种发酵过程中有机酸的变化[J].北方园艺,2011(4):179-181.
[18]程驰新笑,易宗伟,王玉荣,等.重庆东部地区鲊广椒乳酸菌分离鉴定及细菌菌群多样性分析[J].中国酿造,2023,42(9):49-54.
[19]胡此海,杨絮,郭全友,等.萝卜泡菜母水中乳酸菌分离鉴定与发酵特性比较[J].食品与发酵工业,2023,49(23):111-119.
[20]吕嘉伟,卢灏泽,刘振东,等.西藏曲拉中优良乳酸菌的筛选与评价[J].酿酒科技,2023(6):34-45.
[21]夏勒合特·巴克尔拜,刘晶晶,贺红军,等.新疆传统泡菜中乳酸菌的分离鉴定及其益生性能评价[J].保鲜与加工,2021,21(11):87-93.
[22]雷雪艳,赵丽霞,李瑜,等.内蒙古地区自然发酵乳中乳酸菌的分离鉴定及优良菌株筛选[J].食品与发酵工业,2025,51(1):11-17.
[23]刘震坤,陈鲜鑫,任思宇,等.一株鸡源植物乳杆菌益生性能的评价[J].中国饲料,2022(8):21-24.
[24]任香芸,何志刚,林晓姿,等.植物乳杆菌R23胞内抗氧化酶高效提取与保存技术研究[J].福建农业科技,2022,53(3):1-6.
[25]刘珊春,赵欣,李键,等.高抗氧化乳酸菌的筛选鉴定[J].食品与发酵工业,2017,43(8):59-66.
[26]ZHENG S S,WU W Y,ZHANG Y L,et al.Improvement of tomato sour soup fermentation by Lacticaseibacillus casei H1 addition[J].J Food Process Preserv,2022,46(8):e16806.
[27]姚有莉,张朋,王永奔,等.降解霉菌毒素乳酸菌的筛选及鉴定[J].动物营养学报,2024,36(4):2674-2689.
[28]GUNYAKTI A, ASAN-OZUSAGLAM M.Lactobacillus gasseri from human milk with probiotic potential and some technological properties[J].LWT-Food Sci Technol,2019,109:261-269.
[29]ARGYRI A A,ZOUMPOPOULOU G,KARATZAS K A G,et al.Selection of potential probiotic lactic acid bacteria from fermented olives by in vitro tests[J].Food Microbiol,2013,33(2):282-291.
[30]柳青,史迪,刘文俊,等.摩洛哥自然发酵驼乳中乳酸菌分离鉴定及特性研究[J].食品科学技术学报,2022,40(4):85-95,137.
[31]JO Y M,KIM G Y,KIM S,et al.Limosilactobacillus fermentum MG7011:An amylase and phytase producing starter for the preparation of ricebased probiotic beverages[J].Front Microbiol,2021,12:745952.
[32]YU Z X,ZHAO J,QIN Y L,et al.Probiotics,prebiotics,and synbiotics improve uremic,inflammatory,and gastrointestinal symptoms in end-stage renal disease with dialysis:A network meta-analysis of randomized controlled trials[J].Front Nutr,2022,9:984187.
[33]肖秋颖,王翔宇,陈炼红.川西高原传统发酵牦牛酸乳中高产γ-氨基丁酸乳酸菌筛选及鉴定[J].食品工业科技,2021,42(6):111-117,124.
[34]ASHAOLU T J.Immune boosting functional foods and their mechanisms: A critical evaluation of probiotics and prebiotics[J].Biomed Pharmacoth,2020,130(4):110625.
[35]MERRITT M E, DONALDSON J R.Effect of bile salts on the DNA and membrane integrity of enteric bacteria[J].J Med Microbiol,2009,58(12):1533-1541.
[36]LIN W Y,KUO Y W,LIN J H,et al.Probiotic strains isolated from an olympic woman's weightlifting gold medalist increase weight loss and exercise performance in a mouse model[J].Nutrients,2022,14(6):1270.
[37]韦献雅,殷丽琴,钟成,等.DPPH 法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-322.
[38]王小鹏,闫爽,高亚欣,等.人源乳酸菌的筛选鉴定及抗氧化活性研究[J].中国乳品工业,2022,50(6):16-21,64.
[39]吴涵清,洪青,刘振民,等.抗氧化乳酸菌的筛选及其对夸克奶酪品质的影响[J].食品与发酵工业,2024,50(22):286-293.
[40]YANG J,JI Y,PARK H,et al.Selection of functional lactic acid bacteria as starter cultures for the fermentation of Korean leek(Allium tuberosum Rottler ex Sprengel.)[J].Int J Food Microbiol,2014,191(11):164-171.
[41]孙宁,雷敬玲,吴晓青,等.自然发酵酸笋中乳酸菌的筛选鉴定及益生特性研究[J].中国酿造,2020,39(6):63-68.
[42]DING W R,WANG L N,ZHANG J, et al.Characterization of antioxidant properties of lactic acid bacteria isolated from spontaneously fermented yak milk in the Tibetan Plateau[J].J Funct Food,2017,35:481-488.
[43]HU T,CHEN R,QIAN Y,et al.Antioxidant effect of Lactobacillus fermentum HFY02-fermented soy milk on D-galactose-induced aging mouse model[J].Food Science and Human Wellness,2022,11(5):1362-1372.
[44]席杨,梁媛媛,孙丽萍,等.益生菌的耐药性及其安全性的研究进展[J].食品安全导刊,2024(23):172-177,181.
[45]张灼阳,刘畅,郭晓奎.乳酸菌耐药性的研究进展[J].中国微生态学杂志,2007,19(5):478-480.
[46]GANGULY N K,BHATTACHARYA S K,SESIKERAN B,et al.ICMRDBT guidelines for evaluation of probiotics in food[J].Indian J Med Res,2011,134(1):22-25.