臭豆腐(stinky tofu)作为我国久负盛名的传统特色小吃,因“闻起来臭,吃起来香”的味觉特点及深厚的文化底蕴而深受人们喜爱,其起源已无可考,据传已有近千年历史,得“东方奶酪”之称谓[1]。人们一般将其分为发酵型与半发酵型的臭豆腐两类,传统发酵型臭豆腐的卤水通常由蔬菜及香辛料,以一定的配比自然发酵而成[2-4];南方臭豆腐又叫臭干子,为半发酵型,一般是用特制的发酵好的臭卤对白豆腐浸渍数小时后油炸或蒸熟后食用[4-5]。臭豆腐中含有丰富的营养成分及种类繁多的益生元,如维生素B12[6]以及雌马酚等[7-8]。
目前国内外有关臭豆腐挥发性风味物质的相关研究报道繁多,如叶琳洋等[9-13]对臭豆腐中挥发性成分提取与分析,研究者们在优化臭豆腐制作工艺这一方面也展开了诸多研究,如张静等[14]通过加入荷叶、茉莉花等制得了尝味有清新花叶香气的改良发酵臭豆腐;JYC A等[15]研究发现,在豆腐乳中添加单一种类的氨基酸能有效提高发酵过程中的糖利用率、减少残糖水平,且每种氨基酸在大豆乳清发酵过程中产生不同的效果。臭豆腐其特殊风味产生的本质原理是豆腐中的蛋白质、糖等营养物质在臭卤水中微生物与酶作用下被分解,通过一系列反应后形成如酯类、醇类、含硫类化合物等多种风味物质[16]。因此,臭卤水是为半发酵型臭豆腐提供风味的关键原料。但是目前,卤水的发酵时间以及发酵条件等没有具体标准,缺乏可供参考的一套完整工业生产标准体系。
本研究以湖南某公司生产臭豆腐的卤水为研究对象,对其进行理化性质测定,分析不同发酵时间和含盐量卤水的臭豆腐品质差异。采用固相微萃取(solid phase microextraction,SPME)结合气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术分析臭豆腐生产的卤水挥发性风味成分及其动态变化情况,并采用16S rDNA法解析不同发酵阶段卤水的优势菌群。结合理化性质、挥发性风味物质及优势菌群的分析,确定卤水最佳发酵时间和卤水最佳含盐量,为臭豆腐卤水标准化制作提供一定参考价值。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
卤水试验样品采集:在同一臭豆腐生产车间,采集发酵时间分别为454 d、455 d、456 d、462 d、463 d和829 d的卤水样品,将样品分别编号为Ⅰ~Ⅵ。
1.1.2 化学试剂
亚铁氰化钾(分析纯)、硼酸钠(分析纯):国药集团化学试剂有限公司;甲醛溶液(分析纯):佛山西陇化工有限公司;氢氧化钠(分析纯):西陇科学股份有限公司;乙酸锌(分析纯)、盐酸萘乙二胺(分析纯):厦门安永博科技有限公司;对氨基苯磺酸(分析纯)(0.4%):福州飞净生物科技有限公司;亚硝酸钠(纯度>98%):广州检测科技有限公司。
1.1.3 培养基
营养琼脂培养基:杭州百思生物技术有限公司。
1.2 仪器与设备
721G可见分光光度计、PHS-3C台式pH计酸碱测试仪:上海仪电分析仪器有限公司;DZKWS-4电热恒温水浴锅:北京市永光明医疗仪器有限公司;101型电热鼓风干燥箱、DHP-500型电热恒温培养箱:北京市永光明医疗仪器有限公司;LDZM-80L-I立式高压蒸汽灭菌器:上海申安医疗器械厂;XSP-8CAV光学生物显微镜:上海力辰邦西仪器科技有限公司;ws-600plus便携式数显盐度计:东莞盛山电子有限公司。
1.3 方法
1.3.1 臭豆腐卤水的制备
卤水的主要原料包括豆腐、笋子、浏阳豆豉、香菇。豆腐为经过氯化镁点浆后压制获得的白豆腐;冬笋、香菇、豆腐等洗净、沥干、切碎后,按照香菇1.3 kg、浏阳豆豉0.45 kg、豆腐0.2 kg、笋子0.3 kg、凉开水2 kg、食盐0.06 kg配比混合后,煮沸熬制0.5 h,冷却后放入缸中,室温条件下自然发酵一定时间,即得臭豆腐卤水。
1.3.2 卤水的理化指标分析
氨基酸态氮的测定:根据国标GB 5009.235—2016《食品安全国家标准食品中氨基酸态氮的测定》[17]中的酸度计法;亚硝酸盐的测定:根据国标GB 5009.33—2016《食品安全国家标准食品中亚硝酸盐和硝酸盐的测定》[18]中的分光光度法;总酸(以乳酸计)的测定:根据国标GB 12456—2021《食品安全国家标准食品中总酸的测定》[19]中的pH计电位滴定法;盐度的测定:采用便携式盐度计,使用10%的氯化钠对盐度计进行校正。
1.3.3 卤水的细菌菌落总数和优势微生物分析
无菌条件下取25 mL臭豆腐的卤水,放入装有玻璃珠和225 mL无菌生理盐水的锥形瓶中,振摇30 min后,用生理盐水稀释至10-5,采用平板稀释法分析卤水细菌菌落总数和优势微生物。
1.3.4 卤水中挥发性风味物质测定
参考陈晓艺[20]的方法进行卤水中挥发性风味物质测定。固相微萃取头在使用前在进样口进行老化,取50/30 μm DVB/CAR/PDMS萃取头在250℃的条件下活化,保持30 min。用移液枪取1 mL的液体,放入顶空瓶中后加入4 mL纯净水并用密封垫进行密封,将其放在磁力搅拌器上,温度设为60 ℃进行预热,保持预热10 min,将磁粒子的搅拌速度设置为200 r/min,将活化后的萃取头插入样品瓶中,后推出纤维头,吸附40 min后缩回纤维头,吸附完成后拔出萃取头,将吸附好的萃取头插入气相色谱进样口,然后推出纤维头,250 ℃解吸5 min。
GC条件:色谱柱为CD-WAX 弹性石英毛细管柱(30m×0.25 mm×0.25 μm);载气为高纯(99.999 %)氦气,流速1.0 mL/min;进样口温度设置为240 ℃;选择不分流进样。设置升温程序为柱温50 ℃,保持2 min,以5℃/min升温至200 ℃,保持14 min,以15 ℃/min升温至240 ℃。
质谱条件:电子电离(electron ionization,El)源,离子源温度200 ℃;电子能量70 eV;发射电流150 μA;倍增器电压1 037 V;接口温度220 ℃;质量扫描范围45~500 m/z。
定性定量方法:总离子流色谱图经美国国家标准技术研究所(national institute of standards and technology,NIST)2014s标准谱库检索定性鉴定出成分,采用面积归一法进行定量分析,得到各成分挥发性风味物质的相对含量。
1.3.4 16S rDNA序列分析卤水样品中细菌多样性
样品采集及前处理:收集约10 mL卤水,4 ℃、8 000 r/min条件下离心10 min,收集上清液;将上清液置于无菌冻存管中,放入-80 ℃保存。
脱氧核糖 核酸(eoxyribonucleic acid,DNA)提取与聚合酶链式反应(polymerase chain reaction,PCR):采用![]() SpinKitforSoil试剂盒进行DNA提取,并进行PCR扩增。采用通用引物338F和806R扩增细菌16S rDNA基因的可变区。PCR扩增体系为:5×FastPfu Buffer 4 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs)2 μL,正、反向引物(5 μmol/L)各0.8 μL,FastPfu聚合酶0.4 μL,牛血清蛋白(bovine serum albumin,BSA)0.2 μL,DNA模板10 ng,补无菌去离子水至20 μL。PCR扩增条件为:95 ℃预变性3 min;95 ℃变性30 s;56 ℃退火30 s;72 ℃延伸45 s;72 ℃延伸10 min,10 ℃直至结束;2~4步进行30个循环。PCR扩增产物使用琼脂糖凝胶电泳检测后,委托上海美吉生物医疗科技有限公司进行高通量测序。
SpinKitforSoil试剂盒进行DNA提取,并进行PCR扩增。采用通用引物338F和806R扩增细菌16S rDNA基因的可变区。PCR扩增体系为:5×FastPfu Buffer 4 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs)2 μL,正、反向引物(5 μmol/L)各0.8 μL,FastPfu聚合酶0.4 μL,牛血清蛋白(bovine serum albumin,BSA)0.2 μL,DNA模板10 ng,补无菌去离子水至20 μL。PCR扩增条件为:95 ℃预变性3 min;95 ℃变性30 s;56 ℃退火30 s;72 ℃延伸45 s;72 ℃延伸10 min,10 ℃直至结束;2~4步进行30个循环。PCR扩增产物使用琼脂糖凝胶电泳检测后,委托上海美吉生物医疗科技有限公司进行高通量测序。
1.3.5 数据处理
采用Excel 2007对理化试验数据进行统计并制图,所有试验均重复3次,并取平均值作为数据,结果以“平均值±标准差”表示。为了得到每个OTU对应的物种分类信息,采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并在各个水平(域、界、门、纲、目、科、属、种)统计每个样品的群落组成,采用SILVA的核糖体数据库进行对比。同时对OTU数据进行进一步的分析,利用Rarefaction曲线、Rank-Abundance曲线进行了多样性评估;利用BAR、PCA图进行统计分析;挥发性风味物质数据采用软件Origin 2024作图。
2 结果与分析
2.1 臭卤水不同发酵时间理化指标的测定
不同发酵时间卤水样品理化指标的测定结果见图1。
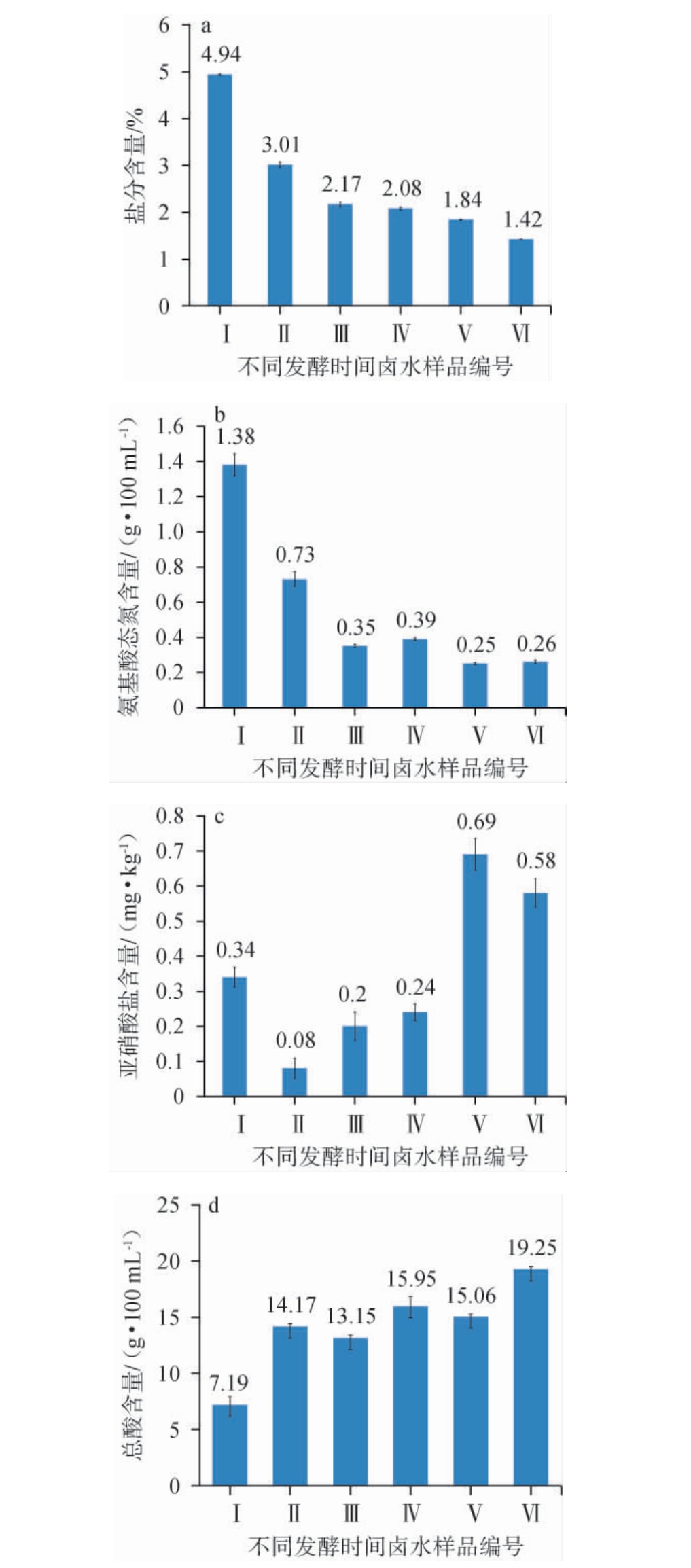
图1 不同发酵时间的卤水样品的盐分(a),氨基酸态氮(b),亚硝酸盐(c)及总酸(d)含量
Fig.1 Contents of salt (a), amino acid nitrogen (b), nitrite (c) and total acid (d) content in brine samples with different fermentation time
由图1a可知,不同卤水样品盐分含量有明显差异,已知卤水中的盐分不会随着发酵时间延长而改变,产生这类情况的原因是制卤师傅在制备各卤水时加盐量有所差异。Ⅰ号卤水和Ⅵ号卤水之间盐分含量相差3.52%,可见这6个批次的卤水中内环境不一致,进而影响其他理化性质和挥发性物质成分。因此可根据其理化性质及挥发性物质成分推断出Ⅰ~Ⅵ号卤水样品中哪个样品的加盐量最适宜发酵,为臭豆腐卤水制备提供一些数据参考。
由图1b可知,随着发酵时间延长,氨基酸态氮含量随之下降。由于Strecker降解反应将游离氨基酸降解为挥发性的醛、酚、醇等风味物质[21]导致卤水体系中氨基酸态氮含量下降。Ⅰ~Ⅵ号卤水样品中氨基酸态氮含量依次是Ⅰ>Ⅱ>Ⅳ>Ⅲ>Ⅵ>Ⅴ,其中Ⅰ号样品和Ⅱ号样品中氨基酸态氮含量相差较大,高达0.65 g/100 mL,Ⅱ号和Ⅲ号样品之间氨基酸态氮含量相差0.38 g/100 mL,Ⅲ~Ⅵ号卤水样品中的氨基酸态氮含量相差不大,与卤水盐分含量呈正相关,与发酵时间呈负相关。可能是食盐对蛋白酶具有抑制作用,高浓度的食盐易使酶变性,活力下降[21],因此氨基酸态氮含量降低。氨基酸态氮含量越高则卤水越鲜,品质越好。由此可知,在这六个样品中,盐分含量最高、发酵时间最短的Ⅰ号卤水样品最鲜,其次是Ⅱ、Ⅳ、Ⅲ、Ⅵ、Ⅴ。
亚硝酸盐是很普遍存在的含氮化合物,其来源主要是植物对硝酸盐的富集,由于近年来氮肥的过量使用,导致植物体内硝酸盐大量积累,而硝酸盐在发酵过程中会被细菌还原成亚硝酸盐[22]。由图1c可知,在所有卤水样品中检测到的亚硝酸盐含量并未超过GB 2762—2022《食品安全国家标准食品中污染物限量》[23]中规定,酱腌菜中亚硝酸盐(以NaNO2计)的限量标准<20 mg/kg。Ⅰ~Ⅵ号卤水样本中亚硝酸盐含量依次是Ⅱ<Ⅲ<Ⅳ<Ⅰ<Ⅵ<Ⅴ。食盐浓度高则可抑制硝酸还原菌的生长,亚硝酸盐生成慢且少,因此亚硝酸盐与盐分含量呈负相关。亚硝酸盐含量与发酵时间大致成正相关。由此可得,加盐量多、发酵时间短更有利于降低卤水中亚硝酸盐含量,从而减少对人体的危害。
卤水中的总酸可以调节食品酸度、改善风味抗氧化以及防止酸败。由图1d可知,Ⅰ~Ⅵ号卤水样品中总酸含量依次是Ⅵ>Ⅳ>Ⅴ>Ⅱ>Ⅲ>Ⅰ。Ⅱ~Ⅵ号样品之间含量相差不大,Ⅰ号样品比Ⅱ号的总酸含量减少了6.98g/100mL。卤水的酸度主要来自于乳酸,盐分高会抑制乳酸菌的生长繁殖代谢产生乳酸,所以总酸含量与盐分含量呈负相关。由此可得,盐分含量高不利于防止卤水酸败,Ⅰ~Ⅵ号卤水样品中,Ⅱ~Ⅵ号样品比之Ⅰ号卤水样品更不容易酸败。
综上理化指标测定结果来看,在这批卤水样品中,卤水的最佳发酵时间为455 d,最佳盐分含量为3.01%。因为在这个发酵条件下,氨基酸态氮和总酸含量都处于较高值,而亚硝酸盐含量最低。
2.2 臭豆腐卤水中微生物菌群分析
2.2.1 菌落和细胞形态观察
不同发酵时间卤水样品的细菌总数及代表菌株菌落特征描述见表1,代表菌株菌落和细胞形态见图2。由表1和图2可知,从菌落总数来看,Ⅳ>Ⅴ>Ⅱ>Ⅲ>Ⅵ>Ⅰ,菌落颜色大多为乳白色。从细胞形态来看,不同发酵时间卤水样品的细菌均为革兰氏阳性芽孢杆菌,因芽孢杆菌具有强大的生存能力,所以能够在卤水这种环境中长期存活和繁殖。
表1 不同发酵时间卤水样品的细菌总数及代表菌株的菌落和细胞形态
Table 1 Total number of bacteria in brine samples with different fermentation time and the colony and cell morphology of representative strains
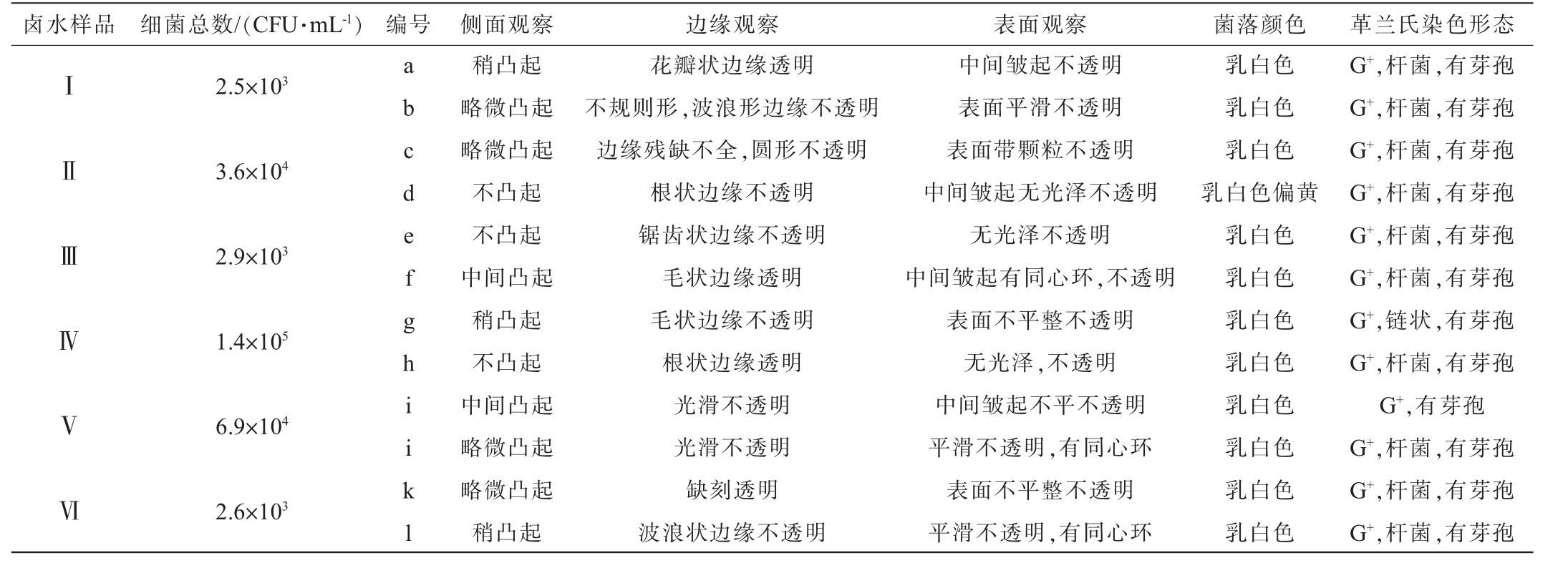
卤水样品 细菌总数/(CFU·mL-1)编号 侧面观察 边缘观察 表面观察 菌落颜色 革兰氏染色形态ⅠⅡⅢⅣⅤⅥ2.5×103 3.6×104 2.9×103 1.4×105 6.9×104 2.6×103 a b c d e f g h i i k l稍凸起略微凸起略微凸起不凸起不凸起中间凸起稍凸起不凸起中间凸起略微凸起略微凸起稍凸起花瓣状边缘透明不规则形,波浪形边缘不透明边缘残缺不全,圆形不透明根状边缘不透明锯齿状边缘不透明毛状边缘透明毛状边缘不透明根状边缘透明光滑不透明光滑不透明缺刻透明波浪状边缘不透明中间皱起不透明表面平滑不透明表面带颗粒不透明中间皱起无光泽不透明无光泽不透明中间皱起有同心环,不透明表面不平整不透明无光泽,不透明中间皱起不平不透明平滑不透明,有同心环表面不平整不透明平滑不透明,有同心环乳白色乳白色乳白色乳白色偏黄乳白色乳白色乳白色乳白色乳白色乳白色乳白色乳白色G+,杆菌,有芽孢G+,杆菌,有芽孢G+,杆菌,有芽孢G+,杆菌,有芽孢G+,杆菌,有芽孢G+,杆菌,有芽孢G+,链状,有芽孢G+,杆菌,有芽孢G+,有芽孢G+,杆菌,有芽孢G+,杆菌,有芽孢G+,杆菌,有芽孢
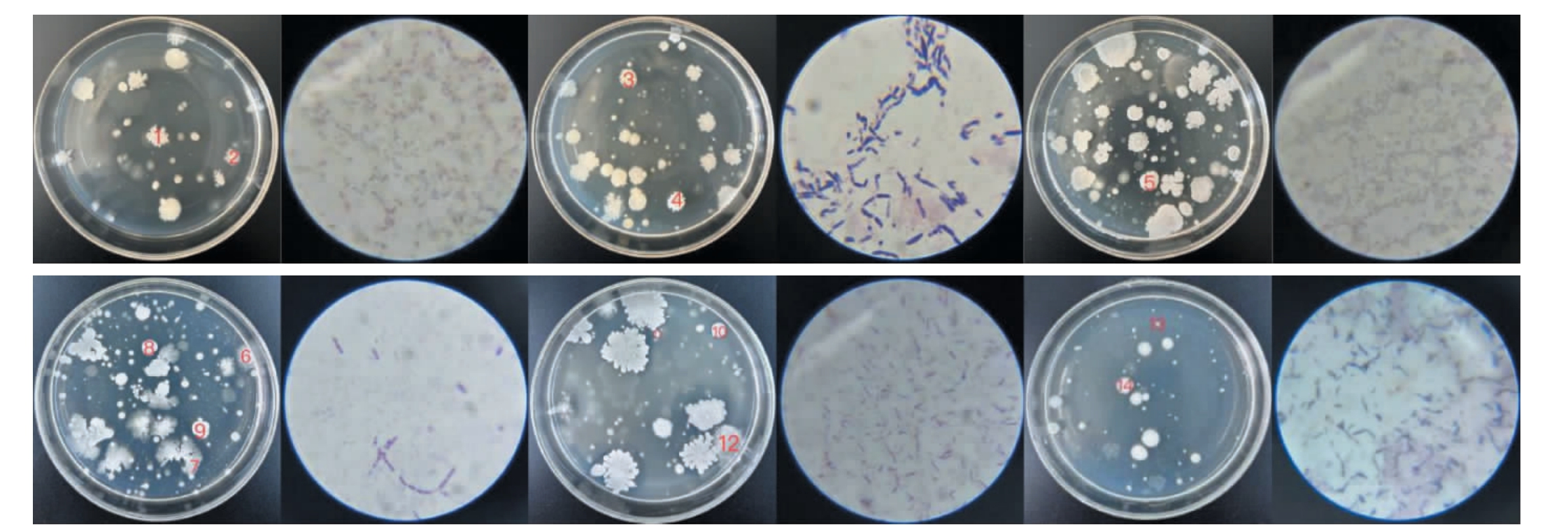
图2 Ⅰ号(a,b),Ⅱ号(c,d),Ⅲ号(e,f),Ⅳ号(g,h),Ⅴ号(i,j)及Ⅵ号(k,l)卤水样品代表菌株的菌落和细胞形态
Fig.2 Colony and cell morphology of representative strains in brine samples Ⅰ(a,b), Ⅱ(c,d), Ⅲ(e,f), Ⅳ(g,h), Ⅴ(i,j), Ⅵ(k,l)
2.2.2 卤水中细菌多样性分析
稀释性曲线是从样本中随机抽取一定数量的个体,统计这些个体所代表的物种数目,并以个体数与物种数来构建曲线。稀释曲线不仅可以比较不同样本中物种的丰富度,还能反映测序的深度是否合理。从不同发酵时间卤水样本中随机抽取一定数量的序列,统计其所对应的物种数目(Sobs指数),并以抽取的序列数与物种数绘制稀释曲线及丰度等级曲线,结果见图3。由图3a可知,基于完整的操作分类单元(operational taxonomic units,OTU)集生成的每个样本的稀释曲线,测序数据量高达50 000时,样本的测序深度才趋近饱和,可见同发酵时间卤水样品中的物种丰富度较大。其中Ⅴ号卤水样本,它的测序深度还未完全达到饱和,因此可能还有继续监测新细菌生长的空间,而其他样本的稀释曲线都较为稳定,表明这些样本中的细菌的测序深度几乎已趋于饱和。Rank-abundance 曲线可用来展示多样性的两个方面:物种丰富度和均匀度。由图3b可知,从Ⅰ~Ⅵ号卤水样品来看,Ⅴ号样品的曲线在横轴上跨越的范围最大,曲线下降最平滑,因此Ⅴ号样品物种丰度和多样性最高。
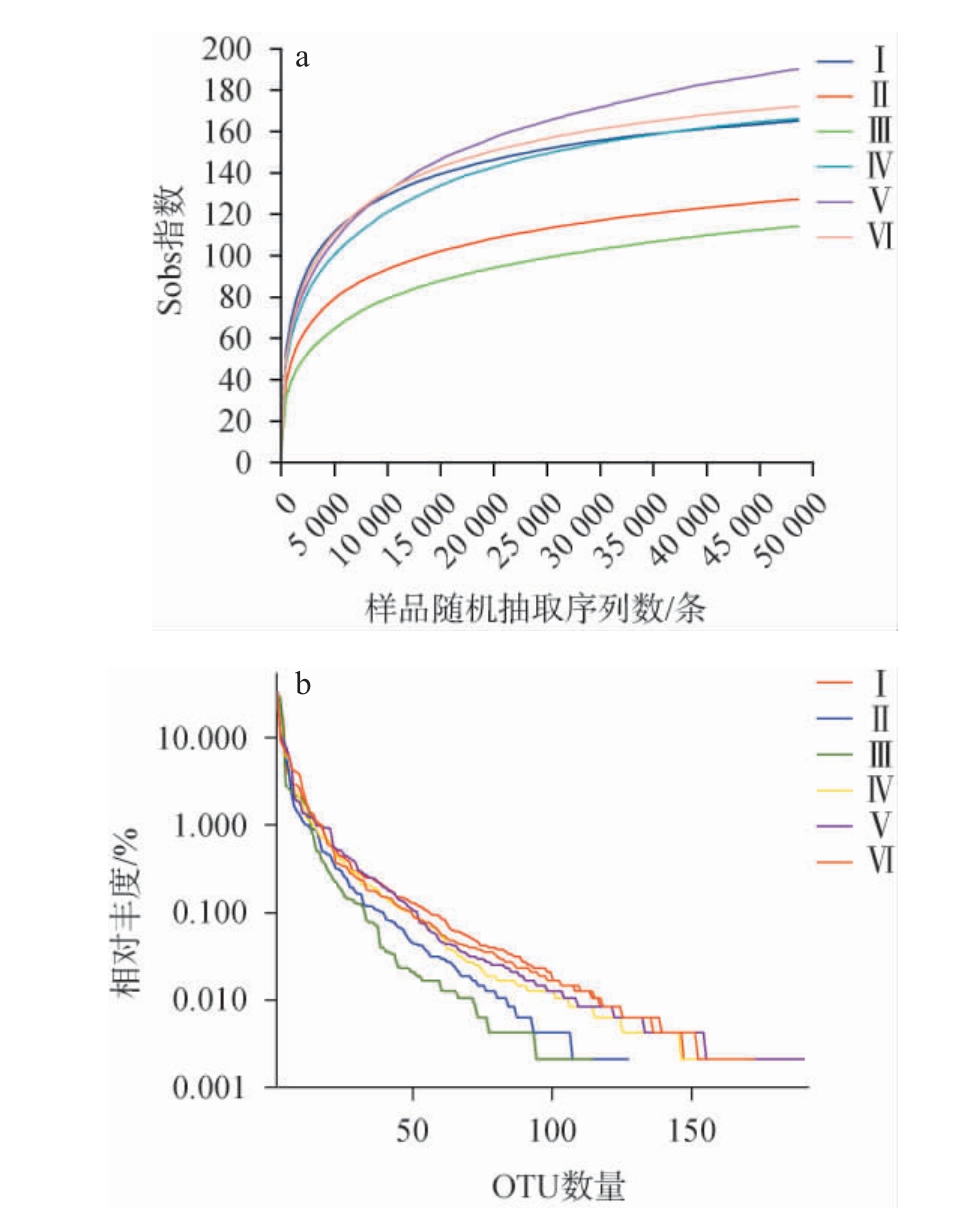
图3 不同发酵时间卤水样品细菌Sobs指数稀释曲线(a)及丰度等级曲线(b)
Fig.3 Sobs indexes dilution curves (a) and abundance grade curves(b) of bacteria in brine samples with different fermentation time
Alpha多样性分析主要通过多个多样性指数来评估环境样本中微生物群落的丰富度和多样性等信息,并通过组间差异检验探究如对照组和处理组Alpha多样性指数的差异性。不同发酵时间卤水样品中细菌菌群的Alpha多样性分析结果见表2。由表2可知,Ace指数和Chao1指数值显示,Ⅰ~Ⅵ号样品中Ⅴ号样品中物种丰富度最高,其次是Ⅵ号和Ⅰ号样本。Shannon指数值越高,群落的多样性越高;Simpson多样性指数值越小,群落多样性越高。由表2可知,Ⅰ号样品的细菌群落多样性最高,其次是Ⅵ号和Ⅴ号样品。
表2 不同发酵时间卤水样品中细菌菌群Alpha多样性指分析结果
Table 2 Alpha diversity analysis of bacterial flora of brine samples with different fermentation time
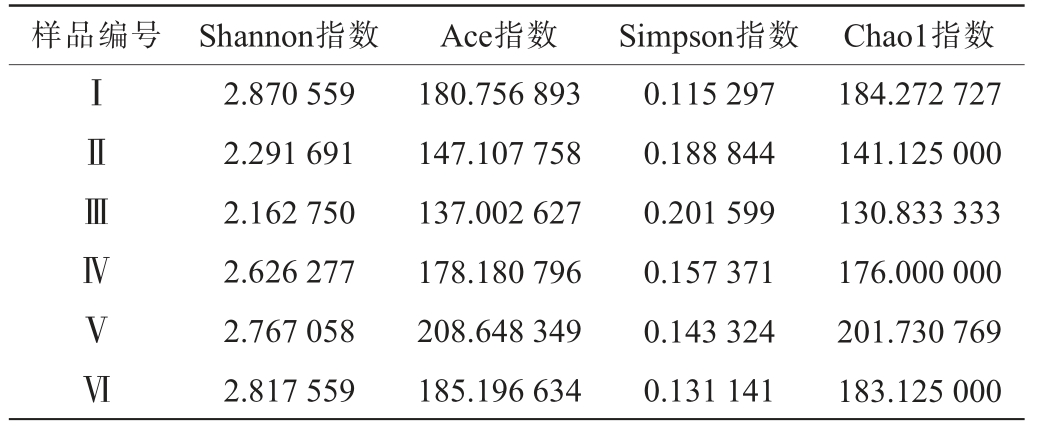
样品编号 Shannon指数 Ace指数 Simpson指数 Chao1指数ⅠⅡⅢⅣⅤⅥ2.870 559 2.291 691 2.162 750 2.626 277 2.767 058 2.817 559 180.756 893 147.107 758 137.002 627 178.180 796 208.648 349 185.196 634 0.115 297 0.188 844 0.201 599 0.157 371 0.143 324 0.131 141 184.272 727 141.125 000 130.833 333 176.000 000 201.730 769 183.125 000
Beta多样性是不同生态系统之间多样性的比较,样本物种组成越相似,反映在主成分分析(principal component analysis,PCA)中的距离越近。基于细菌属水平的不同发酵时间卤水样品主成分分析结果见图4。由图4可知,Ⅴ号和Ⅵ号样品与其他4个样品细菌群落差异性都相对较大,Ⅰ、Ⅱ和Ⅳ号样品之间细菌群落差异性相对较小。通过基于细菌属水平的主成分分析,可以有效区分不同发酵时间卤水样品。
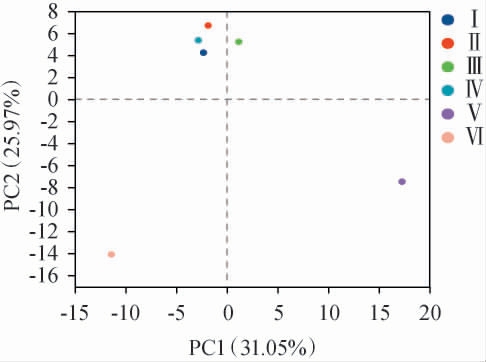
图4 基于细菌属水平的不同发酵时间卤水样品主成分分析
Fig.4 Principal components analysis of brine samples with different fermentation time based on bacterial genus level
2.2.3 不同发酵时间卤水样品中细菌群落结构分析
基于属水平的不同发酵时间卤水样品细菌群落组成见图5。由图5可知,不同发酵时间卤水样本中共发现140属,卤水中共鉴定出10个优势细菌属(相对丰度>1%),即Sporanaerobacter、梭菌属(Clostridium_sensu_stricto_7、Clostridium_sensu_stricto_1、Clostridium_sensu_stricto_15)、己酸菌属(Caproiciproducens)、普雷沃式菌属(Prevotella)、未分类梭菌科(unclassified_f__Clostridiaceae)、Haloimpatiens、链球菌属(Streptococcus)及Caldicoprobacter,其中Sporanaerobacter、Clostridium_sensu_stricto_1和己酸菌属(Caproiciproducens),其中Sporanaerobacter、Clostridium_sensu_stricto_1和Caproiciproducens为臭卤水中主要的优势细菌属。在Ⅰ~Ⅵ号卤水样本中,未分类梭菌科(unclassified_f__Clostridiaceae)在Ⅵ号卤水中占优势,相对丰度为15.71%,Sporanaer obacter在Ⅰ号、Ⅳ号和Ⅵ号中相对丰度分别为21.40%、33.69%和31.56%。己酸菌属(Caproiciproducens)则是Ⅲ号以及Ⅴ号样品的优势菌属,相对丰度分别为30.97%和33.01%。梭状芽孢杆菌属(Clostridium_sensu_stricto_1)在Ⅱ号样品中占优势,相对丰度为31.89%。从总体上看,Sporanaerobacter、梭状芽孢杆菌属(Clostridium_sensu_stricto_1)、己酸菌属(Caproiciproducens)这三种菌属为Ⅰ~Ⅵ号卤水样品中的优势菌,其中Sporanaerobacter占比最高,占比21.40%,梭状芽孢杆菌属(Clostridium_sensu_stricto_1)其次,占比18.19%。
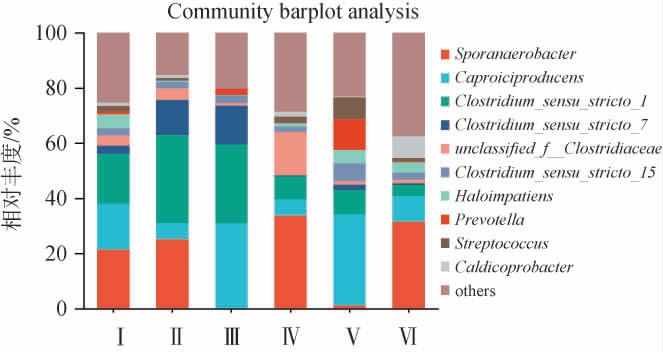
图5 基于属水平的不同发酵时间卤水样品细菌群落结构
Fig.5 Bacterial community structure of brine samples with different fermentation time based on genus level
2.3 不同发酵时间卤水样品中挥发性风味物质分析
采用固相微萃取结合气相色谱-质谱(SPME-GC-MS)分析得到的Ⅰ~Ⅵ号臭豆腐卤水样品中挥发性风味成分总离子流色谱图见图6,各挥发性风味物质相对含量见表3。由图6可知,Ⅰ、Ⅱ号样品的主峰比Ⅲ~Ⅵ号样品的主峰高但峰数少,说明其主要挥发性物质的含量多,但是挥发性物质种类较少。
表3 不同发酵时间卤水样品中挥发性风味物质相对含量
Table 3 Relative contents of volatile flavor substances in brine samples with different fermentation time
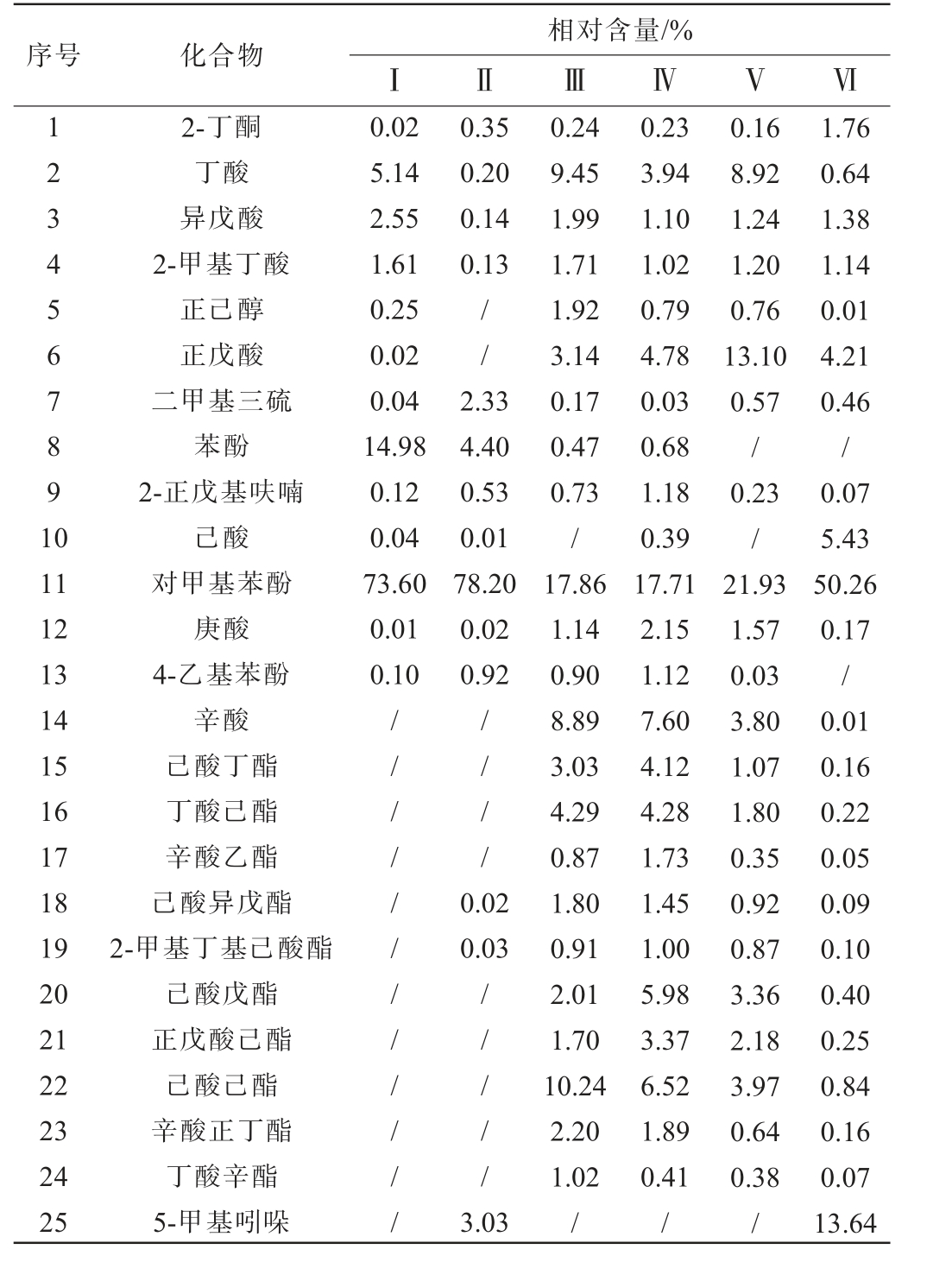
序号 化合物相对含量/%ⅠⅡⅢⅣⅤⅥ1 2 3 4 5 6 7 8 9 1 0 0.35 0.20 0.14 0.13//11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 2-丁酮丁酸异戊酸2-甲基丁酸正己醇正戊酸二甲基三硫苯酚2-正戊基呋喃己酸对甲基苯酚庚酸4-乙基苯酚辛酸己酸丁酯丁酸己酯辛酸乙酯己酸异戊酯2-甲基丁基己酸酯己酸戊酯正戊酸己酯己酸己酯辛酸正丁酯丁酸辛酯5-甲基吲哚0.02 5.14 2.55 1.61 0.25 0.02 0.04 14.98 0.12 0.04 73.60 0.01 0.10 2.33 4.40 0.53 0.01 78.20 0.02 0.92// / / / / / / / / / /// / /0.02 0.03// / / /3.03 0.24 9.45 1.99 1.71 1.92 3.14 0.17 0.47 0.73/17.86 1.14 0.90 8.89 3.03 4.29 0.87 1.80 0.91 2.01 1.70 10.24 2.20 1.02/0.23 3.94 1.10 1.02 0.79 4.78 0.03 0.68 1.18 0.39 17.71 2.15 1.12 7.60 4.12 4.28 1.73 1.45 1.00 5.98 3.37 6.52 1.89 0.41/0.16 8.92 1.24 1.20 0.76 13.10 0.57/0.23/21.93 1.57 0.03 3.80 1.07 1.80 0.35 0.92 0.87 3.36 2.18 3.97 0.64 0.38/1.76 0.64 1.38 1.14 0.01 4.21 0.46/0.07 5.43 50.26 0.17/0.01 0.16 0.22 0.05 0.09 0.10 0.40 0.25 0.84 0.16 0.07 13.64
续表

注:“/”表示未检出。
序号 化合物相对含量/%ⅠⅡⅢⅣⅤⅥ26 27 28辛酸戊酯辛酸己酯八硫杂环辛烷////0.23 0.68 1.25 2.26 0.15 2.53 1.22/1.86 0.62/0.47 0.18 10.95
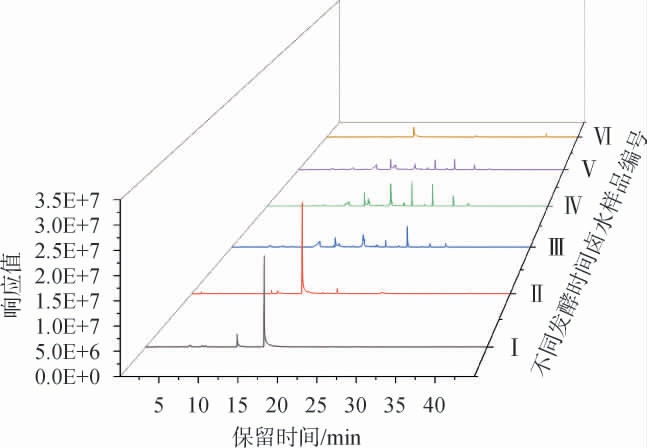
图6 不同发酵时间卤水样品挥发性风味物质气相色谱-质谱分析总离子流色谱图
Fig.6 Total ion chromatogram of volatile flavor substances in brine samples with different fermentation time by GC-MS analysis
由表3可知,不同发酵时间的卤水样品中共鉴定出115种挥发性风味物质,主要风味物质包括酸类7种、酮类1种、醇类1种、苯酚类3种、酯类12种、吲哚类1种和其他类3种。Ⅰ~Ⅵ号卤水样品中相对含量最大的化合物是对甲基苯酚,含量分别为73.60%、78.20%、17.86%、17.71%、21.93%和50.26%。Ⅰ号和Ⅱ号样品中苯酚相对含量分别为14.98%和4.40%。苯酚和对甲基苯酚在长期发酵的“臭味”食品中经常出现[24-25],呈酚醛、窖泥等特殊风味[25]。卤水中酸类和酯类种类最多,主要有丁酸、正戊酸、辛酸、己酸戊酯、己酸己酯,丁酸、正戊酸和辛酸赋予卤水中的酸臭和腐臭味,丁酸在Ⅰ号、Ⅲ号和Ⅴ号样品中相对含量较多,分别为5.14%、9.45%和8.92%,正戊酸是Ⅴ号卤水样品的主要挥发性物质之一,相对含量为13.10%;己酸戊酯和己酸己酯在臭豆腐中提供了“过熟苹果样”的气味,一般来说,酯类物质的宜人花果香味可以提升食品风味[26]。
结果表明,Ⅱ号卤水样品中挥发性风味物质种类较少且影响臭豆腐臭味的主要成分对甲基苯酚相对含量最高,用于臭豆腐生胚卤制最适宜。而Ⅵ号样品相对于其他样品来说发酵时间最长,挥发性风味物质种类杂且主要成分含量少,可见发酵时间太长也不利于臭卤水的“臭味”形成。
3 结论
采用固相微萃取结合GC-MS分析臭豆腐生产相关卤水挥发性成分、特征风味物质及其动态变化情况并采用16S rDNA法探究不同发酵时间卤水的优势细菌菌群。结果表明,不同发酵时间卤水中共鉴定到115种挥发性风味物质,其中主要包括酸、酯、苯酚、吲哚、醇、醚、酮类等,其中,2-丁酮、丁酸、异戊酸、2-甲基丁酸、正己醇、正戊酸、二甲基三硫、苯酚、2-正戊基呋喃、己酸、对甲基苯酚、庚酸、4-乙基苯酚、辛酸、己酸丁酯、丁酸己酯、辛酸乙酯、己酸异戊酯、2-甲基丁基己酸酯、己酸戊酯、正戊酸己酯、己酸己酯、辛酸正丁酯、丁酸辛酯、5-甲基吲哚、辛酸戊酯、辛酸己酯、八硫杂环辛烷等28种物质是卤水发酵过程中的特征风味物质。卤水中共鉴定出10个优势细菌属(相对丰度>1%),即Sporanaerobacter、梭菌属(Clostridium_sensu_stricto_7、Clostridium_sensu_stricto_1、Clostridium_sensu_stricto_15)、己酸菌属(Caproiciproducens)、普雷沃式菌属(Prevotella)、未分 类 梭 菌 科(unclassified_f__Clostridiaceae)、Haloimpatiens、链球菌属(Streptococcus)及Caldicoprobacter,其中Sporanaerobacter、Clostridium_sensu_stricto_1和己酸菌属(Caproiciproducens),其 中Sporanaerobacter、Clostridium_sensu_stricto_1和Caproiciproducens为臭卤水中主要优势菌。在Ⅰ~Ⅵ号样品中,Ⅱ号样品盐分含量3.01%,亚硝酸盐含量最低,为0.08 mg/kg,氨基酸态氮及总酸含量都较高,分别为0.73 g/100 mL和14.17 g/100 mL,主要挥发性风味物质对甲基苯酚相对含量最高,为78.20%。因此,以Ⅱ号样品的盐分含量及发酵时间为依据进行卤水制备,更有利于满足臭豆腐卤水的生产要求。
[1]唐辉,钟瑞敏,朱建华,等.电子鼻结合OAV分析臭豆腐卤水的挥发性成分及风味活性物质[J].中国食品学报,2021,21(3):351-359.
[2]范博望,任翊,樊青青,等.臭豆腐卤水中的主要发酵菌株及发酵研究[J].生物化工,2021,7(2):52-54.
[3]HOU J,GU J S,HE G Q,et al.Research progress of volatile flavor compounds in stinky tofu[J].Sci Technol Food Ind,2017,38(16):314-317.
[4]顾渭忠.一种油炸臭豆腐中药卤汁的制作方法:CN102018215A[P].2011-04-20.
[5]HAN B Z,FRANS M R,ROBERT M J,et al.Chinese fermented soybean food[J].J Food Microbiol,2001,65(1-2):1-10.
[6]WEI G,REGENSTEIN J M, LIU X, et al.Comparative aroma and taste profiles of oil furu(soybean curd)fermented with different mucor strains[J].J Food Sci,2020,85(6):1642-1650.
[7]MO H,KARILUOTO S,PIIRONEN V,et al.Effect of soybean processing on content and bioaccessibility of folate, vitamin B12 and isoflavones in tofu and tempe[J].Food Chem,2013,141(3):2418-2425.
[8]ABIRU Y,KUMEMURA M,UENO T,et al.Discovery of an S-equol rich food stinky tofu,a traditional fermented soy product in Taiwan[J].Int J Food Sci Nutr,2012,63(8):964-970.
[9]叶琳洋,康琴,李刚,等.气-液微萃取和GC-MS对臭豆腐中挥发性成分提取与分析[J].食品工业科技,2020,41(12):47-55.
[10]LI P, XIE J, TANG H, et al.Fingerprints of volatile flavor compounds from southern stinky tofu brine with headspace solid-phase microextraction/gas chromatography-mass spectrometry and chemometric methods[J].Food Sci Nutr,2019,7(2):890-896.
[11]WEI G,YANG Z,REGENSTEIN J M,et al.Characterizing aroma profiles of fermented soybean curd with ageing solutions during fermentation[J].Food Biosci,2020,33:100508.
[12]WANG Y, GAO Y, LIANG W, et al.Identification and analysis of the flavor characteristics of unfermented stinky tofu brine during fermentation using SPME-GC-MS, e-nose, and sensory evaluation[J].J Food Measure Character,2020,14(1):597-612.
[13]郑兵福,徐睿烜,蒋立文.油炸对臭豆腐中挥发性风味物质的影响[J].中国酿造,2019,38(3):14-17.
[14]张静,林锦峰,康彩玲,等.薄荷、茉莉花、荷叶臭豆腐发酵工艺的研究[J].中国酿造,2019,38(7):184-188.
[15]JYC A,SQLA B.Effect of single amino acid addition on growth kinetics and flavor modulation by Torulaspora delbrueckii in soy(tofu)whey alcoholic beverage fermentation[J].Food Res Int,2020,135:109283.
[16]唐辉,蒋立文,谢靓,等.基于SPME-GC-MS和化学计量法分析长沙臭豆腐卤水挥发性风味物质[J].食品与机械,2019,35(1):60-68.
[17]国家卫生和计划生育委员会.GB 5009.235—2016 食品安全国家标准 食品中氨基酸态氮的测定[S].北京:中国标准出版社,2016.
[18]国家食品药品监督管理总局,国家卫生和计划生育委员会.GB5009.33—2016 食品安全国家标准食品中亚硝酸盐与硝酸盐的测定[S].北京:中国标准出版社,2016.
[19]国家卫生健康委员会,国家市场监督管理总局.GB 12456—2021 食品安全国家标准食品中总酸的测定[S].北京:中国标准出版社,2021.
[20]陈晓艺.冬笋和豆腐花对臭豆腐卤水挥发性成分的影响[D].长沙:湖南农业大学,2019.
[21]李里.臭豆腐风味产生菌的分离、鉴定及风味产生机理初探[D].武汉:华中农业大学,2010.
[22]马延岩.发酵蔬菜中亚硝酸盐的生成及降解机理研究[D].天津:天津科技大学,2010.
[23]国家市场监督管理总局,国家卫生健康委员会.GB 2762—2022 食品安全国家标准食品中污染物限量[S].北京:中国标准出版社,2022.
[24]TANG H,MA J K,CHEN L,et al.GC-MS characterization of volatile flavor compounds in stinky tofu brine by optimization of headspace solidphase microextraction conditions[J].Molecules,2018,23(12):3155-3169.
[25]YUKI S, TADASHI S, KOJI N, et al.Identification of phenol- and p-cresol-producing intestinal bacteria by using media supplemented with tyrosine and its metabolites[J].FEMS Microbiol Ecol,2018,94(9):125-136.
[26]RÊGO E, ROSA C A, FREIRE A L, et al.Cashew wine and volatile compounds produced during fermentation by non-Saccharomyces and Saccharomyces yeast[J].LWT-Food Sci Technol,2020,126(1):109291.