酱香型白酒是中国四大基本香型白酒之一,其以高温大曲作为发酵剂,以高粱为主要原料,经固态发酵酿造而成[1-2]。“曲为酒之魂”,制好曲才能产好酒。酱香型大曲是以纯种小麦为原料制成的含有多种微生物和酶的糖化发酵剂[3],大曲中的微生物分泌例如蛋白酶、淀粉酶、果胶酶等多种水解酶类将蛋白质、脂肪、淀粉和纤维素等原料分解成小分子物质,使其具有糖化、发酵、芳香化等功能,在白酒酿造中发挥着重要作用[4-5]。酱香型白酒大曲发酵过程主要包括曲块入仓、两次翻仓及出仓,后续贮存3~6个月再用于生产制酒中,曲块温度最高达58~65 ℃,持续3~5 d[6]。翻仓是曲块入仓后重要操作环节,通过翻仓可以调节曲块发酵温湿度、改善曲块通气性、促进有益微生物生长代谢,进而提高曲块成熟度和质量[7]。在制曲过程中曲块入仓5~7 d温度达到59 ℃左右时进行第一次翻仓,之后温度再次升高至60~65 ℃进行第二次翻仓,此次翻仓利于通过温度梯度筛选耐热菌,同时促进曲块内部糖化酶、酸性蛋白酶等均匀分布提升液化力与酯化力等,翻仓结束后曲块进入稳定发酵期,维持高温(60~63 ℃)9~11 d使耐热微生物充分代谢,出仓曲温度一般在60 ℃,大曲中的微生物群落趋于均匀化,细菌和霉菌数量减少,而功能性微生物逐渐占据优势,最终曲块经自然降温、拆草、储存6个月以上完成陈化[8-9]。
酱香型大曲的理化指标可反映大曲品质优劣[10-11]。地区及生产工艺差异对大曲理化指标及微生物菌群均有一定影响。如南方大曲(HB)水分和酸度显著高于北方大曲(SX),可能与湿热气候下微生物代谢活性较高有关,同时HB淀粉含量和糖化力高,SX则液化力和酯化力水平更高,可能与北方大曲中芽孢杆菌和嗜热真菌的富集有关[12]。冯方剑等[13]研究表明,贵州与四川产地的大曲水分、酸度、糖化力无显著性差异,但贵州地区的大曲吡嗪类物质含量丰富。侯强川等[14]研究表明,茅台大曲菌群的丰度和多样性、菌群彼此间的相关关系及菌群中移动元件含量均显著高于尧治河大曲,而尧治河白曲菌群对原料中的蛋白质和脂质潜在利用率更高。
针对大曲的研究目前集中在感官、理化指标、优势微生物及挥发性风味化合物[15]等方面。YU Q[12]等研究表明,南方大曲以吡嗪类和醛类为主,贡献“酱香”特征;北方大曲以醇类和酯类为主,形成“清甜”风味。LI Z G等[16]分析来自不同地区的酱香型大曲风味化合物与微生物,发现曲霉与戊酸乙酯呈正相关,而毕赤酵母则抑制苯甲醛生成等。PANG Z M等[17]研究表明,北方高温大曲因气候湿度差异,水分含量与南方不同,生产工艺差异如温度也会导致理化指标和微生物群落变化,从而影响风味。
本研究以贵州省仁怀市茅台镇核心地区(A)及仁怀市名酒工业园区(B)酱香型高温大曲为研究对象,对其制曲过程中的入仓发酵曲(生曲)、一次翻仓曲、二次翻仓曲及出仓曲理化指标、挥发性风味化合物进行分析,对挥发性风味化合物进行偏最小二乘-判别分析(partial least square-discriminant analysis,PLS-DA),结合变量重要性投影(variable importance in the projection,VIP)值确定显著差异挥发性风味化合物(VIP>1,P<0.05),并基于显著差异挥发性风味化合物进行聚类分析以期探究地域环境因素对大曲制曲过程的差异化影响,为酱香型白酒的品质提升和标准化生产奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
于贵州茅台镇核心地区(A)、仁怀市名酒工业园区(B)制曲车间选取制曲工艺成熟、成品曲质量稳定且具有一定代表性的两个制曲仓,以入仓发酵曲(生曲)(SQ)、一次翻仓曲(YF)、二次翻仓曲(EF)及出仓曲(CC)4个节点作为仓内发酵阶段的取样时间点,共计32个样品。A、B地区制曲原料均采用软硬混合的普通小麦,制曲方式均为机械制曲。生曲样品取当日车间用样品,一翻曲、二翻曲和出仓曲取仓内上、中、下取样点,分别选取3个,共计9个取样点,将上述9个取样点样品混合得到最终混合样品。大曲采用五点取样法,选取曲块四周及曲心位置分别取样,混匀样品。
1.1.2 试剂
乙酸:天津市科密欧化学试剂有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):福州飞净生物科技有限公司;氢氧化钠:天津大茂化学试剂厂;酪蛋白:北京索莱宝科技有限公司;乳酸钠:上海沪试实验室器材股份有限公司;L-酪氨酸:天津市光复科技发展优选公司;原碘液:天津市致远化学试剂有限公司;无水乙醇:天津市风船化学试剂科技有限公司。所用试剂均为分析纯。
1.2 仪器与设备
ME204T电子天平:梅特勒托利多科技(中国)有限公司;SHP-250B生化培养箱:天津市泰斯特仪器有限公司;BUCHI R-215型旋转蒸发仪:瑞士步琦有限公司;Evolution 350紫外可见分光光度计、Trace 1310-ISO气质联用仪:赛默飞世尔科技公司。
1.3 方法
1.3.1 高温大曲理化指标及酶活力检测
水分、酸度:参考中华人民共和国轻工行业标准QB/T 4257—2011《酿酒大曲通用分析方法》中的恒重法及电位滴定法[18]。
糖化酶活力:采用DNS法测定。1 g酶液在40 ℃、pH 4.6,1 g大曲1 h分解可溶性淀粉产生1 mg葡萄糖的酶量定义为1个酶活力单位,以U/g为单位计[18]。
液化酶活力:采用分光光度法测定。1 g固体酶粉,于60 ℃、pH 6.0条件下,1 min液化1 mg可溶性淀粉,即为1个酶活力单位,以U/g表示[19]。
酯化酶活力:采用皂化法测定。按照每25 g大曲在35 ℃经7 d催化己酸和乙醇合成己酸乙酯,测定所生成的总酯(以己酸乙酯计),以U/g表示[18]。
酸性蛋白酶活力:采用福林法测定。1 g干曲在40 ℃、pH 3.0条件下,1 min水解酪蛋白生成1 μg酪氨酸所需要的酶量为1个酶活力单位,以U/g表示[20]。
1.3.2 高温大曲挥发性风味化合物检测
采用顶空固相微萃取气质联用技术(headspace solidphase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)检测高温大曲挥发性风味化合物。
样品预处理:称取1 g生曲样品加入20 mL顶空瓶中,再加入内标2-辛醇20 μL(0.082 mg/mL);分别称取1 g一次翻仓曲、二次翻仓曲、出仓曲加入20 mL顶空瓶中,再加内标2-辛醇5 μL(0.82 mg/mL)。
HS-SPME条件:将装有样品的顶空进样瓶在65 ℃条件下平衡5 min;吸附样本前,SPME纤准头250 ℃老化10 min;将老化后的萃取头VAB/CAR/PDMS(50 μm/30 μm)转移至孵育室,65 ℃吸附50 min;待吸附和萃取结束后,将萃取头转移至GC进样口,250 ℃解吸附5 min。
GC 条件:HP-INNOWAX 色谱柱(60 m×0.25 mm×0.25 μm),进样口温度250 ℃,载气为高纯氦气(He),柱流量1 mL/min,分流进样,分流比为1∶5。起始温度40 ℃保持2 min,以3 ℃/min升至100 ℃,保持2 min,之后以5 ℃/min升至230 ℃,保持10 min。MS条件:电子电离(electronic ionization,EI)源,离子源温度250 ℃,传输线250 ℃,质谱扫描范围为35~550 m/z。
定性定量分析:根据质谱信息,与美国国家标准技术研究所(national institute of standards and technology,NIST)20谱库进行对比,同时结合保留指数(retention index,RI)对化合物进行定性分析。采用内标法对挥发性物质进行定量分析。
1.3.3 数据分析
多变量统计分析采用IBM SPSS Statistics26.0等软件,图表绘制采用Origin 2021、SIMCA14.1等软件。
2 结果与分析
2.1 不同地区高温大曲制曲过程中理化指标及酶活测定结果
水分、酸度等基本理化指标可一定程度反映大曲品质的优劣。糖化力、液化力、酸性蛋白酶活力、酯化力等反映大曲的酶系功能,对大曲品质有重要影响[21-22]。A、B两地区高温大曲制曲过程中理化指标及酶活检测结果见表1。
表1 A、B两地区高温大曲制曲过程中理化指标及酶活检测结果
Table 1 Results of physiochemical indicators and enzyme activity tests during high-temperature Daqu making process in region A and B
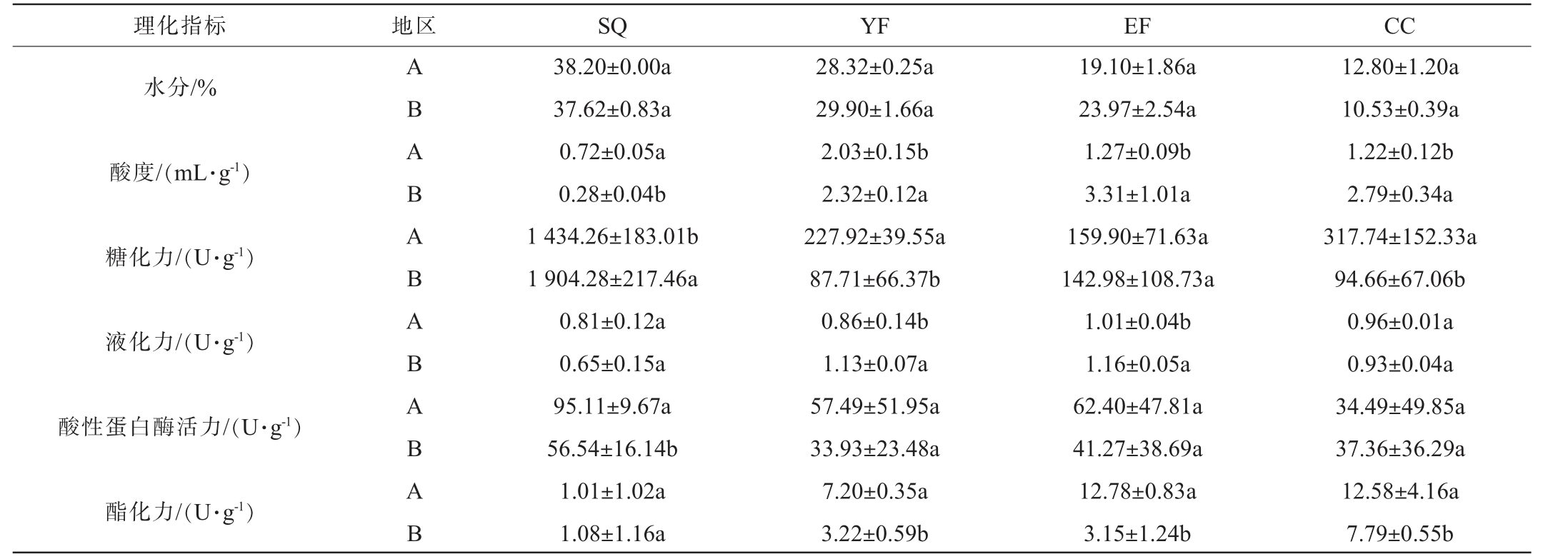
注:表中不同的小写字母表示A、B地区高温大曲理化指标及酶活差异显著(P<0.05)。
理化指标 地区 SQ YF EF CC水分/%酸度/(mL·g-1)糖化力/(U·g-1)液化力/(U·g-1)酸性蛋白酶活力/(U·g-1)酯化力/(U·g-1)A B A B A B A B A B A B 38.20±0.00a 37.62±0.83a 0.72±0.05a 0.28±0.04b 1 434.26±183.01b 1 904.28±217.46a 0.81±0.12a 0.65±0.15a 95.11±9.67a 56.54±16.14b 1.01±1.02a 1.08±1.16a 28.32±0.25a 29.90±1.66a 2.03±0.15b 2.32±0.12a 227.92±39.55a 87.71±66.37b 0.86±0.14b 1.13±0.07a 57.49±51.95a 33.93±23.48a 7.20±0.35a 3.22±0.59b 19.10±1.86a 23.97±2.54a 1.27±0.09b 3.31±1.01a 159.90±71.63a 142.98±108.73a 1.01±0.04b 1.16±0.05a 62.40±47.81a 41.27±38.69a 12.78±0.83a 3.15±1.24b 12.80±1.20a 10.53±0.39a 1.22±0.12b 2.79±0.34a 317.74±152.33a 94.66±67.06b 0.96±0.01a 0.93±0.04a 34.49±49.85a 37.36±36.29a 12.58±4.16a 7.79±0.55b
由表1可知,在制曲过程中,A、B地区高温大曲水分含量无显著差异(P<0.05)。两地区的高温大曲水分含量逐渐降低,A、B地区高温大曲发酵过程中水分含量分别从38.20%、37.62%降低至12.80%、10.53%,其原因可能是大曲发酵过程中温度逐渐升高。制曲过程水分一般由最开始的36%~43%,经升温期和高温期降至20%~25%,成熟期时降至8%~13%。
A地区高温大曲在YF时酸度达到最高值(2.03 mL/g),B地区高温大曲则在EF时酸度达到最高值(3.31 mL/g),一次翻仓之后B地区高温大曲的酸度均显著高于A地区(P<0.05)。可能是由于温度升高,适宜温湿度条件导致产酸微生物增加,造成有机酸积累[23]。
A、B地区高温大曲糖化力均在入仓时期最高,分别为1 434.26 U/g和1 904.28 U/g,B地区高温大曲糖化力显著高于地区A,之后两地区高温大曲糖化力下降后有所增加,其原因可能是因为生曲入仓时温度较低,霉菌等微生物生长代谢,糖化力较高,后续温度迅速上升,霉菌数量降低,使糖化力急剧下降;发酵后期温度下降,霉菌又开始繁殖代谢产酶活力提高,糖化力逐渐回升[24]。
A、B地区高温大曲液化力在制曲过程中均呈先升后降的趋势,在二次翻仓时均达到最大值(1.01 U/g、1.16 U/g),随后由于温度过高,液化力下降,出仓时液化力在0.90 U/g左右。B地区一次翻仓和二次翻仓时大曲液化力显著高于A地区(P<0.05)。大曲液化力与原料、工艺参数、微生物组成和环境等多因素有关,如水分控制在34%~40%时,微生物代谢最活跃;过高会抑制好氧菌(如曲霉属)生长导致酶活下降;通风不足时厌氧菌(如乳酸菌)占优,产酸抑制淀粉酶活[25-26]。
A、B地区高温大曲酸性蛋白酶活力在发酵过程中均整体呈下降趋势,入仓时A地区高温大曲酸性蛋白酶活力(95.11 U/g)显著高于B地区(56.54 U/g)(P<0.05),之后两地区高温大曲酸性蛋白酶活力差异不显著(P>0.05),但出仓时两地区酸性蛋白酶活接近。酸性蛋白酶主要由霉菌和细菌产生,在低pH条件下可溶解发酵原料,促进微生物繁殖,在白酒发酵过程中起协同作用[27-28]。
A、B地区高温大曲酯化力均逐渐增加,出仓时均达到最大值(分别为12.58 U/g、7.79 U/g),除入仓时,A地区高温大曲酯化力显著高于B地区(P<0.05),说明该地区大曲催化合成酯的能力较高或产酯量更高。研究表明,温度直接影响其理化指标和微生物群落结构,高温大曲(如黄曲)具有较高的糖化力和酯化力[31]。
2.2 不同地区高温大曲制曲过程中挥发性风味化合物分析
2.2.1 不同地区高温大曲制曲过程中挥发性风味化合物种类分析
高温大曲是酱香型白酒风味的重要来源,制曲过程中,由于微生物生长繁殖及热效应产生各种挥发性化合物[32]。A、B地区高温大曲发酵过程中挥发性风味化合物检测结果见图1。
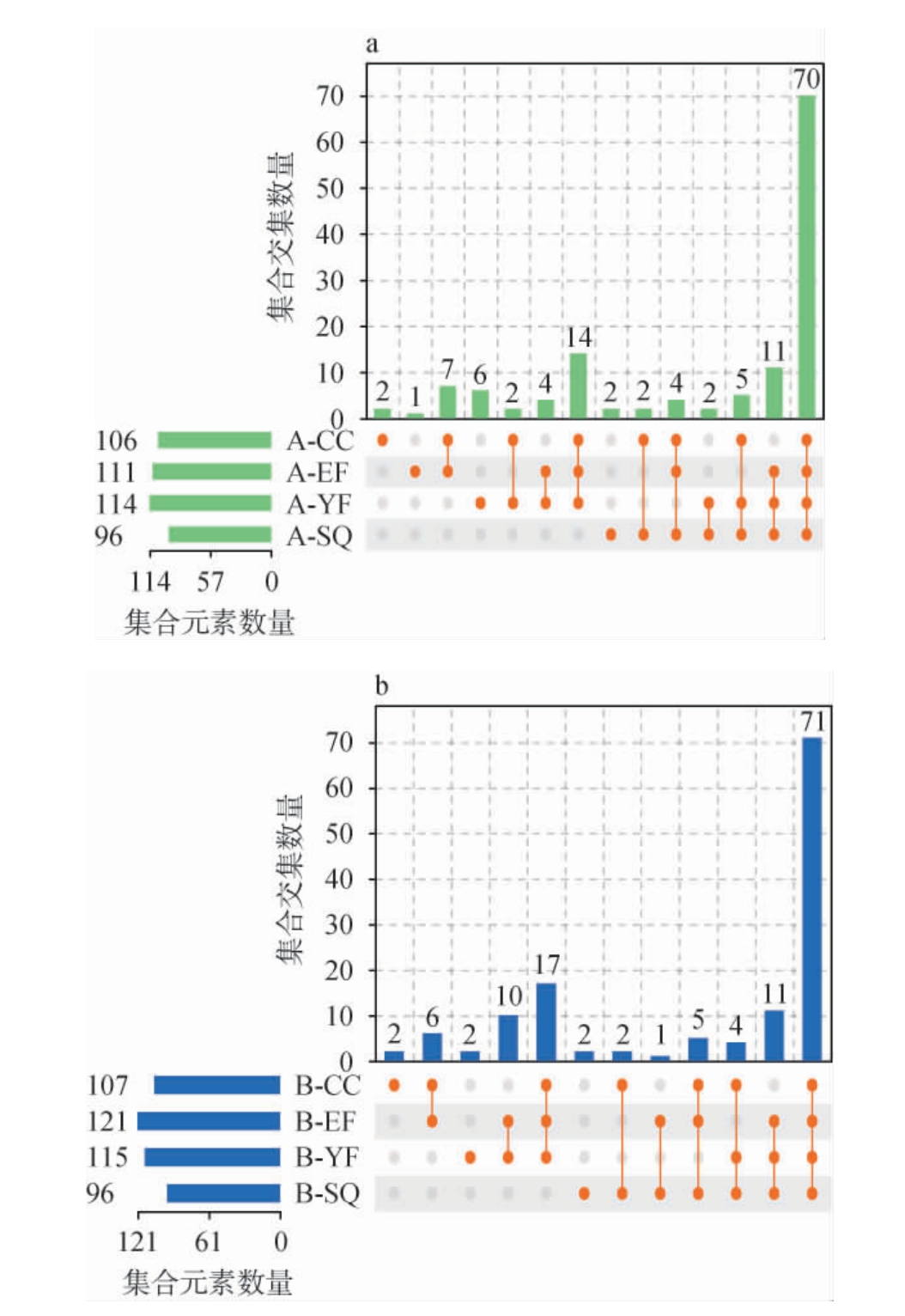
图1 A(a)、B(b)地区高温大曲制曲过程中挥发性风味化合物UpSet图
Fig.1 UpSet diagram of volatile flavor compounds during the hightemperature Daqu making process in region A (a) and B (b)
由图1a可知,A、B地区高温大曲制曲过程中分别检测出挥发性风味化合物114和121种,A地区生曲、一次翻仓、二次翻仓和出仓曲样品中分别检测到挥发性风味化合物96种、114种、111种、106种,B地区生曲、一次翻仓、二次翻仓和出仓曲样品中分别检测到挥发性风味化合物96种、115种、121种、107种。随着发酵的进行,检测到的挥发性风味化合物的数量先增加后降低,两地区均在发酵高温期(一次翻仓和二次翻仓)挥发性风味化合物种类更丰富,且地区B挥发性风味化合物种类略高于A。
A、B两地区高温大曲在入仓发酵阶段(SQ)均独有2种挥发性风味化合物,A地区为辛酸、苯甲酸乙酯,B地区为2,3-丁二酮、苯乙烯。在一次翻仓时分别独有6种和2种挥发性风味化合物,在A地区为乙酸异戊酯、乳酸乙酯、2,3-丁二酮、糠醛等,B地区为辛酸、庚酸乙酯。二次翻仓(EF)时A地区独有亚麻酸乙酯1种物质,B地区无独有化合物。出仓(CC)时A、B均独有2种挥发性风味化合物,在A地区为2-异丁基-3,5,6-三甲基吡嗪和3-辛酮,B地区为2-异丁基-3,5,6-三甲基吡嗪和异丁酸甲酯。在整个制曲过程中两地区高温大曲共有的挥发性风味化合物分别为70和71种。A、B地区高温大曲制曲过程中挥发性风味化合物含量、种类等存在一定差异,可能与不同时期微生物有关。不同发酵阶段大曲独有挥发性物质种类较少,说明挥发性风味化合物的形成相对较稳定,新物质形成大多在翻仓时,可能在该阶段微生物多样性、环境等因素变化较明显[33]。
2.2.2 不同地区高温大曲制曲过程中挥发性风味化合物含量分析
A、B地区高温大曲制曲过程中各类别挥发性风味化合物的含量变化见图2。由图2a可知,酯类物质含量在整个制曲过程中均最高,且呈先升高后下降的趋势,A、B地区高温大曲酯类物质在生曲中含量分别12.44 μg/g和18.27 μg/g,在一次翻曲时含量达到最高,分别为72.178 μg/g、86.903 μg/g,出仓时分别为48.73 μg/g、37.53 μg/g。酸类物质均呈现先升后降趋势,A地区高温大曲在一次翻仓时达到最高值(6.96 μg/g),B地区高温大曲酸类物质在二次翻仓时达到最高值(6.92 μg/g),出仓时分别为6.28 μg/g和6.68 μg/g。酸类物质含量在前期呈上升趋势主要由于乳酸菌和醋酸菌在大曲发酵初期快速增殖,通过糖酵解途径生成乳酸、乙酸等短链酸,后期产酯微生物将酸类物质通过酯化反应转化为酯类,导致酸含量下降,也可能是由于翻仓前温度升高、水分下降,使微生物的生长代谢活动减弱,产酸减少[34]。A、B地区高温大曲醛酮类物质含量呈现先升后降趋势,在一次翻仓时达到最高值,分别为21.09 μg/g和18.86 μg/g,出仓时无明显差异。醛酮类主要由醇类物质氧化、氨基酸脱氨、脱羧等方式形成,与醇、酸类物质含量呈正相关[35]。A、B地区高温大曲中醇类物质含量在生曲中最低,分别为0.65 μg/g和0.67 μg/g,之后呈先升后降趋势,在一次翻仓达到最高值11.38 μg/g、9.46 μg/g,出仓时A地区高温大曲醇类物质含量(6.01 μg/g)高于B地区(3.73 μg/g),发酵前期酵母菌丰度增加醇类物质含量增加,后期温度升高,酵母菌生长被抑制,导致醇类物质含量降低[36]。A、B地区高温大曲中吡嗪类物质含量生曲阶段最低,随发酵的进行持续升高,出仓时均达到最高值(21.17 μg/g、5.75 μg/g),A地区出仓曲中吡嗪类物质含量明显高于B地区,吡嗪类由美拉德反应或乙偶姻与氨/铵盐通过非酶促反应生成,制曲温度高时利于吡嗪的形成[37-38]。
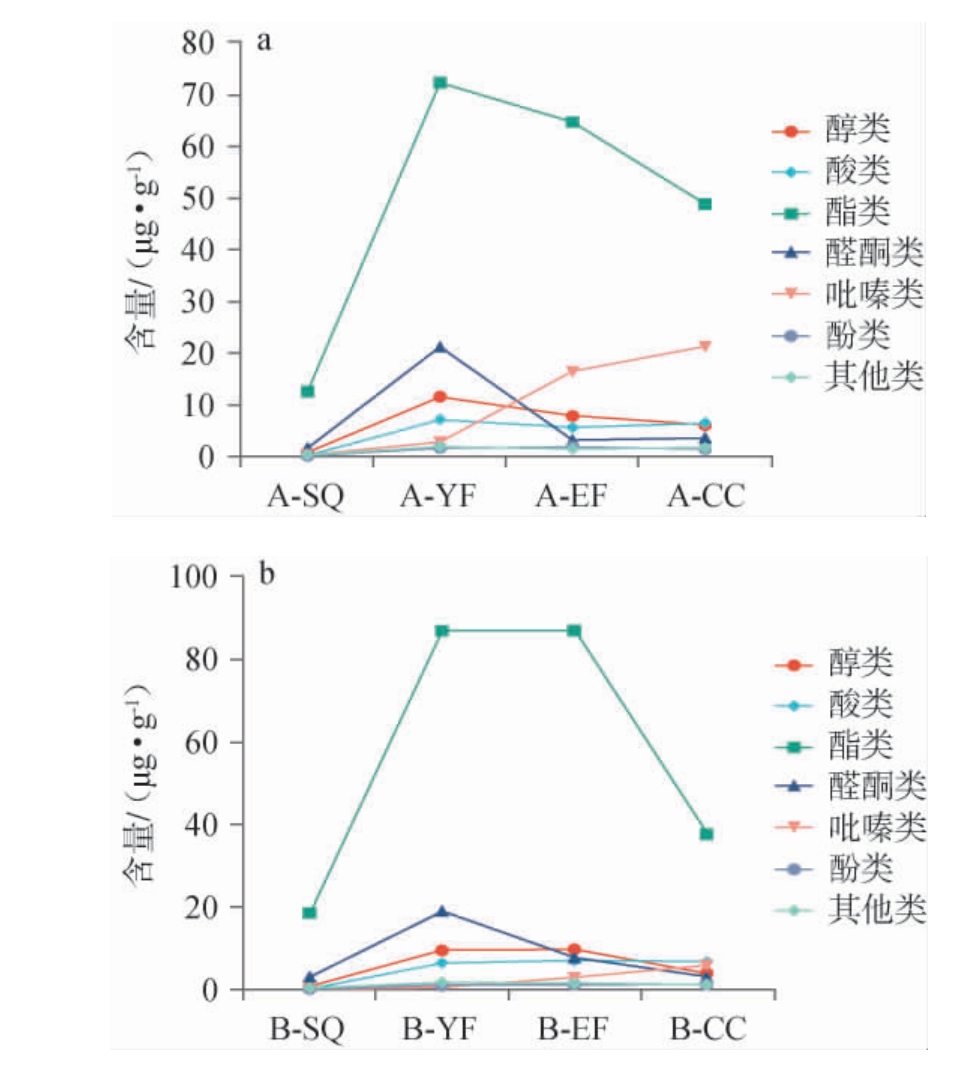
图2 A(a)、B(b)地区高温大曲制曲过程中各类别挥发性风味化合物含量变化
Fig.2 Content changes of various types volatile flavor compounds during the high-temperature Daqu making process in region A (a) and B (b)
综上所述,A、B地区高温大曲制曲过程中不同种类的挥发性风味化合物在数量和含量上均有一定差异,B地区在一次翻仓和二次翻仓时酯类物质高于A地区,而A地区吡嗪类化合物含量明显高于B地区。不同地区高温大曲中吡嗪类化合物含量的差异主要是由微生物菌群、原料、生产工艺、贮存条件以及地理环境等因素共同作用的结果。这些因素影响微生物代谢活动、化学反应路径等,最终决定了酱香型大曲中吡嗪类化合物的种类和含量。
2.3 不同地区高温大曲制曲过程中挥发性风味化合物差异分析
为了进一步明确不同地区制曲过程中的差异,对高温大曲挥发性风味化合物检测结果进行偏最小二乘判别分析(PLS-DA),结果见图3。由图3a可知,A、B两个地区大曲PLS-DA分析中自变量拟合指数(R2X)为0.673,因变量拟合指数(R2Y)为0.984,模型预测指数(Q2)为0.966,两地区大曲挥发性化合物各自聚类,具有明显差异,可见地区差异对大曲挥发性风味化合物组成有一定影响。由图3b可知,随着置换保留度逐渐降低,随机模型的R2和Q2均逐渐下降,说明原模型不存在过拟合现象,模型稳健性良好。
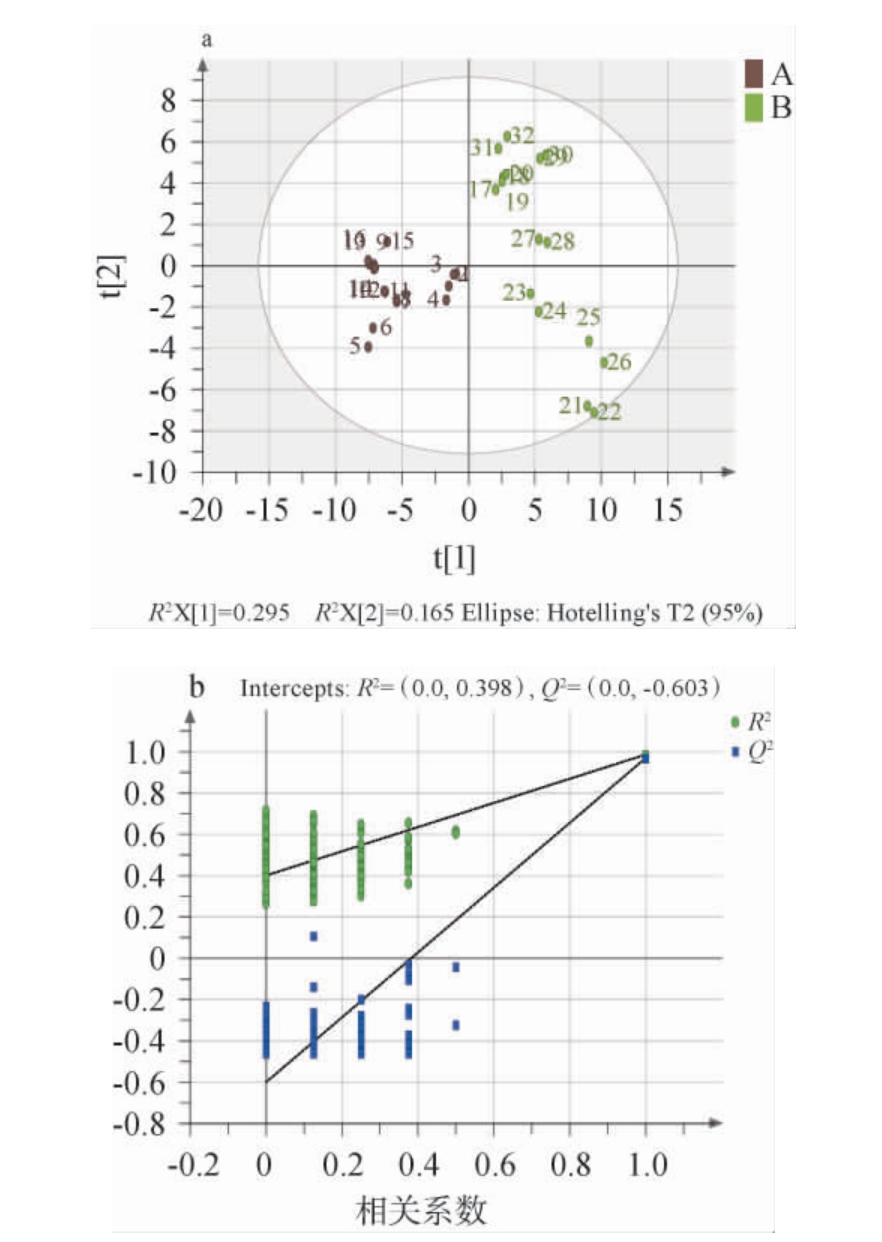
图3 A、B地区高温大曲制曲过程挥发性风味化合物偏最小二乘-判别分析模型得分图(a)及置换检验结果(b)
Fig.3 Partial least squares discriminant analysis model score chart (a)and permutation test results(b)of volatile flavor compounds during the high-temperature Daqu making process of region A and B
变量重要性投影(VIP)值表征了分类过程中各个变量的重要性,通常VIP值>1的变量在不同样本组之间的区分中起着重要作用。根据VIP值>1,P<0.05的标准筛选显著差异挥发性风味化合物,A、B地区高温大曲制曲过程中显著差异挥发性风味化合物共53种,其中,醇类2种、酯类33种、醛酮类9种、吡嗪类3种及其他类6种。因此,酯类是造成A、B地区大曲制曲过程风味差异的主要挥发性风味化合物。选取A、B两地区高温大曲样品中检出的显著差异挥发性风味化合物(VIP值>1,P<0.05)进行聚类分析,结果见图4。由图4可知,A、B两地区高温大曲显著差异挥发性风味化合物均在翻仓时含量升高。高温大曲中差异挥发性风味化合物中,醇类物质为2,3-丁二醇和2-乙基己醇,均为A地区高温大曲中含量较高。吡嗪类物质中2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪在A地区高温大曲中含量明显高于B地区,吡嗪类物质赋予酱香型大曲独特的焦香和烘焙香,对后续酱香型白酒的风味口感也有重要影响。醛酮类物质中2,3-丁二酮、苯乙酮、3-辛酮等在B地区高温大曲中含量较高。酯类物质中棕榈酸甲酯、亚油酸甲酯及月桂酸甲酯等在A地区高温大曲中含量较高;月桂酸乙酯、亚麻酸乙酯、庚酸乙酯、乙酸苯乙酯等在B地区高温大曲中含量较高。
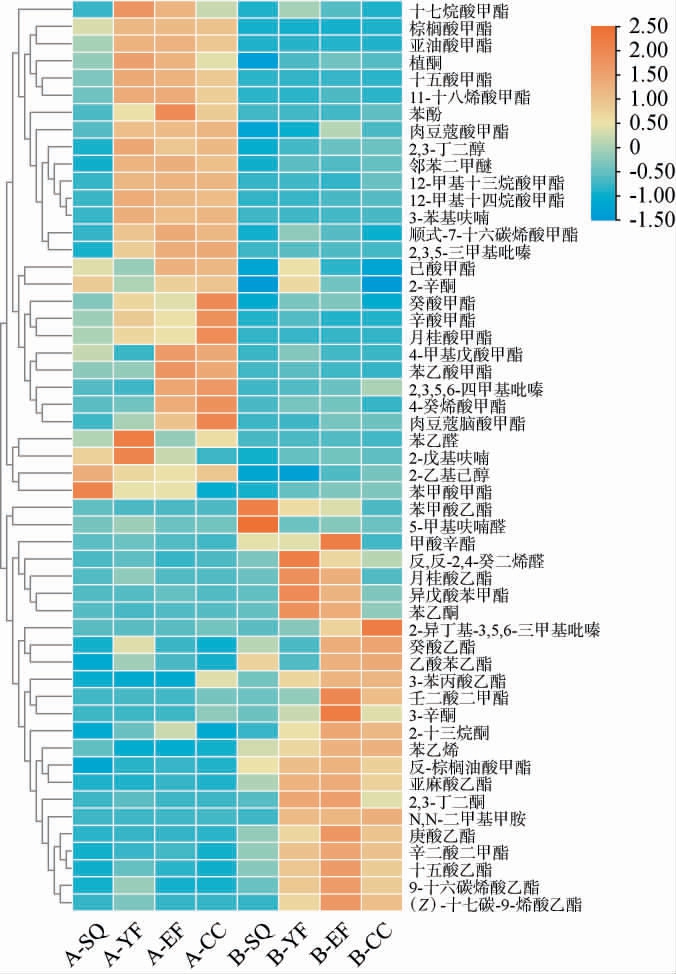
图4 A、B地区高温大曲制曲过程中显著差异挥发性风味化合物聚类分析热图
Fig.4 Cluster analysis heatmap of significantly differential volatile flavor compounds during the high-temperature Daqu making process of region A and B
对A、B两地区出仓曲中显著差异挥发性风味化合物分析结果表明,A地区出仓曲中4-甲基戊酸甲酯、己酸甲酯、辛酸甲酯、癸酸甲酯、苯乙酸甲酯、月桂酸甲酯、肉豆蔻酸甲酯、棕榈酸甲酯、亚油酸甲酯等17种酯类物质含量均明显高于B地区;B地区出仓曲中庚酸乙酯、苯甲酸甲酯、癸酸乙酯、乙酸苯乙酯、十五酸乙酯、9-十六碳烯酸乙酯及亚麻酸乙酯等12种酯类物质含量明显高于A地区。此外,A地区出仓曲2,3-丁二醇、2-辛酮、苯乙醛、植酮、2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪、邻苯二甲醚和苯酚含量明显高于B地区;而B地区出仓曲中2,3-丁二酮、3-辛酮、苯乙酮、2-十三烷酮、2-异丁基-3,5,6-三甲基吡嗪和苯乙烯等含量明显高于A地区。酯类物质可能是造成A、B地区出仓曲风味和感官差异的重要原因之一。挥发性风味化合物与高温大曲感官特征密切相关,依据上述A、B两地区出仓曲挥发性风味化合物差异分析其出仓曲感官风味特征发现,A地区出仓曲感官品质良好,其中黑黄曲带有咖啡香、烘焙香、酱香、焦糊香和弱氨味,具有典型大曲酱香风格。B地区出仓曲曲块完整度较好,其中黄曲占比较多,曲香味明显。由于优质大曲具有大量的优势微生物,其代谢物质使得大曲风味品质越高,其曲香、酱香和烘香的对应强度越高,大曲整体香气越浓郁[39-40]。
酱香型大曲中的挥发性风味化合物与多种因素密切相关,主要包括制曲环境、生产工艺、理化指标等,发酵过程代谢产物变化与环境中的微生物密切相关。霉菌具有一定糖化发酵力和较强的酯化力,其在发酵过程中能产生多种酶类,提高出酒率的同时生成酯类化合物。细菌中能够将酿酒原料中的大分子物质水解为氨基酸和葡萄糖等小分子物质。酵母菌则可产乙醇和酯类物质,为白酒提质增香提供重要保障[38]。从微生物群落结构来看,不同地区的大曲挥发性风味化合物差异与优势菌属存在差异相关,不同地区的高温大曲在发酵温度和制作工艺上的差异也会影响其微生物群落的结构和功能。例如,高温大曲中的芽孢杆菌属和曲霉属相对丰度较高,可能会影响大曲的糖化力、液化力和酯化力。造成两地区风味化合物差异的酯类物质较多,反映出两地区产酯微生物物种丰度及多样性可能存在差异,A地区吡嗪类、醇类物质含量高,则可能芽孢杆菌属相对丰度较高。此外,微生物群落的演替也会影响挥发性风味化合物的种类和含量[41-42]。
3 结论
该研究以贵州茅台镇核心地区(A)及仁怀市名酒工业园区(B)的酱香型高温大曲样品为研究对象,分析其在制曲过程中的理化指标发现,A地区、B地区高温大曲制曲过程中水分、糖化力、酸性蛋白酶活力整体呈逐渐下降趋势,酸度及酯化力逐渐增加,液化力变化不明显;挥发性风味化合物分别检出114和121种,共有挥发性风味化合物分别为70和71种,独有11种、6种挥发性风味化合物。A地区出仓曲中酯类、醇类及吡嗪类物质含量明显高于B地区。PLS-DA表明,获得乙酸苯乙酯、棕榈酸甲酯等53种显著差异挥发性化合物。聚类分析表明,酯类物质可能是造成A、B地区出仓曲风味差异的主要物质。其原因可能是由于制曲过程中大曲微生物组成多样性及演替的复杂性导致水解酶系的差异,造成大曲风味化合物的差异。缩小不同地区酱香型大曲质量的差异,核心在于调控制曲过程中微生物菌群组成结构,维护制曲环境微生态稳定。
[1]孙时光,左勇,张晶,等.酱香型白酒中的风味化合物及功效[J].中国酿造,2017,36(12):10-13.
[2]许焰.酱香型白酒酿造拜耳接合酵母风味代谢特征及机制分析[D].无锡:江南大学,2018.
[3]唐丽云,朱孟江.酱香型白酒生产工艺及关键工艺原理简述[J].中国食品工业,2022(9):101-104.
[4]班世栋,王晓丹,胡宝东,等.酱香型大曲中水解酶系研究[J].酿酒科技,2015(4):13-19.
[5]翁鹏,张建敏,彭志云,等.大曲酶系的研究现状及展望[J].酿酒科技,2023(6):112-117.
[6]李喆,冯海燕,吴德光,等.高温大曲发酵过程中理化指标及风味变化规律的研究[J].酿酒科技,2022(10):40-45.
[7]王永辉,张春香,聂正东,等.翻曲次数对酱香高温大曲品质的影响分析[J].酿酒科技,2022(3):77-82.
[8]DONG W W,YU X,WANG L,et al.Unveiling the microbiota of sauceflavor Daqu and its relationships with flavors and color during maturation[J].Front Microbiol,2024,15:1345772.
[9]ZHANG Y D, SHEN Y, CHENG W, et al.Understanding the shifts of microbial community and metabolite profile from wheat to mature Daqu[J].Front Microbiol,2021,12:714726.
[10]郭敏.基于高通量测序对酱香大曲制曲微生态多样性的研究[D].贵阳:贵州大学,2018.
[11]胡宝东,邱树毅,周鸿翔,等.酱香型大曲的理化指标、水解酶系、微生物产酶的关系研究[J].现代食品科技,2017,33(2):99-106.
[12]YU Q,MOU F Y,XIAO J W,et al.Correlational analysis of physicochemical indexes, microbial communities, and volatile components in lightflavor Daqu from north and south regions of China[J].World J Microb Biot,2023,40(2):54.
[13]冯方剑,唐维川,杨官荣,等.不同产区酱香型大曲理化指标及风味成分的研究[J].酿酒,2023,50(5):29-36.
[14]侯强川,王玉荣,王文平,等.茅台和尧治河高温大曲细菌群落结构差异及功能预测[J].食品与发酵工业,2022,48(1):36-44.
[15]周晨曦,郑福平,李贺贺,等.白酒大曲风味化合物研究进展[J].中国酿造,2019,38(5):6-12.
[16]LI Z G,YAN X,ZOU S B,et al.Analysis of fungal diversity,physicochemical properties and volatile organic compounds of strong-flavor Daqu from seven different areas[J].Foods,2024,13(8):1263.
[17]PANG Z M,LI W W,HAO J,et al.Correlational analysis of the physicochemical indexes, volatile flavor components, and microbial communities of high-temperature Daqu in the northern region of China[J].Foods,2023,12(2):326.
[18]中华人民共和国工业和信息化部.QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国轻工业出版社,2011.
[19]马群,张梦阳,李宜波,等.大曲液化酶活力测定方法的对比研究[J].酿酒科技,2019(10):68-72.
[20]国家市场监督管理总局,国家标准化管理委员会.GB/T 23527.1—2023 酶制剂质量要求 第1部分:蛋白酶制剂[S].北京:中国标准出版社,2023.
[21]LIU J,CHEN J,FAN Y, et al.Biochemical characterization and dominance of different hydrolases in different types of Daqu-a Chinese industrial fermentation starter[J].J Sci Food Agr,2018,98(1):113-121.
[22]袁华伟,赵余,王玉婷,等.高温大曲制曲过程中水解酶系及理化性质的动态变化研究[J].酿酒,2023,50(4):31-36.
[23]LUO H B, WANG D D, WANG Y, et al.The change rules of physiochemical indexes of Luzhou-flavor Daqu based on continuous flow chemical analyzer[J].Adv Mater Res,2014,881:761-765.
[24]李显,蔡琼慧,吴凤智.影响酱香型大曲糖化力的因素[J].酿酒科技,2017(4):79-87.
[25]王晓丹,胡宝东,班世栋,等.酱香型大曲酶系与大曲中微生物产酶关系的研究[J].酿酒科技,2015(9):1-7.
[26]谢丹,吴成,毕远林,等.酱香型白酒高温大曲储存过程中微生物群落演替与理化因子相关性研究[J].食品工业科技,2023,44(15):151-158.
[27]袁华伟,赵余,王玉婷,等.高温大曲制曲过程中水解酶系及理化性质的动态变化研究[J].酿酒,2023,50(4):31-36.
[28]李兵,张超,王玉霞,等.白酒大曲功能微生物与酶系研究进展[J].中国酿造,2019,38(6):7-12.
[31]邢钢,敖宗华,王松涛,等.不同温度大曲制曲过程理化指标变化分析研究[J].酿酒科技,2014(6):20-23.
[32]王利萍,郎莹,邱树毅,等.顶空固相微萃取结合气质联用仪分析五种酱香型白酒大曲中的风味化合物[J].广东化工,2022,49(17):182-186.
[33]沈世明,张娇娇,张高瑜,等.酱香型大曲贮存过程曲香风味化合物变化的分析[J].中国酿造,2022,41(7):58-63.
[34]刘能,何朝玖,陈杰,等.浓香型大曲培菌期主要微生物变化及挥发性风味化合物合成影响因素研究[J].酿酒科技,2023(9):17-25,32.
[35]WANG Z,WANG S,LIAO P F,et al.HS-SPME combined with GC-MS/O to analyze the flavor of strong aroma Baijiu Daqu[J].Foods,2022,11(1):116.
[36]张小龙,邱树毅,王晓丹,等.酱香型大曲中挥发性成分与微生物代谢关系[J].中国酿造,2020,39(12):51-57.
[37]牛姣,樊建辉,韩素娜,等.陶融型中高温大曲中挥发性香味物质分析[J].酿酒科技,2017(11):87-92.
[38]张清玫,赵鑫锐,李江华,等.不同香型白酒大曲微生物群落及其与风味的相关性[J].食品与发酵工业,2022,48(10):1-8.
[39]杨晨,杨栩松,郭壮,等.茅台镇某酒厂高温大曲微生物多样性与感官品质关联性分析[J].中国酿造,2023,42(11):48-53.
[40]何宏魁,李兰,汤有宏,等.古井贡酒大曲感官评价与其微生物、理化指标的关系研究[J].酿酒,2017,44(1):58-63.
[41]甄攀,韩英,王军燕,等.不同时期及不同区域汾酒大曲微生物群落结构分析研究[J].中国酿造,2023,42(6):140-145.
[42]HOU Q C,WANG Y,QU D,et al.Microbial communities, functional,and flavor differences among three different-colored high-temperature Daqu:A comprehensive metagenomic,physicochemical,and electronic sensory analysis[J].Food Res Int,2024,184:114257.