酱油是东方饮食不可或缺的调味品,而广式酱油是中国传统酿造酱油的一个重要流派,形成于以广东为主的华南地区。该类酱油以全大豆和面粉为主要原料,经3个月以上的日晒夜露天然酿造而成,风味独特,是国内产销量最大的一类酱油[1-3]。大豆是酿造酱油的主要原料,包括全大豆和脱脂大豆。全大豆和脱脂大豆的主要成分差异是有机溶剂浸出的大豆油脂成分(soybean oil components,SOC),其中油脂、磷脂和游离脂肪酸占到了总大豆油脂类物质的96.8%以上[4-5]。全大豆的价格相对较高,而脱脂大豆作为油脂工业的副产物,价格相对便宜,因此也有非常多的酱油使用脱脂大豆进行酿造。使用脱脂大豆制作的酱油风味通常与使用全大豆酿制的酱油风味有明显差异[6-7]。目前主流观点认为,全大豆和脱脂大豆酱油在风味和体态上的差异与原料中的油脂含量不同有关,认为部分大豆油脂成分在酱油酿造中会转化成酱油风味物质(如酯类、醛类、酸类和杂环酮类等),使用全大豆酿造的酱油具有浓郁的酱香、豉香和浓厚味等典型特征[7-9]。此外,有研究者对酱油发酵过程中的脂质降解规律进行了研究,发现亚油酸和磷脂是制曲阶段和酱醪发酵阶段主要降解的脂质组分,推测磷脂和亚油酸可能是酱油发酵的重要风味前体物质[10-11]。脂质对于风味的影响可能不仅来自于其自身降解的产物含量,还可能影响其他物质的降解和反应,如微生物生长、蛋白降解和美拉德反应等[12-17]。理论上油脂的存在会改变基质的性质,相关研究表明基质中的油脂成分对其中的微生物群落发育和菌群丰度以及代谢方向都具有调节作用[18-22]。那么广式酱油发酵中大豆油脂成分的存在是否影响酿造酱油成曲微生物菌群结构及其酶系的表达,从而进一步影响酱油的风味物质产生,对此尚未见有深入研究。因此,本研究将深入研究大豆油脂成分对酱油成曲微生物群落变化及酱油风味的差异,从微生物和风味的研究角度,解析大豆油脂成分与酱油风味形成的内在联系,以期为广式酱油品质的提升提供理论基础。
1 材料与方法
1.1 材料与试剂
全大豆、脱脂大豆、面粉、大豆油脂成分等:李锦记(新会)食品有限公司;氨基酸标品:美国Sigma公司;乙酸、L-乳酸、无水柠檬酸、琥珀酸、L-酒石酸、L-苹果酸、己二酸、L-焦谷氨酸、富马酸等(纯度均>99%):上海阿拉丁生化科技股份有限公司;HiPure Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:广州美基生物科技有限公司;AxyPrep DNA凝胶提取试剂盒:美国Axygen公司;聚合酶链式反应(polymerase chain reaction,PCR)相关试剂:日本Toyobo公司。
1.2 仪器与设备
S-433D全自动氨基酸分析仪:德国Sykam公司;JRJ300-YSH均质乳化机:上海梅川机电有限公司;LC-20AT高效液相色谱仪(high performance liquid chromatography,HPLC):日本岛津公司;57328-U固相微萃取纤维(DVB/CAR/PDMS(50/30 μm):美国Supelco公司;7820A-5977B气相色谱-质谱联用仪(gas chromatography-mass spectrometer,GC-MS),配VF-WAXms毛细管色谱柱(60 m×0.25 mm×0.50 μm):美国安捷伦公司;DYY-6C琼脂糖凝胶电泳仪:北京六一仪器厂;Tanon-2500凝胶成像系统:上海天能科技有限公司;StepOnePlus实时荧光定量PCR仪:美国ABI公司。
1.3 方法
1.3.1 添加、不添加SOC酱油与广式酱油酿造工艺要点
(1)脱脂大豆原料预处理
脱脂大豆进行粉碎,粉末颗粒能通过40目筛网,然后添加脱脂大豆粉质量10%的小麦粉混合均匀,制得脱脂大豆预拌粉。
(2)大豆油脂包埋处理
在水中加入大豆油脂和磷脂,经高速均质分散形成水包油型乳化液,大豆油脂和磷脂的质量比例为9∶1,两者总添加量为脱脂大豆粉质量的6%。
(3)包埋大豆油脂与脱脂大豆预拌粉造粒制曲
将大豆油脂水包油型乳化液添加入脱脂大豆预拌粉中搅拌均匀,经造粒机造粒得到颗粒料,造粒后控制含水量为30%~40%;后续将颗粒料经润水、蒸煮和接种米曲霉制备颗粒曲。
(4)广式酱油、添加SOC酱油酿造工艺
广式酱油以全大豆和面粉为主要原料,经蒸煮、接种米曲霉制曲和天然发酵酿造90 d而成[23]。发酵工艺参照广式酱油发酵工艺,发酵90 d后,制备得添加SOC酿造酱油。
(5)不添加SOC酱油酿造工艺
不添加SOC酿造酱油:其工艺参考SOC酿造酱油模型工艺,但其酿造过程中不添加大豆油脂成分。
1.3.2 氨基酸的测定
参考《实用食物营养成分分析手册》中柱前衍生法测定酱油里的氨基酸含量[23]。
1.3.3 酱油有机酸的测定
参考陈杰等[24]的方法测定酱油的有机酸含量。
1.3.4 酱油挥发性成分提取与测定
参考李学伟等[25]的方法应用固相微萃取装置提取酱油挥发性成分并进行测定。
气相色谱-质谱分析条件:色谱柱为安捷伦毛细管色谱柱VF-WAXms(60 m×0.25 mm×0.50 μm)。升温程序为:起始温度40 ℃,保持5 min;以2 ℃/min升温至150 ℃;再以5 ℃/min升温至240 ℃,保持10 min。离子源温度230 ℃,四极杆温度150 ℃,扫描速度1 562 u/s,扫描范围20~500 m/z。
定性定量方法:通过安捷伦MassHunter软件对图谱数据进行分析,应用美国国家标准与技术研究院(national institute of standards and technology,NIST)谱库和Wiley谱库对未知化合物检索进行定性;通过峰面积归一法进行相对含量计算。
1.3.5 酱油成曲总脱氧核糖核酸提取
参照曾小波等[26]的方法,对样品进行处理后,使用HiPure Soil DNA提取试剂盒,按照操作指南对酱油成曲进行脱氧核糖核酸(DNA)进行提取。
1.3.6 PCR扩增及高通量测序
参照GUO M J等[27-28]的方法,PCR扩增细菌基因组,16S rRNA基因的V3-V4区的引物为Nobar_341F(CCTACGGGNGGCWGCAG)和Nobar_806R(GGACTACHVGGGTATCTAAT);PCR扩增真菌基因组,ITS引物为:ITS3_KYO2(GATGAAGAACGYAGYRAA)和ITS4(TCCTCCGCTTATTGATATGC)。Illumina Novaseq 6000测序:从2%琼脂糖凝胶中搜集扩增子,使用AxyPrep DNA凝胶提取试剂盒进行纯化,并使用PCR系统进行定量。纯化后的扩增子根据标准操作在Illumina平台上进行双端测序(PE250)。应用美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库对原始数据进行分析。
1.3.7 数据处理
生物信息数据处理方法参考曾小波等[26]的方法,基于操作分类单元(operational taxonomic unit,OTU)和物种丰度表,应用QIIME软件(版本1.9.1)对alpha多样性指数进行分析;应用Muscle软件(版本3.8.31)对Beta多样性进行分析,使用R软件进行数据处理和作图,实验数据重复4次。
2 结果与分析
2.1 大豆油脂成分对广式酱油成曲细菌多样性的影响
2.1.1 酱油成曲细菌多样性分析
将所有样本有效序列按≥97%相似度进行OTUs聚类分析,共得到3 480个OTU。通过α多样性分析表征细菌微生物群落的丰度和多样性,Sobs、Chao 1和Ace指数是用于估计样本群落中OTU数目的指数,数值越大,微生物群落的丰度高;Shannon和Simpson指数是用于估算样本中微生物多样性的均匀度指数,数值越大,微生物群落的均匀度越高。对酱油成曲细菌微生物α多样性指数进行统计分析(P<0.05),结果见表1。由表1可知,T2组和CK组的细菌群落的丰度和多样性(均匀度)均比T1组高,表明添加大豆油脂类物质有利于广式酱油酿造中细菌微生物的繁殖代谢。
表1 酱油成曲细菌菌群α多样性分析结果
Table 1 Results of α diversity analysis of bacterial community in koji of soy sauce
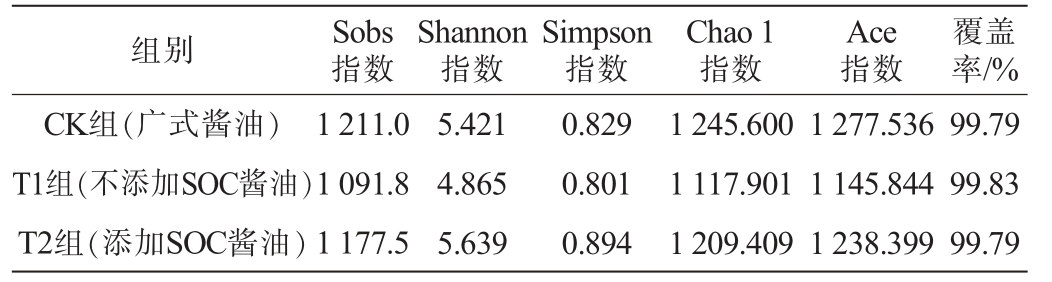
组别 Sobs指数Shannon指数Simpson指数Chao 1指数Ace指数覆盖率/%CK组(广式酱油)T1组(不添加SOC酱油)T2组(添加SOC酱油)1 211.0 1 091.8 1 177.5 5.421 4.865 5.639 0.829 0.801 0.894 1 245.600 1 117.901 1 209.409 1 277.536 1 145.844 1 238.399 99.79 99.83 99.79
通过β多样性由主坐标分析(principal co-ordinates analysis,PCoA)表征样本间微生物菌落物种组成的差异,用于研究样本群落组成的相似性或相异性。样本在PCoA图中的距离越近,样本群落组成的相似性越高。酱油成曲细菌β多样性PCoA结果见图1。由图1可知,T2组和CK组的微生物群落组成的相似性高,表明大豆油脂类物质对酿造酱油部分微生物进行了调控,促进了微生物的繁殖。
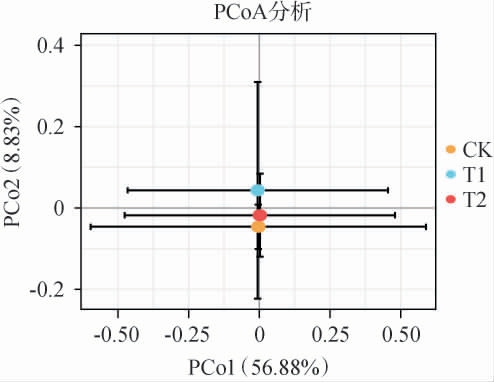
图1 酱油成曲细菌菌群β多样性分析结果
Fig.1 Results of β diversity analysis of bacterial community in koji of soy sauce
2.1.2 酱油成曲细菌群落结构差异分析
对酱油成曲细菌群落结构差异分析,结果见图2。由图2a可知,3组酱油成曲共检测出10个细菌门,主要优势细菌门为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、蓝藻细菌门(Cyanobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)。不同酱油成曲中细菌群落组成在门水平上存在明显差异,其中,T2组中的酸杆菌门(8.43%)和放线菌门(6.78%)与CK组具有相似的丰度,比T1组中的酸杆菌门(5.37%)和放线菌门(4.51%)高,表明大豆油脂类物质有利于酱油成曲中酸杆菌门和放线菌门细菌的繁殖生长。有研究表明,放线菌门是酱香型白酒酿造大曲和酱油发酵中重要微生物[29]。
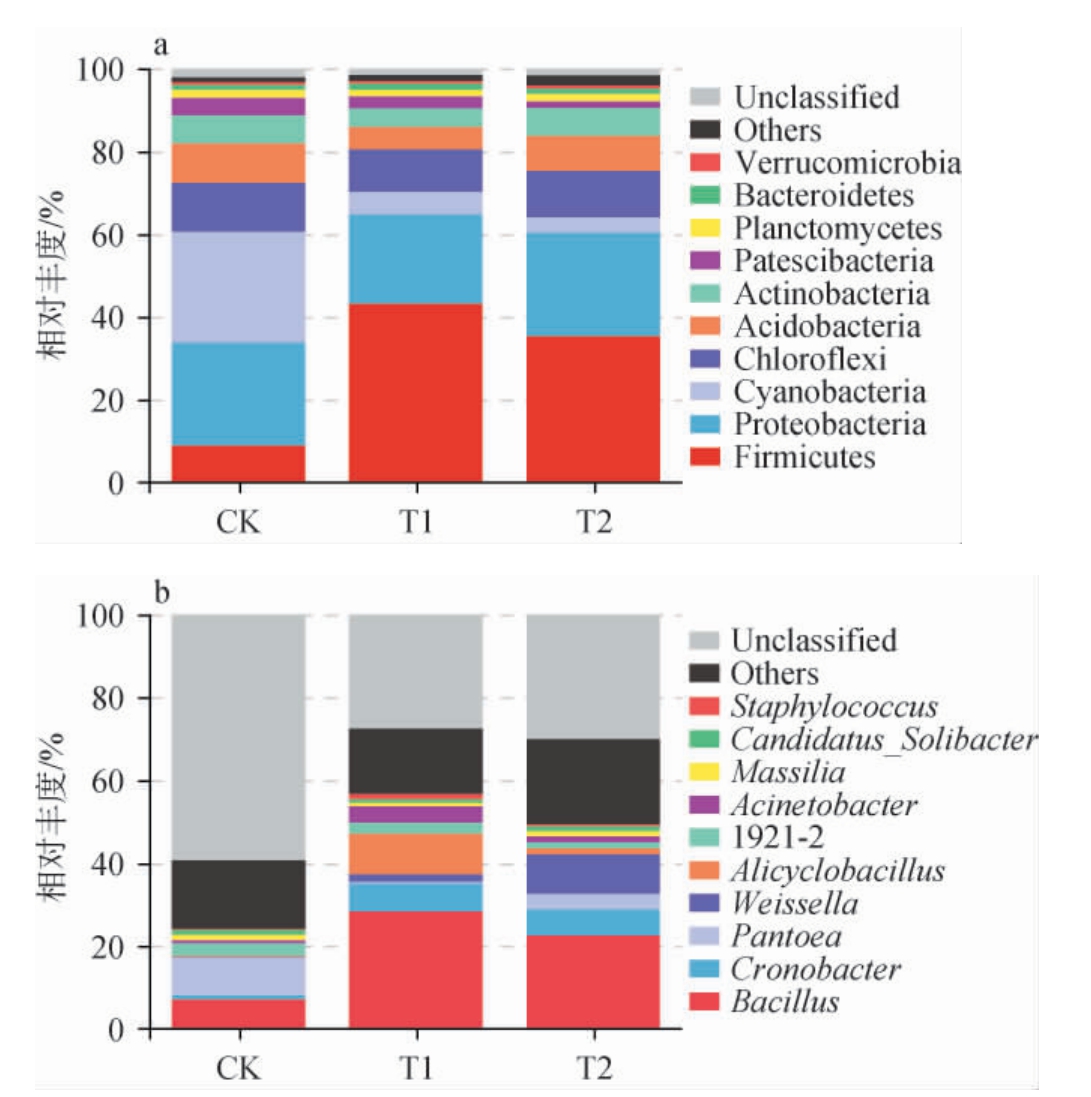
图2 基于门(a)和属(b)水平酱油成曲细菌群落结构分析
Fig.2 Bacterial community structure of koji of soy sauce at phylum (a) and genus (b) levels
由图2b可知,3组酱油成曲共检测出10个细菌属,主要优势细菌属为芽孢杆菌属(Bacillus)、魏斯氏菌属(Weissella)、泛菌属(Pantoea)、酸杆菌属(Candidatus_Solibacter)和脂环酸芽胞杆菌属(Alicyclobacillus)和不动杆菌属(Acinetobacter),不同酱油成曲中细菌群落组成在属水平上存在明显差异。其中T2组中的魏斯氏菌属(9.62%)、泛菌属(3.66%)和酸杆菌属(1.20%)相对丰度比T1组中的魏斯氏菌属(1.82%)、泛菌属(0.45%)和酸杆菌属(0.76%)高,而且这3个细菌属也是CK组中重要的优势菌群,尤其是泛菌属的相对丰度达到9.13%。有研究表明,魏斯氏菌属广泛存在于酱油、豆酱等发酵食品中,对提高食品中有机酸、醛类和酯类等风味物质含量,促进有益酵母生长和提高产品功能性等方面具有重要作用[30];在我国黄酒酿造中,泛菌属是黄酒中小分子脂肪酸酯合成的重要微生物[31]。综合上述结果表明,大豆油脂类物质有利于酱油酿造中魏斯氏菌属、泛菌属和酸杆菌属细菌的繁殖代谢,这些细菌的代谢产物构成了广式酱油重要的风味物质。
2.2 大豆油脂成分对广式酱油成曲真菌多样性的影响
2.2.1 酱油成曲真菌多样性分析
将所有样本有效序列按≥97%相似度进行OTUs聚类分析,共得到711个OTU。通过对酱油成曲真菌微生物α多样性指数进行统计分析(P<0.05),结果见表2。由表2可知,T2组和CK组的真菌群落的Sobs、Chao 1和Ace指数均比T1组高,表明前两者的真菌丰度比后者高;此外,T2组真菌群落的Shannon和Simpson指数比CK组和T1组相对偏低,但差异不明显。可能是由于酱油制曲在原料加入米曲霉进行固态发酵,因此酱油发酵曲的优势真菌是曲霉,同时含有低丰度的酵母。因此各组样本的真菌生物多样性的均匀度差异不大。
表2 酱油成曲真菌菌群α多样性分析结果
Table 2 Results of α diversity analysis of fungal community in koji of soy sauce
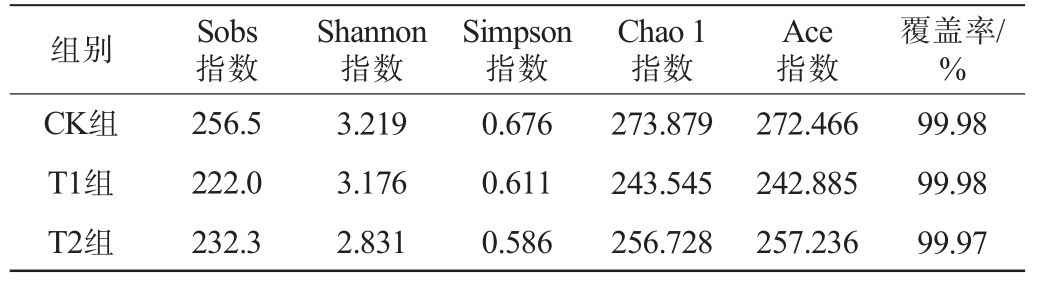
组别 Sobs指数Shannon指数Simpson指数Chao 1指数Ace指数覆盖率/%CK组T1组T2组256.5 222.0 232.3 3.219 3.176 2.831 0.676 0.611 0.586 273.879 243.545 256.728 272.466 242.885 257.236 99.98 99.98 99.97
通过β多样性主坐标分析(PCoA)表征,各酱油成曲间微生物菌落物种组成存在明显差异。酱油成曲真菌β多样性分析结果见图3。
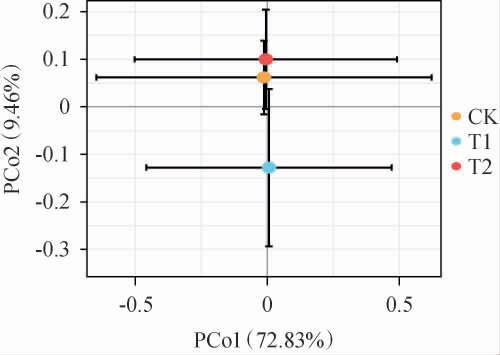
图3 酱油成曲真菌菌群β多样性分析结果
Fig.3 Results of β diversity analysis of bacterial community in koji of soy sauce
由图3可知,在PCoA主坐标上,T2组和CK组的距离最近,而且均与T1组距离较远,表明前两者样本的微生物群落组成的相似性高。对比T1组酱油成曲,T2组添加大豆油脂类物质,大豆油脂类物质对T2组酱油成曲真菌的繁殖代谢进行了调控,使T2组的真菌群落组成与广式酱油曲相似。
2.2.2 酱油成曲真菌群落结构差异分析
对酱油成曲真菌群落结构差异分析,结果见图4。由图4a可知,酱油成曲中主要优势真菌门包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉菌门(Mucoromycota)和被孢霉门(Mortierellomycota),不同酱油成曲中真菌群落组成在门水平上存在明显差异。由于酱油制曲过程中人工加入米曲霉,因此各酱油成曲中子囊菌门均占主导地位。但在3组酱油成曲中,T2组中的子囊菌门丰度最高(78.99%)。
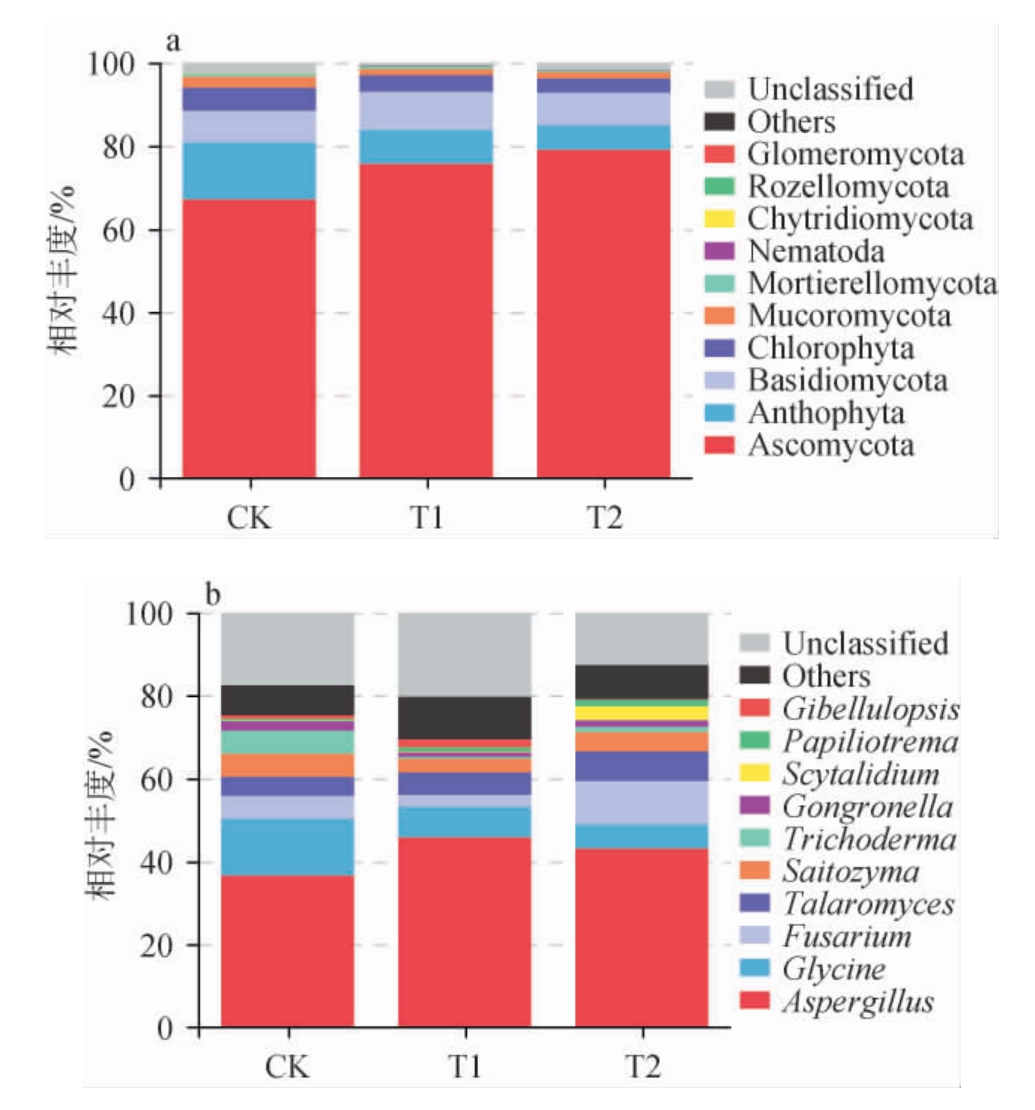
图4 基于门(a)和属(b)水平酱油成曲真菌群落结构分析
Fig.4 Fungal community structure analysis of koji of soy sauce at the phylum (a) and genus (b) levels
3组酱油成曲共检测出9个真菌属,由于酱油酿造过程中需要添加米曲霉进行制曲,因此曲霉属(Aspergillus)均为各组的绝对优势真菌属,其在T2组、T1组和CK组中分别占比43.04%、45.77%和36.56%,见图4b。通过真菌属水平群落结构差异分析,T2组的真菌群落物种组成与广式酱油成曲相似。在CK组中发现了担孢酵母属(Papiliotrema)(0.44%),但其在T2组(1.67%)中具有更高的丰度,有研究发现担孢酵母属能够高产脂肪酶或在葡萄酒中形成更丰富的酯类和酶类辅以酒体更独特的风味[32-33]。由于T2组添加了SOC,可能酱油制曲过程中促进了该类产脂肪酶酵母属的繁殖代谢,对广式酱油独特风味的形成具有影响作用。
2.3 大豆油脂成分对酿造酱油游离氨基酸的影响
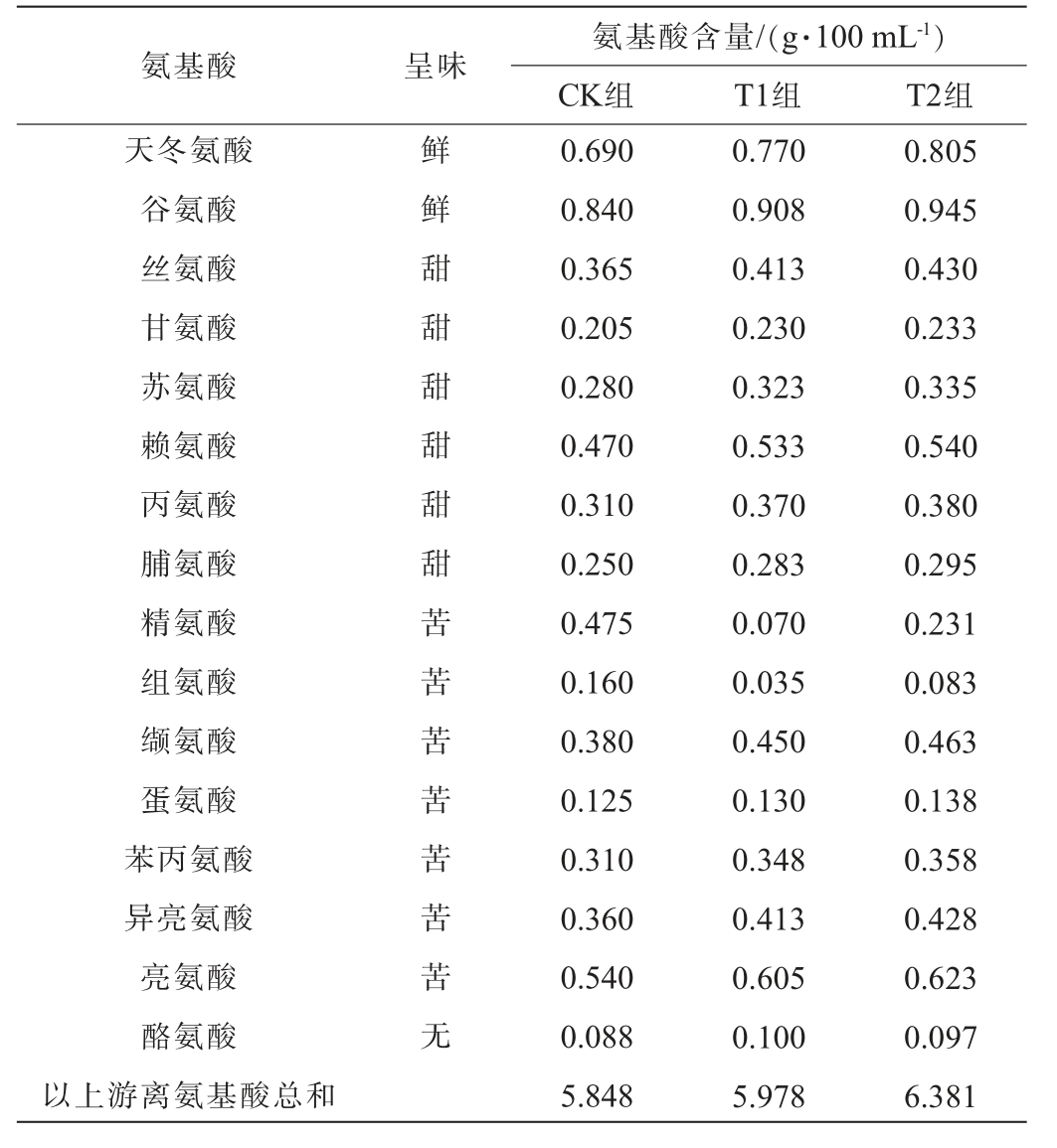
在酱油发酵的过程中,蛋白质会被微生物分泌的蛋白酶分解成氨基酸,其构成及含量是影响酱油滋味和品质的重要因素[25]。酱油中呈鲜味和甜味氨基酸越高,其鲜味越强。通过对比各组酿造酱油游离氨基酸的含量差异,分析大豆油脂成分对酱油氨基酸形成的影响,结果见表3。
表3 各组酱油的氨基酸组成分析
Table 3 Analysis of amino acids composition in various groups of soy sauce
氨基酸 呈味氨基酸含量/(g·100 mL-1)CK组 T1组 T2组天冬氨酸谷氨酸丝氨酸甘氨酸苏氨酸赖氨酸丙氨酸脯氨酸精氨酸组氨酸缬氨酸蛋氨酸苯丙氨酸异亮氨酸亮氨酸酪氨酸以上游离氨基酸总和鲜鲜甜甜甜甜甜甜苦苦苦苦苦苦苦无0.690 0.840 0.365 0.205 0.280 0.470 0.310 0.250 0.475 0.160 0.380 0.125 0.310 0.360 0.540 0.088 5.848 0.770 0.908 0.413 0.230 0.323 0.533 0.370 0.283 0.070 0.035 0.450 0.130 0.348 0.413 0.605 0.100 5.978 0.805 0.945 0.430 0.233 0.335 0.540 0.380 0.295 0.231 0.083 0.463 0.138 0.358 0.428 0.623 0.097 6.381
由表3可知,CK组游离氨基酸总含量为5.848 g/100 mL,T1组游离氨基酸总含量为5.978 g/100 mL,T2组游离氨基酸总含量最高,达到6.381 g/100 mL。对比T1组,T2组具有更高的鲜味氨基酸和甜味氨基酸,表明大豆油脂成分的存在有利于米曲霉等有益微生物繁殖,并分泌更多的外切蛋白酶,形成更多呈味氨基酸,赋予酱油更强的鲜甜味。
2.4 大豆油脂成分对酿造酱油有机酸的影响
酱油的酸味主要由乳酸、醋酸、琥珀酸、柠檬酸等有机酸所产生,这些有机酸构成了酱油的总酸,其不仅是呈味成分,也关系到产品的香气[24]。酱油中有机酸主要由乳酸菌发酵、酵母菌发酵、脂肪酸降解和氨基酸降解后氧化还原产生,这些有机酸可以缓和咸味,产生爽口的感觉,增加酱油的风味[24,34]。通过对比T1组、T2组和CK组酿造酱油中有机酸的含量差异,分析大豆油脂成分对酱油有机酸形成的影响,结果见图5。由图5可知,T1组酿造酱油中乳酸含量最高,其他有机酸含量很低,表明有机酸种类单一,丰富度不够;与T1组相比,T2组和CK组酿造酱油中有机酸种类更丰富,各组分均匀度高。表明大豆油脂成分对酱油微生物的繁殖代谢形成了正向调控,有利于酱油微生物有机酸的生成。此外,大豆油脂成分在酱油发酵过程中氧化分解形成众多的小分子脂肪酸等物质,也构成了酱油丰富有机酸类物质的重要来源。
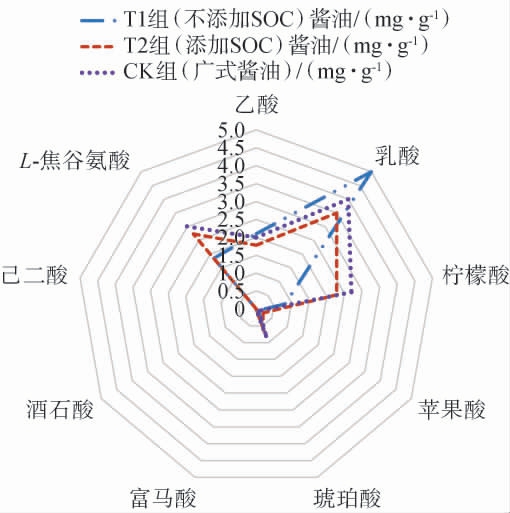
图5 各组酱油有机酸的组成分析
Fig.5 Analysis of organic acids composition in various groups of soy sauce
2.5 大豆油脂成分对酿造酱油主要酯类物质的影响
通过对比各组酿造酱油酯类物质的相对含量差异,分析大豆油脂成分对广式酱油酯类风味物质形成的影响,结果见表4。
表4 各组酱油主要酯类物质的组成分析
Table 4 Analysis of major esters substances composition in various groups of soy sauce
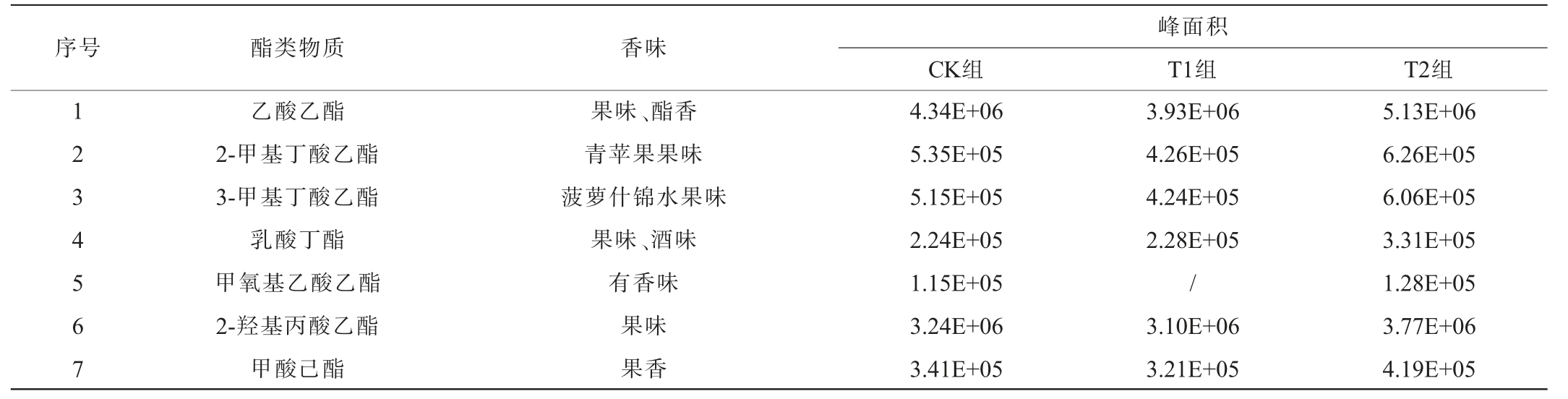
序号 酯类物质 香味CK组峰面积T1组 T2组1 2 3 4 5 6 7乙酸乙酯2-甲基丁酸乙酯3-甲基丁酸乙酯乳酸丁酯甲氧基乙酸乙酯2-羟基丙酸乙酯甲酸己酯果味、酯香青苹果果味菠萝什锦水果味果味、酒味有香味果味果香4.34E+06 5.35E+05 5.15E+05 2.24E+05 1.15E+05 3.24E+06 3.41E+05 3.93E+06 4.26E+05 4.24E+05 2.28E+05/3.10E+06 3.21E+05 5.13E+06 6.26E+05 6.06E+05 3.31E+05 1.28E+05 3.77E+06 4.19E+05
续表
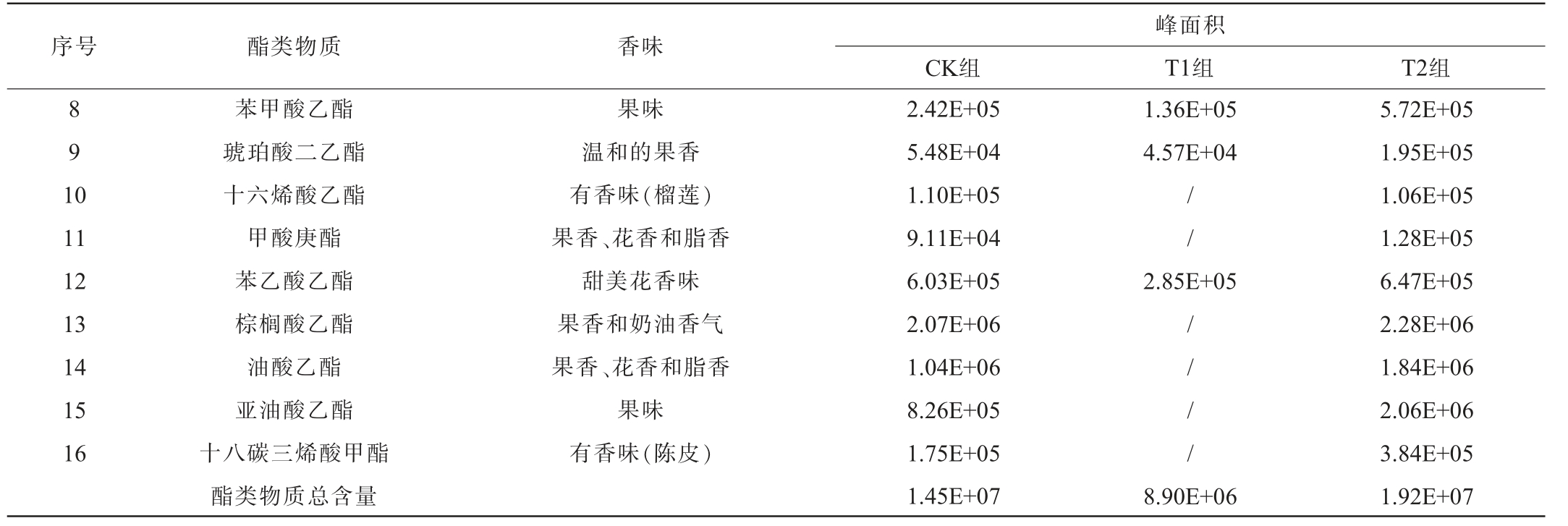
注:“/”代表未检出该特征风味物质。
序号 酯类物质 香味CK组峰面积T1组 T2组8 9 1 0 1.36E+05 4.57E+04 11 12 13 14 15 16苯甲酸乙酯琥珀酸二乙酯十六烯酸乙酯甲酸庚酯苯乙酸乙酯棕榈酸乙酯油酸乙酯亚油酸乙酯十八碳三烯酸甲酯酯类物质总含量果味温和的果香有香味(榴莲)果香、花香和脂香甜美花香味果香和奶油香气果香、花香和脂香果味有香味(陈皮)2.42E+05 5.48E+04 1.10E+05 9.11E+04 6.03E+05 2.07E+06 1.04E+06 8.26E+05 1.75E+05 1.45E+07//2.85E+05// / /8.90E+06 5.72E+05 1.95E+05 1.06E+05 1.28E+05 6.47E+05 2.28E+06 1.84E+06 2.06E+06 3.84E+05 1.92E+07
由表4可知,3组酿造酱油中共检测出16种酯类物质,这些酯类物质赋予了广式酱油浓郁的果香、花香、酯香和脂香等特征香气,而且高级酯类物质能使酱油具有浓厚味。T2组酿造酱油中酯类物质构成与CK组广式酱油相似,而且均检测到16种酯类物质,但前者酯类物质总含量更高,表明T2组酿造酱油具有类似广式酱油的典型特征风味;不添加大豆油脂成分的T1组酿造酱油中酯类物质种类比前两组酿造酱油少,仅检测到10种物质,而且酯类物质总含量也最少。
大豆油脂成分占大豆总质量的18%~20%[4-5],其生物化学反应产物或中间产物是酱油风味物质的重要来源。油脂产生风味物质的主要途径有:①油脂氧化中间产物或产物;②油脂裂解产生短链游离脂肪酸;③β-氧化和脱羧反应产生芳香酮;④羟基脂肪酸环化反应生产内酯[12]。酱油酿造过程中,大豆油脂被米曲霉等微生物产生的脂肪酶水解为甘油和脂肪酸,脂肪酸经过氧化、裂解等一系列生化反应形成醛、酸、酮、醇、酯和烃等化合物,这一过程被认为是大豆油脂贡献酱油风味物质的主要途径[7-11]。另外,脂肪酸与酱醪中的乙醇等醇类化合物酯化生成高级脂肪酸酯,这类酯类化合物具独特的芳香气味,对酱油感官风味具有重要贡献[15]。综合上述数据表明,酱油基质中的大豆油脂成分对其微生物群落发育和菌群丰度以及代谢方向都具有调节作用,促使广式酱油在酿造过程中形成更丰富的风味物质,而且部分大豆油脂成分在酱油酿造过程中参与了酱油风味物质的转化。
3 结论
本研究从酱油微生物菌落结构和酱油风味的研究角度,探究大豆油脂成分与酱油风味形成的内在联系。
本研究通过构建大豆油脂成分与脱脂大豆的酱油酿造模型进行酱油酿造,采用高通量测序技术对酱油成曲微生物多样性进行分析,添加大豆油脂成分(SOC)酿造酱油成曲的细菌和真菌群落组成与广式酱油相似,与不添加SOC酿造酱油具有明显差异,而且前两者的微生物菌落丰富度也比后者高;在优势细菌属中,对比不添加SOC酱油样本,添加SOC酱油样本的魏斯氏菌属、泛菌属和酸杆菌属细菌具有更高的丰度,表明大豆油油脂成分促进了能合成酯类、有机酸和醛类等广式酱油酿造有益细菌的繁殖。在优势真菌属中,添加SOC酱油和广式酱油样本中均发现了担孢酵母属(Papiliotrema),这类酵母能高产脂肪酶或形成更丰富的酯类,可能对广式酱油独特风味的形成具有影响作用。研究结果表明,原料基质大豆油脂成分的存在对酿造酱油微生物进行了调控,促进了广式酱油特征微生物的繁殖代谢。
对大豆油脂成分与广式酱油微生物多样性和酱油风味形成进行关联分析,对比不添加SOC酱油样本,添加SOC酱油样本具有更高的氨基酸含量,尤其是鲜味氨基酸和甜味氨基酸。同时,添加SOC酱油样本的乳酸、柠檬酸、琥珀酸等有机酸种类丰富,各组分均匀度高,使酱油样本风味更加柔和;在酱油酯类物质方面,添加SOC酱油样本中酯类物质总含量最高,而且其种类与广式酱油样本相似,具有广式酱油典型特征风味。表明大豆油脂成分在广式酱油特征风味形成中具有重要的参与作用。
综合上述数据表明,酱油基质中的大豆油脂成分对广式酱油独特微生物群落发育和菌群丰度以及代谢方向都具有正向调节作用,促使广式酱油发酵中形成更丰富的特征风味物质,而且部分大豆油脂成分在酱油酿造过程中参与了酱油风味物质的转化。本研究有助于阐明大豆油脂成分与广式酱油特征风味形成的内在联系,为广式酱油品质的提升提供理论基础。
[1]黄持都,鲁绯,纪凤娣,等.酱油研究进展[J].中国酿造,2009,28(10):7-9.
[2]朱莉,许长华.酱油关键风味物质及其功能与发酵工艺研究进展[J].食品与发酵工业,2018,44(6):287-292.
[3]朱新贵,李学伟,曾小波.典型广式酱油与日式酱油的风味物质差异研究[J].中国酿造,2016,35(7):30-35.
[4]LIU K S,江连洲,朱秀清,等.大豆化学.加工工艺与应用[M].哈尔滨:黑龙江科学技术出版社,2005:30-36.
[5]LIU K S,李次力,刘颖,等.大豆功能食品与配料[M].北京:中国轻工业出版社,2009:12-20.
[6]李学伟,朱新贵,梁姚顺,等.全大豆和脱脂大豆酿造酱油的差异化研究[J].中国酿造,2015,34(1):22-26.
[7]李艳军,许静,谢丰,等.不同工艺及原料酱油风味特征研究进展[J].食品与发酵工业,2025,51(8):367-375.
[8]高献礼.高盐稀态酱油在发酵和巴氏杀菌过程中风味物质形成和变化的研究[D].广州:华南理工大学,2010.
[9]田倚凡.大豆和豆粕发酵酱油风味品质差异及其影响因素的研究[D].广州:华南理工大学,2022.
[10]FENG Y Z,CHEN Z Y,LIU N,et al.Changes in fatty acid composition and lipid profile during koji fermentation and their relationships with soy sauce flavor[J].Food Chem,2014,158(1):438-444.
[11]ZOU M Y,ZHU X G,LI X W,et al.Changes in lipids distribution and fatty acid composition during soy sauce production[J].Food Sci Ntr,2019,7(2):764-772.
[12]ZAMORA R,HIDALGO F J.The Maillard reaction and lipid oxidation[J].Lipid Technol,2011,23(3):59-62.
[13]MURIEL E,ANTEQUERA T,PETRON M J,et al.Volatile compounds in Iberian dry-cured loin[J].Meat Sci,2004,68(3):391-400.
[14]SCHMID A,COLLOMB M,SIEBER R,et al.Conjugated linoleic acid in meat and meat products:A review[J].Meat Sci,2006,73(1):29-41.
[15]LEE S M, SEO B C, KIM Y S.Volatile compounds in fermented and acid-hydrolyzed soy sauces[J].J Food Sci,2006,71(3):C146-C156.
[16]ARMER L J,MOTTRAM D S.Interaction of lipid in the Maillard reaction between cysteine and ribose: The effect of a triglyceride and three phospholipids on the volatile products[J].J Sci Food Agr,2010,53(4):505-525.
[17]扈莹莹,王妍,于晶,等.脂肪添加量对发酵香肠脂质和蛋白质氧化及挥发性化合物形成的影响[J].食品科学,2019,40(18):8-14.
[18]YONG S K, LIM B H, SALEH S, et al.Optimisation, purification and characterisation of extracellular lipase from Botryococcus sudeticus(UTEX 2629)[J].J MolCatal B-Enzym,2016,2(4):99-105.
[19]GURURAJ P,RAMALINGAM S,DEVI G N,et al.Process optimization for production and purification of a thermostable,organic solvent tolerant lipase from Acinetobacter sp.AU07[J].Braz J Microbiol,2016,47(3):647-657.
[20]MACHIDA M,ASAI K,SANO M,et al.Genome sequencing and analysis of Aspergillus oryzae[J].Nature,2005,438(7071):1157-1161.
[21]NEJRUP R G,BAHL M I,VIGSNS L K,et al.Lipid hydrolysis products affect the composition of infant gut microbial communities in vitro[J].Brit J Nutr,2015,114(1):63-74.
[22]MUJICO J R,BACCAN G C,GHEORGHE A,et al.Changes in gut microbiota due to supplemented fatty acids in diet-induced obese mice[J].Brit J Nutr,2013,110(4):711-720.
[23]杨月欣.实用食物营养成分分析手册[M].北京:中国轻工业出版社,2002:47-52.
[24]陈杰,赵莹,韩舜羽,等.17种市售广式酱油中风味物质的检测分析[J].中国酿造,2021,40(12):165-170.
[25]李学伟,苗春雷,朱娅媛,等.电渗析技术在广式酱油减盐中的应用研究[J].中国调味品,2024,49(12):159-165.
[26]曾小波,王婷婷,李学伟,等.添加大曲发酵对广式酱油品质影响的研究[J].中国酿造,2022,41(6):99-105.
[27]GUO M J,WU F H,HAO G E,et al.Bacillus subtilis improves immunity and disease resistance in rabbits[J].Front Immunol,2017,29(8):1-13.
[28]谢玲,兰林,李宇航,等.米浆发酵过程中的微生物群落变化[J].食品与发酵工业,2021,47(21):67-72.
[29]任爱容,黄永光.茅台镇不同主酿区域酱香型白酒酿造大曲中细菌菌群结构分析[J].食品科学,2021,42(4):167-174.
[30]邓岳,梁丽静,迟原龙,等.传统自然发酵酱油细菌群落结构特征分析[J].中国调味品,2022,47(5):89-92,97.
[31]王晓程,徐友强,李秀婷,等.中国传统发酵食品来源典型小分子脂肪酸酯合成微生物及酶的研究进展[J].中国食品学报,2021,21(4):345-355.
[32]史程风,贾冉冉,阎振丽,等.一株产低温脂肪酶酵母菌的鉴定及酶学性质[J].化工进展,2022,41(10):5541-5548.
[33]孙晓璐,杨永学,郭斌,等.发酵葡萄酒中菌种的分离鉴定及糖类耐受性的探究[J].阜阳师范大学学报(自然科学版),2021,38(2):79-84.
[34]刘晓艳,叶月华,钱敏,等.大型发酵酱油酿造过程中风味物质的动态变化分析[J].食品科学,2021,42(12):242-247.