酸马奶在我国新疆、内蒙古等少数民族地区长期作为食疗产品消费[1],因其独特的风味及突出的功能而备受关注,国内外大量研究表明,酸马奶具有免疫调节、抗氧化、调节肠道菌群平衡、抗心血管疾病、改善肺部疾病等功效[2-5]。酸马奶独特的风味及益生作用与其蕴含的有益微生物息息相关[6-10],其菌系组成极其复杂,主要包括乳酸菌和酵母菌两大类,尤以乳酸菌的研究报道居多。常见的酸马奶源乳酸菌有乳杆菌属(Lactobacillus)、乳酪杆菌属(Lacticaseibacillus)、促生乳杆菌属(Levilactobacillus)、乳植杆菌属(Lactiplantibacillus)、乳球菌属(Lactococcus)等,酵母菌中以克鲁维酵母属(Kluyveromyces)、酵母属(Saccharomyces)、哈萨克斯坦酵母属(Kazachstania)、德克酵母属(Dekkera)为主[1,7-13]。
干酪乳酪杆菌(Lacticaseibacillus casei)Zhang是酸马奶源乳酸菌研究最为深入的菌株,在调节肠道菌群、抗肥胖、免疫调节、改善肾病等方面均表现出了积极作用[14-17]。REN S等[18]从内蒙古手工制作的酸马奶中分离到一株副干酪乳酪杆菌(Lacticaseibacillus paracasei),其可通过调节紧密连接改善腹泻。MAN L L等[11]从酸马奶中筛选到一株可产细菌素的植物乳植杆菌(Lactiplantibacillus plantarum)NMD-17,发现其与其他乳酸菌共培养时,所产细菌素植物乳杆菌素(plantaricin)MX合成明显增强,共培养过程中其细菌素的合成受LuxS/2型自诱导物(autoinducer 2,AI-2)介导的群体感应系统调控。传统发酵酸马奶作为天然的菌种资源库,尽管已有诸多功能菌株从中分离筛选,但不同地区、气候条件、加工工艺等均会影响到酸马奶中微生物的组成及特性,其中蕴含的有益微生物资源仍需深入挖掘,以进一步丰富我国有益微生物菌种资源库,为开发工业发酵剂及益生菌产品提供菌种资源。
鉴于此,本研究从新疆伊犁哈萨克自治洲采集酸马奶样品,采用传统培养分离法对其中优势乳酸菌菌株进行分离,通过形态观察及分子生物学技术对其进行菌种鉴定,并对其酸和胆汁耐受性、疏水性、抑菌、抗氧化、抗胁迫、碳源利用能力及抗生素敏感性等益生特性进行评价,旨在筛选性状优良的乳酸菌菌株,为开发适于工业化生产的发酵剂及益生菌制剂菌种奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
传统自然发酵酸马奶样品:新疆维吾尔自治区伊犁哈萨克自治州特克斯县铁热克镇牧民家庭手工制作;大肠埃希氏菌(Escherichia coli)CMCC44102、乙型副伤寒沙门氏菌(Salmonella paratyphi)CMCC50094、金黄色葡萄球菌(Staphylococcus aureus)CMCC(B)26003:中 国 食 品 药 品检定研究院。
1.1.2 化学试剂
细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;2×Taq Master Mix:近岸蛋白质科技有限公司;牛胆粉(≥40%):德国Merck公司;抗生素药敏片:杭州滨和微生物试剂有限公司;HBI乳酸菌生化鉴定条(GB):青岛海博生物技术有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
MRS肉汤、LB肉汤、TSB肉汤:青岛海博生物技术有限公司。固体培养基:在肉汤中添加琼脂20 g/L。
1.2 仪器与设备
SW-CJ-2D超净工作台:苏州净化设备有限公司;DM2500显微镜:上海徕卡显微镜有限公司;SPX-200-II生化培养箱:上海跃进医疗器械厂;H1650台式高速离心机:湖南湘仪实验室仪器开发有限公司;SP-752(PC)紫外-可见分光光度仪:上海光谱仪器有限公司;T100 Thermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;PB-10酸度计:赛多利斯科学仪器有限公司。
1.3 方法
1.3.1 乳酸菌的分离纯化
自然发酵酸马奶样品经无菌生理盐水逐级稀释,取适宜稀释梯度的样品稀释液,涂布于含0.75%CaCO3的MRS固体培养基,并于37 ℃条件下培养24~48 h,选取周围形成透明圈的产酸菌落,进一步划线于MRS固体培养基,37 ℃条件下培养24~48 h,经多次分离纯化直至得到单菌落,单菌落经革兰氏染色和过氧化氢酶试验,将革兰氏染色结果呈阳性且过氧化氢酶试验结果呈阴性的单菌落初步认定为乳酸菌。
1.3.2 乳酸菌的鉴定
形态学观察:将乳酸菌分离株划线于MRS固体培养基,37 ℃条件下培养24 h,观察单菌落的颜色、边缘完整度、表面光滑度、光泽度、隆起度、质地、透明度等菌落形态。菌株经革兰氏染色后镜检观察,记录细胞形态及排列方式。
分子生物学鉴定:提取乳酸菌分离株的基因组DNA,以其为模板,参照文献[19-20]PCR扩增其16S rDNA或pheS基因,随后委托北京六合华大基因科技有限公司测序。将获得的16S rDNA基因序列提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,通过基本局部比对搜索工具(basic local alignment search tool,BLAST)进行搜索比对。选取同源性较高的模式菌株的16S rDNA基因序列,利用MEGA5.1软件中的邻接法(neighbor-joining,NJ)构建系统发育树,利用亲缘关系远近确定菌株的种分类学地位。若16S rDNA基因序列无法确定具体种,再基于pheS基因序列构建系统发育树,进一步加以鉴定。
1.3.3 益生特性分析
(1)酸及胆汁耐受性分析
酸耐受性:将乳酸菌分离株接种于MRS肉汤培养基,37 ℃条件下培养24 h,3 500 r/min条件下离心10 min,弃上清,加入等体积的MRS肉汤(pH为2.0或pH为2.5)重悬,并于37 ℃条件下培养,采用平板菌落计数法分别检测0 h、1 h、2 h培养液的活菌数[21],以此评价分离菌株的酸耐受能力。
胆汁耐受性:将乳酸菌分离株接种于MRS肉汤培养基,37 ℃条件下培养24 h,3 500 r/min条件下离心10 min,弃上清,加入等体积含0.3%或0.5%胆汁的MRS肉汤重悬,并于37 ℃条件下培养,采用平板菌落计数法分别检测0 h、2 h、4 h培养液的活菌数,以此评价分离菌株的胆汁耐受能力。
(2)表面疏水性分析
将乳酸菌分离株接种于MRS肉汤培养基,37 ℃条件下培养24 h,3 500 r/min条件下离心10 min,弃上清,采用无菌磷酸盐缓冲液(phosphate buffer solution,PBS)重悬调至菌体浓度(OD600 nm值)为0.8~0.9,取3 mL菌悬液分别与0.6 mL二甲苯、十六烷或氯仿旋涡振荡2 min,于37 ℃静置孵育1 h,并测定水相在波长600 nm处的吸光度值,计算乳酸菌的表面疏水性,其计算公式如下:
式中:A0为乳酸菌的PBS菌悬液在波长600 nm处的吸光度值;A1为不同溶剂处理1 h后水相在波长600 nm处的吸光度值。
(3)抑菌活性分析
以大肠埃希氏菌、乙型副伤寒沙门氏菌、金黄色葡萄球菌为指示菌,采用牛津杯(外径7.8 mm,内径6.0 mm)法考察乳酸菌分离株对致病菌的抑菌活性[22]。
(4)抗氧化活性分析
以1.5 mg/mL维生素C溶液为参照,测定乳酸菌分离株对羟基自由基及1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH)自由基的清除能力[23-24]。
(5)盐及乙醇耐受性分析
盐耐受性:将乳酸菌分离株的菌悬液按1%(V/V)的接种量接种至不同NaCl含量(0、2.0%、4.0%、6.0%、8.0%、10.0%)的MRS肉汤中,37 ℃条件下培养24 h,分别测定乳酸菌培养液在波长600 nm处的吸光度值,以此评价其对盐的耐受能力。
乙醇耐受性:将乳酸菌分离株的菌悬液按1%(V/V)的接种量接种至不同乙醇体积分数(5.0%、10.0%、15.0%、20.0%、25.0%)的MRS肉汤中,37 ℃条件下培养24 h,分别测定乳酸菌培养液在波长600 nm处的吸光度值,同时以等量无菌水替代乙醇的MRS肉汤为对照,计算乙醇对乳酸菌生长的抑制率,以评价其对乙醇的耐受能力,其计算公式如下:
式中:A乙醇为含某体积分数乙醇的乳酸菌MRS肉汤吸光度值;A水为等量水替代乙醇的乳酸菌MRS肉汤吸光度值。
(6)碳水化合物利用能力
挑取乳酸菌单菌落,用2 mL无菌生理盐水重悬,取100 μL菌悬液分别添加至含七叶苷、纤维二糖、麦芽糖、甘露醇、水杨苷、山梨醇、蔗糖、棉子糖、菊糖、乳糖的乳酸菌生化鉴定条中,37 ℃培养24~48 h观察颜色变化,并记录。乳酸菌若能利用七叶苷,则培养基颜色由紫色变为黑色,即为阳性结果,不变色则为阴性,而菌株若利用糖或糖醇类物质产酸,培养基则会由紫色变为黄色,即为阳性结果,不变色则为阴性。
(7)抗生素敏感性
选取6种临床常用抗生素以考察乳酸菌分离株的抗生素敏感性,包括青霉素、庆大霉素、氨苄西林、四环素、红霉素和氯霉素。将乳酸菌分离株菌悬液稀释至合适浓度,取100 μL涂布于MRS固体培养基,待培养基表面干燥后,放置抗生素药敏纸片,37 ℃恒温培养24 h,测量抑菌圈直径,参照临床实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)药敏试验标准判定乳酸菌分离株的抗生素敏感性。
1.3.4 数据处理
每个试验重复3次,试验数据以“平均值±标准差”表示,利用SPSS 19.0软件对组间进行单因素方差分析,利用MEGA5.1软件制作系统发育树图,采用Excel 2010绘图。
2 结果与分析
2.1 乳酸菌的分离
依据在含0.75%CaCO3的MRS固体培养基上可形成透明圈菌落,革兰氏染色结果呈阳性,且过氧化氢酶试验结果呈阴性为分离筛选条件,从新疆传统酸马奶中共分离得到9株初步认定为乳酸菌的菌株,分别命名为K-1~K-9。
2.2 乳酸菌分离株的鉴定
2.2.1 形态学观察
9株乳酸菌分离株的菌落及细胞形态见表1。由表1可知,9株乳酸菌分离株的菌落呈乳白或灰白色,边缘完整或不规则,表面光滑或粗糙,有光泽,隆起或低凸,质地稀薄,不透明或半透明。细胞均为短杆状,两端钝圆,呈单在、成对排列。
表1 乳酸菌分离株的菌落及细胞形态特征
Table 1 Morphological characteristics of colony and cell of isolated lactic acid bacteria strains

菌株编号K-1 K-2 K-3 K-4菌落形态颜色 边缘 表面 光泽度 隆起度 质地透明度细胞形态形态 排列方式灰白乳白乳白乳白完整完整完整完整粗糙光滑光滑光滑有光泽有光泽有光泽有光泽隆起低凸低凸低凸稀薄稀薄稀薄稀薄半透明不透明不透明不透明短杆、两端钝圆短杆、两端钝圆短杆、两端钝圆短杆、两端钝圆单在、成对单在、成对单在、成对单在、成对
续表
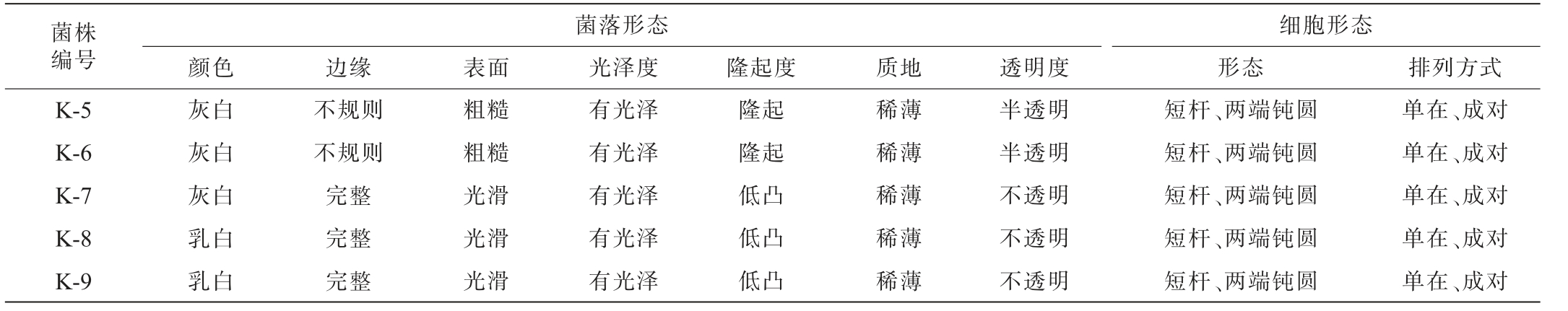
菌株编号K-5 K-6 K-7 K-8 K-9菌落形态颜色 边缘 表面 光泽度 隆起度 质地透明度细胞形态形态 排列方式灰白灰白灰白乳白乳白不规则不规则完整完整完整粗糙粗糙光滑光滑光滑有光泽有光泽有光泽有光泽有光泽隆起隆起低凸低凸低凸稀薄稀薄稀薄稀薄稀薄半透明半透明不透明不透明不透明短杆、两端钝圆短杆、两端钝圆短杆、两端钝圆短杆、两端钝圆短杆、两端钝圆单在、成对单在、成对单在、成对单在、成对单在、成对
2.2.2 分子生物学鉴定
9株乳酸菌分离株的16S rDNA基因序列经过BLAST比对后发现,菌株K-1、K-5、K-6与促生乳杆菌属(Levilactobacillus)亲缘关系最为接近,其他6株菌株则与乳植杆菌属(Lactiplantibacillus)最为接近。以发酵粘液乳杆菌(Limosilactobacillus fermentum)为外标参照菌株,基于16S rDNA基因序列构建9株乳酸菌分离株的系统发育树,结果见图1。
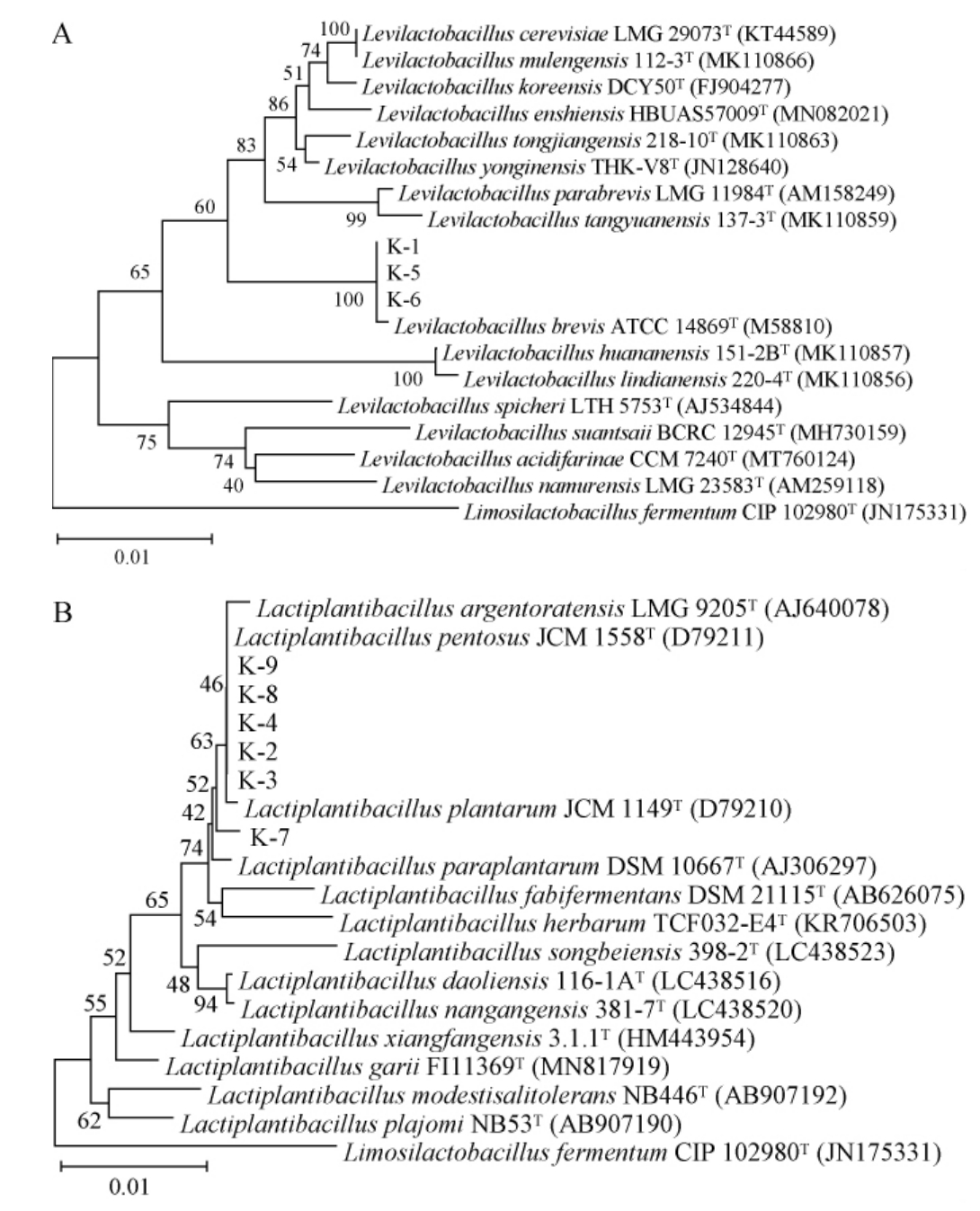
图1 基于16S rDNA基因序列9株乳酸菌分离株的系统发育树
Fig.1 Phylogenetic tree of 9 isolated lactic acid bacteria strains based on 16S rDNA gene sequences
由图1A可知,菌株K-1、K-5、K-6与短促生乳杆菌(Levilactobacillus brevis)ATCC 14869亲缘关系最近,序列同源性达100%,故鉴定这3株菌均为短促生乳杆菌。由图1B可知,菌株K-2、K-3、K-4、K-7、K-8、K-9与乳植杆菌属内的植物乳植杆菌(Lactiplantibacills plantarum)、戊糖乳植杆菌(Lactiplantibacillus pentosus)、阿根廷乳植杆菌(Lactiplantibacillus argentoratensis)、副植物乳植杆菌(Lactiplantibacillus paraplantarum)模式菌株的亲缘关系均较近,尚无法明显区分,故进一步对持家基因pheS[20]进行测序分析,基于pheS基因序列构建6株乳植杆菌属分离株的系统发育树,结果见图2。
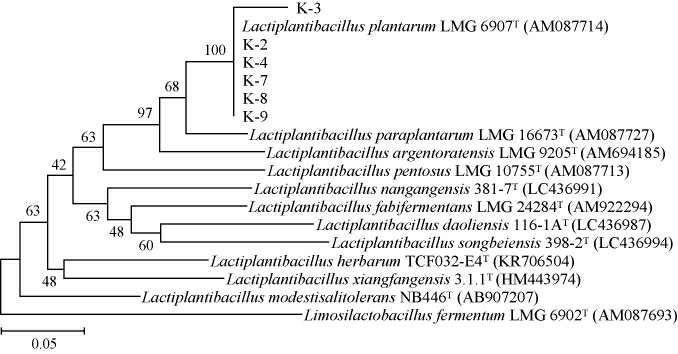
图2 基于pheS基因序列6株乳植杆菌属分离株的系统发育树
Fig.2 Phylogenetic tree of 6 isolated Lactiplantibacillus strains based on pheS gene sequences
由图2可知,菌株K-2、K-3、K-4、K-7、K-8、K-9均与植物乳植杆菌(Lactiplantibacills plantarum)LMG 6907亲缘关系最近,序列同源性达100%,因此,结合16S rDNA和pheS基因序列比对分析,将菌株K-2、K-3、K-4、K-7、K-8、K-9均鉴定为植物乳植杆菌。短促生乳杆菌和植物乳植杆菌作为酸马奶菌系组成,也有类似的相关报道[9,11]。
2.3 酸和胆汁耐受性分析
2.3.1 酸耐受性
乳酸菌作为发酵剂菌种常被用于高酸性发酵食品的生产[25],且其需要对胃酸具有一定的耐受能力才能顺利通过胃酸进入肠道进而发挥益生功能[26]。因此,考察9株乳酸菌分离株的酸耐受性,结果见图3。由图3可知,9株乳酸菌分离株对pH 2.5和pH 2.0两种高酸性条件均表现出了良好的耐受性。在pH 2.5条件下维持2 h,所有乳酸菌分离株活菌数均未出现明显下降,尤其是菌株K-1、K-2、K-3、K-8和K-9,在2 h时的活菌数均显著高于0 h(P<0.05),说明其不仅能耐受pH 2.5酸性胁迫,还能在此条件下继续生长。随着pH值降至2.0,乳酸菌分离株的耐受能力也随之下降,但经过2 h后,菌株K-1、K-2和K-3活菌数并未出现显著降低(P>0.05),展现出了极高的耐受能力,说明这些菌株将来作为益生菌应用时,不必采取特殊的包埋工艺以保护菌株免受胃酸的损伤,可以裸菌形式直接服用。综上,菌株K-1、K-2和K-3展现出了最强的酸耐受性,明显优于其他研究报道的植物乳植杆菌[27-28]和短促生乳杆菌[29]的酸耐受能力。
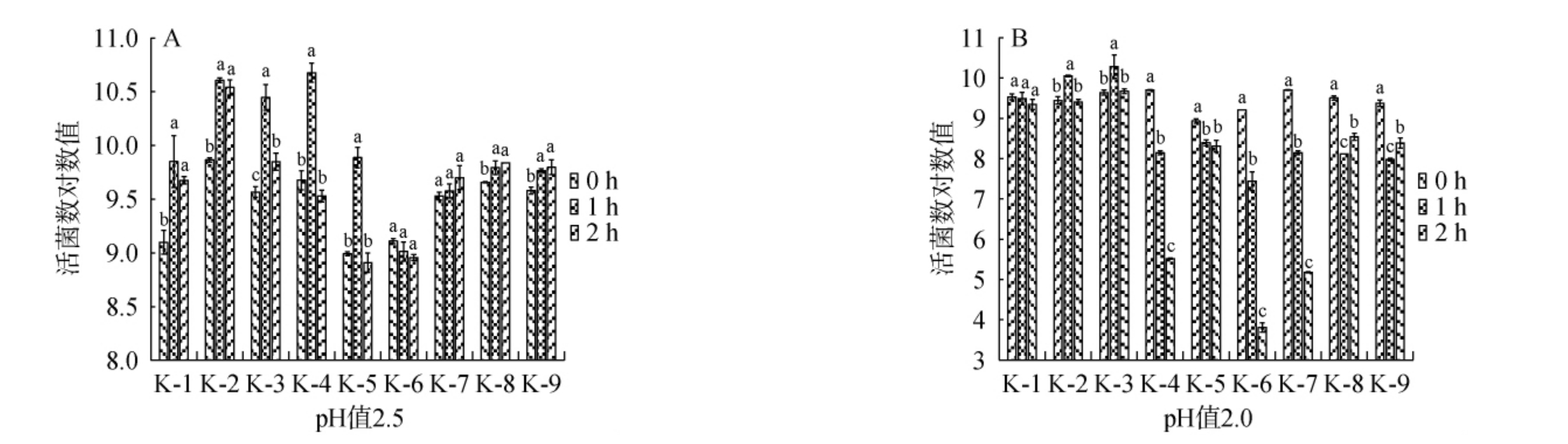
图3 乳酸菌分离株在pH 2.5(A)和pH 2.0(B)酸性条件下的生长情况
Fig.3 Growth of isolated lactic acid bacteria strains under acidic conditions of pH 2.5 (A) and pH 2.0 (B)
不同字母表示差异显著(P<0.05)。下同。
2.3.2 胆汁耐受性
胆汁是乳酸菌口服进入肠道需要面临的第二道屏障,其具有一定的抑菌或杀菌作用[30]。因此,考察9株乳酸菌分离株的胆汁耐受性,结果见图4。由图4可知,9株乳酸菌分离株对胆汁均表现出了不同的耐受能力。所有菌株在0.5%胆汁环境维持4 h后活菌数均出现了显著降低(P<0.05),而在0.3%胆汁环境维持4 h,菌株K-2活菌数无显著变化(P>0.05),菌株K-9出现了先显著上升后显著降低的变化(P<0.05)。所有菌株在0.3%胆汁环境维持4 h后活菌数仍能维持在108 CFU/mL水平以上,而在0.5%胆汁环境下,菌株的耐受能力出现下降,尤其是菌株K-4展现出了最弱的耐受力,4 h后活菌数在106 CFU/mL水平。综上,菌株K-2对胆汁耐受能力表现更为突出,明显优于其他研究报道的植物乳植杆菌[28]。

图4 乳酸菌分离株在0.3%胆汁(A)和0.5%胆汁(B)条件下的生长情况
Fig.4 Growth of isolated lactic acid bacteria strains under 0.3% bile (A) and 0.5% bile (B) conditions
2.4 表面疏水性
益生菌黏附定植于肠道上皮细胞,是其发挥益生功能的关键,而益生菌对有机溶剂的表面疏水性与其肠道黏附能力呈正相关[31],故乳酸菌的表面疏水性通常被用于评价其潜在的黏附能力。因此,考察9株乳酸菌分离株对二甲苯、十六烷、氯仿的表面疏水性,结果见图5。由图5可知,不同菌株对同一有机溶剂的疏水性存在显著差异(P<0.05),且所有供试菌株对3种有机溶剂的疏水率整体上存在相同的趋势,其中菌株K-7对3种有机溶剂的疏水率最高,均在80%以上,而菌株K-2对3种有机溶剂的疏水率均最低,其对十六烷的疏水率仅有2.4%。乳酸菌分离株对有机溶剂的疏水性存在菌株特异性,这与已有报道研究结果一致[32]。综上,菌株K-7的表面疏水性最强。
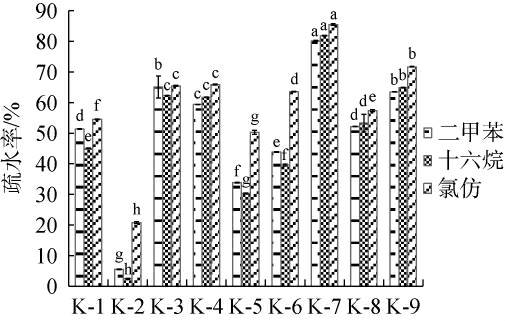
图5 乳酸菌分离株对不同有机溶剂的疏水性
Fig.5 Hydrophobicity of isolated lactic acid bacteria strains to different organic solvents
2.5 抑菌活性
乳酸菌对致病菌的抑菌活性,一方面体现在其进入人体肠道后对肠道致病菌生长繁殖具有抑制作用,从而缓解改善由肠道致病菌引起的相关疾病,另一方面体现在可通过抑制致病菌以提高发酵食品的安全性,故筛选对致病菌具有抑制活性的乳酸菌菌株具有重要意义。大肠埃希氏菌、乙型副伤寒沙门氏菌和金黄色葡萄球菌为常见的肠道致病菌,9株乳酸菌分离株对其抑制活性见表2。由表2可知,所有乳酸菌分离株对3种致病菌均表现出了一定的抑制作用,且具有一定差异。菌株K-7、K-8和K-9对大肠埃希氏菌具有较高抑制活性;菌株K-4、K-5和K-6对乙型副伤寒沙门氏菌具有较高抑制活性;菌株K-2和K-9则对金黄色葡萄球菌具有较高抑制活性。乳酸菌分离株对相同致病菌的抑菌活性具有菌种和菌株特异性,同一菌株的抑菌活性也因致病菌种类而异,这与文献[33-34]报道结果一致,其抑菌活性是否与其可能产生细菌素有关[11],仍需进一步研究加以验证。综上,菌株K-8对大肠埃希氏菌抑菌效果最好,菌株K-6对乙型副伤寒沙门氏菌抑菌效果最好,菌株K-2对金黄色葡萄球菌抑菌效果最好。
表2 乳酸菌分离株对致病菌的抑菌活性
Table 2 Antimicrobial activity of isolated lactic acid bacteria strains to pathogenic bacteria
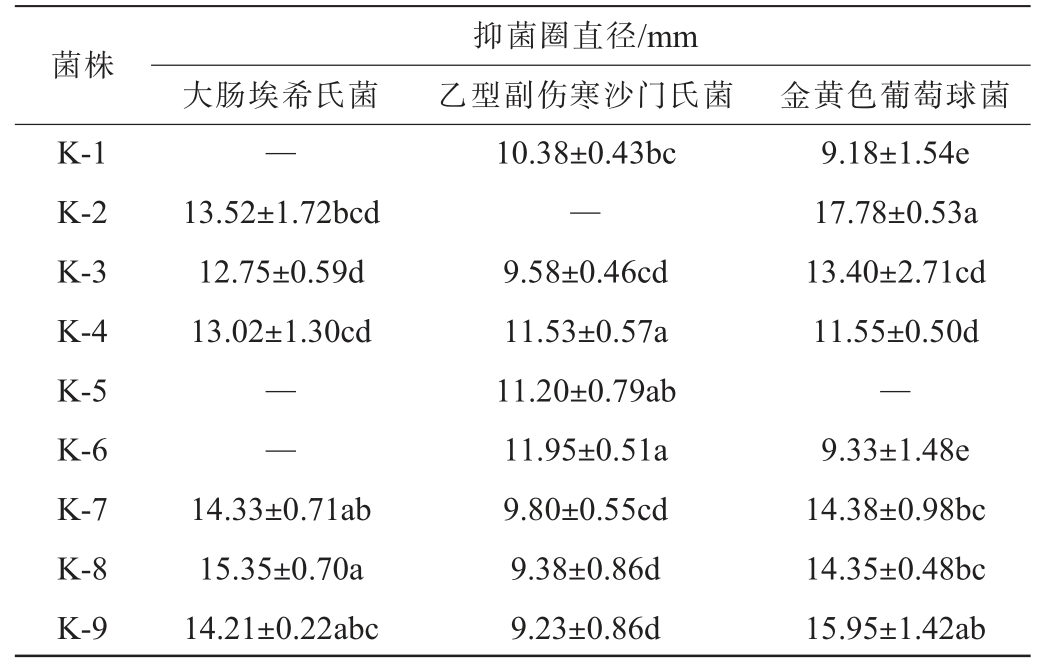
注:“—”表示无抑菌活性。同列不同字母表示差异显著(P<0.05)。
菌株大肠埃希氏菌抑菌圈直径/mm乙型副伤寒沙门氏菌 金黄色葡萄球菌K-1 K-2 K-3 K-4 K-5 K-6 K-7 K-8 K-9—13.52±1.72bcd 12.75±0.59d 13.02±1.30cd——14.33±0.71ab 15.35±0.70a 14.21±0.22abc 10.38±0.43bc—9.58±0.46cd 11.53±0.57a 11.20±0.79ab 11.95±0.51a 9.80±0.55cd 9.38±0.86d 9.23±0.86d 9.18±1.54e 17.78±0.53a 13.40±2.71cd 11.55±0.50d—9.33±1.48e 14.38±0.98bc 14.35±0.48bc 15.95±1.42ab
2.6 抗氧化活性
乳酸菌分离株无细胞上清液对羟基自由基和DPPH自由基的清除能力见图6。由图6可知,9株乳酸菌分离株均展现出了极强的羟基自由基清除能力,经1∶7稀释后,羟基自由基的清除率均在40%以上,均显著高于1.5 mg/mL维生素C对羟自由基的清除率(P<0.05),其中菌株K-9对羟自由基的清除率最高为60.4%。9株乳酸菌分离株对DPPH自由基也表现出了一定的清除能力,清除率在28.0%~80.5%范围,均显著高于1.5 mg/mL维生素C对DPPH自由基的清除率(P<0.05),其中菌株K-1对DPPH自由基的清除率最高为80.5%。乳酸菌分离株对自由基的清除能力因自由基种类而异,对相同自由基清除能力也具有菌株特异性,这与已有研究报道结果一致[35]。综上,菌株K-1对羟基自由基和DPPH自由基均表现出了良好的清除能力。
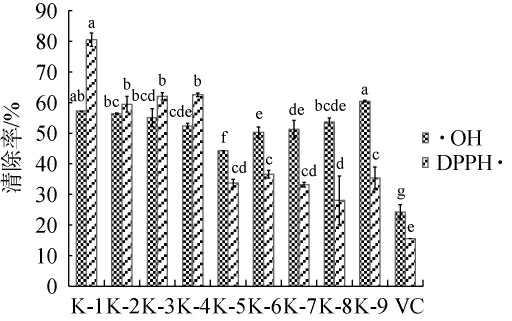
图6 乳酸菌分离株的抗氧化活性
Fig.6 Antioxidant activity of isolated lactic acid bacteria strains
2.7 抗胁迫能力分析
2.7.1 NaCl耐受性
乳酸菌对高渗环境的耐受能力,尤其是耐NaCl能力,是含盐食品发酵生产用菌株的筛选关键,如干酪、酸菜等产品的生产。因此,考察9株乳酸菌分离株对NaCl的耐受性,结果见图7。由图7可知,9株乳酸菌分离株对不同浓度NaCl均表现出了一定的耐受能力。当NaCl含量为2%时,所有菌株的OD600nm值无明显变化或有小幅上升,尤其是菌株K-2、K-3的OD600 nm值出现了显著上升(P<0.05),说明低含量NaCl会在一定程度上促进菌株K-2和K-3的生长,而NaCl含量增至4%时,与NaCl含量为0相比,仅菌株K-3和K-8的OD600 nm值无显著变化(P>0.05),其余均显著降低。当NaCl含量为8%时,所有菌株发酵液的OD600 nm值均下降50%以上。当NaCl含量为10%时,所有菌株仍具有一定活力,相比之下短促生乳杆菌的NaCl耐受能力均弱于植物乳植杆菌。尽管9株乳酸菌分离株表现出了良好的耐NaCl能力,但相比于酱腌菜等高盐生境分离的乳酸菌耐盐能力稍弱[36],说明乳酸菌的耐盐能力与其生存环境有关。综上,菌株K-3和K-8在NaCl含量≤4%时具有较强的耐受能力。
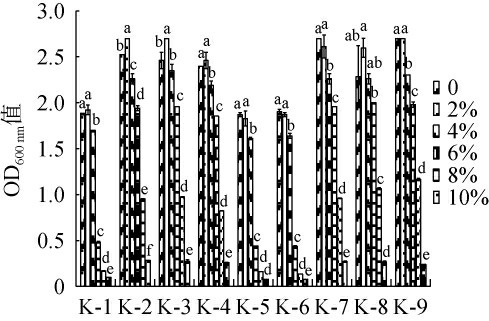
图7 乳酸菌分离株对不同含量NaCl的耐受性
Fig.7 Tolerance of isolated lactic acid bacteria strains to different concentrations of NaCl
2.7.2 乙醇耐受性
乳酸菌对乙醇的耐受能力,直接反映了其作为发酵剂在含酒精的发酵食品加工中的应用潜力,如马奶酒、开菲尔、格瓦斯等,同时也可能作为改善酒精性肝损伤的潜在候选益生菌[37],故筛选具有高耐乙醇能力乳酸菌菌株具有重要意义。传统自然发酵酸马奶中因有酵母菌而存在酒精发酵[1],使其产品中含有一定浓度的乙醇,因此具有生长优势的乳酸菌通常具有一定的乙醇耐受能力,9株乳酸菌分离株对不同体积分数乙醇的耐受能力见图8。由图8可知,随着乙醇体积分数的增加,所有乳酸菌分离株的生长均受到了明显抑制。当乙醇体积分数>15%之后,几乎所有菌株的抑制率均在90%以上,而植物乳植杆菌K-2对乙醇则展现出了最高的耐受力,当乙醇体积分数为25%时,抑制率为61.92%。乳酸菌分离株的耐乙醇机制仍需进一步深入研究,其在乙醇环境中展现出的耐受能力,可能与其胞外多糖的产生、相关代谢酶有关[38-39]。综上,菌株K-2展现出了最强的乙醇耐受性。
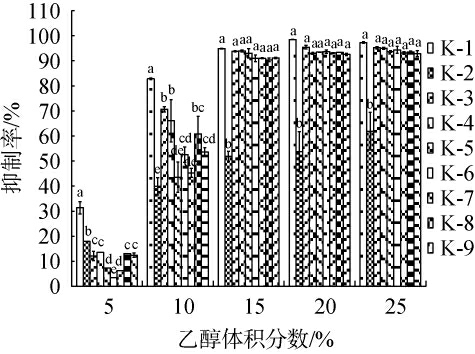
图8 乳酸菌分离株对不同体积分数乙醇的耐受性
Fig.8 Tolerance of isolated lactic acid bacteria strains to different volume fraction of ethanol
2.8 碳水化合物发酵能力分析
乳酸菌对不同碳水化合物的利用能力,可间接反映其可能利用的发酵基质,也是研究其碳代谢的关键[40]。因此,考察9株乳酸菌分离株对10种碳水化合物的利用情况,结果见表3。由表3可知,6株植物乳植杆菌均能利用纤维二糖、麦芽糖、甘露醇、水杨苷、山梨醇、蔗糖、棉子糖、菊糖、乳糖为唯一碳源产酸,同时具有水解七叶苷的能力,表明其具有β-葡萄糖苷酶活性[41],进一步说明其在生物转化皂苷类化合物方面具有相应潜力,如转化原型人参皂苷为活性更强的稀有人参皂苷[42]。3株短促生乳杆菌均能利用麦芽糖、水杨苷、山梨醇、蔗糖、菊糖、乳糖为唯一碳源产酸,而不能利用棉子糖为唯一碳源产酸,均不能水解七叶苷,说明其无β-葡萄糖苷酶活性,这与已有研究报道存在不同[43]。此外,短促生乳杆菌K-1和K-5均能利用纤维二糖、甘露醇为唯一碳源产酸,而菌株K-6则无此能力。综上,相同种的不同菌株在碳水化合物利用能力上存在差异,具有菌株特异性。
表3 乳酸菌分离株对碳水化合物的发酵能力
Table 3 Fermentation ability of isolated lactic acid bacteria strains to carbohydrates

注:“+”表示结果呈阳性;“—”表示结果呈阴性。
碳水化合物 菌株K-1菌株K-2菌株K-3菌株K-4菌株K-5菌株K-6菌株K-7菌株K-8菌株K-9七叶苷纤维二糖麦芽糖甘露醇水杨苷山梨醇蔗糖棉子糖菊糖乳糖—++++++—++++++++++++++++++++++++++++++++—++++++—++——+—+++—++++++++++++++++++++++++++++++++
2.9 抗生素敏感性分析
分析菌株对抗生素的敏感性,是评价益生菌安全性和合理利用的关键[44]。益生菌对抗生素敏感,说明其无抗生素基因,应用时不存在抗性基因转移的风险,而对抗生素具有抗性,则说明其在应用时不受抗生素的影响,其是否存在抗性基因仍需进一步验证。因此,考察9株乳酸菌分离株对临床常见抗生素的敏感程度,结果见表4。由表4可知,所有菌株对氯霉素表现出敏感;除菌株K-9表现为中介外,其他菌株对氨苄西林和红霉素均敏感;除菌株K-1对青霉素中介外,其他菌株均表现为敏感;所有乳酸菌分离株对四环素表现为敏感或中介;除K-1表现为中介外,其他均对庆大霉素具有抗性,这些菌株是否存在抗性基因仍需进一步深入研究。综上,乳酸菌分离株对抗生素的敏感性具有菌株特异性。
表4 乳酸菌分离株对抗生素的敏感性
Table 4 Sensitivity of isolated lactic acid bacteria strains to antibiotics

菌株抑菌圈直径/mm青霉素/10 μg 庆大霉素/10 μg 氨苄西林/10 μg 四环素/30 μg 红霉素/15 μg 氯霉素/30 μg K-1 K-2 K-3 16.31±0.02I 25.02±0.98S 23.50±1.77S 13.25±2.13I 0±0R 0±0R 26.72±4.48S 27.54±6.61S 28.86±0.28S 21.4±1.34S 18.79±1.41I 18.55±2.40I 26.38±1.53S 25.20±0.53S 27.17±3.08S 25.05±3.10S 25.92±5.74S 25.60±1.95S
续表
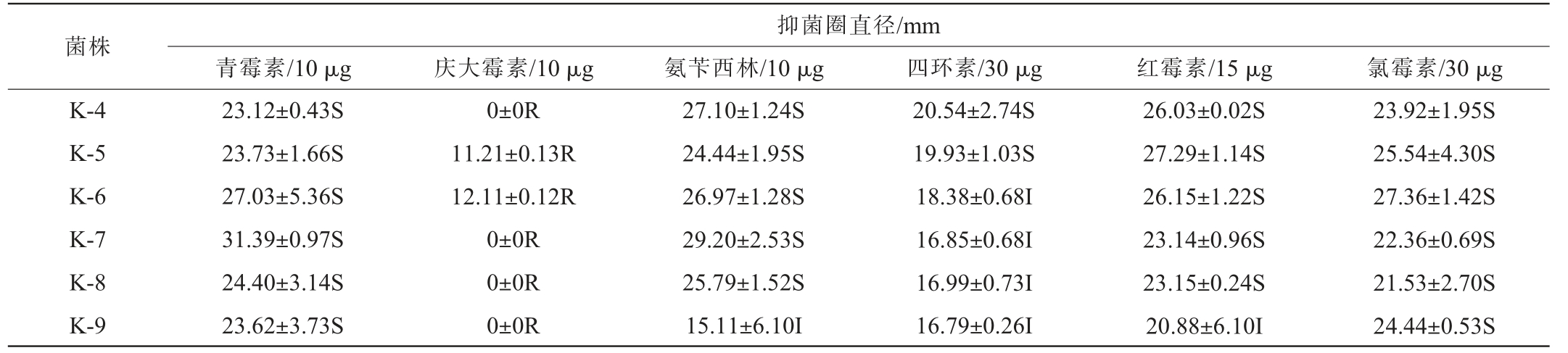
注:“R”表示具有抗性;“I”表示中介;“S”表示敏感。
菌株抑菌圈直径/mm青霉素/10 μg 庆大霉素/10 μg 氨苄西林/10 μg 四环素/30 μg 红霉素/15 μg 氯霉素/30 μg K-4 K-5 K-6 K-7 K-8 K-9 23.12±0.43S 23.73±1.66S 27.03±5.36S 31.39±0.97S 24.40±3.14S 23.62±3.73S 0±0R 11.21±0.13R 12.11±0.12R 0±0R 0±0R 0±0R 27.10±1.24S 24.44±1.95S 26.97±1.28S 29.20±2.53S 25.79±1.52S 15.11±6.10I 20.54±2.74S 19.93±1.03S 18.38±0.68I 16.85±0.68I 16.99±0.73I 16.79±0.26I 26.03±0.02S 27.29±1.14S 26.15±1.22S 23.14±0.96S 23.15±0.24S 20.88±6.10I 23.92±1.95S 25.54±4.30S 27.36±1.42S 22.36±0.69S 21.53±2.70S 24.44±0.53S
3 结论
传统发酵酸马奶经世代传承形成了固有的优势菌群,本研究从新疆传统自然发酵酸马奶样品中共分离得到9株乳酸菌菌株,3株(K-1、K-5、K-6)被鉴定为短促生乳杆菌(Levilactobacillus brevis),6株(K-2、K-3、K-4、K-7、K-8、K-9)被鉴定为植物乳植杆菌(Lactiplantibacillus plantarum)。其中,菌株K-1、K-2和K-3在pH 2.0条件下维持2 h活菌数无明显变化,菌株K-2可完全耐受0.3%胆汁4 h;菌株K-7对二甲苯、十六烷、氯仿的疏水率均为最高,达80%以上;多数菌株对大肠埃希氏菌、乙型副伤寒沙门氏菌、金黄色葡萄球菌均表现出抑制活性,所有菌株无细胞上清液对羟基自由基和DPPH自由基清除率均显著高于1.5 mg/mL维生素C(P<0.05);菌株K-3和K-8可完全耐受4%NaCl,菌株K-2对乙醇耐受性最好;各分离菌株对碳源利用能力及抗生素敏感性存在菌种和菌株特异性。综上,各乳酸菌分离株均展现出了良好的体外益生特性。尽管乳酸菌分离株展现出了良好的体外益生特性,但仍需对其基因组信息、体内益生功能及安全性进一步评估,以开发安全有效的益生菌制剂及产品。
[1]GUO L,YA M,GUO Y S,et al.Study of bacterial and fungal community structures in traditional koumiss from Inner Mongolia[J].J Dairy Sci,2019,102(3):1972-1984.
[2]ISTANBULLUGIL F R,RISVANLI A,SALIKOV R,et al.Koumiss and immunity:A thorough investigation of fermentation parameters and their impact on health benefits[J].J Dairy Sci,2024,107(9):6451-6459.
[3]曹恺欣,武俊瑞,李煜,等.酸马奶中抗结核菌功效成分研究进展[J].中国乳品工业,2022,50(10):34-40.
[4]SALEEM G N,GU R,QU H,et al.Therapeutic potential of popular fermented dairy products and its benefits on human health[J].Front Nutr,2024,11:1328620.
[5]XUE W,YUAN X, JI Z, et al.Nutritional ingredients and prevention of chronic diseases by fermented koumiss:a comprehensive review[J].Front Nutr,2023,10:1270920.
[6]XIA Y,YU J,LIU H,et al.Novel insight into physicochemical and flavor formation in koumiss based on microbial metabolic network[J].Food Res Int,2021,149:110659.
[7]WANG X, ZHAO Z, ZHAO F, et al.Dual-omics strategy for selecting optimal fermentation strains in traditional koumiss production[J].Food Chem X,2025,27:102407.
[8]OLEINIKOVA Y,DAUGALIYEVA S, MOUNIER J, et al.Metagenetic analysis of the bacterial diversity of Kazakh koumiss and assessment of its anti-Candida albicans activity[J].World J Microb Biot,2024,40(3):https://doi.org/10.1007/s11274-024-03896-1.
[9]RAJOKA M S R, MEHWISH H M, ZHANG H, et al.Antibacterial and antioxidant activity of exopolysaccharide mediated silver nanoparticle synthesized by Lactobacillus brevis isolated from Chinese koumiss[J].Colloid Surface B,2020,186:110734.
[10]WU Z,ZUO X,WANG X,et al.The probiotic Lactobacillus casei Zhangmediated correction of gut dysbiosis ameliorates peritoneal fibrosis by suppressing macrophage-related inflammation via the butyrate/PPAR-γ/NF-κB pathway[J].Food Funct,2023,14(15):6840-6852.
[11]MAN L L,XIANG D J.Effect of LuxS/AI-2-mediated quorum sensing system on bacteriocin production of Lactobacillus plantarum NMD-17[J].Folia Microbiol,2023,68(6):855-866.
[12]TANG H,MA H,HOU Q,et al.Profiling of koumiss microbiota and organic acids and their effects on koumiss taste[J].BMC Microbiol,2020,20(1):85.
[13]唐弦,武运,田甜,等.伊犁地区发酵酸马乳优良酵母菌的筛选及其发酵性能研究[J].中国酿造,2024,43(10):42-48.
[14]HE Q,HOU Q,WANG Y,et al.Long-term administration of Lactobacillus casei Zhang stabilized gut microbiota of adults and reduced gut microbiota age index of older adults[J].J Funct Foods,2020,64:103682.
[15]HE Q, ZHANG Y, MA D, et al.Lactobacillus casei Zhang exerts antiobesity effect to obese glut1 and gut-specific-glut1 knockout mice via gut microbiota modulation mediated different metagenomic pathways[J].Eur J Nutr,2022,61(4):2003-2014.
[16]HOR Y,LEW L,LAU A,et al.Probiotic Lactobacillus casei Zhang(LCZ)alleviates respiratory,gastrointestinal&RBC abnormality via immunomodulatory,anti-inflammatory&anti-oxidative actions[J].J Funct Foods,2018,44:235-245.
[17]ZHU H, CAO C, WU Z, et al.The probiotic L.casei Zhang slows the progression of acute and chronic kidney disease[J].Cell Metab, 2021,33(10):1926-1942.
[18]REN S,CHEN A,TIAN Y,et al.Lactobacillus paracasei from koumiss ameliorates diarrhea in mice via tight junctions modulation[J].Nutrition,2022,98:111584.
[19]ARTURSSON V,JANSSON J K.Use of bromodeoxyuridine immunocapture to identify active bacteria associated with arbuscular mycorrhizal hyphae[J].Appl Environ Microb,2003,69:6208-6215.
[20]NASER S M, DAWYNDT P, HOSTE B, et al.Identification of Lactobacilli by pheS and rpoA gene sequence analyses[J].Int J Syst Evol Microbiol,2007,57:2777-2789.
[21]国立东,李秀萍,张焕,等.一株酸面团源乳酸菌的益生特性及其对刺五加叶总皂苷的影响[J].食品工业科技,2021,42(14):121-126.
[22]JIANG J, LI K, WANG Y, et al.Screening, identification and physiological characteristics of Lactobacillus rhamnosus M3(1)against intestinal inflammation[J].Foods,2023,12(8):1628.
[23]HUANG X, TU Z, JIANG Y, et al.Dynamic high pressure microfluidization-assisted extraction and antioxidant activities of lentinan[J].Int J Biol Macromol,2012,51(5):926-932.
[24]ZHANG H,XU J,CHEN Q,et al.Physiological,morphological and antioxidant responses of Pediococcus pentosaceus R1 and Lactobacillus fermentum R6 isolated from Harbin dry sausages to oxidative stress[J].Foods,2021,10(6):1203.
[25]GRUJOVIC′ M Ž,MLADENOVIC′ K G,SEMEDO-LEMSADDEK T,et al.Advantages and disadvantages of non-starter lactic acid bacteria from traditional fermented foods: Potential use as starters or probiotics[J].Compr Rev Food Sci Food Saf,2022,21(2):1537-1567.
[26]SINGH S,GUPTA R,CHAWLA S,et al.Natural sources and encapsulating materials for probiotics delivery systems:Recent applications and challenges in functional food development[J].Front Nutr,2022,9:971784.
[27]WON G,CHOI S I,PARK N,et al.In vitro antidiabetic,antioxidant activity,and probiotic activities of Lactiplantibacillus plantarum and Lacticaseibacillus paracasei strains[J].Curr Microbiol,2021,78(8):3181-3191.
[28]HATI S,RAMANUJ K,BASAIAWMOIT B,et al.Safety aspects,probiotic potentials of yeast and lactobacillus isolated from fermented foods in North-Eastern India,and its anti-inflammatory activity[J].Braz J Microbiol,2023,54(3):2073-2091.
[29]KANKLAI J,SOMWONG T C,RUNGSIRIVANICH P,et al.Screening of GABA-producing lactic acid bacteria from Thai fermented foods and probiotic potential of Levilactobacillus brevis F064A for GABA-fermented mulberry juice production[J].Microorganisms,2020,9(1):33.
[30]KHAGWAL N,SHARMA P K,SHARMA D C.Screening and evaluation of Lactobacillus spp.for the development of potential probiotics[J].Afr J Microbiol Res,2014,8(15):1573-1579.
[31]AYYASH M M,ABDALLA A K,ALKALBANI N S,et al.Invited review:Characterization of new probiotics from dairy and nondairy products-Insights into acid tolerance,bile metabolism and tolerance,and adhesion capability[J].J Dairy Sci,2021,104(8):8363-8379.
[32]SOLEIMANI H,SHOKRI R,NAMI Y,et al.Potential probiotic characterization of lactic acid bacteria isolated from Duimaj, an Iranian traditional snack food, using biochemical, molecular and computational approaches[J].LWT-Food Sci Technol,2023,184:115091.
[33]KERESZTÉNY T,LIBISCH B,ORBE S C,et al.Isolation and characterization of lactic acid bacteria with probiotic attributes from different parts of the gastrointestinal tract of free-living wild boars in Hungary[J].Probiotics Antimicrob Proteins,2024,16(4):1221-1239.
[34]MAIONE A,IMPARATO M,BUONANNO A,et al.Evaluation of potential probiotic properties and in vivo safety of lactic acid bacteria and yeast strains isolated from traditional home-made kefir[J].Foods,2024,13(7):1013.
[35]ABDUXUKUR D,TURSUNTAY A,ZHU X,et al.Antioxidant capacity of lactic acid bacteria and yeasts from Xinjiang traditional fermented dairy products[J].Fermentation,2023,9(7):639.
[36]顾娜泥,武文玉,刘水琳,等.东北传统酱腌菜中耐盐乳酸菌的筛选、鉴定及其发酵特性研究[J].中国酿造,2024,43(8):31-37.
[37]YUN M,JO H E,KIM N,et al.Oral administration of alcohol-tolerant lactic acid bacteria alleviates blood alcohol concentration and ethanol-induced liver damage in rodents[J].J Microbiol Biotechnol,2024,34(4):838-845.
[38]张霖,夏程程,王文悦,等.乳酸菌的乙醇耐受机制及其在食醋生产中的应用[J].现代食品科技,2024,40(3):91-101.
[39]ZHANG L,ZHANG Y,LIU S,et al.Degradation effects and mechanisms of Limosilactobacillus fermentum on ethanol[J].Food Funct,2024,15(20):10283-10299.
[40]LIU S,FANG Z,WANG H,et al.Gene-phenotype associations involving human-residential bifidobacteria (HRB) reveal significant species- and strain-specificity in carbohydrate catabolism[J].Microorganisms,2021,9(5):883.
[41]周俊,夏秀东,李亚辉,等.产β-D-葡萄糖苷酶乳酸菌的筛选、鉴定及系统发育分析[J].食品工业科技,2018,39(12):119-123,131.
[42]李倩,于丹,国立东,等.微生物发酵转化皂苷类化合物机制的研究进展[J].中草药,2022,53(22):7264-7278.
[43]HU K,ZHAO H,KANG X,et al.Fruity aroma modifications in Merlot wines during simultaneous alcoholic and malolactic fermentations through mixed culture of S.cerevisiae,P.fermentans,and L.brevis[J].LWT-Food Sci Technol,2022,154:112711.
[44]HARANAHALLI NATARAJ B,BEHARE P V,YADAV H,et al.Emerging pre-clinical safety assessments for potential probiotic strains:a review[J].Crit Rev Food Sci Nutr,2024,64(23):8155-8183.