基于高通量测序的浓香型和清香型白酒大曲、酒醅菌群结构及差异分析
杜 辉1,杨 芳2,杨军山1,2,何婉清1,郭桂梅2,王利红1,刘美玉1*
(1.河北工程大学 生命科学与食品工程学院,河北 邯郸 056038;2.河北邯郸丛台酒业股份有限公司,河北 邯郸 056002)
摘 要:为了探究浓香型白酒和清香型白酒大曲及其发酵后期酒醅中菌群结构,分析两种白酒生产之间微生物群落的异同,采用高通量测序技术分析大曲、酒醅中菌群结构。 结果表明,两种香型大曲和酒醅细菌丰富度和多样性均高于真菌;浓香型大曲中有2种特有菌种。细菌属水平下,浓香型大曲中魏斯氏菌属(Weissella)相对丰度远高于清香型大曲(分别为23%、<1%),而泛菌属(Pantoea)相对丰度低于清香型大曲;浓香型酒醅中醋杆菌属(Acetobacter)相对丰度最高,清香型酒醅中乳植杆菌属(Lactiplantibacillus)相对丰度最高。真菌属水平下,浓香型大曲和酒醅中相对丰度最高的分别是毕赤酵母属(Pichia)、酵母属(Saccharomyces);清香型大曲、酒醅中相对丰度最高的分别为类酵母属(Saccharomycodes)和酵母属。浓香型大曲中毕赤酵母属(Pichia)相对丰度(66%)远高于清香型大曲(2%);浓香型大曲中菌群丰度差异大,而清香型大曲中各菌群丰度均衡。 两种香型酒醅中相对丰度最高的均为酵母属,浓香型酒醅中曲霉属(Aspergillus)相对丰度(6%)低于清香型酒醅(18%),而诺维酵母属(Naumovozyma)相对丰度(20%)比清香型酒醅(1%)高。以上结论可为明确白酒香型的形成机理、功能微生物的培养筛选提供理论依据。
关键词:清香型白酒;浓香型白酒;大曲;酒醅;菌群结构
中图分类号:TS261.1
文章编号:0254-5071(2025)05-0098-06
doi: 10.11882/j.issn.0254-5071.2025.05.015
引文格式:杜辉,杨芳,杨军山,等.基于高通量测序的浓香型和清香型白酒大曲、酒醅菌群结构及差异分析[J].中国酿造,2025,44(5):98-103.
收稿日期:2024-11-19
修回日期:2025-03-25
基金项目:农业科技成果转化资金项目(21622802D)
作者简介:杜 辉(2003-),男,本科生,研究方向为发酵食品。
*通讯作者:刘美玉(1968-),女,教授,博士,研究方向为食品科学。
Analysis on the microbial community structure and differences in Daqu and fermented grains of strong-flavor and light-flavor Baijiu based on high-throughput sequencing
DU Hui1,YANG Fang2,YANG Junshan1,2,HE Wanqing1,GUO Guimei2,WANG Lihong1,LIU Meiyu1*
(1.College of Life Sciences and Food Engineering,Hebei University of Engineering,Handan 056038,China;2.Handan Congtai Wine Co.,Ltd.,Handan 056002,China)
Abstract:In order to investigate the microbial community structure in the Daqu and fermented grains at the later stages of fermentation for strong-flavor(Nongxiangxing)and light-flavor(Qingxiangxing)Baijiu,analyze the similarities and differences in microbial communities between the two types of Baijiu production,the microbial community structure in Daqu and fermented grains was analyzed by high-throughput sequencing technology.The results showed that the richness and diversity of bacteria were significantly higher than that of fungi in both flavor type of Daqu and fermented grains.There were two specific strains in strong-flavor Daqu.At the bacterial genus level,the relative abundance of Weissella in strong-flavor Daqu was much higher than that in light-flavor Daqu(23%and <1%,respectively),while the relative abundance of Pantoea was lower than that of light-flavor Daqu.The relative abundance of Acetobacter in the fermented grains of strong-flavor Baijiu was the highest,the relative abundance of Lactiplantibacillus in fermented grains of light-flavor Baijiu was the highest.At the fungal genus level, the relative abundance of Pichia and Saccharomyces in Daqu and fermented grains of strong-flavor Baijiu were the highest,respectively.The relative abundance of Saccharomycodes and Saccharomyces in Daqu and fermented grains of light-flavor Baijiu were the highest,respectively.The relative abundance of Pichia in strong-flavor Daqu(66%)was much higher than that in light-flavor Daqu (2%).The difference of community abundance in strong-flavor Daqu was larger, while the difference of community abundance in light-flavor Daqu was balanced. Saccharomyces was the most abundant genus in both flavor types of fermented grains.The relative abundance of Aspergillus in the fermented grains of strong-flavor Baijiu(6%)was lower than that in light-flavor Baijiu(18%),while the relative abundance of Naumovozyma(20%)was higher than that in light-flavor Baijiu(1%).These findings provided a theoretical basis for clarifying the formation mechanism of Baijiu flavor types and the cultivation and screening of functional microorganisms.
Key words:light-flavor Baijiu;strong-flavor Baijiu;Daqu;fermented grains;microbial community structure
浓香型白酒和清香型白酒是中国四大传统香型中深受消费者喜爱的两款香型[1],浓香型白酒窖香浓郁、绵甜醇厚、香味协调、回味悠长,清香型白酒清香纯正、醇甜柔和[2]。这两款香型白酒均是在原料处理、添加大曲、酒醅发酵、蒸馏而制得,影响最终香型的因素除发酵条件和原料外,还与大曲种类、环境中特有微生物有关。大曲中的菌群结构是生成不同香型特有风味物质的关键因素[3],大曲为酒醅提供了发酵所需要的主要功能菌群,调节糖化与酒精发酵平衡,促进酒醅发酵,进一步影响了白酒的品质[4]。
分析大曲、酒醅中微生物菌群常用的方法有纯培养[5]、磷脂脂肪酸分析[6]、变性梯度凝胶电泳[7]和高通量测序(high-throughput sequencing,HTS)等,其中高通量测序技术可以一次性对几百万到十几亿的脱氧核糖核酸(deoxyribonucleic acid,DNA)分子进行分析和测序,对复杂菌种样品进行深度测序,具有通量高、成本低、准确率高的特点,成为研究白酒酿造微生物物种组成、群落结构及群落演替的重要手段。 雷振河[8]利用高通量测序分析发现清香型白酒大曲中优势原核微生物和真核微生物分别为厚壁菌门等和曲霉菌等,酒醅中优势真核微生物和原核微生物分别为肠杆菌科等和假丝酵母等;乔美灵等[9]利用该技术分析了清香型白酒发酵过程中细菌菌落演替及自组装机理,发现了替换是细菌群落变化的主要过程,同时淀粉含量、温度和水分含量等理化性质可能影响细菌群落的自组装;曾波等[10]研究了浓香型酒醅中微生物群落结构演替和理化指标的相关性,发现细菌、真菌均有部分菌群与还原糖、淀粉含量等理化指标呈显著相关;张清玫等[11]研究了不同香型大曲微生物群落及其风味物质的相关性,发现3种大曲菌群结构有显著差异,且各特征菌属不相同;LIU Y B等[12]分析了上、中、下和底层四层坑泥微生物群落结构,并在坑泥中首次发现了部分微生物菌群;ZHOU Q F等[13]研究了几种大曲真菌群落的多样性,发现低温大曲和中高大曲优势菌属不同。目前的研究大都仅针对一种香型的酒醅和酒曲,分析其群落结构及群落演替规律,而不同香型酒曲和酒醅之间微生物群落结构差异性、不同香型形成差异的机理研究较少。
本研究以清香型和浓香型白酒的大曲、发酵后期酒醅为研究对象,利用高通量测序技术分析两种香型白酒大曲和酒醅中微生物群落结构之间的差异,以期为明确白酒香型的形成机理、功能微生物的培养筛选提供理论依据。
1 材料与方法
1.1 材料与试剂
大曲(浓香型大曲和清香型大曲分别为发酵完成后存放三个月的中高温大曲、低温大曲,编号为nxdqA、qxdqA)、酒醅(浓香型酒醅(发酵90 d)、清香型酒醅(发酵21 d),编号为nx6.6A、qx6.7A):河北邯郸丛台酒业股份有限公司。
氢氧化钠、氯化钠、邻苯二甲酸氢钾、可溶性淀粉、己酸、无水乙醇、葡萄糖:上海阿拉丁试剂有限公司;E.Z.N.A.RSoil DNA Kit:美国Omega BioTek公司;琼脂糖:生工生物工程有限公司;Fast Pfu Polymerase:北京全式金生物技术有限公司;AxyPrep DNA Gel Extraction Kit:美国Axygen公司。实验所用试剂均为分析纯或生化试剂。
1.2 仪器与设备
NanoDropTM8000超微量分光光度计、多功能台式自动化提取仪器:Kingfisher Thermo Fisher公司;VeritiPro聚合酶链式反应(polymerasechainreaction,PCR)仪:美国Thermo Fisher Scientifc公司;ExperionTM全自动电泳系统:美国Bio-Rad公司;MGISEQ-2000测序仪:深圳华大智造公司;CR22N高速落地式离心机:德国Eppendorf公司; KZ-II高速研磨仪:上海净信环境科技有限公司。
1.3 方法
1.3.1 微生物多样性测定
提取浓香型和清香型大曲、酒醅中的DNA进行聚合酶链式反应扩增、纯化,在DNBSEQ测序平台,构建DNA文库,使用Agilent 2100 Bioanalyzer等设备检测文库片段的分布,对检测合格的样本细菌、真菌进行序列分析。高通量测序由北京柏科瑞新生物科技有限公司完成。
1.3.2 数据处理
使用FastQC工具[14]进行初步质控,再使用Fastp工具[15]进一步质控和过滤,然后使用Kraken2数据库进行物种注释和分类,将测序数据中的reads分配到不同的物种。再使用Bracken进行物种丰度的校正。使用R软件进行物种α-多样性和β-多样性的计算,分析样本间微生物多样性差异。
2 结果与分析
2.1 浓香型、清香型型大曲和酒醅中细菌、真菌多样性分析
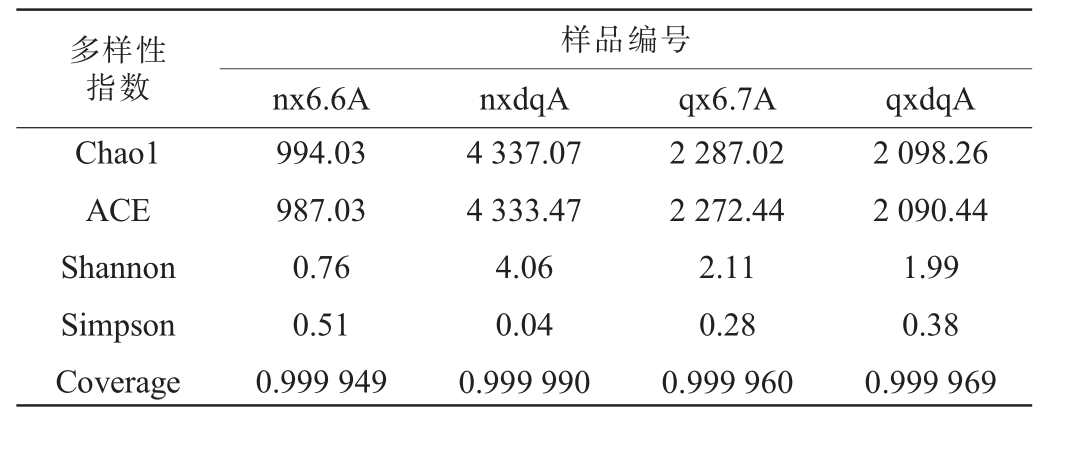
样本多样性分析(α-多样性分析)可反映样本内微生物群落的丰富度和多样性,依据Chao1、ACE、Shannon和Simpson指数对两种香型白酒细菌、真菌的丰富度和多样性进行分析,其中Chao1和ACE指数反映物种丰富度;Shannon和Simpson指数用来衡量微生物群落多样性,前者越大代表微生物群落多样性越高,后者越大代表群落多样性越低。浓香型、清香型大曲和酒醅中细菌及真菌α-多样性指数分别见表1和表2。
表1 浓香型、清香型白酒大曲和酒醅中细菌Alpha多样性指数
Table 1 Alpha diversity index of bacteria in Daqu and fermented grains of strong-flavor and light-flavor Baijiu
多样性指数Chao1 ACE Shannon Simpson Coverage样品编号nx6.6A nxdqA qx6.7A qxdqA 994.03 987.03 0.76 0.51 0.999 949 4 337.07 4 333.47 4.06 0.04 0.999 990 2 287.02 2 272.44 2.11 0.28 0.999 960 2 098.26 2 090.44 1.99 0.38 0.999 969
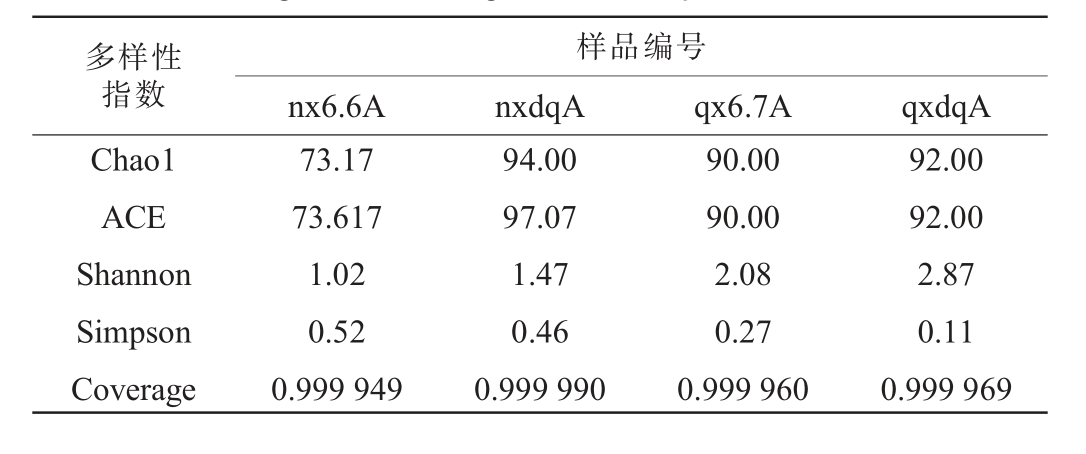
表2 浓香型、清香型白酒大曲和酒醅中真菌Alpha多样性指数
Table 2 Alpha diversity index of fungi in Daqu and fermented grains of strong-flavor and light-flavor Baijiu
多样性指数Chao1 ACE Shannon Simpson Coverage样品编号nx6.6A nxdqA qx6.7A qxdqA 73.17 73.617 1.02 0.52 0.999 949 94.00 97.07 1.47 0.46 0.999 990 90.00 90.00 2.08 0.27 0.999 960 92.00 92.00 2.87 0.11 0.999 969
由表1可知,浓香型、清香型型大曲和酒醅中细菌有效序列覆盖率均达到99.99%以上,说明测序结果准确性高。浓香型大曲的Chao1、ACE指数和Shannon指数均高于其酒醅,而Simpson指数低于其酒醅,这表明浓香型大曲的细菌丰富度和多样性均高于其酒醅,这可能因为浓香型酒醅发酵周期过长,发酵后期以乳酸菌为绝对优势菌群,过酸的环境使大部分细菌无法生存[16]。清香型大曲的Chao1、ACE指数和Shannon指数均低于其酒醅,而Simpson指数高于其酒醅,表明清香型大曲的细菌丰富度和多样性均低于其酒醅,这可能与清香型酒醅发酵环境中空气菌群和酒厂环境中特有菌群有关,外来菌群是影响清香型白酒风味口感的重要因素。
浓香型大曲Chao1、ACE和Shannon指数均远高于清香型大曲和酒醅,Simpson指数低于清香型大曲和酒醅,这表明浓香型大曲细菌丰富度和多样性远高于清香型大曲和酒醅。细菌菌群的差异代表着产酸、产香能力的差异,这是导致两种香型白酒风味差异的主要原因。
由表2可知,浓香型、清香型型大曲和酒醅中真菌有效序列覆盖率均达到99.99%以上,说明测序结果准确性高。浓香型大曲Chao1、ACE和Shannon指数均高于酒醅,Simpson指数小于酒醅,表明浓香型大曲的真菌丰富度和多样性高于其酒醅。 清香型大曲的Chao1、ACE和Shannon指数均高于酒醅,Simpson指数小于酒醅,说明清香型大曲的真菌丰富度和多样性高于其酒醅。
浓香型大曲真菌多样性略高于清香型大曲;浓香型酒醅真菌多样性低于清香型酒醅,这可能是在发酵过程中受外部环境的影响,酒醅菌群发生了演替。 酒醅中真菌除来自于大曲外,还可能来自于酒厂空气和发酵池等外部环境,这些外来菌群是形成不同白酒特色风味的主要微生物。
综上所述,浓香型、清香型大曲和酒醅中细菌丰富度和多样性均高于真菌。这与罗爱国等[17-18]的结果一致。在浓香型、清香型的大曲和酒醅四个样本中,浓香型大曲真菌、细菌群落丰富度和多样性最高,其酒醅最低。
2.2 两种香型大曲和酒醅中细菌、真菌群落多样性差异分析
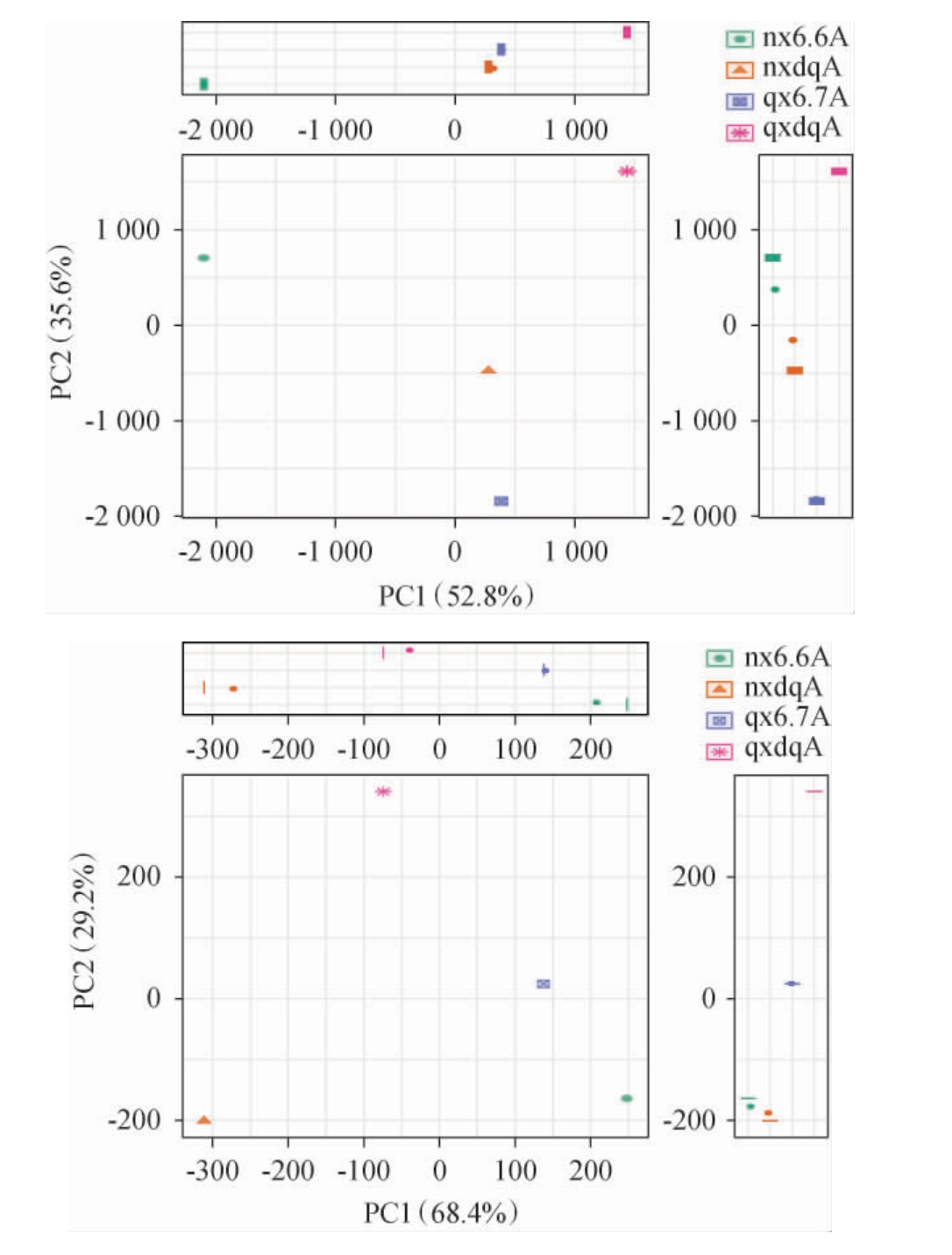
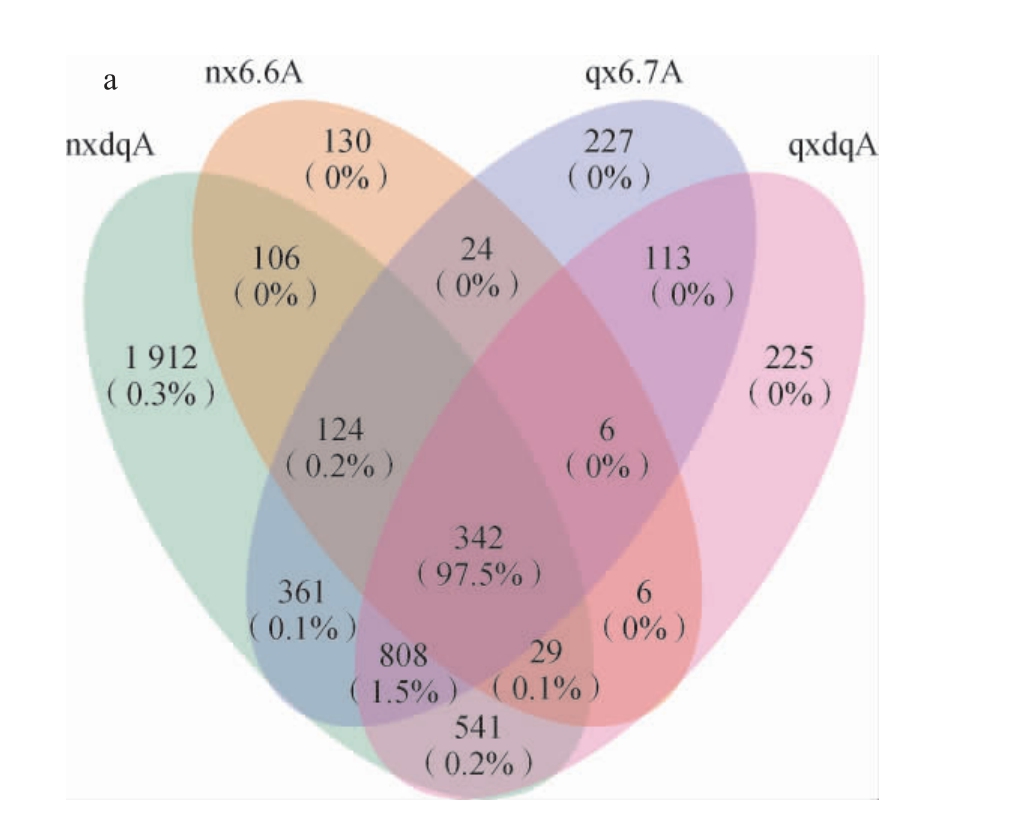
采用主成分分析法(principal component analysis,PCA)对浓香型、清香型大曲和酒醅的细菌、真菌群落多样性差异分析,结果见图1。浓香型、清香型大曲和酒醅微生物OTU Venn图见图2。
由图1可知,浓香型和清香型大曲、酒醅的细菌和真菌在主成分坐标轴上的分布明显分离,所以各组间存在明显差异,即两种香型的大曲和酒醅无论在细菌群落结构还是真菌群落结构上均存在着显著差异。
由图2可知,两种香型大曲和酒醅共有的细菌OTU为342个,浓香型大曲和酒醅、清香型大曲和酒醅中特有细菌OTU数分别为1 912个、130个、225个和227个。两种香型大曲和酒醅共有的真菌OTU为72个,浓香型大曲和酒醅、清香型大曲和酒醅中特有真菌OTU数分别为2种、0种、0种和0种。
2.3 两种香型大曲和酒醅菌群结构分析
2.3.1 细菌菌群结构分析
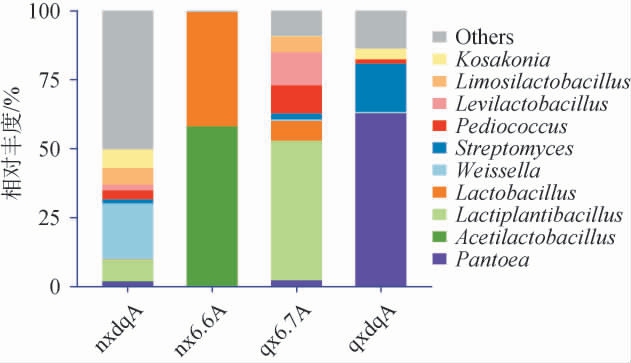
细菌是白酒发酵过程中的重要微生物,能提供白酒发酵所需要的酶,同时可产生有机酸和部分香味物质,是白酒风味形成的关键。 两种香型大曲和酒醅细菌在门、属水平下群落结构见图3~图4。
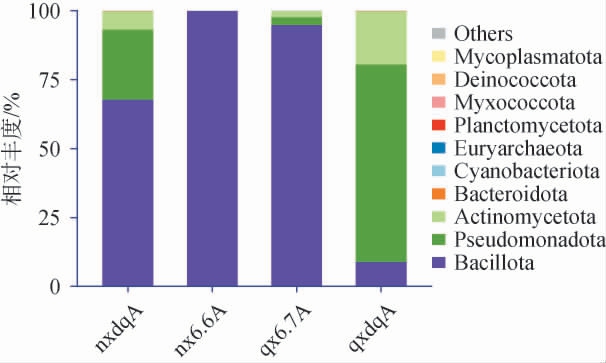
由图3可知,在门水平下,浓香型酒醅、清香型酒醅和浓香型大曲中厚壁菌门(Bacillota)相对丰度最高,分别为99%、95%和68%;清香型大曲中变形菌门(Pseudomonadota)相对丰度最高,为71%;浓香型大曲中Pseudomonadota和放线菌门(Actinomycetota)相对丰度分别为24%和7%;浓香型酒醅中Pseudomonadota和Actinomycetota相对丰度分别为0.250%和0.057%;清香型大曲中Bacillota和Actinomycetota相对丰度分别为21.0%和7.5%。 清香型酒醅中Actinomycetota和Pseudomonadota相对丰度分别为2.5%、2.4%,这与刘雪婷等[19]提出的清香型酒醅中的优势菌群基本一致。
由图4可知,在属水平下,浓香型大曲中除其他菌属外,魏斯氏菌属(Weissella)相对丰度最高,为20%;、乳植杆菌属(Lactiplantibacillus)、科萨克氏菌属(Kosakonia)、粘液乳杆菌属(Limosilactobacillus)和片球菌属(Pediococcus),相对丰度分别为7.8%、7.8%、6.7%和6.3%;浓香型酒醅中s醋杆菌属(Acetilactobacillu)、乳杆菌属(Lactobacillus)相对丰度分别为61.2%和38.7%。 清香型大曲中泛菌属(Pantoea)相对丰度最高,为63%;其次链霉菌属(Streptomyces)和Kosakonia的相对丰度分别为17%和4%;清香型酒醅中Lactiplantibacillus相对丰度为50%,其余菌群相对丰度从高到低依次为促乳杆菌属(Levilactobacillus)(12%)、Pediococcus(10%)、Limosilactobacillus(7.2%)和Lactobacillus(6%)。 这与王秀秀[21]研究中浓香型酒醅酒曲中菌群结构基本相似。
浓香型和清香型的大曲相比,细菌菌群组成存在较大差异,浓香型大曲中Weissella相对丰度较高,Pantoea与Streptomyces丰度较低;而清香型大曲中Pantoea相对丰度最高,其次为Streptomyces,这与凌荔等[22]的结论略有不同。酒醅细菌菌属组成的差异是导致风味物质不同的主要原因,发酵后期的两种香型酒醅细菌菌属组成差异较大。 清香型酒醅中的Lactiplantibacillus产生乳酸等有机酸能使白酒口感更佳柔和清爽,而浓香型酒醅中Acetilactobacillus产生醋酸等有机酸可进一步与乙醇反应形成酯类物质,赋予白酒更浓郁的香味。
2.3.2 真菌菌群结构分析
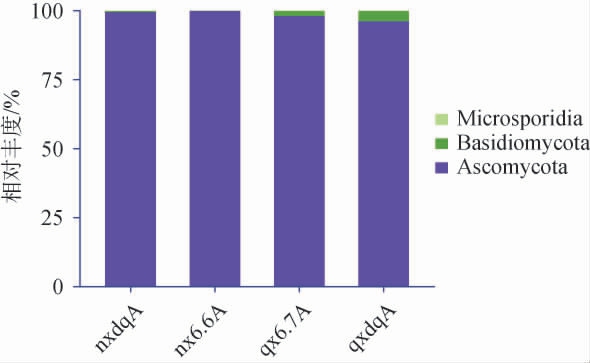
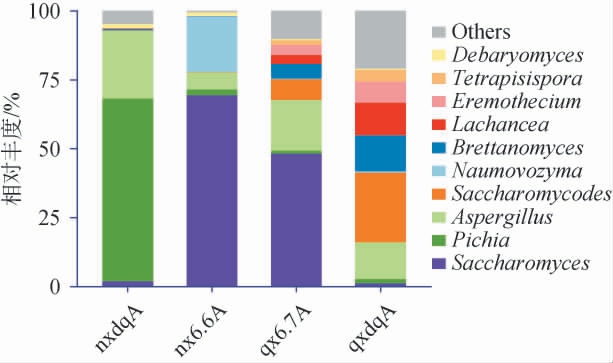
白酒发酵中的真菌主要为酵母菌和霉菌,前者是白酒发酵的核心微生物,除产生乙醇和香味物质外,还能与其他微生物相互作用;后者可为白酒发酵提供淀粉酶、糖化酶、蛋白酶和纤维素酶等,对原料的降解具有重要作用。两种香型大曲和酒醅真菌在门、属水平下菌群结构见图5~图6。
由图5可知,在门水平下,浓香型大曲和酒醅、清香型大曲和酒醅中相对丰度最高的菌群均为子囊菌门(Ascomycota),依次为99.6%、99.8%、96.3%和98.1%;清香型大曲、酒醅和浓香型大曲、酒醅中担子菌门(Basidiomycota)的相对丰度分别为0.36%、0.05、1.80%、3.70%;浓香型大曲、酒醅及清香型大曲、酒醅中隐菌门(Microsporidia)相对丰度分别为0、0.00 000 962%、0.000 004 33%、0.000 003 38%。
由图6可知,在属水平下,浓香型大曲中毕赤酵母属(Pichia)的相对丰度最高为66%,其次为曲霉属(Aspergillus)(25%)、酿酒酵母属(Saccharomyces)(2%);浓香型酒醅中酿酒酵母属相对丰度最高为69%,其次为诺维酵母属(Naumovozyma)和Aspergillus,相对丰度分别为20%和6%。 清香型大曲中类酵母属(Saccharomycodes)相对丰度为25%,Aspergillus、布雷坦酵母属(Brettanomyces)、拉察尼亚酵母属(Lachancea)、荒漠酵母属(Eremothecium)和四孢酵母属(Tetrapispora)相对丰度分别为13%、13%、11%、7%和4%;清香型酒醅中Saccharomyces相对丰度最高,为48%,其他依 次 为Aspergillus、Saccharomycodes、Lachancea和Eremothecium,相对丰度分别为18.0%、7.4%、5.0%和3.5%。
浓香型大曲中除Aspergillus外其他菌群丰度均高于其酒醅;清香型大曲中除Saccharomycodes外,其他菌群丰度均衡。在浓香型大曲中Pichia相对丰度高于清香型大曲;两种香型酒醅中相对丰度最高的菌群均为Saccharomyces;浓香型酒醅中Aspergillus相对丰度低于清香型酒醅,而Naumovozyma相对丰度高于清香型酒醅。
浓香型酒醅菌群结构与宋建阳[28]和王雪山[29]的结果基本相似;浓香型酒醅和清香型酒醅中相对丰度较高的菌群与曾波[10]、李艳婷[30]的结论有所不同,这与选用酒醅发酵周期不同,酒醅菌群结构发生变化有关。浓香酒醅中Aspergillus由大曲提供,另外可能还来自酒厂发酵环境[31-32]。
3 结论
采用高通量测序技术对两种香型的大曲和发酵后期酒醅进行分析,浓香型大曲中有2种特有菌种,浓香型酒醅、清香型大曲和酒醅中无特有真菌。 两种香型大曲和酒醅细菌群落丰富度和多样性均高于真菌,浓香型大曲真菌群落丰富度和多样性高于清香型,这是浓香型香味比清香型浓郁的重要原因。
在门水平下,细菌:浓香型酒醅、清香型酒醅和浓香型大曲中Bacillota相对丰度最高(99%、95%、68%);清香型大曲中Pseudomonadota相对丰度最高(71%)。真菌:浓香型大曲和酒醅、清香型大曲和酒醅中相对丰度最高的菌群均为Ascomycota(99.6%、99.8%、96.3%、98.1%)。
在属水平下,细菌:浓香型大曲中Pantoea与链霉菌属(Streptomyces)相对丰度远低于清香型大曲。 浓香型酒醅中Acetilactobacillus相对丰度(61.2%)最高,清香型酒醅中相对丰度最高的菌群为Lactiplantibacillus(50%)。 真菌:浓香型大曲和酒醅中相对丰度最高的分别是Pichia、Saccharomyces(66%、69%);清香型大曲、酒醅中相对丰度最高的分别为Saccharomycodes和Saccharomyces(25%、48%)。 浓香型大曲中Pichia相对丰度远高于清香型大曲(6%),浓香型酒醅中Aspergillus相对丰度低于清香型酒醅。
本研究为探究不同香型白酒风味差异形成机理和揭示白酒酿造机理提供理论依据,根据大曲、酒醅菌群结构的差异,后续可结合培养组学调整菌群丰度,结合微生物代谢产生的风味物质研制更多高质量大曲用于白酒发酵中。
参考文献:
[1]HE Y X,LIU Z P,QIAN M,et al.Unraveling the chemosensory characteristics of strong-aroma type Baijiu from different regions using comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry and descriptive sensory analysis[J].Food Chem,2020,331:127335.
[2]CHEN C,YANG H Q,LIU J,et al.Systematic review of Actinomycetes in the Baijiu fermentation microbiome[J].Foods,2022,11(22):3551.
[3]YAO F,YI B,SHEN C H,et al.Chemical analysis of the Chinese liquor Luzhoulaojiao by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J].Sci Rep,2015,5:9553.
[4]BAI Y,MIAO Z J,YAN R Y,et al.Daqu regulates the balance of saccharification and alcoholic fermentation to promote Chinese Baijiu fermentation[J].Food Biosci,2024,61:104723.
[5]李锐,杨玉贤,杨强,等.劲酒传统发酵过程中可培养功能细菌群落的动态变化初步研究[J].湖北大学学报(自然科学版),2019,41(6):572-577.
[6]ZHANG H X,ZHANG X H,ZHAO J L,et al.Analysis of the microbial communities of three kinds of Fen-Daqu by PLFAs[J].J I Brewing,2016,122(1):34-41.
[7]ZHANG L Q, WU C D, DING X F, et al.Characterisation of microbial communities in Chinese liquor fermentation starters Daqu using nested PCR-DGGE[J].World J Microb Biot,2014,30(12):3055-3063.
[8]雷振河.采用高通量测序技术分析清香型白酒酿造微生物[J].食品与发酵工业,2015,41(9):164-167.
[9]乔美灵,任宇婷,张桂莲,等.传统清香型白酒发酵过程中细菌群落演替及自组装机理[J].食品科学,2023,44(22):139-148.
[10]曾波,饶家权,邹永芳,等.浓香型白酒酒醅发酵过程中微生物群落结构演替及其与理化指标相关性[J].食品科学,2024,45(7):111-118.
[11]张清玫,赵鑫锐,李江华,等.不同香型白酒大曲微生物群落及其与风味的相关性[J].食品与发酵工业,2022,48(10):1-8.
[12]LIU Y B, SUN M X, HOU P, et al.Analysis of microbial community structure and volatile compounds in pit mud used for manufacturing Taorong-type Baijiu based on high-throughput sequencing[J].Sci Rep,2022,12(1):7347.
[13]ZHOU Q F,MA K,SONG Y,et al.Exploring the diversity of the fungal community in Chinese traditional Baijiu daqu starters made at low-,medium-and high-temperatures[J].LWT-Food Sci Technol,2022,162:113408.
[14]HAO Z Q,LIANG X J,LI G L.Quality control and preprocessing of sequencing reads[J].Bio-protoc,2022,12(13):1-8.
[15]CHEN S F,ZHOU Y Q,CHEN Y R,et al.fastp:an ultra-fast all-in-one FASTQ preprocessor[J].Bioinformatics,2018,34(17):i884-i890.
[16]赵亮亮,盛伟喜,时晓,等.浓香型白酒酿造生境中微生物群落多样性及群落间相互作用[J].中国酿造,2023,42(11):15-21.
[17]罗爱国,杨牛恬,郑同庆,等.清香型白酒酿酒大曲微生物菌群多样性解析[J].中国酿造,2022,41(4):73-79.
[18]张双燕.清香型白酒风味物质形成与大曲微生物相关性研究[D].北京:北京理工大学,2016.
[19]刘雪婷,王子媛,刘继明,等.清香型白酒酒醅发酵菌株分离鉴定及细菌群落结构分析[J].中国酿造,2021,40(1):39-43.
[20]WEI J L,NIE Y,DU H,et al.Reduced lactic acid strengthens microbial community stability and function during Jiang-flavour Baijiu fermentation[J].Food Biosci,2024,59:103935.
[21]王秀秀.浓香型白酒酿造过程微生物多样性分析[D].济南:齐鲁工业大学,2024.
[22]凌荔,方尚玲,牟飞燕,等.基于高通量测序技术分析南方清香型白酒大曲的微生物多样性[J].酿酒科技,2023(1):51-60.
[23]邓杰,张曼,周杰,等.2种浓香型白酒大曲中微生物群落结构及功能研究[J].食品科学技术学报,2024,42(4):75-85.
[24]赵欣怡,甄攀,赵鑫锐,等.清香型白酒立醅期酒醅中主体酸和细菌菌群结构动态解析[J].食品与发酵工业,2022,48(9):26-33.
[25]韩冰玙,陈辉太,李宗军.酱、浓、清香型白酒酿造过程中真菌及其功能特性研究进展[J].中国酿造,2024,43(3):27-32.
[26]WANG J S,CHEN H,WU Y S,et al.Uncover the flavor code of strongaroma Baijiu:Research progress on the revelation of aroma compounds in strong-aroma Baijiu by means of modern separation technology and molecular sensoryevaluation[J].J Food Compos Anal,2022,109:104499.
[27]杨凤英,秦洋,赵千慧,等.冠突散囊菌对大曲发酵性能、微生物区系以及白酒风味的影响[J].食品工业科技,2023,44(16):180-186.
[28]宋建阳,梁莉莹,岑定运,等.浓香型白酒发酵过程中酒醅微生物群落结构解析及其与风味物质的相关性[J].食品研究与开发,2023,44(14):86-92.
[29]王雪山,杜海,徐岩.清香型白酒发酵过程中微生物种群空间分布[J].食品与发酵工业,2018,44(9):1-8.
[30]李艳婷,郭尚,郭霄飞,等.清香型白酒发酵过程中微生物群落结构变化及与理化性质的相关性[J].中国食品学报,2023,23(5):330-340.
[31]杜艾明,李良,李俊薇,等.清香型白酒酿造核心功能微生物的研究与应用[J].中国酿造,2021,40(2):16-19.
[32]王秀秀,汪俊卿,吕志远,等.浓香型白酒酿造区域空气微生物群落结构研究[J].中国酿造,2024,43(3):33-39.