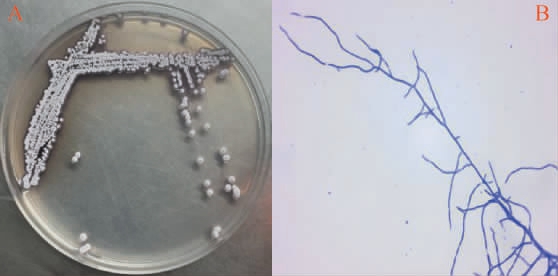
图1 菌株tz-6的菌落(A)及细胞(B)形态
Fig.1 Colony (A) and cell (B) morphology of the strain tz-6
Identification and antagonistic mechanism of strains against Staphylococcus aureus
金黄色葡萄球菌(Staphylococcus aureus)属于革兰氏阳性菌,被认为是全球除大肠杆菌(Escherichia coli)外第二大食源性致病菌[1]。据报道,中国超过25%的食源性疾病由金黄色葡萄球菌感染引起[2]。 作为常见的人畜共患传染病菌,金黄色葡萄球菌可以在人类和动物间传播[3]。该细菌易引发如中毒性休克综合症、肺部感染、骨髓炎等疾病,严重时甚至危及生命[4-6]。由于金黄色葡萄球菌对外界生长环境适应能力强,在各种环境中都能迅速繁殖,使得其防控具有一定难度[7]。 对于金黄色球菌感染疾病的治疗,传统上主要使用抗生素类药物[8]。 然而,不规范的使用抗生素导致约90%的金黄色葡萄球菌对多种抗生素产生耐药性,严重威胁人类健康安全,因此,迫切需要不断研发新型抗菌药物[9-11]。
由于微生物种类繁多且具有代谢旺盛、易于培养的特点,从微生物代谢产物中寻找新的抗金黄色葡萄球菌药物已经成为当前研究的热点领域[12]。如芽孢杆菌(Bacillus)H223被发现能产生一种非蛋白类小分子,对耐药性金黄色葡萄球菌具有拮抗作用[13];解淀粉芽孢杆菌(Bacillus amyloliquefaciens)SY11所产生的脂肽类粗提物Bacillomycin D对金黄色葡萄球菌具有良好的抑制效果[14]。目前,对金黄色葡萄球菌的拮抗机制的研究,主要集中在生物膜、酶、核酸和蛋白质合成等方面[15]。生物膜的存在使得病原菌对抗生素和宿主防御机制具有更强的耐受性。 持续使用同种抗生素会增强金黄色葡萄球菌生物膜形成的能力,有生物膜包裹的金黄色葡萄球菌,具有对抗生素敏感性低和逃避被宿主免疫细胞的吞噬效果的能力[16]。因此,对抗金黄色葡萄球菌机制的研究重点通常放在生物膜上。 刘俊俊等[17]探究了7种中药对金黄色葡萄球菌的抑菌效果,发现这些中草药通过影响生物被膜通透性和细胞能量代谢来影响金黄色葡萄球菌的生长。 此外,球毛壳菌(Chaetomiumglobosum)CGMCC6882产生的多糖能诱导金黄色葡萄球菌生物被膜去极化,降低细胞膜上Ca2+、Mg2+和三磷酸腺苷(adenosine triphosphate,ATP)酶的活性,并增加细胞质中Ca2+的含量,从抑制金黄色葡萄球菌的生长[18]。
为了开发新型抗金黄色葡萄球菌药物,本研究选取了课题组早期发现对金黄色葡萄球菌有抑制作用的菌株tz-6为研究对象,通过形态学观察、生理生化试验及分子生物学技术对其进行菌种鉴定,并通过评估该菌株对金黄色葡萄球菌的生长、β-半乳糖苷酶、脱氧核糖核酸(deoxyribonucleic acid,DNA)和蛋白质泄漏程度、生物膜形成以及丙酮酸释放等指标的影响,深入探究其抑制金黄色葡萄球菌的机制,以期为防治金黄色葡萄球菌感染提供新的研究方向。
1.1.1 菌株菌株tz-6:由本实验室从江西赣州私人果园中分离、保存;金黄色葡萄球菌:由本实验室保存。
1.1.2 主要试剂
无水乙醇、甲醇、氯化钠、可溶性淀粉、硝酸钾、硫酸镁、磷酸氢二钾、磷酸二氢钾、硫酸亚铁、硫酸铵、硫酸锰、硫酸锌、氢氧化钠:国药集团化学试剂有限公司;酵母提取物、结晶紫染色液:生工生物工程(上海)股份有限公司;蛋白胨:青岛高科技工业园海博生物技术有限公司;2-硝基苯基-β-D-吡喃半乳糖苷、2,4-二硝基苯肼、邻硝基苯酚、丙酮酸:上海麦克林生化科技股份有限公司;Ezup柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:齐一生物科技(上海)有限公司。本研究所用试剂均为分析纯或生化试剂。
1.1.3 培养基
LB液体培养基[19]:酵母提取物5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,pH 7.0。
高氏一号培养基[19]:可溶性淀粉20.0 g/L,KNO31.0 g/L,NaCl 0.5 g/L,MgSO4 0.5 g/L,K2HPO4 0.5 g/L,FeSO4·7H2O 0.01 g/L,pH 7.2。
发酵培养基:可溶性淀粉20g/L,蛋白胨20g/L、(NH)2SO4 2 g/L、KH2PO4 1 g/L、MgSO4 1 g/L、MnSO4 0.01 g/L、ZnSO4 0.01 g/L、pH 7.2。
以上培养基均在121 ℃条件下高压蒸汽灭菌20 min。
LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;LRH-250生化培养箱:上海一恒科学仪器有限公司;ZWY-2102C恒温培养振荡器:上海智城分析仪器制造有限公司;HBS-1096A酶标分析仪:南京德铁实验设备有限公司;H1750R高速台式冷冻离心机:湖南湘仪实验室仪器开发有限公司;BM2000显微镜:南京江南永新光学有限公司;SW-CJ-2FD型双人单面净化工作台:苏州净化设备有限公司;RE-52AA旋转蒸发仪:上海亚荣生化仪器厂。
1.3.1 菌株tz-6的鉴定
形态学观察:将菌株tz-6接种于高氏一号琼脂培养基上,30 ℃条件下培养7 d,观察菌落形态特征。 挑取单菌落经革兰氏染色后,在光学显微镜下观察菌株形态特征。
生理生化试验:参照《链霉菌鉴定手册》[20]对菌株tz-6的生理生化特性进行研究。
分子生物学鉴定:将菌株tz-6划线接种于高氏一号固体培养基上,30 ℃条件下培养7 d。挑选单菌落,采用Ezup柱式细菌基因组DNA抽提试剂盒提取基因组DNA,并以其为模板,利用引物27F(5'-AGTTTGATCMTGGCTCAG-3')和1942R(5'-GGTTACCTTGTTACGACTT-3')PCR扩增16SrDNA基因序列。PCR扩增体系:基因组DNA(20~50ng/μL)0.5μL、10×Buffer(with Mg2+)2.5 μL、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)(各2.5 mmol/L) 1 μL、DreamTaqTMDNAPolymerase 0.2μL、27F(10μmol/L)0.5μL、1942R(10 μmol/L)0.5 μL、加双蒸水(ddH2O)至25 μL。PCR扩增条件:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环;最后72 ℃延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后,委托生工生物工程(上海)股份有限公司进行测序。 将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对搜索。 选取同源性较高的模式菌株的16S rDNA基因序列,使用Mega 5.2软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.2 菌株tz-6发酵粗提物的制备
将菌株tz-6的单菌落接种至含50 mL发酵培养基的250 mL锥形瓶中,30 ℃、180 r/min条件下振荡培养7 d后,加入同等体积的无水乙醇静置48 h,混合液经8 000 r/min离心10 min后,上清液60 ℃旋转蒸发除去乙醇,用0.22 μm的无菌滤膜过滤,滤液即为放线菌tz-6的发酵粗提物。
1.3.3 菌株tz-6发酵粗提物最小抑菌浓度的测定
将甘油管保存的金黄色葡萄球菌接种到50 mL LB液体培养基,37 ℃振荡培养24 h后,吸取1 mL接种到50 mL LB液体培养基中,37 ℃振荡培养6 h,得到金黄色葡萄球菌悬液。
在无菌96孔板中依次加入100 μL LB液体培养基,第一个孔再加入100 μL发酵粗提物,混匀后吸取100 μL混合液加入下一孔,依次类推稀释至第11列,第11列混匀后弃去100 μL,保持第1~11列各孔液体体积都为100 μL,再向12列加入100 μL LB液体培养基,作为对照组,每孔分别加入100 μL金黄色葡萄球菌悬液,37 ℃静置培养24 h。 采用滤纸片法[21]测定发酵粗提物对金黄色葡萄球菌的抑菌效果,以肉眼可见的能够抑制金黄色葡萄球菌的最低浓度为的最小抗菌浓度(minimum inhibitory concentrations,MIC)。
1.3.4 菌株tz-6发酵粗提物对金黄色葡萄球菌生长的影响
于含有100 mL LB液体培养基的250 mL锥形瓶中,接种1 mL金黄色葡萄球菌菌悬液,并分别加入菌株tz-6发酵粗提物,使发酵粗提物浓度分别达到1/4 MIC、1/2 MIC、1 MIC和2 MIC,以加入等量无菌水为对照组。37 ℃、180 r/min条件下振荡培养24 h,每隔2 h取样,在波长600 nm处检测发酵液的吸光度值。 以培养时间为横坐标,以OD600 nm值为纵坐标,绘制生长曲线。
1.3.5 菌株tz-6发酵粗提物对金黄色葡萄球菌生物膜形成的影响
采用结晶紫染色法[22]测定金黄色葡萄球菌生物膜的形成。 在无菌96孔板中加入10 μL金黄色葡萄球菌悬液,分别加入菌株tz-6发酵粗提物,使菌株tz-6发酵粗提物浓度分别达到0(CK)、1/4 MIC、1/2 MIC、1 MIC和2 MIC,每孔用LB液体培养基补至200 μL,37 ℃静置培养24 h后,移去上清液,每孔加入100 μL甲醇固定15 min后,弃去甲醇,风干,每孔加入100 μL结晶紫染色液染色5 min后,弃去染色液,风干,每孔加入200 μL 33%冰醋酸,37 ℃静置30 min使结晶紫充分溶解,使用酶标仪于波长590 nm处测定吸光度值。
1.3.6 菌株tz-6发酵粗提物对金黄色葡萄球菌细胞膜通透性的影响
将甘油管保存的金黄色葡萄球菌接种到50 mL LB液体培养基,37 ℃振荡培养24 h后,吸取1 mL接种于50 mL LB液体培养基中,37 ℃振荡培养6 h后,依次加入菌株tz-6发酵粗提物,使其浓度分别达到1/4 MIC、1/2 MIC、1 MIC和2 MIC,以加入等量无菌水为对照组,37 ℃、180 r/min条件下振荡培养6 h。 采用pH计测定发酵液的pH值。 发酵液经8 000 r/min离心10 min后得到上清液,参考文献[23]的方法测定丙酮酸含量;参考文献[24]的方法测定β-半乳糖苷酶活性,β-半乳糖苷酶活性定义:每分钟催化生成1 μmol产物邻硝基苯酚所需的酶量为一个酶活力单位(U);参考文献[25]测定核酸和蛋白含量。
1.3.7 数据处理与统计分析
每组试验设置3个生物学重复,使用DPS 7.05软件分析与处理数据,应用Origin 2018软件作图。
2.1.1 形态学观察
菌株tz-6的形态特征见图1。由图1A可知,在高氏一号培养基上菌株tz-6的菌落呈现白色,表面干燥、中间隆起,边缘不规则,且产生红褐色的色素。 由图1B可知,菌株tz-6的细胞为较长的杆状,经革兰氏染色后变为紫色,判定其为革兰氏阳性菌。

图1 菌株tz-6的菌落(A)及细胞(B)形态
Fig.1 Colony (A) and cell (B) morphology of the strain tz-6
2.1.2 生理生化试验
菌株tz-6的生理生化特征见表1。由表1可知,菌株tz-6均能利用葡萄糖、蔗糖、甘露糖等碳源生长,能利用纤维素,但不能水解淀粉,不可以使牛奶凝固和胨化,不产生硫化氢,不能降解吐温80。参考《链霉菌鉴定手册》[20],初步判定其为放线菌。
表1 菌株tz-6的生理生化特征
Table 1 Physiological and biochemical characteristics of the strain tz-6

注:“+”表示结果呈阳性,“-”表示结果呈阴性。
项目 结果 项目 结果 项目 结果葡萄糖蔗糖甘露糖阿拉伯糖麦芽糖+++++鼠李糖纤维二糖木糖半乳糖++++产硫化氢淀粉水解牛奶凝固/胨化纤维素吐温80+--/-+-
2.1.3 分子生物学鉴定
基于16S rDNA基因序列构建菌株tz-6的系统发育树,结果见图2。由图2可知,菌株tz-6与链霉菌属(Streptomyces sp.)在分子生物学上具有96%的同源性,结合菌落形态和生理生化实验结果,确定菌株tz-6为链霉菌属(Streptomyces sp.)。
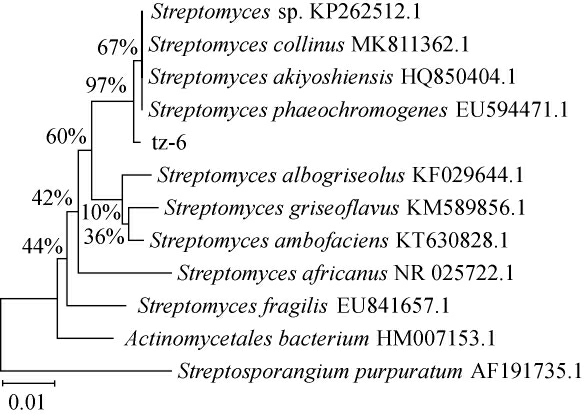
图2 基于16S rDNA基因序列菌株tz-6的系统发育树
Fig.2 Phylogenetic tree of the strain tz-6 based on 16S rDNA gene sequence
2.2.1 链霉菌tz-6发酵粗提物对金黄色葡萄球菌生长的影响
链霉菌tz-6发酵粗提物对金黄色葡萄球菌生长的影响见图3。由图3可知,随着链霉菌tz-6发酵粗提物浓度的增加,金黄色葡萄球菌的生长逐渐受到抑制。当链霉菌tz-6发酵粗提物的浓度为MIC时,对数生长期在很大程度上被延迟,尤其是当浓度为2 MIC时,金黄色葡萄球菌几乎不生长。结果表明,低浓度的菌株tz-6发酵粗提物能延缓金黄色葡萄球菌的生长速度,而高浓度的发酵粗提物能够完全抑制金黄色葡萄球菌的生长。
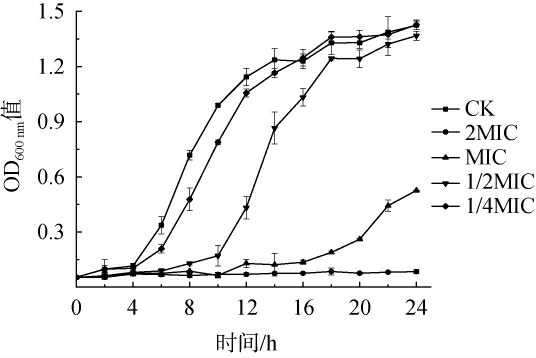
图3 链霉菌tz-6发酵粗提物对金黄色葡萄球菌生长的影响
Fig.3 Effect of fermentation crude extract of Streptomyces tz-6 on the growth of Staphylococcus aureus
2.2.2 链霉菌tz-6发酵粗提物对金黄色葡萄球菌生物膜形成的影响
生物膜形成是微生物生存的一种重要的自我保护方式,它能提高微生物在环境中的生存能力[26]。链霉菌tz-6发酵粗提物对金黄色葡萄球菌生物膜形成的影响见图4。由图4可知,当未添加链霉菌tz-6发酵粗提物时,发酵液的OD590 nm值为1.35,此时金黄色葡萄球菌有很强的生物膜形成能力。但随着链霉菌tz-6发酵粗提物浓度的增加,OD590nm值显著下降(P<0.05),生物膜形成逐渐减少。结果表明,链霉菌tz-6发酵粗提物能有效抑制金黄色葡萄球菌生物膜的形成。
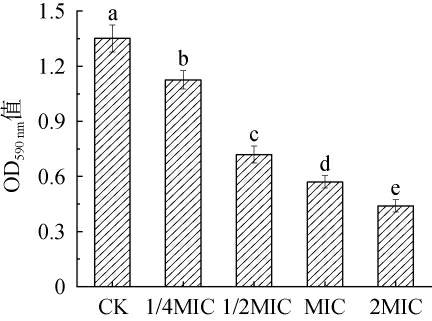
图4 链霉菌tz-6发酵粗提物对金黄色葡萄球菌生物膜形成的影响
Fig.4 Effect of fermentation crude extract of Streptomyces tz-6 on cell membrane formation of Staphylococcus aureus
不同小写字母表示差异显著(P<0.05)。 下同。
2.2.3 链霉菌tz-6发酵粗提物对金黄色葡萄球菌细胞膜通透性的影响
为进一步探究细胞外泄物质的酸碱度,测定添加不同浓度链霉菌tz-6发酵粗提物处理金黄色葡萄球菌发酵液的pH值,结果见图5。 由图5可知,与对照组相比,添加不同浓度链霉菌tz-6发酵粗提物处理金黄色葡萄球菌发酵液的pH值均显著降低(P<0.05),且随着链霉菌tz-6发酵粗提物浓度的增加,pH值不断下降,表明链霉菌tz-6发酵粗提物作用后的金黄色葡萄球菌会释放酸性物质。
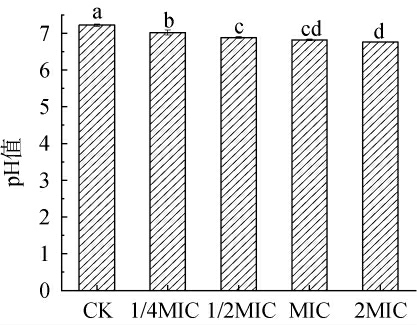
图5 链霉菌tz-6发酵粗提物对金黄色葡萄球菌发酵液pH的影响
Fig.5 Effect of fermentation crude extract of Streptomyces tz-6 on pH of Staphylococcus aureus fermentation broth
β-半乳糖苷酶位于细胞内膜中,当内膜受损时,β-半乳糖苷酶会穿过细胞膜渗漏到外部,据此可通过β-半乳糖苷酶含量变化来评估金黄色葡萄球菌内膜受损程度[27]。链霉菌tz-6发酵粗提物对金黄色葡萄球菌发酵液β-半乳糖苷酶活力的影响见图6。 由图6可知,与对照组相比,添加不同浓度链霉菌tz-6发酵粗提物处理金黄色葡萄球菌发酵液的β-半乳糖苷酶活力均升高,且随着链霉菌tz-6发酵粗提物浓度的升高,β-半乳糖苷酶活力逐渐升高。当链霉菌tz-6的浓度>1/2MIC之后,β-半乳糖苷酶活力显著升高(P<0.05)。结果表明,链霉菌tz-6发酵粗提物成功破坏了金黄色葡萄球菌的内膜结构,导致β-半乳糖苷酶泄漏至细胞外,且这种损坏程度与链霉菌tz-6发酵粗提物浓度呈正相关。
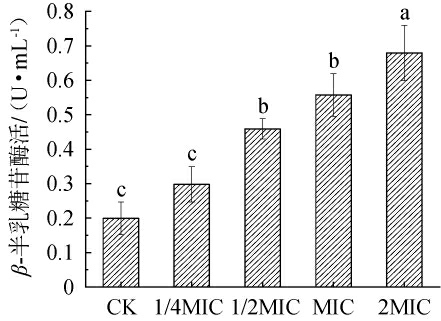
图6 链霉菌tz-6发酵粗提物对金黄色葡萄球菌发酵液β-半乳糖苷酶活力的影响
Fig.6 Effects of fermentation crude extract of Streptomyces tz-6 on β-galactosidase activity of Staphylococcus aureus fermentation broth
为进一步探究链霉菌tz-6发酵粗提物对金黄色葡萄球菌细胞膜通透性的影响,对间接反应细胞膜通透性的核酸渗漏和蛋白质泄漏大分子进行检测[28]。 链霉菌tz-6发酵粗提物对金黄色葡萄球菌细胞膜通透性的影响见图7。由图7可知,与对照组相比,添加不同浓度链霉菌tz-6发酵粗提物处理金黄色葡萄球菌发酵液中核酸及蛋白质含量均显著升高(P<0.05),且随着链霉菌tz-6发酵粗提物浓度的升高,核酸及蛋白质含量呈上升趋势,表明链霉菌tz-6发酵粗提物可能增加金黄色葡萄球菌细胞膜的通透性,导致细胞内的大分子物质被释放到细胞外中。
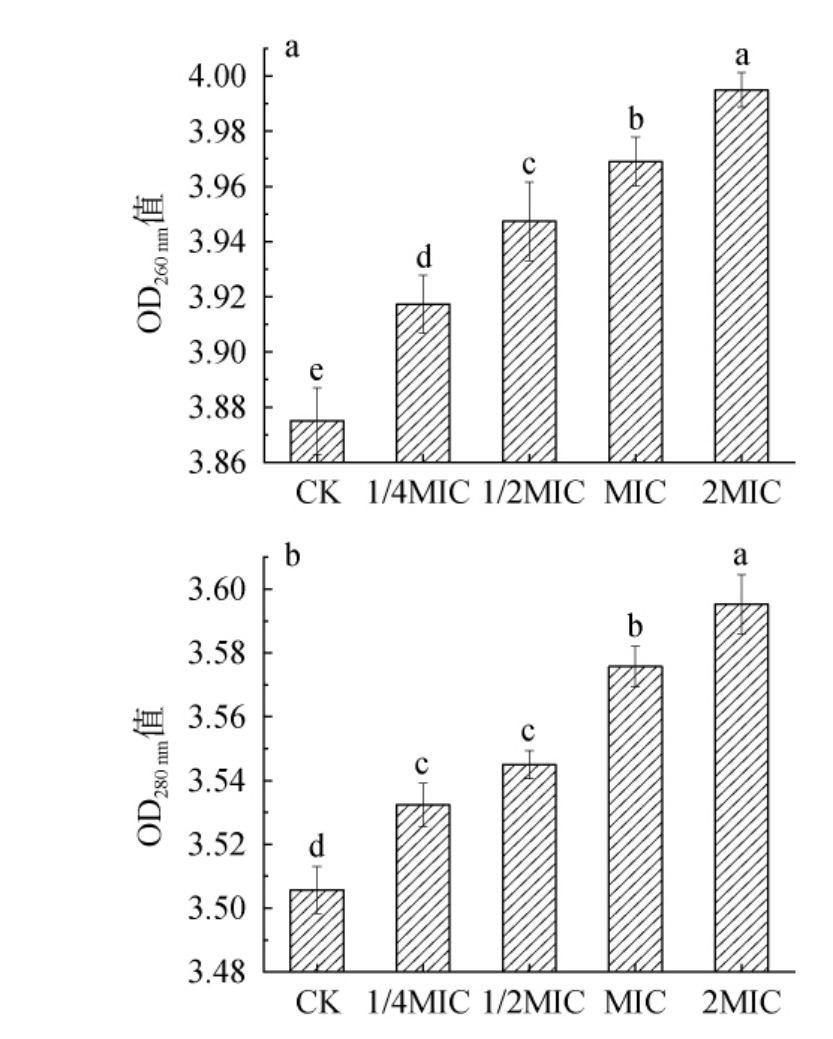
图7 链霉菌tz-6发酵粗提物对金黄色葡萄球菌核酸(a)及蛋白质(b)泄漏的影响
Fig.7 Effects of fermentation crude extract of Streptomyces tz-6 on nucleic acid (a) and protein (b) leakage of Staphylococcus aureus
丙酮酸作为生物体代谢的中间产物,在菌体内过量的积累会导致能量代谢受阻,从而引起菌体机体能量和物质代谢障碍[29]。 链霉菌tz-6发酵粗提物对金黄色葡萄球菌发酵液中丙酮酸含量的影响见图8。
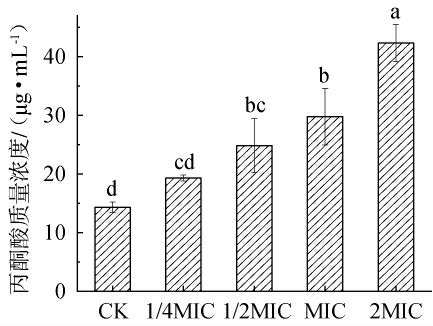
图8 链霉菌tz-6发酵粗提物对金黄色葡萄球菌发酵液中丙酮酸含量的影响
Fig.8 Effects of fermentation crude extract of Streptomyces tz-6 on pyruvate contents in Staphylococcus aureus fermentation broth
由图8可知,与对照组相比,添加不同浓度链霉菌tz-6发酵粗提物处理金黄色葡萄球菌发酵液中的丙酮酸含量均升高,且随着链霉菌tz-6发酵粗提物浓度的增加,丙酮酸含量也在逐渐上升。 当链霉菌tz-6发酵粗提物浓度>1/2MIC之后,丙酮酸含量升高显著(P<0.05),说明链霉菌tz-6发酵粗提物能够阻碍金黄色葡萄球菌的机体能量和物质代谢。
本研究以对金黄色葡萄球菌有抑制作用的菌株tz-6为研究对象,通过形态学观察、生理生化试验及分子生物学技术鉴定其为链霉菌属(Streptomyces sp.)。 菌株tz-6的发酵粗提物能影响金黄色葡萄球菌的正常生长,导致金黄色葡萄球菌的存活率降低,具有防治金黄色葡萄球菌潜在能力。进一步研究发现,菌株tz-6的发酵粗提物会破坏金黄色葡萄球菌的细胞膜和内膜结构,增加细胞膜的通透性,导致胞内酸性物质、β-半乳糖苷酶、核酸和蛋白质含量释放,阻碍了金黄色葡萄球菌的机体能量和物质代谢过程。本研究结果为防治金黄色葡萄球菌提供了优质的菌株资源。
[1]YU Y,MA X Y,ZHANG W.Detection of Staphylococcus aureus in milk using real-time fluorescence loop-mediated isothermal amplification[J].Adv J Food Sci Technol,2015,8(9):678-684.
[2]FARHA A K,YANG Q Q,KIM G,et al.Inhibition of multidrug-resistant foodborne Staphylococcus aureus biofilms by a natural terpenoid(+)-nootkatone and related molecular mechanism[J].Food Control, 2020,112:107154.
[3]HEATON C J, GERBIG G R, SENSIUS L D, et al. Staphylococcus aureus epidemiology in wildlife:A systematic review[J].Antibiotics,2020,9(2):89.
[4]URISH K L, CASSAT J E. Staphylococcus aureus osteomyelitis: bone,bugs,and surgery[J].Infect Immun,2020,88(7):e00932-19.
[5]RAINERI E J M,ALTULEA D,VAN DIJL J M.Staphylococcal trafficking and infection-from'nose to gut'and back[J].FEMS Microbiol Rev,2022,46(1):fuab041.
[6]POUDEL B, ZHANG Q S, TRONGTORSAK A, et al.An overlooked cause of septic shock:Staphylococcal toxic shock syndrome secondary to an axillary abscess[J].IDCases,2021,23:e01039.
[7]BENCARDINO D, AMAGLIANI G, BRANDI G.Carriage of Staphylococcus aureus among food handlers: An ongoing challenge in public health[J].Food Control,2021,130:108362.
[8]LE C Y,YE Y J,XU J,et al.Hinokitiol selectively enhances the antibacterial activity of tetracyclines against Staphylococcus aureus[J].Microbiol Spectr,2023,11(2):1-12.
[9]FERRI M, RANUCCI E, ROMAGNOLI P, et al.Antimicrobial resistance:A global emerging threat to public health systems[J].Crit Rev Food Sci Nutr,2017,57(13):2857-2876.
[10]张明明.天然化合物桧木醇对黄曲霉和金黄色葡萄球菌的抑制作用研究[D].郑州:河南工业大学,2023.
[11]LEWIS K.The science of antibiotic discovery[J].Cell,2020,181(1):29-45.
[12]李芳芳,陆盛胜,吉腾飞,等.动物来源放线菌的次级代谢产物及其生物活性研究进展[J].药学学报,2017,52(7):1091-1101.
[13]张昊,袭恒豫,毕斓婷,等.拮抗金黄色葡萄球菌的细菌分离及其作用机制[J].中国兽医学报,2020,40(4):730-734.
[15]刘萍,王祖华,张七,等.金黄色葡萄球菌拮抗菌株的筛选鉴定及其抗菌物质分析[J].微生物学通报,2020,47(5):1544-1551.
[16]TANG Y Y,ZOU F L,CHEN C C, et al.Antibacterial and antibiofilm activities of sertindole and its antibacterial mechanism against Staphylococcus aureus[J].ACS Omega,2023,8(6):5415-5425.
[17]刘俊俊,田佳仪,李坤,等.7种中药提取物体外抑制金黄色葡萄球菌的效果及机制研究[J].畜牧与兽医,2024,56(6):130-138.
[18]WANG Z C, ZHU J F, LI W T, et al.Antibacterial mechanism of the polysaccharide produced by Chaetomium globosum CGMCC 6882 against Staphylococcus aureus[J].Int J Biol Macromol,2020,159:231-235.
[19]章帅文,吴庆华,黄国昌,等.拮抗柑桔致病菌的放线菌筛选及其活性物质分析[J].中国南方果树,2024,53(4):25-30,36.
[20]中国科学院微生物研究所放线菌分类组.链菌鉴定手册[M].北京:科学出版社,1975:83-92.
[21]李永建,韦明杰,张凰.29株淡水真菌固体发酵提取物的抑菌活性研究[J].昆明理工大学学报(自然科学版),2021,46(4):137-146.
[22]FLEMMING H C,WINGENDER J.The biofilm matrix[J].Nat Rev Microbiol,2010,8(9):623-633.
[23]王佶.大肠杆菌积累丙酮酸的研究[D].杭州:浙江大学,2008.
[24]宫路路.高产β-半乳糖苷酶乳酸菌的筛选、基因克隆与表达[D].昆明:昆明理工大学,2013.
[25]邓丽.金黄色葡萄球菌拮抗细菌的分离鉴定及机制研究[D].贵阳:贵州大学,2021.
[26]XU Z H, MANDIC-MULEC I, ZHANG H H, et al.Antibiotic bacillomycin D affects iron acquisition and biofilm formation in Bacillus velezensis through a Btr-mediated FeuABC-dependent pathway[J].Cell Rep,2019,29(5):1192-1202.
[27]ALIKUNJU A P,JOY S,SALAM J A,et al.Functional characterization of a new cold-adapted β-galactosidase from an arctic fjord sediment bacteria Enterobacter ludwigii MCC 3423[J].Catal Lett,2018,148(10):3223-3235.
[28]SHEN S X,ZHANG T H,YUAN Y,et al.Effects of cinnamaldehyde on Escherichia coli and Staphylococcus aureus membrane[J].Food Control,2015,47:196-202.
[29]罗艺晨,黄利明,杨颖,等.绿原酸抑制金黄色葡萄球菌机理研究[J].西南大学学报(自然科学版),2016,38(3):15-19.