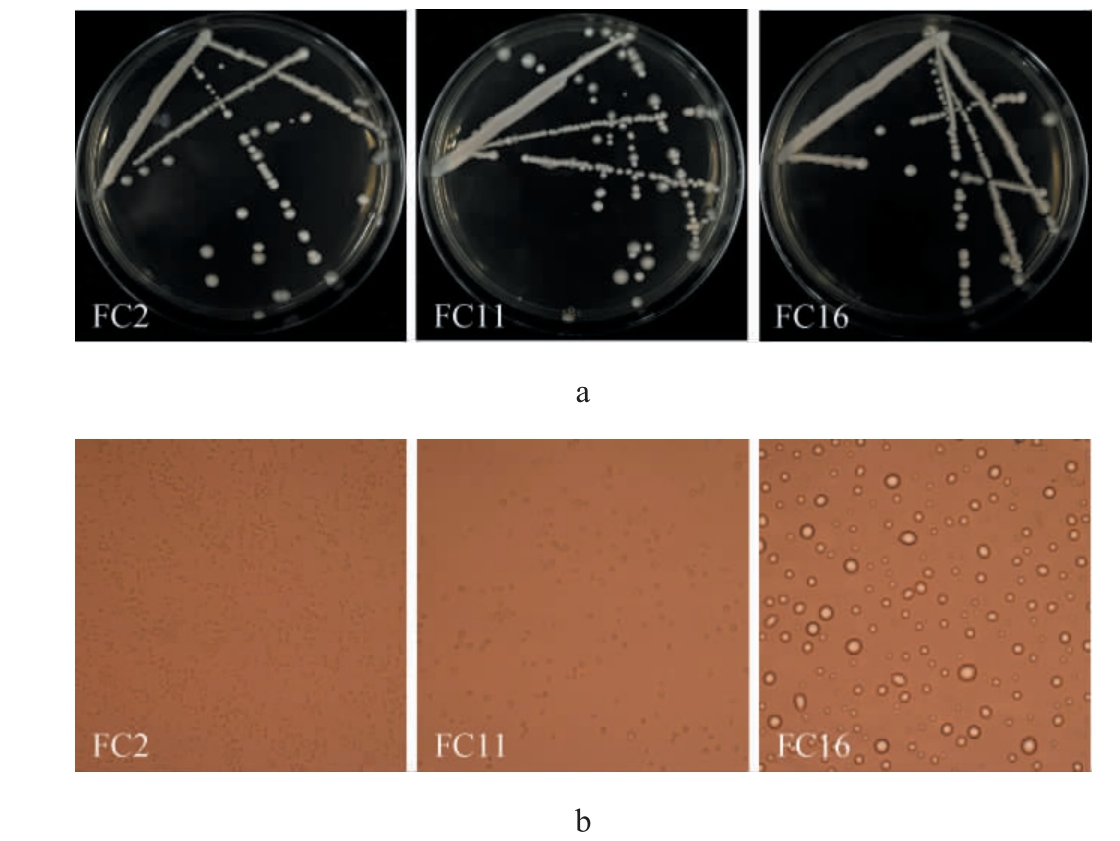
图1 部分酵母菌的菌落形态(a)和细胞形态(b)
Fig.1 Colony morphology (a) and cell morphology (b) of some yeast strains
Screening,identification and tolerance of specific yeast strains for sour cherry fruit wine
樱桃为多年生木本经济树木,属蔷薇科(Rosaceae)、李属(Prunus)、樱亚属(Subgenus cerasus)。世界各地栽培的樱桃品种繁多,其中包括中国樱桃(Prunus pseudocerasus Lind1.)、甜樱桃(Prunus avium L.)、酸樱桃(Prunus cerasus Ledeb.)、毛樱桃(Prunus tomentosa Thunb.)等[1]。 酸樱桃原产于欧洲东南部黑海沿岸及亚洲西部,果实果皮薄,色泽艳丽,汁水丰富,丰产且抗逆性强,其挥发性风味物质中含有大量的羰基化合物、酯类、酸类和萜烯类物质,具有独特的酸香味[2-3]。 同时,酸樱桃果实富含多酚类化合物,如黄酮类化合物(黄酮醇、花青素),其具有很强的抗氧化活性,对人体健康有益,起保护心血管[4]、抗肿瘤[4]和糖尿病[5]、抗炎[6]、预防痛风[7]和关节炎[7]等作用。
由于酸樱桃鲜食味道欠佳,主要被加工为果酱、果汁、果脯、罐头和酒精饮料[8]。樱桃果酒作为一种工业化产品,不仅延长了果实的保鲜期,还保留了樱桃本身丰富的营养物质,同时也迎合了当下粮食酒走向果酒的饮酒潮流[9]。在酿造过程中,酿酒酵母(Saccharomyces cerevisiae)等微生物通过多种代谢途径影响着果酒风味、营养和功能特性,被誉为发酵食品的“灵魂”[10-12]。因此,筛选优良的酵母菌株是提升酸樱桃酒品质的关键。汪前等[13]针对浆果类果酒的菌种筛选进行了总结归纳,提出了筛选专用果酒酵母可以提升果酒品质,使之果实特色更加突出。白玉峰等[14]从赤霞珠葡萄自然发酵汁中分离出299株酵母,最后筛选出13株具有降解L-苹果酸的能力的酵母菌株,为葡萄酒降酸提供了酵母资源。舒学香等[15]以猕猴桃的果皮和果园土壤为材料,筛选出一株酿酒酵母,该酵母菌发酵能力强,所产猕猴桃酒风味好。目前,酸樱桃酒酿造大多采用葡萄酒果酒专用酵母,导致酸樱桃酒风味不足,典型性欠佳,关于酸樱桃酒专用酵母的筛选鲜见报道。
本研究采用传统培养分离法结合形态学观察从酸樱桃自然发酵液中分离酵母菌株,通过发酵能力和产酒精能力测定筛选优良的酵母菌,通过分子生物学技术对其进行菌种鉴定,并对优良酵母菌株的乙醇、pH、葡萄糖耐受性进行分析,以期获得优良酸樱桃专用优良酵母菌株,为优质酸樱桃酒生产提供酵母资源。
1.1.1 材料
欧洲酸樱桃(‘奥杰’和‘玫丽’):2023年8月采集自陕西省铜川市西北农林科技大学铜川果树试验站。
1.1.2 试剂
葡萄糖、氢氧化钠、无水乙醇、盐酸、甘油、琼脂(均为分析纯):北京百奥基生物科技有限公司;2,3,5-氯化三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC):西安热默尔生物科技有限公司;Biospin脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:杭州博日科技有限公司;引物、2×Taq酶(5 U/mL):昆明擎科生物科技有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast peptone dextrose,YPD)固(液)体培养基:青岛高科技工业园海博生物技术有限公司;2,3,5-氯化三苯基氯化四氮唑上层培养基、TTC下层培养基:参照杨惠婷[16]的方法配制。
906-ULTS型超低温冰箱:赛默飞世尔科技(中国)有限公司;202-2AB型电热恒温干燥箱:天津市泰斯特仪器有限公司;DL-CJ-2ND I型洁净工作台:北京东联哈尔仪器制造有限公司;XGQ-2000恒温培养箱:余姚市星辰仪表厂;P4型紫外可见分光光度计:上海美谱达仪器有限公司;HW.SY11-KP3智能恒温水浴锅:北京市长风仪器仪表公司;YP10002电子天平:上海佑科仪器仪表有限公司;DYY-10C型电泳仪:北京六一生物科技有限公司;YJYC-100B台式恒温培养振荡器:上海新诺仪器集团有限公司;T100型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIO-RAD公司;PHS-3C数显台式pH计:上海仪电科学仪器股份有限公司;BX63全自动正置荧光显微镜:日本奥林巴斯公司。
1.3.1 酵母菌的分离纯化
称取1 000 g成熟、新鲜、无腐烂的酸樱桃果,充分破碎,破碎后置于已提前灭菌的2 L锥形瓶中,在相同条件下制备3份,于25 ℃条件下自然发酵5~7 d。等待发酵结束时,取发酵液按10倍系列梯度稀释至10-7,选择10-5、10-6、10-7稀释液分别吸取100 μL涂布于YPD固体培养基上,于28 ℃条件下恒温培养5~7 d[17]。参照《酵母菌的特征与鉴定手册》[18]观察菌落形态以及颜色,挑取表面光滑、湿润、中间隆起、易挑起的具有典型酵母菌特征的单菌落接种于YPD液体培养基,活化后划线于YPD固体培养基,重复这个操作直到培养皿中都是同一形态的单菌落,在电子显微镜下观察酵母菌的细胞形态。
1.3.2 发酵性能的测定
采用杜氏小管发酵法测定酵母菌的发酵性能[19],取分离得到的酵母菌划线接种于YPD固体培养基上,28 ℃条件下活化3 d;挑取单菌落接种于YPD液体培养基中,在28 ℃、180 r/min条件下进行扩大培养得到种子液;以2%(V/V)的接种量将种子液接种于含有倒置且已灭菌的杜氏小管的YPD液体培养基中,在28 ℃条件下培养48 h,观察杜氏小管内气体的变化。
1.3.3 产酒精能力的测定
采用TTC筛选法测定酵母菌株的产酒精能力[20],将初步筛选的酵母菌菌株接种于TTC下层培养基,28 ℃条件下培养48 h后,覆盖TTC上层培养基,避光培养2~3 h,按照酵母菌的显色情况判断其产酒精能力,产酒精能力强的酵母菌呈深红色,次之为粉红色。
1.3.4 分子生物学鉴定
采用BiospinDNA 提取试剂盒提取酵母菌基因组DNA,以其为模板,采用酵母通用引物NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')与NL4(5'-GGTCCGTGTTTCAAGACGG-3')对菌株的26S rDNA D1/D2区基因序列进行PCR扩增。 PCR扩增体系:2×Rapid Taq Master Mix 12.5 μL、基因组DNA 1.0 μL、引物NL1(10 μmol/L)1.0 μL、引物NL4(10 μmol/L)1.0 μL,补充双蒸水(ddH2O)至25.0 μL。 PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s,共30个循环;72 ℃再延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后,委托生工生物工程(上海)股份有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)中的GenBank数据库采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,选取同源性较高的模式菌株的26S rDNA D1/D2区基因序列,使用MEGA7.0软件中的邻接(neighborjoining,NJ)法构建系统发育树,对酵母菌进行菌种鉴定。
1.3.5 生长曲线的绘制
将筛选得到的优良酵母菌菌株的种子液按照2%(V/V)的接种量接种于100 mL YPD液体培养基中,于28 ℃、180 r/min条件下摇床培养38 h,每隔2 h无菌定量取样,测定培养液在波长600 nm处的吸光度值(OD600 nm值),设置未接菌种的无菌培养基作为对照,试验平行重复3次。以培养时间为横坐标,OD600nm值为纵坐标,绘制生长曲线[21]。
1.3.6 酵母的耐受性分析
参照熊荣园等[22-24]的方法稍作改动,将筛选菌株的种子液以2%(V/V)的接种量分别接种于不同葡萄糖质量浓度(150 g/L、200 g/L、250 g/L、300 g/L、350 g/L、400 g/L)、不同pH值(pH 2.6、pH 2.8、pH 3.0、pH 3.2、pH 3.4)、不同乙醇体积分数(10%、12%、14%、16%、18%、20%)的YPD液体培养基中,于28 ℃条件下培养48 h后,在波长600 nm处测定OD600nm值,考察不同菌株对葡萄糖、pH、乙醇的耐受性。
1.3.7 数据处理
使用Microsoft Excel 2016、MEGA7.0软件对数据进行处理,每组试验作3次重复,结果采用“平均值±标准差”表示。采用Origin 2024软件绘图。
对酸樱桃果实自然发酵液中的菌种进行分离纯化,结果共分离得到76株菌株。 根据菌株的菌落形态及显微镜镜检结果,排除不符合酵母形态特征的菌株,并将形态相似的菌株归为一类,最后筛选出具有典型酵母菌形态特征的34株菌株,编号为FC1~FC34,部分代表菌株的菌落及细胞形态见图1。 由图1可知,分离酵母菌菌落形态多为白色或奶油色,表面凸起,湿润光滑,细胞形态多为圆形或椭圆形,大小不一,其繁殖方式为出芽繁殖和裂殖。

图1 部分酵母菌的菌落形态(a)和细胞形态(b)
Fig.1 Colony morphology (a) and cell morphology (b) of some yeast strains
在酒精发酵过程中,酵母菌扮演着重要的角色,它们既进行着发酵作用,又同时进行呼吸作用,这两种作用都能将糖类分解,产生CO2[25]。 因此,通过观察酵母菌产气情况,可以判断出酵母菌发酵性能的好坏。 优良酵母在发酵过程中起酵快、产气泡速度快且气泡多。 各分离酵母菌菌株的产气情况见表1。
表1 34株酵母菌菌株的产气性能
Table 1 Gas production performance of 34 yeast strains
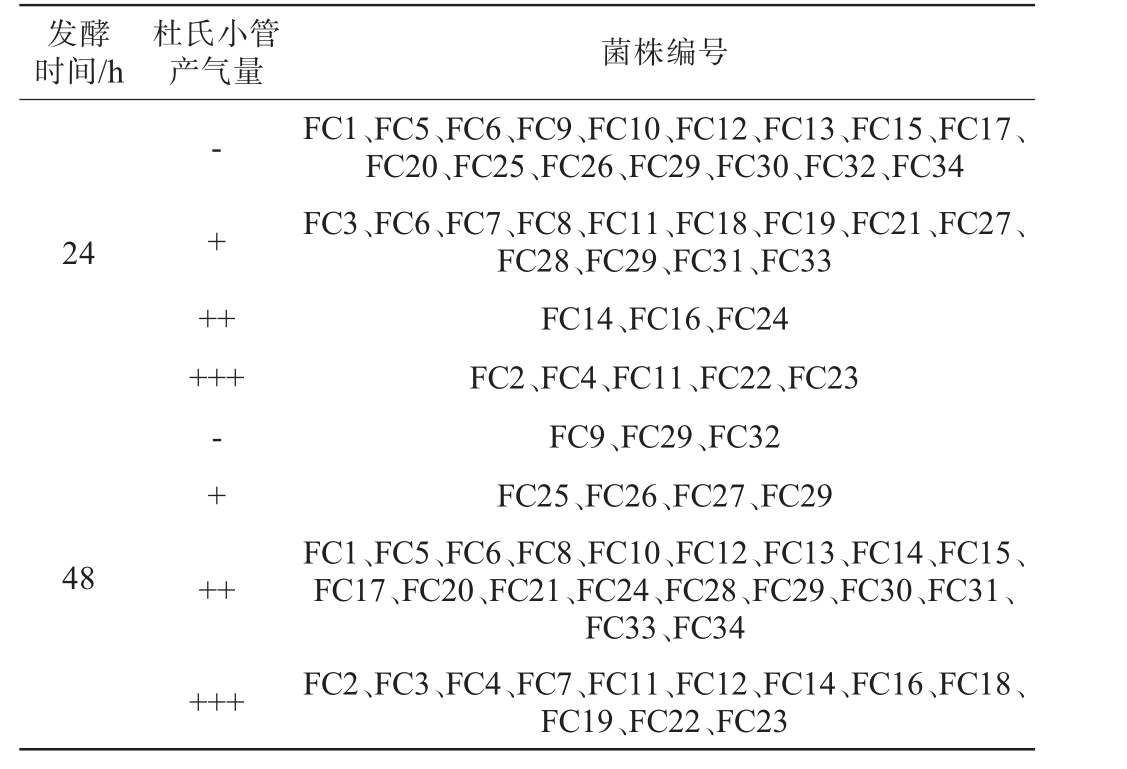
注:“-、+、++、+++”分别表示杜氏小管内无气体产生、产生1/3气体、产生2/3气体、充满气体。
发酵时间/h杜氏小管产气量 菌株编号24-+ +++++48-+ +++++FC1、FC5、FC6、FC9、FC10、FC12、FC13、FC15、FC17、FC20、FC25、FC26、FC29、FC30、FC32、FC34 FC3、FC6、FC7、FC8、FC11、FC18、FC19、FC21、FC27、FC28、FC29、FC31、FC33 FC14、FC16、FC24 FC2、FC4、FC11、FC22、FC23 FC9、FC29、FC32 FC25、FC26、FC27、FC29 FC1、FC5、FC6、FC8、FC10、FC12、FC13、FC14、FC15、FC17、FC20、FC21、FC24、FC28、FC29、FC30、FC31、FC33、FC34 FC2、FC3、FC4、FC7、FC11、FC12、FC14、FC16、FC18、FC19、FC22、FC23
由表1可知,有3株酵母菌菌株(FC9、FC29、FC32)在发酵48 h内均不产气。菌株FC1、FC5、FC6、FC9等16株菌株在发酵24 h内不产气,其中,菌株FC25、FC26、FC27、FC29在发酵48 h内仅产生1/3气体,产气能力较差。菌株FC3、FC7、FC12、FC14、FC16、FC18、FC19在发酵24 h内可产生1/3或2/3气体,在发酵48 h内产生气体充满杜氏小管,有5株酵母菌菌株(FC2、FC4、FC11、FC22、FC23)在发酵24 h内使杜氏小管内充满气体,产气快。 因此,筛选出可以在48 h内充满杜氏小管的12株酵母菌菌株进行产酒精能力分析。
将筛选得到的12株酵母菌菌株分别接种于TTC培养基中进行培养,各菌株在TTC培养基上的显色结果见图2。由图2可知,12株酵母菌菌株均能产生酒精,但各菌株表现出的颜色深浅不一,说明产酒精的能力各不相同,挑选6株颜色呈深红色的菌株进行保藏用于后续耐受性试验,分别为菌株FC2、FC3、FC11、FC14、FC16、FC18。
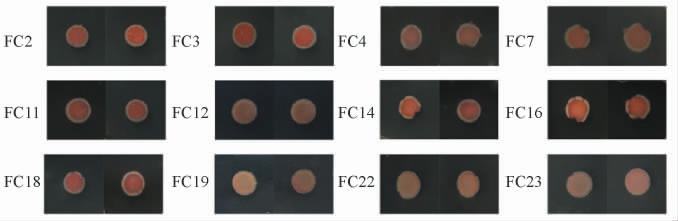
图2 12株酵母菌菌株产酒精能力测定结果
Fig.2 Determination results of ethanol production capacity of 12 yeast strains
基于26S rDNA的D1/D2区基因序列构建6株酵母菌菌株的系统发育树,结果见图3。由图3可知,菌株FC3、FC14、FC16、FC18与葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)聚于同一分支,亲缘关系最近。 菌株FC2和FC11与酿酒酵母(Saccharomycescerevisiae)聚于同一分支,亲缘关系最近。结合各菌株的形态学特征,最终将菌株FC3、FC14、FC16、FC18鉴定为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum),菌株FC2和FC11鉴定为酿酒酵母(Saccharomycescerevisiae)。

图3 基于26S rDNA D1/D2区基因序列6株酵母菌菌株的系统发育树
Fig.3 Phylogenetic tree of 6 yeast strains based on 26S rDNA D1/D2 region gene sequences
6株优良酵母菌菌株的生长曲线见图4。由图4可知,菌株FC2和菌株FC3生长趋势基本一致,在培养0~2 h时开始生长,为迟滞期,在培养2~8 h内菌体快速生长,为对数生长期,在培养8~38 h内生长缓慢,逐步进入稳定期,培养38 h时,OD600nm值分别达到最大值2.227、2.206;菌株FC11和FC16生长趋势相似,菌株FC11在培养0~2 h时为迟滞期,菌株FC16发酵起步略晚,在培养0~4 h时为迟滞期,随后均进入快速生长期,在培养10~22 h内生长速率稳定,但在22 h后出现衰退期。 菌株FC14和FC18相比以上菌株,生长速率较慢,尤其是菌株FC18,其生长迟滞期为0~10 h,10~24 h为生长对数期,24 h后进入衰减期。综上,菌株FC2、FC3生长速率、活力最高且最快进入稳定期,生长周期短。菌株FC14和菌株FC18生长速率缓慢,相比其余4株酵母,起酵速度较慢。
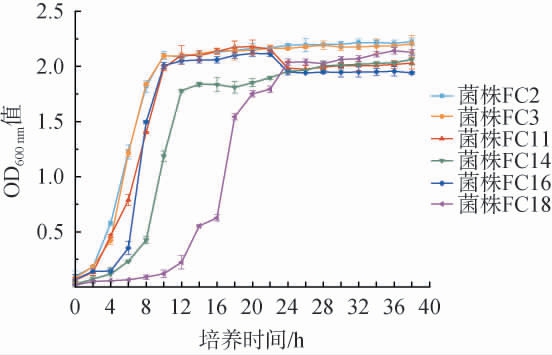
图4 6株酵母菌菌株的生长曲线
Fig.4 Growth curves of 6 yeast strains
2.6.1 葡萄糖耐受性
在果酒酿造过程中通常需要添加一定量的葡萄糖,葡萄糖的质量浓度影响着酵母菌的生长状态,葡萄糖质量浓度较低时能促进酵母菌菌株的生长,但其质量浓度过高会造成的高渗透压环境,对酵母菌株的生长产生抑制作用,引起酵母菌细胞破裂、水分流失[26]。 因此,考察6株酵母菌菌株的葡萄糖耐受性,结果见图5。
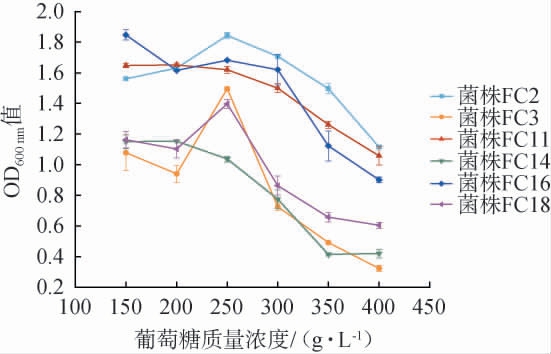
图5 6株筛选酵母菌菌株的葡萄糖耐受性
Fig.5 Glucose tolerance of 6 screened yeast strains
由图5可知,当葡萄糖质量浓度在150~400 g/L的范围内的升高,酵母菌菌株的OD600nm值大多出现先升高后下降的趋势。在葡萄糖质量浓度为150 g/L的环境下,菌株FC16的OD600nm值最高,达到1.56,其次是菌株FC11、FC2,两者的OD600 nm值差别较小,OD600 nm值最小的是菌株FC3,为1.11。当葡萄糖质量浓度达到250 g/L时,菌株FC2、FC3、FC18的OD600 nm值呈现最大值,其中,菌株FC2的OD600 nm值达到最高,为1.84。当葡萄糖质量浓度>250 g/L,所有菌株的生长均受到不同程度的抑制,OD600 nm值均呈下降趋势。 从整体上看,菌株FC2、FC11、FC16对葡萄糖耐受程度较高,当葡萄糖质量浓度为400 g/L时,OD600 nm值仍在1.0上下浮动,而菌株FC3、FC14、FC18对葡萄糖耐受能力较差,适应性不强,OD600 nm值在0.4上下浮动,其中菌株FC3的OD600 nm值仅为0.32。 王琪等[19]比较了菌株WQ-3、WQ-8和商业酵母酵母ADT的葡萄糖耐受性,结果发现,3株酵母菌可耐受葡萄糖质量浓度400 g/L,本研究中酵母菌菌株FC2、FC11、FC16在葡萄糖质量浓度为400 g/L时的OD600nm值均高于菌株WQ-3、WQ-8、ADT。结果表明,6株酵母菌均可耐受葡萄糖质量浓度400 g/L,且菌株FC2、FC11、FC16葡萄糖耐受性较好。
2.6.2 乙醇耐受性
果酒发酵期过程中,经过糖代谢产生乙醇,乙醇的积累对酵母菌细胞产生毒害作用,抑制菌株生长[27]。 因此,考察6株酵母菌菌株的乙醇耐受性,结果见图6。
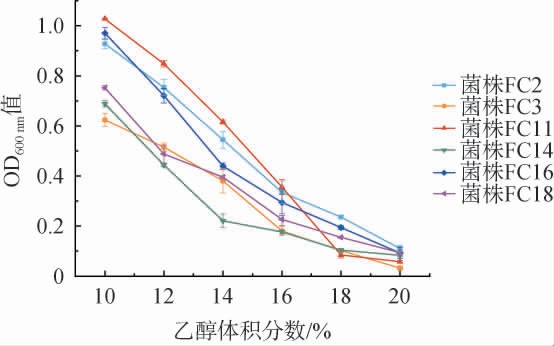
图6 6株筛选酵母菌菌株的乙醇耐受性
Fig.6 Ethanol tolerance of 6 screened yeast strains
由图6可知,随着乙醇体积分数的增加,各酵母菌菌株的生长均受到不同程度的抑制,OD600 nm值均呈下降趋势。当乙醇体积分数为10%时,菌株FC11的OD600 nm值最高,为1.03;当乙醇体积分数达到16%时,6株酵母菌菌株的OD600nm值均<0.5,但菌株FC2、FC11、FC16的OD600nm值均高于其他3株菌株;当乙醇体积分数为18%时,菌株FC3、FC11、FC14几乎不生长;当乙醇体积分数达到20%时,所有酵母菌菌株几乎不生长。综上,菌株FC3、FC11、FC14均可耐受乙醇体积分数16%,菌株FC2、FC16、FC18可耐受乙醇体积分数18%,乙醇耐受性均优于闫兴敏等[17]的试验菌株。
2.6.3 pH耐受性
pH值对酵母菌的生长和代谢活动有着重要的影响,其可以调节细胞内的代谢传递和酶活性,当环境的pH值偏低或偏高时,都会直接影响酵母菌的生长和代谢能力[28]。因此,维持适当的pH值对于酵母菌的正常生长至关重要。在酸樱桃酒的酿造过程中,pH值范围需要保持在2.8~3.2之间最好[29],因此,考察6株筛选酵母菌菌株对pH的耐受性,结果见图7。
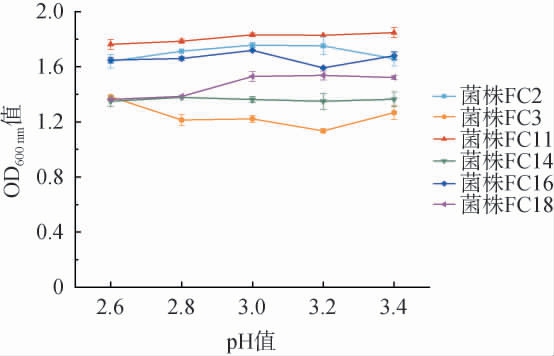
图7 6株筛选酵母菌菌株的pH耐受性
Fig.7 pH tolerance of 6 screened yeast strains
由图7可知,在pH值为2.6~3.4时,所有菌株均能正常生长,其中,菌株FC11对pH耐受性最高,其次为菌株FC2和FC16,菌株FC3对pH耐受性相对较弱。因此,所有酵母菌菌株均可耐受pH值2.6。
本研究以酸樱桃自然发酵液为原材料,采用传统培养分离法共分离出76株菌株,经过形态学观察,除去形态相似的菌株,共得到34株酵母菌。通过杜氏小管发酵性能测试和TCC显色筛选,发现菌株FC2、FC3、FC11、FC14、FC16、FC18这6株酵母菌发酵性能及产酒精能力优良,通过分子生物学技术鉴定菌株FC2和FC11均属于酿酒酵母(Saccharomyces cerevisiae),其余菌株均为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)。 6株菌株均可耐受乙醇体积分数16%、pH 2.6、葡萄糖质量浓度400 g/L,且菌株FC2、FC11、FC16耐受性能优于FC3、FC14、FC18,更适合酸樱桃果酒的酿造。 本研究结果可为今后酸樱桃酒的酿造提供理论和技术支持,促进国内酸樱桃产业的发展。
[1]中国农学会遗传资源学会.中国作物遗传资源[M].北京:中国农业出版社,1994:859-867
[2]蔡宇良,冯瑛,邱蓉,等.酸樱桃新品种‘玫丽’[J].园艺学报,2013,40(3):593-595.
[3]ZLATIC′ E, PICHLER A, LONCˇARIC′ A, et al.Volatile compounds of freeze-dried sour cherry puree affected by the addition of sugars[J].Int J Food Prop,2017,20(sup1):S449-S456.
[4]CSIKI Z,PAPP-BATA A,CZOMPA A,et al.Orally delivered sour cherry seed extract(SCSE)affects cardiovascular and hematological parameters in humans[J].Phytother Res,2015,29(3):444-449.
[5]MAHMOUD F,HAINES D,AL-AWADHI R,et al.Sour cherry(Prunus cerasus)seed extract increases heme oxygenase-1 expression and decreases proinflammatory signaling in peripheral blood human leukocytes from rheumatoid arthritis patients[J].Int Immunopharmacol, 2014, 20(1):188-196.
[6]OU B,BOSAK K N,BRICKNER P R,et al.Processed tart cherry products-Comparative phytochemical content,in vitro antioxidant capacity and in vitro anti-inflammatory activity[J].J Food Sci,2012,77(4-6): H105-H112.
[7]WANG C,SUN W,DALBETH N,et al.Efficacy and safety of tart cherry supplementary citrate mixture on gout patients:A prospective,randomized,controlled study[J].Arthritis Res Ther,2023,25(1):164.
[8]GRAFE C, SCHUSTER M.Physicochemical characterization of fruit quality traits in a German sour cherry collection[J].Sci Hortic,2014,180:24-31.
[9]张妮.樱桃酒致香成分的研究及发酵工艺对其香气成分的影响[D].上海:华东理工大学,2012.
[10]陈倩,李永杰,扈莹莹,等.传统发酵食品中微生物多样性与风味形成之间关系及机制的研究进展[J].食品工业科技,2021,42(9):412-419.
[11]GÓMEZ L F H,U′BEDA J,BRIONES A.Characterisation of wines and distilled spirits from melon(Cucumis melo L.)[J].Int J Food Sci Technol,2008,43(4):644-650.
[12]王双慧,马世源,李子健,等.酿酒酵母对浓香型白酒发酵过程中微生物群落演替的影响机制[J].食品科学,2024,45(7):103-110.
[13]汪前,刘军波,邹礼根.浆果类果酒酵母菌种筛选研究进展[J].食品科技,2022,47(10):51-56.
[14]白玉峰,张文霞,田亚楠,等.宁夏贺兰山东麓降L-苹果酸葡萄酒酵母的筛选[J].中国酿造,2021,40(1):49-54.
[15]舒学香,周文,吴霞,等.猕猴桃果酒酿造专用酵母菌株的筛选[J].中国酿造,2021,40(8):99-104.
[16]杨惠婷.浙江地区酿酒酵母的优选鉴定及发酵特性的研究[D].内蒙古:内蒙古农业大学,2022.
[17]闫兴敏,姜娇,高辉,等.优良本土酿酒酵母的酿酒特性及产香能力初析[J].食品与发酵工业,2022,48(4):62-68.
[18]BARNETT J A,胡瑞卿.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:7-10.
[19]王琪,蔡建,高秀,等.黄泡野生酵母菌的筛选鉴定及其发酵性能研究[J].中国酿造,2024,43(6):182-188.
[20]WANG Z,HAO Q,AN X,et al.Optimization of Mopan persimmon wine fermentation with pectinase and analysis of its mechanism of action[J].Foods,2023,12(6):1246.
[21]胡江南,高熳熳,马立娟,等.葡萄酒发酵优良酵母的筛选、鉴定及应用[J].中国酿造,2023,42(7):43-50.
[22]熊荣园,王黎明,魏玲,等.柑橘及桑葚中优质酵母菌的筛选及鉴定[J].中国酿造,2023,42(4):163-167.
[23]管庆林,周笑犁,赵姗,等.番茄自然发酵液中酵母菌的分离鉴定及其特性研究[J].食品工业科技,2021,42(3):66-100,107.
[24]贾春凤,贾志军,朱维红,等.红提葡萄酒发酵酵母菌的分离及耐受性研究[J].中国酿造,2016,35(6):76-80.
[25]FUGELANG K C,EDWARDS C G.葡萄酒酿造微生物学-实验技术与规划[M].第二版,北京:中国轻工业出版社,2010:94.
[26]刘安,王丹阳,王振,等.高耐受性酿酒酵母的适应性驯化选育与发酵[J].微生物学通报,2024,51(3):1018-1032.
[27]QIU Z L,JIANG R R.Improving Saccharomyces cerevisiae ethanol production and tolerance via RNA polymerase II subunit Rpb7[J].Biotechnol Biofuels,2017,10(1):125.
[28]王辉,袁婷玉,白卫东,等.青梅自然发酵液中酵母菌的分离鉴定及特性研究[J].食品科技,2021,46(8):16-21.
[29]PHAM T M, SUN W, BUJNA E, et al.Optimization of fermentation conditions for production of Hungarian sour cherry spirit using response surface methodology[J].Fermentation,2021,7(4):209.