表1 荔枝果酒发酵工艺优化Box-Benhnken试验设计因素与水平
Table 1 Factors and levels of Box-Benhnken experiments design for fermentation process optimization of litchi fruit wine
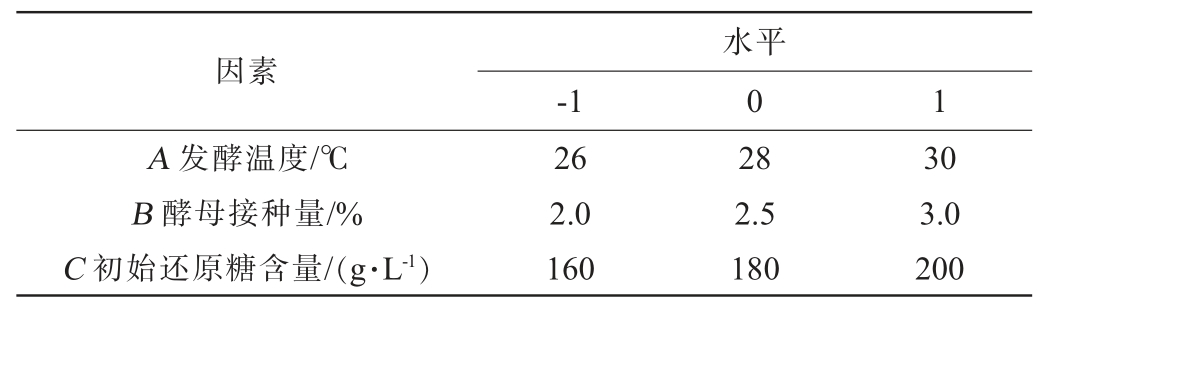
因素-1水平0 1 A 发酵温度/℃B 酵母接种量/%C 初始还原糖含量/(g·L-1)26 2.0 160 28 2.5 180 30 3.0 200
Fermentation process optimization,analysis of volatile flavor components and non-volatile metabolites of litchi fruit wine
荔枝(Litchi chinensis Sonn.)是一种亚热带水果,富含可发酵糖、维生素、矿物质和多酚类化合物,是理想的果酒发酵原料[1],荔枝果酒因独特口感和风味在市场上受到青睐[2]。 其风味由挥发性和非挥发性化合物决定,特征性风味物质对产品的芳香强度和口感复杂度至关重要[3]。因此,充分挖掘荔枝果酒的风味物质组成对于提高产品品质具有重要意义。
当前国内外对荔枝果酒的研究主要集中在发酵工艺参数优化和风味成分分析等方面。在酿造工艺上,发酵温度、酵母菌株接种量、初始pH值和糖含量等因素均会影响发酵进程和最终风味物质的保存与转化[4]。优化这些参数被认为是提升果酒风味品质的关键措施[5]。
龚诗媚等[6]研究贝氏酵母发酵荔枝果酒挥发性风味物质的特征,结果表明,贝氏酵母发酵荔枝果酒中起关键性作用的特征香气成分主要有丁酸乙酯、二氢草莓酸乙酯、异丁醛、乙酸异戊酯、己酸乙酯和辛酸乙酯,这些物质共同提高了荔枝酒风味的丰富性。唐忠盛[7]对荔枝酒加工全程中不同形态香气成分的变化规律进行了研究,分别检出192种游离态和65种键合态香气成分。结果表明,游离态的萜类和顺式-玫瑰醚的损失主要发生在主发酵前期(2~3d);发酵结束后,荔枝酒中典型香气成分的键合态是游离态的4~1740倍,键合态醛酮类香气物质达到最高值(6 025.85μg/L),为游离态醛酮类物质的2 000倍。CHEN D等[8]对不同酿酒酵母株发酵荔枝汁的成分差异进行了研究,发现乙醇发酵性能和挥发性产物的组成存在显著差异。ZHAO L等[9]的研究指出,“糯米糍”这一荔枝品种的果肉含糖量可达到19.2%,并散发出浓郁的玫瑰花香和柑橘类水果的香气。尽管这些研究对工艺进行了深入的探讨,但对于挥发性和非挥发性代谢物的研究尚显不足。
本研究以鲜荔枝为原料,以感官评分为响应值,通过单因素及响应面试验优化荔枝果酒发酵工艺。利用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)-气相色谱-质谱联用(GC-MS)和液相色谱-质谱联用(LC-MS)技术分析发酵前后荔枝酒的挥发性风味成分和非挥发性代谢物,采用正交偏最小二乘-判别分析(orthogonal partial leastsquaresdiscriminantanalysis,OPLS-DA)构建模型,利用变量重要性投影(variable importance in the projection,VIP)值及方差分析P值筛选关键差异代谢物,并进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)代谢通路分析。旨在揭示荔枝果酒风味形成机制,为提升荔枝果酒的品质提供理论依据。
新鲜荔枝(产地四川泸州)、蔗糖:市售;酿酒酵母(Saccharomyces cerevisiae)(G1):本实验室筛选及保藏;酿酒酵母(G2):安琪酵母有限公司;酿酒酵母CICC1398(G3)、CICC9080(G4)、CICC9763(G5):中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC);柠檬酸(分析纯):陕西正宏生物科技有限公司;果胶酶(10万U/g):河南晟发生物科技有限公司;辛酸甲酯(分析纯):泰安市江舟生物科技有限公司。
L6-L621九阳榨汁机:九阳股份有限公司;GSG-24电热恒温水浴锅:上海一恒科学仪器有限公司;7890A-5975C气相色谱-质谱联用仪、Agilent7470液相色谱-质谱联用仪联用仪:安捷伦科技(上海)有限公司;Supelco固相微萃取头:赛默飞世尔科技(中国)有限公司;HWS-260B恒温培养箱:杭州绿博仪器有限公司。
1.3.1 荔枝果酒加工工艺流程及操作要点
鲜荔枝→清洗、分选→去皮→去核、榨汁→酶解→调酸、调糖→接种酵母→发酵→荔枝果酒
操作要点:
原料荔枝清洗剥壳去核后进行榨汁,将破碎后的荔枝果汁与果胶酶(200 mg/L)混合,在45 ℃条件下进行酶解2 h。 调整果汁还原糖含量(使用蔗糖调整至180 g/L)和pH值(使用柠檬酸调整5.0),接种2.5%酿酒酵母种子液[浓度6.4 lg(CFU/mL)],于28 ℃条件下恒温发酵8 d,每24 h测定发酵液质量,当质量减少量低于0.2 g,即为发酵结束,得到荔枝果酒成品。
1.3.2 不同菌种对荔枝果酒品质的影响
按照荔枝果酒加工工艺流程及操作要点进行单菌发酵试验。 酵母菌菌株分别为:酿酒酵母(G1)、酿酒酵母(G2)、CICC1398(G3)、CICC9080(G4)、CICC9763(G5),以相同的工艺条件发酵制备荔枝酒,试验重复3次,发酵结束后,测定荔枝酒总酸、总酯含量和酒精度并进行感官评价,筛选适合荔枝果酒发酵的酵母菌株。
1.3.3 荔枝果酒发酵工艺优化
(1)单因素试验
单因素试验基准条件为酵母接种量2.5%,初始pH值5.0,发酵温度28 ℃,初始还原糖含量180 g/L。在此基础上,分别考察酵母接种量(1.5%、2.0%、2.5%、3.0%、3.5%)、初始pH值(3.5、4.0、4.5、5.0、5.5)、初始还原糖含量(120 g/L、140 g/L、160 g/L、180 g/L、200 g/L)、发酵温度(24 ℃、26 ℃、28 ℃、30 ℃、32 ℃)等因素对荔枝果酒品质指标(酒精度、感官评分、总酸、总酯)的影响。
(2)响应面试验
基于单因素试验结果,选取发酵温度(A)、酵母接种量(B)和初始还原糖含量(C)作为自变量,以感官评分(Y)为响应值,采用Design-Expert 8.0.6软件进行Box-Behnken试验设计,Box-Behnken试验因素与水平见表1。
表1 荔枝果酒发酵工艺优化Box-Benhnken试验设计因素与水平
Table 1 Factors and levels of Box-Benhnken experiments design for fermentation process optimization of litchi fruit wine

因素-1水平0 1 A 发酵温度/℃B 酵母接种量/%C 初始还原糖含量/(g·L-1)26 2.0 160 28 2.5 180 30 3.0 200
1.3.4 分析检测
(1)理化指标
酒精度、总酸测定:参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》;总酯、挥发酸:采用滴定法[10]。
(2)感官评价
请20位受过专业酒类品评训练的人员,按照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》及文献[11],分别从色泽、香气、口味、风格方面对荔枝果酒进行感官评价,满分100分,感官评价标准见表2。
表2 荔枝果酒感官评价标准
Table 2 Sensory evaluation standards of litchi fruit wine

项目 评分标准及等级很好(90~100分) 较好(80~89分) 一般(70~79分) 较差(60~69分) 差(<60分)色泽(10分)微黄,澄清透明色泽太深,浑浊香气(30分)口味(40分)风格(20分)荔枝香、酒香浓郁酒体丰满、协调爽口典型性完美,风格独特微黄至浅黄,澄清透明,无悬浮物荔枝香、酒香纯正酒质柔顺,柔和爽口典型明确,风格良好浅黄至浅褐,澄清至微浑,无悬浮物具有荔枝香、酒香、无异味酒体协调、纯正无杂有典型性,风格不够典雅褐色,较浑,失光荔枝香、酒香不足,带有不愉快的气味酒体寡淡、不协调典型性不明显气味不良酸,涩,有异味不具有荔枝酒的典型性
(3)有机酸
有机酸的检测采用高效液相色谱法(high performance liquid chromatography,HPLC)[12]。
(4)挥发性风味成分
挥发性成分的检测采用顶空-固相微萃取-气质联用(HS-SPME-GC-MS)法[12]。
(5)非挥发性代谢物
非挥发性代谢物检测采用液相色谱-质谱联用(LCMS)法[13]。
1.3.5 数据处理
数 据 分 析 采 用Origin 9.5、Design Expert 8.0.6、SPSS 27.0、非挥发性代谢物的鉴定基于自建库、mzCloud在线库、LIPID MAPS、HMDB、MoNA以及美国国家标准技术研究所(National Institute of Standards and Technology,NIST)-2020-MS/MS 图谱库进行数据处理。
不同酵母菌株发酵对荔枝果酒品质的影响见图1。
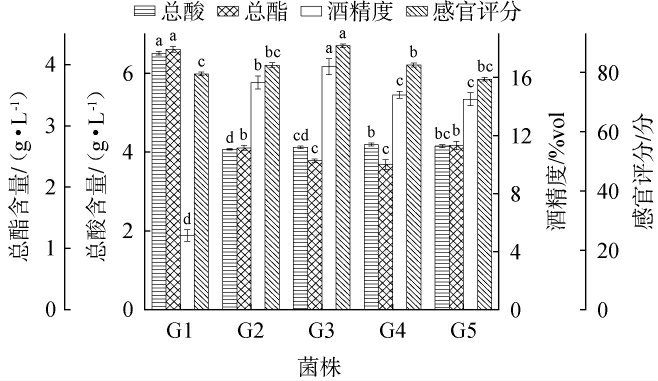
图1 不同酵母菌株对荔枝果酒品质的影响
Fig.1 Effect of different yeast strains on the quality of litchi fruit wine
不同字母表示差异显著(P<0.05)。下同。
由图1可知,菌株G3制备的荔枝果酒感官评分最高为89分,果酒特征香气与乙醇呈现高度融合,形成协调复杂的风味。相比之下,菌株G1制备的荔枝果酒总酸含量(6.51 g/L)和总酯含量(4.25 g/L)均高于其他菌株,但其感官评分(79.5分)与酒精度(5.1%vol)并不及菌株G3制备的荔枝果酒。菌株G1可能具有较高的乙酸酯酶和有机酸代谢酶活性,这些酶促进了有机酸和酯类的生成而非乙醇[14]。此外,较高的酸度也可能使酒体的平衡感下降,导致感官评分较低。 综合比较,选择酿酒酵母菌株G3作为荔枝果酒发酵的最适菌株。
2.2.1 发酵温度对荔枝果酒品质的影响发酵温度对荔枝果酒品质的影响见图2。
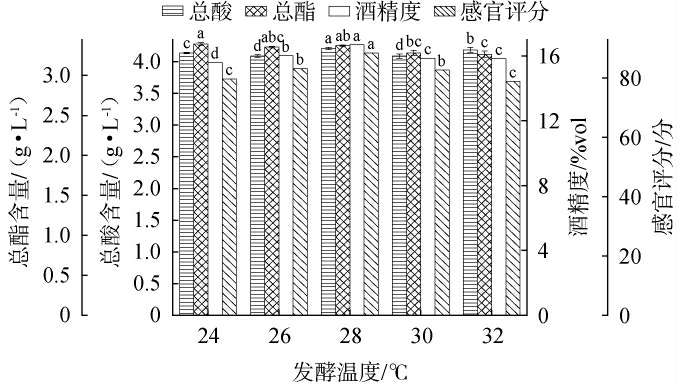
图2 不同发酵温度对荔枝果酒品质的影响
Fig.2 Effect of different fermentation temperature on the quality of litchi fruit wine
由图2可知,当发酵温度为24~28 ℃时,感官评分和酒精度随发酵温度升高而增加;当发酵温度为28 ℃时,感官评分、酒精度以及总酸含量最高,分别为88分、16.5%vol、4.21 g/L;当发酵温度>28 ℃之后,感官评分、酒精度以及总酸均有所下降;总酯随着温度的升高而减小,总酯含量最低为3.26 g/L。发酵温度对酵母的繁殖及其糖代谢途径有显著影响。 在28 ℃时,磷酸果糖激酶(phosphofructokinase,PFK)和丙酮酸激酶(pyruvate kinase,PK)的活性可能得到最佳表达,酵母细胞的增殖与代谢达到平衡,从而提高乙醇浓度[15]。 此外,高温或低温条件下酵母的氧化应激或渗透应激,可能影响细胞内环境、酶活性和代谢产物生成[16]。因此,选择最适发酵温度为28 ℃。
2.2.2 酵母接种量对荔枝果酒品质的影响
酵母接种量对荔枝果酒品质的影响见图3。 由图3可知,当酵母接种量为1.5%~2.5%时,感官评分和酒精度随酵母接种量升高而增加,总酯含量随酵母接种量升高而降低;当酵母接种量为2.5%时,感官评分和酒精度最高,分别为86分、16.1%vol,总酯含量最低为2.35 g/L;当酵母接种量>2.5%,感官评分和酒精度均有所下降,总酯含量有所上升。当酵母接种量为1.5%~3.0%时,总酸含量随之上升;当酵母接种量为3.0%时,总酸含量最高,为4.26 g/L;当酵母接种量>3.0%之后,总酸含量变化不大。适量的酵母接种量有助于维持酯化酶的平衡活性,促进果香酯类物质的生成,塑造层次丰富、协调优雅的果酒风味。因此,选择最适酵母接种量为2.5%。
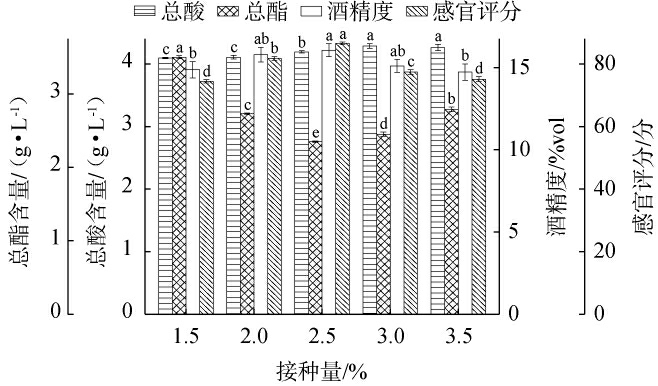
图3 不同接种量对荔枝果酒品质的影响
Fig.3 Effect of different inoculum on the quality of litchi fruit wine
2.2.3 初始pH值对荔枝果酒品质的影响
初始pH值对荔枝果酒品质的影响结果见图4。
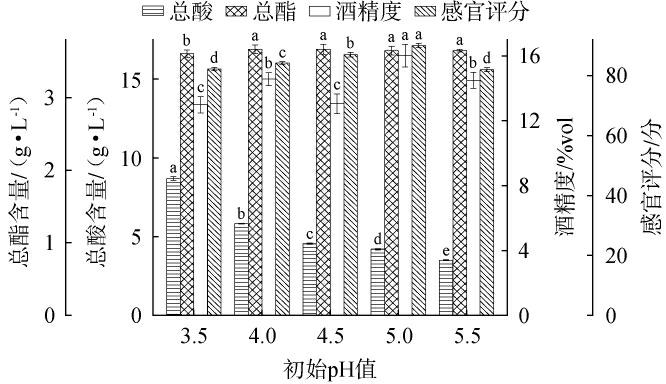
图4 不同初始pH值对荔枝果酒品质的影响
Fig.4 Effect of different initial pH on the quality of litchi fruit wine
由图4可知,当初始pH值为3.5~5.5时,荔枝果酒的总酸呈现下降趋势,总酯呈现先缓慢上升后平稳趋势,感官评分、酒精度现先上升后下降再上升趋势。 当初始pH值为5.0时,感官评分与酒精度最高,分别为90分和16%vol。当初始pH值>5.0之后,感官评分下降为82分,酒精度下降为14.5%vol。适宜的初始pH条件能够保持糖酵解途径中的关键酶的活性,这些酶在中性或弱酸性环境下表现最佳,从而提高糖的代谢效率,增加乙醇生成[17]。因此,选择最适初始pH值为5.0。
2.2.4 初始还原糖含量对荔枝果酒品质的影响
初始还原糖含量对荔枝果酒品质的影响见图5。由图5可知,随着初始还原糖含量在120~180 g/L范围内的增加,感官评分和酒精度随之增高;当初始还原糖含量为180 g/L时,感官评分和酒精度最高,分别为91分、16%vol;当初始还原糖含量>180 g/L之后,感官评分和酒精度有所下降。初始还原糖含量在120~200 g/L时,总酸从4.21 g/L上升到4.36 g/L,之后趋于平稳;总酯随着初始还原糖含量的增加而减小。
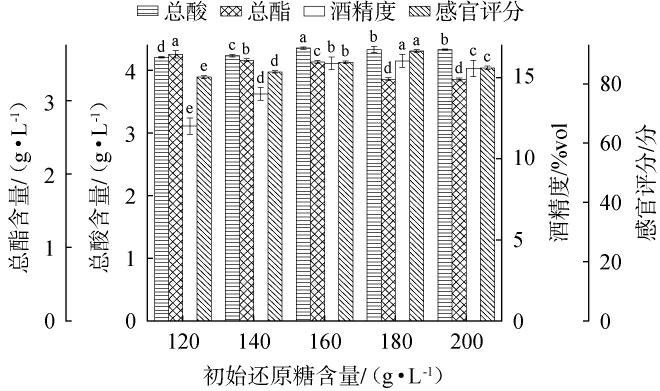
图5 不同初始还原糖含量对荔枝果酒品质的影响
Fig.5 Effect of different initial reducing sugar contents on the quality of litchi fruit wine
初始还原糖含量影响糖酵解途径中关键酶的表达和活性,适宜的糖浓度可以诱导己糖激酶(hexokinase,HK)、磷酸果糖激酶和丙酮酸激酶等酶的合成, 促进糖的高效利用[17]。过高的糖浓度可能通过反馈抑制机制降低某些酶的活性,渗透压的增加限制了酵母菌的繁殖和产乙醇的能力,影响发酵效率。 根据HO C W等[18]的研究,发酵时随着糖分的增加导致代谢产物的积累,总酸含量增加,这主要是由于有机酸(如苹果酸、乳酸等)的生成。因此,选择最适初始还原糖含量为180 g/L。
2.3.1 响应面试验设计与结果
基于单因素试验结果,利用Design Expert 8.0.6软件设计响应面试验,固定初始pH值为5.0,以发酵温度(A)、酵母接种量(B)、初始还原糖含量(C)为自变量,以感官评分(Y)为响应值,Box-Behnken试验设计结果见表3,方差分析结果见表4。
表3 荔枝果酒发酵工艺优化Box-Benhnken试验设计及结果
Table 3 Design and results of Box-Benhnken experiments for fermentation process optimization of litchi fruit wine
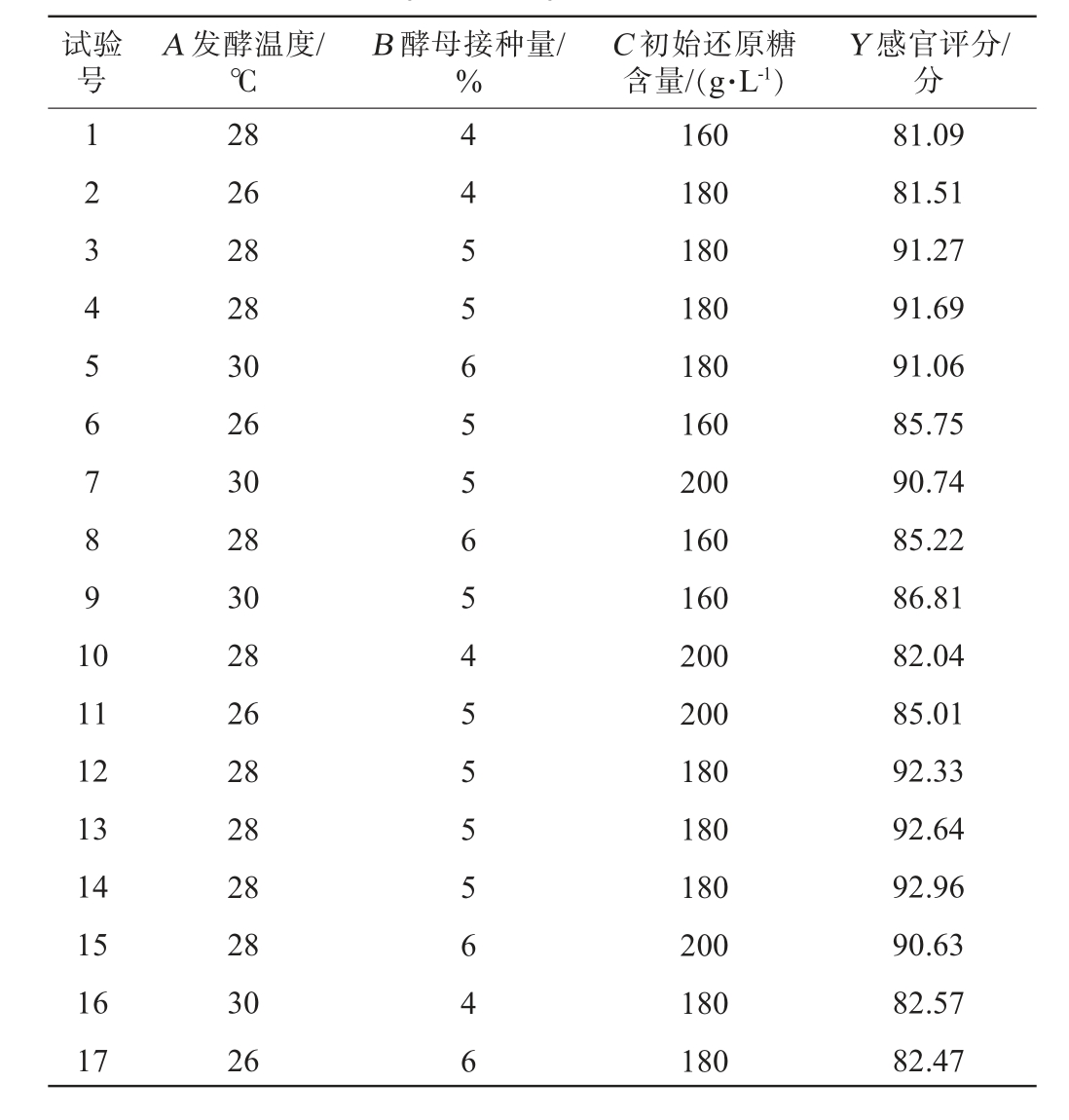
试验号A 发酵温度/℃B 酵母接种量/%C 初始还原糖含量/(g·L-1)Y 感官评分/分1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 28 26 28 28 30 26 30 28 30 28 26 28 28 28 28 30 26 4 4 5 5 6 5 5 6 5 4 5 5 5 5 6 4 6 160 180 180 180 180 160 200 160 160 200 200 180 180 180 200 180 180 81.09 81.51 91.27 91.69 91.06 85.75 90.74 85.22 86.81 82.04 85.01 92.33 92.64 92.96 90.63 82.57 82.47
表4 回归模型方差分析
Table 4 Variance analysis of regression model
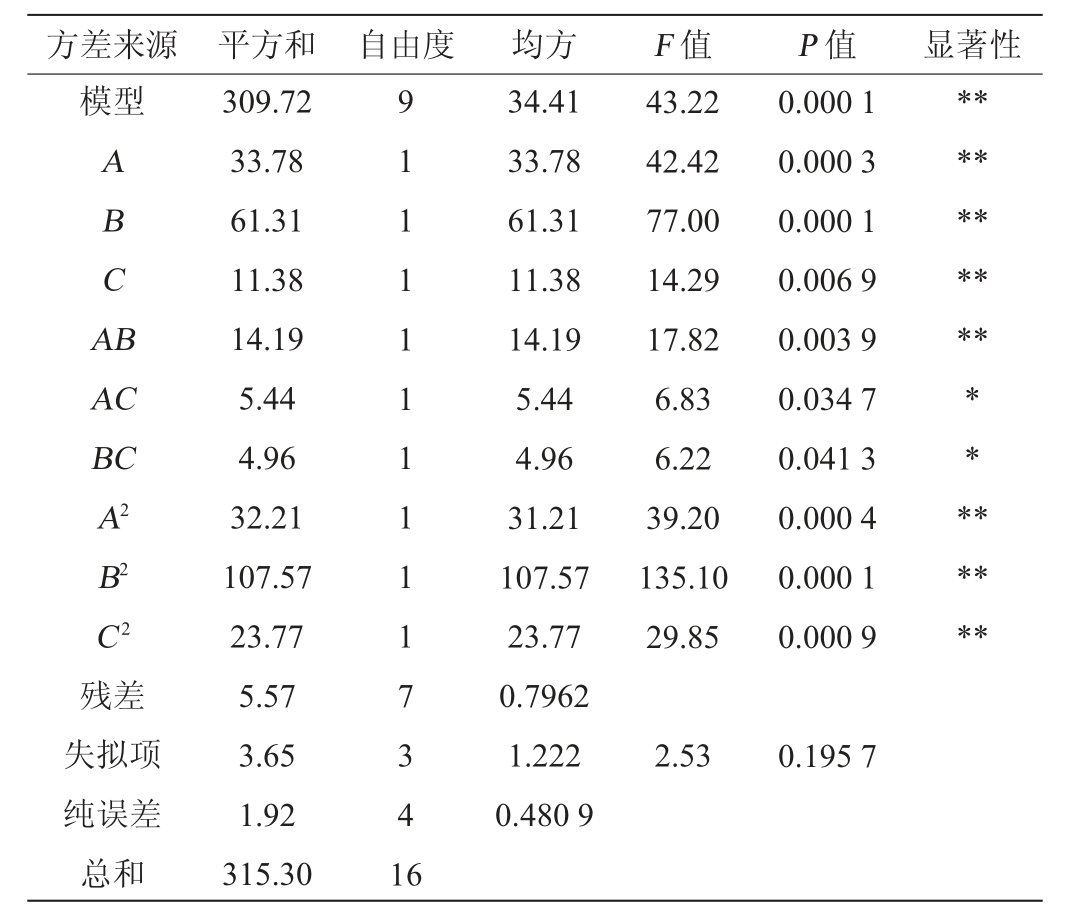
注:“*”表示对结果影响显著(P<0.05);“**” 表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B**********AC BC A2 B2 C2残差失拟项纯误差总和309.72 33.78 61.31 11.38 14.19 5.44 4.96 32.21 107.57 23.77 5.57 3.65 1.92 315.30 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 34.41 33.78 61.31 11.38 14.19 5.44 4.96 31.21 107.57 23.77 0.7962 1.222 0.480 9 43.22 42.42 77.00 14.29 17.82 6.83 6.22 39.20 135.10 29.85 0.000 1 0.000 3 0.000 1 0.006 9 0.003 9 0.034 7 0.041 3 0.000 4 0.000 1 0.000 9** ******2.53 0.195 7
通过Design Expert 8.0.6软件分析表3数据,得到多元二次多项式回归方程如下:
由表4可知,该模型极显著(P<0.01),失拟项P值>0.05,不显著,表明该模型方程与实际值拟合良好。 模型决定系数R2为0.982 3,调整决定系数R2adj为0.959 6,变异系数(coefficient of variation,CV)=1.02%<10%,表明该试验模型的可行度和精确度较高。由P值可知,一次项A、B、C,二次项A2、B2、C2及交互项AB对结果影响极显著(P<0.01),交互项AC、BC对结果影响显著(P<0.05)。由F值可知,各因素对结果影响顺序为酵母接种量(B)>发酵温度(A)>初始还原糖含量(C)。
2.3.2 各因素间交互作用对结果影响的响应面分析
两因素交互作用对结果影响的响应面越陡峭,等高线越接近椭圆形,表明二者交互作用对结果影响越显著;反之,两因素交互作用对结果影响的响应面越平缓,等高线越接近圆形,表明二者交互作用对结果影响越不显著。 各因素交互作用对荔枝果酒感官评分影响的响应面及等高线见图6。
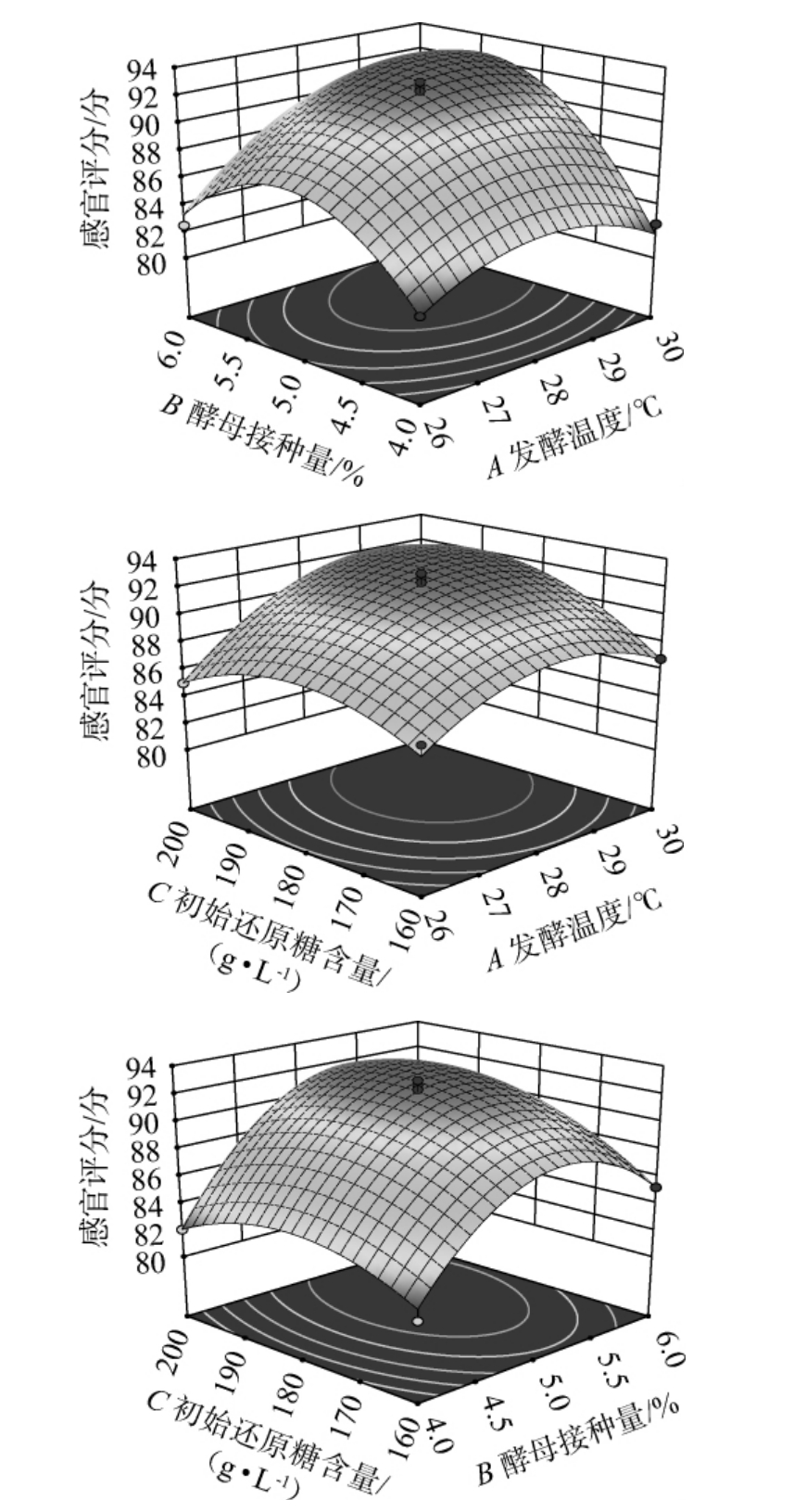
图6 各因素交互作用对荔枝果酒感官评分影响的响应面及等高线
Fig.6 Response surface plots and contour lines of effect of interaction between various factors on sensory score of litchi fruit wine
由图6可知,当发酵温度(A)、酵母接种量(B)、初始还原糖含量(C)两者交互作用时,其中AB对结果影响极显著(P<0.01),AC、BC对结果影响显著(P<0.05)。这与方差分析结果一致。
2.3.3 最佳发酵工艺的确定
根据Design Expert 8.0.6软件预测得出最佳发酵工艺为发酵温度28.30 ℃、酵母接种量2.59%、初始还原糖含量181.21 g/L。 在此优化条件下,荔枝果酒感官评分预测值为92.96分。考虑到实际操作可行性,将最佳发酵工艺修正为发酵温度28 ℃、酵母接种量2.5%、初始还原糖含量180 g/L。 在此优化条件下进行3次平行验证试验,得到的荔枝果酒酒精度为15.64%vol,感官评分实际值为92.0分,与模型预测值相差不大,说明模型优化发酵工艺条件可行。
优化发酵工艺条件下制备荔枝果酒理化指标见表5。由表5可知,荔枝果酒酒精度、总酸、挥发酸均符合QB/T 4262—2011《荔枝酒》要求,此外,荔枝果酒中未检出甲醇。
表5 荔枝果酒理化指标
Table 5 Physicochemical indexes of litchi fruit wine
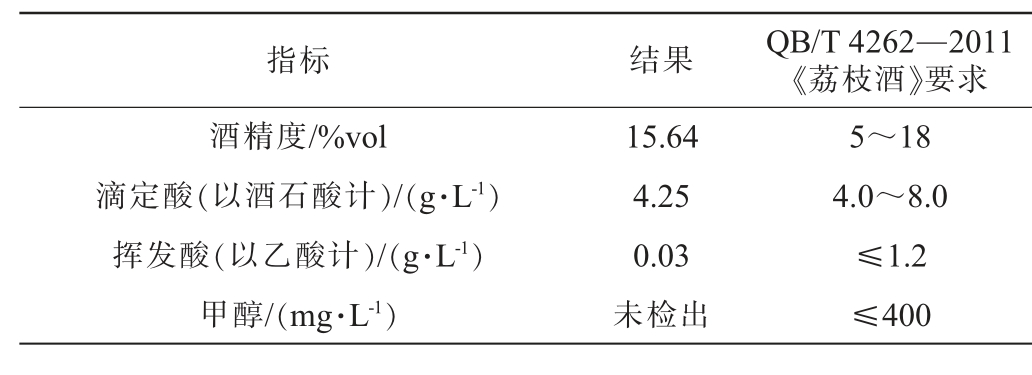
指标 结果 QB/T 4262—2011《荔枝酒》要求酒精度/%vol滴定酸(以酒石酸计)/(g·L-1)挥发酸(以乙酸计)/(g·L-1)甲醇/(mg·L-1)15.64 4.25 0.03未检出5~18 4.0~8.0≤1.2≤400
2.5.1 有机酸分析
发酵前后荔枝果酒的有机酸组成发生了显著变化,直接影响了果酒的酸度和风味。 荔枝果汁与果酒有机酸含量测定结果见图7。 由图7可知,发酵前后均检出10种有机酸,其中发酵前,乙酸含量最高(5.95 mg/mL),其次是苹果酸和乳酸,含量分别为3.60 mg/mL和3.50 mg/mL。发酵后荔枝果酒中,乳酸含量从3.50 mg/mL上升至17.18 mg/mL,这一变化可能是由于苹果酸-乳酸发酵(malolactic fermentation,MLF)的发生,酵母和乳酸菌将苹果酸转化为乳酸,降低了果酒的酸度,使口感更加柔和、圆润[19]。 此外,发酵后丙酮酸含量上升,反映了糖酵解途径的活跃性,它不仅影响酒体的酸度平衡,还为风味形成提供了基础。 富马酸含量较低,主要参与三羧酸循环,对酒体的化学稳定性有所贡献[20]。总体而言,发酵过程通过乳酸的生成以及其他有机酸的转化,显著丰富了荔枝果酒的风味层次,使其酸度适中,进而提升了果酒的感官品质。
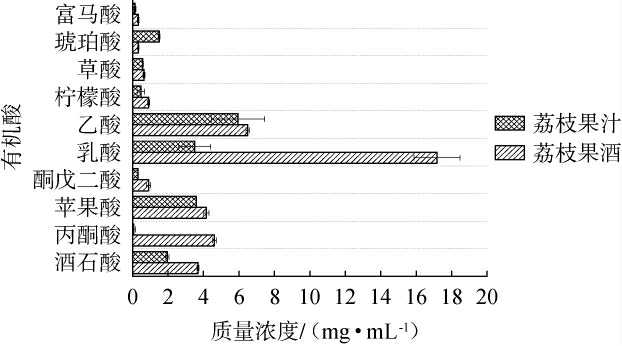
图7 荔枝果汁与荔枝果酒中有机酸含量测定结果
Fig.7 Determination results of organic acid contents in litchi juice and litchi fruit wine
2.5.2 挥发性风味物质分析
荔枝果汁及荔枝果酒样品中挥发性风味物质HS-SPMEGC-MS分析结果见表6。由表6可知,荔枝果汁及荔枝果酒样品中共检出56种挥发性风味物质,包括醇类21种、酯类12种、醛类2种、酸类3种、烯萜类8种、其他类10种。 荔枝果汁样品共检出41挥发性风味物质,包括醇类15种、酯类7种、醛类2种、酸类2种、烯萜类4种、其他类11种。荔枝果酒样品共检出37种挥发性风味物质,包括醇类13种、酯类10种、醛类1种、酸类3种、烯萜类6种、其他类4种。
表6 荔枝果汁及荔枝果酒中挥发性风味成分分析结果及气味活度值
Table 6 Analysis results and odor activity value of volatile flavor components in litchi juice and litchi fruit wine
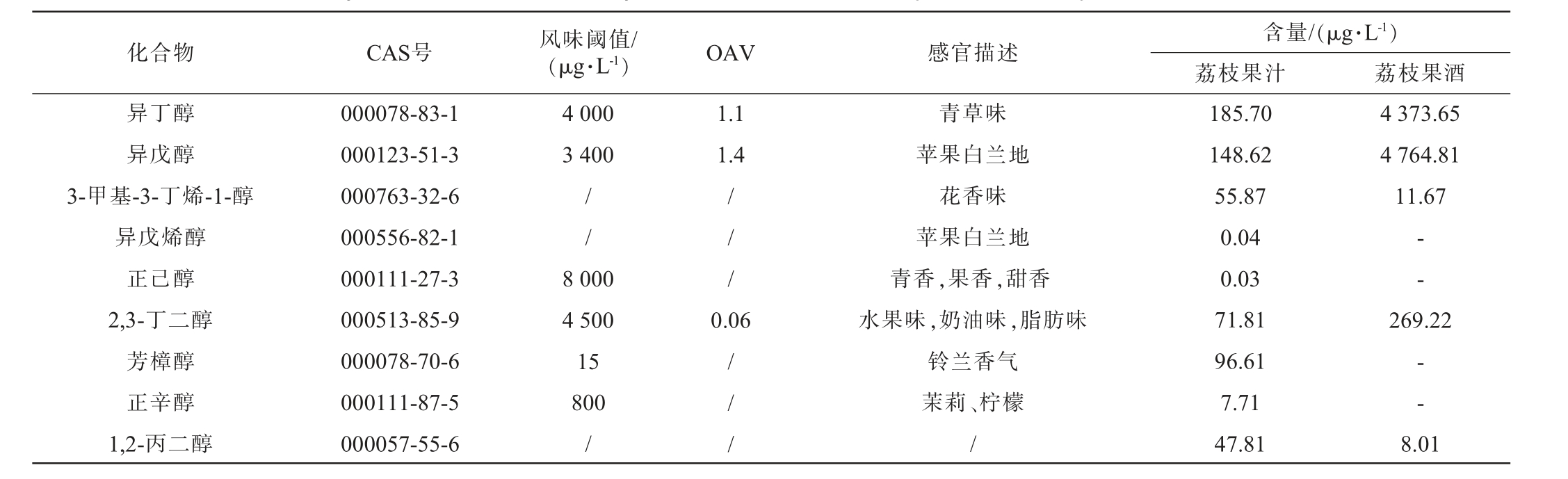
化合物 CAS号 风味阈值/(μg·L-1) OAV 感官描述含量/(μg·L-1)荔枝果汁 荔枝果酒异丁醇异戊醇3-甲基-3-丁烯-1-醇异戊烯醇正己醇2,3-丁二醇芳樟醇正辛醇1,2-丙二醇000078-83-1 000123-51-3 000763-32-6 000556-82-1 000111-27-3 000513-85-9 000078-70-6 000111-87-5 000057-55-6 4 000 3 400//8 000 4 500 15 800/1.1 1.4// /0.06// /青草味苹果白兰地花香味苹果白兰地青香,果香,甜香水果味,奶油味,脂肪味铃兰香气茉莉、柠檬/185.70 148.62 55.87 0.04 0.03 71.81 96.61 7.71 47.81 4 373.65 4 764.81 11.67--269.22--8.01
续表

注:“-”表示未检出,“/”表示未查到相关资料。
化合物 CAS号 风味阈值/(μg·L-1) OVA 感官描述4-萜烯醇D-香茅醇香叶醇苯甲醇苯乙醇异香叶醇丙醇正丁醇(S)-1,2-丙二醇2-乙基己醇3-甲硫基丙醇乙酸乙酯乙酸异丁酯乙酸异戊酯L(-)-乳酸乙酯辛酸乙酯癸酸乙酯甲酸芳樟酯棕榈酸乙酯正己酸乙酯乙基9-癸烯酸酯菊酯月桂酸乙酯乙醛2-己烯醛苯甲醛3-羟基-2-丁酮(+)-异薄荷酮薄荷酮D-香芹酮乙酸辛酸丁酸玫瑰醚甲基苯乙基醚桧烯月桂烯(+)-柠檬烯4-异丙烯基甲苯2,6-二甲基α-姜黄烯邻-异丙基苯甲氧基苯肟(-)-α-蒎烯毕澄茄烯β-石竹烯α-石竹烯000562-74-3 001117-61-9 000106-24-1 000100-51-6 000060-12-8 005944-20-7 000071-23-8 000071-36-3 004254-15-3 000104-76-7 000505-10-2 000141-78-6 000110-19-0 000123-92-2 000687-47-8 000106-32-1 000110-38-3 000115-99-1 000628-97-7 000123-66-0 067233-91-4 023986-74-5 000628-97-7 000066-25-1 000505-57-7 000100-52-7 000513-86-0 001196-31-2 010458-14-7 002244-16-8 000064-19-7 000058-86-6 000079-31-2 016409-43-1 003558-60-9 003387-41-5 000123-35-3 005989-27-5 001195-32-0 002792-39-4 000644-30-4 000527-84-4 1000222-86-6 003856-25-5 013744-15-5 000087-44-5 006753-98-6///200 20 3 000 1 000 1.9 14.1/1.1// /玫瑰甜玫瑰香、柠檬苦杏仁味玫瑰花香甜玫瑰香、柠檬/水果香、蔷薇香//1 000 4 500 3 000 860/50 200/100// / / / 0 1.03 0.06 0.08/13.6 9.0/3.5// /// /500 0.85////350 0.04// / /200 000 10 000 100// / / 0 0 0.47// / / 3卷心菜、烤土豆、大蒜苹果、菠萝香味成熟水果香味强烈的水果香气,带梨的甜酸味/强烈的柑桔香气椰子香型香气柑橘木香果爵、奶油强烈酒香果味、脂肪/花果香气,肥皂风味青苹果,刺激的气味青草香味花香和香草味/薄荷味薄荷香气留兰香食醋酸味及刺激性气味不愉快的脂肪酸败味蚝奶油味花香青草式辛辣味芳香和木质香4/ / / / / / /// / / / / / / / / / /香脂柑橘香芳香/柠檬香气//100 160 0.93 0.2辛辣味、水果味辛辣而微苦果香味、木香木香、青草香含量/(μg·L-1)荔枝果汁 荔枝果酒0.08 325.10 281.90 118.00 38.72 19.10-380.40 342.00-- - - -50.10-250.00 17.33 54.22 110.61 0.033 9.63-- - -21.80 6.00 54.91 41.32 32.71 19.51 14.52 180.53 10.25-38.32 17.21 16.73 47.44 23.11 13.63 14.52 11.93 8.22 12.21 1 141.95-466.40 20.70 20.30 14.40 0.13 4 655.20 174.60 70.30-681.21 1 797.22-355.13 28.14 133.14 67.32 426.11 3 159.12-15.22-- - -380.74 68.75 46.84 16.83--94.82—— - -368.53 149.92-189.31 60.71 33.91 92.93 80.22
气味活度值(odor activity value,OAV)为待测化合物的质量浓度与该物质嗅觉阈值的比值,一般认为OAV>1是关键香气化合物。 基于OAV>1荔枝果酒发酵前后样品中共筛选出8种关键风味物质(OAV>1)。
由表6可知,高级醇类在发酵后显著增加,其中异戊醇从148.62 μg/L升至4 764.81 μg/L,苯乙醇从38.72 μg/L升至1 141.95 μg/L,D-香茅醇从325.10 μg/L升至380.40 μg/L。这些高级醇不仅为果酒增添了复杂的果香和花香,还提升了酒体的层次感[21]。CHYAU C C等[22]研究表明,D-香叶醇是对荔枝特征风味起关键作用的物质。
由表6可知,酯类物质在发酵过程中从7种增加至10种,关键酯类物质(OAV>1)如乙酸乙酯、辛酸乙酯和癸酸乙酯的质量浓度显著提升。乙酸乙酯从50.10μg/L增至4655.20μg/L,赋予果酒清新的果香;辛酸乙酯和癸酸乙酯分别带来了柑橘和椰子的香气[23]。这些酯类物质显著提高了荔枝果酒的整体感官表现和品质。此外,发酵后保留的玫瑰醚等芳香化合物进一步增强了荔枝果酒的花香层次。通过OAV分析,确定了异戊醇、异丁醇、D-香茅醇、苯乙醇、乙酸乙酯、辛酸乙酯、癸酸乙酯等是荔枝果酒中的关键酯类成分(OAV>1)。
2.5.3 非挥发性代谢物分析
(1)非挥发性代谢物鉴定结果
在阳离子模式下检测到了697种代谢物,在阴离子模式下检测到了485种代谢物,将代谢物在HMDB数据库进行注释,荔枝果酒中共注释952种非挥发性代谢物,结果见图8。 由图8可知,所有代谢物可以分为11类,其中有机酸及其衍生物含量最多,共有264种,占总鉴定物含量的28%,其次有机酸及其衍生物,占总代谢物含量的22%,有机杂环化合物占比为14%,有机氧化物占比为14%,苯丙素类和多酮类化合物占比为10%,苯类化合物占比为7%,核苷及类似物占比为3%,生物碱及其衍生物占比为1%。此外还发现代谢产物中具有降血糖和降血脂的葫芦巴碱[24]及可以促进细胞体内的生成、捕获自由基、具有抗氧化的生理功能的L-苹果酸[25]等。
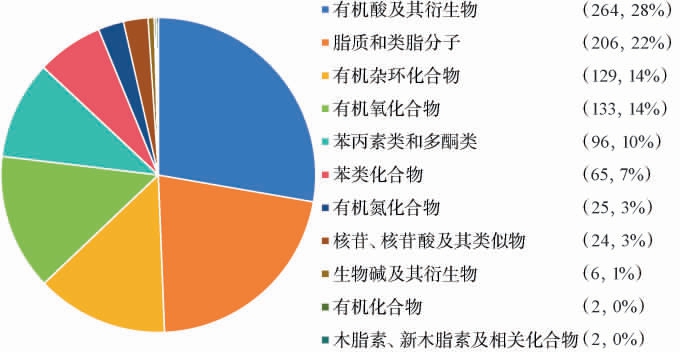
图8 荔枝果酒非挥发性代谢物种类及占比
Fig.8 Types and proportion of non-volatile metabolites of litchi fruit wine
(2)非挥发性代谢物差异火山图
在对荔枝果酒发酵前后非挥发性代谢物的差异分析中,差异火山图提供了一种直观的方式来展示代谢物表达量的变化差异,从而便于后续分析中挖掘和筛选出具有生物学意义的差异代谢产物。采用VIP≥1和P<0.05筛选得到544种关键差异代谢物,荔枝果酒发酵前后关键差异代谢物分析火山图见图9。由图9a可知,在阳离子模式下筛选到290种关键差异代谢物,其中上调的关键差异代谢物有180个,其中,4-氨基丁酸乙酯[26]的代谢通路与氨基酸生物合成有关,通常具有水果或花香的气味,可为果酒的香气增加复杂度;下调的关键差异代谢物有110个。由图9b可知,在阴离子模式下筛选到254种关键差异代谢物,其中上调的关键差异代谢物有154个,其中苯乙酸[27]的代谢通路与氨基酸代谢相关,通常呈现出类似蜂蜜的甜美香气,下调的关键差异代谢物有100个。
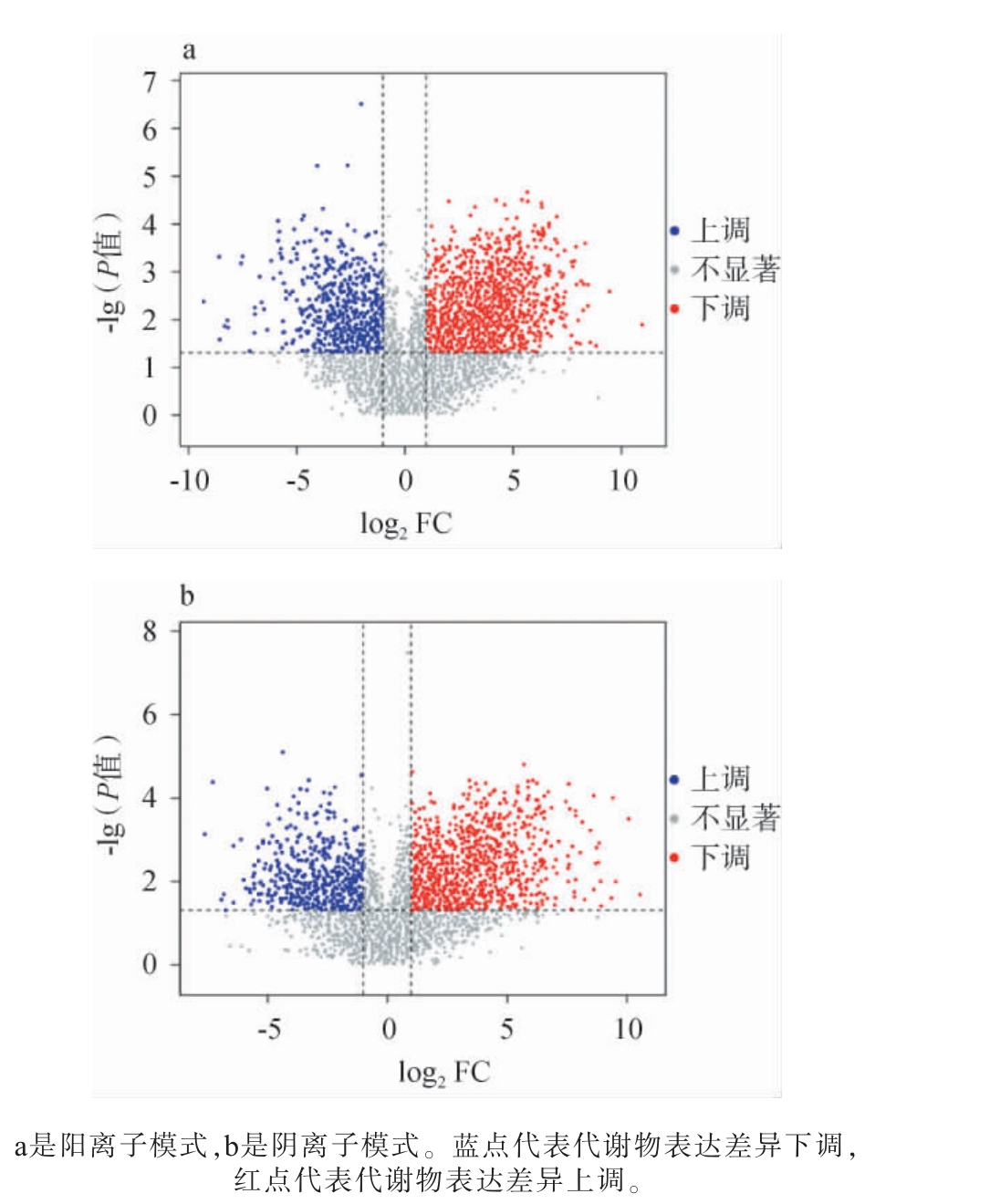
图9 荔枝果酒发酵前后关键差异代谢物火山图
Fig.9 Volcanic diagram of key differential metabolites between litchi fruit wine before and after fermentation
(3)KEGG代谢通路分析
通过对关键差异代谢物进行KEGG通路富集分析,结果见图10。由图10可知,前20个重要通路为氨基酸的生物合成(biosynthesis of amino acids)、嘌呤代谢(purine metabolism)、氨酰基-tRNA生物合成(aminoacyl-tRNA biosynthesis)、ABC转运蛋白(ABC-binding cassette transporter proteins)、D-氨基酸代谢(D-amino acid metabolism)、玉米素生物合成(zeatin biosynthesis)、精氨酸和脯氨酸代谢(arginine and proline metabolism)、精氨酸生物合成(arginine biosynthesis)、亚油酸代谢(linoleic acid metabolism)、嘧啶代谢(pyrimidine metabolism)、植物激素信号转导(plant hormone signal transduction)、咖啡因代谢(caffeine metabolism)、代谢途径(metabolic pathways)、单萜类生物合成(monoterpenoid biosynthesis)、半胱氨酸和蛋氨酸代谢(cysteine and methionine metabolism)、莨菪烷、哌啶和吡啶生物碱生物合成(tropane,piperidine and pyridine alkaloid biosynthesis)、类黄酮生物合成(flavonoid biosynthesis)、花生四烯酸代谢(arachidonic acid metabolism)、单环酰胺生物合成(monobactam biosynthesis)、缬氨酸、亮氨酸和异亮氨酸降解(valine,leucine and isoleucine degradation);其中蓝色代表新陈代谢通路,红色代表遗传信息通路,绿色代表环境信息通路;氨基酸的生物合成、嘌呤代谢、氨酰基-tRNA 生物合成、ABC转运蛋白、D-氨基酸代谢,这5条代谢通路显著,富集的化合物数量分别为128个、101个、51个、138个、69个。 氨基酸代谢在荔枝果酒发酵过程中发挥重要作用,其代谢产物可转化为香叶醇等多种特征性香气化合物,是果酒香气形成的关键途径[28]。
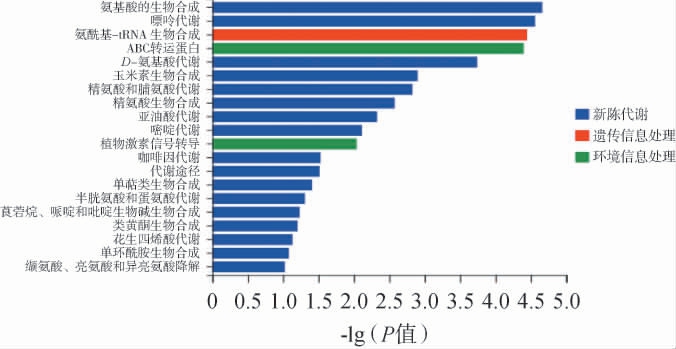
图10 关键差异代谢物KEGG代谢通路富集结果
Fig.10 KEGG metabolic pathways enrichment results of key differential metabolites
本研究通过优化荔枝果酒的发酵工艺,解析其发酵过程中挥发性风味物质和非挥发性代谢物的变化。研究表明,最佳的发酵条件为:发酵温度28 ℃,酵母接种量2.5%,初始pH值5.0,初始还原糖含量为180 g/L。 在此优化条件下制备的荔枝果酒,酒精度达到15.64%vol,感官评分高达92.0分。挥发性风味物质的分析结果显示,荔枝果酒发酵前后共检出56种挥发性风味物质。通过正交偏最小二乘-判别分析(OPLS-DA)构建了模型,并筛选出544种关键差异代谢物,其中334种上调,210种下调。 代谢通路分析显示,葫芦巴碱和L-苹果酸等代谢物在发酵后显著富集,且具有潜在的保健功能。 此外,氨基酸生物合成途径在荔枝果酒特征风味的形成中发挥了重要作用。本研究为荔枝果酒生产工艺优化供了理论依据,也为果酒风味提升和健康功效的研究提供了新思路。
[1]HE M Y, GE Z X, HONG M, et al.Alleviation of pericarp browning in harvested litchi fruit by synephrine hydrochloride in relation to membrane lipids metabolism[J].Postharvest Biol Tec,2020,166:111223.
[2]CAO H,BAI M,LOU Y,et al.Optimization of the brewing process and analysis of antioxidant activity and flavor of elderberry wine[J].Fermentation,2023,9(3):276-281.
[3]DELLACASSA E, TRENCHS O, FARINA L, et al.Pineapple (Ananas comosus L.Merr.)wine production in Angola:Characterisation of volatile aroma compounds and yeast native flora[J].Int J Food Microbiol,2017,241(12):161-167.
[4]韩保林,张淑凡,邹玉锋,等.低醇桑葚酒酵母的筛选及果酒发酵工艺优化[J].中国酿造,2024,43(9):170-176.
[5]曾朝珍,慕钰文,袁晶,等.不同发酵温度对苹果酒理化性质及香气成分的影响[J].中国酿造,2023,42(12):192-197.
[6]龚诗媚,邓雅妮,张曼,等.贝氏酵母发酵过程中荔枝果酒的挥发性风味成分变化[J].食品与发酵工业,2022,48(19):236-241.
[7]唐忠盛.荔枝酒加工过程中香气成分变化规律及特征香气研究[D].广州:华南理工大学,2019.
[8]CHEN D, LIU S Q.Chemical and volatile composition of lychee wines fermented with four commercial Saccharomyces cerevisiae yeast strains[J].Int J Food Sci Technol,2014,49(2):521-530.
[9]ZHAO L,WANG K,WANG K,et al.Nutrient components,health benefits,and safety of litchi(Litchi chinensis Sonn.):A review[J].Compr Rev Food Sci Food Saf,2020,19(4):2139-2163.
[10]袁英豪,何梦娇,唐春麟,等.醋源生香酵母的筛选及其特性研究[J].食品与发酵工业,2024,50(15):63-71.
[11]秦献泉,李鸿莉,李冬波,等.基于模糊综合评判法的荔枝酒感官评价研究[J].西南农业学报,2016,29(6):1443-1447.
[12]张桂容.四川晒醋固态发酵过程中真菌群落结构演替与风味形成途径解析[D].宜宾:四川轻化工大学,2022.
[13]汪琪,高雁,薛娟娟,等.LC-MS非靶向代谢组学分析3种不同生产原料波杂发酵饮品的代谢差异[J/OL].食品科学,1-21[2025-03-25].http://kns.cnki.net/kcms/detail/11.2206.ts.20240821.1456.049.html.
[14]STEENSELS J, DAENEN L, MALCORPS P, et al.Brettanomyces yeasts-From spoilage organisms to valuable contributors to industrial fermentations[J].Int J Food Sci Technol,2015,206:24-38.
[15]ZHENG C,HOU S,ZHOU Y,et al.Regulation of the PFK1 gene on the interspecies microbial competition behavior of Saccharomyces cerevisiae[J].Appl Microbiol Biot,2024,108(1):272-275.
[16]RIBEIRO R A, BOURBON-MELO N, SA-CORREIA I, et al.The cell wall and the response and tolerance to stresses of biotechnological relevance in yeasts[J].Front Microbiol,2022,13(4):453-479.
[17]王猛强,周飘苹,黄文文,等.不同蛋白质水平下葡萄糖添加水平对大黄鱼生长性能、糖酵解和糖异生关键酶活性的影响[J].动物营养学报,2015,27(8):2431-2442.
[18]HO C W,LAZIM A,FAZRY S,et al.Alcoholic fermentation of soursop(Annona muricata)juice via an alternative fermentation technique[J].J Sci Food Agr,2020,100(3):1012-1021.
[19]LEGUA P,MODICA G,PORRAS I,et al.Bioactive compounds,antioxidant activity and fruit quality evaluation of eleven blood orange cultivars[J].J Sci Food Agr,2022,102(7):2960-2971.
[20]SAHIN A W, RICE T, ZANNINI E, et al.Leuconostoc citreum tr116:In-situ production of mannitol in sourdough and its application to reduce sugar in burger buns[J].Int J Food Microbiol,2019,56(2):80-89.
[21]怀欲晓,孙泽荟,李文,等.菠萝百香果复合低醇果酒发酵工艺及香气成分分析[J].酿酒,2024,51(3):87-92.
[22]CHYAU C C,KO P T,CHANG C H,et al.Free and glycosidically bound aroma compounds in lychee (Litchi chinensis Sonn.) [J].Food Chem,2003,80(3):387-392.
[23]唐忠盛.荔枝酒加工过程中香气成分变化规律及特征香气研究[D].广州:华南理工大学,2019.
[24]张艳红,王柯静,李丽娟,等.葫芦巴碱对妊娠期糖尿病大鼠血脂代谢及胰岛素抵抗的影响[J].中国比较医学杂志,2023,33(8):68-74.
[25]盛明俊,詹凯,马龙.L-苹果酸的生产方法、生理功能及其应用[J].安徽农学通报,2024,30(1):82-87.
[26]SHELP B J,BOWN A W,ZAREI A.4-Aminobutyrate(GABA):a metabolite and signal with practical significance[J].Botany,2017,95(11):1015-1032.
[27]CAMPO E,SAENZ-NAVAJAS M P,CACHO J,et al.Consumer rejection threshold of ethyl phenylacetate and phenylacetic acid,compounds responsible for the sweet-like off odour in wines made from sour rotten grapes[J].Aust J Grape Wine Res,2012,18(3):280-286.
[28]张会,郭磊,王军民,等.GC-MS用于花果香气成分研究进展[J].食品研究与开发,2020,41(5):213-219.