Characteristics and influencing factors of solid-state fermentation of Rhizopus delemar
酿酒技术在我国有着数千年的发展历史,早在秦汉时期古人便发明了先富集微生物再发酵产酒的酿酒方法[1],但由于科学技术的局限,直至现代随着高通量测序技术与生物信息学的快速发展,一些微生物在酿酒过程中的作用规律才被发现,其中根霉属(Rhizopus)微生物被普遍报道,WANG B等[2]通过宏蛋白质组学技术发现在白酒发酵过程中约80%的碳水化合物水解酶由酒曲提供,而这些酶主要来自曲霉属和根霉属的微生物,它们产生的糖化酶还与白酒的产量呈正相关。 LIU Y等[3]研究发现,根霉属微生物是中高温大曲和高温大曲中的优势微生物,通过相关性分析发现,根霉属微生物与大曲中的2,4-二甲基-3-异丁基磷酸酯等4种酯类挥发性风味物质呈显著正相关,与苯乙醇等4种醇类挥发性风味物质呈显著负相关。LI Z等[4]研究了7个不同产区的成品浓香型大曲,结果发现根霉属微生物与大曲中的3-辛烯-2-酮和己醛呈显著正相关,与苯甲醇、苯甲醛和2,5-二甲基吡嗪呈显著负相关,并通过冗余分析发现根霉属微生物与水分、淀粉含量和发酵力呈负相关。 而LIU S等[5]研究发现,在大曲的生产过程中真菌群落与温度、水分和氨基酸态氮呈显著正相关。 BAN S等[6]研究发现,水分和温度是显著影响大曲微生物的理化因素,并通过构建数学模型得出水分对根霉属微生物有显著影响。
戴尔根霉(Rhizopus delemar)繁殖能力强,广泛分布于粮食与土壤中[7-8],在白酒的发酵剂大曲和小曲中均有被发现[9-10],它对纤维素、淀粉等多糖物质有较强的分解能力,实验证明其分泌的糖化酶也较为安全[11],戴尔根霉也常被用于生产延胡索酸和苹果酸[12-13],但对其发酵规律的研究较少。本研究选择一株从浓香型大曲中分离到的戴尔根霉(Rhizopus delemar)作为研究对象,进行可培养实验,并使用小麦为固态发酵培养基,灭菌后接种戴尔根霉,研究培养基温度和水分对戴尔根霉生长繁殖、糖化酶活力及产挥发性风味物质的影响,并利用正交偏最小二乘法判别分析(orthogonalpartialleastsquares-discriminantanalysis,OPLS-DA)构建模型,基于变量重要性投影(variable importance in the projection,VIP)值与方差分析P值筛选关键差异挥发性风味物质(VIP>1,P<0.05),旨在为戴尔根霉的培养提供最优温度和水分条件,为戴尔根霉的实践应用提供风味方面的参考。
1.1.1 材料
小麦(产地四川宜宾):市售;戴尔根霉(Rhizopus delemar):本实验室保存。
1.1.2 试剂
葡萄糖(分析纯):天津致远化学试剂有限公司;可溶性淀粉(生化试剂)、冰乙酸、无水乙酸钠、硫酸铜、氢氧化钠、氯化钠、酒石酸钾钠(均为分析纯):成都科隆化学试剂有限公司。
1.1.3 培养基
马铃薯液体培养基、马铃薯葡萄糖琼脂培养基:青岛海博生物技术有限公司。
固态发酵培养基:用小麦质量7%~9%的水浸润小麦2 h,随后粉碎至烂皮而不烂心的程度作为固态发酵培养基的原料,每份称取500 g置于瓷盘中,使用8层纱布包裹,121 ℃湿热灭菌20 min。
7890A/5975B气相色谱-质谱联用(gas chromatographymass spectrography,GC-MS)仪:美国Agilent公司;57330-U萃取头:美国Supelco公司;T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司。
1.3.1 戴尔根霉孢子悬液的制备
将本实验室保存的已分离鉴定的戴尔根霉菌种接种至已灭菌装液量为100 mL/250 mL马铃薯液体培养基中,在30 ℃、100 r/min条件下振荡培养2 d,随后接种至马铃薯葡萄糖琼脂培养基斜面上,在30 ℃条件下恒温培养2 d,再将斜面上的菌株接种至马铃薯葡萄糖琼脂固体培养基上,在30 ℃条件下恒温培养2d,使用5mL无菌生理盐水多次冲洗刮取菌丝至无菌离心管中,再加入20 mL无菌生理盐水5 000 r/min离心5 min,并弃除上清液,重复3次,最后使用无菌生理盐水稀释,得到戴尔根霉孢子悬液并测定其孢子数量。
1.3.2 水分和温度对戴尔根霉生长代谢的影响实验
使用上述制备好的小麦固态发酵培养基和孢子悬液,每份培养基加入其质量10%的孢子悬液,空白对照组加入等量生理盐水,混合均匀,发酵4 d。 分别考察水分含量为30%、发酵温度(25 ℃,30 ℃,35 ℃,40 ℃)及发酵温度为30 ℃、水分(30%,35%,40%,45%)对戴尔根霉生长代谢(孢子数量)的影响,每个变量均做3个平行,分别在第1、2和4天进行取样。
1.3.3 分析检测
(1)水分
参考国标GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中的直接干燥法。
(2)糖化酶活力
采用菲林法检测[14]。 糖化酶酶活的定义为:1 g样品在pH 4.6、35 ℃条件下反应1 h,将可溶性淀粉分解产生1 mg葡萄糖所需的酶量为一个酶活力单位(U/g)。
(3)戴尔根霉孢子数量
采用分光光度计[15]测定戴尔根霉在不同生长条件、不同稀释倍数下孢子悬液的OD600nm值,对比血球板计数法得到的孢子悬液浓度(孢子数量)。
(4)挥发性风味物质检测
采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)-气相色谱-质谱联用(GC-MS)法。
样品前处理[16]:称取4 g样品加入1%无菌氯化钙10 mL,在4 ℃下浸泡10 h,130 W超声30 min后在4 ℃、10 000×g条件下离心20 min,取5 mL上清液、20 μL内标乙酸戊酯(1.0512 g/L)和1.5 g氯化钠加入20 mL顶空瓶中。将顶空瓶放在50 ℃下平衡5 min后插入萃取头(50/30 μm DVB/CAR/PDMS),在60 ℃水浴中吸附45 min。GC-MS进样口250 ℃条件下解吸5 min,进行GC-MS分析。
GC条件:使用Agilent 122-7062 DB-WAX色谱柱(60 m×250 μm×0.25 μm),以高纯度氦气(He)为载气,恒流量为1.0 mL/min,升温程序为初始温度保持在45 ℃,3 min后以4℃/min提高到150℃,保持2min,再以6℃/min提高到200℃,最后以10 ℃/min提高到230 ℃,保持10 min。以不分流模式进样。
MS条件:电子电离(electronic ionization,EI)源,电子能量为70 eV,离子源温度为230 ℃,质谱接口温度为250 ℃,扫描方式为全扫描,质量扫描范围为35~400 amu。
定性定量方法:将质谱数据采用美国国家标准技术研究所(National Institute of Standards and Technology,NIST)05质谱库比对,仅保留匹配度>70%的物质,根据各化合物的保留指数(retention index,RI)定性;采用内标法定量。挥发性风味物质含量计算公式如下:
1.3.4 数据处理与统计分析
使用IBM SPSS Statistics 20.0软件进行单因素方差分析(one-way analysis of variance,ANOVA)、邓肯检验和T检验(Student's t-test,T)计算样品间显著性(P<0.05);Origin 2024软件进行折线图的绘制;Simca14.1软件对挥发性风味物质进行正交偏最小二乘法判别分析(OPLS-DA);联川云绘图工具(https://www.omicstudio.cn/tool)对挥发性风味物质聚类分析热图、韦恩图、堆叠柱状图和倍数变化(fold change,FC)柱状图的绘制,ChiPlot云平台(https://www.chiplot.online/)进行堆叠柱状图的绘制。
由图1A可知,在尽量接近固态发酵的水分含量范围内,戴尔根霉孢子数量随着水分含量的上升而增加,在整个发酵过程中水分含量为45%时的戴尔根霉孢子数量均为最大值。 发酵0~1 d时,不同水分造成孢子数量的影响最为显著(P<0.05),随着发酵的进行,培养基水分含量分别为30%、35%、40%、45%时,戴尔根霉孢子数量整体呈现快速上升后缓慢下降的趋势,均在第2天达到最大值,分别为29.76×106个/g、27.68×106个/g、37.67×106个/g和57.45×106个/g,在发酵后期不同水分造成孢子数量的差异逐渐减小。较高的水分有利于戴尔根霉孢子的增殖,这是因为水是生化反应的溶剂,缺水时代谢受阻,孢子的萌发也需要吸收水分[17]。水分对戴尔根霉固态发酵前期的孢子数量影响明显,但发酵后期差异不大。 结果表明,水分含量为45%时有利于戴尔根霉孢子增殖。
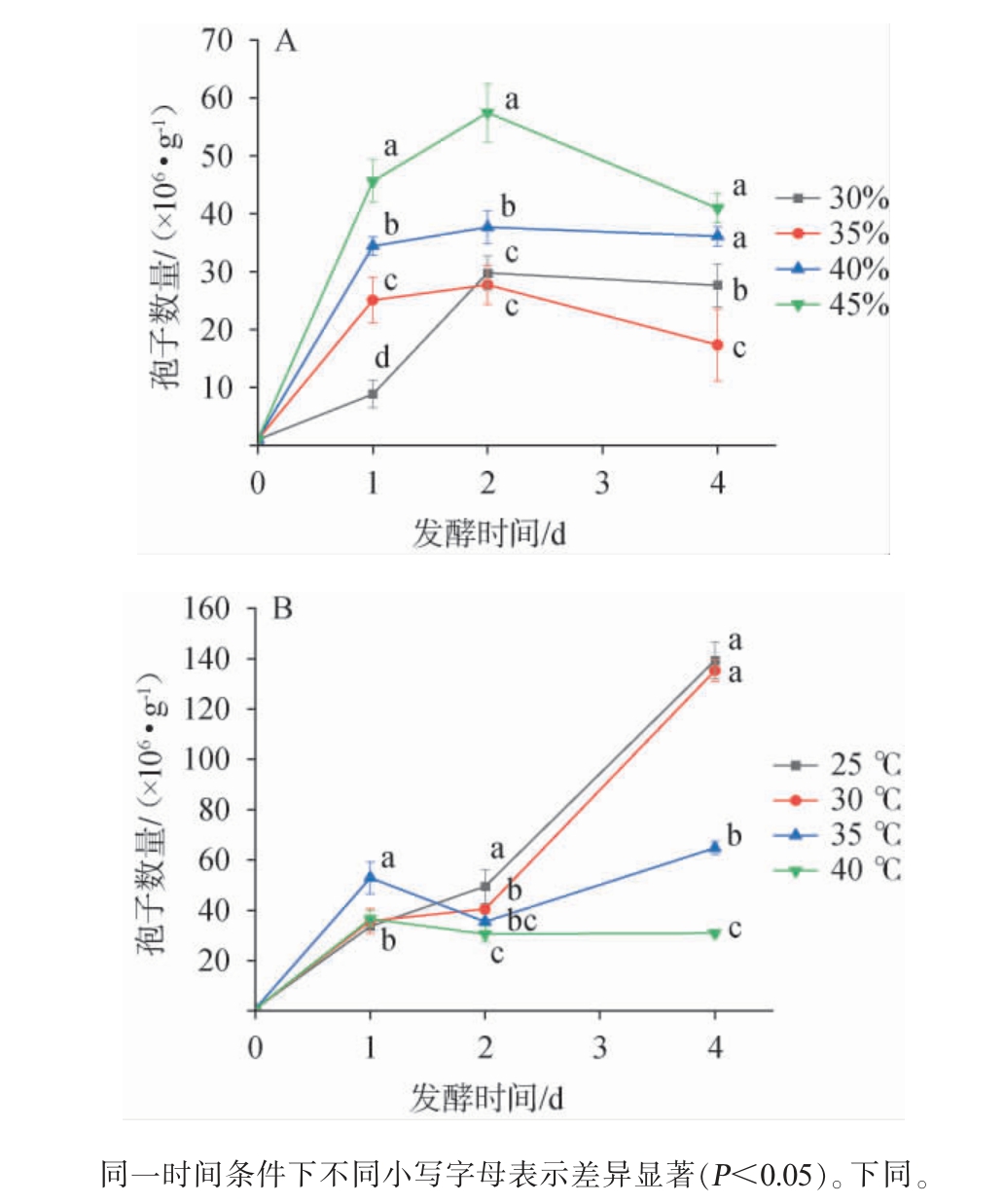
图1 固态发酵条件下水分(A)和温度(B)对戴尔根霉孢子繁殖的影响
Fig.1 Effects of moisture (A) and temperature (B) on the propagation of Rhizopus delemar spore under solid-state fermentation conditions
由图1B可知,温度对戴尔根霉固态发酵前期孢子增殖的影响不大,仅35 ℃条件的孢子数量显著最高(P<0.05),随着发酵的进行,不同温度造成的孢子数量差异逐渐显著。 25 ℃条件下孢子数量最高,为(139.28±5.94)×106个/g,25 ℃和30 ℃的戴尔根霉孢子数量显著高于其他温度条件(P<0.05)。整个发酵过程中,不同温度条件下戴尔根霉孢子增殖趋势也有较大差异,这可能是因为微生物的生长繁殖受多种酶的调控,而酶活力受到温度的影响[18],此外孢子的萌发也受温度的影响[19]。 结果表明,温度25 ℃对戴尔根霉孢子繁殖最有利。
由图2A可知,在维持固态发酵的情况下,戴尔根霉的糖化酶活力也随着水分含量的上升而增加,整个发酵过程中水分为45%时的糖化酶活力均为最大值。发酵0~1 d时,不同水分造成的糖化酶活力影响最为显著(P<0.05),不同水分的糖化酶活力整体呈现快速上升后缓慢上升的趋势。水分对戴尔根霉固态发酵整个过程中的糖化酶活力都有重要的影响,在维持培养基固态的情况下水分越高糖化酶活力越高。这可能是因为多糖的分解是需要水的[20],增加水分促进了戴尔根霉对糖类的利用。结果表明,水分含量为45%时对戴尔根霉产糖化酶最有利。 由图2B可知,25 ℃时糖化酶活力在第1天达到最大值,后续快速下降,40 ℃时糖化酶活力在第2天达到最大值,后续快速下降至接近25 ℃,35 ℃时糖化酶活力在第1天达到最大值后续缓慢下降,仅30 ℃时糖化酶活力持续上升。 这可能是因为温度能显著影响糖化酶活性[21],30 ℃时戴尔根霉能更好利用碳源和氮源源繁殖产孢子[22]。 结果表明,温度为30 ℃时对戴尔根霉产糖化酶最有利。
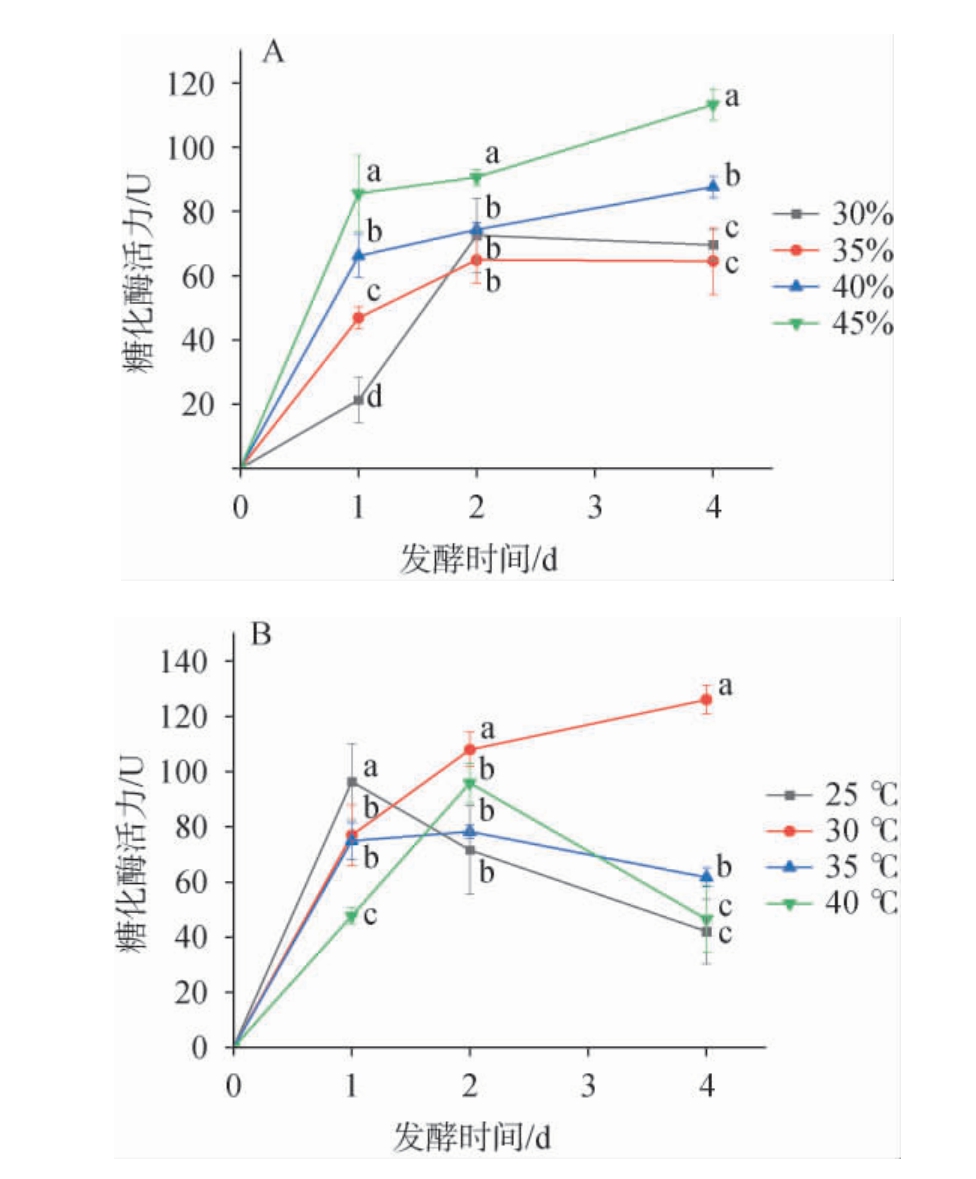
图2 固态发酵条件下水分(A)和温度(B)对戴尔根霉产糖化酶活力的影响
Fig.2 Effects of moisture (A) and temperature (B) on the activities of glucoamylase produced by Rhizopus delemar under solidstate fermentation conditions
2.3.1 培养基水分对戴尔根霉产挥发性风味物质的影响
由图3a可知,水分含量为30%时共检测出25种挥发性风味物质,包括10种醇类、2种醛类、8种酯类、1种吡嗪类、2种芳香族化合物和2种烃类;水分含量35%时共检测出23种挥发性风味物质,包括8种醇类、9种酯类、1种吡嗪类、4种芳香族化合物和1种烃类;水分含量40%时共检测出25种挥发性风味物质,包括11种醇类、8种酯类、1种吡嗪类、3种芳香族化合物和2种烃类;水分含量45%时共检测出22种挥发性风味物质,包括10种醇类、5种酯类、1种吡嗪类、1种芳香族化合物、4种烃类和1种其他类。由图3b可知,水分含量在30%~40%时,挥发性风味物质含量差异不大,水分含量为30%时,醇类占77.6%、醛类占0.5%、酯类占20.0%、吡嗪类占0.08%、芳香族化合物占1.34%、烃类占0.4%;水分含量为35%时,醇类占81.6%、酯类占16.2%、吡嗪类占0.09%、芳香族化合物占2.01%、烃类占0.15%;水分含量为40%时,醇类占83.1%、酯类占15.6%、吡嗪占0.06%、芳香族占1.01%、烃类占0.21%;水分含量为45%时,挥发性风味物质总量最低,其中醇类占89.3%、酯类占10.1%、吡嗪类占0.05%、芳香族化合物占0.14%、烃类占0.21%、其他类占0.24%。 结果表明,水分含量为30%时最利于积累挥发性风味物质。
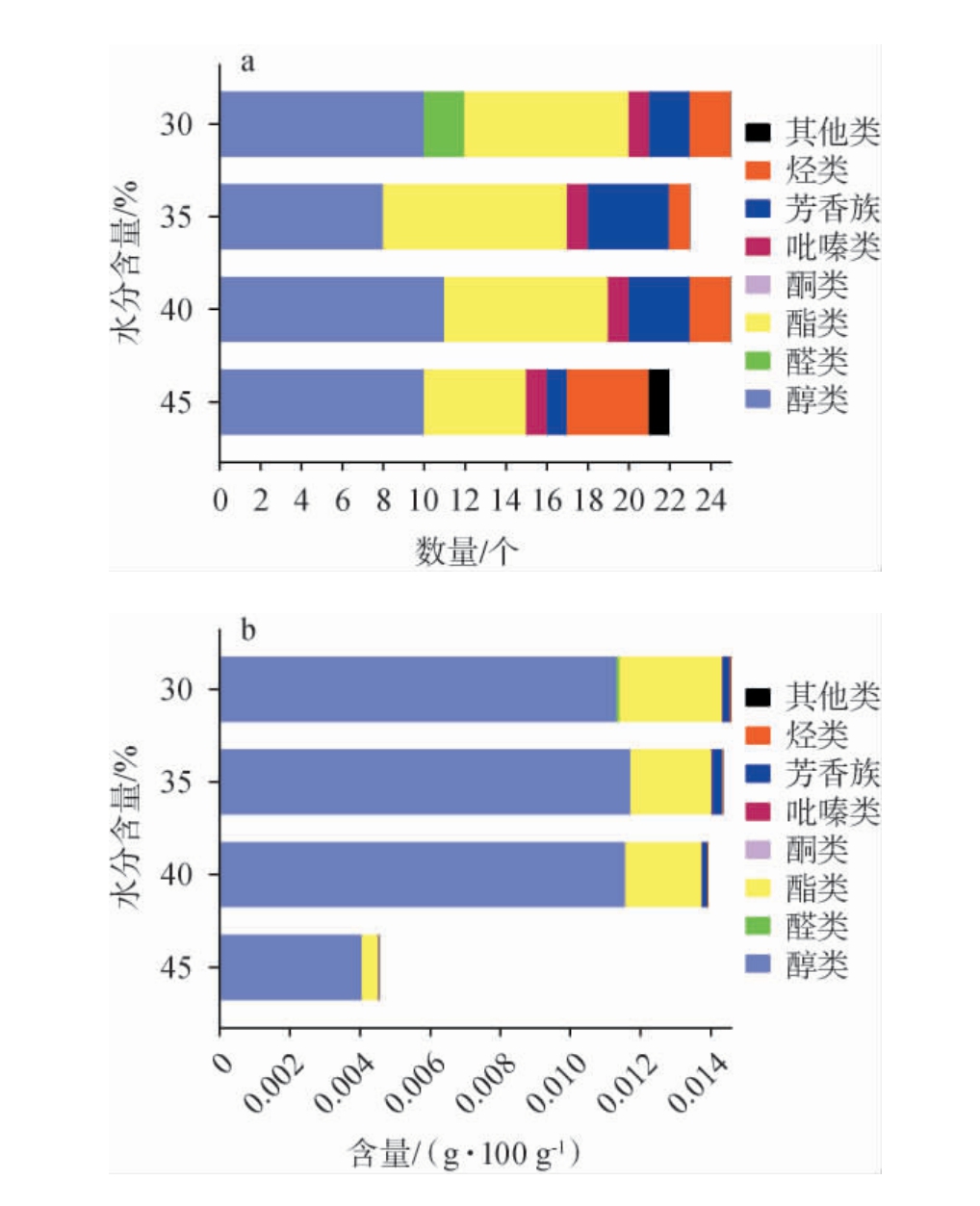
图3 固态发酵条件下水分对戴尔根霉产各类别挥发性风味物质数量(a)及含量(b)的影响
Fig.3 Effects of moisture on quantities (a) and contents (b) of various categories volatile flavor components produced by Rhizopus delemar under solid-state fermentation conditions
2.3.2 培养基温度对戴尔根霉产挥发性风味物质的影响
由图4a可知,温度为25 ℃时共检测出25种挥发性风味物质,包括10种醇类、7种酯类、1种吡嗪类、5种芳香族化合物、1种烃类和1种其他类;温度30 ℃时共检测出20种挥发性风味物质,包括8种醇类、6种酯类、1种吡嗪类和5种芳香族化合物;温度35 ℃时共检测到23种挥发性风味物质,包括9种醇类、8种酯类、1种酮类、1种吡嗪类和4种芳香族化合物;温度40 ℃时共检测出25种挥发性风味物质,包括10种醇类、6种酯类、1种吡嗪类、6种芳香族化合物、1种烃类和1种其他类。由图4b可知,40 ℃时检测出的挥发性风味物质含量最高,其中醇类占79.6%、酯类占15.1%、吡嗪类占0.06%、芳香族化合物占4.6%、烃类占0.27%、其他类占0.38%。30 ℃与35 ℃时检测到的挥发性风味物质含量最少,30 ℃时醇类占87.9%、酯类占8.94%、吡嗪类占0.08%、芳香族化合物占3.11%;35 ℃时醇类占84.2%,酯类占13.9%、酮类占0.44%、吡嗪类占0.09%、芳香族化合物占1.35%。 结果表明,温度为40 ℃时最利于积累挥发性风味物质。
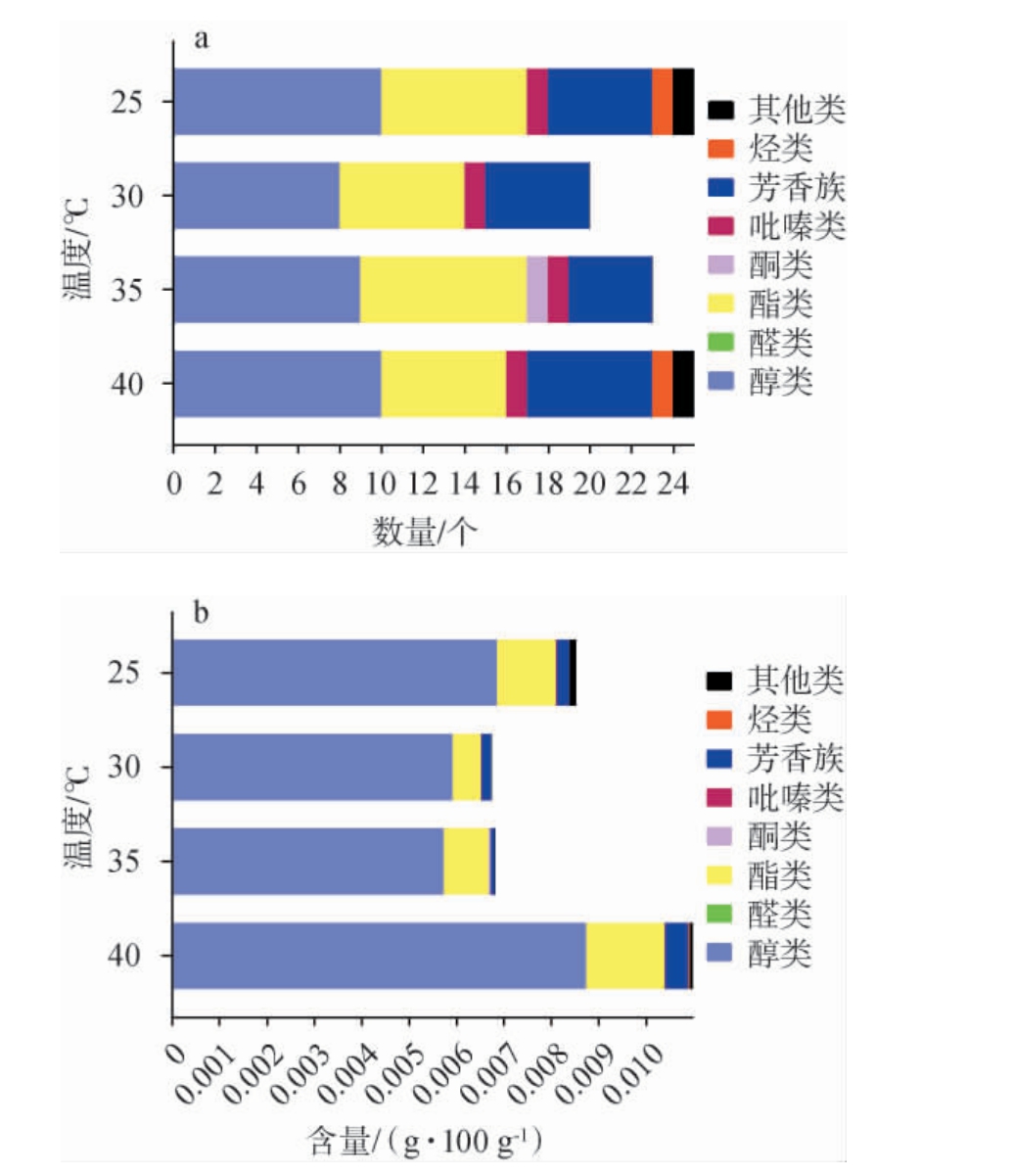
图4 固态发酵条件下温度对戴尔根霉产各类别挥发性风味物质数量(a)及含量(b)的影响
Fig.4 Effects of temperature on quantities (a) and contents (b) of various categories volatile flavor components produced by Rhizopus delemar under solid-state fermentation conditions
戴尔根霉在不同水分及温度条件下产挥发性风味物质聚类分析结果见图5。 由图5可知,实验组和对照组共检测出64种挥发性风味物质,其中实验组独有化合物44种,对照组独有化合物8种,实验组和对照组共有化合物12种。实验组挥发性风味物质种类更多,其中部分醇类、酯类含量明显更高,醇类能表现出果香、花香和青草香气,酯类也与水果的香气描述、甜味和花香有关[23]。而乙酸庚酯、苯甲醛等物质含量明显下降,这些可能是小麦自身合成的物质,可见戴尔根霉会生成新的挥发性风味物质,同时也会促进固有风味物质的转化。
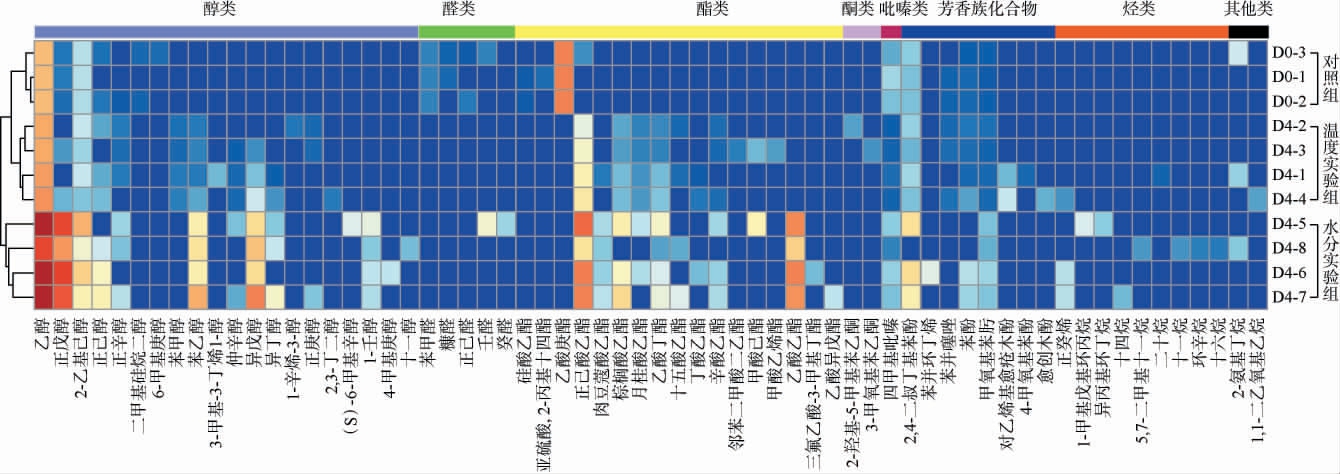
图5 固态发酵条件下戴尔根霉产挥发性风味物质聚类分析
Fig.5 Cluster analysis of volatile flavor components produced by Rhizopus delemar under solid-state fermentation conditions
颜色越蓝代表含量越低,越红代表含量越高。
为筛选戴尔根霉固态发酵前后差异风味物质,进一步对检测到的所有挥发性风味物质进行解析。使用正交偏最小二乘判别分析(OPLS-DA)构建模型,利用变量重要性投影(VIP)值,根据样品的正态性使用T检验或秩和检验(Rank Sum Test)判断每个物质在实验组与空白组之间的差异显著性(P<0.05)[24],将同时满足VIP值>1,差异显著(P<0.05)的物质筛选为关键差异挥发性风味物质[25]。基于挥发性风味物质正交偏最小二乘-判别分析,模型置换检验结果及变量重要性投影值见图6。
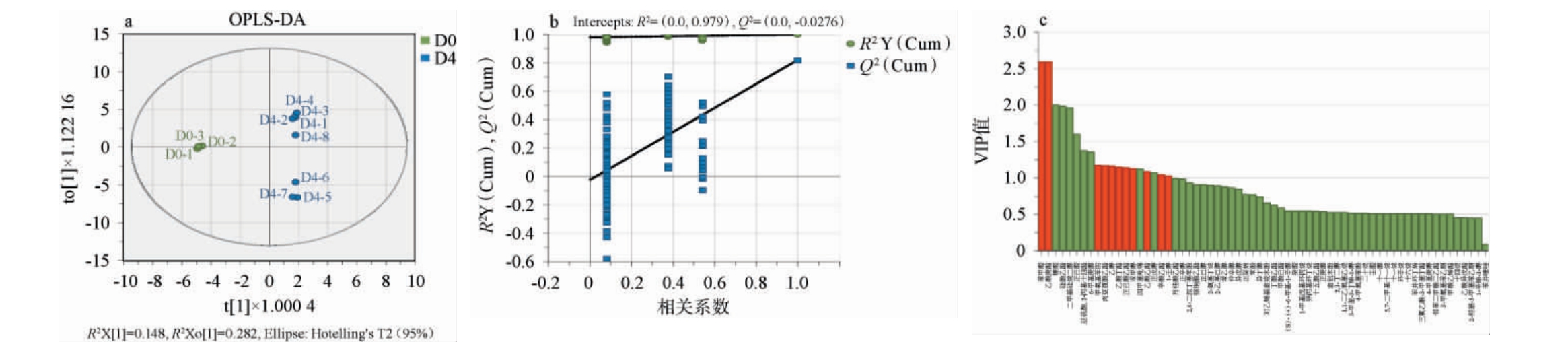
图6 挥发性风味物质正交偏最小二乘-判别分析(a)、200次置换检验结果(b)及变量重要性投影值(c)
Fig.6 Orthogonal partial least squares-discriminant analysis (a), 200 permutation test results (b) and variable importance in the projection values (c) of volatile flavor components
由图6a可知,对照组点位与实验组点位能明显区分,且模型自变量解释率(R2X)>0.5,因变量解释率(R2Y)与预测能力(Q2)均>0.8,说明模型拟合良好,模型验证有效。由图6b可知,OPLS-DA分析模型经200次置换检验后,(Q2)回归线与纵坐标交点均小于0,说明模型不存在过度拟合[26]。由图6c可知,依据变量重要性投影(VIP)值>1及P<0.05筛选出11种关键差异挥发性风味物质,其中苯甲醇和乙酸庚酯的含量显著下降,甲氧基苯肟、肉豆蔻酸乙酯、乙醇、乙酸丁酯、己酸乙酯、苯甲醇、乙酸乙酯、辛酸乙酯和1-壬醇的含量显著上升。其中乙酸乙酯对小曲清香型白酒的主体风味有着重要贡献[27],而HU Y等[28]研究发现,戴尔根霉是小曲制作过程中的5种核心微生物之一,这说明戴尔根霉有为小曲清香型白酒风味做出贡献的潜力。
本实验对戴尔根霉固态发酵特性及影响因素进行研究,探究了水分和温度对戴尔根霉孢子增殖量、糖化酶活力和挥发性风味物质生成的影响规律,并筛选了关键差异挥发性风味物质。研究发现,在维持固态发酵的情况下,水分含量为45%时有利于戴尔根霉孢子增殖、产糖化酶,25 ℃条件下孢子数量最高,为(139.28±5.94)×106个/g,30 ℃下糖化酶活性最高[(126.09±4.33)U/g],水分含量30%、温度40 ℃最利于积累挥发性风味物质,以醇类和酯类为主。 小麦基质接种戴尔根霉固态发酵后增加了36种挥发性风味物质,基于VIP>1且P<0.05,共筛选11种关键差异挥发性风味物质,即苯甲醇、乙酸庚酯、甲氧基苯肟、肉豆蔻酸乙酯、乙醇、乙酸丁酯、己酸乙酯、苯甲醇、乙酸乙酯、辛酸乙酯和1-壬醇。本研究通过解析戴尔根霉固态发酵特性能及影响因素,可为戴尔根霉的生产应用提供参考。
[1]LIU L,ZHANG Y,GE W,et al.Revealing the 2300-year-old fermented beverage in a bronze bottle from Shaanxi,China[J].Fermentation,2024,10(7):365.
[2]WANG B,WU Q,XU Y,et al.Synergistic effect of multiple saccharifying enzymes on alcoholic fermentation for Chinese Baijiu production[J].Appl Environ Microbiol,2020,86(8):e00013-20.
[3]LIU Y,LI X,LI H,et al.Taorong-type Baijiu starter: Analysis of fungal community and metabolic characteristics of middle-temperature Daqu and high-temperature Daqu[J].PloS One,2022,17(10):e0274881.
[4]LI Z,YAN X,ZOU S,et al.Analysis of fungal diversity,physicochemical properties and volatile organic compounds of strong-flavor Daqu from seven different areas[J].Foods,2024,13(8):1263.
[5]LIU S, ZHOU Y, MA D, et al.Environment microorganism and mature daqu powder shaped microbial community formation in mechanically strong-flavor Daqu[J].Food Biosci,2023,52:102467.
[6]BAN S,CHEN L,FU S,et al.Modelling and predicting population of core fungi through processing parameters in spontaneous starter(Daqu)fermentation[J].Int J Food Microbiol,2022,363:109493.
[7]梁锦鹏.一株具有促生作用的烤烟内生真菌的筛选及初步应用[D].雅安:四川农业大学,2023.
[8]HOTA S,ACHARY K G,SINGH S.Identification and molecular characterization of Rhizopus delemar from eastern ghats of state of India and its biotechnological applications[J].Geomicrobiol J,2024,41(4):429-439.
[9]HU Y,LEI X,ZHANG X,et al.Characteristics of the microbial community in the production of Chinese rice-flavor Baijiu and comparisons with the microflora of other flavors of Baijiu[J].Front Microbiol, 2021, 12:673670.
[10]牟飞燕,何夷敏,夏博宇,等.β-石竹烯产生菌的筛选和提取工艺优化[J].中国酿造,2024,43(4):91-97.
[11]EFSA Panel on Food Contact Materials, Enzymes and Processing Aids(CEP),LAMBRE C,BARAT B J M,et al.Safety evaluation of the food enzyme glucan-1,4-α-glucosidase from the non-genetically modified Rhizopus delemar strain CU634-1775[J].EFSA J,2023,21(2):e07841.
[12]孙婷,杨英,王华林,等.利用玉米芯水解液产苹果酸的戴尔根霉突变菌株选育及代谢分析[J].食品科学,2015,36(15):90-97.
[13]李硕,潘丽军,吴悦,等.戴尔根霉发酵麸皮酶解液制备富马酸的研究[J].菌物学报,2014,33(3):719-730.
[14]肖冬光.酿酒分析与检测[M].北京:中国轻工业出版社,2018:197-200.
[15]袁洪威,陈湖芳,高东民,等.分光光度法测定黑曲霉孢子浓度的研究[J].中国酿造,2017,36(4):122-126.
[16]YANG L,FAN W,XU Y.GC×GC-TOF/MS and UPLC-Q-TOF/MS based untargeted metabolomics coupled with physicochemical properties to reveal the characteristics of different type daqus for making soy sauce aroma and flavor type Baijiu[J].LWT-Food Sci Technol,2021,146:111416.
[17]CAO Q, LIANG Y, TIAN Y, et al.Survival dynamics of Trichoderma longibrachiatum Tr58 in conidia-and chlamydospore-amended soils with different moisture levels[J].Agriculture,2023,13(2):238.
[18]WAN X,LI X,SANG C,et al.Effect of organic matter manipulation on the seasonal variations in microbial composition and enzyme activities in a subtropical forest of China[J].J Soil Sediment, 2019, 19: 2231-2239.
[19]JI T,ALTIERI V,SALOTTI I,et al.Effects of temperature and moisture duration on spore germination of four fungi that cause grapevine trunk diseases[J].Plant Dis,2023,107(4):1005-1008.
[20]胡薇薇,顾俊超,杨开,等.多糖及其水解产物对谷物淀粉理化及消化特性的影响研究进展[J].中国食品学报,2024,24(9):486-496.
[21]范海月,于朝,张政洁,等.低转苷活性糖化酶GluM3的淀粉糖化工艺优化及淀粉颗粒的结构表征[J].食品工业科技,2025,46(3):204-212.
[22]ZHAO H,JU X,NIE Y,et al.High-throughput screening carbon and nitrogen sources to promote growth and sporulation in Rhizopus arrhizus[J].AMB Express,2024,14(1):76.
[23]TANG P,WANG L,LU J,et al.Characterization of key aroma compounds and relationship between aroma compounds and sensory attributes in different quality of high temperature Daqu[J].LWT-Food Sci Technol,2024,194:115801.
[24]张然,孙德鹏,田洪芸,等.山东地区成熟/未成熟洋槐蜂蜜中酚类物质比较[J].食品与发酵工业,2018,44(5):256-258.
[25]牛玉坤.基于物质基础变化探讨山茱萸炮制机理[D].石家庄:河北医科大学,2022.
[26]邵淑贤,徐梦婷,林燕萍,等.基于电子鼻与HS-SPME-GC-MS技术对不同产地黄观音乌龙茶香气差异分析[J].食品科学,2023,44(4):232-239.
[27]WANG H,WANG Y,RUAN Y,et al.Core microbes identification and synthetic microbiota construction for the production of Xiaoqu lightaroma Baijiu[J].Food Res Int,2024,183:114196.
[28]HU Y,YANG Q,CHEN D,et al.Study on microbial communities and higher alcohol formations in the fermentation of Chinese Xiaoqu Baijiu produced by traditional and new mechanical technologies[J].Food Res Int,2021,140:109876.