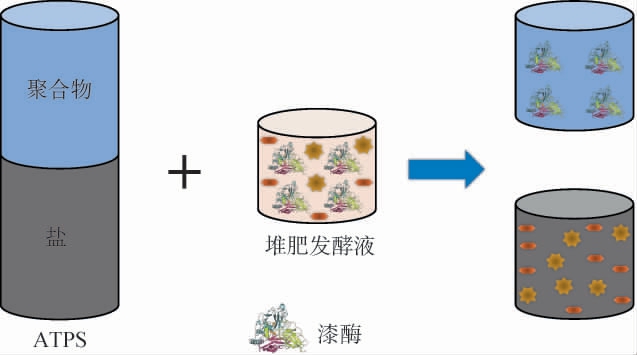
图1 水二相体系分离回收漆酶示意图
Fig.1 Schematic diagram of separation and recovery of laccase by aqueous two-phase system
Application of fungal laccase in food processing and wastewater treatment
真菌漆酶属于一类蓝色多铜氧化还原酶,可催化酚类和非酚类化合物的单电子转移[1]。该类酶的分子结构中含有2个二硫键和4个铜原子,其中铜原子分布在T1-Cu(1个)、T2-Cu(1个)和T3-Cu(2个)位点[2-3]。 其中,T1-Cu为单核,在波长610 nm左右有吸收峰,负责显现漆酶特有的蓝色;T2/T3-Cu共同组成漆酶的三核铜簇,底物在T1-Cu氧化后,所获得的电子通过组氨酸(histidine,His)-半胱氨酸(cysteine,Cys)-His三肽序列转移到三核铜簇,并实现O2还原为H2O[4-5]。 与木质素过氧化物酶和锰过氧化物酶等相比,真菌漆酶无需H2O2参与执行底物的氧化反应,且仅以O2作为唯一共底物,具有简单、高效、绿色、节能和环保等优点[6]。此外,真菌漆酶也会与小分子氧化还原介质合作,通过快速氧化介质获得一个或多个电子后,氧化态的介质从漆酶催化口袋扩散并氧化底物分子,从而促进大分子木质素等难降解底物的氧化裂解[7]。
中国是食品加工和农业生产大国,每年产生的大量食品和农业副产品常被作为废弃物处理,造成巨大的经济损失和生态破坏[8]。食品和农业废弃物的主要成分是木质素,该化合物作为自然界中最丰富的生物大分子聚合物,具有结构复杂、抗逆性强、难降解等特点[9]。因此,如何有效地分解食品-农业废物中的木质素已经成为研究者亟待解决的关键科学问题之一。 木质素的预处理方法包括物理法、化学法和生物法,其中生物法因具备绿色、经济和环保等优点而备受科研人员关注[10]。已证实,白腐真菌分泌的胞外漆酶会将木质素解聚为纤维素和半纤维素等碳水化合物,进而显著地提高木质素氧化裂解产物的生物发酵性能,并减低能源损耗和废物流[11]。通过小分子介质辅助真菌漆酶,能够使木质素结构的分解率高达80%~90%[12]。 显然,采用产漆酶真菌进行生物液体或固体发酵培养,不仅可以诱导漆酶的生物合成和生产,也有助于将木质素转化为具有工业应用价值的生物能源和化学产品。
目前,利用双孢蘑菇(Agaricus bisporus)、平菇(Pleurotus ostreatus)、肺形侧耳(Pleurotus pulmonarius)和变色栓菌(Trametes versicolor)等白腐真菌分泌的胞外漆酶氧化分解木质素的研究最广泛[13]。pH、温度、基质、微量元素和碳氮源等微生物发酵培养条件均可以显著地影响白腐真菌分泌胞外漆酶的产量[14-15]。普遍认为,漆酶是真菌的次级代谢产物,其分子质量和等电点分别约为60 kDa和4.0,最佳催化温度为40~70 ℃[1]。 本文概述了利用食品工业副产品和农业废弃物生产真菌漆酶的关键技术,重点总结了真菌漆酶在提高酒水质量、改善烘焙品质和促进甜菜果胶凝胶化等食品加工中的最新研究进展和应用价值,并阐明了真菌漆酶处理食品厂废水的效能及机理,以期为扩展真菌漆酶在食品工业和环境修复中的应用提供理论基础和科学指导。
担子菌(Basidiomycetes)中的白腐真菌是自然界中最重要的木质素分解菌,同时也是最主要的漆酶生产者之一[16]。目前,传统的漆酶生产方式为白腐真菌的液体或固体发酵培养。在人工培养系统中,常见的漆酶生产菌包括A.bisporus、P.ostreatus、P.pulmonarius、T.versicolor和云芝(Coriolus versicolor)。 采用大型真菌进行生物发酵培养,可以从果皮、花生壳、果汁残渣、酒糟等食品工业副产品中生产漆酶。 然而,从发酵液中分离回收漆酶的过程十分复杂且价格高昂。如何开发新技术和新方法,用于简单、高效地分离纯化漆酶,已经成为研究者亟待解决的关键科学问题之一。 水二相体系(aqueous two-phase system,ATPS)作为一种新兴的漆酶分离技术,是将两种不同成分的水溶液混合成双相体系,在特定的临界浓度下两种水溶液变得不相溶。 采用ATPS分离回收漆酶的示意图见图1[17]。 将含有漆酶的堆肥发酵液与两种不同组分组成的ATPS进行混合,在一定的临界条件下(如温度、浓度等),两种水溶液变得不可混溶,从而实现漆酶的有效分离。普遍采用的ATPS由1~2种聚合物和1种盐形成,如聚乙二醇和葡聚糖,两种不相溶组分中水的含量约为80%。每一相都有不同的特征,可以使它们对不同分子的样品进行划分。该方法为生物制品提供了良好的环境,已经被应用于从食品工业副产品的堆肥发酵中回收纯化生物漆酶产品[18]。2023年,SILVÉRIO S C等[19]首次研究了漆酶在21种不同ATPS中的稳定性,并评估了ATPS在生物发酵中原位回收漆酶的潜力,结果表明,漆酶在聚乙二醇-磷酸盐ATPS中表现出较高的稳定性和提取率。此外,UCON-盐类(UCON是一种无规共聚物,由50%环氧乙烷和50%环氧丙烷组成)、聚合物-聚合物ATPS也被应用于堆肥发酵中漆酶的分离回收;其中,UCON-(NH4)2SO4 ATPS对漆酶的回收率高达98%以上[20]。

图1 水二相体系分离回收漆酶示意图
Fig.1 Schematic diagram of separation and recovery of laccase by aqueous two-phase system
农业废弃物主要包括农作物副产物和畜禽粪便等,它们已经成为造成农业生态环境污染的关键污染源。 如何充分利用农业废弃物并确保农业生态环境不受破坏是现代农业面临的难题。固态发酵不仅能够有效地处理农业废弃物,也可以生成副产物漆酶[21]。该技术具有避免农业环境污染、提高漆酶产量和稳定性、降低漆酶生产成本等诸多优点[22]。 POSTEMSKY P D等[23]研究了灵芝(Ganoderma lucidum)固态发酵对水稻和向日葵秸秆生物转化和增值效益的影响,结果表明,每吨农业废弃物(干质量)可以产生56 kg药用菌,且水稻和向日葵秸秆粗提物中漆酶的最大活性分别高达10 927 U/kg和16 442 U/kg。同时,在固态发酵过程中产生的漆酶底物特异性较广泛,会加速农业废弃物的氧化和分解。此外,选用大麦麸皮、香蕉皮、柑橘皮等农业废弃物作为大型真菌的生长基质,也能够用于裂解木质素、纤维素和半纤维素,并实现高水平的真菌和漆酶产量[24]。显然,运用固态堆肥发酵处理农业废弃物,不仅可以分解木质素、生产漆酶副产品,也有助于提高大型真菌的生产效益,从而降低能源损耗和经济成本。而且,在发酵过程中产生的大量胞外漆酶经过分离回收后,又有望重新应用于农业废弃物的处理。
食品工业产生的副产物具有酚类含量高、pH低、生化需氧量(biochemical oxygen demand,BOD)和化学需氧量(chemical oxygen demand,COD)高等特点,从而导致其难以被微生物降解和利用。 目前,真菌漆酶已经被应用于食品工业副产物的加工和处理,如增加果汁饮料特有的风味和色泽、提高葡萄酒和啤酒的稳定性、改善面团质构特性、促进果胶凝胶化、提升食品感官品质等[25]。
果汁饮料中含有的天然酚类及其氧化产物是影响其特有风味和色泽的重要指标[26]。运用酶分析法和福林酚(Folin-Ciocalteu)法测定果汁饮料中总酚含量,可以揭示果汁饮料中酚类浓度和漆酶的线性相关性[27]。由于多酚与蛋白质相互作用会导致果汁饮料中沉积物的形成,果汁饮料想要保持品质和稳定就必须延缓蛋白质-多酚相互作用,从而避免该过程中形成的沉淀物引起的浑浊现象。 YIN L等[28]将漆酶处理后的荔枝汁的净度和总酚含量与未处理样品进行比较,发现经过漆酶处理后荔枝汁中总酚含量显著降低(P<0.05),并提高了荔枝汁的澄清度、稳定性和品质。LETTERA V等[29]采用固定化P.ostreatus漆酶澄清橙子、石榴、杏、桃汁、樱桃和苹果等果汁,结果发现,漆酶对果汁中苯酚的还原率高达45%,且不影响果汁中的总黄酮含量;漆酶处理后的果汁中乙烯基愈创木酚(一种具有胡椒/辛辣气味的化合物)的含量显著减少,因此表现出更好的感官特征。固定化T.versicolor漆酶在处理苹果汁中的应用潜力,如图2所示[30],采用戊二醛活化椰壳纤维,制备的固定化漆酶具有良好的热稳定性;该固定化漆酶可以有效地澄清苹果汁,且循环使用10次后,果汁色度降低61%、浊度减少29%,而漆酶活性仍保持100%。因此,漆酶作为果汁饮料澄清的加工助剂,在饮料加工中具有良好的实际应用前景。
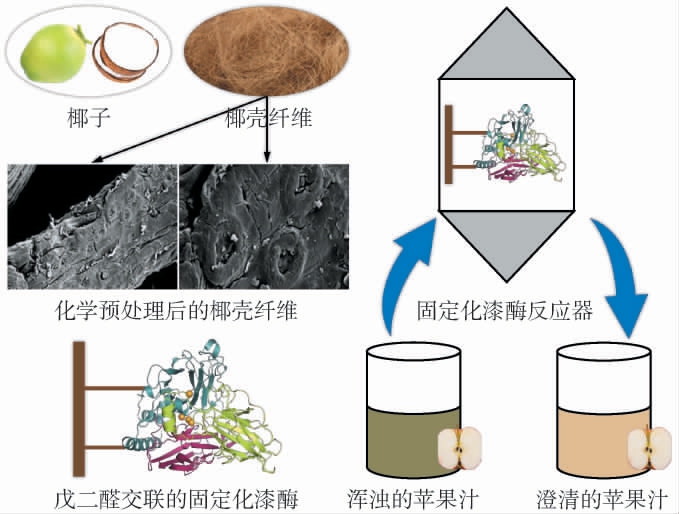
图2 固定化漆酶在澄清苹果汁中的应用
Fig.2 Application of immobilized laccase in clarifying apple juice
适量饮用葡萄酒和啤酒有益于人体健康,包括抗炎症、预防心血管疾病、癌症等[31]。葡萄酒中含有乙醇、有机酸、盐类和酚类等化合物,其中乙醇和有机酸会影响葡萄酒的芳香性,而酚类则影响葡萄酒的色泽和味道。 研究者普遍采用化学法,将不溶解的聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)添加到葡萄酒中,以稳定葡萄酒的色泽和风味[32]。 然而,PVP的生物可降解性较低,且处理过程会造成环境污染,限制了其在稳定葡萄酒中的大规模应用。漆酶能够调控葡萄酒和啤酒中酚类化合物含量,以提高酒质的稳定性[33]。 与传统的化学处理方法相比,真菌漆酶是一种生物降解性天然酶,相较于化学添加剂更为环保,减少了对环境的负面影响,并且避免了可能带来的健康风险。通过有效地降解葡萄酒中的酚类物质,尤其是引起澄清问题的单宁和多酚化合物,从而减少沉淀和浑浊,提升葡萄酒的外观和口感。 相比其他生物酶类,漆酶在酸性至中性条件下依然保持较好的稳定性和酶活性。MAZLAN S Z等[34]研究指出,游离漆酶在30 ℃的最适pH为4.0。因此,即使葡萄酒或其他发酵饮料的pH值较低(pH 3.0~4.0),漆酶仍能够有效地参与反应并保持较高活性。 这些特性决定了漆酶不仅可以改善葡萄酒的风味和色泽,还能够提高其长期保存的稳定性。 如CLAUS H等[35]利用T.versicolor所产生的漆酶处理人工模拟的葡萄酒溶液,能够有效地去除葡萄酒中90%以上的阿魏酸和34%的酚类化合物;而来自T.versicolor的突变异种漆酶(最适pH 2.7)在溶液中处理3 h后,可以去除黑葡萄酒中70%儿茶酚、90%花色素以及50%总多酚。JAMES A等[36]研究发现,运用漆酶调节葡萄酒中多酚含量、颜色、雾度稳定性和感官质量,可以酿造出稳定、优质的葡萄酒。 漆酶氧化聚合葡萄酒中邻苯二酚的作用机制见图3。首先,漆酶催化邻苯二酚的单电子氧化形成苯氧自由基活性中间体或邻位醌;随后,这些极不稳定的活性中间体自发、连续的耦合,产生有色聚合产物,从而有效去除葡萄酒中的邻苯二酚,减少其在葡萄酒中的游离浓度,有效地改善酒液的口感,降低酒液中苦味和涩味的程度,有助于提升葡萄酒的整体风味和质量[37]。
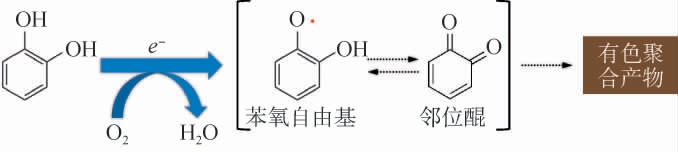
图3 漆酶催化氧化葡萄酒中邻苯二酚的去除机制
Fig.3 Removal mechanism of catechol in wine by catalytic oxidation with laccase
真菌漆酶在提高酒质稳定性中的另一个主要应用是改善啤酒品质[38]。啤酒产品在包装时能够保持澄清,但其在长期的贮存过程中会出现混浊现象,这主要是因为啤酒中的多酚如儿茶酸和原花色素与活性蛋白质聚合,从而导致啤酒“冷混浊”[39]。温度、氧气和外观浑浊是影响啤酒质量的关键因素。 由于成品啤酒中不需要O2,所以添加漆酶不仅能够去除啤酒中多酚类化合物,也可以消除啤酒中多余的O2、提高啤酒的储存半衰期[40]。如在啤酒生产过程结束时添加漆酶,有助于消除成品啤酒中残留的O2,从而提高啤酒的储存寿命[41]。DHILLON G S等[42]研究发现,Thapsia villosa和T.versicolor所产生的漆酶能够在啤酒加工结束时消除多酚并降低O2含量,从而实现啤酒的絮凝和澄清,促进啤酒的保存。可见,漆酶作为澄清剂和絮凝剂,能够对粗啤酒中浑浊物进行高效絮凝。因此,漆酶在维持葡萄酒和啤酒稳定性等方面具有极大的应用价值和商业前景。
过氧化物酶、脂肪氧合酶和漆酶等生物酶能够改善面团体积和稠度、增强面筋结构强度,已经被广泛地应用于烘焙行业[23]。过氧化物酶主要是通过氧化水溶性阿拉伯木聚 糖(water-extractable arabinoxylans,WEAX),以 提 高 面团的黏性;脂肪氧合酶可以催化不饱和脂肪酸氧化,产生氢过氧化物自由基中间体;随后,在自由基存在下,WEAX发生氧化交联反应,从而提高面团的黏弹性[43]。 鉴于全麦粉中WEAX的含量约为7.0%,且含有阿魏酸,它们是漆酶的催化氧化底物。 因此,在全麦面包的制作过程中加入漆酶能够对面团的流变性质及面包的质构产生较大影响[44]。FLANDER L等[45]选择燕麦和小麦面团作为原料,研究了毛栓孔菌(Trametes hirsuta)所产漆酶、木聚糖酶及其组合对燕麦和小麦面团的影响。 结果表明,漆酶通过氧化交联作用,降低了燕麦面团中可提取WEAX的含量,增加了小麦面团的硬度。漆酶改善面团质地的作用机制见图4。将漆酶与阿魏酸添加到生面团中,通过漆酶对WEAX中阿魏酸酯的二聚作用,以及阿魏酸和漆酶对巯基氧化的促进效应,可以将面团中的巯基氧化为二硫键,通过增加二硫键的数目,增强面筋的强度,有助于改善面团的拉伸特性和稳定性,从而改善面包的质地和风味[46]。
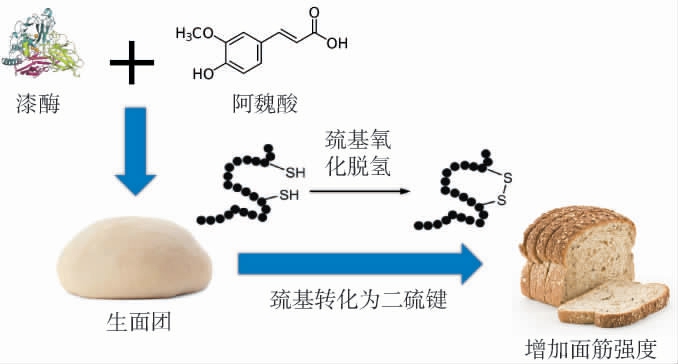
图4 漆酶改善面团质地的作用机制
Fig.4 Mechanism of laccase in improving dough texture
糖用甜菜果胶(sugar beet pectin,SBP)是一种具有特殊功能的食品组分,它可以与阿魏酸发生氧化交联反应形成凝胶[47]。 漆酶能够促进果胶和阿魏酸的氧化凝胶化,该过程无需H2O2参与,且生成的凝胶体具有热不可逆性,这对加热时保持凝胶结构十分有利[48]。 LIN J W等[49]研究了以SBP为载体,通过漆酶诱导果胶凝胶化应用于开发含姜黄素的新型果冻食品,结果表明,姜黄素首先被SBP包封,产生的复合物随后通过漆酶形成凝胶,增强了姜黄素的强度和光稳定性,为食品工业将生物活性成分掺入食品中提供了便利手段。 另有研究报道,将漆酶和果胶添加在午餐肉中可以促进块状肉凝胶化,有利于产品的切分[50]。β-乳球蛋白(β-lactoglobulin,BLG)是乳制品的重要营养成分,约占乳蛋白总量的10%~15%,同时也是引发牛奶过敏患者严重健康风险的主要过敏原之一[51]。通过漆酶催化交联处理,BLG的结构和功能特性可得到改善,从而提高其安全性和消化率,同时保留其对人体有益的健康效应[52]。漆酶催化BLG和甜菜果胶的交联反应见图5。LITTOZ F等[53]通过将甜菜果胶分子静电沉积到蛋白质包被的液滴表面上,随后将漆酶添加到乳液中,能够促进甜菜果胶分子的交联。该方法可以制备由漆酶交联的多层生物聚合物界面包裹的稳定乳液。与传统的单层或非交联的双层乳液相比,BLG-甜菜果胶界面包裹的乳液具有更好的NaCl渗透压稳定性。 此外,C.versicolor所产漆酶已经被用于交联来自酸樱桃提取物中的BLG酚基[54]。
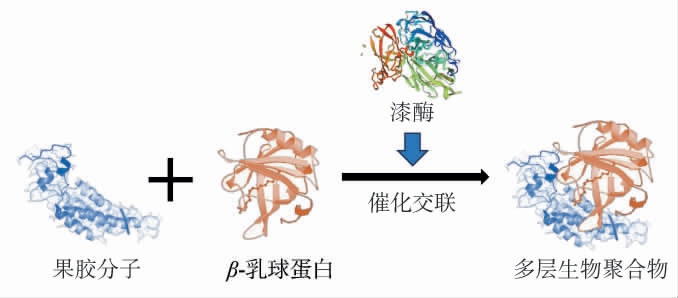
图5 漆酶催化β-乳球蛋白和甜菜果胶的交联反应
Fig.5 Cross-linking reaction between β-lactoglobulin and beet pectin catalyzed by laccase
真菌漆酶在改善食品感官品质方面也有很多应用。油或含油产品易被游离态氧氧化变质,如豆油中含有大量的亚油酸,易和产品中的游离态氧反应,形成不良挥发物。添加一定量的漆酶能够实现脱氧,从而阻止氧化反应的发生,改善油的风味[55]。漆酶也能够对植物提取物中的汤汁类或浓缩产品进行部分或全部的脱氧反应[23]。例如,采用C.versicolor所产的粗漆酶溶液浸泡可可豆,经过干燥、烘干后,会去除可可豆中的苦味和其他不良味道,增加可可豆肉及以其为原料的产品的香气和味道[56]。此外,利用漆酶处理大豆水解蛋白,在不影响水解效率及其最佳诱导条件的情况下,有效地增加了水解大豆蛋白的风味[57]。另有报道指出,运用漆酶和绿原酸处理半胱氨酸,可以明显地降低其恶臭气味,并减少50%以上的半胱氨酸含量[58]。
综上,真菌漆酶在改善果汁、葡萄酒、啤酒、面包品质以及果胶凝胶化等食品加工中的应用展现出独特的价值,特别是在改善食品的感官品质、提高产品的稳定性和优化营养成分方面。 随着技术的不断进步,漆酶有望成为食品加工领域中一种重要的天然催化剂,推动食品工业朝着更高效、环保和健康的方向发展。
我国经济高速发展、人民生活水平显著提高的同时,也加剧了食品生产过程对生态环境和人类健康的危害,特别是食品厂排出的废水具有酚类污染物浓度高、色度高、水质和水量变化幅度大等特点[59]。采用固定化漆酶可以有效地去除食品厂废水中酚类污染物,实现废水的易回收再利用[60-61]。
酿酒厂生产过程中形成的主要废物包括废水、废弃谷物、酿造酵母和冷却残渣。 据报道,现代酿酒厂中每生产100 L啤酒,会产生300~1 000 L废水[62]。这些废水通常具有较高的BOD和COD,其处理的难度较大。 糖蜜是糖生产的副产品,碳水化合物含量约为50%,在葡萄酒厂和啤酒厂工业发酵过程中被广泛用作廉价的碳源。利用甘蔗糖蜜发酵生产乙醇过程中产生的流出物被称为葡萄酒液,这种最终流出物由于其可溶性有机物含量高,颜色呈现深棕色(类黑素),会破坏生态环境。真菌漆酶在糖蜜废水的脱色处理中起着关键作用。GEORGIOU R P等[63]研究了T.versicolor所产漆酶在处理酒厂废水中的应用,将T.versicolor所产漆酶固定于玻璃和氧化铝载体上,48 h内两种固定化漆酶对模拟糖蜜废水的降解率分别达到74%和71%;而对于类黑素溶液,在pH 4.5和28 ℃条件下,24 h内固定于玻璃载体的漆酶对其降解率达到68%。这种处理方法有效降低了糖蜜废水中污染物,减轻了其对环境的负荷。此外,啤酒厂废水中含有较高浓度的单宁类多酚化合物,且颜色深棕,经常引发生态环境问题。YAGÜE S等[64]研究了产漆酶粗毛革孔菌(Coriolopsis gallica)降解高浓度单宁废水的特性,结果发现,经过12 d处理后C.gallica能够有效去除废水中的颜色,并使COD降低约65%。 此外,C.gallica对啤酒厂废水中单宁具有很强的耐受性,在添加40%啤酒厂废水的条件下,漆酶产量的增幅达到20倍。HULTBERG M等[65]筛选得到 了 产 漆 酶 真 菌P. ostreatus、T. versicolor 和Trichoderma harzianum,并探索了它们对酿酒废水中酚类物质的处理效果,结果发现,P.ostreatus处理的生物量最高,干质量为1.78 g/L,而T.harzianum处理的酚类去除能力最好,COD最大降幅为初始值的89%。 GIACOBBE S等[66]研究了从P.ostreatus中提取的两种漆酶对啤酒酿造过程中主要固体废物脱木质素和废水解毒的能力,结果表明,P.ostreatus所产漆酶对废水中酚类物质的去除率高达94%。此外,这些漆酶还表现出显著地固体废物解毒作用,并能够促进废水中糖化过程。可见,真菌漆酶能够有效地降低酿酒废水中BOD和COD,脱除废水中颜色和酚类物质,并处理糖蜜废水中有机污染物。
橄榄油厂废水(olive oil mill wastewater,OMW)是导致地中海地区污染的一项重要原因,因为它产生了大量固、液废物,其中含有对生态环境造成严重污染的有毒化合物[67]。 OMW处理中最大的问题主要与低pH、高BOD、高COD、高浓度酚(从1.5~8.0 g/L)和其他有机物有关[68]。P. ostreatus、T. versicolor、香 菇(Lentinus edodes)、齿 毛 菌(Cerrena)和球藻菌(Chlorella pyrenoidosa Chick.)等白腐真菌产生的漆酶能够氧化OMW中存在的不同酚类化合物,而且这种活性可以通过酶固定化来增强[69]。TSIOULPAS A等[70]研究了几种P.ostreatus去除OMW中酚类化合物的能力以及处理后OMW的植物毒性,以筛选能够解毒OMW的菌株,结果表明,所有菌株均能够在OMW中生长,且产生大量的胞外漆酶,去除69%~76%的酚类化合物,OMW的颜色由黑色变成黄褐色或更亮。 AGGELIS G等[71]采用原毛平革菌(Phanerochaete sp.)降解OMW中的酚类化合物,也得到类似结论。 FOUNTOULAKIS M S等[72]考察了P.ostreatus在灭菌和热处理条件下对OMW中酚类物质的降解能力,结果发现,该菌对OMW中苯酚的降解率高达78.4%,经热处理稀释及未稀释的OMW中苯酚的降解率则分别为65.7%和64.8%。
随着“绿色工业、食品安全”等核心价值理念的深入人心,从大型真菌液体或固体发酵培养中分离回收漆酶,有望实现其商业化推广与应用。 然而,漆酶的大批量生产受到微生物遗传特征等因素限制,致使漆酶合成速率缓慢及其催化活性偏低,且分离纯化工艺成本高、费时费力。 因此,亟待开发新型的漆酶初级回收和纯化处理技术,以获得低成本漆酶,并实现其在食品加工及废水治理中的大规模应用。 基于此,将来的研究重点仍需从以下几个方面进行:①分离筛选具有产漆酶特性的真菌,并构建漆酶基因工程菌,最大化提高菌株的漆酶产量;②寻找简单、高效的漆酶分离纯化方法,显著降低漆酶的生产和纯化成本;③挖掘新型天然材料,开发稳定且机械性能优异的漆酶固定化技术,提高漆酶的催化活力和环境稳定性;④构建高效、绿色、新型、环保的漆酶催化体系,评估漆酶的毒理学及其作为食品添加剂的安全性;⑤推动新型真菌漆酶的开发与研制,拓展漆酶在食品工业领域的新应用途径。
[1]SUN K,LI S Y,SI Y B,et al.Advances in laccase-triggered anabolism for biotechnology applications[J].Crit Rev Biotechnol, 2021, 41(7): 969-993.
[2]MOT A C,SILAGHI-DUMITRESCU R.Laccases:Complex architectures for one-electron oxidations[J].Biochemistry,2012,77:1395-1407.
[3]陈慧玲,张青云,孙凯.漆酶介导生物体内酚类氧化偶联的基本原理及其在绿色合成中的应用[J].生物技术通报,2020,36(5):193-204.
[4]龚睿,孙凯,谢道月.真菌漆酶在绿色化学中的研究进展[J].生物技术通报,2018,34(4):24-34.
[5] AZA P,MOLPECERES G,RUIZ-DUEÑAS F J, et al.Heterologous expression,engineering and characterization of a novel laccase of Agrocybe pediades with promising properties as biocatalyst[J].J Fungi,2021,7(5):359.
[6]WANG X Q, CHEN Z, ZHAO X Y, et al.Regulation of coordination number over single Co sites: Triggering the efficient electroreduction of CO2[J].Angew Chem Int Edit,2018,130(7):1962-1966.
[7]SUN K, CHEN M H, QI X M, et al.Laccase-evoked removal of antibiotics: Reaction kinetics, conversion mechanisms, and ecotoxicity assessment[J].Crit Rev Env Sci Tec,2024,54(2):162-183.
[8]王建华,钭露露,马玲.农户融入农业绿色生产转型的驱动机制分析——以农户农业废弃物资源化利用为例[J].南京农业大学学报,2023,23(5):165-177.
[9]POLLEGIONI L, TONIN F, ROSINI E.Lignin-degrading enzymes[J].FEBS J,2015,282(7):1190-1213.
[10]CHENG F,BAYAT H,JENA U,et al.Impact of feedstock composition on pyrolysis of low-cost,protein-and lignin-rich biomass:A review[J].J Anal Appl Pyrol,2020,147:104780.
[11]CURRAN L M C L K,PHAM L T M,SALE K L,et al.Review of advances in the development of laccases for the valorization of lignin to enable the production of lignocellulosic biofuels and bioproducts[J].Biotechnol Adv,2022,54:107809.
[12]BILAL M,IQBAL H M N.Ligninolytic enzymes mediated ligninolysis:An untapped biocatalytic potential to deconstruct lignocellulosic molecules in a sustainable manner[J].Catal Lett,2020,150:524-543.
[13]ZHUO R, FAN F F.A comprehensive insight into the application of white rot fungi and their lignocellulolytic enzymes in the removal of organic pollutants[J].Sci Total Environ,2021,778:146132.
[14]GALHAUP C, HALTRICH D.Enhanced formation of laccase activity by the white-rot fungus Trametes pubescens in the presence of copper[J].Appl Microbiol Biot,2001,56:225-232.
[15]唐禄鑫,王雅娴,彭明意,等.真菌漆酶及其生产,固定化与应用[J].菌物学报,2023,42(9):1821-1837.
[16]HAQ I U,HILLMANN B,MORAN M,et al.Bacterial communities associated with wood rot fungi that use distinct decomposition mechanisms[J].ISME Commun,2022,2(1):26.
[17]JUNIOR J A,VIEIRA Y A,CRUZ I A,et al.Sequential degradation of raw vinasse by a laccase enzyme producing fungus Pleurotus sajor-caju and its ATPS purification[J].Biotechnol Rep,2020,25:e00411.
[18]MAYOLO-DELOISA K, GONZÁLEZ-GONZÁLEZ M, RITO-PALOMARES M.Laccases in food industry: Bioprocessing, potential industrial and biotechnological applications[J].Front Bioeng Biotech,2020,8:00222.
[19]SILVÉRIO S C,RODRÍGUEZ O,TAVARES A P M,et al.Laccase recovery with aqueous two-phase systems: Enzyme partitioning and stability[J].J Mol Catal B Enzym,2013,87:37-43.
[20]AGRAWAL K,VERMA P.Potential removal of hazardous wastes using white laccase purified by ATPS-PEG-salt system: An operational study[J].Environ Technol Inno,2020,17:100556.
[21]RISDIANTO H, SOFIANTI E, SUHARDI S H, et al.Optimisation of laccase production using white rot fungi and agriculture wastes in solid state fermentation[J].ITB J Eng Sci,2012,44(2):93-105.
[22]VANDENBERGHE L P S,PANDEY A,CARVALHO J C,et al.Solidstate fermentation technology and innovation for the production of agricultural and animal feed bioproducts[J].Syst Microbiol Biomanuf,2021,1:142-165.
[23]POSTEMSKY P D,BIDEGAIN M A,GONZÁLEZ-MATUTE R,et al.Pilot-scale bioconversion of rice and sunflower agro-residues into medicinal mushrooms and laccase enzymes through solid-state fermentation with Ganoderma lucidum[J].Bioresource Technol,2017,231:85-93.
[24]WANG F,XU L,ZHAO L T,et al.Fungal laccase production from lignocellulosic agricultural wastes by solid-state fermentation:A review[J].Microorganisms,2019,7(12):665.
[25]BACKES E,KATO C G,CORRÊA R C G,et al.Laccases in food processing: Current status, bottlenecks and perspectives[J].Trends Food Sci Tech,2021,115:445-460.
[26]TIGHRINE A,AMIR Y,ALFARO P,et al.Simultaneous extraction and analysis of preservatives and artificial sweeteners in juices by salting out liquid-liquid extraction method prior to ultra-high performance liquid chromatography[J].Food Chem,2019,277:586-594.
[27]BLAINSKI A,LOPES G C,DE MELLO J C P.Application and analysis of the folin ciocalteu method for the determination of the total phenolic content from Limonium brasiliense L.[J].Molecules,2013,18(6):6852-6865.
[28]YIN L,YE J Y,KUANG S B,et al.Induction,purification,and characterization of a thermo and pH stable laccase from Abortiporus biennis J2 and its application on the clarification of litchi juice[J].Biosci Biotechnol Biochem,2017,81(5):1033-1040.
[29]LETTERA V,PEZZELLA C,CICATIELLO P,et al.Efficient immobilization of a fungal laccase and its exploitation in fruit juice clarification[J].Food Chem,2016,196:1272-1278.
[30]DE SOUZA BEZERRA T M, BASSAN J C, DE OLIVEIRA S V T,et al.Covalent immobilization of laccase in green coconut fiber and use in clarification of apple juice[J].Process Biochem,2015,50(3):417-423.
[31]MARCOS A,SERRA-MAJEM L,PÉREZ-JIMÉNEZ F,et al.Moderate consumption of beer and its effects on cardiovascular and metabolic health:An updated review of recent scientific evidence[J].Nutrients,2021,13(3):879.
[32]BILKO M, GUNKO S, BABYCH I, et al.Investigation of the appearance and elimination of pinking coloration in white wines[J].E Eur J Enterp Tech,2022,11(115):56-62.
[33]BENUCCI I, MAZZOCCHI C, LOMBARDELLI C, et al.Phenolic-degrading enzymes: Effect on haze active phenols and chill haze in India pale ale beer[J].Foods,2022,12(1):77.
[34]MAZLAN S Z, HANIFAH S A.Effects of temperature and pH on immobilized laccase activity in conjugated methacrylate-acrylate microspheres[J].Int J Polym Sci,2017,2017(1):5657271.
[35]CLAUS H, MOJSOV K.Enzymes for wine fermentation: Current and perspective applications[J].Fermentation,2018,4(3):52.
[36]JAMES A,YAO T,KE H M,et al.Microbiota for production of wine with enhanced functional components[J].Food Science Human Wellness,2023,12(5):1481-1492.
[37]刘庆竹,孙凯,司友斌.真菌漆酶介导自由基偶联和接枝反应在绿色化学中的应用[J].环境化学,2021 40(3):914-927.
[38]MINUSSI R C, PASTORE G M, DURÁN N.Potential applications of laccase in the food industry[J].Trends Food Sci Technol,2002,13(6-7):205-216.
[39]ALVARADO-RAMÍREZ L,ROSTRO-ALANIS M,RODRÍGUEZ-RODRÍGUEZ J,et al.Exploring current tendencies in techniques and materials for immobilization of laccases-A review[J].Int J Biol Macromol,2021,181:683-696.
[40]WANG Y,YE L Z.Haze in beer:Its formation and alleviating strategies,from a protein-polyphenol complex angle[J].Foods,2021,10(12):3114.
[41]MATE D M,ALCALDE M.Laccase:a multi-purpose biocatalyst at the forefront of biotechnology[J].Microb Biotechnol, 2017, 10(6): 1457-1467.
[42]DHILLON G S, KAUR S, BRAR S K, et al.Flocculation and haze removal from crude beer using in-house produced laccase from Trametes versicolor cultured on brewer's spent grain[J].J Agr Food Chem,2012,60(32):7895-7904.
[43]HE N,PAN Z Q,LI L,et al.Improving the microstructural and rheological properties of frozen unfermented wheat dough with laccase and ferulic acid[J].Foods,2023,12(14):2772.
[44]SELINHEIMO E,KRUUS K,BUCHERT J,et al.Effects of laccase,xylanase and their combination on the rheological properties of wheat doughs[J].J Cereal Sci,2006,43(2):152-159.
[45]FLANDER L, ROUAU X, MOREL M H, et al.Effects of laccase and xylanase on the chemical and rheological properties of oat and wheat doughs[J].J Agr Food Chem,2008,56(14):5732-5742.
[46]LABAT E,MOREL M H,ROUAU X.Effects of laccase and ferulic acid on wheat flour doughs[J].Cereal Chem,2000,77(6):823-828.
[47]SIEW C K,WILLIAMS P A.Role of protein and ferulic acid in the emulsification properties of sugar beet pectin[J].J Agr Food Chem, 2008,56(11):4164-4171.
[48]CHEN H, GAN J, JI A G, et al.Development of double network gels based on soy protein isolate and sugar beet pectin induced by thermal treatment and laccase catalysis[J].Food Chem,2019,292:188-196.
[49]LIN J W, JIANG G L, LIANG C X, et al.Laccase-induced gelation of sugar beet pectin-curcumin nanocomplexes enhanced by genipin crosslinking[J].Foods,2023,12(14):2771.
[50]ROBERT B, CHENTHAMARA D, SUBRAMANIAM S.Fabrication and biomedical applications of arabinoxylan, pectin, chitosan, soy protein,and silk fibroin hydrogels via laccase-ferulic acid redox chemistry[J].Int J Biol Macromol,2022,201:539-556.
[51]KONTOPIDIS G,HOLT C,SAWYER L.Invited review:β-lactoglobulin:binding properties,structure,and function[J].J Dairy Sci,2004,87(4):785-796.
[52]KUSHWAHA A,HANS N,KUMAR S,et al.A critical review on speciation,mobilization and toxicity of lead in soil-microbe-plant system and bioremediation strategies[J].Ecotox Environ Safe,2018,147:1035-1045.
[53]LITTOZ F, MCCLEMENTS D J.Bio-mimetic approach to improving emulsion stability: Cross-linking adsorbed beet pectin layers using laccase[J].Food Hydrocolloid,2008,22(7):1203-1211.
[54]TANTOUSH Z,STANIC D,STOJADINOVIC M,et al.Digestibility and allergenicity of β-lactoglobulin following laccase-mediated cross-linking in the presence of sour cherry phenolics[J].Food Chem,2011,125(1):84-91.
[55]CHEN B C, MCCLEMENTS D J, GRAY D A, et al.Stabilization of soybean oil bodies by enzyme (laccase) cross-linking of adsorbed beet pectin coatings[J].J Agr Food Chem,2010,58(16):9259-9265.
[56]BRITO E S,GARCÍA N H P,AMÂNCIO A C.Effect of polyphenol oxidase(PPO)and air treatments on total phenol and tannin content of cocoa nibs[J].Food Sci Technol,2002,22:45-48.
[57]MU D D,LI H W,LI X J,et al.Enhancing laccase-induced soybean protein isolates gel properties by microwave pretreatment[J].J Food Process Preserv,2020,44(4):e14386.
[58]ASGHARNEJAD H, NAZLOO E K, LARIJANI M M, et al.Comprehensive review of water management and wastewater treatment in food processing industries in the framework of water-food-environment nexus[J].Compr Rev Food Sci F,2021,20(5):4779-4815.
[59]陈宇.提高食品厂废水处理系统性能的几种方法[J].食品科学,2001,22(10):95-97.
[60]陈明雨,倪烜,司友斌,等.固定化真菌漆酶在环境有机污染修复中的应用研究进展[J].生物技术通报,2021,37(6):244.
[61]IQHRAMMULLAH M,FAHRINA A,CHIARI W,et al.Laccase immobilization using polymeric supports for wastewater treatment: A critical review[J].Macromol Chem Phys,2023,224(9):2200461.
[62]TIŠMA M,JURIC′ A,BUCIC′-KOJIC′ A,et al.Biovalorization of brewers'spent grain for the production of laccase and polyphenols[J].J I Brewing,2018,124(2):182-186.
[63]GEORGIOU R P, TSIAKIRI E P, LAZARIDIS N K, et al.Decolorization of melanoidins from simulated and industrial molasses effluents by immobilized laccase[J].J Environ Chem Eng,2016,4(1):1322-1331.
[64]YAGÜE S,TERRÓN M C,GONZÁLEZ T,et al.Biotreatment of tanninrich beer-factory wastewater with white-rot basidiomycete Coriolopsis gallica monitored by pyrolysis/gas chromatography/mass spectrometry[J].Rapid Commun Mass Sp,2000,14(10):905-910.
[65]HULTBERG M,BODIN H.Fungi-based treatment of brewery wastewater-biomass production and nutrient reduction[J].Appl Microbiol Biot,2017,101:4791-4798.
[66]GIACOBBE S,PISCITELLI A,RAGANATI F,et al.Butanol production from laccase-pretreated brewer's spent grain[J].Biotechnol Biofuels,2019,12:1-8.
[67]BOUCHERIT Z,FLAHAUT S,DJOUDI B,et al.Potential of halophilic Penicillium chrysogenum isolated from Algerian saline soil to produce laccase on olive oil wastes[J].Curr Microbiol,2022,79(7):178.
[68]ZERVA A,PENTARI C,TOPAKAS E.Crosslinked enzyme aggregates(CLEAs) of laccases from Pleurotus citrinopileatus induced in olive oil mill wastewater(OOMW)[J].Molecules,2020,25(9):2221.
[69]DÍAZ A I,IBAÑEZ M,LACA A,et al.Biodegradation of olive mill effluent by white-rot fungi[J].Appl Sci,2021,11(21):9930.
[70]TSIOULPAS A,DIMOU D,ICONOMOU D,et al.Phenolic removal in olive oil mill wastewater by strains of Pleurotus spp.in respect to their phenol oxidase(laccase)activity[J].Bioresource Technol,2002,84(3):251-257.
[71]AGGELIS G, ICONOMOU D, CHRISTOU M, et al.Phenolic removal in a model olive oil mill wastewater using Pleurotus ostreatus in bioreactor cultures and biological evaluation of the process[J].Water Res,2003,37(16):3897-3904.
[72]FOUNTOULAKIS M S,DOKIANAKIS S N, KORNAROS M E, et al.Removal of phenolics in olive mill wastewaters using the white-rot fungus Pleurotus ostreatus[J].Water Res,2002,36(19):4735-4744.