邛崃地区新老窖池黄水的理化指标及微生物差异性分析
马峻凯1,2,刘林培2,林涵瑞1,2,帖 余3,马伊然2,黄蜀生4,王 峰4,陈 勇5,王 轩5,吴 波2,庄 勇2,何明雄1,2*
(1.成都理工大学 生态环境学院,四川 成都 610059;2.农业农村部成都沼气科学研究所 生物质能技术研究中心(农业农村部农村可再生能源开发利用重点实验室),四川 成都 610041;3.固态发酵资源利用四川省重点实验室,四川 宜宾 644000;4.四川省文君井酒业集团有限公司,四川 成都 611500;5.泸州老窖股份有限公司,四川 泸州 646000)
摘 要:该研究通过Illumina高通量测序、多样性分析及主坐标分析(PCoA)等方法比较了邛崃产区新窖池(一年窖龄)与老窖池(十年以上与二十年以上窖龄)黄水理化性质与微生物群落结构差异。结果表明,老窖池黄水的乙酸、丙酸、乳酸、己酸含量显著高于新窖池(P<0.05),且老窖池中还原糖、淀粉含量随着年份增加显著上升(P<0.05)。 随着窖龄的升高,新窖池与老窖池黄水中的细菌群落丰富度和多样性逐渐减少,而真菌群落则表现出先降低后升高,PCoA可以将不同窖龄的黄水区分开。新窖池中优势菌属是乳杆菌属(Lactobacillus)和微曲霉属(Microascus),老窖池中则是乳杆菌属(Lactobacillus)和嗜热子囊菌属(Thermoascus)。乳杆菌属与乳酸、还原糖和淀粉含量之间呈极显著正相关(P<0.01),表明其可能是影响不同窖龄黄水差异及白酒发酵体系的主要细菌属;真菌类中的红曲霉属(Monascus)、青霉属(Penicillium)和乳酸、己酸、还原糖和淀粉含量亦表现出正相关。结果表明,窖龄的变化对黄水的微生物群落及其代谢产物的形成具有重要影响。
关键词:黄水;窖龄;邛崃产区;微生物群落;差异分析
中图分类号:TS261.2
文章编号:0254-5071(2025)05-0054-06
doi: 10.11882/j.issn.0254-5071.2025.05.009
引文格式:马峻凯,刘林培,林涵瑞,等.邛崃地区新老窖池黄水的理化指标及微生物差异性分析[J].中国酿造,2025,44(5):54-59.
收稿日期:2024-10-23
修回日期:2025-03-12
基金项目:四川省重点研发计划(2023YFN0025);固体发酵资源利用四川省重点实验室开放基金项目(2024GTYY01);四川省区域创新合作项目(2024YFHZ0201);中国农业科学院农业科技创新工程(CAAS-ASTIP-2016-BIOMA);中央级公益性科研院所基本科研业务费专项(1610012021001_03202)
作者简介:马峻凯(1999-),男,硕士研究生,研究方向为浓香型强化大曲。
*通讯作者:何明雄(1978-),男,研究员,博士,研究方向为应用微生物技术。
Analysis of the physicochemical indexes and microbial differences in Huangshui from new and old pits in Qionglai production area
MA Junkai1,2,LIU Linpei2,LIN Hanrui1,2,TIE Yu3,MA Yiran2,HUANG Shusheng4,WANG Feng4,CHEN Yong5,WANG Xuan5,WU Bo2,ZHUANG Yong2,HE Mingxiong1,2*
(1.College of Ecology and Environment,Chengdu University of Technology,Chengdu 610059,China;2.Key Laboratory of Development and Application of Rural Renewable Energy(Ministry of Agriculture and Rural Affairs),Biomass Energy Technology Research Centre,Biogas Institute of Ministry of Agriculture and Rural Affairs,Chengdu 610041,China;3.Solid-state Fermentation Resource Utilization Key Laboratory of Sichuan Province,Yibin 644000,China;4.Sichuan Wenjunjing Distillery Co.,Ltd,Chengdu 611500,China;5.Luzhou Laojiao Co.,Ltd.,Luzhou 646000,China)
Abstract:In this study,using Illumina high-throughput sequencing,diversity analysis,and principal coordinate analysis(PCoA),the physicochemical properties and microbial community structure of Huangshui from new (one-year-old) and old pits(over 10 years and over 20 years old) in Qionglai production area were compared.The results revealed that the concentrations of acetic acid,propionic acid,lactic acid,and caproic acid in the Huangshui from the old pits were significantly higher than those from the new pit(P<0.05).Additionally,the contents of reducing sugar and starch in the Huangshui from the old pits increased significantly with the age of the pits(P<0.05).As the pit age increased,the richness and diversity of bacterial communities in the Huangshui of both the new and old pits gradually decreased, while the fungal communities initially decreased and then increased.The Huangshui of different pits ages could be distinguished by PCoA.Lactobacillus and Microascus were the dominant genera in the new pit,while Lactobacillus and Thermoascus were the dominant genera in the old pits.Lactobacillus showed a significant positive correlation with the contents of lactic acid,reducing sugar,and starch(P<0.01),suggesting that Lactobacillus might be the key genus influencing the differences in Huangshui across pit ages and in the fermentation system of Baijiu.Moreover, the fungal genera Monascus and Penicillium were positively correlated with lactic acid,caproic acid,reducing sugar,and starch contents.These findings indicated that changes of pit age had an important effect on the formation of microbial community and its metabolites in the Huangshui.
Key words:Huangshui;pit age;Qionglai production area;microbial community;difference analysis
黄水又名黄浆水,是白酒发酵过程中原料经微生物分解代谢形成的具有酸涩味的棕褐色液体[1]。黄水中不仅富含醇、酸、醛、酯等微量有机成分,也含有大量微生物、糖类物质、含氮化合物等[2-3],浓香型白酒酒醅中的微生物会在重力作用下通过黄水转移至窖泥,窖泥中的微生物也会通过黄水迁移至酒醅,两者间的微生物互作关系显著影响着白酒发酵品质[4-5],因此黄水作为浓香型白酒窖泥和酒醅物质与能量的交换介质发挥着重要的作用[6-7]。已有研究通过分析黄水的理化指标及风味特征来反映多粮浓香型白酒窖内发酵状态,说明黄水与白酒发酵体系质量密切相关[8-9]。因此,以黄水为监测及调控切入点,对浓香型白酒的“可视化”生产具有重要意义。
近年来,探究黄水发酵变化规律及相关微生物群落成为了研究热点。彭杰等[10]通过对不同发酵季节的黄水理化指标和微生物分析,发现在不同发酵季节下的黄水呈现出相似的变化规律,证明通过检测黄水的方法不会受到发酵季节的影响;唐艳平等[11]通过对不同黄水中微生物群落分析,发现不同来源黄水之间的微生物群落存在异质性,与黄水理化因子显著相关。黄水作为维系并影响浓香型白酒发酵体系的纽带,因此,探究黄水的理化指标和微生物群落至关重要。窖龄是影响浓香型白酒发酵质量的关键,有大量的研究表明不同窖龄之间的酒醅、窖泥与基酒等均存在显著的差异。敖灵等[12]分析了不同窖龄的浓香型基酒,发现窖龄能够显著影响酒体风味。樊科权等[13]通过分析不同窖龄的窖泥微生物群落特征,发现窖泥中细菌群落多样性与窖龄呈现负相关,窖龄越长其微生物群落结构会更趋于相对稳态。 邱显平等[14]通过新、老窖池发酵过程中酒醅微生物群落结构差异分析,发现老窖池酒醅的微生物互作网络具有更高的聚集程度,微生物群落的共存关系也更加复杂,稳定性更高。总之,现存相关研究表明,不同窖龄间发酵体系存在明显的差异。
当前,川酒邛崃产区作为中国最大的浓香型白酒原酒生产基地之一[15],以邛崃产区为特色,聚焦不同窖龄黄水差异性的专门研究鲜有报道。以白酒发酵期间容易抽取的黄水为监测及调控切入点,探究不同窖龄的差异对浓香型白酒的“简易可视化”生产具有重要意义。基于此,本研究以邛崃某白酒企业不同窖龄的黄水为研究对象,分析不同窖龄黄水的理化性质和微生物等差异,旨在为初步明晰邛崃产区不同窖龄黄水的差异与特征提供一定的数据支撑,助力邛酒的“可视化”生产。
1 材料与方法
1.1 材料与试剂
盐酸、乙酸、丙酸、丁酸、乳酸、正己酸、五水硫酸铜、次甲基蓝、葡萄糖、氢氧化钠、酒石酸钾钠、亚铁氰化钾(均为分析纯):成都科隆化学品有限公司;OMEGA Soil脱氧核糖核酸(deoxyribonucleic acid,DNA) Kit(D5625-01)试剂盒:OMEGA Bio-tek有限公司。
1.2 仪器与设备
DF-101S-集热式恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;Agilent 1200 series高效液相色谱仪:安捷伦科技(中国)有限公司;AR2140-电子天平、FE28-pH计:梅特勒-托利多仪器有限公司;HVA-85-垂直层流洁净工作台:日本Sanyo公司;TU-1901紫外分光光度计:上海仪电科学仪器有限公司。
1.3 实验方法
1.3.1 黄水样本采集
该研究在四川省邛崃市某浓香型白酒企业厂间(五粮工艺)按三组窖龄,新窖池(一年窖龄)、十年以上窖池(十一年窖龄)、二十年以上窖池(二十一年窖龄)随机选取9口发酵工艺与历史数据相近的新老窖池组,按一年窖池、十年以上窖池、二十年以上窖池分组,每组3口窖池。在同一时间发酵结束时,对确定的9个窖池抽取黄水样本,按统一窖龄组的3口窖池黄水样本均匀混合,将一年窖池、十年以上窖池、二十年以上窖池组的黄水分别标记为YW-new、YW-10、YW-20。
1.3.2 黄水理化指标检测
参照地方标准DB34/T 1728—2012《白酒固态发酵黄浆水中常规指标的分析方法》,对不同窖龄黄水的淀粉和还原糖含量进行测定,并使用FE28-pH计测定不同窖龄黄水的pH。
1.3.3 黄水中不挥发有机酸含量测定
黄水样品的预处理:通过移液枪准确吸取20 mL黄水于50 mL离心管备用,将不同窖龄黄水样品分别于5 000 r/min离心5 min,再用0.22 μm滤膜过滤后于高效液相色谱进样分析。
高效液相色谱条件:Bio-Rad Aminex HPX-87H色谱柱(300 mm×7.8 mm);柱温35 ℃;流动相5 mmol/L H2SO4;进样体积10 μL;示差检测器;检测温度40 ℃。
五种有机酸的标准曲线绘制:分别配制浓度梯度为0.25 mg/mL、0.5 mg/mL、1.0 mg/mL、2.5 mg/mL、5.0 mg/mL的有机酸标准样品,将配制好的标准溶液按浓度顺序于液相色谱分析,绘制各有机酸的峰面积-质量浓度曲线,计算五种有机酸的线性回归方程和相关系数。
1.3.4 DNA提取与Illumina高通量测序
量取不同窖龄的黄水各5 mL,用OMEGA bio-tek有限公司提供试剂盒提取DNA,通过TU-1901紫外分光光度计测定其浓度与纯度。 使用引物338F/806R(5'-ACTCCTACGGGAGGCAGCAGAG-3'/5'-GGACTACHVGGTWTCTAAT-3')扩增细菌16SrRNA 基因的V3~V4可变区域,用引物ITS1f/2043R(5'-CTTGGTCATTAGGAAGA-3'/5'-GCTGCGTTCTTCATCGATGC-3')扩增真菌rRNA基因的ITS区。
聚合酶链式反应(polymerase chain reaction,PCR)扩增体系:0.25μLQ5 高保真DNA聚合酶、5 μL5倍浓缩反应缓冲液、5 μL 5倍浓缩高GC含量缓冲液、2 μL脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(10 mmol/L)、2 μL DNA模板,1 μL正向引物(10 μmol/L),1 μL反向引物(10 μmol/L),8.75 μL ddH2O。 细菌PCR扩增程序:98 ℃预热2 min,98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,一共25个循环,最后72 ℃保持5 min使产物延伸完整。真菌PCR扩增程序:95 ℃预热3 min,95 ℃变性30 s,61 ℃退火30 s,72 ℃延伸45 s,共32个循环,最后72 ℃保持10 min使产物延伸完整,都通过Illumina平台进行测序。
1.3.5 测序数据处理与统计学分析
所得的不同窖龄黄水原始序列数据利用demux、cutadapt、DADA2插件进行处理,对处理后的序列按照100%的序列相似度进行归并,生成特征性序列ASVs以及丰度数据表格。将扩增子序列变异(amplicon sequence variants,ASV)特征序列与Greengenes数据库中的参考序列相比对,获取每个ASV所对应的分类学信息,根据ASV划分和分类地位鉴定结果。通过QIIME2软件对每个黄水样本计算Chao1指数、Observed species指数、Shannon指数和Simpson指数。不同窖龄黄水样本理化因子之间的差异显著性分析通过SPSS(24.0)方差分析实现,不同窖龄黄水中真菌与细菌主坐标分析(principal coordinates analysis,PCoA)分析利用R软件绘制,不同窖龄黄水理化因子与其菌群组成之间的热图分析通过Tbtools软件绘制。
2 结果与分析
2.1 黄水理化性质的差异
五种有机酸的线性回归方程和相关系数见表1。由表1可知,5种有机酸标准曲线回归方程相关系数均>0.999,表明在测定范围内线性关系良好。
表1 五种有机酸的线性回归方程参数
Table 1 Linear regression equations parameters of five organic acids

有机酸 保留时间/min 回归方程 相关系数(R2)乙酸丙酸丁酸乳酸己酸15.3 18.0 21.8 13.7 18.9 Y=136 616x+11 289 Y=177 750x-7 405.2 Y=199 188x+10 013 Y=148 842x-5 615.3 Y=119 782x+3 630.9 0.999 9 0.999 9 0.999 9 0.999 9 1
邛崃产区不同窖龄的黄水理化性质测定结果见表2。
表2 邛崃产区不同窖龄的黄水理化指标测定结果
Table 2 Determination results of physiochemical indexes of Huangshui from different pit ages in Qionglai production area
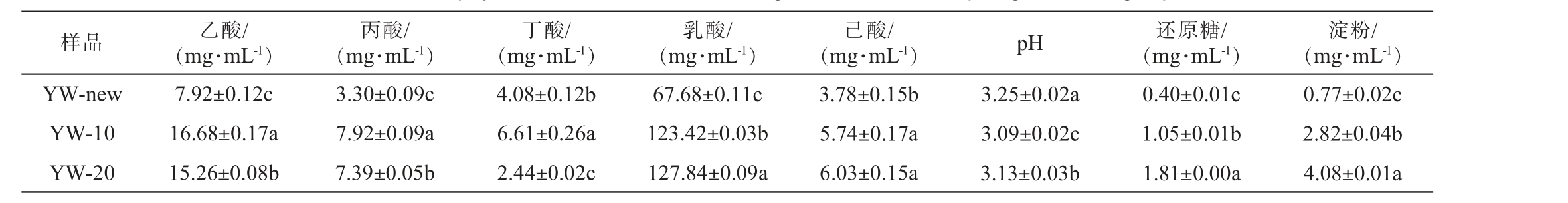
注:同列不同小写字母表示差异显著(P<0.05)。
样品 乙酸/(mg·mL-1)丙酸/(mg·mL-1)丁酸/(mg·mL-1)乳酸/(mg·mL-1)(mg·mL-1) pH 还原糖/(mg·mL-1)己酸/淀粉/(mg·mL-1)YW-new YW-10 YW-20 0.77±0.02c 2.82±0.04b 4.08±0.01a 7.92±0.12c 16.68±0.17a 15.26±0.08b 3.30±0.09c 7.92±0.09a 7.39±0.05b 4.08±0.12b 6.61±0.26a 2.44±0.02c 67.68±0.11c 123.42±0.03b 127.84±0.09a 3.78±0.15b 5.74±0.17a 6.03±0.15a 3.25±0.02a 3.09±0.02c 3.13±0.03b 0.40±0.01c 1.05±0.01b 1.81±0.00a
由表2可知,新老窖池黄水样品中各项理化性质存在显著性差异(P<0.05),表明黄水样品理化性质与窖龄可能存在一定的相关性。 新窖池黄水与窖龄十年以上的相比,老窖池黄水的乙酸、丙酸、己酸含量显著高于新窖池(P<0.05),老窖池发酵过程中代谢形成的各种酸类物质更丰富,可能是老窖池发酵过程中存在更优的氢传递,更容易促进己酸等酸类物质的合成[16]。黄水样品中的丁酸随着窖龄增加则表现出先升高后降低的趋势,可能是与白酒发酵过程中合成其他酸类有关。 另一方面,黄水样品的乳酸含量随窖龄的增加显著提升(67.68 mg/mL增至127.84 mg/mL)(P<0.05),可能是随着窖池年份的增加,产乳酸菌属逐渐成为优势菌属造成的,需要进一步结合微生物多样性分析以充分验证。研究结果还表明,与新窖池黄水相比,老窖池中黄水的还原糖、淀粉含量显著上升(P<0.05),残糖类物质含量升高,表明窖龄对发酵体系的理化性质有着突出贡献。新窖池黄水的pH相比都显著高于老窖池(P<0.05),可能是由于新窖池微生物群体尚未稳定,微生物之间代谢不够平衡,发酵产物与利用机制不同。 现有研究表明,窖龄与微生物利用效率成正相关,能够在一定程度上影响发酵体系及基酒的品质[17]。 新窖池和老窖池的黄水在理化性质上存在差异,说明窖龄可能与黄水的理化性质有一定相关性,同时窖龄与微生物利用效率呈正向关性,随着窖龄增加,发酵体系和基酒的品质可能会得到提升。
2.2 黄水微生物α-多样性分析
不同窖龄黄水微生物群落α-多样性分析结果见表3。由表3可知,不同窖龄黄水微生物的丰富度指数Chao 1指数为29.05~438.49,而Observed species指数在28.8~436.6之间。 随着窖龄的增加,黄水中细菌的Chao 1指数和Observed species指数都呈现下降趋势,与窖龄的变化呈负相关。可能是随着窖龄的递增,受到黄水理化中乳酸含量及酸度增强的影响,对黄水微生物群落进行了长期的选择与驯化[18]。但黄水中的酸类物质趋于相对稳定,形成相对稳定的微生物群落。随着窖龄的增长,真菌类的Chao 1指数和Observedspecies指数呈现先降低再增加的趋势,初期窖池环境可能较为不稳定或资源有限,导致真菌的多样性下降。而随着时间的推移,环境逐渐稳定,微生物之间的相互作用发生变化,部分真菌种类逐渐适应了新的环境条件,从而导致群落的多样性回升。
表3 邛崃产区不同窖龄黄水微生物群落α-多样性分析
Table 3 α-Diversity analysis of microbial communities of Huangshui in Qionglai production area with different pit ages
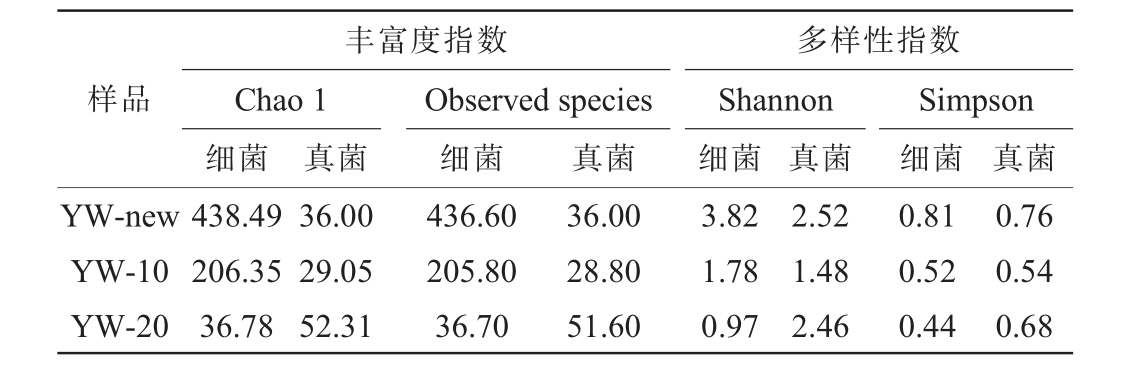
样品丰富度指数Chao 1细菌Observed species细菌真菌 真菌 真菌多样性指数Shannon细菌Simpson细菌 真菌YW-new YW-10 YW-20 438.49 206.35 36.78 36.00 29.05 52.31 436.60 205.80 36.70 36.00 28.80 51.60 3.82 1.78 0.97 2.52 1.48 2.46 0.81 0.52 0.44 0.76 0.54 0.68
不同窖龄黄水微生物的多样性指数Shannon指数在0.97~3.82之间,Simpson指数在0.44~0.81之间,多样性指数趋势与丰富度指数类似。随着窖龄的升高,新窖池与老窖池黄水中的细菌群落丰富度和多样性逐渐减少,而真菌群落则表现出先降低后升高的趋势,该现象可能与黄水中酸类物质的稳定化有关。
2.3 黄水微生物PCoA分析结果
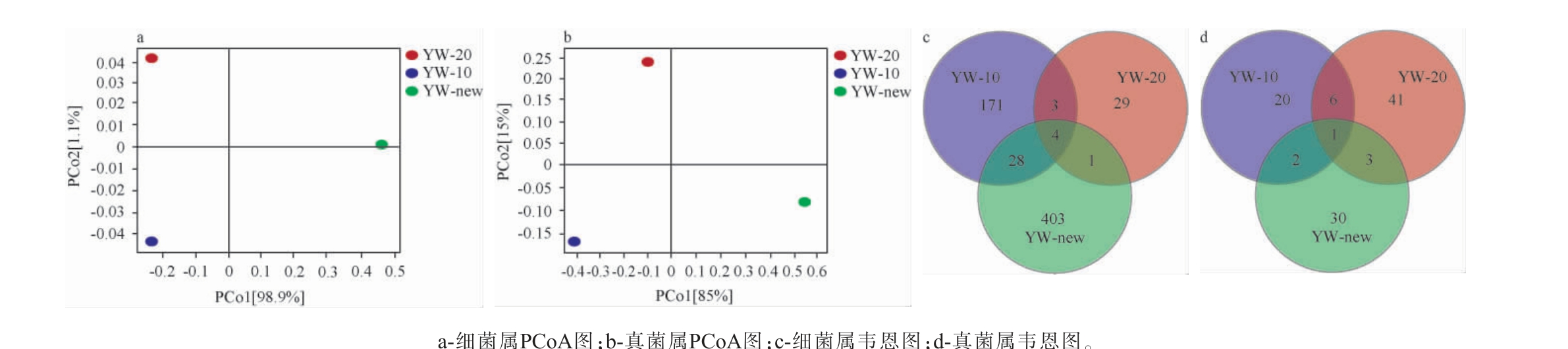
邛崃产区不同窖龄黄水微生物PCoA分析和韦恩图结果见图1。由PCoA图(图1a-b)可知,不同窖龄黄水中的细菌属与真菌属样本间距较为离散,样本之间差异性较大,表明不同窖龄黄水微生物之间的差异性显著,主坐标分析法可以将不同窖龄的黄水分开。
根据黄水样本中微生物丰度数据绘制韦恩图(图1c、1d)进一步分析不同窖龄黄水之间微生物的差异性,结果表明,细菌属中,新窖池黄水和窖龄十年的黄水样品相同菌属有32种,十年窖龄以上与二十年窖龄以上黄水相同菌属有7种,新老窖池黄水之间存在有4种相同细菌属。真菌属中,新窖池黄水和窖龄十年的黄水相同菌属有3种,十年窖龄以上与二十年窖龄以上黄水相同菌属有7种,新老窖池黄水之间仅有1种相同菌属。结果表明,不同窖龄黄水中细菌属和真菌属都随着窖龄的改变而发生波动,发酵体系中细菌与细菌,真菌与真菌以及细菌与真菌之间存在相互作用[19],表明随着窖龄的改变,微生物之间的互作关系可能会发生变化导致相对丰度发生改变。
2.4 微生物相对丰度分析
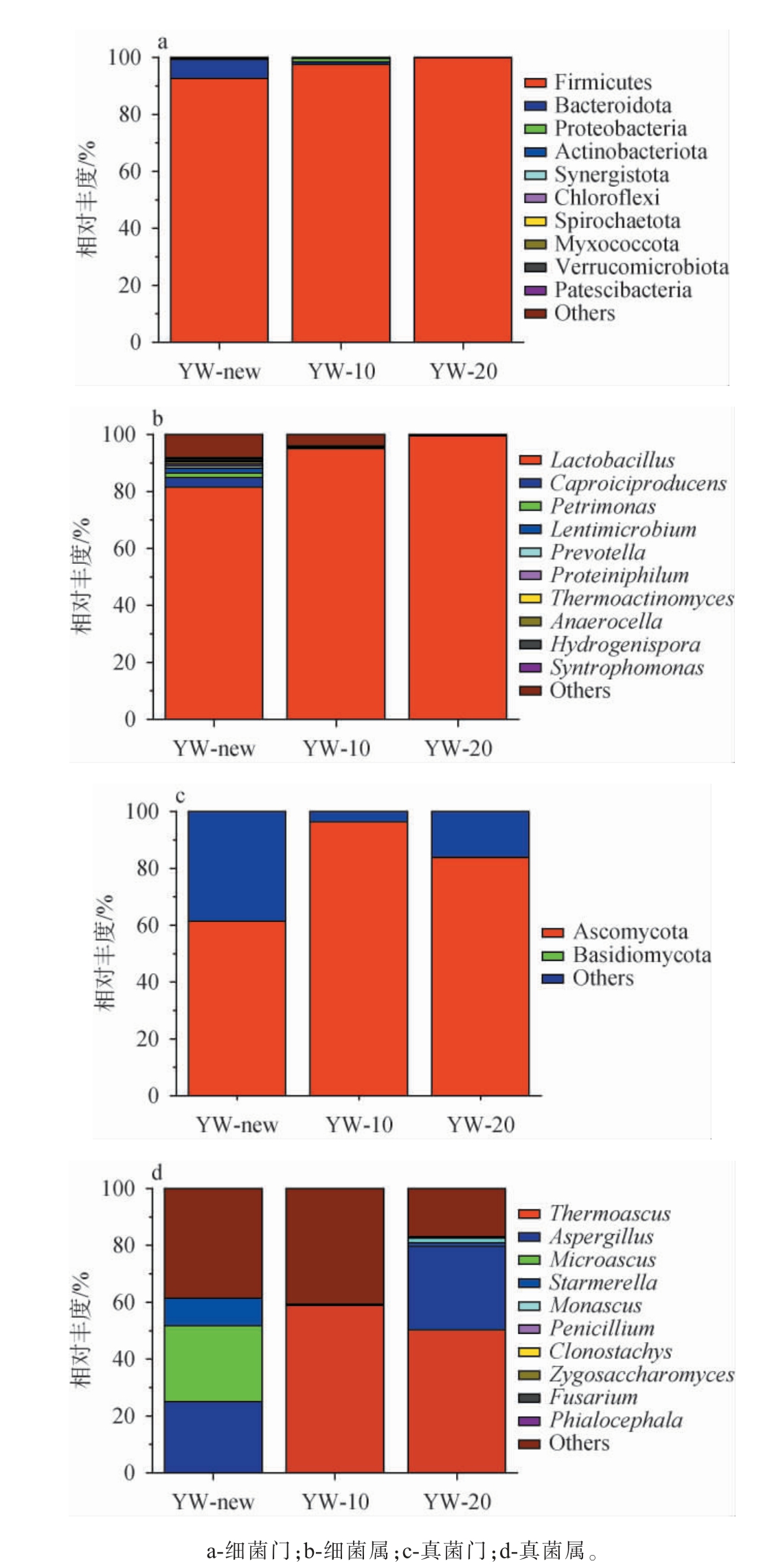
对不同窖龄的黄水样品微生物相对丰度进行分析,结果见图2。
由图2a、b可知,细菌门类中厚壁菌门(Firmicutes)为主要菌门,新窖池黄水中占比92.72%,而十年窖龄以上和二十年窖龄以上黄水中更为丰富(97.60%、99.93%)。新窖池黄水细菌中主要含有乳杆菌属(Lactobacillus,81.53%)、己酸菌属(Caproiciproducens,3.46%)、理研菌属(Petrimonas,1.57%)等。随着窖龄的增加,乳杆菌属相对丰度(十年窖龄以上95.12%,二十年窖龄以上99.58%)不断提升、其他细菌普遍减少,表明乳杆菌属在发酵体系中为具有优势竞争力的细菌属[20-21]。 乳杆菌的种类和含量多方面影响着发酵体系,魏斯氏菌主要代谢产生乳酸、乙酸和酶类等能够影响发酵体系。但乳酸菌属过多会导致产生过高的乳酸含量,从而抑制发酵及糖化过程中酶的活性,还会对其他有益菌属(如己酸菌属、曲霉属等)造成毒害作用及竞争现象[22]。目前浓香型白酒行业普遍面临发酵乳酸含量过高的问题,平衡乳酸含量是生产实践中需要解决的关键问题。 因此,鉴于黄水与发酵糟醅,窖泥等均存在不同程度的物质与微生物传递[23-25],黄水乳酸菌属的定向调控方向将是未来浓香型白酒行业提质增效的新着力点。
由图2c、d可知,真菌门类中子囊菌门(Ascomycota)为主要菌门,新窖池黄水中占比61.45%,十年窖龄以上和二十年窖龄以上黄水中分别为96.47%和83.91%。真菌属类中十年窖龄以上和二十年窖龄以上黄水检测到相对丰度较高的嗜热子囊菌属(Thermoascus,58.92%和50.36%),现有研究表明,嗜热子囊菌属具有提高淀粉糖化的强劲潜力[26],但该属在新窖池黄水中含量较低(新窖池优势菌属为微曲霉属26.63%),该菌丰度的差异可能会影响发酵体系中部分理化性质。 此外,十年窖龄以上黄水与二十年窖龄以上黄水中曲霉属(Aspergillus)含量分别为24.99%和29.32%,有研究报道,曲霉菌属能通过参与发酵过程产生大量的胞外酶和增香产物[27],有助于提高原料的糖化能力、益于风味物质的生成。因此,特定真菌属在适宜情况的强化可能具有改善发酵体系的潜力。
2.5 黄水理化性质与基于属水平微生物的相关性
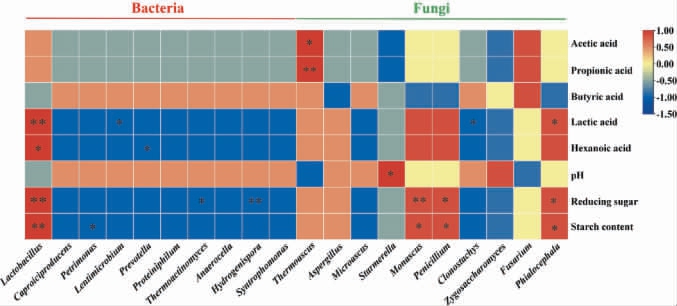
为进一步揭示新老窖池黄水中微生物与理化性质之间的相关性,选取新老窖池黄水中细菌和真菌相对丰度前10的可鉴定属进行热图可视化分析,结果见图3。由图3可知,新老窖池黄水中细菌属丰度前10为乳杆菌属(Lactobacillus,92.07%)、己酸菌属(Caproiciproducens,1.26%)、理研菌属(Petrimonas,0.58%)、Lentimicrobium(0.56%)、普雷沃氏菌属(Prevotella,0.30%)、嗜蛋白质菌属(Proteiniphilum,0.29%)、高温放线菌属(Thermoactinomyces,0.25%)、厌氧球菌属(Anaerocella,0.20%)、产氢分枝菌属(Hydrogenispora,0.17%)、共营养单胞菌属(Syntrophomonas,0.15%)。 结果显示,乳杆菌属(Lactobacillus)与乳酸、己酸、还原糖、淀粉含量呈显著正相关(P<0.05)。乳杆菌属代谢产生的乳酸、乙酸等有机酸能直接影响发酵体系[28],这进一步解释了前文不同窖龄间黄水相关有机酸差异的微生物菌属层次可能性(表2和图2)。 另一方面,乳杆菌属还能以酸类物质为原料产生乳酸乙酯、乙酸乙酯等酯类物质影响白酒发酵与风味特征[29-30]。此外,乳杆菌属也能通过乳糖酶将乳糖分解为葡萄糖和半乳糖,为酵母生长提供碳源[31]。研究结果表明,乳杆菌属可能是影响不同窖龄黄水差异及白酒发酵体系的主要细菌属。
新老窖池黄水中真菌属丰度前10为嗜热子囊菌属(Thermoascus,36.45%)、曲霉属(Aspergillus,18.24%)、微曲霉属(Microascus,8.88%)、星形酵母属(Starmerella,3.65%)、红曲菌属(Monascus,0.57%)、青霉菌属(Penicillium,0.15%)、克隆孢霉属(Clonostachys,0.01%)、接合酵母菌属(Zygosaccharomyces,0.01%)、镰孢菌属(Fusarium,0.01%)、Phialocephala(0.01%)。 其中红曲霉属、青霉菌属、Phialocephala与还原糖、淀粉含量呈显著正相关(P<0.05),嗜热子囊菌属与乙酸、丙酸含量呈显著正相关(P<0.05);有研究表明曲霉属(Aspergillus)是诸多胞外酶(如淀粉酶和糖化酶)的主要贡献者,参与大分子物质的降解代谢,对白酒生产体系的发酵具有增益能力[32]。这意味着这些真菌可能与代谢过程中的某些物质变化密切相关,牵动发酵过程中的物质转化,进而影响白酒的风味和品质。 为改进传统白酒发酵工艺和提高白酒的质量提供了潜在的微生物学依据。
3 结论
本研究通过检测不同窖龄黄水的理化指标和微生物群落结构,明析不同窖龄之间黄水的变化规律以及黄水理化指标与微生物群落之间的关系。 结果表明,随着窖龄的增加,黄水中的己酸含量、乳酸含量及还原糖、淀粉等物质的含量显著上升(P<0.05),尤其是在老窖池中,黄水的酸性物质和微生物的种类和丰度都有明显变化。微生物群落分析结果显示,随着窖龄的增加,黄水中的细菌群落的丰富度和多样性呈下降趋势,而真菌群落则呈先下降后回升的趋势。尤其是乳杆菌属在老窖池黄水中的相对丰度显著提高,这表明其在发酵过程中可能发挥了主导作用。 真菌群落方面,嗜热子囊菌属和曲霉属的丰度随着窖龄的增加而增加,这些真菌种类的代谢产物可能对发酵体系中的物质转化产生重要影响。通过韦恩图和PCoA得知,细菌和真菌群落的结构随着窖龄变化呈现出不同的分布模式,提示窖龄对微生物群落的选择和演替有重要作用。
综上所述,窖龄对黄水的理化性质及微生物群落结构具有显著影响,随着窖龄的增加,发酵体系中的酸类物质趋于稳定,微生物群落逐渐形成相对稳定的结构。 细菌中乳酸菌属和真菌中曲霉属可能是影响黄水理化性质的关键因素。本研究结果将为进一步明晰浓香型白酒不同窖龄与黄水关联规律提供一定的理论基础,对浓香型白酒的“可视化”生产具有重要意义。
参考文献:
[1]王莉,袁宁,管桂坤,等.黄水对浓香型白酒酒质的影响[J].酿酒科技,2020(10):83-86.
[2]黄治国,江科,乔宗伟,等.五粮浓香型白酒发酵过程中黄水变化规律探究[J].现代食品科技,2023,39(5):210-216.
[3]梅漫莉,王艳丽,何宏魁,等.浓香型白酒酿造过程中黄浆水理化指标和风味物质的变化规律[J].中国酿造,2024,43(7):104-109.
[4]CHAI L J, QIAN W, ZHONG X Z, et al.Mining the factors driving the evolution of the pit mud microbiome under the impact of long-term production on strong-flavor Baijiu[J].Appl Environ Microbiol,2021,12:741718.
[5]GAO J J,LIU G Y,LI A J,et al.Domination of pit mud microbes in the formation of diverse flavour compounds during Chinese strong aroma-type Baijiu fermentation[J].LWT-Food Sci Technol,2022,159:111566.
[6]潘玲玲,班世栋,王媚,等.流加黄水对浓香型白酒产量和质量的影响[J].中国酿造,2024,43(2):174-180.
[7]张榆俊,张宿义,张楷正,等.浓香型白酒发酵过程中黄水与酒醅的相关性[J].中国酿造,2023,42(5):35-40.
[8]谢旭,黄永军,洪胜,等.黄水形成及其对酒醅风味物质影响的研究[J].酿酒,2019,46(4):20-23.
[9]郭辉祥,余东,龙远兵,等.发酵期间多粮浓香型白酒窖内黄水成分的变化趋势[J].中国酿造,2020,39(1):82-87.
[10]彭杰,张宿义,敖宗华,等.浓香型白酒发酵过程中黄水理化指标与微生物群落的相关性研究[J].酿酒科技,2024(6):65-74.
[11]唐艳平,高秀兵,倪婕,等.白酒发酵副产物黄水原核微生物组成及理化特性研究[J].中国酿造,2024,43(3):72-78.
[12]敖灵,曾珊,沈才洪,等.不同窖龄窖池酿造浓香型基酒的风味差异分析[J].食品科学,2024,45(19):104-111.
[13]樊科权,刘孟华,唐清兰,等.浓香型白酒不同窖龄窖池微生物群落特征研究[J].酿酒科技,2024(7):60-64.
[14]邱显平,黄桥,杨静,等.浓香型白酒在新、老窖池发酵过程中酒醅微生物群落结构差异分析[J].中国酿造,2024,43(1):50-56.
[15]林涵瑞,刘林培,黄蜀生,等.邛崃产区中高温大曲性能及微生物动态变化研究[J].食品与发酵工业,2023,50(19):117-126.
[16]TAO Y, WANG X, LI X Z, et al.The functional potential and active populations of the pit mud microbiome for the production of Chinese strong-flavour liquor[J].Microbial Biotechnol,2017,10(6):1603-1615.
[17]张会敏,孟雅静,王艳丽,等.新老窖池黄水的差异性及静置培养对其影响[J].食品科学,2020,41(2):215-222.
[18]任海伟,孙一帆,王希,等.不同窖龄及位置浓香型白酒窖泥中细菌群落结构的差异性分析[J].食品与发酵工业,2023,49(9):103-111.
[19]赵亮亮,盛伟喜,时晓,等.浓香型白酒酿造生境中微生物群落多样性及群落间相互作用[J].中国酿造,2023,42(11):15-21.
[20]胡世伟,王超凡,王景春,等.浓香型白酒窖泥微生物群落及其风味成分研究进展[J].中国酿造,2023,42(12):9-12.
[21]TAN Y W, ZHONG H P, ZHAO D, et al.Succession rate of microbial community causes flavor difference in strong-aroma Baijiu making process[J].Int J Food Microbiol,2021,354:109323.
[22]杨荣,华进,周亚宾,等.白酒酿造中乳酸产生及控制的研究进展[J].中国酿造,2024,43(3):21-26.
[23]曾波,饶家权,邹永芳,等.浓香型白酒酒醅发酵过程中微生物群落结构演替及其与理化指标相关性[J].食品科学,2024,45(7):111-118.
[24]车路萍.浓香型白酒发酵过程中酒醅与黄水相关性研究[D].宜宾:四川轻化工大学,2020.
[25]吴玉轩.浓香型白酒窖泥己酸菌丰度分析与应用研究[D].济南:齐鲁工业大学,2023.
[26]MCCLENDON S D,BATTH T,PETZOLD C J,et al.Thermoascus aurantiacus is a promising source of enzymes for biomass deconstruction under thermophilic conditions[J].Biotechnol Biofuel,2021,1(14):97.
[27]贺奕森.浓香型白酒大曲中霉菌的分离鉴定及应用[D].邯郸:河北工程大学,2023.
[28]阎春悦,利佳炜,张茜,等.不同香型白酒酿造过程乳酸菌的研究进展[J].酿酒科技,2023(9):114-120.
[29]邢敏钰,杜海,徐岩,等.芝麻香型白酒发酵过程中乳酸菌多样性及其演替规律[J].微生物学通报,2018,45(1):19-28.
[30]PANG X N,CHEN C,HUANG X N,et al.Influence of indigenous lactic acid bacteria on the volatile flavor profile of light-flavor Baijiu[J].LWTFood Sci Technol,2021,147:111540.
[31]SUDEN,WULIJIDELIGEN,ARAKAWA K,et al.Interaction between lactic acid bacteria and yeasts in airag, an alcoholic fermented milk[J].Animal Sci J,2013,84(1):66-74.
[32]王乐.基于微生物多样性分析探究北方浓香型白酒高级醇含量偏高的原因及解决措施[D].呼和浩特:内蒙古农业大学,2022.