Analysis of organic acids in high-temperature Daqu based on UPLC-MS/MS technology
高温大曲是以小麦为主要原料,采用生料制曲、自然接种,在培养室内固态发酵而成,制曲过程中品温可达65 ℃左右[1-2],是生产酱香酒必不可少的糖化发酵剂。高温大曲中含有丰富的独特微生物、蛋白质、糖类物质和有机酸等,为酱香型白酒提供了必要的酶系、功能菌和风味前体物质。其中,有机酸是一种水溶性化合物,在预测和评价食品成熟度、生产和质量控制方面起到至关重要的作用[3]。作为酱香型白酒中的一类化合物,有机酸对白酒的风味和口感产生着重要影响,发酵过程中还影响着微生物的生长与繁殖[4]。 张倩[5]研究表明,高温大曲的酸度是影响其产品质量的重要因素之一,因此清晰大曲中的有机酸种类及含量,对大曲发酵工艺的监控有重要意义。
目前,测定有机酸的方法主要有气相色谱法(gas chromatography,GC)[6-7]、气相色谱-质谱法(gas chromatographymass spectrometry,GC-MS)[8-10]、离子色谱法(ion chromatography,IC)[11-12]、高效液相色谱法(high performance liquid chromatography,HPLC)[13-16]和高效液相色谱-串联质谱法(high-performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)[17-19]。GC和GC-MS法主要用于分析易挥发性有机酸,对于不易挥发性有机酸,分析前需采用三甲基氯硅烷和吡啶等衍生试剂进行衍生化,操作步骤繁琐、耗时,且所用试剂有毒,对环境和实验室人员不友好,不利于批量样品的分析。 离子色谱需除去蛋白质干扰,不适合微量成分分析。国标GB 5009.157—2016《食品安全国家标准食品中有机酸的测定》[20] 中采用HPLC法测定食品中7种有机酸,存在分析的有机酸种类少,且无法有效确证分离的有机酸等问题。 目前,鲜见大曲中有机酸分析方面的研究报道,骆茂香等[21-22]采用HPLC法测定大曲中有机酸,存在分析种类少、耗时长等不足。LC-MS/MS具有抗干扰能力强,分离度高、选择性好,灵敏度高、检出限低和高通量等特点,是一种更有前景的方法。
本研究基于超高效液相色谱-三重四极杆串联质谱(ultra-high performance liquid chromatography-triple quadrupole tandem mass spectrometry,UPLC-MS/MS)检测技术,以期建立一种快速测定高温大曲中11种有机酸的新方法。该方法具有简便、快速、准确、高通量等优点,为高温大曲制曲过程的质量监控提供技术参考。
1.1.1 材料
高温大曲样品(24份,入仓曲、翻仓曲、拆仓曲和生产用大曲各6份):由贵州省某酱香酒企业提供。
1.1.2 试剂
甲酸(色谱纯):赛默飞世尔科技公司;甲醇、乙腈(均为色谱纯)、己二酸、L-抗坏血酸、柠檬酸、富马酸、L-(+)-乳酸、异柠檬酸、马来酸、丙二酸、D-(+)-苹果酸、琥珀酸、D-(-)-酒石酸标准品(纯度均≥98%):德国Merck公司。
1290UPLC-6470MSMS超高效液相色谱-三重四级杆质谱联用仪:美国安捷伦科技有限公司;Milli-QR IQ 7000超纯水仪:美国密理博公司;XSR205DU分析天平:梅特勒-托利多公司;SCAA-114微孔滤膜:上海安谱公司;ZORBAX SB-C18色谱柱(100 mm×2.1 mm,1.8 μm):美国安捷伦科技有限公司;Accucore aQ色谱柱(150 mm×2.1 mm,2.6 μm):赛默飞世尔科技公司。
1.3.1 标准溶液的配制
储备液配制:精确称取适量有机酸标准品,分别置于10 mL棕色容量瓶中,用50%甲醇水溶液溶解并定容,配制成5 000 mg/L的标准储备溶液,4 ℃下避光保存2个月,其中抗坏血酸现配现用。
中间标准液配制:以水为溶剂,配制成含柠檬酸、异柠檬酸、酒石酸、琥珀酸、苹果酸、丙二酸、乳酸、己二酸、马来酸、富马酸的混合标准中间液(100 mg/L),4 ℃下避光保存7 d;其中抗坏血酸现配现用。
分别用大曲提取基质溶液逐级稀释标准中间液,得到混合标准溶液系列工作液,柠檬酸、异柠檬酸、酒石酸、琥珀酸、苹果酸、丙二酸、乳酸、己二酸、马来酸、富马酸、抗坏血酸11种化合物质量浓度依次为0.01 mg/L、0.025 mg/L、0.05 mg/L、0.1 mg/L、0.25 mg/L、0.5 mg/L、1.0 mg/L、2.5 mg/L、5.0 mg/L、10.0 mg/L、25.0 mg/L、50.0 mg/L。
1.3.2 高温大曲样品中有机酸含量分析
样品前处理:高温大曲磨粉,准确称取2.00 g高温大曲,置于50 mL离心管,加入30 mL水,涡旋振荡10 min,4 ℃8000r/min离心5min,取一定量上清液,离心(4℃、12000r/min)10 min,取一定量上清液,用水稀释,过0.22 μm滤膜,滤液待测。
UPLC条件:Accucore aQ色谱柱(150 mm×2.1 mm,2.6 μm);柱温40 ℃,进样量1 μL;流速:400 μL/min;流动相为:0.2%甲酸水溶液(A),甲醇(B);梯度洗脱程序:0~2 min,100%A、0B;2~2.5 min,100%~90%A、0~10%B;2.5 ~5.0 min,90%~25%A、10%~75%B;5.0 ~5.6 min,25%~0A、75%~100%B;5.6~6.0 min,0A、100%B,6.0~6.1 min,0~100%A、100%~0B;6.1~6.5 min,100%A、0B。
MS/MS条件:采用电喷雾离子(electrospray ionization,ESI)源;负离子扫描模式;多反应监测(multiple reaction monitoring,MRM)模式;离子喷雾电压-2.5 kV;鞘气温度400 ℃,鞘气流速11 L/min;喷嘴电压1 000 V;离子源温度:230 ℃,驻留时间20 ms。
1.3.3 样品前处理条件优化
在方法1.3.2基础上,以高温大曲为基质,分别考察提取溶剂(采用甲醇、50%甲醇水、水)及提取方式(超声(15 min)、振荡(5 min、10 min、15 min、20 min、30 min))对目标物峰面积的影响,确定提取溶剂及提取方式。
1.3.4 色谱条件优化
在1.3.2 MS/MS条件的基础上,采用标准溶液,依次考察色谱柱(ZORBAX SB-C18(100 mm×2.1 mm,1.8 μm)和Accucore aQ(150 mm×2.1 mm,2.6 μm))、流动相(甲醇、甲醇-0.2%甲酸水、甲醇-0.6%甲酸水、甲醇-0.8%甲酸水)、流速(0.20 mL/min、0.30 mL/min、0.35 mL/min、0.40 mL/min、0.45 mL/min)、柱温(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)4个变量对11种有机酸的分离效果和峰形影响,确定最佳色谱条件。
1.3.5 基质效应
采用UPLC-MS/MS技术分析时,复杂基质在质谱检测时由于离子化效应而产生的离子增强或抑制作用,称为基质效应[23]。通过对比基质样品溶液与纯溶剂添加混合标准溶液目标物的定量离子响应强度,考察高温大曲中11种有机酸检测方法的基质效应。 基质效应(matrix effecet,ME)计算公式为:
式中:A为基质溶液中定量离子的峰面积;B为纯溶剂中定量离子的峰面积。
ME为负值时,表示有基质抑制效应,ME为正值时,表示存在基质增强效应,ME在±20%以内表示基质效应不明显。
1.3.6 方法学考察
(1)检出限、定量限
将11种有机酸组分的基质标准工作溶液,按照最优方法进行测定。以11种有机酸的峰面积(Y)为纵坐标,质量浓度(X)为横坐标,绘制标准工作曲线。 以3倍和10倍信噪比(signal-to-noise ratio,S/N)分别确定方法的检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)。
(2)加标回收率和精密度试验
选取高温大曲样品,分别添加低、中、高3个水平的11种有机酸混标溶液,按照最优方法进行测定,重复6次。 计算方法的回收率和精密度试验结果的相对标准偏差(relative standard deviation,RSD)。
2.1.1 提取溶剂的选择
针对酒醅、大曲等固态基质中有机酸的提取,大多采用水、乙醇、甲醇和50%甲醇水溶液作为提取溶剂[21,24-25]。根据前期实验的经验,乙醇溶剂对质谱的离子化有较大的影响,因此,本研究对比了甲醇、水对11种有机酸的提取效果,结果见图1。由图1可知,甲醇作为提取溶剂时,酒石酸、马来酸未检出,其他化合物的峰面积也最低;水和50%甲醇水作为提取溶剂时,富马酸的峰面积无明显差异,而水作为提取溶剂时,其余10种化合物的峰面积是50%甲醇水作为提取溶剂时的1.14倍以上。 因此,确定最佳提取溶剂为水。
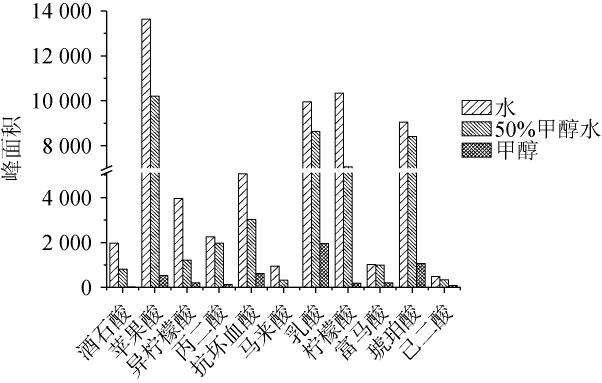
图1 提取溶剂对11种有机酸峰面积的影响
Fig.1 Effect of extraction solvents on the peak areas of 11 organic acids
2.1.2 提取方式的选择
有机酸常见的提取方法有浸泡法[26]、振荡提取法[22]、超声提取法[27-28],其中浸泡法耗时较长,因此本研究选择超声提取法和振荡提取法。 不同提取方式对11种有机酸提取效果的影响见图2。 由图2可知,以11种有机酸的峰面积作为参考指标,超声和振荡两种提取方式对马来酸的含量检测无明显差异,但对于其余化合物,振荡提取效果显著优于超声提取,振荡提取的响应值是超声提取的1.1倍以上;随着振荡时间在0~10 min范围内的增加,不同有机酸的峰面积整体呈增加趋势;当振荡时间>10 min后,各目标物的峰面积趋于稳定。 因此,确定最佳提取方式为振荡提取10 min。
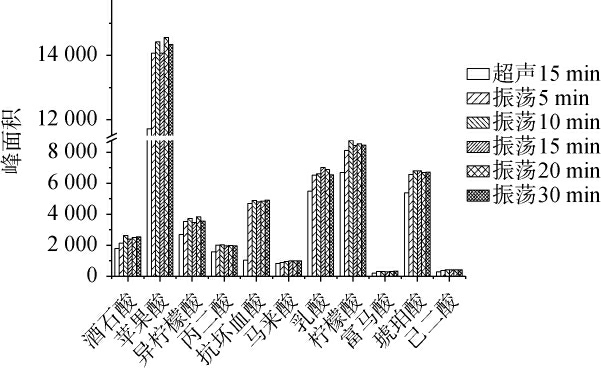
图2 提取方式对11种有机酸峰面积的影响
Fig.2 Effect of extraction methods on the peak areas of 11 organic acids
2.2.1 色谱柱
当选用SB-C18色谱柱(100 mm×2.1 mm,1.8 μm)时,富马酸和马来酸同分异构体分离差,异柠檬酸和柠檬酸峰形差,且未基线分离,大部分目标物保留差。SB-C18色谱柱是不封端的碳十八固定相,由于裸漏的硅醇基存在,与目标化合物发生氢键、离子间作用等,目标物在固定相中的扩散速率变慢,导致目标化合物有拖尾,峰形差等现象出现。当选用Accucore aQ色谱柱(150 mm×2.1 mm,2.6 μm)时,11种有机酸在Accucore aQ色谱柱上表现出良好的分离和保留,峰形更优,响应更佳。 其原因可能是色谱柱键合相使用极性基团封端,且于100%含水流动相完全兼容,可实现极性化合物更好的分离和保留。 因此,选择Accucore aQ色谱柱(150 mm×2.1 mm,2.6 μm)。
2.2.2 流动相
通过向流动相中添加酸性添加剂,以促进脱氢准分子离子峰[M-H]-的形成,增强目标化合物的响应值。 流动相对11种有机酸峰面积的影响见图3。 由图3可知,当流动相中添加0.2%甲酸,各有机酸化合物的响应值均最高,是未添加甲酸时的1.1~4.0倍。 但当流动相中甲酸浓度增大至0.6%、0.8%时,各有机酸的峰面积呈降低趋势,其响应值降幅为3%~54%,其原因可能是甲酸在喷雾电离时对目标物造成了电离抑制,目标物响应值明显降低。 这与战楠等[29]发现的添加甲酸量为0.9%时的离子化效应好的现象不同。因此,确定最佳甲酸添加量为0.2%。
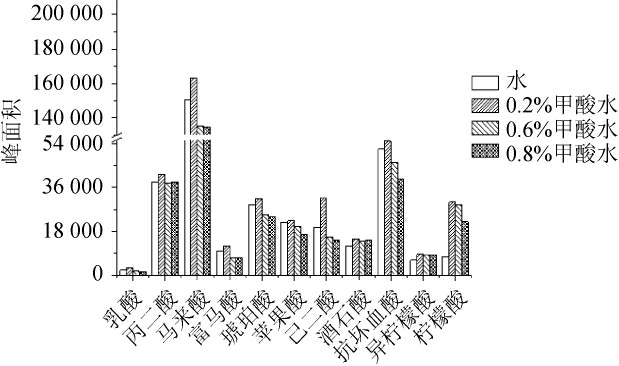
图3 流动相对11种有机酸峰面积的影响
Fig.3 Effect of mobile phase on the peak areas of 11 organic acids
2.2.3 流速
流速过大会导致溶剂通过柱床时速度过快,多种目标化合物分离不充分;而流速过小则会导致分析时间过长,峰展宽等现象[29]。 当流速低于0.35 mL/min时,有机酸峰宽大,且有拖尾现象,且分析时间过长,出峰时间靠后;当流速提升至0.4 mL/min时,11种有机酸可获得的尖锐的峰形和较好的灵敏度;而流速高于0.45 mL/min时,苹果酸、异柠檬酸、丙二酸和抗坏血酸4种化合物出现峰完全重叠,分离度不佳。因此,选择最优流速为0.4 mL/min。
2.2.4 柱温
柱温升高可提高传质效率、提升分离度、缩短分析时间,同时降低流动相黏度,但柱温过高不利于组分分离,且影响色谱柱的使用寿命[30]。 当柱温低于35 ℃时,出现峰展宽、拖尾的现象;柱温为40 ℃时,各目标化合物分离度好、峰形好,且有较好的保留,而柱温为45 ℃时,化合物在色谱柱上保留不佳,且多组分同时共流出,分离差。因此,确定最佳柱温为40 ℃。
配制11种有机酸标准溶液约5.0 mg/mL,采用单针自动进样分析分别在正、负离子模式下扫描,根据化合物的响应强度选择目标化合物的电离方式;有机酸含有羧基基团,容易产生[M-H]-,负离子模式下目标化合物响应更高,因此选择负离子模式。采用全扫描模式和反应离子监测(MRM)模式,获得分子离子峰和定性定量离子,并优化其去簇电压和碰撞能等质谱参数,结果见下表1。
表1 各待测组分化合物信息及质谱参数
Table 1 Information and mass spectrum parameters of each target component compounds
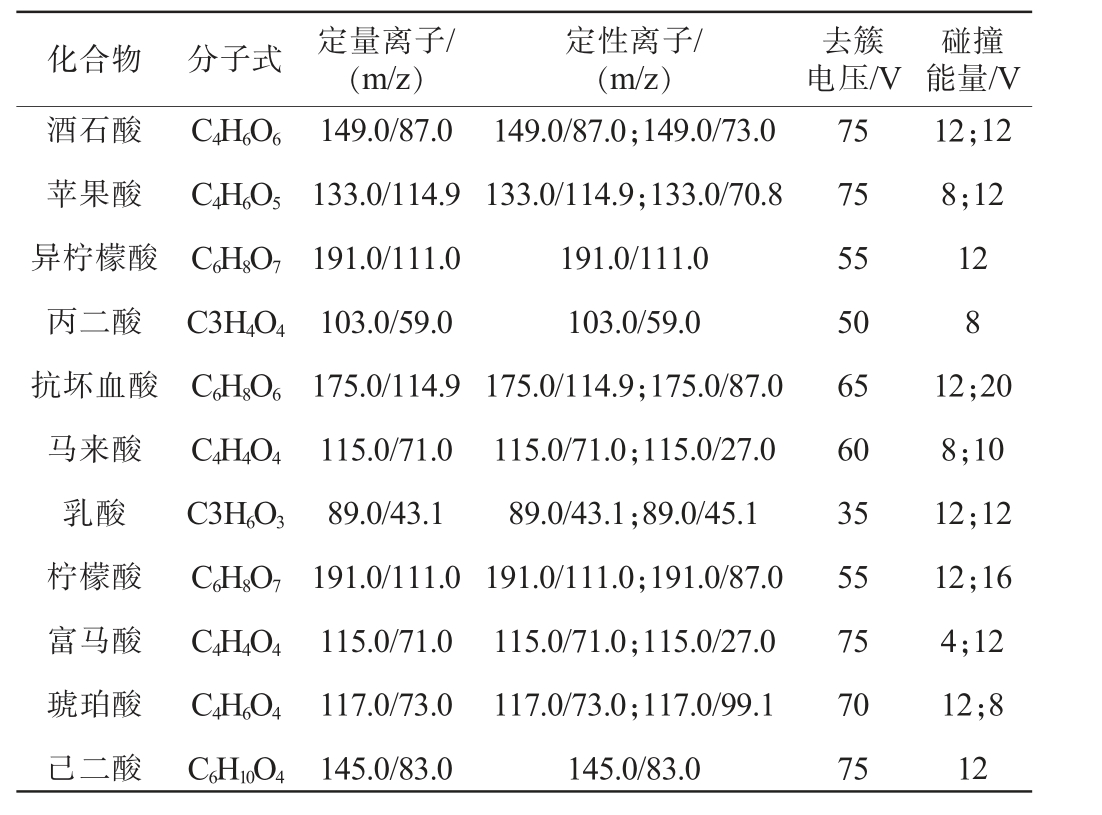
化合物 分子式 定量离子/(m/z)定性离子/(m/z)去簇电压/V碰撞能量/V酒石酸苹果酸异柠檬酸丙二酸抗坏血酸马来酸乳酸柠檬酸富马酸琥珀酸己二酸C4H6O6 C4H6O5 C6H8O7 C3H4O4 C6H8O6 C4H4O4 C3H6O3 C6H8O7 C4H4O4 C4H6O4 C6H10O4 149.0/87.0 133.0/114.9 191.0/111.0 103.0/59.0 175.0/114.9 115.0/71.0 89.0/43.1 191.0/111.0 115.0/71.0 117.0/73.0 145.0/83.0 149.0/87.0;149.0/73.0 133.0/114.9;133.0/70.8 191.0/111.0 103.0/59.0 175.0/114.9;175.0/87.0 115.0/71.0;115.0/27.0 89.0/43.1;89.0/45.1 191.0/111.0;191.0/87.0 115.0/71.0;115.0/27.0 117.0/73.0;117.0/99.1 145.0/83.0 75 75 55 50 65 60 35 55 75 70 75 12;12 8;12 12 8 12;20 8;10 12;12 12;16 4;12 12;8 12
2.4.1 标准工作曲线、线性关系、检出限及定量限
11种有机酸的线性回归方程、线性范围、相关系数、检出限和定量限见表2。 由表2可知,11种有机酸在0.01~50.00mg/L线性范围内线性关系良好,相关系数(R2)≥0.996。11种有机酸的检出限(LOD)为0.08~4.13 μg/kg,定量限(LOQ)为0.27~13.76 μg/kg。该方法的检出限和定量限能够满足酱香型大曲中有机酸的定性定量需求。
表2 11种有机酸的线性回归方程、线性范围、相关系数、检出限和定量限
Table 2 Linear regression equations, linear range, correlation coefficient, detection limit and quantitation limit of 11 kinds of organic acids
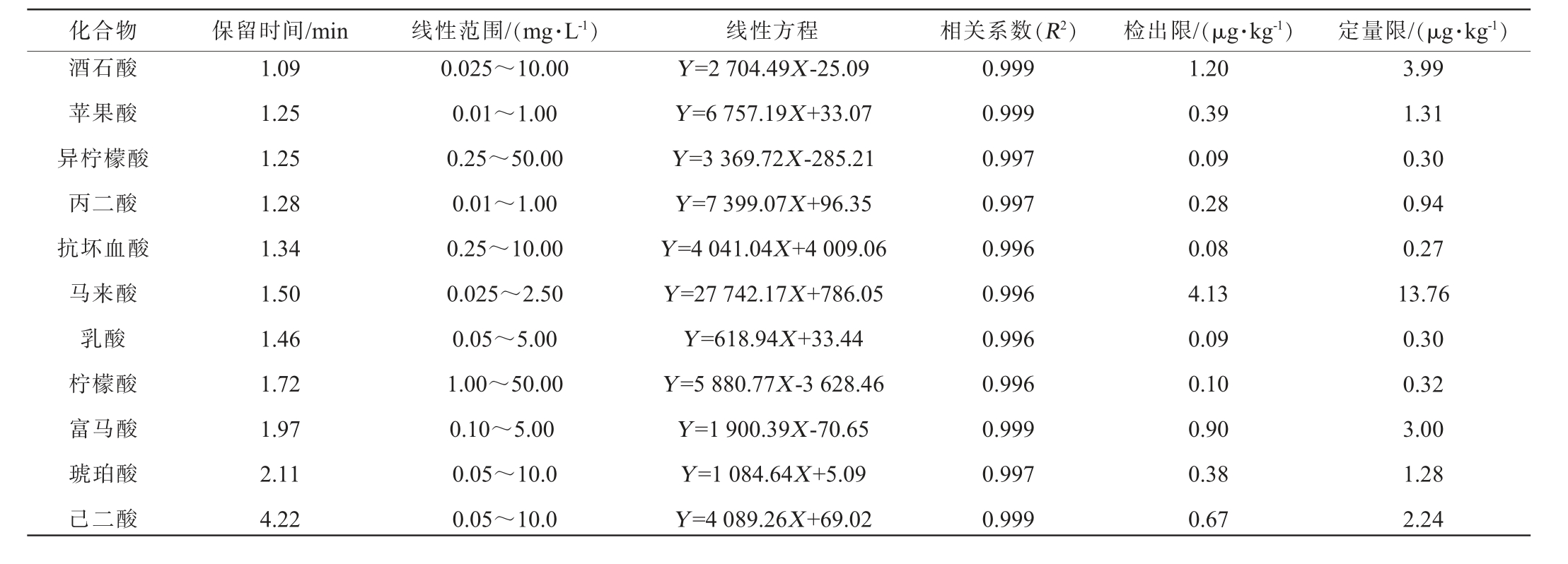
化合物 保留时间/min 线性范围/(mg·L-1) 线性方程 相关系数(R2) 检出限/(μg·kg-1) 定量限/(μg·kg-1)酒石酸苹果酸异柠檬酸丙二酸抗坏血酸马来酸乳酸柠檬酸富马酸琥珀酸己二酸1.09 1.25 1.25 1.28 1.34 1.50 1.46 1.72 1.97 2.11 4.22 0.025~10.00 0.01~1.00 0.25~50.00 0.01~1.00 0.25~10.00 0.025~2.50 0.05~5.00 1.00~50.00 0.10~5.00 0.05~10.0 0.05~10.0 Y=2 704.49X-25.09 Y=6 757.19X+33.07 Y=3 369.72X-285.21 Y=7 399.07X+96.35 Y=4 041.04X+4 009.06 Y=27 742.17X+786.05 Y=618.94X+33.44 Y=5 880.77X-3 628.46 Y=1 900.39X-70.65 Y=1 084.64X+5.09 Y=4 089.26X+69.02 0.999 0.999 0.997 0.997 0.996 0.996 0.996 0.996 0.999 0.997 0.999 1.20 0.39 0.09 0.28 0.08 4.13 0.09 0.10 0.90 0.38 0.67 3.99 1.31 0.30 0.94 0.27 13.76 0.30 0.32 3.00 1.28 2.24
2.4.2 回收率与精密度试验结果
高温大曲中11种有机酸的加标回收率和精密度试验结果见表3。由表3可知,高温大曲中有机酸的平均加标回收率为77.0%~113.0%,相对标准偏差(RSD)为0.1%~11.5%,说明该方法的准确度和精密度良好,均满足日常检测分析的要求。
表3 高温大曲中11种有机酸的加标回收率和精密度试验结果
Table 3 Recovery rates and precision test results of 11 organic acids in high-temperature Daqu
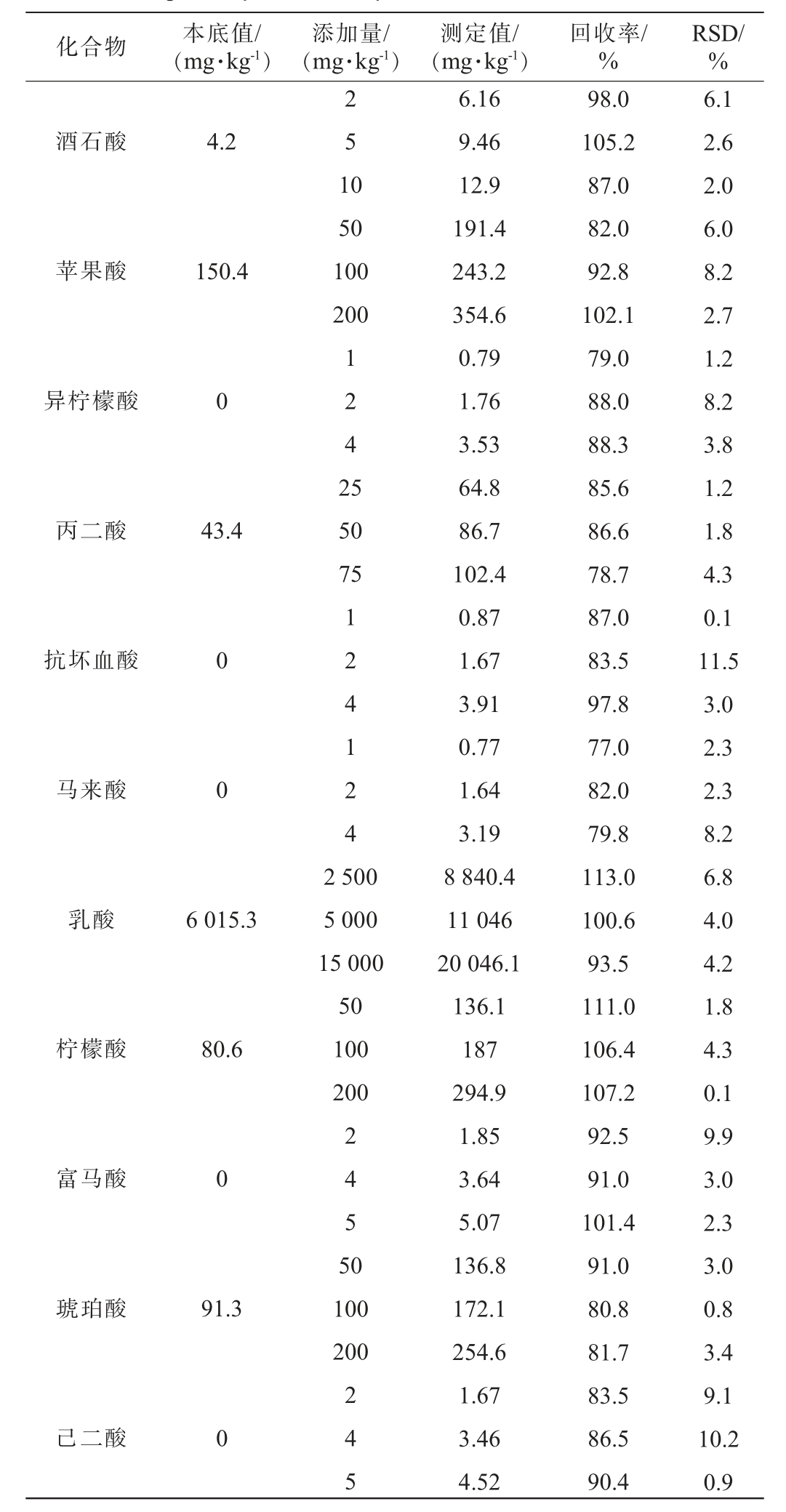
?化合物 本底值/(mg·kg-1)添加量/(mg·kg-1)测定值/(mg·kg-1)回收率/%RSD/%酒石酸4.2 2 5 1 0苹果酸150.4 50 100 200异柠檬酸0 1 2 4 2 5丙二酸43.450 75抗坏血酸0马来酸0 1 2 4 1 2 4乳酸6 015.3柠檬酸80.6 2 500 5 000 15 000 50 100 200富马酸0 2 4 5 5 0琥珀酸91.3100 200己二酸0 2 4 5 6.16 9.46 12.9 191.4 243.2 354.6 0.79 1.76 3.53 64.8 86.7 102.4 0.87 1.67 3.91 0.77 1.64 3.19 8 840.4 11 046 20 046.1 136.1 187 294.9 1.85 3.64 5.07 136.8 172.1 254.6 1.67 3.46 4.52 98.0 105.2 87.0 82.0 92.8 102.1 79.0 88.0 88.3 85.6 86.6 78.7 87.0 83.5 97.8 77.0 82.0 79.8 113.0 100.6 93.5 111.0 106.4 107.2 92.5 91.0 101.4 91.0 80.8 81.7 83.5 86.5 90.4 6.1 2.6 2.0 6.0 8.2 2.7 1.2 8.2 3.8 1.2 1.8 4.3 0.1 11.5 3.0 2.3 2.3 8.2 6.8 4.0 4.2 1.8 4.3 0.1 9.9 3.0 2.3 3.0 0.8 3.4 9.1 10.2 0.9
2.4.3 基质效应
高温大曲中含有丰富的糖类、色素、油脂以及蛋白质等物质[1],基质复杂,样品在离子化过程中基质成分与目标化合物相互竞争电离产生基质效应[31]。考察了11种有机酸的基质效应,苹果酸、丙二酸、抗坏血酸、乳酸、琥珀酸和己二酸6种有机酸基质效应不明显(ME在-11.3%~9.3%范围内),而其余5种有机酸存在明显的基质效应,其中酒石酸、异柠檬酸、柠檬酸和马来酸存在较为明显的基质增强效应(ME>23%);富马酸存在明显的基质抑制效应(ME为-64.9%)。为消除基质效应的影响,本研究采用有机酸含量较低的高温大曲基质校正工作曲线进行定量。
采用本方法对某酒厂的高温大曲生产过程中入仓曲、一翻曲、二翻曲、拆仓曲及大曲中的11种有机酸含量进行检测,结果见表4。 由表4可知,在高温大曲生产环节中仅有酒石酸、苹果酸、丙二酸、乳酸柠檬酸和琥珀酸6种氨基酸检出。 且在不同环节其含量具有显著差异,其中含量最高的有机酸是乳酸。 其余5种有机酸异柠檬酸、抗坏血酸、马来酸、富马酸和己二酸在高温大曲中未检出。 前期通过超高效液相高分辨质谱仪初步筛查酒醅中的有机酸,发现该5种有机酸的在酒醅中有检出,结合本研究结果,说明该5种有机酸主要是在酿造过程酒醅发酵阶段产生,在制曲阶段不产生或者产生极少。
表4 高温大曲生产过程中11种有机酸的检测结果
Table 4 Detection results of 11 organic acids in high temperature Daqu during production mg/kg
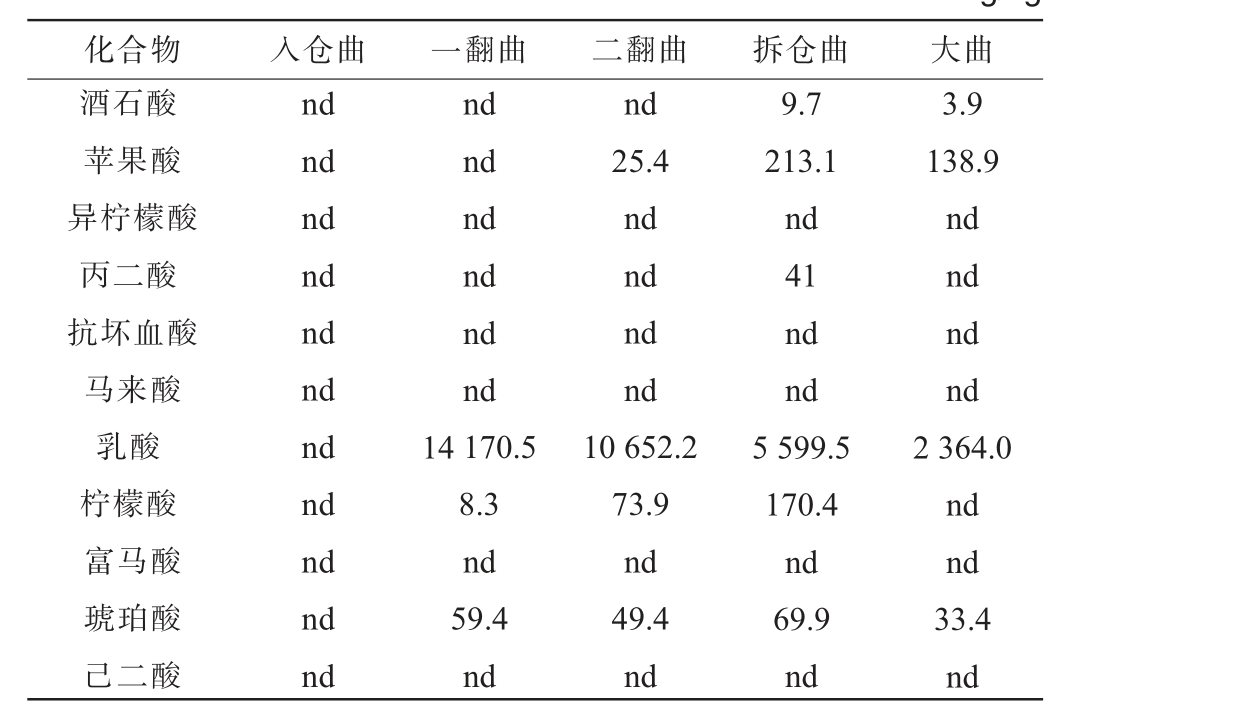
注:“nd”表示低于仪器检出限,未检出。
化合物 入仓曲 一翻曲 二翻曲 拆仓曲 大曲酒石酸苹果酸异柠檬酸丙二酸抗坏血酸马来酸乳酸柠檬酸富马酸琥珀酸己二酸nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd 14 170.5 8.3 nd 59.4 nd nd 25.4 nd nd nd nd 10 652.2 73.9 nd 49.4 nd 9.7 213.1 nd 41 nd nd 5 599.5 170.4 nd 69.9 nd 3.9 138.9 nd nd nd nd 2 364.0 nd nd 33.4 nd
本研究建立了快速检测高温大曲中11种有机酸的超高效液相色谱-三重四极杆串联质谱法,高温大曲样品经过水提取、稀释,Accucore aQ色谱柱(150 mm×2.1 mm,2.6 μm)分离,以甲醇-0.2%甲酸作为流动相梯度洗脱,流速400 μL/min,柱温40 ℃,采用负离子-多反应监测模式(MRM)进行测定,基质外标法定量。结果表明,11种有机酸在各自浓度范围内线性关系良好,相关系数(R2≥0.996),检出限(LOD)为0.08~4.13 μg/kg,定量限(LOQ)为0.27~13.76 μg/kg,在3种不同质量浓度加标水平下,加标回收率为77.0%~113.0%,精密度实验结果的相对标准偏差(RSD)为0.1%~11.5%。该方法前处理操作简便、准确度高、重复性好等特点,适合高温大曲样品中有机酸的快速准确定性定量分析。
[1]杨理章,倪德让,杨玉波,等.液液微萃取结合气质联用技术分析高温大曲中风味物质[J].中国酿造,2022,41(8):223-228.
[2]杨军林,田栋伟,王佳,等.超高效液相色谱-质谱-一测多评法结合质量控制图在高温大曲生产过程品控分析中的应用[J].食品与发酵工业,2024,50(8):290-298.
[3]QIU X,ZHANG Y,ZHOU Y,et al.Progress in pretreatment and analysis of organic acids:An Update since 2010[J].Food Chem,2021,360:129977.
[4]范文来,龚舒蓓,徐岩.白酒有机酸谱[J].酿酒,2019,46(1):37-42.
[5]张倩.中高温大曲发酵过程中曲皮与曲心微生物群落结构和功能差异及形成机制[D].宜宾:四川轻化工大学,2021.
[6]吉鑫,樊双喜,李宜聪,等.白酒中有机酸和醛类的偏最小二乘回归法定量分析模型[J].食品与发酵工业,2020,46(14):204-210.
[7]胡国英,唐丽君,喻俊磊.毛细管气相色谱法检测白酒中的有机酸类组分含量[J].江西化工,2016(5):96-98.
[8]WANG G N, SONG X B, ZHU L, et al.A flavoromics strategy for the differentiation of different types of Baijiu according to the non-volatile organic acids[J].Food Chem,2022,374:131641.
[9]杨会.白酒中不挥发呈味有机酸和多羟基化合物研究[D].无锡:江南大学,2017.
[10]WANG G,LI X,SONG X,et al.Optimization and validation of a method for analysis of non-volatile organic acids in Baijiu by derivatization and its application in three flavor-types of Baijiu[J].Food Anal Met,2022,15(6):1606-1618.
[11]NATASHA L.H,HANS S.A.Y,TOBIAS J.S,et al.Organic acid profiles of Australian stingless bee honey samples determined by ion chromatography[J].J Food Compos Anal,2023,122:105466.
[12]龙四红,陈谢花,李红洲,等.离子色谱法测定酸汤中13种有机酸的分析方法[J].食品科技,2022,47(8):256-263.
[13]HAN Y,DU J,LI J,et al.Quantification of the organic acids in hawthorn wine:A comparison of two HPLC methods[J].Molecules,2019,24(11):1-14.
[14]张长勇,张雪婧,纪丽君,等.有机酸指纹图谱结合化学计量学分析鉴定黄酒的方法研究[J].食品安全质量检测学报,2022,13(1):48-55.
[15]AHMED M E, HAMMAM A R A, ALI A E F, et al.Measurement of carbohydrates and organic acids in varieties of cheese using high-performance liquid chromatography[J].Food Sci Nutr,2023,11:2081-2085.
[16]YU C, WANG Y, CAO H, et al.Simultaneous determination of 13 organic acids in liquid culture media of edible fungi using high-performance liquid chromatography[J].Bio Med Res Int,2020,2020(3):1-7.
[17]宁亚维,侯琳琳,于同月,等.UPLC-MS/MS法快速测定乳酸菌发酵食品中的苯乳酸[J].食品与发酵工业,2021,47(5):174-179.
[18]ALIABADI M H S, KARAMI-OSBOO R, KOBARFARD F, et al.Detection of lime juice adulteration by simultaneous determination of main organic acids using liquid chromatography-tandem mass spectrometry[J].J Food Compos Anal,2022,105:104223.
[19]王姚,郑昊东,程曦,等.液相色谱-串联质谱定量分析不同花色菊花中黄酮和有机酸的含量[J].食品科技,2023,48(8):264-277.
[20]中华人民共和国国家卫生和计划生育委员会.GB 5009.157—2016 食品安全国家标准食品中有机酸的测定[S].北京:中国标准出版社,2016.
[21]骆茂香,徐兴江,刘磊.基于UPLC法测定酱香型白酒原辅料中5种非挥发性有机酸[J].酿酒科技,2023(9):137-140.
[22]赵尚碧,赵振宇,刘松,等.超高效液相色谱法测定酱香型白酒高温大曲中的乳酸含量[J].酿酒科技,2021(6):125-128.
[23]林伟坚,康海宁,吴凤琪,等.超高效液相色谱-三重四极杆质谱法测定化妆品中秋水仙碱,秋水仙胺和秋水仙碱苷[J].分析试验室,2022,41(7):783-788.
[24]侯睿,向丽萍,张冰雪,等.HPLC同时测定酱香型白酒酒糟中13种有机酸的分析研究[J].酿酒科技,2023(8):103-111.
[25]梅婕,李玉岩,程凡,等.高效液相色谱法同时测定窖泥和养窖液中四种有机酸[J].酿酒科技,2023(7):102-106.
[26]徐勇,郎召伟,沈咪娜,等.泸型酒酿造过程中上层和下层酒醅的有机酸变化分析[J].四川理工学院学报(自然科学版),2018,31(5):9-13.
[27]李晴,于晓涛,刘轩墀,等.牛栏山二锅头发酵过程中有机酸的变化规律[J].中国酿造,2021,40(10):83-88.
[28]唐贤华,王思思,黄睿.不同入窖糟醅在发酵过程中有机酸的变化及对酒质的影响[J].粮食与食品工业,2020,27(2):39-44,50.
[29]马瑞,欧阳嘉,李鑫,等.高效液相色谱法同时测定生物质乳酸发酵液中有机酸及糖类化合物[J].色谱,2012,30(1):62-66.
[30]战楠,孙青,郭峰,等.在线固相萃取-高效液相色谱-高分辨质谱法测定植物中11种水溶性有机酸[J].食品科学,2023,44(4):256-264.
[31]张巍巍,孙东哲,任丹丹,等.超高效液相色谱-串联三重四极杆质谱法同时测定油菜籽中13种硫代葡萄糖苷[J].食品安全质量检测学报,2022,13(6):1895-1902.