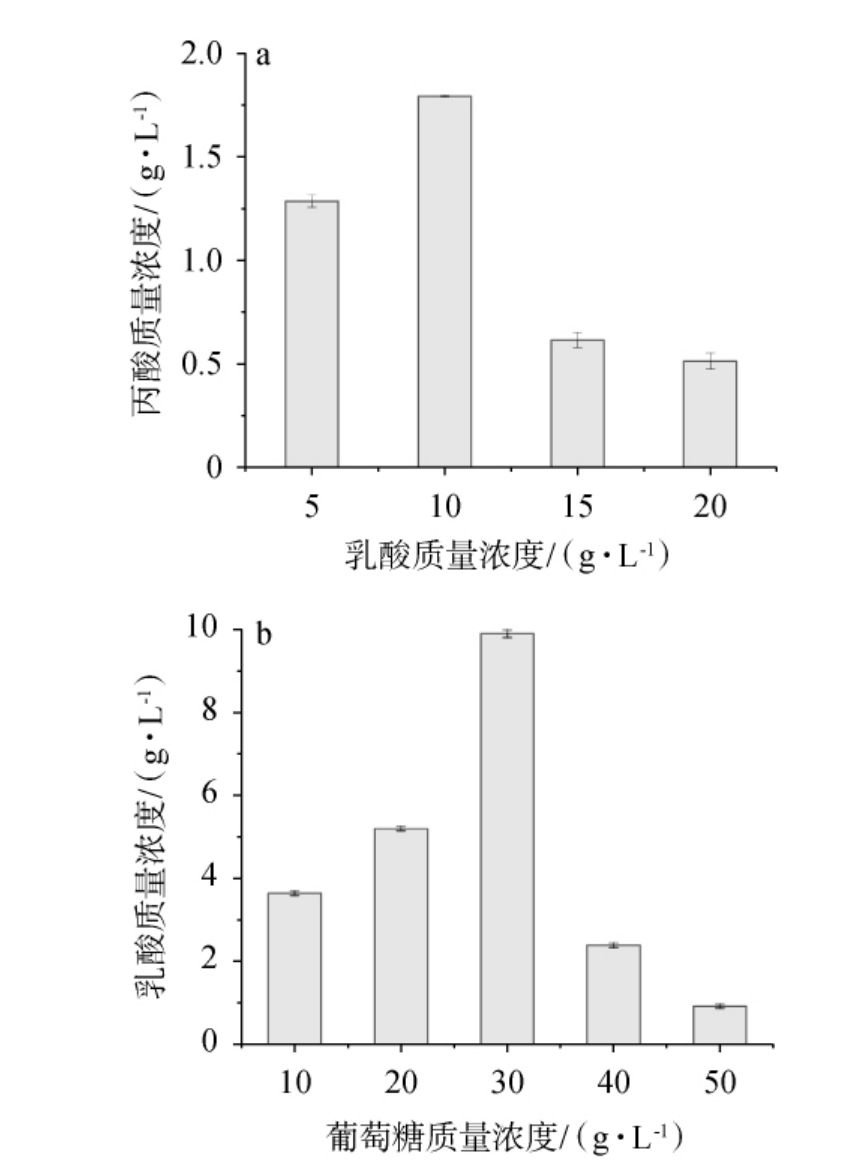
图1 不同乳酸、葡萄糖质量浓度对菌株R3、Z5产丙酸(a)、乳酸(b)的影响
Fig.1 Effects of different mass concentrations of lactic acid and glucose on the production of propionic acid (a) and lactic acid (b) by strains R3 and Z5
Effect of co-culture of Bacillus tropicus and Lactococcus lactis on organic acid metabolism
共培养是一种将不同微生物(如细菌、真菌)在无菌条件下共同培养的技术,通过模拟自然环境中微生物的相互作用(如竞争、共生等),刺激次级代谢产物的生成,从而提升产物多样性或改善产品质量。其核心优势在于能够激活沉默基因、产生单一培养无法获得的新化合物,或优化现有代谢产物的质量浓度与性能[1]。
清香型白酒的生成是将原料蒸煮后与曲拌匀后于酒醅中发酵[2],随着发酵过程中多种微生物协同作用的进行[3-4],酒醅中的淀粉、葡萄糖等营养物质渗出,为微生物提供生长所需的营养成分[5]。酿造过程中,乳酸菌以及其他微生物共存时表现出较强的适应能力,优先利用营养成分进行繁殖和代谢,生成乳酸,并与乙醇发生酯化反应形成乳酸乙酯[6],导致清香型白酒中乳酸乙酯含量过高[7],适度的乳酸乙酯能够提升酒的醇厚感,但含量过高,酒体的香气减弱,味道变得单薄,甚至产生涩口感[8-9],乳酸乙酯作为一种较为稳定的成分,难分解[10];即通过转化乳酸乙酯的前体成分乳酸以达到“降乳”[11]。
丙酸菌是经培养能够代谢生成丙酸的一类微生物[12],以葡萄糖或乳酸作为碳源,发酵生成丙酸,同时乙酸、琥珀酸、二氧化碳等副产物伴随产生[13]。目前,清香型白酒的典型物质是乙酸乙酯和乳酸乙酯[14],理想比例约为55∶45[15],由于酿造工艺的原因乳酸乙酯的含量较高,即研究丙酸菌利用乳酸生成丙酸对探究清香型白酒酿造过程中降低乳酸含量具有重要意义。据相关报道,丙酸及丙酸乙酯于清香型白酒中被检测出[16],对风味的形成具有一定的贡献,所以将丙酸菌应用于清香型白酒酿造中可实现“增丙降乳”[17]。目前,辛秀明等[18]将丙酸菌与红曲霉应用于特香型白酒中以增加丙酸乙酯质量浓度,而针对清香型白酒中利用丙酸菌实现“降乳”研究报道较少[19]。
以实验室前期从清香型大曲中筛选得到的产丙酸的热带芽孢杆菌(Bacillus tropicus)R3与产乳酸的乳酸乳球菌(Lactococcus lactis)Z5为研究对象,比较纯培养与共培养条件下两株菌生长和代谢的差异,并以葡萄糖和乳酸为碳源探究菌株Z5对菌株R3生长及代谢的影响。 以期解析产丙酸菌降解乳酸的机理,为发酵工艺优化及白酒品质提升提供理论支撑。
1.1.1 菌种
热带芽孢杆菌(Bacillus tropicus)R3:分离自清香型白酒厂优质大曲;乳酸乳球菌(Lactococcus lactis)Z5:实验室筛选保藏。
1.1.2 培养基
种子培养基:葡萄糖10 g/L,胰蛋白胨6 g/L,酵母浸膏3 g/L,氯化钠5 g/L,磷酸氢二钾0.25 g/L,蒸馏水1 000 mL,121 ℃灭菌15 min。
MRS肉汤培养基:蛋白胨10 g/L,牛肉浸粉8 g/L,酵母浸粉4 g/L,葡萄糖20 g/L,磷酸氢二钾2 g/L,柠檬酸氢二铵2 g/L,乙酸钠5 g/L,硫酸镁0.2 g/L,硫酸锰0.04 g/L,吐温-80 1 g/L,蒸馏水1 000 mL,121 ℃灭菌15 min。
MRS改良培养基A:蛋白胨10 g/L,牛肉浸粉8 g/L,酵母浸粉4 g/L,葡萄糖30 g/L,磷酸氢二钾2 g/L,柠檬酸氢二铵2 g/L,乙酸钠5 g/L,硫酸镁0.2 g/L,硫酸锰0.04 g/L,吐温-80 1 g/L,氯化钴0.01 g/L,蒸馏水1 000 mL,121 ℃灭菌15 min。
MRS改良培养基B:乳酸5 g/L,蛋白胨10 g/L,牛肉浸粉8 g/L,酵母浸粉4 g/L,葡萄糖30 g/L,磷酸氢二钾2 g/L,柠檬酸氢二铵2 g/L,乙酸钠5 g/L,硫酸镁0.2 g/L,硫酸锰0.04 g/L,吐温-80 1 g/L,氯化钴0.01 g/L,蒸馏水1 000 mL,121 ℃灭菌15 min。
1.1.3 试剂
葡萄糖、硫酸锰、蛋白胨、胰蛋白胨、磷酸二氢钠、硫酸镁、氯化钙、氯化铵、碳酸钠、磷酸氢二钾、吐温-80:国药集团化学试剂有限公司;硫酸铵、酵母浸膏、柠檬酸氢二铵:麦克林试剂有限公司;牛肉浸膏:北京双旋微生物培养基制品厂;MRS肉汤培养基:海博生物技术有限公司。所用试剂均为分析纯或生化试剂。
LRH-250生化培养箱:上海智城分析仪器有限公司;LDZX-50KBS高压蒸汽灭菌锅:上海申安医疗器械厂;SBA-40D生物传感分析仪:山东省科学院生物研究所;B-JY88-IIN型超声破碎机、BL86L110超低温冰箱:上海铂温仪器有限公司;TGL16M型离心机、TGL16M高速冷冻离心机:盐城市凯特实验仪器有限公司;1645050电泳仪:上海伯乐生命医学产品有限公司;SYQ-DSX-280-B高压蒸汽灭菌锅:上海申安医疗系统有限公司;Thermo U3000 高效液相色谱(high performance liquid chromatography,HPLC)仪、Acclaim OA色谱柱(4.6 mm×250 mm,5 μm):赛默飞世尔科技有限公司;PHS-25 pH计:上海仪电科学仪器有限公司。
1.3.1 菌株种子液的制备
B.tropicus R3种子液的制备[20]:将保藏于甘油管的菌株Z5,划线于MRS固体平板上活化,34 ℃恒温培养48 h,挑取单菌落接种到100 mL灭菌的种子培养基中,用橡胶塞塞紧,34 ℃静置培养72 h。
L.lactis Z5种子液的制备[21]:将保藏于甘油管的菌株R3,划线于MRS固体平板上活化,34 ℃恒温培养48 h,挑取单菌落接种到100 mL灭菌的种子培养基中,34 ℃静置培养48 h。
1.3.2 不同底物质量浓度分别对菌株R3、Z5产丙酸、乙酸的影响
(1)乳酸质量浓度对菌株R3产丙酸的影响
在MRS肉汤培养基的基础上,将不同质量浓度的乳酸(5 g/L、10 g/L、15 g/L、20 g/L)代替葡萄糖作为发酵培养基。挑取菌株R3单菌落接种到100 mL灭菌的种子培养基中,用橡胶塞塞紧,34 ℃静置培养72 h,然后将菌液以接种量4%接种至发酵培养基中,34 ℃静置发酵7 d, 测定发酵过程中丙酸的质量浓度。
(2)葡萄糖质量浓度对菌株Z5产乳酸的影响
在MRS肉汤培养基的基础上,设置不同质量浓度的葡萄糖(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L)作为发酵培养基。 挑取菌株Z5单菌落接种到100 mL灭菌的种子培养基中,34 ℃静置培养48 h,然后将菌液以接种量4%接种至发酵培养基中,34 ℃静置发酵7 d,测定发酵过程中乳酸的质量浓度。
1.3.3 菌株Z5及R3共培养发酵过程中葡萄糖、有机酸及pH
值的变化
在上述实验结果基础上,根据菌株R3代谢生成丙酸的最佳底物(乳酸)浓度,确定菌株Z5发酵7 d时最佳乳酸质量浓度的葡萄糖含量作为菌株Z5与R3共同培养时培养基中葡萄糖含量,并添加0.01 g/L氯化钴,将培养基命名为MRS改良培养基A[22]。然后将菌株Z5与R3种子液按照2∶1的体积比以接种量为4%接种至MRS改良培养基A,34 ℃下静置培养15 d,并在相同培养条件单独培养菌株Z5和R3作为对照实验,每间隔3 d进行取样检测发酵液中的丙酸、乳酸、葡萄糖浓度及pH值变化。
1.3.4 以葡萄糖和乳酸为碳源菌株Z5对菌株R3生长及代
谢的影响
为探究在葡萄糖和乳酸共存的条件下,菌株Z5除了作为底物提供者和氧气消耗者之外,是否影响菌株R3的生长及代谢;在MRS肉汤培养基基础上添加0.5 g/L乳酸和0.01 g/L氯化钴作为菌株Z5及R3共培养培养基,命名为MRS改良培养基B。
菌株Z5及R3拮抗作用:在MRS改良培养基B固体平板上,将菌株R3和Z5分别采用不同的划线顺序接种,34 ℃兼性环境培养6 d后观察两种菌的生长情况[23]。
共培养发酵过程中丙酸、琥珀酸、乳酸及葡萄糖的变化:将菌株R3与Z5的种子液按1∶2体积比以接种量4%接种到MRS改良培养基B,34 ℃静置培养16 d,以菌株Z5和R3单独培养作为对照试验,每间隔2 d取样检测发酵液中的丙酸、琥珀酸、乳酸及葡萄糖质量浓度的变化。
1.3.5 分析检测
(1)有机酸的测定琥珀酸、丙酸、乳酸采用高效液相色谱(HPLC)测定。样品预处理:取10 mL待测发酵液,在12 000 r/min、室温条件下离心8 min,取上清液0.5 mL,用体积分数60%乙醇溶液定容至5 mL,经0.22 μm有机滤膜过滤,待HPLC分析。
HPLC条件:AcclaimOA色谱柱(4.6mm×250mm,5μm),柱温为25 ℃,检测波长为210 nm,流速0.8 mL/min;流动相A为40 mmol/L硫酸钠溶液(甲磺酸调pH至2.68),流动相B为100%乙腈,流动相C为100%超纯水[18,24]。
定性定量分析:通过保留时间定性,外标法定量。
(2)葡萄糖含量测定
取2 mL发酵液于10 000 r/min离心5 min,吸取离心上清液0.1 mL,用蒸馏水定容稀释10倍,测定时加入25 μL的样品稀释液。采用生物传感分析仪检测,在进行葡萄糖测定之前,需先进行系统的标定,仪器标定成功后,取25 μL的样品稀释液进行测定[25]。
(3)pH值的测定
采用pH计测定发酵液的pH值。
1.3.6 数据处理采用Excel 2019处理实验数据;利用Origin 2021绘图。
由图1a可知,当乳酸质量浓度为5 g/L、10 g/L时,丙酸的质量浓度逐渐增加;当乳酸质量浓度为10 g/L时,丙酸质量浓度达最高值,为1.793 g/L;当乳酸质量浓度>10 g/L之后,乳酸含量过多导致其生长环境的pH值较低,影响菌株R3对营养物质的吸收,并导致菌株R3细胞壁所带电荷的改变,从而影响繁殖代谢[26],故确定菌株R3代谢生成丙酸最佳乳酸质量浓度为10 g/L。

图1 不同乳酸、葡萄糖质量浓度对菌株R3、Z5产丙酸(a)、乳酸(b)的影响
Fig.1 Effects of different mass concentrations of lactic acid and glucose on the production of propionic acid (a) and lactic acid (b) by strains R3 and Z5
由图1b可知,当葡萄糖质量浓度为10g/L、20 g/L、30 g/L,乳酸的质量浓度逐渐增加;当葡萄糖质量浓度为30 g/L时,乳酸质量浓度达最高值,为9.750 g/L;当葡萄糖质量浓度>30 g/L之后,葡萄糖质量浓度过高使菌株Z5的生理环境发生改变,从而抑制其生长和繁殖,导致菌株Z5的发酵活性下降[27],从而影响生长代谢,故确定菌株Z5代谢生成乳酸最佳葡萄糖质量浓度为30 g/L。
综上所述,葡萄糖质量浓度为30 g/L时,菌株Z5代谢生成乳酸的质量浓度最接近菌株R3高产丙酸的最佳乳酸质量浓度,故将MRS改良培养基A中葡萄糖设置为30 g/L。
菌株Z5及R3共培养发酵过程中葡萄糖质量浓度、pH值、乳酸及丙酸质量浓度的变化见图2。由图2a可知,菌株R3在0~9 d范围内单独培养时,葡萄糖质量浓度逐渐下降;直到发酵9 d时,葡萄糖基本利用完全。随着发酵时间在0~3 d范围内增加,菌株Z5单独培养及菌株共培养时葡萄糖质量浓度不断降低;发酵时间为3 d时,葡萄糖基本被完全利用。其原因可能是,菌株Z5利用葡萄糖通过糖酵解途径代谢只生成乳酸,而菌株R3利用葡萄糖通过Embden-Meyerhof-Parnas途径、Wood-Werkman循环途径代谢生成丙酸并伴随乙酸、琥珀酸等副产物生成[28],乙酸通过抑制菌株R3的生长和代谢途径影响葡萄糖的利用[29],故菌株Z5利用葡萄糖为底物代谢生长的能力优于菌株R3。
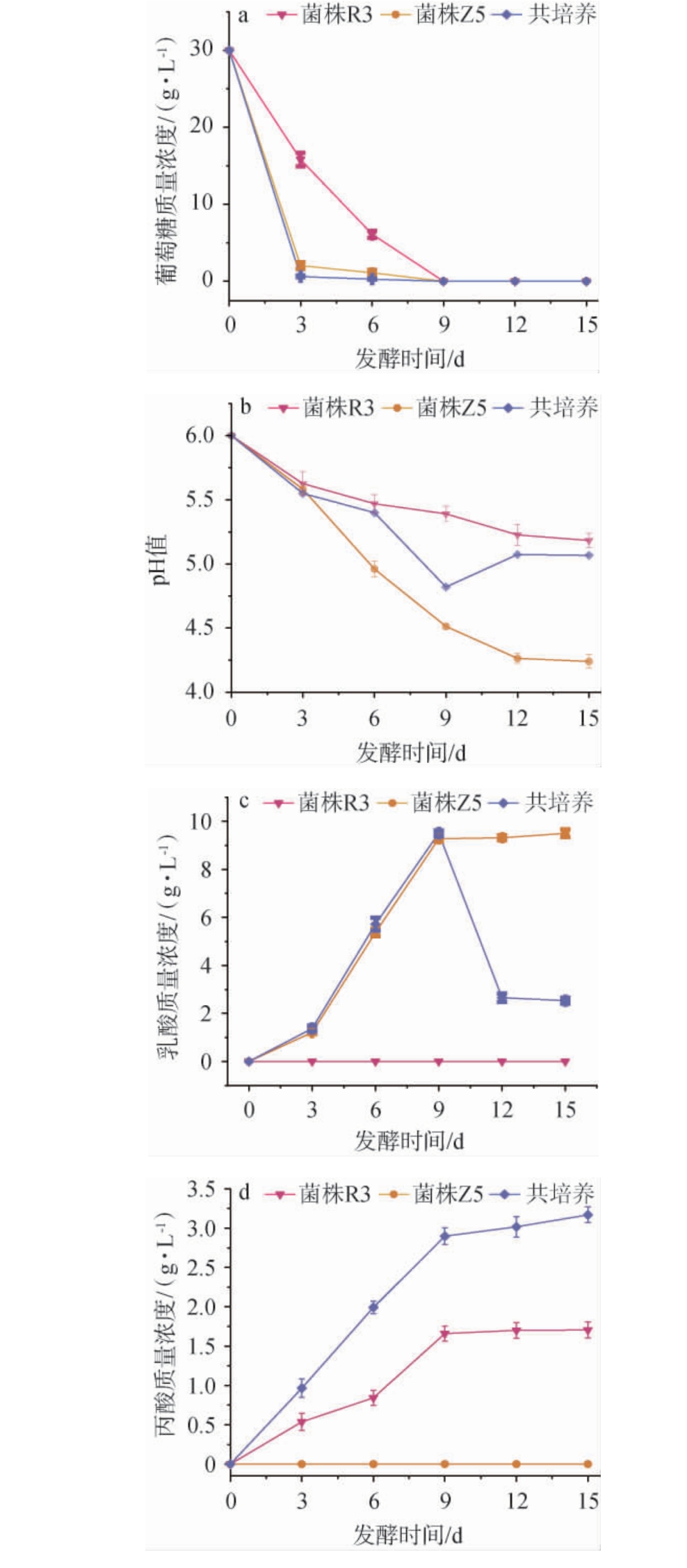
图2 菌株Z5及R3共培养发酵过程中葡萄糖质量浓度(a)、pH值(b)、乳酸(c)及丙酸(d)质量浓度的变化
Fig.2 Changes in the glucose mass concentrations (a), pH (b), lactic acid (c) and propionic acid (d) mass concentrations during the co-culture fermentation process of strain Z5 and R3
由图2b可知,当发酵时间为0~15 d时,菌株R3、Z5单独培养时pH值逐渐降低,且菌株Z5单独培养时pH值下降较快;发酵12 d时,pH值分别为5.3、4.2;继续发酵,pH值趋于稳定。 当发酵时间为0~9 d时,菌株Z5及R3共培养时,pH值逐渐下降;发酵到第9天时,pH值有所回升,其原因可能是由于菌株R3利用乳酸继续生长代谢导致的;当发酵结束时,pH值为5.067。由图2c可知,在整个发酵期内(0~15 d),菌株R3单独培养时,乳酸均未检出。 当发酵时间为0~9 d时,菌株Z5单独培养及菌株Z5与R3共培养时,乳酸质量浓度变化趋于一致,均呈逐渐增加的趋势,菌株Z5优先利用葡萄糖代谢生成乳酸;当发酵时间为9 d时,菌株Z5单独培养时的乳酸质量浓度变化趋于稳定,此时,葡萄糖被消耗完全,乳酸质量浓度为9.05 g/L,而菌株Z5与R3共培养时快速下降,其原因可能是菌株R3持续利用乳酸代谢生成丙酸。 由图2d可知,在整个发酵期内(0~15 d),菌株Z5单独培养时,丙酸均未检出。当发酵时间为0~9 d时,菌株R3单独培养及菌株Z5与R3共培养时,丙酸质量浓度变化趋于一致,均呈逐渐增加的趋势;当发酵时间>9 d时,菌株R3单独培养时,丙酸质量浓度下降,菌株Z5与R3共培养时,丙酸质量浓度逐渐增加,其原因可能是由于菌株Z5优先利用葡萄糖代谢生成乳酸为菌株R3发酵提供底物,发酵结束时,丙酸质量浓度分别为1.71 g/L、3.17 g/L。因此,以质量浓度30 g/L的葡萄糖为碳源的MRS改良培养基A时,菌株Z5利用葡萄糖代谢生成的乳酸可为菌株R3提供合成丙酸的底物。
2.3.1 菌株Z5与R3拮抗作用
菌株Z5与R3交叉划线菌落培养结果见图3。由图3可知,R3菌落呈浅黄色且不透明,Z5菌落呈白色。由图3a可知,菌株Z5先划线而菌株R3后划线时,在菌株Z5与R3接触的后半段,肉眼可见的菌落仍然属于菌株Z5,未发现菌株R3菌落。 由图3b可知,菌株R3先划线而菌株Z5后划线时,在菌株Z5与R3交叉点的后半段,观察到的菌落是菌株Z5而非菌株R3。菌株R3划线至与菌株Z5的交叉点,接种环上同时存在菌株R3和Z5,表明在此培养条件下菌株Z5与R3同时接种时,菌株Z5的生长优势超过菌株R3,因此占据主导地位。
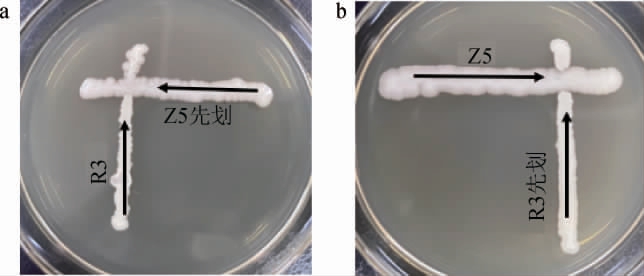
图3 菌株Z5与R3交叉划线菌落培养结果
Fig.3 Cross-streaking colony culture results of strain Z5 and R3
2.3.2 菌株Z5及R3共培养发酵过程中葡萄糖及有机酸含量的变化
菌株Z5及R3共培养发酵过程葡萄糖、乳酸、丙酸及琥珀酸质量浓度的变化见图4。
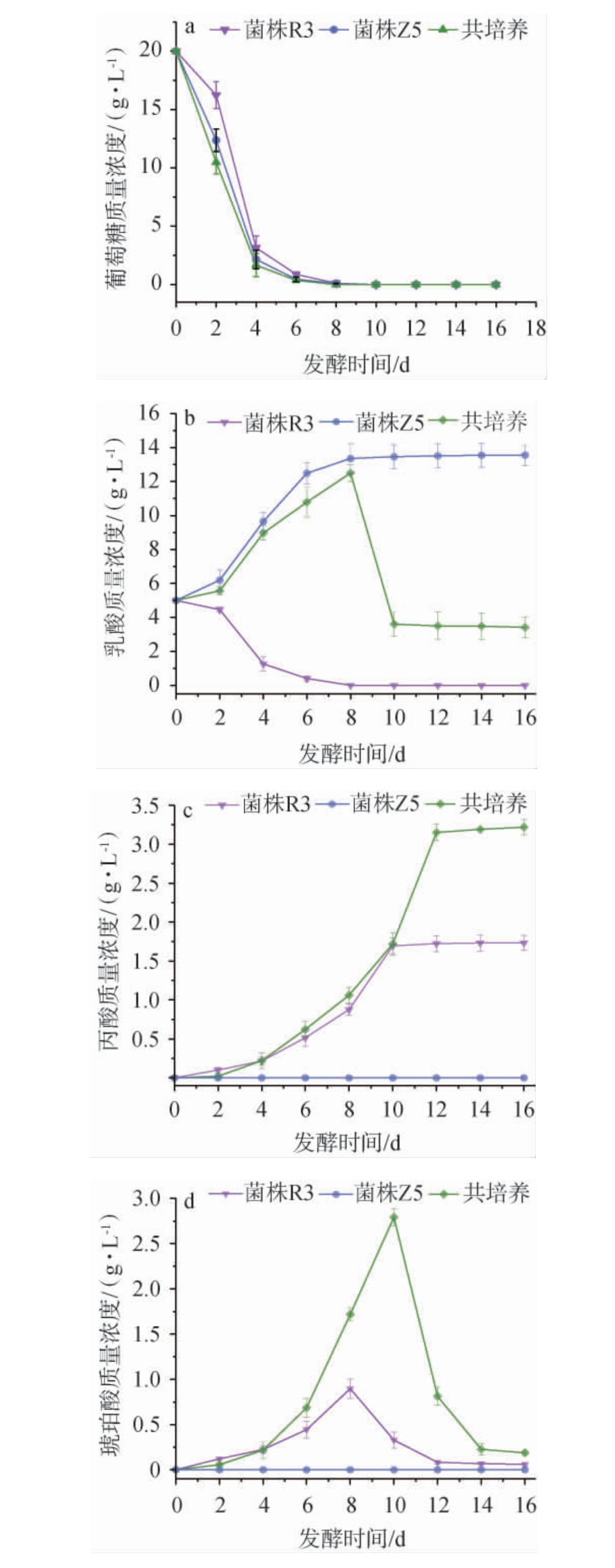
图4 菌株Z5及R3共培养发酵过程中葡萄糖(a)、乳酸(b)、丙酸(c)及琥珀酸(d)质量浓度的变化
Fig.4 Changes in the mass concentrations of glucose (a), lactic acid (b), propionic acid (c), and succinic acid (d) during the co-culture fermentation process of strains Z5 and R3
由图4a可知,菌株Z5、R3单独培养时及菌株Z5与R3共培养时,随着发酵时间在0~8 d范围内增加,葡萄糖质量浓度变化趋势趋于一致,均呈快速下降趋势,发酵时间为8 d时,葡萄糖基本被完全利用。
由图4b可知,随着发酵时间在0~8 d范围内增加,菌株Z5单独培养及菌株Z5与R3共培养时,乳酸质量浓度逐渐增加;当发酵时间为8 d时,乳酸质量浓度均达到最大值,分别为13.36 g/L、12.50 g/L;当发酵时间>8 d,菌株Z5单独培养时乳酸质量浓度趋于稳定,而菌株Z5与R3共培养时,乳酸质量浓度快速下降并趋于稳定,其原因可能是菌株R3利用菌株Z5代谢生成的乳酸为底物合成丙酸,发酵结束时,乳酸质量浓度分别为13.55 g/L、3.41 g/L。 菌株Z5单独培养时,乳酸质量浓度在0~8 d范围内下降,之后乳酸质量浓度趋于稳定。
由图4c可知,当发酵时间分别在0~10 d、0~12 d范围内增加,菌株R3单独培养及菌株Z5与R3共培养时,丙酸质量浓度均呈上升趋势;随着发酵进行,琥珀酸质量浓度均趋于平稳,当发酵结束时,丙酸质量浓度分别为1.73 g/L、3.22 g/L。其原因可能是,根据丙酸菌利用乳酸生成丙酸的Wood-Werkman循环途径中,丙酮酸经草酰乙酸转羧基酶(oxaloacetic transcarboxylase,OTC)作用生成草酰乙酸,经苹果酸脱氢酶(malic dehydrogenase,MDH)作用下草酰乙酸生成苹果酸,苹果酸在富马酸酶(fumarase,Fas) 的作用下生成富马酸[28],富马酸在琥珀酸酶(succinase,Scs)的作用下生成琥珀酸,琥珀酸再经过丙酰辅酶A、琥珀酸辅酶A转移酶催化作用后生成丙酸,琥珀酸是合成丙酸的中间产物,说明菌株Z5与菌株R3共培养可以促使丙酸的生成[30-31]。在整个发酵期内(0~16 d),菌株Z5单独培养时,琥珀酸均未检出。
由图4d可知,菌株R3单独培养及菌株Z5与R3共培养时,琥珀酸质量浓度变化趋势趋于一致,均呈先上升后下降的趋势,当发酵时间分别为8 d、10 d时,琥珀酸质量浓度均达到最大值,分别为2.79 g/L、0.90 g/L,当发酵结束时,琥珀酸质量浓度分别为0.06 g/L、0.19 g/L。 其原因可能是,菌株Z5代谢葡萄糖生成乳酸为菌株R3提供底物代谢生成丙酸、琥珀酸,菌株R3代谢过程中消耗琥珀酸速度比生成琥珀酸低[13]。 在整个发酵期内(0~16 d),菌株Z5单独培养时,琥珀酸均未检出。
本研究考察了菌株R3及Z5在纯培养及共培养条件下生长和代谢的差异,结果表明,菌株R3在乳酸质量浓度为10 g/L时丙酸产量最高(1.793 g/L),而菌株Z5在葡萄糖质量浓度为30 g/L时乳酸产量最高(9.75 g/L);在共培养条件下,菌株Z5利用葡萄糖通过糖酵解途径代谢只生成乳酸,菌株R3利用葡萄糖通生成丙酸。菌株Z5对R3生长及代谢的影响结果表明,在乳酸与葡萄糖共同碳源条件下,由于菌株Z5比R3更具有生长优势,菌株Z5代谢葡萄糖生成乳酸为菌株R3提供底物代谢生成丙酸、琥珀酸。 本研究对两种微生物间的相互作用有了更清晰的认识,为菌株Z5与R3应用于清香型白酒酿造过程中“降乳”提供参考依据。
[1]武文惠.微生物共培养及其分析方法的研究进展[J].当代化工,2020,49(12):2805-2807.
[2]管健.大曲清香型白酒功能菌的筛选与应用[D].武汉:湖北工业大学,2018.
[3]TU W Y,CAO X N,CHENG J,et al.Chinese Baijiu:The perfect works of microorganisms[J].Front Microbiol,2022,13:919044.
[4]ZHAO J,GAO Z F.Dynamic changes in microbial communities and flavor during different fermentation stages of proso millet Baijiu,a new product from Shanxi light-flavored Baijiu[J].Front Microbiol,2024,15:1333466.
[5]WEI Y,ZHANG L Q,RAN M F,et al.Investigation on fresh bamboo replacing rice husks for brewing light-aroma Baijiu[J].J Food Sci, 2023,88(4):1224-1236.
[6]杜艾明,李良,李俊薇,等.清香型白酒酿造核心功能微生物的研究与应用[J].中国酿造,2021,40(2):16-19.
[7]田德雨,闫子茹,危晶晶,等.清香型白酒酿造微生物和风味物质的研究进展[J].中国酿造,2021,40(4):20-25.
[8]LI H H, ZHANG X, GAO X J, et al.Comparison of the aroma-active compounds and sensory characteristics of different grades of light-flavor Baijiu[J].Foods,2023,12(6):1238.
[9]NIU Y W,YAO Z M,XIAO Q,et al.Characterization of the key aroma compounds in different light aroma type Chinese liquors by GC-olfactometry, GC-FPD, quantitative measurements, and aroma recombination[J].Food Chem,2017,233:204-215.
[10]DOLZHENKO A V.Ethyl lactate and its aqueous solutions as sustainable media for organic synthesis[J].Sustain Chem Pharm,2020,18:100322.
[11]罗青春,乔宗伟,郑佳,等.一株高效降解乳酸的原玻璃蝇节杆菌筛选与代谢动力学分析[J].中国酿造,2021,40(1):82-86.
[12]薛茹.丙酸菌—大肠杆菌穿梭载体构建及表达[D].石家庄:河北科技大学,2012.
[13]张维,牟飞燕,陈玫,等.白酒酿造中丙酸菌及应用的研究进展[J].中国酿造,2024,43(2):1-6.
[14]谢再斌,常煦,何国庆,等.清香型白酒釀造過程中功能微生物及應用研究[J].中国酿造,2024,43(7):27-32.
[15]王震,叶宏,朱婷婷,等.清香型白酒风味成分的研究进展[J].食品科学,2022,43(7):232-244.
[16]张卜升,袁丛丛,李汶轩,等.浓香,酱香,清香型白酒挥发性风味的特征与差异研究[J].食品安全质量检测学报,2022,13(24):8058-8067.
[17]何培新,胡晓龙,郑燕,等.中国浓香型白酒“增己降乳”研究与应用进展[J].轻工学报,2018,33(4):1-12.
[18]辛秀明.丙酸菌的筛选,分离及在特型酒生产中的应用[D].南昌:南昌大学,2011.
[19]李艳婷,郭尚,郭霄飞,等.清香型白酒发酵过程中微生物群落结构变化及与理化性质的相关性[J].中国食品学报,2023,23(5):330-340.
[20]韩芸娇,梁玲,邱雯雯,等.费氏丙酸杆菌与乳酸菌混合发酵酸奶研究[J].中国食品学报,2017,17(3):96-104.
[21]王晖,蒲叶,李霁阳,等.白酒窖泥中乳酸菌分离鉴定及其发酵产挥发性风味物质比较[J].食品科学技术学报,2020,38(1):26-35.
[22]晋湘宜,赵婷,王家胜,等.共培养时酿酒酵母对速生梭菌己酸代谢的影响及其机理[J].食品科学,2022,43(18):121-126.
[23]陈茂彬,殷想想,郭志豪,等.酪丁酸梭菌共培养对速生梭菌己酸代谢的影响及机理探讨[J].食品科学,2023,44(10):158-164.
[24]李甜,雷雨,李东,等.不同非酿酒酵母与酿酒酵母顺序发酵对茵红李果酒风味的影响[J].食品科学,2023,44(24):179-187.
[25]赵剑雷,邱树毅,王晓丹.异常威克汉姆酵母与酿酒酵母在混合发酵中的相互作用机制[J].食品科学,2022,43(16):201-208.
[26]WANG S P,RUBIO L A,DUNCAN S H,et al.Pivotal roles for pH,lactate,and lactate-utilizing bacteria in the stability of a human colonic microbial ecosystem[J].mSystems,2020,5(5):e00645-20.
[27]WANG C H,SUN J C,LASSABLIERE B,et al.Potential of lactic acid bacteria to modulate coffee volatiles and effect of glucose supplementation: fermentation of green coffee beans and impact of coffee roasting[J].J Sci Food Agr,2019,99(1):409-420.
[28]BÜCHER C, BURTSCHER J, DOMIG K J.Propionic acid bacteria in the food industry:An update on essential traits and detection methods[J].Compr Rev Food Sci Food Saf,2021,20(5):4299-4323.
[29]TRCˇEK J,MIRA N P,JARBOE L R.Adaptation and tolerance of bacteria against acetic acid[J].Appl Microbiol Biotechnol,2015,99(15):6215-6229.
[30]LIU L,GUAN N Z,ZHU G X,et al.Pathway engineering of Propionibacterium jensenii for improved production of propionic acid[J].Sci Rep,2016,6:19963.
[31]孙丹.丙酸杆菌耐酸菌株的选育及其应用[D].保定:河北大学,2017.