表1 产酶条件优化PB试验设计因素与水平
Table 1 Factors and levels of PB experiments for enzyme production conditions optimization
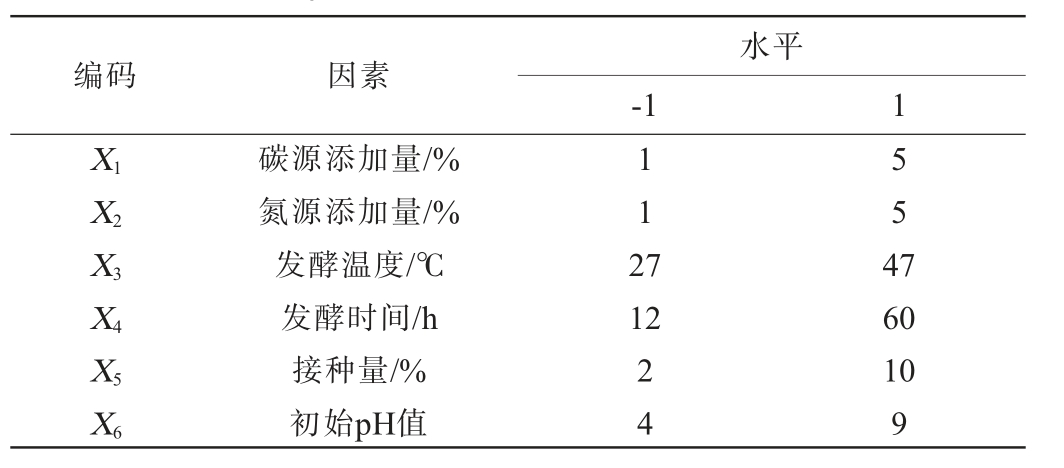
编码 因素水平-1 1 X1 X2 X3 112 7 554 7 X4 12 X5 X6碳源添加量/%氮源添加量/%发酵温度/℃发酵时间/h接种量/%初始pH值24 60 10 9
Screening of a lactic acid bacterium with high-yield protease and optimization of its enzyme-producing conditions
蛋白酶(蛋白酶或肽酶)是一类水解酶,可以切割蛋白质中的肽键,在食品行业中主要应用于肉制品、奶酪[1]、面包[2]和果汁[3]等食品。 蛋白酶主要来源于动物内脏[4]、植物和微生物,也可以通过基因工程来获得蛋白酶。微生物具有培养简便、生长周期短,生长成本低,容易突变等优点[5]。许多微生物都有产蛋白酶的能力。产蛋白酶的菌株有芽孢杆菌、乳酸菌、肠杆菌和微球菌等[6],由于芽孢杆菌产蛋白酶能力较强[7],因此现在研究芽孢杆菌居多。然而在食品应用中,芽孢杆菌会产生水解酶[8]和腐败酶[9],导致食品变质、涨袋,严重影响了产品的外观、营养价值和口感[10];在生产过程中,芽孢杆菌会粘附在储罐、管道和蒸发器表面并形成生物膜[11],对工厂进行持续污染。 食品中芽孢杆菌的存在也会导致产品被退货或者销毁,增加了企业的经济损失[12]。相比较于芽孢杆菌,乳酸菌在国家发布的《可用于食品的菌种名单》中,同时乳酸菌可以产生有抗菌作用的细菌素[13]、抗菌肽[14]以及去除霉菌毒素[15],有较高的安全性且能降低生产成本。因此筛选出具有产蛋白酶能力的乳酸菌株是现在研究的热点。
目前,乳酸菌大多都来源于婴儿粪便、肠道、乳制品和一些发酵产品中[16]。 婴儿粪便中有鼠李糖乳杆菌(Lactobacillus rhamnosus)、植物乳植杆菌(Lactiplantibacillus plantarum)以及干酪乳杆菌(Lactobacillus casei)等多种乳酸菌[17],这些乳酸菌都有产蛋白酶的能力,比如鼠李糖乳杆菌的基因组中有两个特定的蛋白酶基因prtP和prtP2[18],可以产生蛋白酶并具有较强的水解蛋白活力;干酪乳杆菌会产生细胞包膜蛋白酶,能将牛乳酪蛋白水解成多种肽[19];植物乳杆菌可以分泌胰蛋白酶,能够水解蛋白质中由赖氨酸或者精氨酸的羧基所构成的肽链[20]。此外,婴儿粪便源乳酸菌有良好的益生菌特性、耐酸能力、耐胆盐能力和抑菌能力[21]等优点。上述研究结果为从婴儿粪便中分离和筛选高产蛋白酶菌株提供了理论依据和实验支持。但是目前分离得到的菌株普遍存在产蛋白酶活力不高的问题。IKRAM-UL-HAQ等[22]研究了15种乳酸菌产蛋白酶的能力,其中,副干酪乳杆菌的蛋白水解活性最高,达7.28 U/mL。因此,从婴儿粪便中筛选出高产蛋白酶的乳酸菌,并对其产酶条件进行优化具有重要意义。
本研究以母乳喂养的6月龄内的婴儿粪便为研究对象,采用水解圈初筛法和蛋白酶活复筛法筛选具有高产蛋白酶能力的菌株,并通过形态学观察、生理生化试验和分子生物学技术对其鉴定。以蛋白酶活为响应值,采用单因素试验、Plackett-Burman(PB)试验、最陡爬坡试验以及Box-Behnken试验优化菌株的产酶条件,为生产加工乳酸菌产蛋白酶提供必要的理论支持。
1.1.1 样品来源
试验所用样品来源自母乳喂养的6月龄内的健康婴儿的粪便。
1.1.2 化学试剂
Ezup 柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、可溶性淀粉、脱脂乳粉:上海生工生物工程股份有限公司;乳杆菌生化鉴定试剂盒:广东环凯生物科技有限公司;福林酚:上海源叶生物科技有限公司;牛肉膏、蛋白胨、琼脂粉、酵母浸粉、葡萄糖:北京奥博星生物技术有限公司。 实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
MRS液体培养基:蛋白胨10.0 g/L,牛肉膏8.0 g/L,酵母粉4.0 g/L,葡萄糖20.0 g/L,磷酸氢二钾2.0 g/L,柠檬酸氢二铵2.0 g/L,乙酸钠5.0 g/L,硫酸镁0.2 g/L,硫酸锰0.04 g/L,吐温80 1.0 g/L。在此基础上添加20 g/L琼脂粉为MRS固体培养基。
双层筛选培养基[23]:下层板为琼脂粉15 g/L,上层板为琼脂粉7.5 g/L,脱脂乳粉50 g/L。
以上培养基均在121 ℃高压灭菌处理15 min。
JA2003分析天平:上海良平仪器表有限公司;BS124S电子天平:沈阳龙腾电子仪器厂;DHG-9240电热鼓风干燥箱:上海一恒科学仪器有限公司;SJ-3F pH计:上海圣科仪器设备有限公司;TGL-16G台式离心机:上海科雳仪器设备有限公司;DK-98-ⅡA电热恒温水浴锅:天津石泰斯特仪器有限公司;UV-5500PC紫外可见光分光光度计:上海元析仪器有限公司;SW-CJ-IFD紫外超净工作台:北京思博晟达科技有限公司;GI立式高压灭菌锅:厦门致微科技有限公司;96型聚合酶链反应(polymerase chain reaction,PCR)仪:BBI生命科学有限公司;FR980型凝胶成像系统:上海复日科技有限公司。
1.3.1 产蛋白酶菌株的分离及初筛
将1 g婴儿粪便样品加入9 mL的无菌水中,振荡均匀,并梯度稀释至10-6、10-8、10-10。取3个不同梯度的菌悬液1 mL涂布于MRS固体平板中,37 ℃厌氧培养48 h,用接种针挑选符合乳酸菌形态特征的单菌落于MRS斜面中,并保存于-20 ℃的冰箱中。待分离完菌株后,将保存于冰箱的菌株接种在100 mLMRS液体培养基中,37 ℃静置培养24 h,得到种子液,将双层筛选培养基的下层倒入平板中,静置至液体凝固,后向平板中注入活化后的菌液200 μL,涂布均匀,然后再将双层筛选培养基的上层即琼脂和脱脂乳粉的混合培养基倒入平板。在37 ℃条件下培养48 h,观察水解圈直径(D)与菌落直径(d)的比值,挑取比值大的菌落进行蛋白酶活复筛。
1.3.2 产蛋白酶菌株的复筛
将挑取下来的单菌落接种于100 mL MRS液体培养基,在37 ℃条件下静置培养24 h得到发酵液。将发酵液在12 000 r/min的条件下离心10 min,得到上清液即为粗酶液。收集上清液,测定上清液中的蛋白酶活力,选取酶活最高的菌株进行鉴定。 蛋白酶活的测定采用福林酚法[24]。 蛋白酶活是指在40 ℃的条件下酪蛋白水解20 min,一分钟内产生1 μg酪氨酸所需的蛋白酶量,即为1个酶活力单位(U/mL)。
1.3.3 菌株的鉴定
形态学观察:将纯化好的菌株划线接种于MRS固体培养基,于37 ℃恒温培养箱培养48 h,观察菌落形态及细胞特征,根据菌落形态及细胞特征对所分离菌株进行初步判定。
生理生化试验:参考GB 4789.35—2023《食品安全国家标准食品微生物学检验乳酸菌检验》进行。将菌株分别与七叶苷、纤维二糖、麦芽糖、甘露醇、水杨苷、山梨醇、蔗糖和棉子糖进行生化反应。
分子生物学鉴定:采用Ezup柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒提取菌株的总DNA,以细菌通用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')PCR扩增16S rRNA基因序列。 PCR扩增体系(25 μL):模板DNA 1 μL,通用引物27F(10 μmol/L)和1492R(10 μmol/L)各1 μL,双蒸水(ddH2O)9.5 μL。PCR扩增条件:95 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸90 s,总共循环30次;72 ℃终延伸10 min。 扩增产物经1.5%琼脂糖凝胶电泳检测后送至上海生工生物有限公司进行测序。将获得的序列通过美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中的基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,并利用MEGA 11.0软件对菌株亲缘性相近属种进行分析,构建系统发育树。
1.3.4 产酶条件优化单因素试验
在MRS液体培养基的基础上,分别考察添加量均为2%碳源种类(可溶性淀粉、乳清粉、果糖、蔗糖、糊精)及其添加量(1%、2%、3%、4%、5%)、添加量均为2%氮源种类(蛋白胨、麦芽浸粉、牛肉膏、酵母浸粉、硫酸铵)及其添加量(1%、2%、3%、4%、5%)、发酵温度(27 ℃、32 ℃、37 ℃、42 ℃、47 ℃)、发酵时间(12 h、24 h、36 h、48 h、60 h、72 h)、接种量(2%、4%、6%、8%、10%)和培养基初始pH值(4.0、5.0、6.0、7.0、8.0、9.0)对蛋白酶活力的影响。
1.3.5 产酶条件优化响应面试验
(1)Plackett-Burman(PB)试验
根据单因素试验结果,对碳源添加量(X1)、氮源添加量(X2)、发酵温度(X3)、发酵时间(X4)、接种量(X5)、初始pH值(X6)进行PB试验设计,以筛选影响蛋白酶活的重要变量,PB试验设计因素与水平见表1。
表1 产酶条件优化PB试验设计因素与水平
Table 1 Factors and levels of PB experiments for enzyme production conditions optimization

编码 因素水平-1 1 X1 X2 X3 112 7 554 7 X4 12 X5 X6碳源添加量/%氮源添加量/%发酵温度/℃发酵时间/h接种量/%初始pH值24 60 10 9
(2)最陡爬坡试验
根据PB试验筛选出最显著的3个因素,根据这3个显著影响因素的系数值来确定爬坡步长和爬坡方向,从而最快速度靠近最佳区域。 设计试验确定最佳培养条件,并以此作为Box-Behnken试验起始中心点。
(3)Box-Behnken试验
在单因素试验和PB试验的基础上,选择对筛选菌株产蛋白酶活性最大的3个因素发酵温度(A)、碳源添加量(B)、接种量(C)为自变量,以蛋白酶活(Y)为响应值,设计3因素3水平的响应面优化试验,Box-Behnken试验因素与水平见表2。
表2 产酶条件优化Box-Behnken试验因素与水平
Table 2 Factors and levels of Box-Behnken experiments for optimization of enzyme-producing conditions

因素-1水平0 1 A 发酵温度/℃B 碳源添加量/%C 接种量/%27 37 36 48 47 5 10
1.3.6 数据分析与处理
重复上述试验3次,选用IBM SPSS Statistics 27.0统计分析数据,运用单因素ANOVA对所得数据进行显著性分析,并借助Design-Expert 13.0进行PB试验、最陡爬坡试验、Box-Behnken试验设计,用Graphpad prism10.0进行绘图。
从婴儿粪便样品中共分离得到乳酸菌159株,以水解圈大小为依据进行筛选,结果筛选出D/d值>0.2的菌株有13株,将D/d值较高(4.9、3.0、3.3)的3株菌株进行蛋白酶活测定,其蛋白酶活分别为29.56U/mL、38.35U/mL和31.16 U/mL。选择蛋白酶活最高的菌株作为目标菌株进行后续研究,并命名为mys-01。
2.2.1 形态学观察
菌株mys-01的菌落及细胞形态见图1。由图1a可知,菌株mys-01的菌落呈圆形且边缘较为整齐,表面光滑、有光泽且不透明,呈乳白色且微微凸起。 由图1b可知,菌株mys-01的细胞呈短杆状,且为革兰氏阳性菌。
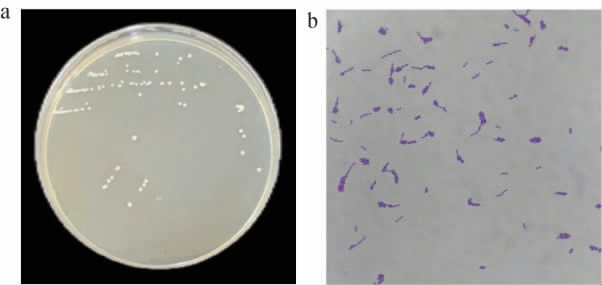
图1 菌株mys-01的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell morphology (b) of strain mys-01
2.2.2 菌株mys-01生理生化试验
菌株mys-01生理生化鉴定结果见表3。 由表3可知,菌株mys-01可以利用七叶苷、纤维二糖、麦芽糖、甘露醇、水杨苷、山梨醇和蔗糖,但是不能利用棉子糖。结合形态特征,参照《乳酸细菌分类鉴定及实验方法》[25],将菌株mys-01初步判定为乳杆菌属(Lactobacillus)。
表3 菌株mys-01生理生化鉴定结果
Table 3 Physiological and biochemical identification results of strain mys-01

测试指标 结果 测试指标 结果七叶苷纤维二糖麦芽糖甘露醇++++水杨苷山梨醇蔗糖棉子糖+++-
2.2.3 菌株mys-01分子生物学鉴定
基于16S rRNA基因序列菌株mys-01的系统发育树见图2。由图2可知,菌株mys-01与Lacticaseibacillus rhamnosus strain亲缘关系最近,同源性达100%。 结合形态学特征和生理生化试验结果,最终鉴定菌株mys-01为鼠李糖乳杆菌(Lacticaseibacillus rhamnosus)。

图2 基于16S rRNA基因序列菌株mys-01的系统发育树
Fig.2 Phylogenetic tree of strain mys-01 based on 16S rRNA gene sequences
2.3.1 碳源种类及最佳碳源添加量对菌株mys-01产蛋白酶的影响
不同碳源及乳清粉添加量对菌株产蛋白酶的影响见图3。
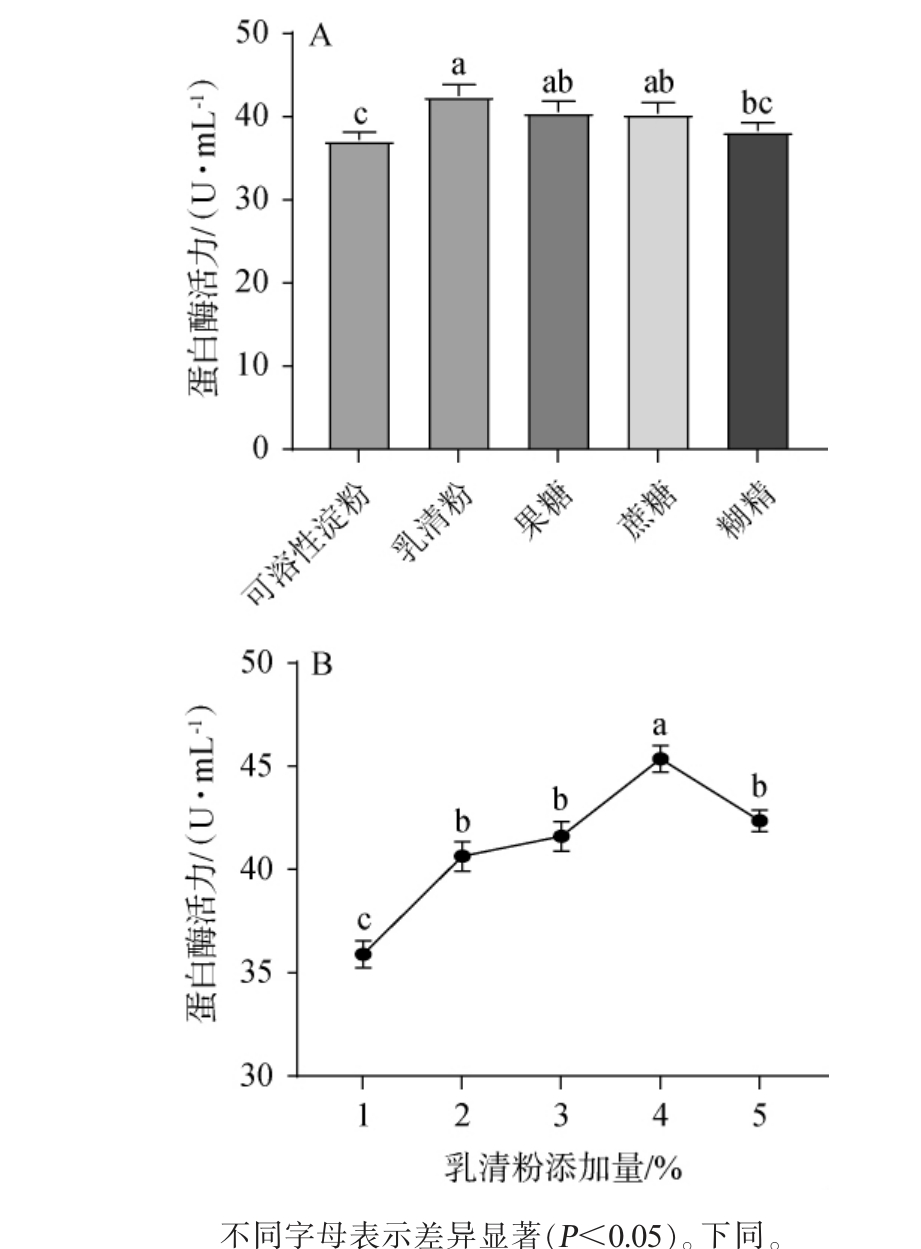
图3 不同碳源(A)及乳清粉添加量(B)对蛋白酶活力的影响
Fig.3 Effect of different carbon sources (A) and whey powder addition (B) on protease activity
由图3A可知,在5种碳源中,乳清粉是菌株mys-01发酵过程中的最佳碳源,此时蛋白酶活为42.53 U/mL,与菌株mys-01在MRS基础培养基中蛋白酶活力(38.35 U/mL)相比,酶活提升了10.90%,显著高于以可溶性淀粉、果糖、蔗糖和糊精为碳源的蛋白酶活力(P<0.05)。因此,确定最佳碳源是乳清粉。由图3B可知,随着乳清粉添加量在1%~5%范围内的增加,蛋白酶活力呈先上升再下降的趋势。当乳清粉添加量为4%时,菌株产蛋白酶酶活力最高,达到43.37 U/mL。因此,确定最适乳清粉加量为4%。
2.3.2 不同氮源及最佳氮源添加量对mys-01产蛋白酶的影响
不同氮源及麦芽浸粉添加量对菌株产蛋白酶的影响见图4。由图4A可知,在5种氮源中,麦芽浸粉是菌株mys-01发酵过程中的最佳氮源,此时蛋白酶活是45.62 U/mL,与菌株mys-01在MRS基础培养基中蛋白酶活力(38.35 U/mL)相比,酶活提升了18.95%。因此,确定最佳氮源是麦芽浸粉。由图4B可知,随着麦芽浸粉添加量在1%~5%范围内的增加,蛋白酶活力呈先上升再下降的趋势。当麦芽浸粉添加量为3%时,菌株产蛋白酶活力最高,为45.87 U/mL。 因此,确定最适麦芽浸粉的最佳添加量为3%。
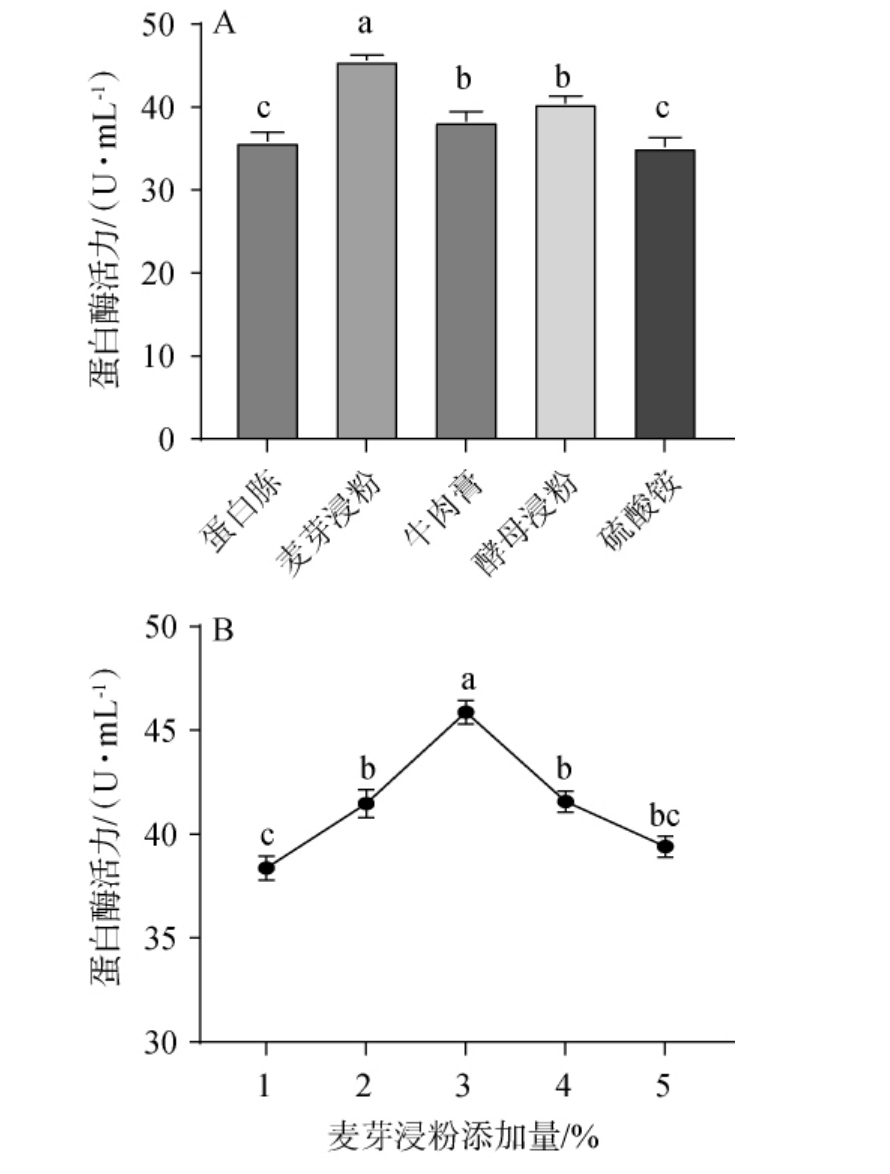
图4 不同氮源(A)及麦芽浸粉添加量(B)对蛋白酶活力的影响
Fig.4 Effect of different nitrogen sources (A) and malt extract addition (B) on protease activity
2.3.3 发酵条件对菌株mys-01产蛋白酶的影响
发酵条件对菌株产蛋白酶的影响见图5。 温度对微生物的生长有很大影响,温度过高或者过低微生物的生长速率都会下降,酶活力也会下降[26]。由图5A可知,随着发酵温度在27~47 ℃范围内的增加,蛋白酶活呈先上升再下降的趋势,并在37 ℃时达到最高值,为51.67 U/mL。 因此,确定最佳发酵温度为37 ℃。
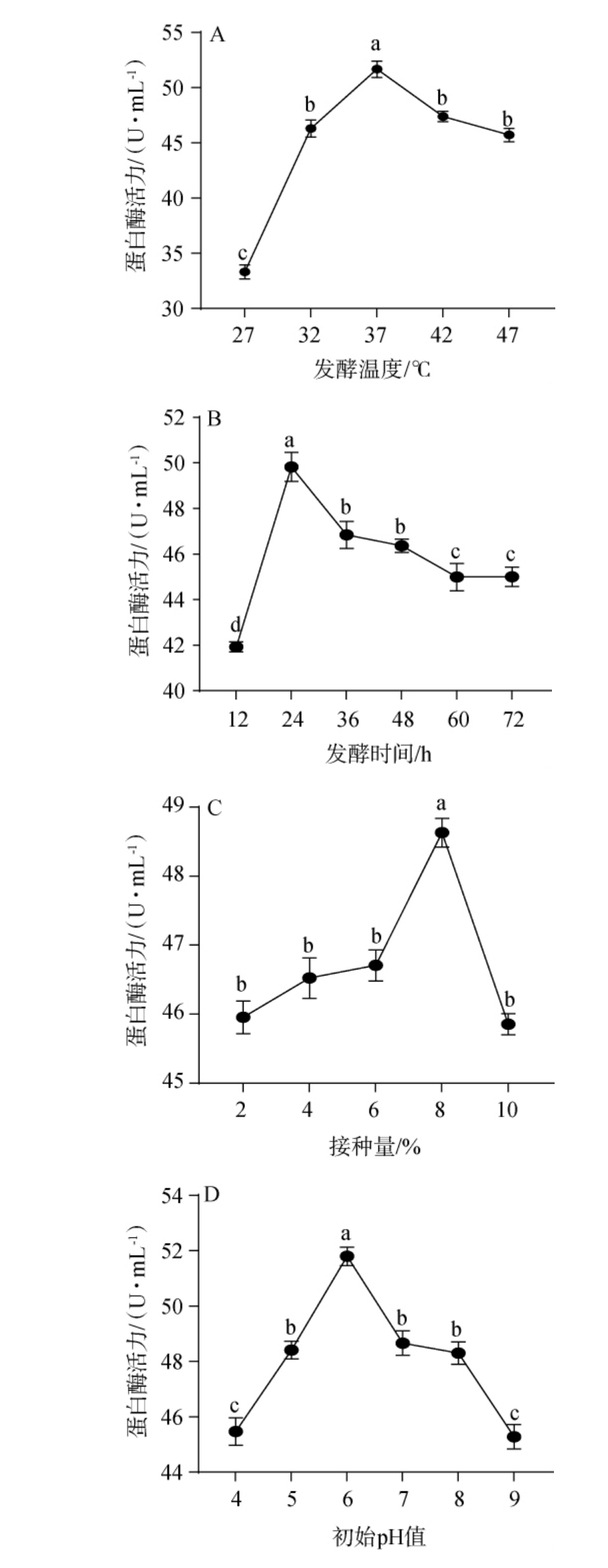
图5 发酵条件对蛋白酶活力的影响
Fig.5 Effects of different fermentation conditions on protease activities
由图5B可知,随着发酵时间在27~37 ℃的延长,蛋白酶活力呈先上升再下降的趋势,当发酵时间为24 h时,蛋白酶活力达到最高,为49.83 U/mL。产生这一现象原因可能是由于菌株mys-01在前期处于繁殖生长期,活菌数量大,导致酶活增加。 到后期,营养物质被消耗,发酵液中的微生物吸收营养成分并挤占剩余空间,导致酶活持续下降。 此外,菌株mys-01在发酵活化的过程中还会产生乳酸,而乳酸的积累也会抑制微生物的生长[27],从而导致酶活力降低。因此,确定最佳发酵时间为24 h。
菌体接种量过高或者过低都会对微生物的产酶能力产生影响。接种量过少时,微生物生长迟滞,产酶能力缓慢上升,时间成本居高不下;当接种量过大时,微生物生长过快,会造成培养液中微生物密度更高,从而对微生物生长有抑制作用[28]。由图5C可知,随着接种量在2%~10%范围内的增加,蛋白酶活力呈先上升再下降的趋势;当接种量为8%时,蛋白酶活最高,达48.53 U/mL。 因此,确定最佳接种量为8%。
培养液初始pH会对菌体生长产生影响。 初始pH过低或过高,都会影响菌体的代谢生长、稳定性以及发酵产物。初始pH过低,会导致培养基的酸化时间更加提前,而过高的初始pH会导致培养基碱化,这两种情况均会抑制微生物的生长。 由图5D可知,随着初始pH在4~9范围内的增加,蛋白酶活呈先上升再下降的趋势;当初始pH为6时蛋白酶活最高,达到51.8 U/mL,显著高于其他初始pH值条件(P<0.05)。表明在弱酸性条件时更适合菌株生长和产酶,这与罗素贤等[29]研究出的鼠李糖乳杆菌的最适生长pH为6一致。因此,确定最佳初始pH为6。
2.4.1 Plackett-Burman试验设计
根据单因素试验结果,对碳源添加量(X1)、氮源添加量(X2)、发酵温度(X3)、发酵时间(X4)、接种量(X5)、初始pH值(X6)进行PB试验设计,试验设计及结果见表4,Plackett-Burman试验各效应评价见表5。 由表5可知,接种量、碳源添加量和发酵温度对蛋白酶活影响极显著(P<0.01)。
表4 产酶条件优化Plackett-Burman试验设计及结果
Table 4 Design and results of Plackett-Burman experiments for enzyme production conditions optimization
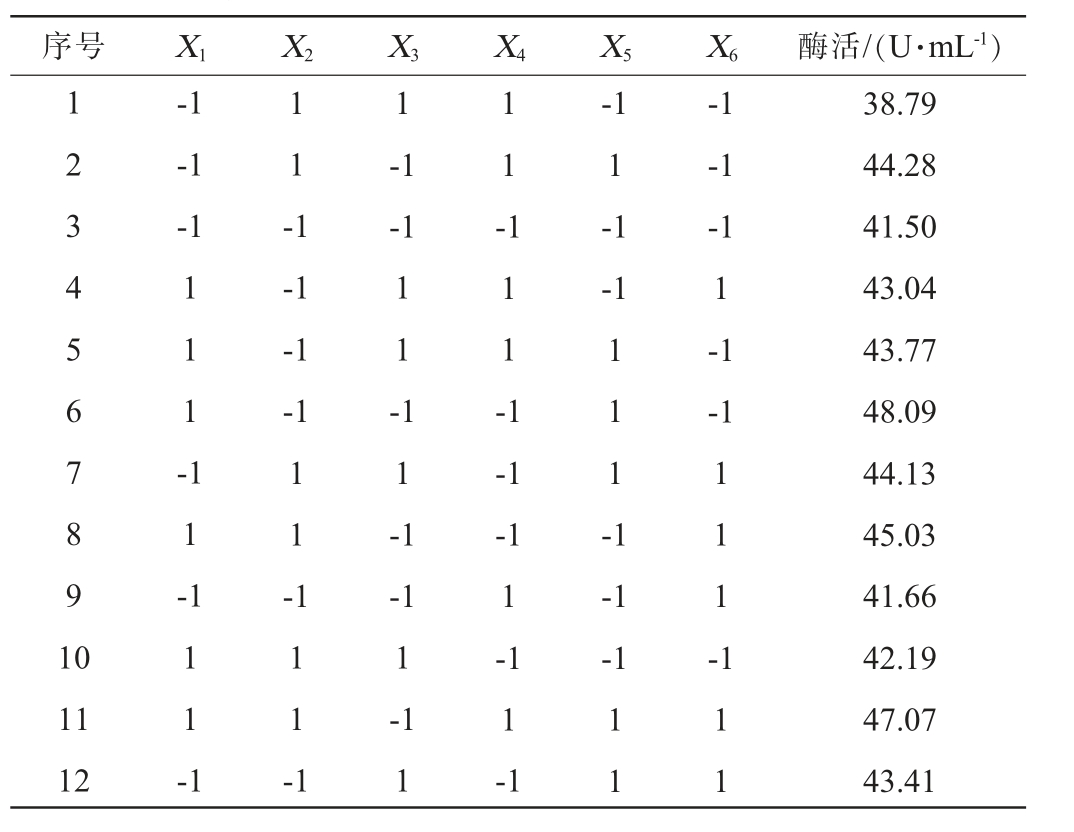
序号 X1 X2 X3 X4 X5 X6 酶活/(U·mL-1)1 2 3 4 5 6 7 8 9 1 0-1-1-1 1 1 -1 1-1-1 1 1 -1 1 1 --1-1-1 1 1 -1 1 1 -1-1 1-1-1-1-1-1 1-1-1 1 1 -1 1 -1 1 -1 1 1 1 -1-1-1 1 1 1 -11 12 1 1 1 -1 1 1 1 -1-1 1-1 1-1-1 1-1 1-1 1 1 1 1 1 38.79 44.28 41.50 43.04 43.77 48.09 44.13 45.03 41.66 42.19 47.07 43.41
表5 Plackkett-Burman试验效应评价
Table 5 Effect evaluation of Plackkett-Burman experiments
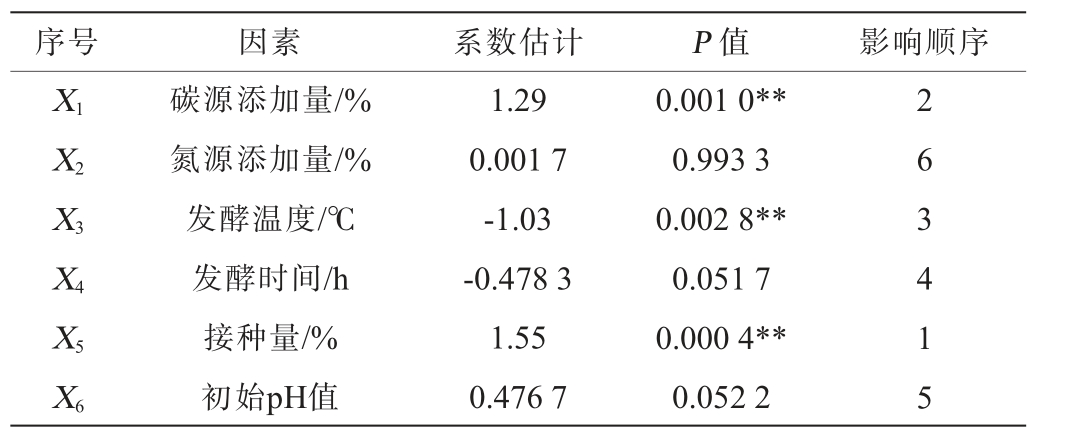
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
序号 因素 系数估计 P 值 影响顺序X1X2X3X4X5X6碳源添加量/%氮源添加量/%发酵温度/℃发酵时间/h接种量/%初始pH值1.29 0.001 7-1.03-0.478 3 1.55 0.476 7 0.001 0**0.993 3 0.002 8**0.051 7 0.000 4**0.052 2 2 6 3 4 1 5
2.4.2 最陡爬坡试验
PB试验筛选出接种量、碳源添加量、发酵温度是影响蛋白酶活力的显著因素。然后经过最陡爬坡试验,准确定位响应面中点。因为碳源添加量和接种量的效应系数为正,选择高水平;而发酵温度的效应系数为负,选择低水平,最陡爬坡试验结果见表6。由表6可知,第3组试验所得蛋白酶活力最高,为56.23 U/mL,因此,将BB试验的中心点选为碳源添加量为4%,温度为37 ℃,接种量为8%。
表6 最陡爬坡试验结果
Table 6 Results of the steepest climb tests
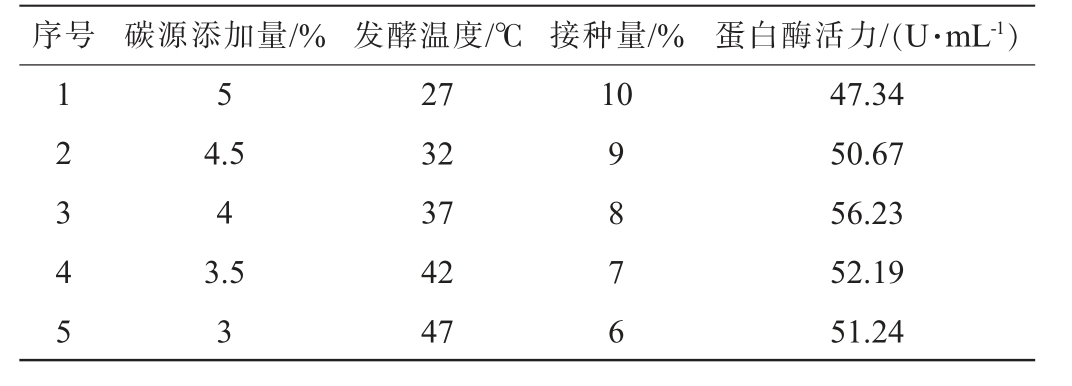
序号 碳源添加量/% 发酵温度/℃ 接种量/% 蛋白酶活力/(U·mL-1)1 2 3 4 5 5 10 4.5 4 3.5 3 27 32 37 42 47 9 8 7 6 47.34 50.67 56.23 52.19 51.24
2.4.3 响应面试验
在单因素试验、PB试验和最陡爬坡试验的基础上,确定温度(A)、碳源添加量(B)、接种量(C)为主要的3个影响因子,以这3个影响因子为考察因素,蛋白酶活力(Y)为响应值。采用Design-Expert 13.0软件设计3因素3水平的Box-Behnken响应面试验,试验设计与结果见表7,方差分析见表8。
表7 产酶条件优化Box-Behnken试验设计及结果
Table 7 Design and results of Box-Behnken experiments for optimization of enzyme-producing conditions
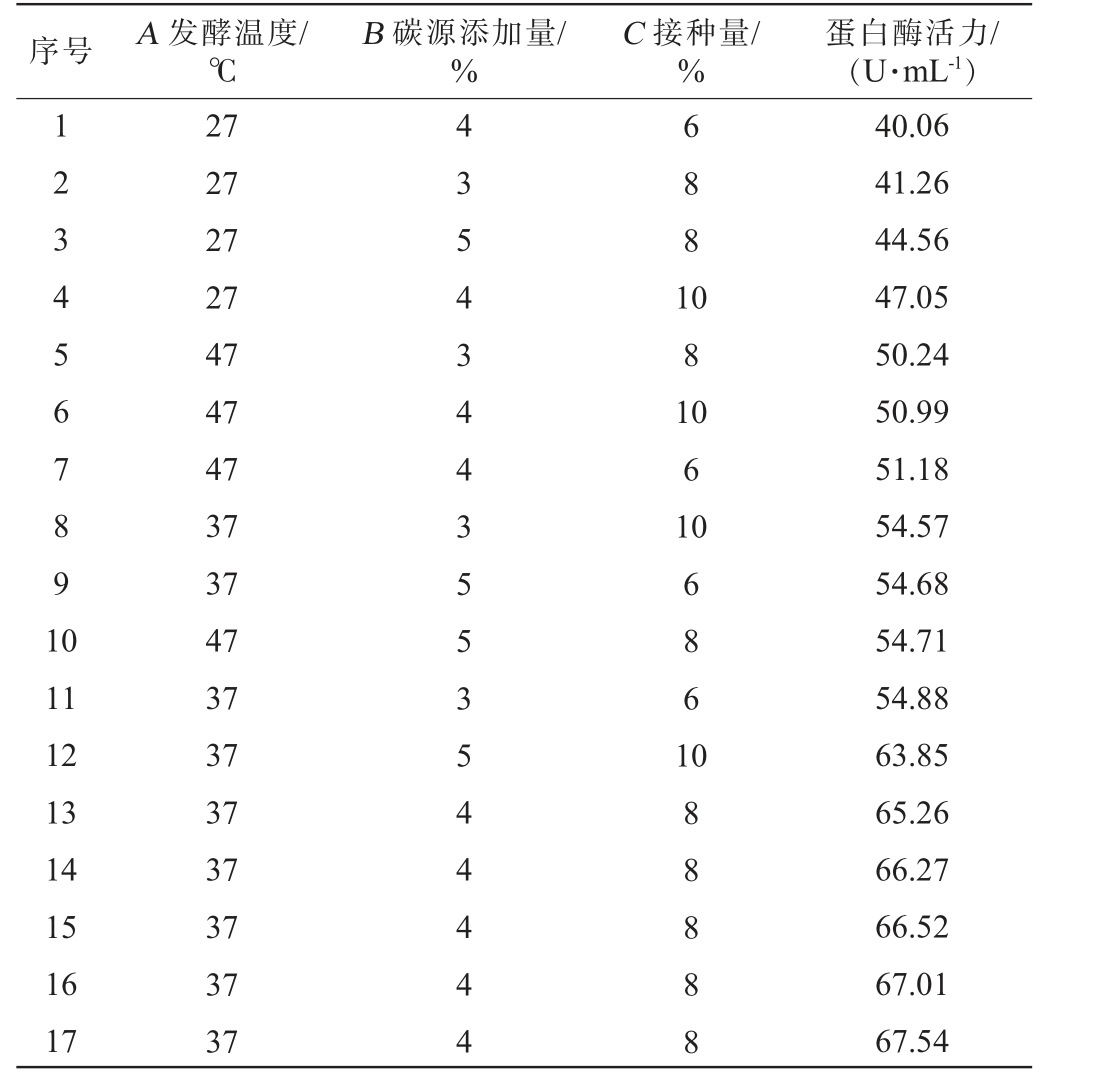
序号 A 发酵温度/℃B 碳源添加量/%C 接种量/%蛋白酶活力/(U·mL-1)1234567891 0 6881 081 0 61 11 12 13 14 15 16 17 27 27 27 27 47 47 47 37 37 47 37 37 37 37 37 37 37 43543443553544444 068 61 088888 40.06 41.26 44.56 47.05 50.24 50.99 51.18 54.57 54.68 54.71 54.88 63.85 65.26 66.27 66.52 67.01 67.54
表8 回归模型方差分析
Table 8 Variance analysis of regression model
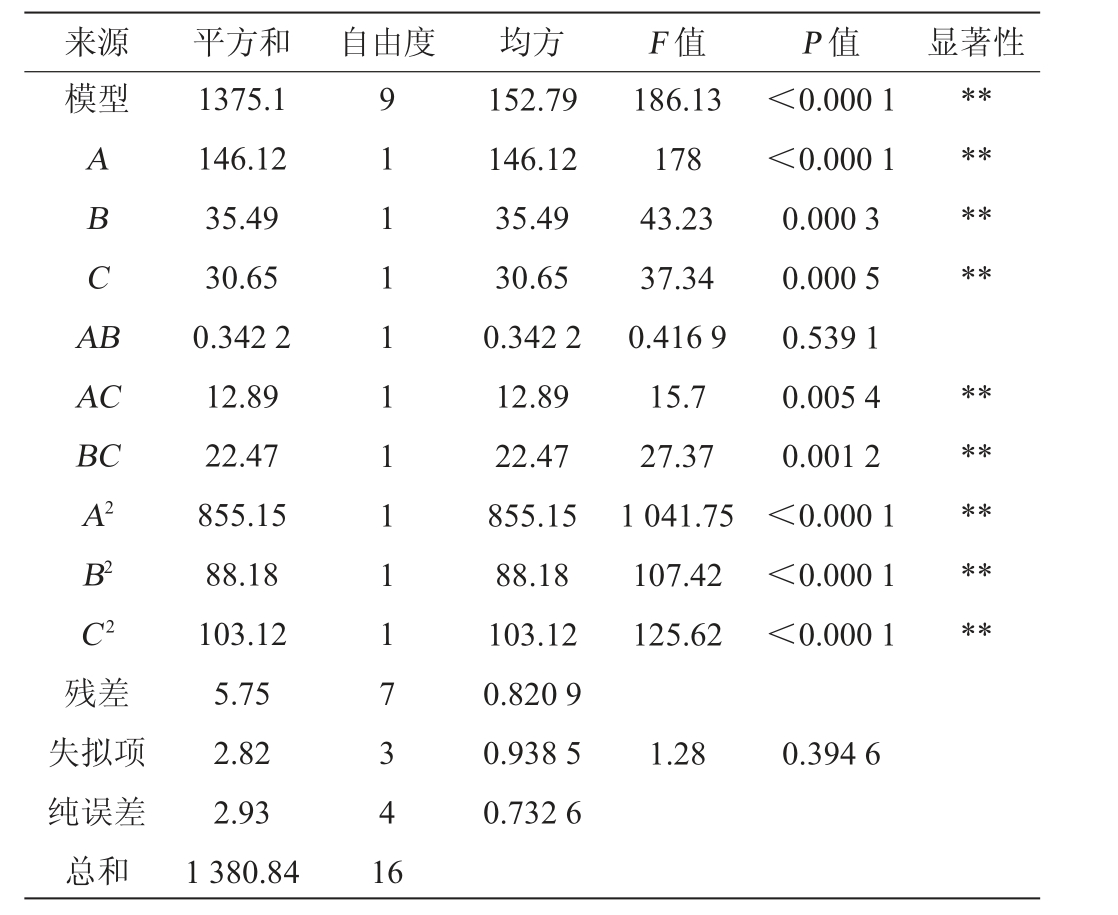
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著
(P<0.05)。
来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B********AC BC A2 B2 C2残差失拟项纯误差总和1375.1 146.12 35.49 30.65 0.342 2 12.89 22.47 855.15 88.18 103.12 5.75 2.82 2.93 1 380.84 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 152.79 146.12 35.49 30.65 0.342 2 12.89 22.47 855.15 88.18 103.12 0.820 9 0.938 5 0.732 6 186.13 178 43.23 37.34 0.416 9 15.7 27.37 1 041.75 107.42 125.62<0.000 1<0.000 1 0.000 3 0.000 5 0.539 1 0.005 4 0.001 2<0.000 1<0.000 1<0.000 1**********1.28 0.394 6
采用Design-Expert 13.0进行多元二次回归拟合,得出方程如下:
由表8可知,模型极显著(P值<0.01),失拟项不显著(P值>0.05)。决定系数R2=0.9958,调整决定系数R2adj=0.9905,模型相关性良好、拟合度较高。由P值可知,一次项A、B、C,交互项AC、AB,二次项A2、B2、C2对结果影响极显著(P>0.05)。由F值可知,各因素对蛋白酶活的影响程度为温度(A)>碳源添加量(B)>接种量(C)。
底部等高线图形状,可判断因素间的交互性,若底部等高线图和椭圆接近,即各因素间有显著的交互作用;而底部等高线图各圆形越接近,即因素间不存在显著交互作用[30]。各因素间交互作用对蛋白酶活影响的响应曲面及等高线见图6。 由图6可知,AC、BC间等高线为椭圆形,因此其交互作用对菌株mys-01所产蛋白酶酶活具有显著影响。
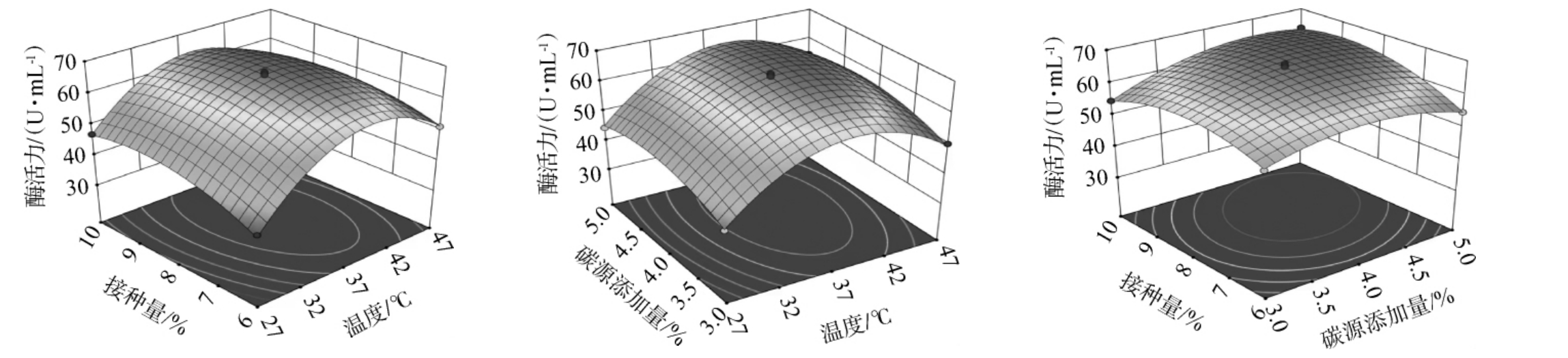
图6 各因素间交互作用对蛋白酶活影响的响应曲面及等高线
Fig.6 Response surface plots and contour lines of effect of interaction between various factors on protease activities
利用Design-Expert 13.0软件分析后,确定最佳产酶条件为:发酵温度38.37 ℃,碳源添加量4.29%,接种量8.48%。在此优化条件下,蛋白酶活预测值67.37 U/mL,为方便实际操作,将最优发酵条件修正为:发酵温度38 ℃,碳源添加量4%,接种量8.5%。在此条件下,蛋白酶活实际值为70.59 U/mL,经过进行3次重复验证试验,实际值与预测值相差不大,较菌株初始酶活38.35 U/mL高84.07%。
本研究采用水解圈初筛法和蛋白酶复筛法从6月龄内母乳喂养的婴儿粪便中分离筛选高产蛋白酶乳杆菌,命名为mys-01,通过形态学观察、生理生化试验和分子生物学技术鉴定该菌株为鼠李糖乳杆菌(Lacticaseibacillus rhamnosus)。 通过单因素试验、PB试验和响应面试验优化得到菌株mys-01的最优发酵条件为发酵温度38 ℃,碳源添加量4%,接种量8.5%。在此优化条件下,菌株mys-01的蛋白酶活力达70.59 U/mL,与菌株初始酶活(38.35 U/mL)提升84.07%,为开发高效产蛋白酶乳酸菌剂及工业化应用提供理论及应用支持。
[1]ARTIFON S E S,SUMNY E H,FABRIS T,et al.Biosynthesis of the acid protease produced by Lacticaseibacillus casei LBC 237 and Limosilactobacillus fermentum LBF 433 and their potential application in the bovine milk clotting[J].Food Biosci,2023,54:102879.
[2]LI X, WANG L, JIANG P, et al.The effect of wheat bran dietary fibre and raw wheat bran on the flour and dough properties:A comparative study[J].LWT-Food Sci Technol,2023,173:114304.
[3]THERON L W,BELY M,DIVOL B.Monitoring the impact of an aspartic protease (MpAPr1) on grape proteins and wine properties[J].Appl Microbiol Biotechnol,2018,102(12):5173-5183.
[4]ANDEVARI T, REZAEI G, et al.Extraction, partial purification and characterization of alkaline protease from rainbow trout (Oncorhynchus mykiss)viscera[J].Aquaculture,2019,500:458-463.
[5]JISHA V N, SMITHA R B, PRADEEP S, et al.Versatility of microbial proteases[J].Adv Enzyme Res,2013,1(3):39-51.
[6]檀茜倩,王丹,王晓晴,等.发酵海产品中产蛋白酶菌株多样性及其酶学特性[J].中国食品学报,2024,24(2):62-70.
[7]梁安健,石沁兰,王金丽,等.产蛋白酶波茨坦短芽孢杆菌的鉴定及产酶条件优化[J].现代食品科技,2024,40(5):73-83.
[8]王小璐,杨永龙,王美华,等.乳制品中芽孢杆菌的研究进展[J].食品科技,2021,46(5):20-24.
[9]苗华彪.饲用耐热蛋白酶的开发及其在枯草芽孢杆菌中分泌调控方式的揭示[D].昆明:云南师范大学,2023.
[10]邱月,秦雪,马钰,等.原料乳中腐败微生物对液态乳品质的影响及防控[J].食品安全质量检测学报,2023,14(16):8-15.
[11]胡玉婷.枯草芽孢杆菌不锈钢微生物腐蚀的胞外双向电子传递机制研究[D].北京:北京科技大学,2023.
[12]赵瑾德,张淑丽,贺凯茹,等.灭菌乳中枯草芽孢杆菌危害与控制研究进展[J].乳业科学与技术,2024,47(4):59-65.
[13]DABA G M,ELKHATEEB W A.Bacteriocins of lactic acid bacteria as biotechnological tools in food and pharmaceuticals:Current applications and future prospects[J].Biocatal Agr Biotech,2020,28:101750.
[14]章检明,步雨珊,杨慧,等.产抗菌肽乳酸菌筛选及抗菌肽的分离纯化与特性研究[J].食品安全质量检测学报,2018,9(4):781-787.
[15]EL-NEZAMI H, KANKAANPAA P, SALMINEN S, et al.Ability of dairy strains of lactic acid bacteria to bind a common food carcinogen,aflatoxin B1[J].Food Chem Toxicol,1998,36(4):321-326.
[16]RAVESCHOT C, CUDENNEC B, DERACINOIS B, et al.Proteolytic activity of Lactobacillus strains isolated from Mongolian traditional dairy products:A multiparametric analysis[J].Food Chem,2020,304:125415.
[17]盖赛伦,陈晓洁,凌涛,等.婴儿源鼠李糖乳杆菌的筛选及其促肠道类器官生长的研究[J].食品工业科技,2022,43(17):167-175.
[18]GUO T,OUYANG X,XIN Y,et al.Characterization of a new cell envelope proteinase PrtP from Lactobacillus rhamnosus CGMCC11055[J].J Agr Food Chem,2016,64(37):6985-6992.
[19]LISA S,LUCINANA D V,DAVIDE T,et al.Peptidomic study of casein proteolysisin bovine milk by Lactobacillus casei PRA205 and Lactobacillus rhamnosus PRA331[J].Int Dairy J,2018,85:237-246.
[20]MARGONO, TRISMILAH, SUMARYONO, et al.Characterization of trypsin-like protease of Lactobacillus plantarum FNCC 0270[J].Hayati J Biosci,2014,21(2):87-94.
[21]HYRSLOVA I, DRAB V, CIHLAR J, et al.Functional and probiotic characterization of newly isolated strains from infant feces and breast milk[J].Fermentation,2023,9(11):960.
[22]IKRAM-UL-HAQ, MUKHTAR H.Protease biosynthesis from Lactobacillus species:Fermentation parameters and kinetics[J].J Food Process Preserv,2007,31(1):102-115.
[23]李誉琦.产蛋白酶菌株的筛选鉴定、发酵工艺优化、酶学性质及罗非鱼皮应用[D].青岛:山东科技大学,2019.
[24]于豪杰.产蛋白酶乳酸菌的筛选及其应用于豆粕发酵初探[D].郑州:郑州大学,2020.
[25]凌代文.《乳酸细菌分类鉴定及实验方法》[J].微生物学通报,1999(1):23.
[26]余萍,张春宇,矫艳平,等.一株鼠李糖乳杆菌培养条件的优化[J].中国乳品工业,2021,49(9):28-32.
[27]侯子君,刘静,李竹月,等.浅谈乳酸菌代谢产物对微生物生长的抑制作用[J].农村科学实验,2018(1):99,44.
[28]高若珊,杨春华,王冰,等.一株耐高温诱变鼠李糖乳杆菌产酸条件优化及其特性分析[J].中国食品学报,2022,22(4):208-216.
[29]罗素贤,叶昱,周信荣,等.一株鼠李糖乳杆菌的培养条件优化研究[J].江西农业大学学报,2018,40(2):365-370.
[30]黄倩,梁安健,朱鹏程,等.一株高产淀粉酶魏斯氏菌产酶条件优化[J].西南民族大学学报(自然科学版),2024,50(1):16-27.