表1 青稞固态发酵工艺优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests optimization for solid-state fermentation of highland barley

水平 A 蒸煮时间/min B 发酵温度/℃ C 接种量/%1 0 -1 30 40 50 35 37 39 2.5 5.0 7.5
Optimization of solid-state fermentation process of highland barley for 1-deoxynojirimycin production and its in vitro hypoglycemic ability
近年来,全世界糖尿病患病人数持续增加,糖尿病的危害主要包括影响肾脏健康、影响身体的正常代谢和其他并发症[1]。 预计至2046年,全球II型糖尿病患病人数将增至6.42亿。 目前,常用的降糖药物有阿卡波糖、伏格列糖和米格列醇,虽然这些药物降血糖效果好,但价格高、副反应和毒副作用较大[2],因此,从天然动植物和矿物中寻找低毒、高效的α-葡萄糖苷酶抑制剂具有广阔的应用前景[3]。
α-葡萄糖苷酶也称为α-葡萄糖苷水解酶或葡萄糖基转移酶(glucosyltransferase,GTase),是一种在淀粉水解酶家族中占有重要地位的酶[4],主要在细胞外起作用,能从多糖的非还原末端水解底物的α-葡萄糖苷键,产生α-D-葡萄糖[5]。除水解作用,α-葡萄糖苷酶还具有转糖苷作用,能够将低聚糖中的α-1,4-糖苷键转化成α-1,6-糖苷键[6],从而得到非发酵性的低聚异麦芽糖或糖肽等。α-葡萄糖苷酶主要在人体的上消化道中发挥作用,它们将复杂的碳水化合物分解成简单的单糖形式[7]。α-葡萄糖苷酶抑制剂通过与小肠内的α-葡萄糖苷酶竞争结合位点,从而抑制其活性,减缓碳水化合物分解成葡萄糖的过程[8]。这一作用机制有助于延缓葡萄糖从肠道进入血液的速度,进而降低餐后血糖的升高[8]。α-葡萄糖苷酶抑制剂通过这种机制,为Ⅱ型糖尿病患者提供一种有效控制血糖的选择。 其中,1-脱氧野尻霉(1-deoxynojirimycin,DNJ)是一种强效α-葡萄糖苷酶抑制剂[9]。 与传统降糖药物相比,DNJ的降糖机制独特,通过抑制α-葡萄糖苷酶的作用阻碍碳水化合物转化成葡萄糖,可抑制小肠对葡萄糖的吸收,达到抑制血糖值和血压的上升[10]。 DNJ通过多种机制发挥降糖功效,具有低血糖风险低、毒副作用少等优点,是一种具有潜力的天然降血糖成分[11-12]。
青稞(Hordeum vulgare var.coeleste L.)是一种生长在高海拔地区的特种大麦,其含有丰富的蛋白质、脂肪、碳水化合物、维生素和矿物质,是全世界公认营养成分最均衡的禾谷类作物[13-14]。 随着青稞种植技术和加工技术不断提高,青稞产品的种类和品质也不断提升[15]。青稞经过发酵后可以提高其淀粉、β-葡聚糖和膳食纤维等的含量,使得青稞中的营养成分更易于被人体吸收和利用[16]。 本研究以青稞为原料,一株高产DNJ的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)B-14为发酵菌株,通过单因素及响应面试验优化解淀粉芽孢杆菌B-14固态发酵青稞产DNJ的工艺参数,并通过测定α-葡萄糖苷酶抑制率、α-淀粉酶抑制率和体外消化试验对其降糖能力进行评价,以期为青稞功能性食品的研究提供参考,同时也为糖尿病患者提供一种新型餐后降血糖产品。
青稞(藏青2000):西藏农业科学院;解淀粉芽孢杆菌(Bacillus amyloliquefaciens)B-14:中国食品发酵工业研究院保存;DNJ标准品(纯度>99%)、α-葡萄糖苷酶、α-淀粉酶、芴甲氧羰酰氯(Fmoc-Cl)、对硝基苯酚-β-D-吡喃葡萄糖 苷(4-nitrophenyl-beta-D-galactopyranoside,pNPG)、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):上海源叶生物科技有限公司;唾液淀粉酶(>5 U/mg)、胃蛋白酶(>250 U/mg)、胰 酶(4 U/mg)、胰 脂 肪 酶(100 U/mg):德 国Sigma公司;葡萄糖试剂盒:默克生命科学技术有限公司;其余试剂均为国产分析纯或生化试剂。
LDZX-50L-I立式高压蒸汽灭菌锅:上海申安医疗器械厂;Multiskan FC型酶标仪:赛默飞世上海仪器有限公司;2-16N高速微量离心机:湖南恒诺仪器设备有限公司;Agilent Technologies G7129高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Agilent公司。
1.3.1 青稞固态发酵
选择色泽鲜艳、颗粒饱满、无杂质、无病虫害的优质青稞,清洗,以去除表面的灰尘和杂质。将清洗干净的青稞在常温的清水中浸泡24 h,使青稞充分吸水膨胀,将浸泡好的青稞放入高压灭菌锅中105 ℃蒸煮40 min, 冷却到适合解淀粉芽孢杆菌B-14生长的温度。取新鲜解淀粉芽孢杆菌B-14的种子液(活菌数为2×108 CFU/mL)按7.5%的接种量与冷却好的青稞混合均匀,取50 g放入250 mL三角瓶中,在35 ℃恒温恒湿培养箱中发酵3 d。 发酵结束后放入烘箱中进行干燥、粉碎,备用[17]。
1.3.2 DNJ含量的检测
参考HU G等[18]方法,取青稞固态发酵产物0.01 g于10 mL蒸馏水中超声30 min使其完全溶解,12 000 r/min离心2 min,取上清备用。 参照国标GB/T 40642—2021《桑叶提取物中1-脱氧野尻霉素的检测高效液相色谱法》采用高效液相色谱法测定DNJ含量。以DNJ质量浓度(x)为横坐标,峰面积(y)为纵坐标,得到DNJ标准曲线的回归方程为y=4.114x-2.96,相关系数R2为0.996 9。
1.3.3 青稞固态发酵工艺优化单因素试验
在方法1.3.1的基础上,以DNJ含量为评价指标,采用单因素轮换法依次考察接种量(2.5%、5.0%、7.5%、10.0%、12.5%)、发酵时间(1 d、2 d、3 d、4 d、5 d)、发酵温度(31 ℃、33 ℃、35 ℃、37 ℃、39 ℃)和蒸煮时间(20 min、30 min、40 min、50 min、60 min)对DNJ含量的影响。
1.3.4 青稞固态发酵工艺优化响应面试验
根据单因素试验得到的结果,以DNJ含量(Y)为响应值,选择蒸煮时间(A)、发酵温度(B)、接种量(C)为考察因素,采用Design-Expert 13.0软件设计3因素3水平的Box-Behnken响应面试验,试验因素与水平见表1。
表1 青稞固态发酵工艺优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests optimization for solid-state fermentation of highland barley

水平 A 蒸煮时间/min B 发酵温度/℃ C 接种量/%1 0 -1 30 40 50 35 37 39 2.5 5.0 7.5
1.3.5 DNJ体外降糖活性研究
(1)α-葡萄糖苷酶抑制率
参考YING Q等[19]方法,以蒸馏水为空白对照,采用蒸馏水配制3组不同的样品,一组为不同质量浓度的阿卡波糖(阳性对照)、一组为不同质量浓度的未加菌的青稞固态发酵产物(阴性对照)、一组为不同质量浓度的青稞固态发酵产物(试验组)。 每组不同质量浓度的样品各取两份,每份200 μL,一份加入α-葡萄糖苷酶工作液200 μL为样品组,另一份加入0.1mol/L pH为7.2的磷酸缓冲盐溶液(phosphate buffer saline,PBS)溶液200 μL为样品背景组,混匀后于37 ℃孵育5 min,后加入200 μL pNPG(2.5 mmol/L)混和均匀,于37 ℃继续孵育15 min,最后加入800 μL Na2CO3(0.2 mol/L)终止反应。吸取200 μL反应终止液至96孔板中,采用酶标仪测定波长405 nm处的吸光度值(A405 nm值),计算α-葡萄糖苷酶抑制率,其计算公式如下:
(2)α-淀粉酶抑制率
参考张娜英等[20]方法并加以改进,以蒸馏水为空白对照,采用蒸馏水配制3组不同的样品,一组为不同质量浓度的阿卡波糖(阳性对照)、一组为不同质量浓度的未加菌的青稞固态发酵产物(阴性对照)、一组为不同质量浓度的青稞固态发酵产物(试验组)。 每组不同质量浓度的样品各取两份,每份100 μL,一份加入1%可溶性淀粉溶液200 μL为样品组,另一份加入0.1 mol/L pH为7.2的PBS 200 μL为样品背景组,混合后于37 ℃孵育10 min,之后加入200 μL α-淀粉酶工作液继续孵育10 min。随后加入400 μL DNS,沸水浴煮沸5 min。 取出放入冷水中降温,加入4 mL去离子水,涡旋混合后吸取200 μL至96孔板,采用酶标仪测定波长540 nm处的吸光度值(A540 nm值),计算α-淀粉酶抑制率,其计算公式如下:
(3)体外消化模拟实验
参考ZHANG Q等[21]方法并加以改进,模拟口腔液:取7 500 U唾液淀粉酶加入100 mL口腔电解质溶液中,搅拌10 min至完全溶解,并用2 mol/L NaOH溶液将模拟口腔液pH调至7.0。 模拟胃液:取2×105 U胃蛋白酶加入100 mL胃电解质溶液中,配制成胃蛋白酶活力为2 000 U/mL的模拟胃液,加入5 mL CH3COONa缓冲液(1 mol/L,pH 5.0),搅拌10 min至完全溶解,并用2 mol/L HCL溶液将模拟胃液pH调至2.0。模拟肠液:取50 mL小肠电解质溶液、100 mL胆汁盐溶液(40 mmol/L)和50 mL胰液(0.8%),加入胰脂肪酶50 000 U,搅拌10 min至完全溶解,并用2 mol/L NaOH溶液将模拟肠液pH调至7.0。体外模拟消化:称取200 mg玉米淀粉为空白对照组,另取200 mg玉米淀粉,添加不同含量的青稞固态发酵样品(5%、10%、15%、20%),先与模拟口腔液1∶1(V/V)混合,于37 ℃、200 r/min条件下振荡2 min,立即加入2 mol/L HCl调节pH值至2.0以停止口腔模拟消化。 然后加入10 mL的模拟胃液,在37 ℃、200 r/min条件下孵化2 h,模拟在胃中的消化,随后迅速添加2 mol/L NaOH调节pH值至7.0,终止胃模拟消化。 最后迅速加入10 mL模拟肠液,37 ℃、200 r/min条件下孵育2 h,模拟在肠中的消化。 取1 mL在肠中消化0、20 min、40 min、60 min、90 min、120 min、150 min、180 min的消化液,沸水浴灭酶10 min,于8 000 r/min离心10 min后取上清液100 μL,加入到900 μL淀粉葡萄糖苷酶溶液(1.1 mg/mL),使样品反应体系中淀粉葡萄糖苷酶终质量浓度为1 mg/mL,于37 ℃孵育20 min后,沸水浴加热10 min后立即用流动水冷却至室温,8 000 r/min离心10 min,取上清液,用葡萄糖试剂盒测定上清液中葡萄糖的含量,计算淀粉水解率,其计算公式如下:
1.3.6 数据处理
每组试验重复3次,通过IBM SPSS Statistics 27.0和Design-Expert 13.0对数据进行统计分析,结果用“平均值±标准差”表示,使用Origin 2022和GraphPad Prism 8.0作图。
2.1.1 不同接种量对DNJ含量的影响
不同接种量对DNJ含量的影响见图1。 由图1可知,随着接种量的升高,DNJ含量呈先升高后下降的趋势,当接种量为5%时,DNJ含量最高,为4.83 mg/g。 分析原因可能是接种量较低,青稞中的营养物质未被完全利用,导致DNJ含量较低;接种量过高,青稞中的营养物质不足,不利于解淀粉芽孢杆菌B-14的生长发育及代谢[22]。因此,确定最佳接种量为5%。
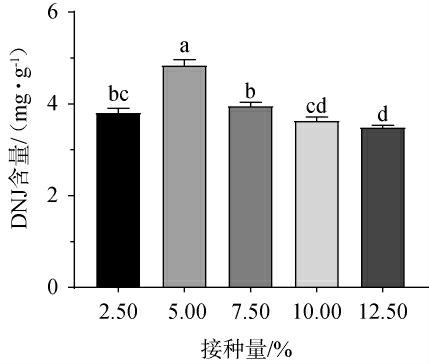
图1 不同接种量对脱氧野尻霉素含量的影响
Fig.1 Effect of different inoculum on 1-deoxynojirimycin contents
不同小写字母表示差异显著(P<0.05)。下同。
2.1.2 不同发酵时间对DNJ含量的影响
不同发酵时间对DNJ含量的影响见图2。由图2可知,随着发酵时间的延长,DNJ含量呈先升高后下降的趋势,当发酵时间为3 d时,DNJ含量最高,为4.76 mg/g。分析原因可能是,发酵时间过短,青稞未被完全利用,导致DNJ含量较低,但发酵时间过长时,菌体产生的酶可能会降解DNJ,或者将DNJ的前体物质转化为其他代谢产物,从而减少DNJ的合成[23],同时发酵时间过长,青稞固态发酵产物会出现淡淡的异味,可能是菌体的代谢产物的累积导致青稞出现异味[24]。因此,固定最佳发酵时间为3 d。
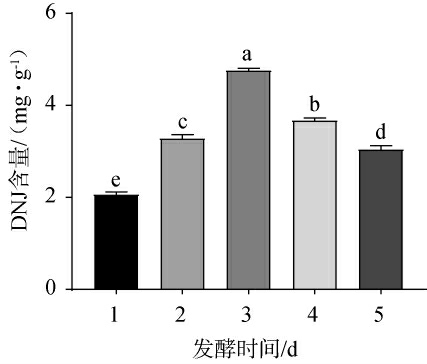
图2 不同发酵时间对脱氧野尻霉素含量的影响
Fig.2 Effect of different fermentation time on 1-deoxynojirimycin contents
2.1.3 不同发酵温度对DNJ含量的影响
不同发酵温度对DNJ含量的影响见图3。由图3可知,随着发酵温度的升高,DNJ含量呈先升高后下降的趋势,当发酵温度为37 ℃时,DNJ含量最高,达到5.85 mg/g。分析原因可能是发酵温度过低会导致菌株体内的酶催化活性不够,延缓菌株的生长繁殖及代谢;发酵温度过高会导致菌株的酶活性降低,并且菌丝过早自溶,进而导致DNJ含量下降[25]。因此,确定最佳发酵温度为37 ℃。
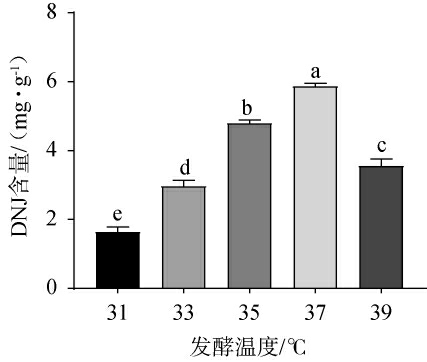
图3 不同发酵温度对脱氧野尻霉素含量的影响
Fig.3 Effect of different fermentation temperature on 1-deoxynojirimycin contents
2.1.4 不同蒸煮时间对DNJ含量的影响
不同蒸煮时间对DNJ含量的影响见图4。 由图4可知,随着蒸煮时间的延长,DNJ含量呈先升高后下降的趋势,当蒸煮时间为40 min时,DNJ含量最高,为5.81 mg/g。 分析原因可能是蒸煮时间过短,部分青稞未被煮开,青稞内的营养成分不能完全被利用,导致DNJ含量较低;而蒸煮时间过长时,青稞被煮的过于软烂,青稞的形态发生很大变化,且青稞中的营养物质有所流失导致后续发酵中的DNJ含量降低[26]。因此,确定最佳蒸煮时间为40 min。
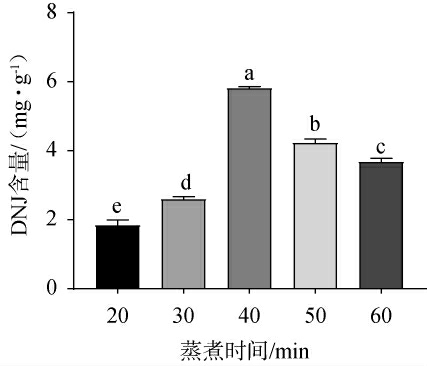
图4 不同蒸煮时间对脱氧野尻霉素含量的影响
Fig.4 Effect of different cooking time on 1-deoxynojirimycin contents
在单因素试验的基础上,固定发酵时间为3 d,以DNJ含量为响应值,选择蒸煮时间(A)、发酵温度(B)、接种量(C)为考察因素,采用Design-Expert 13.0软件设计3因素3水平的Box-Behnken响应面试验,试验设计及结果见表2,方差分析见表3。
表2 青稞固态发酵工艺优化Box-Benhnken响应面试验设计及结果
Table 2 Design and results of response surface tests optimization for solid-state fermentation of highland barley
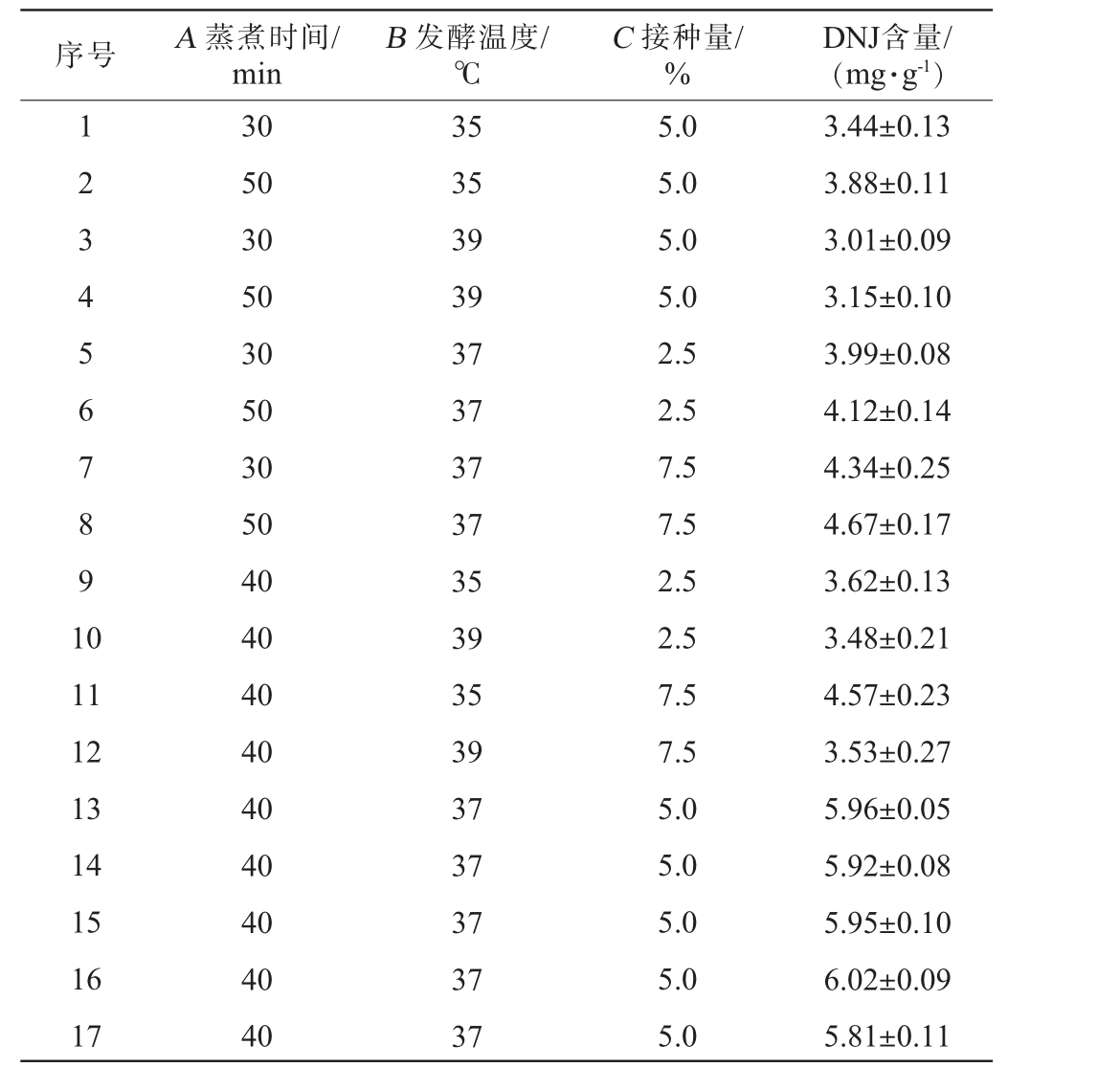
序号 A 蒸煮时间/min B 发酵温度/℃C 接种量/%DNJ含量/(mg·g-1)1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 30 50 30 50 30 50 30 50 40 40 40 40 40 40 40 40 40 35 35 39 39 37 37 37 37 35 39 35 39 37 37 37 37 37 5.0 5.0 5.0 5.0 2.5 2.5 7.5 7.5 2.5 2.5 7.5 7.5 5.0 5.0 5.0 5.0 5.0 3.44±0.13 3.88±0.11 3.01±0.09 3.15±0.10 3.99±0.08 4.12±0.14 4.34±0.25 4.67±0.17 3.62±0.13 3.48±0.21 4.57±0.23 3.53±0.27 5.96±0.05 5.92±0.08 5.95±0.10 6.02±0.09 5.81±0.11
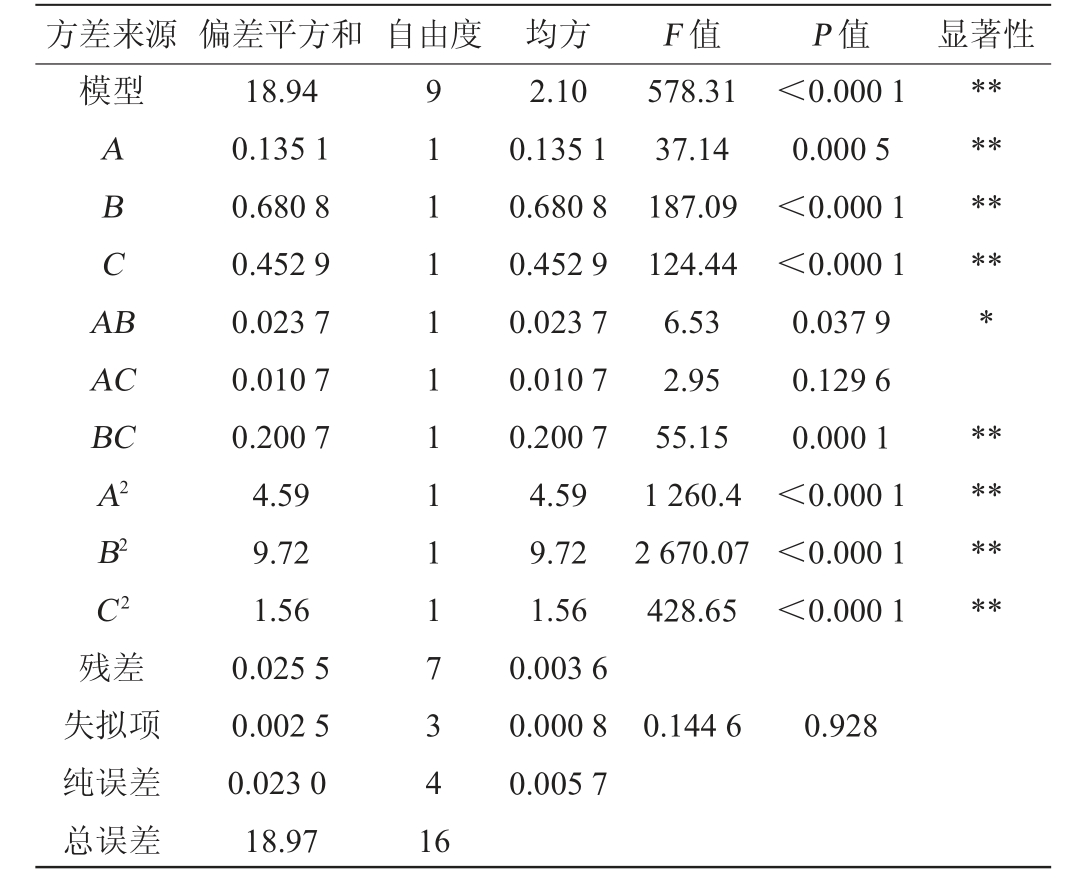
表3 回归模型方差分析
Table 3 Variance analysis of regression model
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著
(P<0.05)。
方差来源 偏差平方和 自由度 均方 F 值 P 值 显著性模型ABCA B*********AC BC A2 B2 C2残差失拟项纯误差总误差18.94 0.135 1 0.680 8 0.452 9 0.023 7 0.010 7 0.200 7 4.59 9.72 1.56 0.025 5 0.002 5 0.023 0 18.97 91111111117341 6 2.10 0.135 1 0.680 8 0.452 9 0.023 7 0.010 7 0.200 7 4.59 9.72 1.56 0.003 6 0.000 8 0.005 7 578.31 37.14 187.09 124.44 6.53 2.95 55.15 1 260.4 2 670.07 428.65<0.000 1 0.000 5<0.000 1<0.000 1 0.037 9 0.129 6 0.000 1<0.000 1<0.000 1<0.000 1********0.144 6 0.928
采用Design-Expert 13.0软件对表2数据进行多元二次回归拟合,得到回归方程:Y=5.91+0.127 5A-0.316 2B+0.258 8C-0.072 5AB+0.052 5AC-0.185 0BC-1.01A2-1.53B2-0.623 0C2。
由表3可知,模型的P值<0.000 1,极显著,失拟项P=0.576 5>0.05,不显著,表明该试验结果与模型预测值拟合较好;决定系数R2=0.998 7和调整决定系数R2Adj=0.996 9,说明该模型拟合程度较好,由P值可知,一次项A、B、C,二次项A2、B2、C2及交互项BC对DNJ含量影响极显著(P<0.01),交互项AB对结果影响显著(P<0.05),交互项AC对结果影响不显著(P>0.05)。由F值可知,3个因素对DNJ含量影响的主次顺序为B>C>A,即发酵温度>接种量>蒸煮时间。
各因素间交互作用对DNJ含量影响的响应面见图5。由图5可知,响应面均呈凸面,存在最大值,AB、BC间交互作用趋于椭圆形,AC间交互作用趋于圆形,说明AB、BC间交互作用对DNJ含量影响较大,AC间交互作用对DNJ含量影响最小,这与方差分析结果一致。
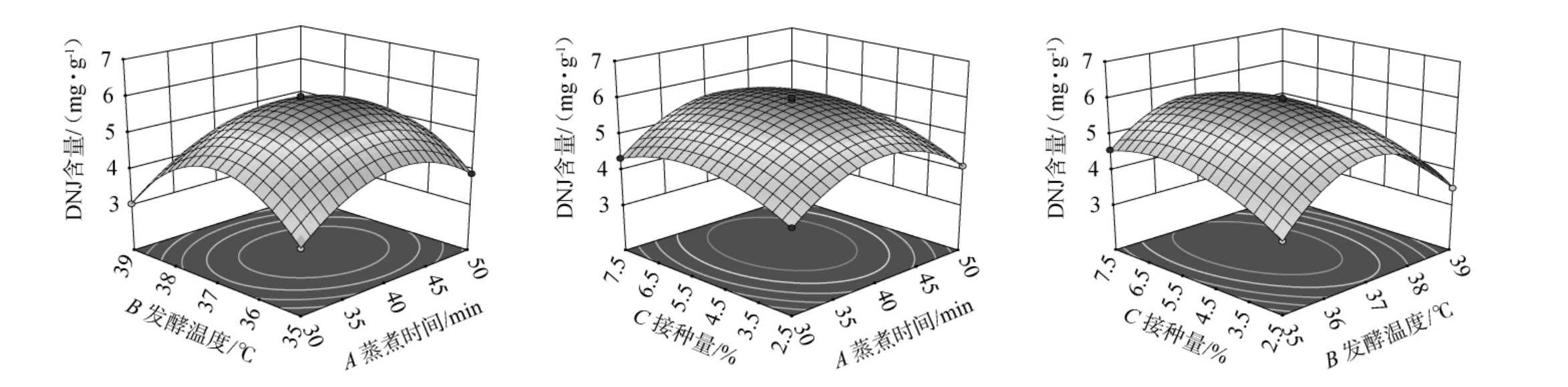
图5 发酵温度、接种量、蒸煮时间两两间交互作用对1-脱氧野尻霉含量影响的响应曲面及等高线
Fig.5 Response surface plots and contour lines of effect of interaction between fermentation temperature, inoculum and cooking time on 1-deoxynojirimycin contents
通过Design-Expert 13软件对多元二次回归方程进行最优求解,得到解淀粉芽孢杆菌B-14固态发酵青稞产DNJ的最佳工艺条件为蒸煮时间40.719 min,发酵温度36.772 ℃,接种量5.548%,在此条件下,DNJ含量的预测值为5.979 mg/g,为便于实际操,将最优发酵条件修订为蒸煮时间41 min,发酵温度37 ℃,接种量5.5%。 在此优化条件下,进行5组平行试验结果并取平均值,得到DNJ含量为6.134 mg/g,与理论预测值相比相对误差<3%,说明该模型可用于预测解淀粉芽孢杆菌B-14固态发酵青稞产DNJ。
2.3.1 青稞固态发酵产物对α-葡萄糖苷酶的抑制率
α-葡萄糖苷酶可有效催化水解淀粉和低聚糖,引起餐后血糖升高[24],因此,以阿卡波糖为阳性对照,未加菌的青稞固态发酵产物为阴性对照,通过测定青稞固态发酵产物的α-葡萄糖苷酶抑制率评价其体外降糖活性,结果见图6。由图6可知,随着质量浓度的升高,阿卡波糖对α-葡萄糖苷酶的抑制率呈先升高后稳定的趋势,未加菌的青稞固态发酵产物及青稞固态发酵产物对α-葡萄糖苷酶的抑制率呈升高趋势。 青稞固态发酵产物对α-葡萄糖苷酶的IC50值为0.29 mg/mL,低于未加菌的青稞固态发酵产物对α-葡萄糖苷酶的IC50值(3.86 mg/mL),但高于阿卡波糖对α-葡萄糖苷酶的IC50值(0.03 mg/mL),说明经解淀粉芽孢杆菌B-14固态发酵后的青稞对α-葡萄糖苷酶的抑制效果明显有所提高,分析原因可能是经过发酵后,青稞中的β-葡聚糖或其他降糖成分有所增加,同时又有DNJ产生,从而导致发酵后青稞对α-葡萄糖苷酶抑制效果的提高[27]。
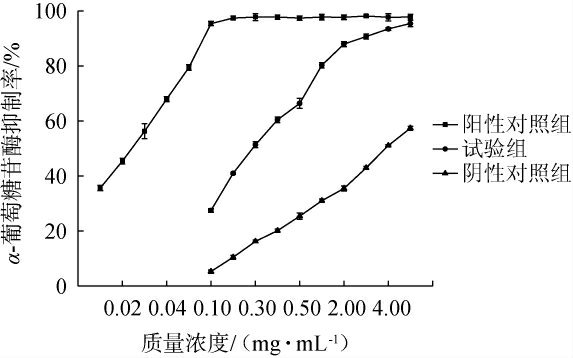
图6 不同质量浓度的阿波卡糖、青稞固态发酵产物和未加菌青稞固态发酵产物对α-葡萄糖苷酶的抑制率的影响
Fig.6 Effect of different concentrations of Apoka sugar, solid-state fermentation products of highland barley and solid-state fermentation product of highland barley without strains on the inhibition rate of α-glucosidase
2.3.2 青稞固态发酵产物对α-淀粉酶的抑制率
α-淀粉酶可以有效将淀粉和糖水解成糊精、低聚糖和单糖,引起人体餐后血糖升高,因此,抑制α-淀粉酶的活性可以控制人体的餐后血糖水平[28]。以阿卡波糖为阳性对照,未加菌的青稞固态发酵产物为阴性对照,测定青稞固态发酵产物对α-淀粉酶的抑制率,结果见图7。由图7可知,随着质量浓度的升高,阿卡波糖对α-淀粉酶的抑制率呈先升高后稳定的趋势,未加菌的青稞固态发酵产物及青稞固态发酵产物对α-淀粉酶的抑制率呈升高趋势。青稞固态发酵产物对α-淀粉酶的IC50值为2.89 mg/mL,低于未加菌的青稞固态发酵产物对α-淀粉酶的IC50值(6.73 mg/mL),但高于阿卡波糖对α-葡萄糖苷酶的IC50值(0.15 mg/mL),说明经解淀粉芽孢杆菌B-14固态发酵后的青稞对α-淀粉酶的抑制效果明显有所提高,可能是在发酵过程中产生更多的多肽和酚类物质[29],对α-淀粉酶有更好的抑制效果。
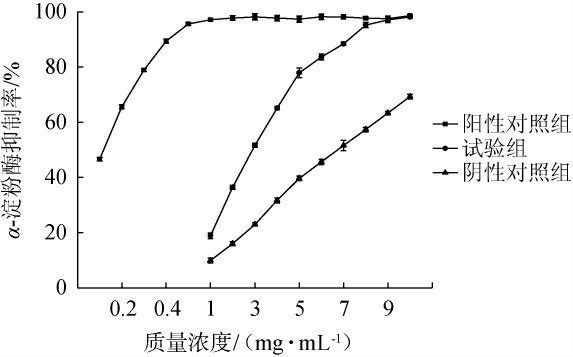
图7 不同质量浓度的阿波卡糖、青稞固态发酵产物和未加菌青稞固态发酵产物对α-淀粉酶的抑制率的影响
Fig.7 Effect of different concentrations of Apoka sugar, solid-state fermentation products of highland barley and solid-state fermentation product of highland barley without strains on the inhibition rate of α-amylase
2.3.3 青稞固态发酵产物的淀粉水解率
基于体外模拟胃肠道消化试验评估不同添加量的青稞固态发酵产物对玉米淀粉消化性的影响,结果见图8。由图8可知,随着青稞固态发酵产物添加量的增加,淀粉水解率呈下降趋势,模拟肠消化180 min后,空白对照组中玉米淀粉水解率为79.73%,其次为5%青稞固态发酵产物(64.71%)、10%青稞固态发酵产物(57.68%)、15%青稞固态发酵产物(50.68%)、20%青稞固态发酵产物(44.60%)。结果表明,在体外模拟胃肠道消化体系下,青稞固态发酵产物可以有效降低玉米淀粉的水解率,且呈现一定的量效关系。
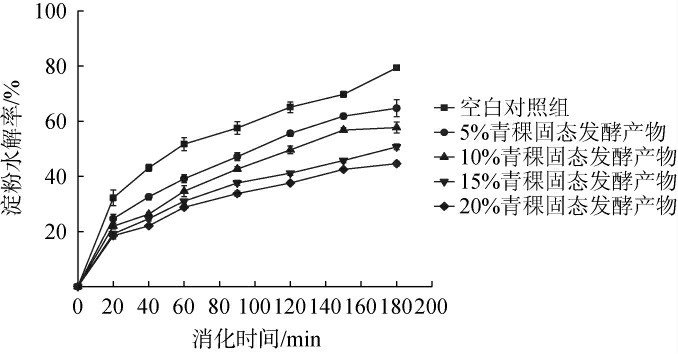
图8 不同含量的青稞固态发酵产物对淀粉水解率的影响
Fig.8 Effects of different concentrations of highland barley solidstate fermentation products on starch hydrolysis rate
本试验以一株高产DNJ的解淀粉芽孢杆菌B-14为发酵菌株,在单因素的基础上,采用响应面法优化得到其固态发酵青稞产DNJ的最优工艺为发酵时间3 d、蒸煮时间41 min,发酵温度37 ℃,接种量5.5%。 在此优化条件下,DNJ的含量为6.13 mg/g。体外降糖活性试验结果表明,青稞固态发酵产物在降低血糖方面有明显效果,其对α-葡萄糖苷酶和α-淀粉酶的IC50值分别为0.29 mg/mL和2.89 mg/mL;随着青稞固态发酵产物添加量的增加,淀粉水解率有明显的抑制作用,当添加量为20%、模拟肠消化180 min时,淀粉水解率为35.13%。本研究结果可为青稞食品的研发提供一种新的研究思路。
[1]SHARMA R,MUSYUNI P,MAJEED J,et al.Challenges and opportunities in precision therapy for diabetic patients[J].HSR,2024,12:100190-100190.
[2]ABDELMONSEF M,SHAWKY E,GHAREEB A D,et al.Comprehensive metabolomics and chemometrics unravel potential anti-diabetic metabolites of pumpkin (Cucurbita pepo L.) fruits through UPLC-QqQ-MS and GC-MS analyses[J].Food Res Int,2024,192:114771-114771.
[3]CLARK D, SUNDEEN E, JENKINS C.Diabetes self-management support through diabetes-related distress awareness[J].JNP, 2024, 20(8):105129-105129.
[4]郅丽超,张琳依,梁馨元,等.天然活性成分对α-葡萄糖苷酶抑制作用的研究进展[J].食品安全质量检测学报,2021,12(6):2276-2282.
[5]熊能,韦圣,胡忠策. α-葡萄糖苷酶抑制剂的研究进展和趋势[J].发酵科技通讯,2018,47(1):58-64.
[6]于轶群,薛陆州,倪豪,等.海洋α-葡萄糖苷酶的克隆表达及其制备高纯潘糖的研究[J].食品工业科技,2024,45(19):158-165.
[7]WANG L,AI C,JIN C,et al.Xanthones as potential α-glucosidase noncompetition inhibitors:Synthesis,inhibitory activities,and in silico studies[J].Chem Biol,2023,102(3):547-556.
[8]郅丽超,张琳依,梁馨元,等.天然活性成分对α-葡萄糖苷酶抑制作用的研究进展[J].食品安全质量检测学报,2021,12(6):2276-2282.
[9]LANG X J, ZHANG M, YU L, et al.Metabolic engineering of Bacillus amyloliquefaciens for efficient production of α-glucosidase inhibitor1-deoxynojirimycin[J].Syth Syst Biotech,2023,8(3):378-385.
[10]XIN X,JIANG X,NIU B,et al.Identification and expression of key genes related to 1-deoxynojirimycin biosynthesis in Streptomyces lavendulae[J].Electron J Biotechnol,2023,64:1-9.
[11]SUPARDI I P, SOO T, JUNYA I, et al.Supplementation of Bacillus amyloliquefaciens AS385 culture broth powder containing 1-deoxynojirimycin in a high-fat diet altered the gene expressions related to lipid metabolism and insulin signaling in mice epididymal white adipose tissue[J].Food Funct,2020,11(5):3926-3940.
[12]PARIDA S I,TAKASU S,ITO J,et al.Physiological effects and organ distribution of Bacillus amyloliquefaciens AS385 culture broth powder containing 1-deoxynojirimycin in c57bl/6j mice[J].J Nutr Sci Vitaminol,2019,65(2):157-163.
[13]SARITA, DEEPIKA, KUMARI A, et al. In-vitro cytotoxic, hypoglycaemic, and inhibitory α-amylase and α-glucosidase potential of flour of improved hull-less and hulled barley varieties[J].Plant Food Hum Nutr,2024,79(3):712.
[14]WANG Y, LIAO Y, GOU C, et al.Effect of Lentinus sajorcaju on the chemical composition and antioxidant activity of highland barley straw under solid-state fermentation[J].Front Microbiol,2024,15:1365254-1365254.
[15]MA S,DONG J,LI J,et al.Effect of solid-state fermentation on the nutritional composition and physicochemical properties of whole-grain highland barley and the application in digestive cookies[J].FBIO,2024,59:104088.
[16]ZHOU X,WANG J,SHAO G,et al.Bidirectional solid-state fermentation of highland barley by edible fungi to improve its functional components,antioxidant activity and texture characteristics[J].Plant Food Hum Nutr,2024,79(2):308-315.
[17]ZHANG D,TAN B,ZHANG Y,et al.Improved nutritional and antioxidant properties of hulless barley following solid state fermentation with Saccharomyces cerevisiae and Lactobacillus plantarum[J].J Food Process Preserv,2021,46(2):16245.
[18]HU G,CAI X,CAO H,et al.Correlation between the DNJ content and genetic diversity of SSR markers of 36 mulberry(Morus spp.)germplasm resources[J].Gene Resource Evol,2022,70(3):1039-1047.
[19]YING Q, JURI N, TAKEAKI I, et al.Kinetic analysis of inhibition of α-glucosidase by leaf powder from Morus australis and its component iminosugars[J].Biosci Biotechn Biochem,2020,84(10):1-8.
[20]张娜英,杨广宇.α-淀粉酶检测方法及其应用[J].生物工程学报,2023,39(3):898-911.
[21]ZHANG Q,LI H,CHIOU S B,et al.Adding gamma-aminobutyric acid to modulate the in vitro digestive characteristics of tapioca pearls[J].FBIO,2024,58:103783.
[22]党斌.纳豆菌固态发酵青稞产纳豆激酶工艺优化研究[J].青海农林科技,2023(3):15-21.
[23]LU Y,CHENG X,DENG H,et al.Improvement of 1-deoxynojirimycin production of Bacillus amyloliquefaciens by gene overexpression and medium optimization[J].LWT-Food Sci Technol,2021,149:111812.
[24]邱卫华,刘瑾如.微生物发酵在天然α-葡萄糖苷酶抑制剂研究中的应用进展[J].化学与生物工程,2024,41(12):15-23.
[25]张伟建,李茂,赵佳伟,等.青稞酿造酒的研究进展[J].酿酒科技,2023(7):91-94.
[26]GAO T,ZHANG M,FANG Z,et al.Optimization of microwave-assisted extraction of flavonoids from young barley leaves[J].Int Agrophys,2017,31(1):45-52.
[27]ZHU J,LI J,WU H,et al.Processing of whole kernel tapioca pearl and milk tea boba of fresh highland barley: Optimization of processing parameters and quality evaluation[J].Foods,2024,13(6):927.
[28]彭茜,曹根凤,陈婷,等.杨梅素对α-淀粉酶的抑制机制研究[J].中国食品添加剂,2024,35(11):121-128.
[29]张群. α-淀粉酶制备关键技术研究[J].食品与生物技术学报,2023,42(1):112.