混菌麸曲制备工艺优化及其在清香型白酒酿造中的应用
黄治国1,2,刘钏宇1,李彦中3,卫春会1,2,任志强1,2,邓 杰1,2*
(1.四川轻化工大学 生物工程学院 酿酒生物技术及应用四川省重点试验室,四川 宜宾 644000;2.中国轻工业酿酒生物技术及智能制造重点试验室,四川 宜宾 644000;3.四川江口醇隆鼎酒业有限公司,四川 巴中 636400)
摘 要:为了节约单菌麸曲培养时间和原料,简化麸曲制备工艺,提升麸曲的生产效率,以扣囊复膜酵母(Saccharomycopsis fibuligera)与根霉(Rhizopus)进行混菌麸曲制备,以糖化力和酵母活细胞数为评价指标,通过单因素及正交试验优化其制备工艺条件,并将混菌麸曲应用于清香型白酒酿造中,采用常规检测方法及顶空固相微萃取气相色谱质谱联用(HS-SPME-GC-MS)法探讨清香型白酒发酵过程的理化指标和挥发性风味物质变化,考察混菌麸曲添加对清香型白酒风味的影响。结果表明,最优混菌麸曲制备工艺条件为:培养温度30 ℃、水分含量45%、培养时间36 h。 在此优化条件下,糖化力为582 U/g、酵母活细胞数为8.42×108 CFU/g。 将混菌麸曲应用于清香型白酒的酿造中,以市售麸曲作为对照组,混菌麸曲显著提高了酒醅酸度(P<0.05),并且提高了乙酸乙酯、乳酸乙酯含量,分别为1 798.43 mg/L、666.91 mg/L。 结果显示,混菌麸曲应用于清香型白酒酿造中可以提高主要风味物质含量,简化了制曲工艺,为清香型白酒酒曲生产提供了新思路。
关键词:根霉;扣囊复膜酵母;混菌麸曲;制备工艺优化;麸曲白酒
中图分类号:TS262.3
文章编号:0254-5071(2025)05-0195-08
doi: 10.11882/j.issn.0254-5071.2025.05.029
引文格式:黄治国,刘钏宇,李彦中,等.混菌麸曲制备工艺优化及其在清香型白酒酿造中的应用[J].中国酿造,2025,44(5):195-202.
收稿日期:2024-12-03
修回日期:2025-03-19
基金项目:四川省中央引导地方科技发展专项项目(2024ZYD0252);四川省科技创新创业苗子工程项目(2023JDRC0116);四川轻化工大学泸州老窖研究生创新基金(LJCX2022-1);四川轻化工大学研究生创新基金项目(Y2023237)
作者简介:黄治国(1978-),男,教授,博士,研究方向为酿酒生物技术及应用。
*通讯作者:邓 杰(1988-),男,实验师,博士,研究方向为酿酒生物技术及应用。
Optimization of preparation process of mixed-strain Fuqu and its application in light-flavor Baijiu production
HUANG Zhiguo1,2,LIU Chuanyu1,LI Yanzhong3,WEI Chunhui1,2,REN Zhiqiang1,2,DENG Jie1,2*
(1.Liquor Making Biotechnology and Application of Key Laboratory of Sichuan Province,College of Biological Engineering,Sichuan University of Science&Engineering,Yibin 644000,China;2.Liquor Brewing Biotechnology and Intelligent Manufacturing Key Laboratory of China Light Industry,Yibin 644000,China;3.Sichuan Jiangkou Alcohol Longding Wine Industry Co.Ltd.,Bazhong 636400,China)
Abstract:In order to save the culture time and raw materials of single strain Fuqu,simplify the preparation process of Fuqu,and improve the production efficiency of Fuqu, a mixed-strain Fuqu was prepared using Saccharomycopsis fibuligera and Rhizopus spp.With saccharification power and viable yeast cell counts as evaluation indexes, the preparation process conditions were optimized through single-factor and orthogonal experiments.The mixed-strain Fuqu was applied to the brewing of light-flavor(Qingxiangxing)Baijiu.The physicochemical indexes and changes of volatile flavor substances during the fermentation process of light-flavor Baijiu were studied by conventional detection methods and headspace solid-phase microextraction gas chromatography-mass spectrometry(HS-SPME-GC-MS)method,and the effect of mixed-strain Fuqu addition on the flavor of light-flavor Baijiu was investigated.The results showed that the optimal preparation process conditions for the mixed-strain Fuqu were as follows: culture temperature 30 ℃, moisture 45%, and cultivation time 36 h.Under these optimal conditions, the saccharification power was 582 U/g, and the viable yeast cell counts were 8.42×108 CFU/g.The mixed-strain Fuqu was applied to light-flavor Baijiu brewing, using commercial Fuqu as the control group, the mixed-strain Fuqu significantly increased the acidity of the fermented grains(P<0.05)and enhanced the contents of ethyl acetate and ethyl lactate,which were 1 798.43 mg/L and 666.91 mg/L,respectively.The results showed that the application of mixed-strain Fuqu in the light-flavor Baijiu brewing could increase the contents of main flavor substances and simplify the Fuqu-making process,providing a new idea for light-flavor Baijiu Jiuqu production.
Key words:Rhizopus;Saccharomycopsis fibuligera;mixed-strain Fuqu;preparation process optimization;Fuqu Baijiu
白酒是中国特色酒类饮品,根据使用的糖化发酵剂不同可以分为大曲白酒、小曲白酒和麸曲白酒三个种类[1]。麸曲白酒具有发酵时间短、出酒率高、酒体清冽等特点,在中国酿酒史上占据特殊地位[2]。但由于麸曲清香型白酒与其他清香型白酒相比香味物质组分少、含量低、高级醇高,风味寡淡,所以如何改善麸曲白酒风味成为当下研究的重点[3]。在酒类发酵中通过添加功能菌和组合发酵的方式可以提升酒类风味,改善酒体质量,郭锦宁等[4]研究表明,通过添加米根霉(Rhizopus oryzae)麸曲可以提高豉香型白酒乳酸乙酯含量;赵港国等[5]研究发现,添加高产乙酸乙酯库德毕赤酵母(Pichia kudriavzevii)强化发酵清香型白酒,有效提高了乙酸乙酯含量;何洋等[6]采用优质酿酒酵母(Saccharomyces cerevisiae)LF05、胶红酵母(Rhizopus mucilaginosa)PL10协同米根霉发酵可改善商业甜米酒滋味及酒味寡淡问题,为云南甜米酒的制备提供了参考和理论基础。 根霉(Rhizopus)是一种常被应用于糖化剂生产中的菌种,具有高产糖化酶的特性[7],并且具有一定的产酯能力[8]。 根霉在实际生产中展现出与酵母具有良好的共生作用[9]。扣囊复膜酵母(Saccharomycopsis fibuligera)的固态发酵物具有浓烈果香,并且在清香型白酒发酵应用上证明可以有效提高乙酸乙酯含量,改善酒体风味[10-11]。扣囊复膜酵母本身作为强化发酵剂时配曲生产可以起到降低高级醇的作用[12]。 扣囊酵母与米根霉、酿酒酵母混合发酵时可以降低高级醇含量[13],但现在对于根霉与产香酵母混合培养制备麸曲的研究较少,利用扣囊复膜酵母降醇产酯的特性与根霉制备麸曲应用到白酒生产中改善风味的效果还需要进一步的探索。
本研究以扣囊复膜酵母和根霉制备混菌麸曲,以糖化力和酵母活细胞数为评价指标,通过单因素试验与正交试验优化混菌麸曲的制备工艺条件。再将制备的混菌麸曲应用于清香型白酒酿造中,并与市面上的麸曲进行对比,采用常规检测方法及顶空固相微萃取-气相色谱-质谱联用(headspace solid phase microextraction-gas chromatographymass spectrometry,HS-SPME-GC-MS)法探讨清香型白酒发酵过程的理化指标和挥发性风味物质变化,考察混菌麸曲对清香型白酒风味的影响。旨在得到一种通过根霉与扣囊复膜酵母混合培养方式生产的高酵母量混菌麸曲,可以应用于麸曲清香型白酒生产之中并达到提升酒体风味的效果。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及原料
米根霉(Rhizopus oryzae)(G1)、台湾根霉(Rhizopus taiwanensis)(G2)、黑根霉(Rhizopus nigricans)(G3)、扣囊复膜酵母(Saccharomycopsis fibuligera):从大曲中分离并保存于酿酒生物技术及应用四川省重点实验室。 麸皮、粳高粱、麸曲:市售。
1.1.2 试剂
无水葡萄糖(分析纯)、琼脂粉、蛋白胨、酵母浸粉(均为生化试剂):成都市科隆化学品有限公司;乙酸、乙酸乙酯、甲醇(均为色谱纯):天津市光复科技发展有限公司。
1.1.3 培养基
麦芽汁液体培养基:酵母浸粉3 g,葡萄糖10 g,蛋白胨4 g,麦芽浸粉10 g,蒸馏水1 000 mL,加水溶解后121℃条件下灭菌20 min。
麦芽汁固体培养基:麦芽汁液体培养基中添加20 g/L琼脂。121 ℃条件下灭菌20 min。
1.2 仪器与设备
LRH-250恒温培养箱:上海齐欣科学仪器有限公司;GI54DS 立式自动压力蒸汽压灭菌锅:致微(厦门)仪器有限公司;CP214 电子天平:奥豪斯仪器有限公司;Agilent 8890型气相色谱仪、Agilent 7890B-7000D气相色谱-质谱联用(GC-MS)仪:美国安捷伦公司。
1.3 方法
1.3.1 扣囊复膜酵母种子液的制备
自保存于斜面培养基挑取1环扣囊复膜酵母进行活化培养,即接种于装有10 mL麦芽汁液体培养基的试管中,30 ℃、120 r/min条件下振荡培养24 h,活化培养完成后以接种量10%(V/V)接种于装液量为100 mL/500 mL的麦芽汁液体培养基中,30 ℃、120 r/min条件下振荡培养24 h,即得扣囊复膜酵母种子液,备用[14]。
1.3.2 根霉种曲及麸曲制备
将保存于斜面培养基的根霉挑取于麦芽汁固体培养基上以30 ℃活化培养48 h。 将麸皮以45%水分拌合过后,装入装料量为30 g干麸皮/500 mL三角瓶中,120 ℃灭菌20 min,待冷却后将麦芽汁固体培养基活化后平板上的根霉菌挑取一环接种于其中,30 ℃恒温培养2~3 d,在24 h时轻敲底部使其整体与底面保持空隙,并倒置培养,待产出孢子后,以37 ℃低温烘干,粉碎后过40目筛网,即得根霉种曲。
将根霉种曲接种于120 ℃灭菌后的45%水分的装料量100 g干麸皮/盘的浅盘上培养,30 ℃培养36 h,即得根霉麸曲[15]。
1.3.3 根霉与扣囊复膜酵母混菌麸曲的制备
于浅盘中放置100 g麸皮,调整含水量为50%。121 ℃下灭菌30 min。 在无菌工作台中,将扣囊复膜酵母种子液以6%接种量(以绝干麸皮质量计)接种,同时将台湾根霉(G2)以种曲0.5%接种量(以绝干麸皮质量计)接种于浅盘上。用玻璃棒充分均匀搅拌混合,于30 ℃恒温培养箱中培养32 h,培养完成之后风干粉碎,即得混菌麸曲。
1.3.4 混菌麸曲制备工艺优化
(1)单因素试验
分别考察培养温度(28 ℃、30 ℃、32 ℃、34 ℃、36 ℃)[16-18]、水分含量(35%、40%、45%、50%、55%)[19-21]、培养时间(12 h、24 h、36 h、48 h、60 h)[22-23]对发酵体系酵母活细胞数与糖化力的影响,每组处理进行3次平行试验。
(2)正交试验
在单因素试验结果基础上,以培养温度(A)、水分含量(B)、培养时间(C)为影响因素,以酵母活细胞数为考察指标,按照正交试验L9(33)设计进行3因素3水平正交试验。
1.3.5 分析检测
糖化力测定:采用赵恒山[24]方法;酵母活细胞数的测定:采用稀释涂布平板法[25];水分、酸度、淀粉、还原糖测定:参照《酿酒分析与检测》[26];原料出酒率、淀粉出酒率的计算参考文献[27]。
挥发性风味物质测定:采用HS-SPME-GC-MS法[28]。
样品预处理:取8 mL酒样装入顶空瓶,加入NaCl至溶液饱和,再加入30 μL混合内标物(混合内标乙酸正戊酯25.628 mg/mL、2-辛醇27.361mg/mL、2-乙基丁酸17.366mg/mL);在50 ℃条件下平衡20 min,插入50/30 DVB/CAR/PDMS 萃取头,吸附30 min;吸附完成后,迅速插入GC-MS进样口,解吸5 min。
气相色谱条件[29]:DB-Wax 毛细管色谱柱(60 m×0.25 mm,0.25 μm)。初始温度50 ℃保持3 min,以3 ℃/min升温至120 ℃保持10 min,再以10 ℃/min升温至220 ℃保持5 min,230 ℃后运行5 min。
质谱条件[29]:电子电离(electronic ionization,EI)源,电子能量70 eV,离子源温度230 ℃,双四级杆温度均为150 ℃,全扫描(SCAN)模式,扫描范围35~350 amu。
定性定量方法:检测挥发性香气物质质谱图与美国国家标准技术研究所(National Institute of Standards and Technology,NIST)17.L标准质谱图进行对比匹配,正反相似度>75%为初步定性依据。根据内标法定量。
1.3.6 混菌麸曲在清香型白酿造中的应用
采用清香型白酒工艺进行酿酒试验[30],以粳高粱为原料,采用温度为70~75 ℃的热水没过原料,浸泡24 h。采用蒸汽初蒸20~30 min,闷粮20~30 min,根据开花率视情况进行复蒸10~15 min,蒸后高粱开花率50%以上,水分含量为50%~52%。糠壳采用清蒸方式,开盖蒸1 h后无霉味,备用。 后将高粱摊凉至40 ℃左右并添加高粱质量5%的糠壳,拌匀后加曲再次翻拌均匀。敞开并盖纱布在室温糖化24 h。以麸曲4%添加量,将最佳制备工艺条件下制备的混菌麸曲加入酒醅中,进行发酵试验,以市售麸曲作为对照,取糖化后(TH)、发酵结束时(7 d)的酒醅进行检测。进而探讨清香型白酒发酵过程的理化指标和挥发性风味物质变化,考察混菌麸曲添加对清香型白酒风味的影响。
1.3.7 数据处理及图像处理方法
试验数据均用“平均数±标准差”表示,采用Origin 2022、Excel 2019作图,SPSS 22.0软件进行方差分析和多重比较,采用Duncans新复极差法多重比较进行差异性显著分析,以P<0.05表示差异显著。
2 结果与分析
2.1 扣囊复膜酵母与根霉的制曲性能测定
扣囊复膜酵母种子液与麸曲中酵母数分别为2.89×109 CFU/mL、6.78×108CFU/g,其酵母活细胞数均>107 CFU/mL(g),可以应用于麸曲培养。
选取实验室保存的米根霉(G1)、台湾根霉(G2)、黑根霉(G3)3株根霉制成种曲,并测得其制备的根霉麸曲糖化力,结果见表1。由表1可知,菌株G2制备根霉麸曲糖化力[(842±21.2)U/g]>菌株G3制备根霉麸曲糖化力[(682±20.3)U/g]>菌株G1制备根霉麸曲糖化力[(588±20.8)U/g],其中菌株G2制备麸曲糖化力显著大于其余两株根霉(P<0.05)。 故选择菌株G2作为制备混菌麸曲试验的菌种。
表1 扣囊复膜酵母种子液、麸曲中酵母数及根霉麸曲糖化力差异
Table 1 Differences in yeast counts in seed liquid of Saccharomycopsis fibuligera and Fuqu, and saccharification power of Rhizopus Fuqu

注:不同小写字母表示根霉麸曲糖化力差异显著(P<0.05)。 下同。
菌株编号 糖化力/(U·g-1) 酵母数G1 G2 G3扣囊复膜酵母菌液扣囊复膜酵母麸曲588±20.8c 842±21.2a 682±20.3b-- -2.89×109 CFU/mL 6.78×108 CFU/g--
2.2 混菌麸曲培养条件单因素试验结果
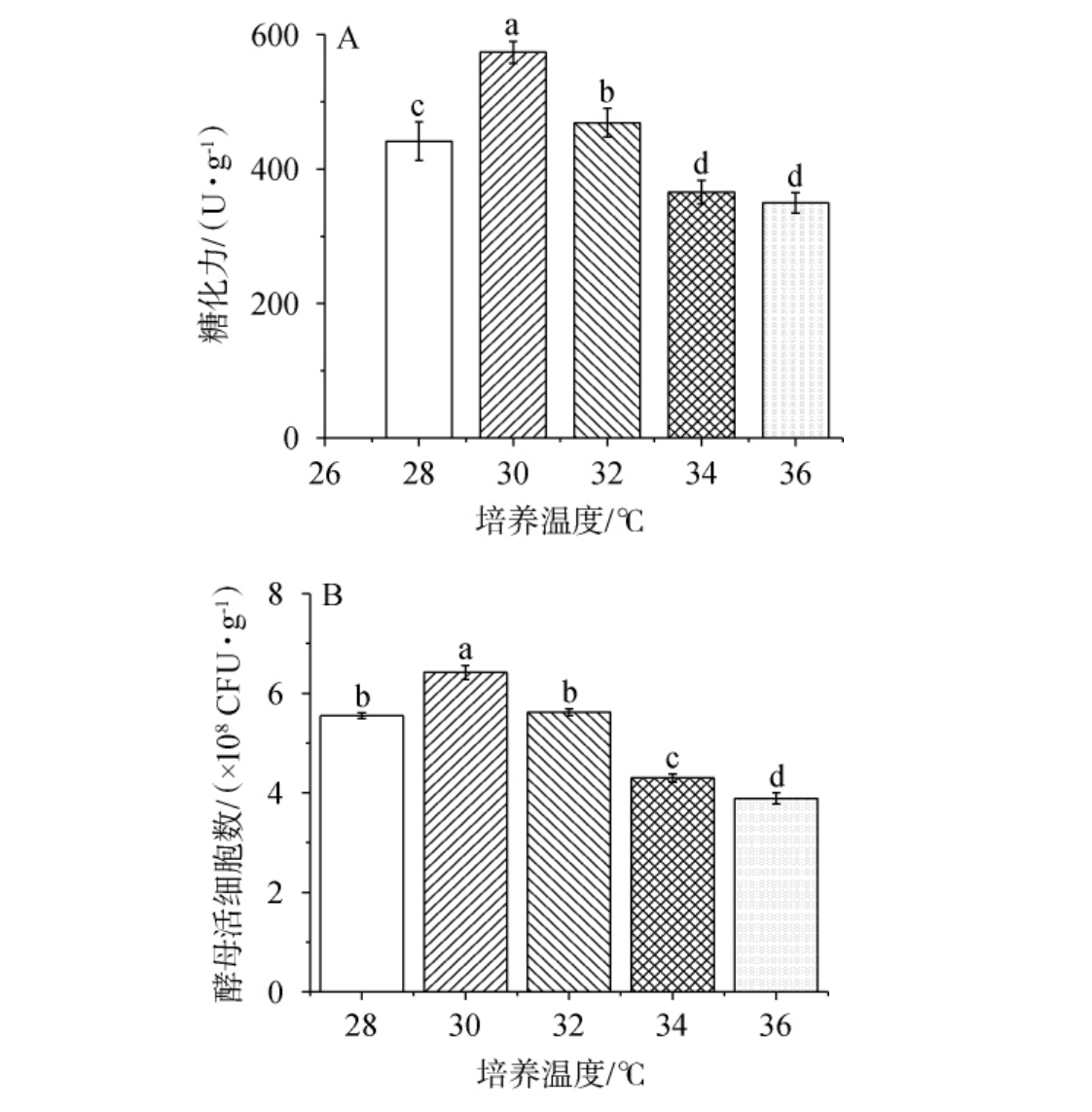
2.2.1 培养温度对混菌麸曲糖化力与酵母活细胞数的影响
不同培养温度对混菌麸曲糖化力和酵母活细胞数的影响结果见图1。
由图1可知,随着培养温度在28~36 ℃范围内的上升,混菌麸曲糖化力和酵母活细胞数均呈现先增加后减少的变化趋势。当培养温度为28~30 ℃时,混菌麸曲糖化力和酵母活细胞数均随培养温度的升高而增加;当培养温度为30 ℃时,混菌麸曲糖化力和酵母活细胞数最高,分别为(574±16.37)U/g、(6.42±0.14)×108CFU/g,显著高于其他培养温度时的糖化力和酵母活细胞数(P<0.05);当培养温度>30 ℃之后,混菌麸曲糖化力和酵母活细胞数均有所下降。因此,选择最适培养温度为30 ℃。
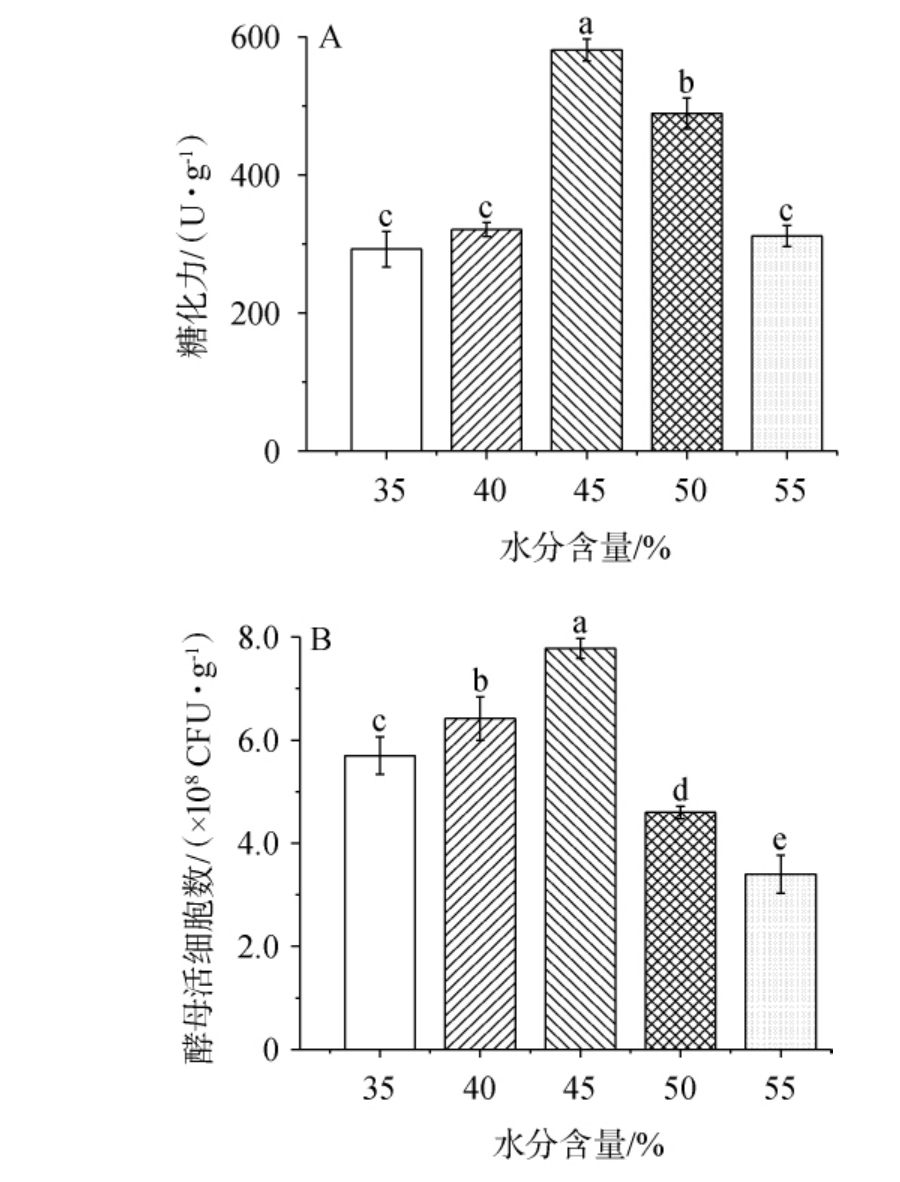
2.2.2 水分含量对混菌麸曲糖化力与酵母活细胞数的影响不同水分含量对混菌麸曲糖化力和酵母数的影响结果见图2。由图2可知,随着水分含量在35%~55%范围内上升,混菌麸曲糖化力与酵母活细胞数均呈现先增加后减少的变化趋势。当水分含量为35%~45%时,混菌麸曲糖化力和酵母活细胞数均随温度的升高而增加;当水分含量为45%时,混菌麸曲糖化力和酵母活细胞数最高,分别为(581±15.85)U/g、(7.78±0.19)×108 CFU/g,显著高于其他水分含量时的糖化力和酵母活细胞数(P<0.05);当水分含量>45%之后,混菌麸曲糖化力和酵母活细胞数均有所下降。 因此,选择最适水分含量为45%。
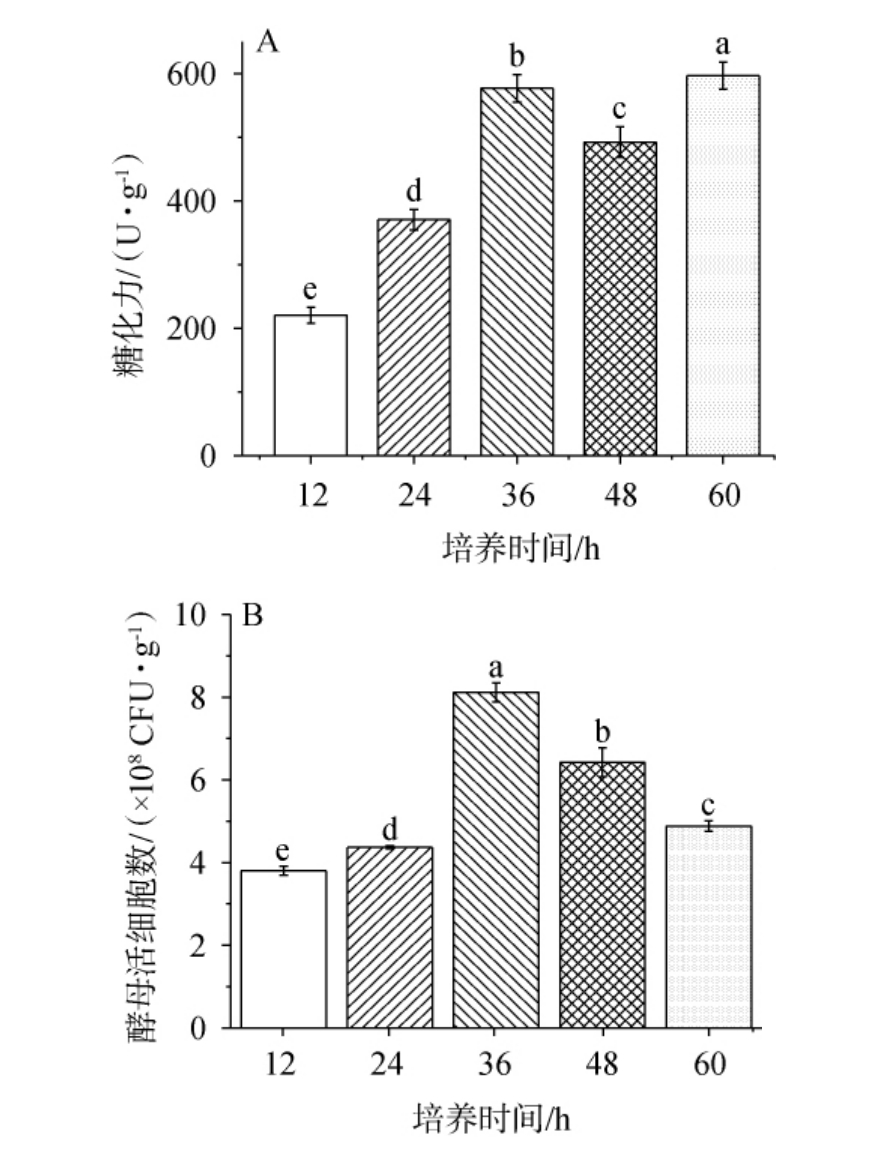
2.2.3 培养时间对混菌麸曲糖化力与酵母数的影响
不同培养时间对混菌麸曲糖化力和酵母数的影响结果见图3。由图3可知,随着培养时间在12~60 h范围内的增加,混菌麸曲糖化力呈现先增加后减少再上升的趋势。当培养时间为12~36 h时,混菌麸曲糖化力和酵母活细胞数均随培养时间的升高而增加;当培养时间为36 h时,混菌麸曲糖化力为(596±23.3) U/g,酵母活细胞数最高,为(8.12±0.23)×108 CFU/g;当培养时间>36 h之后,混菌麸曲酵母活菌数有所下降,糖化力有所上升。
由于根霉生长后期会产生黑色孢子,虽然糖化力会继续上升,但影响后续麸曲产酒质量[31]。 因此应当控制生长时间,使其在产孢子之前达到酶活力最高,并且混菌麸曲中的根霉在48 h时已经开始产黑色孢子,60 h时黑色孢子达到最大数量。因此,选择最适培养时间为36 h。
2.3 混菌麸曲制备工艺优化正交试验
本试验通过在2.2比较不同培养条件对糖化力影响,各个单因素最佳水平条件下的糖化力水平均超过500 U/g,达到了麸曲应用标准。说明混菌麸曲培养条件的正交试验优化对糖化力影响不明显,故不选择糖化力作为正交试验的检测指标,而选择酵母数作为混菌麸曲培养条件优化的检测指标。
在单因素试验结果基础上,选择培养温度(A)、水分含量(B)、培养时间(C)为影响因素,以酵母活细胞数为评价指标,进行3因素3水平的正交试验。正交试验结果及分析见表2。 由表2可知,由极差R值分析可得,各因素对酵母活细胞数影响顺序为培养时间(C)>培养温度(A)>水分含量(B)。混菌麸曲最佳培养条件组合为A2B2C2,即培养温度30 ℃,水分含量45%,培养时间36 h。在此优化条件下,混菌麸曲的糖化力为582 U/g,酵母活细胞数为8.42×108 CFU/g。
表2 混菌麸曲制备工艺优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for preparation process optimization of mixed strain Fuqu
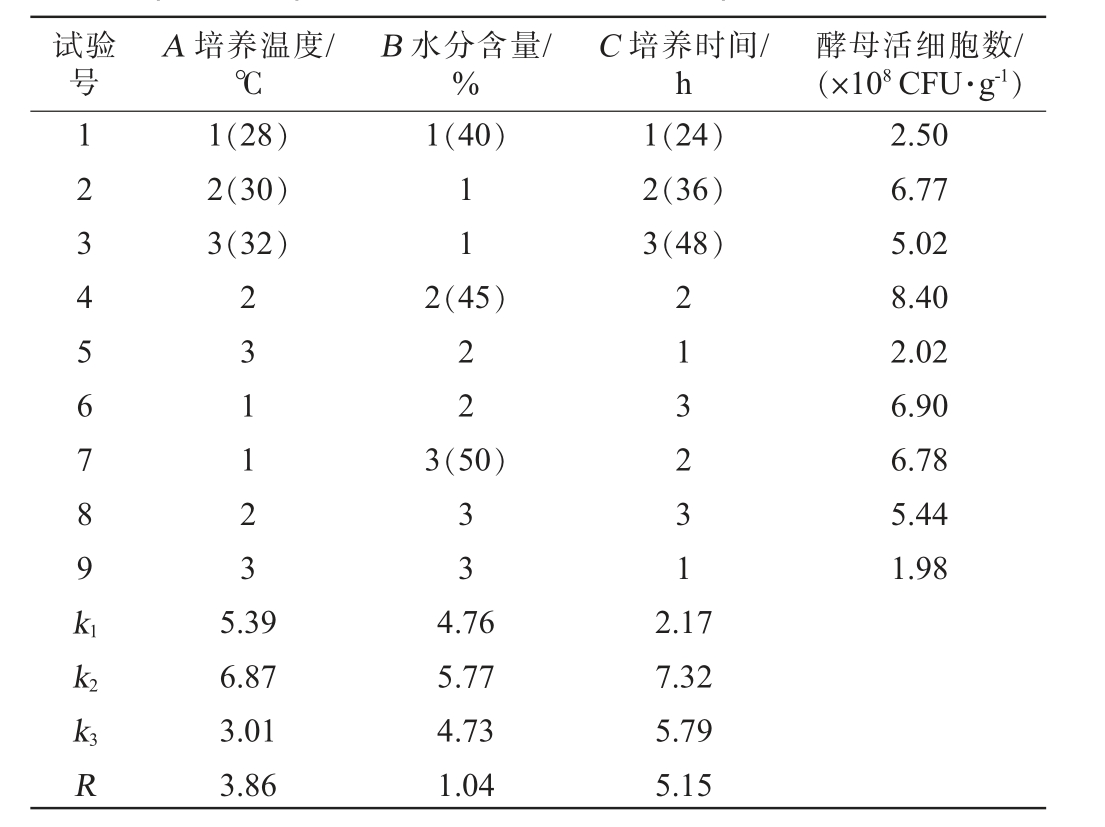
试验号A 培养温度/℃B 水分含量/%C 培养时间/h酵母活细胞数/(×108 CFU·g-1)123456789k1 1(28)2(30)3(32)1(40)11 1(24)2(36)3(48)231123 2(45)22 3(50)33 213231 2.50 6.77 5.02 8.40 2.02 6.90 6.78 5.44 1.98 k2 k3R 5.39 6.87 3.01 3.86 4.76 5.77 4.73 1.04 2.17 7.32 5.79 5.15
2.4 混菌麸曲酿酒试验的理化指标、挥发性风味物质检测及差异风味物质分析
2.4.1 理化指标分析
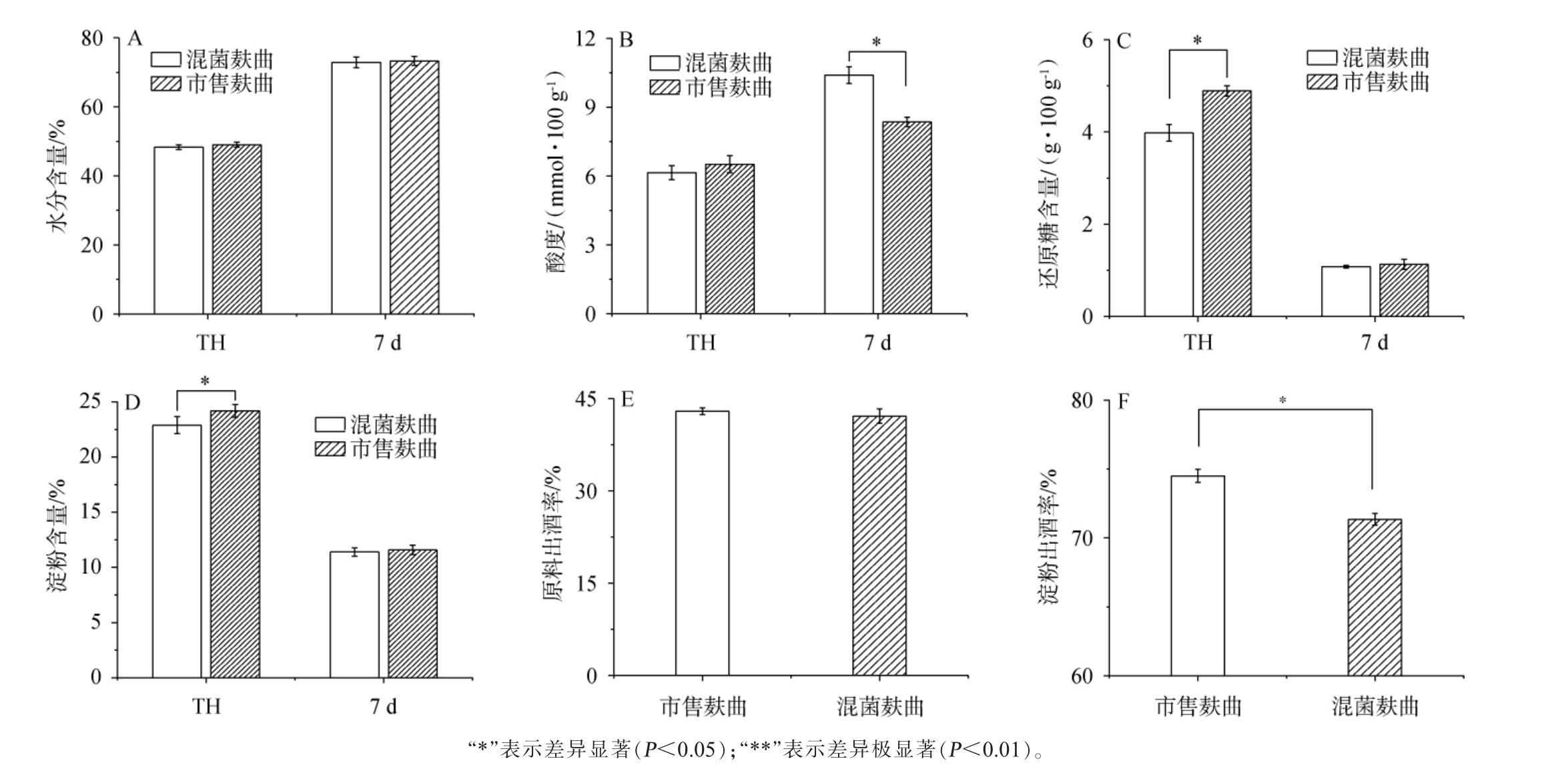
混菌麸曲组和市售麸曲组在糖化后(TH)和发酵结束(7 d)时酒醅理化指标检测结果见图4。 由图4A可知,两种麸曲在发酵前后的酒醅水分含量并无显著差异(P>0.05)。由图4B可知,混菌麸曲组由于引入了扣囊复膜酵母,从而增强了发酵过程中微生物产酸能力,混菌麸曲组在发酵结束时的酸度达到了(10.4±0.37)mmol/100 g,显著高于市售麸曲组发酵结束时的酸度(P<0.05)。由图4C可知,市售麸曲由于前期糖化力高于混菌麸曲,还原糖含量在糖化结束时显著高于混菌麸曲的还原糖含量,但发酵结束后两者还原糖差异不显著(P>0.05)。由图4D可知,两种麸曲的淀粉含量在糖化后混菌麸曲的含量显著低于市售麸曲(P<0.05),但发酵结束后两种麸曲的淀粉含量却无显著差异(P>0.05)。这可能是在前期培菌时,混菌麸曲引入了扣囊复膜酵母,从而消耗了更多被糖化后的淀粉,从而还原糖与淀粉含量均低于了市售麸曲。 由图4E可知,混菌麸曲与市售麸曲的原料出酒率差异不显著(P>0.05),均达到了40%以上。 由图4F可知,市售麸曲的淀粉出酒率显著高于混菌麸曲(P<0.05),由于两者原料出酒率相近,这可能是混菌麸曲中引入了扣囊复膜酵母这一产香酵母,导致淀粉被转化为了其他香味化合物,因此使得淀粉出酒率低于市售麸曲。
2.4.2 混菌麸曲酿酒试验的风味分析
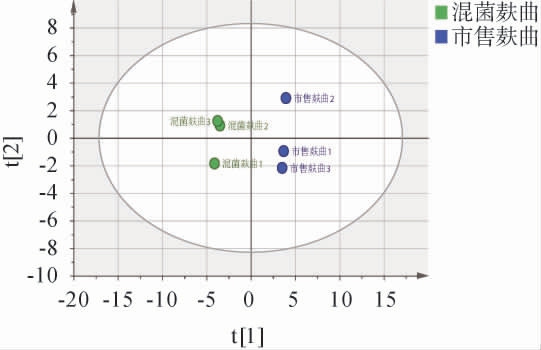
本试验将混菌麸曲应用于麸曲清香型白酒发酵,以市售麸曲作为对照,将发酵完成的酒样进行挥发性风味物质检测,并对结果进行主成分分析(principal component analysis,PCA),结果见图5。由图5可知,混菌麸曲组的白酒样品分布在第一、四象限,市售麸曲组的白酒样品分布在第二、三象限,这说明对照组与试验组的风味物质数量和种类较为一致,但在含量方面存在明显的差异。结果表明,基于挥发性风味物质PCA可以有效区分不同麸曲酿造的清香型白酒。
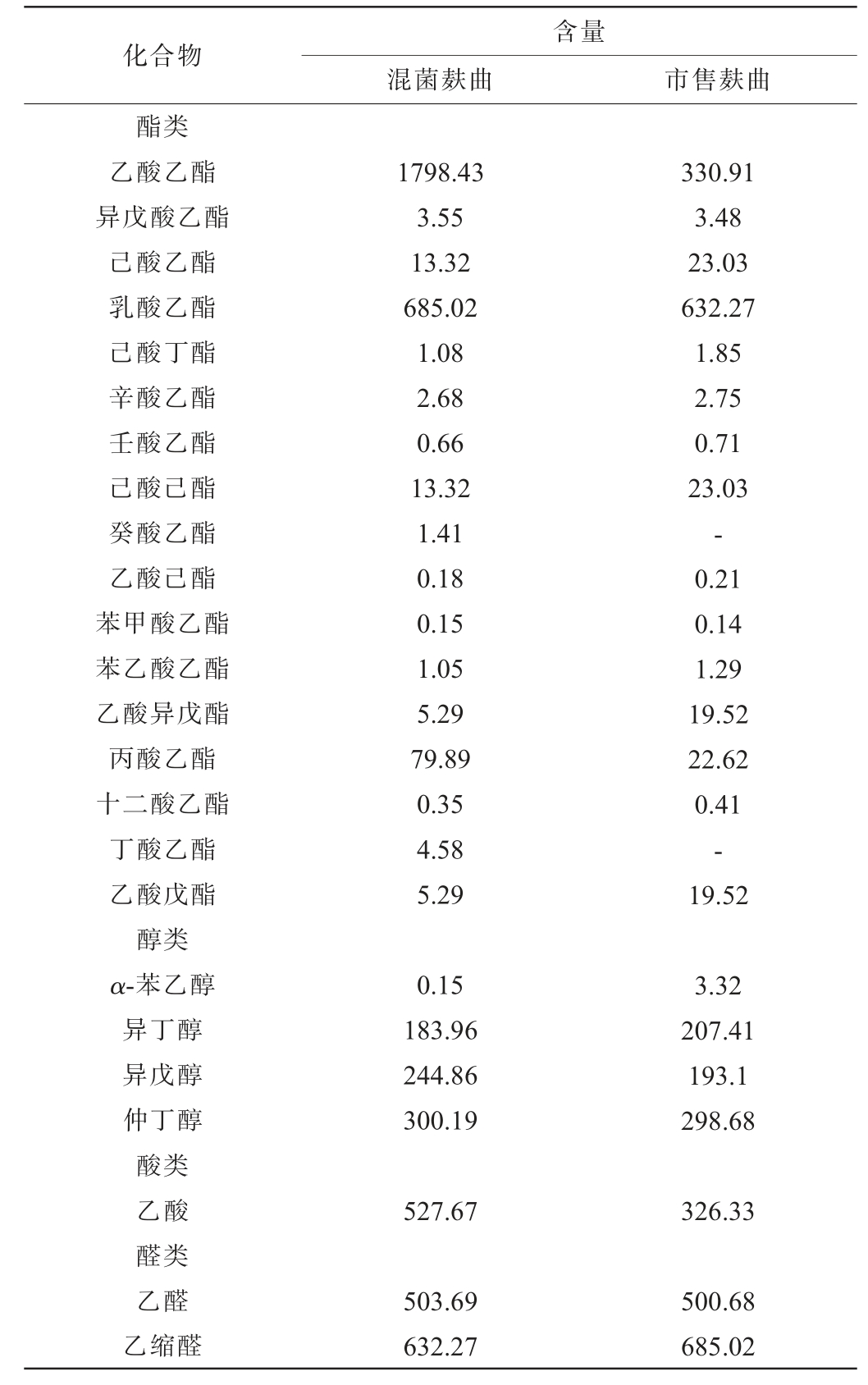
由表3可知,混菌麸曲酿造的白酒中共检测出24种挥发性风味物质,其中17种酯类、4种醇类、1种酸类、2种醛类,市售麸曲中共检测出22种挥发性风味物质,其中有15种酯类、4种醇类、1种酸类、2种醛类。 结果表明,混菌麸曲在清香型白酒酿造中应用增加了清香型白酒酯类物质。
表3 混菌麸曲和市售麸曲酿造清香型白酒中挥发性风味物质测定结果
Table 3 Determination results of volatile flavor components in light-flavor Baijiu brewed with mixed-strain Fuqu and commercial Fuqu mg/L
注:“-”表示未检出。
化合物含量混菌麸曲 市售麸曲酯类乙酸乙酯异戊酸乙酯己酸乙酯乳酸乙酯己酸丁酯辛酸乙酯壬酸乙酯己酸己酯癸酸乙酯乙酸己酯苯甲酸乙酯苯乙酸乙酯乙酸异戊酯丙酸乙酯十二酸乙酯丁酸乙酯乙酸戊酯醇类α-苯乙醇异丁醇异戊醇仲丁醇酸类乙酸醛类乙醛乙缩醛1798.43 3.55 13.32 685.02 1.08 2.68 0.66 13.32 1.41 0.18 0.15 1.05 5.29 79.89 0.35 4.58 5.29 330.91 3.48 23.03 632.27 1.85 2.75 0.71 23.03-0.21 0.14 1.29 19.52 22.62 0.41-19.52 0.15 183.96 244.86 300.19 3.32 207.41 193.1 298.68 527.67 326.33 503.69 632.27 500.68 685.02
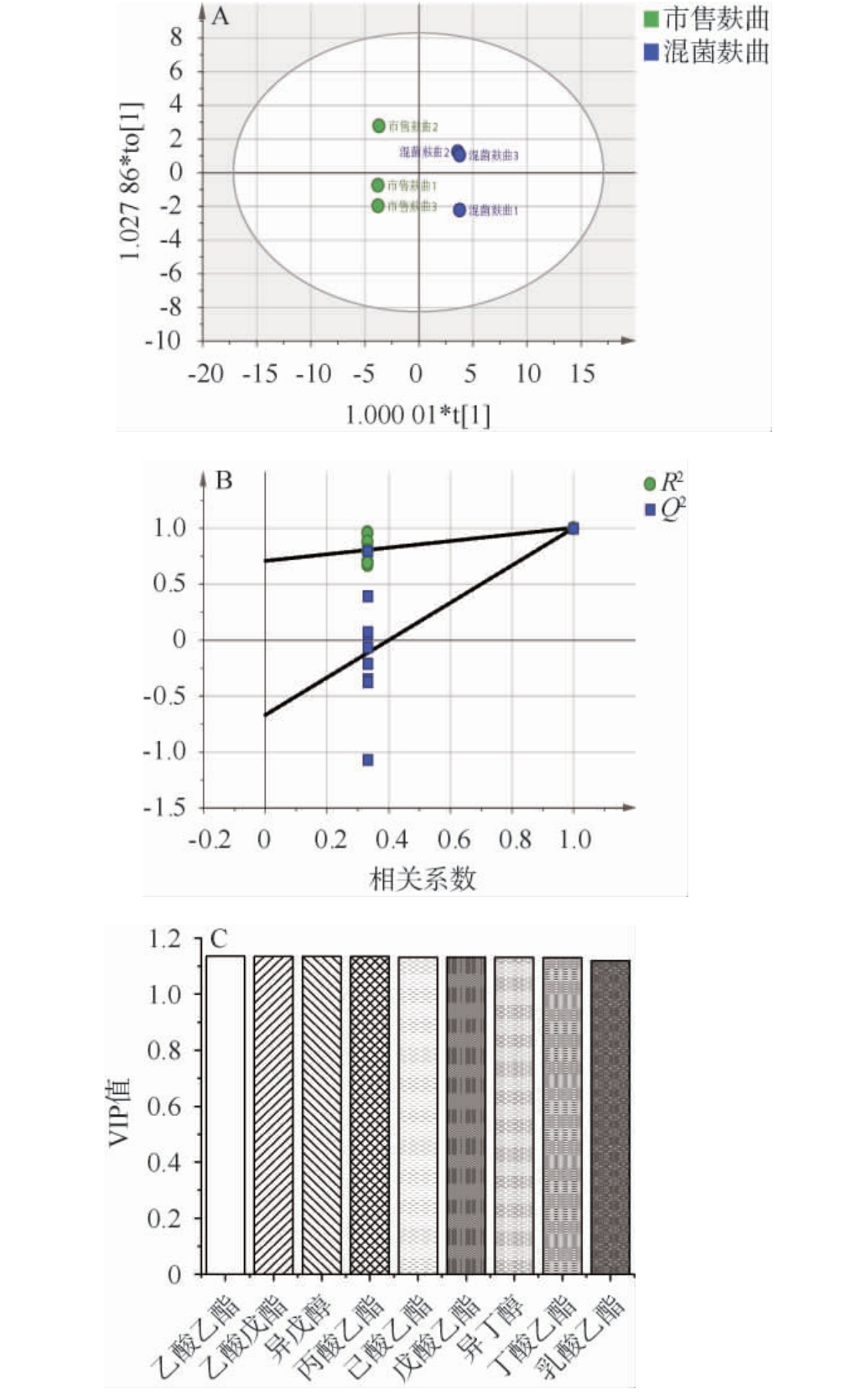
为进一步探讨混菌麸曲和市售麸曲发酵后的挥发性风味物质差异,基于挥发性风味物质进行正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)、模型置换检验及筛选关键差异风味物质,结果见图6。
由图6A可知,变量解释能力R2为0.867,预测能力Q2为0.997,均>0.5,混菌麸曲组白酒样品与市售麸曲组白酒样品沿纵坐标有明显区分,混菌麸曲组白酒样品分布在置信区间右侧,市售麸曲组白酒样品分布在置信区间左侧,说明混菌麸曲组与市售组小曲清香型白酒之间挥发性风味物质存在明显的差异,二者可以通过OPLS-DA进行有效区分。为验证该模型是否过度拟合数据,进行置换检验(n=200)。由图6B可知,置换检验R2截距为0.721,Q2截距为-0.597,且图中左侧的点均低于右侧的点,表明此模型对数据没有出现过拟合现象,并且模型预测能力良好。
通过变量重要性投影(variable importance in project,VIP)值来衡量试验组与对照组之间风味化合物的累计差异对两组样本分类判别的解释能力和影响强度,依据VIP值>1为标准筛选关键差异风味物质。由图6C可知,共筛选出9种关键差异风味物质(VIP值>1)。相关研究证明乙酸乙酯、乳酸乙酯和高级醇是麸曲清香型白酒的主要差异风味物质,通过分析差异性物质得到,混菌麸曲酒样的乙酸乙酯含量相较于市售麸曲酒样有极显著增加(P<0.01),提升了约5倍;混菌麸曲酒样的乳酸乙酯含量相较于市售麸曲酒样也有显著增加(P<0.05)[32]。 由于乙酸乙酯和乳酸乙酯是清香型白酒的重要风味物质,其赋予了酒体甜香的口感和水果香味[33-34];混菌麸曲酒样的异丁醇含量相较于市售麸曲酒样显著减少(P<0.05),异戊醇有少量上升,但均在清香型风味范围内[35]。异丁醇能够给酒体带来柔和的刺激感与苦味[36];异戊醇可以使白酒的口感更加柔顺、醇厚,并增强酒体的平衡度和韵味[37]。
3 结论
本研究使用扣囊复膜酵母和经筛选后的一株高糖化力台湾根霉进行制备混菌麸曲试验,并通过以酵母数为指标,进行正交试验优化混菌麸曲培养条件,得到了混菌麸曲的最佳制备工艺条件为:培养温度30 ℃,水分含量45%,培养时间36 h。在此最优条件下,麸曲糖化力为582 U/g,酵母活细胞数为8.42×108 CFU/g。 并通过酿造试验证明了混菌麸曲应用到麸曲清香型白酒工艺中时,混菌麸曲有效提高了酿造结束时酒醅的酸度,并且在没有降低出酒率的情况下,相较于市售麸曲发酵的酒样,其乙酸乙酯、乳酸乙酯有显著提升,提高了清香型白酒酯类物质含量。本研究建立在对混菌麸曲制备工艺进行探索,后续可将工艺制作的混菌麸曲应用于实际生产中,以期改善清香型白酒风味。
参考文献:
[1]ZHENG X W,HAN B Z.Baijiu(白酒),Chinese liquor:history,classification and manufacture[J].J Ethnic Foods,2016,3(1):19-25.
[2]张英,鄢定波,胡景辉,等.清香型白酒发展概述[J].中国酿造,2024,43(9):1-8.
[3]徐娟,刘忠军,钟吉安,等.基于仿生学和GC-IMS技术分析市售不同酒曲清香型白酒的风味特征[J].中国酿造,2023,42(12):244-248.
[4]郭锦宁,刘幼强,何松贵,等.米根霉麸曲提高豉香型白酒中乳酸乙酯的含量[J].现代食品科技,2021,37(8):84-90.
[5]赵港国,李晓晓,张婧靖,等.基于响应面法优化库德毕赤酵母强化发酵工艺生产清香型白酒[J].中国酿造,2024,43(8):224-229.
[6]何洋,冯怡婷,吴昊文,等.云南米酒中优质酵母协同米根霉发酵对米酒理化性质及风味物质的影响[J].食品工业科技,2025,46(12):1-11.
[7]DE BARROS RANKE F F,SHINYA T Y,DE FIGUEIREDO F C,et al.Ethanol from rice byproduct using amylases secreted by Rhizopus microsporus var.oligosporus.Enzyme partial purification and characterization[J].J Environ Manage,2020,266:110591.
[8]WU J F,REN L X,ZHAO N,et al.Solid-state fermentation by Rhizopus oryzae improves flavor of wheat bran for application in food[J].J Cereal Sci,2022,107:103536.
[9]KANG J M,HUANG X N,LI R S,et al.Deciphering the core microbes and their interactions in spontaneous Baijiu fermentation: A comprehensive review[J].Food Res Int,2024,188:114497.
[10]SON E Y,LEE S M,KIM M,et al.Comparison of volatile and non-volatile metabolites in rice wine fermented by Koji inoculated with Saccharomycopsis fibuligera and Aspergillus oryzae[J].Food Res Int,2018,109:596-605.
[11]王晓丹,陈美竹,班世栋,等.茅台大曲中酵母的分离、鉴定及其功能初探[J].食品科学,2017,38(4):51-57.
[12]SU C,ZHANG K Z,CAO X Z,et al.Effects of Saccharomycopsis fibuligera and Saccharomyces cerevisiae inoculation on small fermentation starters in Sichuan-style Xiaoqu liquor[J].Food Res Int,2020,137:109425.
[13]刘霄,黄治国,卫春会,等.扣囊复膜酵母麸曲制备及其在小曲白酒中的应用[J].食品科学,2025,46(1):56-63.
[14]刘建学,刘金科,李璇,等.白酒酒醅高产酯酵母筛选鉴定及其发酵性能研究[J].食品与机械,2020,36(6):42-49.
[15]白茹.白酒酿造用真菌酯化酶的挖掘、表达及催化性质研究[D].天津:天津科技大学,2022.
[16]王茜,陈晖,何国庆,等.高产糖化酶的扣囊复膜酵母菌株筛选及其在清香型白酒酿造中的应用[J].酿酒科技,2024(12):71-76.
[17]姚万春,唐玉明,任道群,等.酿酒用根霉菌株的培养特性研究[J].中国酿造,2006,25(10):34-37.
[18]孙思佳,翟磊,白秀彬,等.一株高产淀粉酶扣囊复膜孢酵母的产酶条件优化及酶学性质研究[J].食品与发酵工业,2019,45(21):31-37.
[19]苏凤,卫春会,曾波,等.中高温大曲中红曲霉的筛选及应用[J].食品与机械,2024,40(5):203-209.
[20]丁娟,许勤虎,王祥河,等.多微麸曲清香型白酒酿造用糖化菌种筛选研究[J].天津科技,2023,50(7):19-22,26.
[21]马美荣,刘小改,李洪媛,等.两种扣囊复膜酵母在清香型麸曲白酒生产中的应用[J].食品工业科技,2021,42(21):133-139.
[22]陈思达,陈沙,张凤英.以粗粮为基质保藏米根霉的保存时间研究[J].粮食科技与经济,2023,48(5):115-119.
[23]王志男,杨佳,李新生,等.扣囊复膜酵母生物学性状及生理生化特性研究[J].陕西理工大学学报(自然科学版),2022,38(3):39-46.
[24]赵恒山.产糖化酶、液化酶菌株的筛选及麸曲的制备[D].晋中:山西农业大学,2017.
[25]夏玙,谢军,黄丹,等.异常威克汉逊酵母的麸曲制作工艺优化[J].食品研究与开发,2018,39(22):118-123.
[26]王福荣.酿酒分析与检测[M].北京:化学工业出版社,2012:56-120.
[27]KRUIS A J,LEVISSON M,MARS A E,et al.Ethyl acetate production by the elusive alcohol acetyltransferase from yeast[J].Metab Eng,2017,41:92-101.
[28]周钰涵.生香酵母的风味物质分析及其在麸曲白酒中的应用[D].天津:天津科技大学,2022.
[29]牟薏,卫春会,曾波,等.基于黄水线上下层酒醅及基酒的风味特征分析[J].食品与发酵工业,2024,50(19):321-330.
[30]马美荣,刘小改,李洪媛,等.两种扣囊复膜酵母在清香型麸曲白酒生产中的应用[J].食品工业科技,2021,42(21):133-139.
[31]李洪媛,马美荣,周林艳,等.根霉酵母混合麸曲在清香型白酒生产中的应用[J].酿酒科技,2021(9):123-130.
[32]蒲升惠,秦辉,徐琼,等.根霉功能曲制曲工艺条件优化研究[J].酿酒科技,2024(1):24-29.
[33]郭学武,范恩帝,马冰涛,等.中国白酒中微量成分研究进展[J].食品科学,2020,41(11):267-276.
[34]HUANG Q,LIU Y,TIAN L,et al.Effects of storage time on flavor characteristics of bran-free fermented Baijiu by using electronic sensory,descriptive sensory analysis,GC×GC-MS,and ICP-MS[J].Food Chem,2024,23:101667.
[35]QIU F H,DU B H,ZHANG C N,et al.Effects of Saccharomyces cerevisiae on microbial community and flavor metabolites in solid-state fermentation of strong-flavor Baijiu[J].Food Biosci,2024,59:103925.
[36]YU X Y,HUANG T T,HUANG Z J,et al.Effects of six commercially available koji(Chinese Xiaoqu)on the production of ethyl acetate,ethyl lactate,and higher alcohols in Chinese Baijiu(distilled spirit)brewing[J].Heliyon,2023,9(7):e17739.
[37]CUI D Y,LIU L,ZHANG X Y,et al.Using transcriptomics to reveal the molecular mechanism of higher alcohol metabolism in Saccharomyces cerevisiae[J].Food Biosci,2023,51:102227.