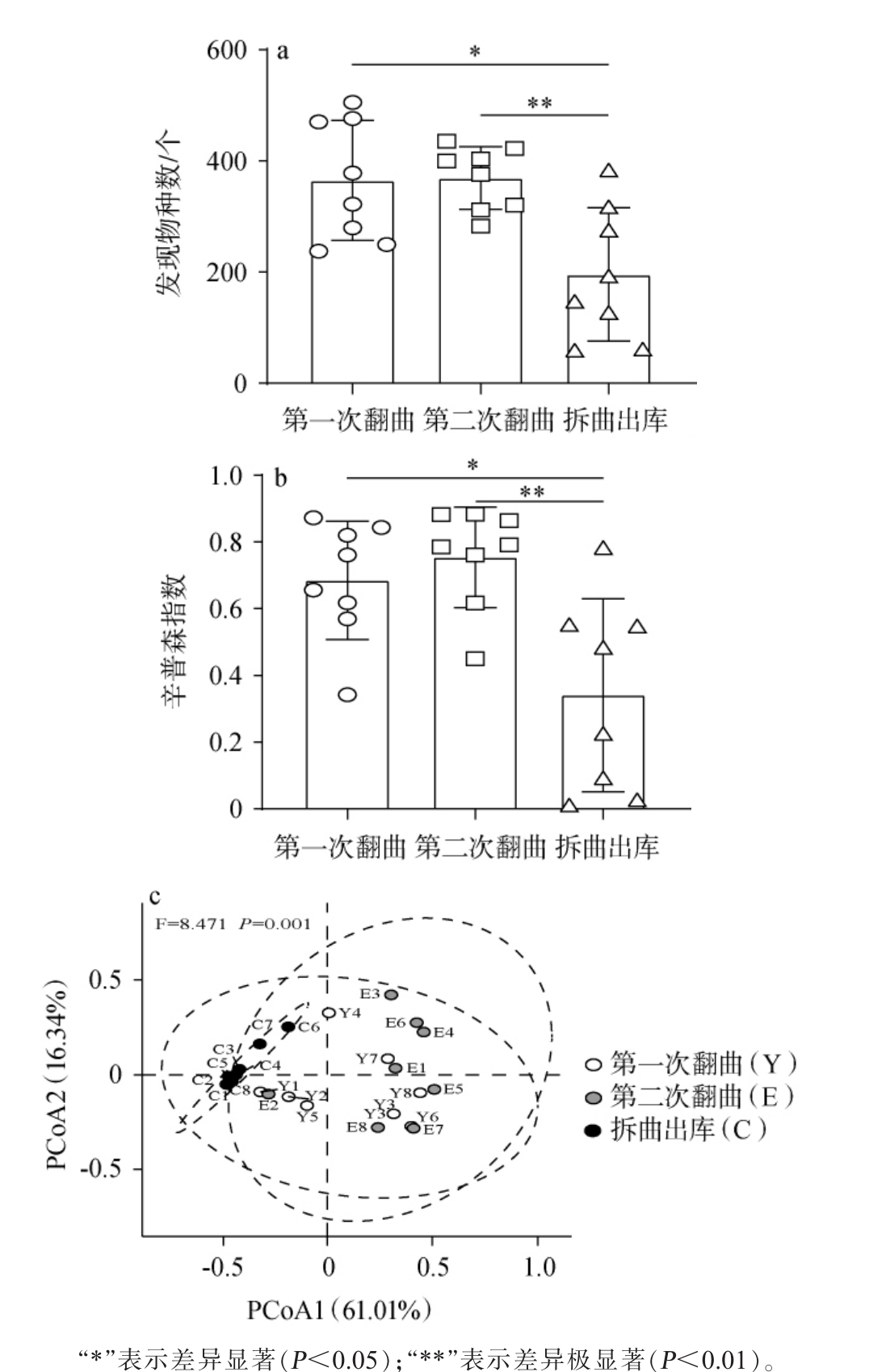
图1 高温大曲发酵过程中真菌群落α多样性(a,b)和β多样性(c)分析结果
Fig.1 Analysis results of α diversity (a, b) and β diversity (c) of the fungal community during high-temperature Daqu fermentation process
Analysis of fungal community succession during high-temperature Daqu fermentation process based on Illumina MiSeq high-throughput sequencing technology
中国白酒因其独特的风味和悠久的酿造历史,与白兰地、威士忌等并列为世界六大知名蒸馏酒[1]。根据酿造原料、工艺及风味特征的差异,中国白酒可进一步细分为酱香型、浓香型和清香型等12大主要香型[2]。 其中,酱香型白酒以其酱香醇厚,回味悠长等风格特征而深受广大消费者的喜爱[3]。高温大曲是酱香型白酒酿造的主要发酵剂,其在生产过程中通过高温条件富集耐热微生物类群,形成特有的微生物群落结构、风味物质前体和功能酶类[4]。尽管高温大曲的微生物群落已得到广泛研究,但这些研究大多以成品大曲为研究对象[5-6],或仅对发酵过程中细菌菌群的变化规律进行了解析[7-10],高温大曲发酵过程中真菌群落结构的演替规律仍未得到充分揭示。之前ZUO Q等[9]对贵州省某酱香型白酒酿酒厂不同发酵时间的高温大曲细菌群落进行研究,结果发现厚壁菌门(Firmicutes)是最丰富的门类,并且在发酵过程中相对含量由43.15%逐渐上升至93.10%。这一现象表明,随着高温大曲发酵的进行,耐受性差的微生物逐渐被淘汰,而适应该环境的微生物逐渐增殖成为优势菌群,从而实现了大曲发酵微生物的“净化”,有效抑制了杂菌的生长[10]。 此外,已有的研究还发现真菌在酱香型白酒酿造中也扮演着重要角色。 例如,酵母菌属(Saccharomyces)和毕赤酵母属(Pichia)等可产生多种风味物质[11];而丝状真菌如曲霉属(Aspergillus)、根毛霉属(Rhizomucor)和根霉属(Rhizopus)等能够代谢产生α-淀粉酶、葡糖淀粉酶等多种酶类[12],为酱香型白酒后期的糖化和酒化提供重要动力。由此可见,大曲中真菌群落结构组成与酱香型白酒的品质之间存在密切的联系,深入解析高温大曲制曲过程中真菌菌群的多样性和群落演替规律对于促进酱香型白酒的生产具有重要的意义。
目前,高温大曲微生物群落结构的研究方法主要包括传统的微生物纯培养技术和无需培养的分子生物学技术。随着核酸检测技术的发展,高通量测序技术因其高特异性、高灵敏度、高通量和低成本等优势[13],近年来在大曲微生物研究中得到了广泛应用。例如,DENG Y等[14]利用Illumina MiSeq高通量测序技术分析了四川省遂宁市一家酒企浓香型大曲发酵过程中的微生物变化,发现发酵过程中大曲的细菌菌群多样性呈现先下降后上升的趋势,并且不同发酵时间点的样品中优势菌属相对含量存在显著差异;ZONG E等[15]则通过高通量测序技术分析了山西省汾阳市杏花村某酒厂低温大曲产品在生产过程中微生物群落结构的变化,发现细菌和真菌群落的香农指数在发酵第3天开始增加,在发酵5~8 d达到最大值,随后逐渐下降,直到第17天达到最低点。这些研究表明,Illumina MiSeq高通量测序技术在探索高温大曲发酵过程中的真菌多样性和群落演替规律方面具有高度可行性。
本研究以高温大曲生产过程中首次翻曲、二次翻曲及拆曲出库三个关键阶段的高温大曲为研究对象,利用Illumina MiSeq高通量测序技术系统解析了高温大曲发酵过程中真菌菌群多样性和群落结构的动态演替规律,以期为后续优化大曲发酵工艺和提高产品品质提供重要的基础数据。
DNeasy mericon Food Kit脱氧核糖核酸(deoxyribonucleic acid,DNA)基因组提取试剂盒:德国QIAGEN公司;10×Buffer、DNA聚合酶(5 U/μL)、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP):北京全式金生物技术有限公司;引物ITS3F/ITS4R:上海桑尼生物科技有限公司。 其他试剂均为国产分析纯。
BF-10小型高速粉碎机:河北本辰科技有限公司;Veriti FAST梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;DYY-12型电泳仪:北京六一仪器厂;UVPCDS8000凝胶成像分析系统:美国Protein Simple公司;Illumina MiSeq PE300高通量测序平台:美国Illumina公司;R930机架式服务器:美国DELL公司。
1.3.1 不同发酵时间高温大曲样品的采集
高温大曲的制作通常包括粉碎、加水、加入母曲、拌曲配料、踩曲成型、入仓发酵、第一次翻曲、第二次翻曲、拆曲出库和贮存等几个步骤[16],本研究分别于第一次翻曲(发酵第9天)、第二次翻曲(发酵第16天)和拆曲出库(发酵第44天)各采集8块样品作为实验样本。采样时根据曲房内曲块堆积的层数均匀抽取,将采集的曲块装入灭菌的样品袋低温状态下迅速运回实验室。使用破碎仪将曲块充分磨成粉后混匀取样后进行编号:Y1~Y8代表第一次翻曲样品,E1~E8代表第二次翻曲样品,C1~C8代表拆曲出库样品。 为尽量避免酒曲在粉碎过程中的交叉污染,粉碎操作在开放的环境中进行,曲块在粉碎并充分混匀得到实验样品后均使用高压冲气枪彻底清理粉碎机的叶片、磨膛和死角,确保不会对后续样品造成污染。
1.3.2 不同发酵时间高温大曲样品微生物宏基因组DNA提取、PCR扩增和高通量测序
使用QIAGEN DNeasy mericon Food Kit DNA基因组提取试剂盒提取不同发酵时间高温大曲样品真菌群落的宏基因组DNA,使用1%琼脂糖凝胶电泳检测其完整性。以提取的宏基因组DNA为模板,使用通用引物ITS3F(5'-GCATCGATGAAGAACGCAGC-3')和ITS4R(5'-TCCTCCGCTTATTGATATGC-3')对真菌菌群的ITS2区基因序列进行PCR扩增[17]。 PCR扩增体系:10×PCR缓冲液2.5 μL,2.5 mmol/L dNTP 2 μL,ITS3F/ITS4R各0.5 μL,DNA聚合酶0.5 μL,DNA模板1 μL,用双蒸水(ddH2O)补充至25 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃再延伸5 min。PCR扩增产物使用1.5%琼脂糖凝胶电泳进行检测,将检测合格的产物委托上海美吉生物医药有限公司采用Illumina MiSeq PE300高通量测序平台进行测序。
1.3.3 生物信息学分析
参照WANG Y R等[18]的方法,使用QIIME(V1.9.1)平台对高通量测序数据进行处理和生物信息学分析。首先,利用FLASH软件(V1.2.7)根据序列的重叠区域进行拼接,并根据Barcode将序列分配到各个样品。 然后,使用UCHIME工具去除序列中的接头、标签和引物。使用UCLUST软件按97%的相似度将所有序列划分为操作分类单元(operational taxonomic unit,OTU)。最后,从每个OTU中选取代表性序列,并与UNITE数据库(V10.0)进行比对,获得不同OTU的物种注释信息。通过汇总各OTU的注释结果,进一步分析各样品在不同分类学水平上的菌群结构。通过计算样本相同测序深度下的发现物种数和辛普森指数评估样品中菌群的丰富度和多样性,同时基于加权UniFrac距离,对大曲样品的β多样性进行分析。
1.3.4 数据处理和可视化
采用Mann-Whitney检验进行差异显著性分析;使用Origin 2018软件、R(v4.1.3)软件绘图;使用在线网站(http://huttenhower.sph.harvard.edu/galaxy/)进行线性判别分析效应值大小(linear discriminant analysis effect size,LEfSe)计算和绘图;使用Spearman Rank相关性分析确定优势真菌属间的相关关系。
使用Illumina MiSeq高通量测序技术对不同发酵时间高温大曲样品的真菌群落进行测序,过滤低质量序列后共得到1 517 642条高质量序列,平均每个样品的序列数为63 235条。基于QIIME(V1.9.1)平台对不同发酵阶段高温大曲样品真菌菌群的α和β多样性进行分析,结果见图1。

图1 高温大曲发酵过程中真菌群落α多样性(a,b)和β多样性(c)分析结果
Fig.1 Analysis results of α diversity (a, b) and β diversity (c) of the fungal community during high-temperature Daqu fermentation process
由图1a和图1b可知,第一次翻曲时真菌菌群的发现物种数和辛普森指数分别为364.94个和0.69;第二次翻曲时发现物种数和辛普森指数达到最高,分别为369.16和0.75;拆曲出库时,这两个指标均极显著下降(P<0.01)。高温大曲的整个发酵过程会经历一个先升温后降温的变化,曲块入房进行堆积时,会通过铺稻草和关门窗等进行保温,所以大曲品温迅速升高,在第一次翻曲时品温可达到60 ℃以上[19],而大部分真菌的最适生长温度为25~28 ℃[20],当温度达到50~60 ℃时大部分真菌会出现死亡,导致此时高温大曲样品中真菌菌群丰富度和多样性较低;而第二次拆曲时,大曲的品温有所降低,一般为38~42 ℃,所以此时大曲的真菌丰富度和多样性相较于第一次翻曲时出现升高;从第二次翻曲到拆曲出库阶段,发酵基质中的可用营养物质,如糖类和氨基酸被大量消耗,使得微生物群落缺乏足够的资源进行生长和繁殖,导致其数量减少,群落结构变得更加单一[19]。 本研究也证实了这一点,即发现物种数和辛普森指数在拆曲出库时显著下降,此时的真菌菌群丰富度和多样性最低。综上可知,随着发酵时间的推移,高温大曲真菌群落丰富度和多样性呈现先上升后下降的趋势。
由图1c可知,PCoA1和PCoA2对真菌群落结构的方差贡献率分别为61.01%和16.34%,两者累计解释了不同发酵时间高温大曲样本组成差异的77.35%。其中第一次翻曲与第二次翻曲的样品存在一定的重叠,但与拆曲出库阶段的样品差别较大。 说明第二次翻曲至拆曲出库阶段,大曲中真菌群落结构发生了比较大的变化。
利用Venn图对不同发酵时间高温大曲样品的共有和特有OTU进行分析,直观反映不同发酵时间高温大曲OTU的共性和差异。基于97%相似度对序列进行划分后从高温大曲样品中共得到1 377个OTU,不同发酵阶段微生物的共有和特有OTU的数量见图2。
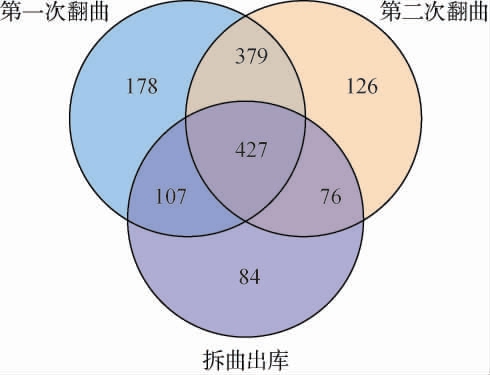
图2 高温大曲发酵过程中真菌菌群操作分类单元数韦恩图
Fig.2 Venn diagram of fungal operating taxonomic units number of the fungal community during high-temperature Daqu fermentation process
由图2可知,第一次翻曲、第二次翻曲和拆曲出库高温大曲样品中有效OTU数目分别为1 091、1 008和694个,其中3个发酵阶段样品共有的真菌OTU数目为427个,占OTU总数的31.01%,但这些OTU中所包含的序列数占各样品总序列的平均比例高达97.96%(79.36%~99.94%),由此可见,在不同发酵阶段,共有OTU在大曲真菌群落中均占据着主导地位。 在高温大曲发酵过程中,真菌菌群的OTU数在发酵后期明显降低,这与α多样性分析结果一致。究其原因可能是,发酵前期小麦原料和加入的母曲中都含有大量真菌群落[21],且此时发酵底物充足,发酵环境适宜,所以各种真菌群落生长繁殖较快,而随着发酵的进行,真菌群落逐渐进入一个高温条件,不适宜此环境的微生物则会进入消亡,耐受性较强的真菌群落则生存下来,导致发酵后期OTU的数量减少。由此可知,高温大曲的发酵过程本身是一个微生物筛选的过程。
将各OTU代表性序列与UNITE数据库比对后发现,不同发酵时间高温大曲样品所得OTU归属于4个真菌门、14个真菌纲、28个真菌目、54个真菌科和76个真菌属。进一步在门和属水平上对高温大曲发酵过程中真菌群落的构成进行分析,结果见图3。
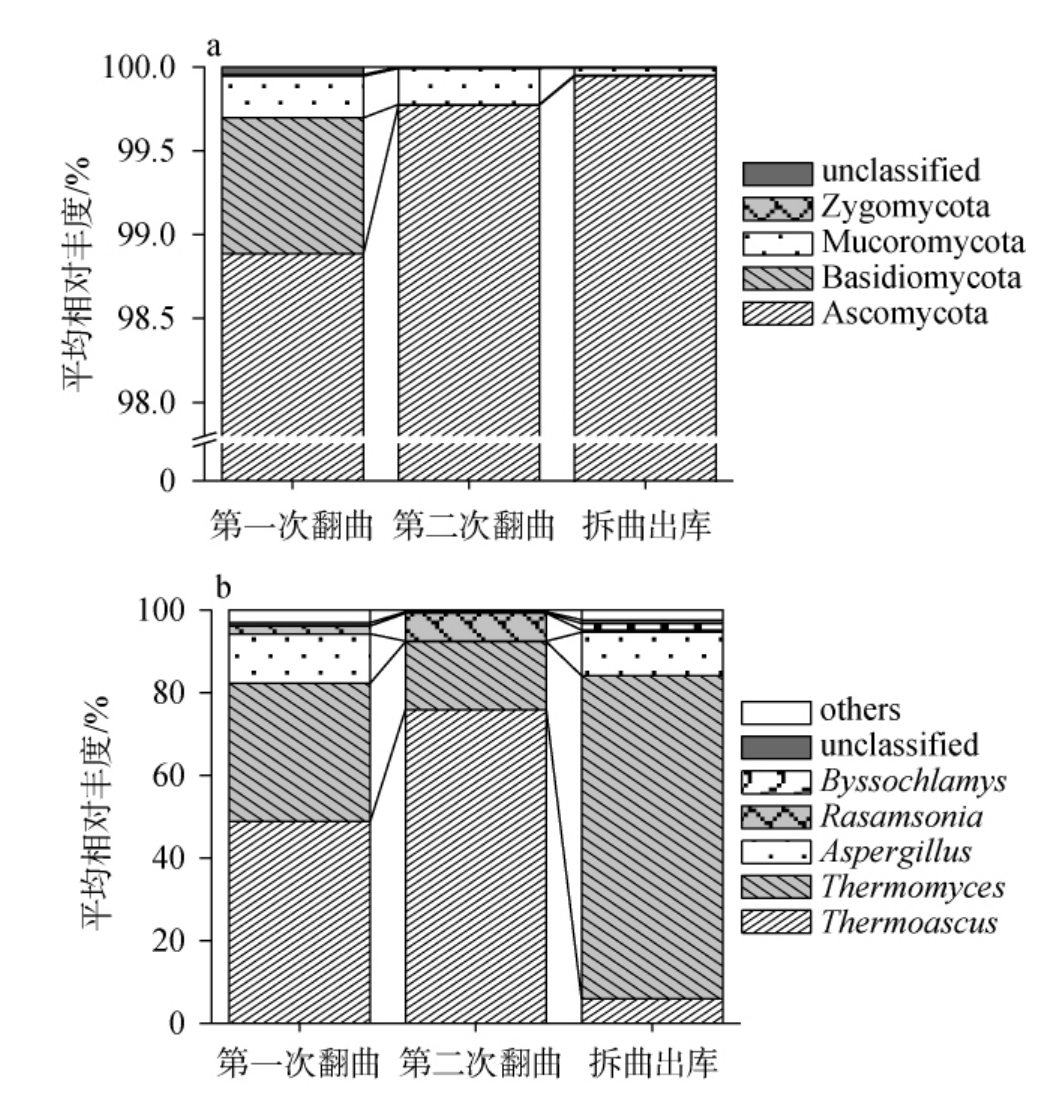
图3 基于门(a)和属(b)水平高温大曲发酵过程中真菌群落结构分析结果
Fig.3 Analysis results of fungal community structure during hightemperature Daqu fermentation at the phylum (a) and genus (b) levels
由图3a可知,在24份不同发酵时间的高温大曲样本中共鉴定出4个真菌门,包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉门(Mucoromycota)和接合菌门(Zygomycota)。 其中,Ascomycota在整个高温大曲制曲期间占据绝对优势,其在各发酵阶段样品中的平均相对丰度介于98.88%~99.95%之间。该结果与郑亚伦等[22]对湖北省宜昌市某白酒企业高温大曲发酵过程中微生物多样性的研究结果相一致,即Ascomycota为绝对优势真菌门,在整个发酵过程中平均相对丰度>90%。结果表明,Ascomycota作为主导真菌门可能是高温大曲发酵过程中的普遍现象。
由图3b可知,在属水平上,共鉴定出5个优势真菌属(平均相对丰度>1%),均隶属于Ascomycota,包括嗜热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)、曲霉属(Aspergillus)、罗萨氏菌属(Rasamsonia)和丝衣霉菌属(Byssochlamys)。这5个优势真菌属的平均相对丰度之和达到97.96%,表明它们在高温大曲发酵过程中起主导作用。在第一次翻曲时,Thermoascus和Thermomyces的平均相对丰度分别为48.91%和33.42%。随着发酵进行,Thermoascus的平均相对丰度在第二次翻曲时显著增加至75.93%(P<0.05),成为发酵体系中的绝对优势真菌属,随后其相对丰度逐渐下降,至拆曲出库时降至6.03%,显著低于两次翻曲时的平均相对丰度(P<0.05)。Thermoascus是一种耐热性较强的真菌属,能分泌多种酶类,包括过氧化氢酶、内切葡聚糖酶、蛋白酶和淀粉酶等,这些特性使其具有在高温条件下提高大曲糖化力和液化力的能力,对后续的高温堆积发酵以及白酒风味的形成具有重要作用[23-24]。 相比之下,Thermomyces的平均相对丰度呈现出不同的动态变化模式,在第二次翻曲时下降至16.37%,在发酵后期,该菌属的平均相对丰度再次显著增加(P<0.05),至拆曲出库时达到峰值(79.49%),占绝对优势。Thermomyces作为高温大曲的核心功能微生物之一,在风味物质生成和酶活性方面发挥着重要作用。宋建阳等[25]的研究表明,Thermomyces与多种风味物质(如己酸乙酯、醇类物质和酸类物质)存在密切的联系。此外,Thermomyces具有产生高活力耐高温酶类的能力,这些酶能够有效降解蛋白质和大分子多糖,促进微生物对酿酒原料的利用,从而产生特定的风味物质[26]。除上述两种绝对优势真菌属外,Aspergillus在发酵过程中也表现出显著的动态变化,其在第一次翻曲和拆曲出库时,Aspergillus为主要优势真菌属,平均相对丰度分别达到11.93%和10.69%,在第二次翻曲时,其平均相对丰度显著降低至0.19%(P<0.05)。Aspergillus作为大曲中常见的优势霉菌,能够产生淀粉酶和蛋白酶等水解酶类,有利于白酒酿造过程中大分子物质的分解利用[27]。此外,Byssochlamys虽然在高温大曲中较少被报道为优势真菌属,但其在本研究拆曲出库阶段其平均相对丰度达到了1.67%。Byssochlamys能够产生对热具有较强抵抗能力的子囊孢子,这些孢子在85 ℃以上的环境中仍然能够存活。同时,Byssochlamys还可以分泌果胶酶,有利于白酒酿造的糖化过程[28]。
值得强调的是,大多数真菌在温度达到50 ℃以上时几乎停止生长。然而,高温大曲制曲过程中最高品温可达60 ℃以上。在这种极端环境下,耐热真菌如Thermoascus和Thermomyces在真菌群落中占据绝对优势地位,这反映了它们对高温环境的特殊适应性。 综上所述,高温大曲发酵过程中真菌群落结构呈现明显的时间动态变化特征:第一次翻曲时以Thermoascus和Thermomyces为主导真菌属,第二次翻曲时Thermoascus占据绝对优势,而在拆曲出库时Thermomyces成为主导真菌属。 这种动态变化模式可能与不同发酵阶段的特定环境条件和营养成分的改变存在密切的关系。
基于真菌群落结构研究结果,进一步利用LEfSe和相关性分析,深入探讨了高温大曲发酵过程中差异真菌菌群及优势真菌属间的相互作用关系,结果分别见图4和图5。
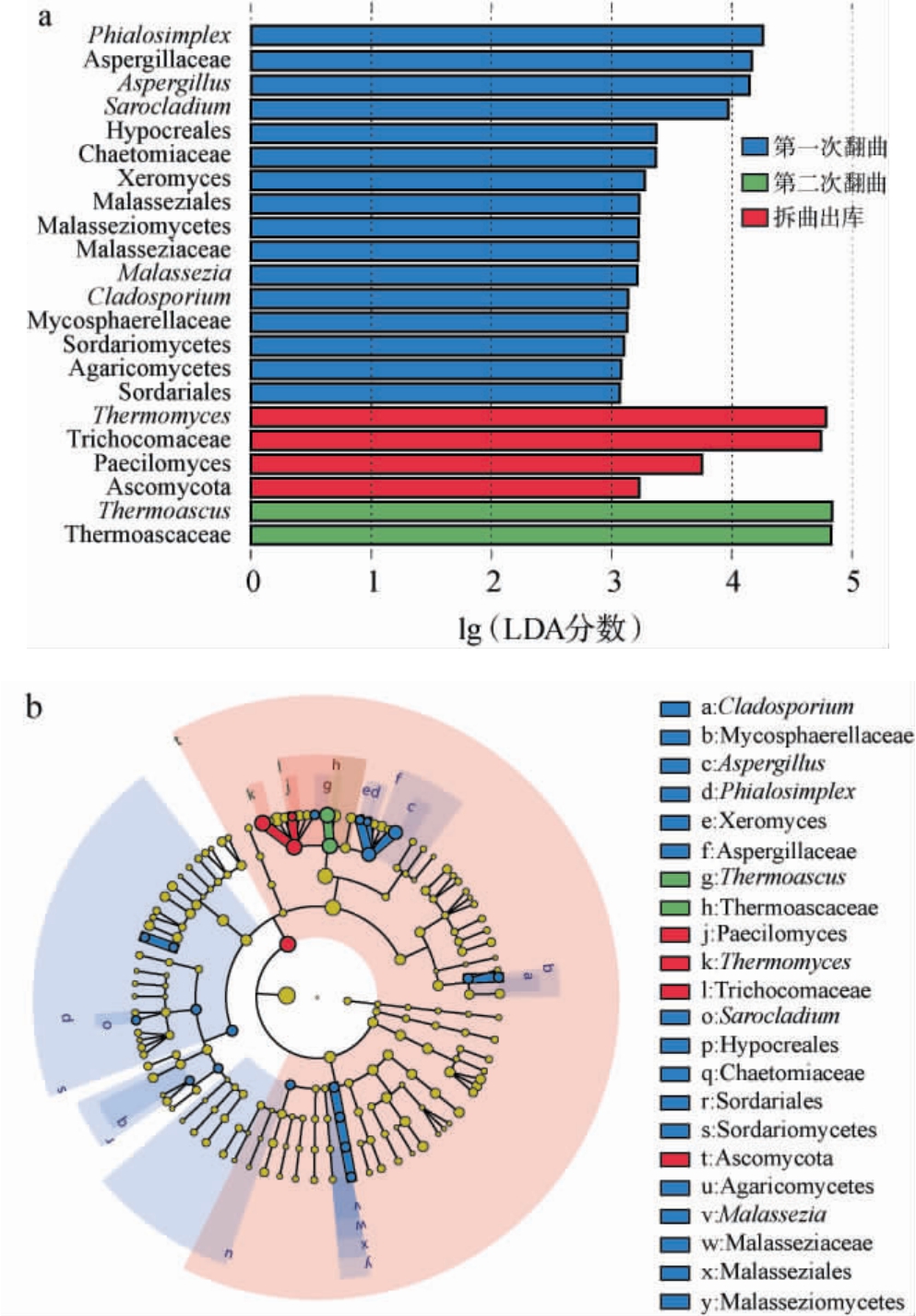
图4 高温大曲发酵过程中差异真菌菌群分析结果
Fig.4 Analysis results of the differential fungal community during high-temperature Daqu fermentation process
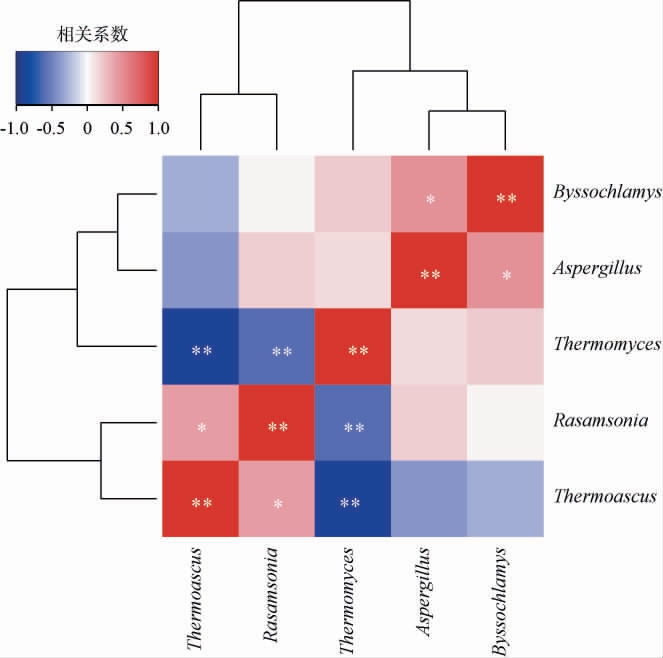
图5 高温大曲发酵过程中优势真菌属间相关性分析结果
Fig.5 Results of correlation analysis among dominant fungi genera during high temperature Daqu fermentation process
“*”表示相关性显著(P<0.05);“**”表示相关性极显著(P<0.01)。
由图4可知,在第一次翻曲时,4个真菌属显著富集,分别为Phialosimplex、Aspergillus、帚枝霉属(Sarocladium)和马拉色氏霉菌属(Malassezia)。 第二次翻曲时,Thermoascus成为显著富集的优势真菌属。 拆曲出库时,Thermomyces和拟青霉属(Paecilomyces)显著富集。由此可见,第一次翻曲阶段特异性真菌的数量较多。根据lg(LDA分数)值,Phialosimplex、Thermoascus和Thermomyces可分别作为第一次翻曲、第二次翻曲和拆曲出库阶段的生物标志物。
由图5可知,Thermomyces与Thermoascus、Rasamsonia之间均存在极显著负相关关系(P<0.01),而Thermoascus与Rasamsonia之间存在显著正相关关系(P<0.05)。此外,Byssochlamys和Aspergillus之间也存在显著正相关关系(P<0.05)。 结果表明,高温大曲发酵过程中的真菌群落结构呈现显著的时间动态特征和复杂的相互作用关系。 其中,第一次翻曲阶段表现出最高的真菌多样性,可能与初始发酵环境及原料中原始菌群较为复杂有关[29]。而主导菌属如Thermomyces、Thermoascus和Rasamsonia的相对丰度在发酵过程中呈现明显的此消彼长趋势,反映了它们对变化环境的适应能力差异以及它们可能通过竞争或协同作用影响整个发酵过程。同时这些菌属在不同发酵阶段的优势地位变化,可能反映了它们在发酵过程中的功能互补性,共同贡献于高温大曲的品质形成[30]。
本研究采用Illumina MiSeq高通量测序技术对不同发酵阶段高温大曲样品的真菌群落结构演替规律进行解析。研究发现,高温大曲真菌群落的多样性和丰富度呈现先上升后下降的趋势,在第二次翻曲时达到最大,发现物种数和辛普森指数分别为369.16、0.75。高温大曲发酵过程中真菌群落结构发生了较大变化,第一次翻曲时以Thermoascus和Thermomyces为主,第二次翻曲时Thermoascus为绝对优势真菌属,拆曲出库时Thermomyces成为主导菌属。 LEfSe分析结果表明,不同发酵阶段呈现出特征性优势菌,Phialosimplex、Thermoascus和Thermomyces可分别为第一次翻曲、第二次翻曲和拆曲出库阶段的生物标志物。相关性分析结果表明,真菌群落结构的变化可能与菌群间的互作关系密切相关。本研究结果为后续优化大曲发酵过程和提高产品品质奠定了基础。
[1]TU W,CAO X,CHENG J,et al.Chinese Baijiu:The perfect works of microorganisms[J].Front Microbiol,2022,13(7):919044.
[2]LIU H L,SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[3]YANG L,FAN W,XU Y.GC×GC-TOF/MS and UPLC-Q-TOF/MS based untargeted metabolomics coupled with physicochemical properties to reveal the characteristics of different type Daqus for making soy sauce aroma and flavor type Baijiu[J].LWT-Food Sci Technol, 2021,146(7):111416.
[4]谢丹,吴成,毕远林,等.酱香型白酒高温大曲储存过程中微生物群落演替与理化因子相关性研究[J].食品工业科技,2023,44(15):151-158.
[5]GUO Z, XIANG F, HOU Q C, et al.Analysis of bacterial community structure and taste quality of different colored high-temperature Daqu in the Xiangyang region,China[J].LWT-Food Sci Technol,2023,188(10):115411.
[6]马梦月,郭壮,李学思,等.临沂和周口地区中高温大曲细菌群落结构与基因功能差异性研究[J].食品工业科技,2024,45(1):155-161.
[7]左乾程,黄永光,郭敏,等.酱香型白酒机械化制曲发酵细菌群落的演替[J].食品科学,2021,42(18):150-156.
[8]谢丹,吴成,程平言,等.应用单分子实时测序技术解析酱香型白酒高温大曲制作过程细菌多样性[J].食品与发酵工业,2022,48 (19):58-64.
[9]ZUO Q,HUANG Y,MIN G.Evaluation of bacterial diversity during fermentation process:A comparison between handmade and machine-made high-temperature Daqu of Maotai-flavor liquor[J].Anna Microbiol,2020,70(9):1-10.
[10]PAN F, QIU S, LV Y, et al.Exploring the controllability of the Baijiu fermentation process with microbiota orientation[J].Food Res Int,2023,173(11):113249.
[11]LI W,FAN G,FU Z,et al.Effects of fortification of Daqu with various yeasts on microbial community structure and flavor metabolism[J].Food Res Int,2020,129(5):108837.
[12]BEHERA B C.Citric acid from Aspergillus niger: A comprehensive overview[J].Crit Rev Microbiol,2020,46(6):727-749.
[13]GOODWIN S,MCPHERSON J D,MCCOMBIE W R.Coming of age:Ten years of next-generation sequencing technologies[J].Nat Rev Genet,2016,17(6):333-351.
[14]DENG Y,HUANG D,HAN B,et al.Correlation:Between autochthonous microbial diversity and volatile metabolites during the fermentation of Nongxiang Daqu[J].Front Microbiol,2021,12(9):688981.
[15]ZONG E,BO T,DANG L,et al.Different functions can be provided by low-temperature Daqu with different appearance features due to variations in the microbial community structure during fermentation[J].LWT-Food Sci Technol,2024,193(1):115763.
[16]向凡舒,蔡文超,田龙新,等.襄阳地区高温大曲真菌群落结构及其风味品质解析[J].食品科学,2023,44(24):211-219.
[17]ZHANG Z D,WANG Y R,HOU Q C,et al.Description of Lactobacillus enshiensis sp.nov., a novel arsenic-resistant bacterium[J].Int J Syst Evol Microbiol,2020,70(4):2573-2580.
[18]WANG Y R,XIANG F S,ZHANG Z D,et al.High-throughput sequencing-based analysis of fungal diversity and taste quality evaluation of Douchi,a traditional fermented food[J].Food Sci Nutr,2020,8(10):6612-6620.
[19]ZHU Q, CHEN L, PENG Z, et al.Analysis of environmental driving factors on core functional community during Daqu fermentation[J].Food Res Int,2022,157(7):111286.
[20]ZENG Y,WANG Y,CHEN Q,et al.Dynamics of microbial community structure and enzyme activities during the solid-state fermentation of Forgood Daqu:A starter of Chinese strong flavour Baijiu[J].Arch Microbiol,2022,204(9):577.
[21]程驰新笑,贺子豪,郭壮,等.高温大曲中葡萄球菌多样性解析及其分离株鉴定[J].中国酿造,2024,43(1):57-62.
[22]郑亚伦,赵婷,王家胜,等.数字化高温大曲发酵过程中微生物群落结构的变化[J].食品科学,2022,43(12):171-178.
[23]ZHU M,ZHENG J,XIE J,et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Res Int,2022,153(5):110955.
[24]YAN S B, CHEN X S, GUANG J Q.Bacterial and fungal diversity in the traditional Chinese strong flavour liquor Daqu[J].J I Brewing,2019,125(4):443-452.
[25]宋建阳,梁莉莹,岑定运,等.浓香型白酒发酵过程中酒醅微生物群落结构解析及其与风味物质的相关性[J].食品研究与开发,2023,44(14):86-92.
[26]REN H, SUN Y, YANG Y, et al.Unraveling the correlations between microbial communities and metabolic profiles of strong-flavor Jinhui Daqu with different storage periods[J].Food Microbiol,2024,121:104497.
[27]HE G Q, HUANG J, ZHOU R Q, et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Front Microbiol,2019,10(1):56.
[28]SANTOS J L P,SAMAPUNDO S,PIMENTEL G C,et al.Assessment of minimum oxygen concentrations for the growth of heat-resistant moulds[J].Front Microbiol,2019,84(12):103243.
[29]DU H,WANG X,ZHANG Y,et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].Int J Food Microbiol,2019,297:32-40.
[30]HOU Q, WANG Y, CAI W, et al.Metagenomic and physicochemical analyses reveal microbial community and functional differences between three types of low-temperature Daqu[J].Food Res Int,2022,156:111167.