
Effects of Rhizopus addition on physicochemical indexes of fermented grains and flavor components of base liquor in Xiaoqu light-flavor Baijiu
作为白酒历史中最古老酒种之一的小曲清香型白酒,拥有清、净、纯、正的特点,其酒体中含有多种风味物质,而这些风味物质主要来源于发酵过程中微生物的代谢合成[1-2]。白酒酿造中微生物的主要的来源是酒曲微生物,酒曲中的微生物直接影响了发酵过程中酒醅微生物群落的更替和代谢,进而影响到基酒的风味和品质[3-4]。
酒曲不仅为发酵过程提供菌系和物系,更为发酵过程提供必不可少的酶系,丰富的酶系不仅保证了发酵过程的顺利进行,并且丰富了酒醅中的风味物质。 而酒曲中酶的形成与霉菌密不可分[5],在小曲清香型白酒发酵的糖化阶段,霉菌所提供的酶系(主要为糖化酶、液化酶和蛋白酶)对原料中淀粉、蛋白质的降解具有重要催化作用,原料经酶解后生成糖类及氨基酸,在为其他微生物的生长代谢提供基础物质的同时,也为白酒的风味物质的形成奠定了基础[6-10]。 根霉属(Rhizopus)和曲霉属(Aspergillus)是白酒酿造中最常见的霉菌。 曲霉属可以产生多种酶系,如黑曲霉(Aspergillus niger)可以产生α-淀粉酶、纤维素酶、半纤维素酶等酶类,同时也可产生少量酒精[11]。相比于根霉,曲霉的“共栖性”较差,而根霉更适宜多菌混合培养环境[12]。根霉不仅含丰富的糖化酶、液化酶等酶系,还可以边糖化、边发酵,使得淀粉利用率更高。 另外根霉在发酵过程中还可产生一些风味物质,如乙酸乙酯、丙酸乙酯、正丙醇、3-甲基丁醇、乙醛等风味物质[13],进而丰富酒体的风味物质的组成和含量。 基于根霉菌所具有的特性,研究者尝试在不同香型白酒的发酵曲中添加根霉菌。万营东等[14]在浓香型白酒中研究发现,根霉强化可以提高糟醅中优势挥发性成分的含量,提高在发酵过程中乙酸乙酯和己酸乙酯的含量,并增大酯类组分的比例,改善白酒的风味和香气。 王明生等[15]在馥郁型白酒中研究发现,在糖化阶段加入根霉菌,提高了基酒中总酸和乙酸乙酯的含量,使得酒样香味馥郁,口感体现前浓中清后酱的特点。
本实验尝试将根霉菌以加强曲的形式添加在原小曲清香型白酒发酵工艺中,采用常规分析方法、气相色谱(gas chromatography,GC)法、高效液相色谱(high performance liquid chromatography,HPLC)法分析不同根霉菌添加量对小曲清香型白酒糖化阶段糖化酶、液化酶、酸性蛋白酶酶活及发酵过程酒醅水分、残糖、残淀粉、酸度、氨基酸态氮、氨氮、有机酸、乙醇以及基酒中风味成分的影响,并对不同根霉菌添加量的酶活、酒醅理化因子进行相关性分析及主成分分析(principal component analysis,PCA)。以期为根霉菌曲在小曲清香型白酒酿造生产中的应用提供参考依据,为丰富酒体风味成分、改善口感进而提高小曲清香型白酒的品质提供新思路。
1.1.1 材料
米根霉(Rhizopus oryzae)Q303:本实验室保存;高粱、酒糟、谷壳、酒曲:某小曲清香型白酒酒厂。
1.1.2 化学试剂
五水硫酸铜、茚三酮、碳酸钠、三氯乙酸、无水乙醇、磷酸、盐酸、硫酸、亚铁氰化钾、酒石酸钾钠、无水葡萄糖、氢氧化钠、磷酸氢二钠(均为分析纯):天津市科密欧化学试剂有限公司;磷酸二氢钾、无水乙酸钠(均为分析纯):天津市风船化学试剂科技有限公司;亚甲基蓝(分析纯):国药集团化学试剂有限公司;福林酚试剂(分析纯):北京Solarbio科技有限公司;纳氏试剂(分析纯):宜昌绿源生物科技有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、WL营养琼脂:青岛高科技工业园海博生物技术有限公司。
LC-E109S电磁炉:广东顺德忠臣电器有限公司;LDZM-60KCS高压蒸汽灭菌锅:上海申安医疗器械厂;LD5-2A型离心机:北京医用离心机厂;722型分光光度计:天津普瑞斯生物科技有限公司;XMTB型电热恒温水浴锅:天津市中环实验电炉有限公司;ZWYR-D2401型卧式恒温摇床:上海智城分析仪器制造有限公司;LRH-250A型生化培养箱:上海博迅实业有限公司;Agilent 1260高效液相色谱仪、Agilent 7890A气相色谱仪:安捷伦科技(北京)有限公司。
1.3.1 纯种根霉曲的制备
(1)麸曲固体培养基
一级麸曲固体培养基:称取一定量的麸皮,加入质量分数65%的蒸馏水,拌匀后分装在规格为10 mm×100 mm的试管中,每支试管装料量大约为1 g。121 ℃灭菌20 min。
二级麸曲固体培养基:称取一定量的麸皮,加入质量分数80%的蒸馏水,拌匀后分装在500 mL的三角瓶中,每个三角瓶装大约40 g。121 ℃灭菌20 min。
(2)一级麸曲培养
从PDA固体平板上挑取一环菌丝体接入到一级麸曲固体培养基中,30 ℃培养48 h。菌丝体将会布满麸皮,此时为一级麸曲种子。
(3)二级麸曲培养
将一级麸曲种子全部接种于灭菌的二级麸曲固体培养基中,30 ℃培养48 h。待菌丝布满培养基、麸皮连结成饼时,进行扣瓶。扣瓶后继续培养1 d,在35~40 ℃下烘干。烘干后在无菌条件下研磨成粉,于干燥器内保存,用于后续实验。
1.3.2 实验室模拟小曲清香型白酒固态发酵工艺流程及操作要点
本实验以只添加1%酒曲,不添加根霉菌为对照组(CK),设计3个实验组:工艺1(在添加1%酒曲的基础上,添加原粮质量0.1%根霉菌)、工艺2(在添加1%酒曲的基础上,添加原粮质量0.3%根霉菌)和工艺3(在添加1%酒曲的基础上,添加原粮质量的0.5%根霉菌)。 实验室模拟小曲清香型白酒固态发酵工艺流程如下:

操作要点:
泡粮:将高粱清洗后,加72 ℃水至高出粮面10 cm以上浸泡,72 ℃保温20 h。
初蒸:高粱泡粮后,沥干水分,105 ℃进行蒸粮20 min。
焖粮:将初蒸后高粱取出,加65 ℃水至高出粮面10 cm以上,浸泡5 min焖粮。
复蒸:将初蒸高粱焖粮后沥干,105 ℃进行复蒸20 min。
摊粮加曲:复蒸后,将高粱摊凉至20~40 ℃之间时加曲,酒曲添加比例为原粮质量的1%,根霉菌曲添加量分别为0.1%、0.3%、0.5%。
培菌糖化:将拌匀的熟粮装入小桶,表面铺一层湿纱布,置于30 ℃培养箱培菌糖化24 h。
复原糟灭菌:将小曲清香型白酒酒厂的新鲜丢糟105 ℃灭菌20 min。
配糟:将酒糟与糖化醅按2:1搅拌均匀后装入500 mL锥形瓶,25 ℃培养箱中培养15 d。
蒸酒:在蒸锅中加入200 mL水,加热至上汽,取发酵结束的酒醅100 g装入蒸锅进行蒸馏,接取馏出液,即得小曲清香型白酒。
1.3.3 酵母菌落总数平板计数
称取10 g酒醅,置于含100 mL无菌水的三角瓶中,180 r/min振荡30 min。 吸取1 mL菌悬液进行梯度稀释后,取100 μL在WL营养琼脂培养基上进行平板涂布,30 ℃培养2~3 d后,采用菌落记号方式进行酵母单菌落数的统计。
1.3.4 糖化及发酵阶段酒醅酶活力的测定
糖化酶活力测定:采用菲林试剂法[16]。 取10 g酒醅加100 mL乙酸-乙酸钠缓冲溶液(pH=4.6),40 ℃水浴1 h,每15 min搅拌一次,过滤后作为待测酶液。
液化酶活力测定:采用分光光度法[17]。 取10 g酒醅加100 mL磷酸缓冲溶液(pH=6.5),40 ℃水浴1 h,每15 min搅拌一次,过滤后作为待测酶液。
酸性蛋白酶活力测定:采用福林酚法[18]。取10 g酒醅加100 mL乳酸-乳酸钠缓冲溶液(pH=3.0),40 ℃水浴30 min,每15 min搅拌一次,过滤后作为待测酶液。
1.3.5 酒醅理化指标的测定
酒醅的水分、残糖、残淀、酸度、氨基酸态氮和氨氮测定:参照文献[19]。
1.3.6 基酒酒样主要风味物质的测定
(1)挥发性风味物质的测定
采用气相色谱(GC)法测定基酒酒样中主要挥发性风味物质。GC条件:Agilent CP-WAX色谱柱(50 m×250 μm×0.25 μm);载气为高纯氮气(纯度>99.999%);柱流速1 mL/min;进样口温度250 ℃;检测器温度148.8 ℃;升温程序为起始温度35 ℃,保持1 min,以3 ℃/min升至0 ℃,保持15 min,再以3.5 ℃/min升至190 ℃,保持22 min;进样体积1 μL;分流进样,分流比30∶1。
定性定量方法:根据风味物质标准品的保留时间来进行定性分析。以标准物质的质量浓度(x)为横坐标、峰面积(y)为纵坐标,绘制标准曲线,按照标准曲线回归方程对基酒酒样中风味物质进行定量分析。
(2)有机酸含量的测定
采用Agilent 1260高效液相色谱仪对酒样有机酸含量进行测定。 HPLC条件:Agilent GH0830078H色谱柱(300 mm×7.8 mm×8 μm),紫外检测器,柱温50 ℃,流动相为5 mmol/L稀硫酸缓冲液,流速0.6 mL/min,波长210 nm,进样量20 μL。
定性定量方法:根据有机酸单一标准品的保留时间来确定各有机酸的出峰时间与顺序从而进行有机酸定性分析。以标准品质量浓度(x)为横坐标、峰面积(y)为纵坐标,绘制标准曲线,采用峰面积外标法对基酒酒样有机酸进行定量分析[20]。
1.3.7 数据处理与统计分析
使用IBM SPSS 25.0进行显著性分析,采用GraphPad 9.0和Origin 2021对所得数据进行绘图处理及统计学分析。
在发酵过程中,酒醅中主要酶系的酶活呈现出动态变化,酶系变化决定着酒醅中各种物质的变化,影响到乙醇的产量以及原酒中香味化学成分的浓度,进而影响到酒的质量和生产效益[21-22]。 酒醅中糖化酶和液化酶的活力直接关系到酒醅中淀粉的利用率,液化酶即α-淀粉酶,其能切断淀粉分子内部的α-1,4-糖苷键,将其分解为大、小糊精,淀粉粘度迅速下降而液化,从而为糖化酶提供更多的作用位点[23]。 蛋白酶可以分解原料中的蛋白质,所产生的多肽和氨基酸,是微生物生长、繁殖的营养成分。不同根霉菌添加量对发酵过程中酒醅的糖化酶、液化酶、蛋白酶酶活的影响结果见图1。
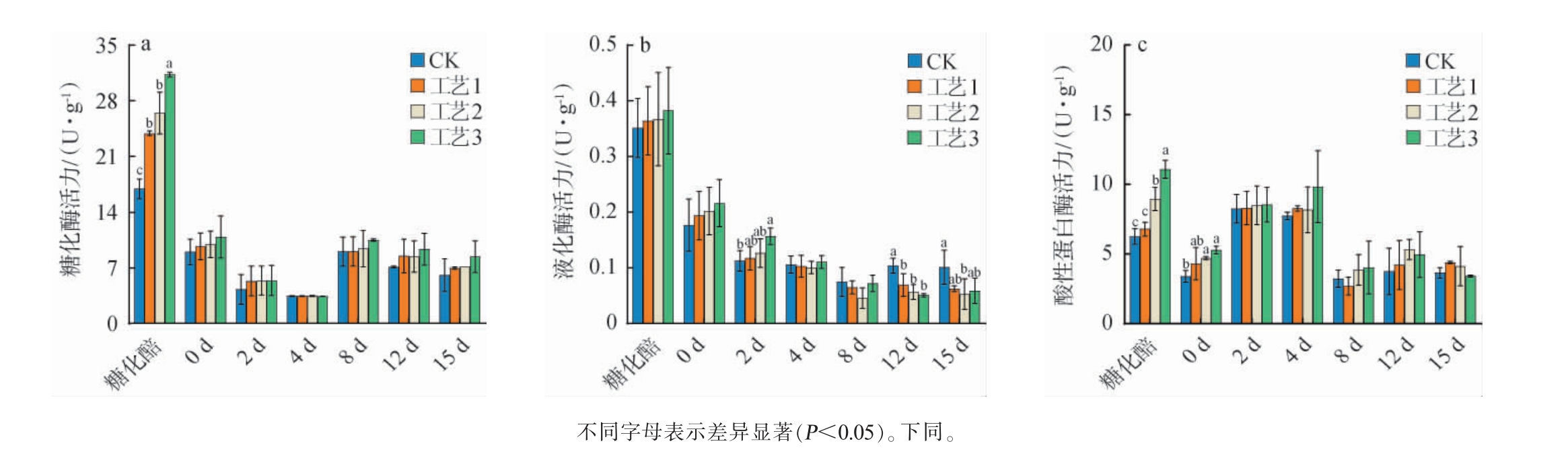
图1 不同根霉菌添加量对糖化及发酵阶段酒醅糖化酶(a)、液化酶(b)及酸性蛋白酶(c)酶活的影响
Fig.1 Effects of different Rhizopus addition on the activities of glucoamylase (a), amylase (b) and acid protease (c) of fermented grains in saccharification and fermentation stage
由图1a可知,培菌糖化阶段酒醅中糖化酶的酶活明显高于发酵阶段。在发酵阶段,糖化酶活力呈现先下降再上升之后又下降的趋势。 随着根霉菌添加量的增加,与对照组相比,糖化阶段酒醅中的糖化酶活力显著升高(P<0.05),其中工艺3的效果最好为31.31 U/g,比对照组升高了84.83%;但根霉菌添加量的增加并没有对发酵阶段酒醅中糖化酶活力造成显著影响(P>0.05)。
由图1b可知,糖化阶段液化酶的酶活明显高于发酵阶段。 在糖化阶段,酒醅的液化酶活力随着根霉菌添加量的增加呈上升趋势,其中工艺3的糖化酶活力最高为0.38 U/g,比对照组升高了8.57%。由于根霉菌主要作用于糖化阶段,所以发酵阶段的液化酶活力并没有随着根霉菌添加量的增加而升高。
由图1c可知,在糖化阶段,随着根霉菌添加量的增加,相比于对照组,糖化阶段酒醅中的酸性蛋白酶活力出现了显著的升高(P<0.05),其中,工艺3酒醅酸性蛋白酶活力最高为11.09 U/g,比对照组升高了77.16%。 在发酵阶段除入池醅酸性蛋白酶的酶活力随着根霉菌添加量的增加而明显升高外,对其他发酵阶段酒醅中酸性蛋白酶活力并未造成显著影响(P>0.05)。
综上,根霉菌的添加对酒醅酶活的影响主要在糖化阶段,对发酵阶段的酶活影响较小。在糖化阶段,随着根霉菌添加量的增加,酒醅的糖化酶活力、酸性蛋白酶活性显著升高(P<0.05),尤其是添加0.5%根霉菌的工艺3酒醅酶活最高,其糖化酶活力(31.31 U/g)显著高于对照组(16.94 U/g)(P<0.05);酸性蛋白酶活力(11.09 U/g)显著高于对照组(6.26 U/g)(P<0.05);而液化酶活力(0.38 U/g)高于对照组(0.35 U/g),但不显著(P>0.05)。 结果表明,最适根霉菌添加量为0.5%。
不同根霉菌添加量与糖化酶、液化酶、酸性蛋白酶酶活的相关性分析结果见图2。
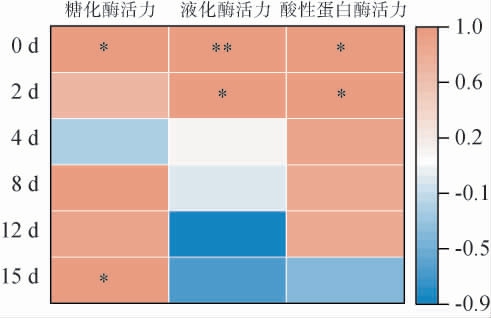
图2 不同根霉菌添加量与糖化酶、液化酶、酸性蛋白酶酶活的相关性分析结果
Fig.2 Correlation analysis results between different Rhizopus addition and the enzyme activities of glucoamylase,amylase and acid protease
“*”表示组间显著相关(P<0.05);“**”表示组间极显著相关(P<0.01)。下同。
由图2可知,发酵第0天,酒醅的糖化酶和酸性蛋白酶活力与根霉菌添加量呈显著正相关(P<0.05),液化酶活力与根霉菌添加量呈极显著正相关(P<0.01)。当发酵第2天时,酒醅的液化酶和酸性蛋白酶活力与根霉菌添加量呈显著正相关(P<0.05)。 当发酵结束(15 d)时,酒醅的糖化酶活力与根霉菌添加量呈显著正相关(P<0.05)。
不同根霉菌添加量对小曲清香型白酒发酵过程中酒醅理化指标的影响结果见图3。
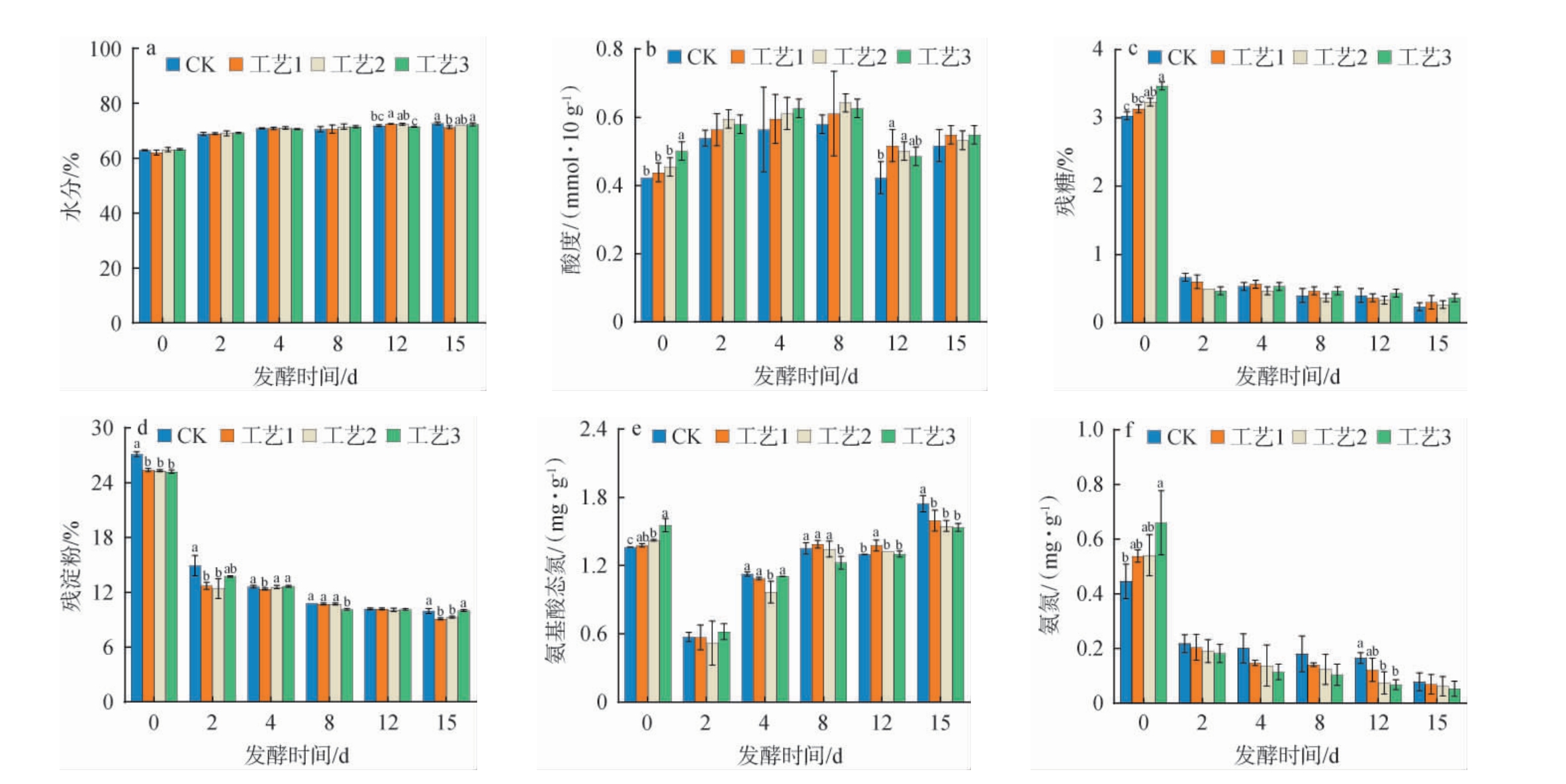
图3 不同根霉菌添加量对酒醅发酵过程中水分(a)、酸度(b)、残糖(c)、残淀粉(d)、氨基酸态氮(e)和氨氮(f)的影响
Fig.3 Effects of different Rhizopus addition on moisture (a), acidity (b), residual sugar (c), residual starch (d), amino acid nitrogen (e) and ammonia nitrogen (f) of fermented grains during fermentation process
由图3a可知,在发酵过程中,水分是保障酒醅中微生物生长代谢的重要因素,并为其代谢产物提供有效溶剂[24]。发酵过程中酒醅的含水量整体呈现上升趋势,大约在60%~75%。发酵前期酒醅水分上升较快,发酵中后期(4~15 d)水分上升缓慢,逐步至一个稳定的状态。 不同根霉菌添加量并未对发酵阶段前期和中期的水分造成影响。
由图3b可知,在发酵阶段,酒醅的酸度呈先上升再下降趋势。 随着发酵时间的延长,乳酸菌的大量繁殖导致酒醅的酸度上升,而后酒醅中酸度下降可能是酸类与醇类物质发生酯化反应导致酒醅的酸度下降[25]。入池醅的酸度随着根霉菌添加量的增加出现了显著的升高,造成这一现象的原因可能是根霉菌在糖化阶段中产生乳酸、柠檬酸、葡萄糖酸、琥珀酸等有机酸导致入池醅酸度随着根霉菌添加量的增加而显著增加[12]。
酒醅中的淀粉是白酒发酵过程中最重要的碳源,可以被霉菌所产生的糖化酶、液化酶降解成还原糖,并被微生物生长代谢所利用。酒醅的还原糖和淀粉含量的变化可以体现微生物发酵代谢的变化趋势[26]。 由图3c和3d可知,入池醅的残糖含量远高于发酵阶段的其他时期,且随着根霉菌添加量的增加,入池醅残糖含量随之增加,而残淀粉含量明显的降低。
氨基酸态氮是发酵微生物生长繁殖所需要的氮源,含量的高低关系着微生物能否正常生长繁殖[27]。由图3e可知,在发酵阶段中氨基酸态氮呈先下降后上升的趋势。在入池醅阶段随着根霉菌添加量的增加,氨基酸态氮含量出现了显著的升高。这可能是由于根霉菌添加量的增加,导致酒醅中的酸性蛋白酶的活性的增加,进而导致酒醅中的蛋白质分解产生较多的氨基酸态氮[28]。在发酵阶段前期(0~2 d),酒醅中氨基酸态氮含量呈下降趋势,造成这一现象的原因可能是发酵阶段前期酵母快速增殖,其生长的主要氮源来自于氨基酸态氮,进而造成了发酵阶段前期糟醅中氨基酸态氮含量的迅速下降[29]。在发酵阶段后期大部分微生物代谢逐渐减缓甚至死亡,导致后期氨基酸态氮含量急剧增加。
由图3f可知,在发酵阶段酒醅中的氨氮含量呈一直下降的趋势,表明微生物一直在利用氨氮进行自身的生长繁殖。
综上,不同的根霉菌添加量对酒醅水分无明显影响,但显著影响了发酵前期酒醅的酸度、残糖、残淀粉、氨基酸态氮和氨氮。当根霉菌添加量为0.5%时,发酵起始(0 d)酒醅中的酸度、残糖、氨基酸态氮和氨氮含量最高,相比于对照组,分别上升了18.43%、14.31%、14.24%和47.98%。因此,最适根霉菌添加量为0.5%。
为了探究根霉菌添加量的不同对发酵过程中酒醅理化因子的影响,利用Pearson相关性分析了根霉菌添加量与不同发酵阶段的酒醅理化因子的相关性,结果见图4。
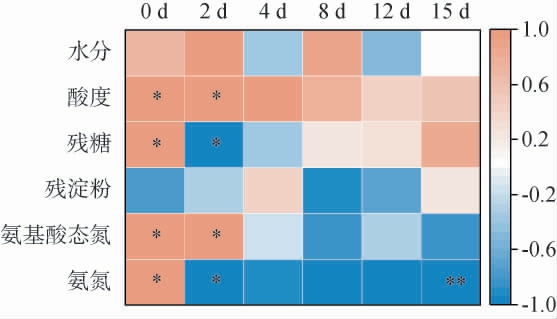
图4 不同根霉菌添加量与酒醅理化指标相关性分析结果
Fig.4 Correlation analysis results between different Rhizopus addition and physicochemical indexes of fermented grains
由图4可知,在发酵起始(0 d),残糖、酸度、氨基酸态氮、氨氮与根霉菌添加量呈显著正相关(P<0.05);在发酵第2天时,酸度、氨基酸态氮与根霉菌添加量呈显著正相关(P<0.05),残糖、氨氮与根霉菌添加量呈显著负相关(P<0.05)。在发酵结束(15 d)时,氨氮与根霉菌添加量呈极显著负相关(P<0.01)。
为了进一步解析不同根霉菌添加量对整个发酵周期的影响,对不同工艺酒醅中的6种主要理化因子(水分、酸度、残糖、残淀粉、氨基酸态氮和氨氮)和3种主要酶(糖化酶、液化酶和酸性蛋白酶)的活性进行主成分分析,结果见图5。由图5可知,第一主成分(PC1)方差贡献率为59.1%,第二主成分(PC2)方差贡献率为27.7%,PC1和PC2两个主成分的累计方差贡献率为86.8%,表明所选的理化因子和酶活力是驱动整个发酵阶段酒醅物质变化的重要因子。整个小曲清香型白酒发酵过程被9种要素划分为3个阶段:发酵起始(糖化阶段)、发酵前期(0~4 d)和发酵中后期(4~15 d)。
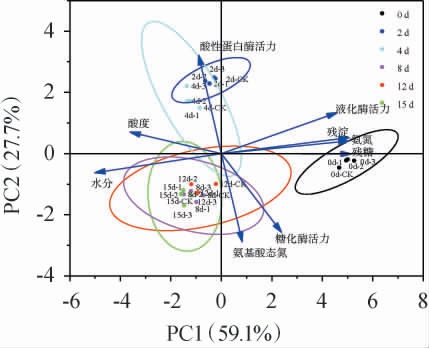
图5 基于理化指标和酶活不同酒醅样品主成分分析
Fig.5 Principal component analysis of different fermented grains samples based on physicochemical indexes and enzyme activities
对发酵结束后的对照组和实验组酒样的风味物质进行测定,结果见表1。
表1 不同根霉菌添加量对基酒风味物质含量的影响
Table 1 Effects of different Rhizopus addition on flavor components content of base liquor
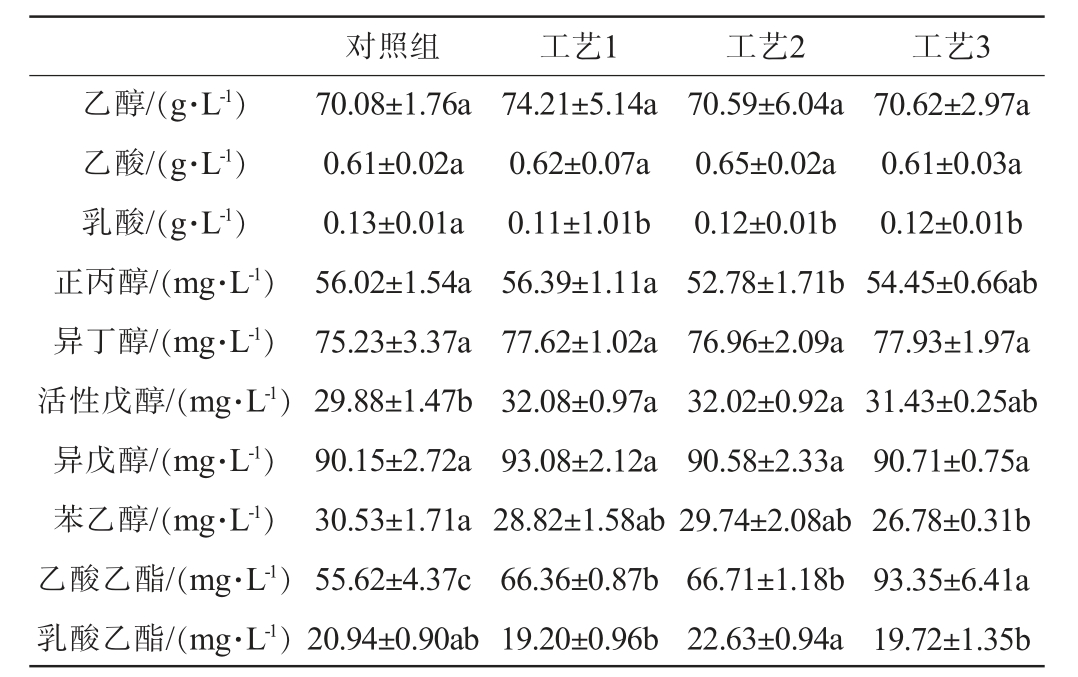
注:字母不同表示差异显著(P<0.05)。
对照组 工艺1 工艺2 工艺3乙醇/(g·L-1)乙酸/(g·L-1)乳酸/(g·L-1)正丙醇/(mg·L-1)异丁醇/(mg·L-1)活性戊醇/(mg·L-1)异戊醇/(mg·L-1)苯乙醇/(mg·L-1)乙酸乙酯/(mg·L-1)乳酸乙酯/(mg·L-1)70.62±2.97a 0.61±0.03a 0.12±0.01b 54.45±0.66ab 77.93±1.97a 31.43±0.25ab 90.71±0.75a 26.78±0.31b 93.35±6.41a 19.72±1.35b 70.08±1.76a 0.61±0.02a 0.13±0.01a 56.02±1.54a 75.23±3.37a 29.88±1.47b 90.15±2.72a 30.53±1.71a 55.62±4.37c 20.94±0.90ab 74.21±5.14a 0.62±0.07a 0.11±1.01b 56.39±1.11a 77.62±1.02a 32.08±0.97a 93.08±2.12a 28.82±1.58ab 66.36±0.87b 19.20±0.96b 70.59±6.04a 0.65±0.02a 0.12±0.01b 52.78±1.71b 76.96±2.09a 32.02±0.92a 90.58±2.33a 29.74±2.08ab 66.71±1.18b 22.63±0.94a
由表1可知,对照组和实验组酒样中的乙醇含量无显著性差异(P>0.05)。 酒样中乳酸含量随着根霉菌添加量的增加而降低,工艺3酒样中乳酸含量比对照组降低了7.69%,而根霉菌的添加对酒样中的乙酸含量影响不显著(P>0.05)。工艺2酒样的正丙醇含量最低,比对照组降低了5.78%。工艺1和工艺2酒样中的活性戊醇含量相比于对照组显著提高了7.36%、7.16%(P<0.05)。根霉菌添加量的不同并未对酒样中异丁醇和异戊醇的含量造成显著影响,但酒样中苯乙醇含量随着根霉菌添加量的增加而降低,工艺3比对照组降低了12.28%。对照组酒样的乳酸乙酯含量和实验组之间无显著性差异(P>0.05),但工艺2酒样的乳酸乙酯含量与工艺1、工艺3相比具有显著差异(P<0.05),工艺2的乳酸乙酯含量比工艺1、工艺3分别升高17.86%、14.75%。实验组酒样中乙酸乙酯的含量显著高于对照组(P<0.05),分别比对照组提高了19.31%、19.94%、67.84%。
综上,不同的根霉菌添加量对酒样的醇类物质影响不显著(P>0.05),但随着根霉菌添加量的增加,相对于对照组,显著升高了基酒中乙酸乙酯的含量(P<0.05),当根霉菌添加量为0.5%时最佳,小曲清香型的主要呈香物质—乙酸乙酯的含量比对照组上升了67.84%。
根据酒醅理化因子和酒醅酶活将发酵阶段分为了3个阶段:发酵起始(糖化阶段)、发酵前期(0~4 d)和发酵中后期(4~15 d)。 在这3个阶段的不同根霉菌添加量和基酒酒样中的风味物质的相关性分析结果见图6。 由图6可知,发酵起始(糖化阶段),乙醇含量与根霉菌添加量呈显著负相关(P<0.05);在发酵阶段中后期(4~15 d),正丙醇和苯乙醇含量与根霉菌添加量呈显著负相关(P<0.05)。 值得注意的是,在整个发酵周期中,乙酸乙酯含量、乙乳比与根霉菌添加量呈极显著正相关(P<0.01)。
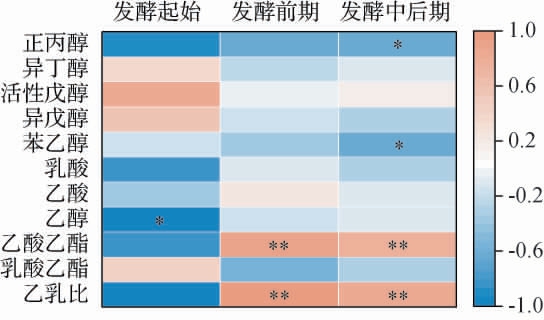
图6 不同根霉菌添加量与基酒中的风味物质的相关性分析结果
Fig.6 Correlation analysis results between different Rhizopus addition and flavor components of base liquor
在小曲清香型白酒的生产实践中,由于传统发酵的环境变化,使得每个时期的酒体中各成分含量很难保证完全相同,尤其在夏季生产时,气候温度高、空气湿度大,造成环境中乳酸菌的浓度升高,导致酒中乳酸和乳酸乙酯的浓度过高,乙酸乙酯相对较低,使酒体香味失去平衡[30]。因此,增加根霉菌的含量所生产出的高“乙乳比”的基酒可以为解决清香型白酒“增乙降乳”的问题提供一种方向。
乙酸乙酯与乳酸乙酯是小曲清香型白酒中重要的酯类化合物,两者结合形成的复合香味是小曲清香型白酒的主体香[31]。根霉菌添加量对乙酸乙酯、乳酸乙酯含量及酵母菌数的影响见图7。 由图7a可知,随着发酵的进行,酒样中乙酸乙酯含量呈现逐步升高的趋势,并且添加根霉菌的实验组存在两个阶段(0~2 d和12~15 d)显著上升。由图7b可知,酒样中的乳酸乙酯含量同样也呈现逐步升高的趋势,但根霉菌的加入并未对在发酵过程中产生的乳酸乙酯造成显著影响。乙酸乙酯在白酒酿造过程中主要由酵母菌生成,酵母菌在合成乙醇的同时伴随着乙酸乙酯的生成[32]。由图7c可知,实验组和对照组酵母数量在整个发酵过程中呈先上升后下降的趋势。在发酵阶段前期(0~4 d),酒醅中的酵母数量呈上升趋势,在发酵阶段中后期(4~15 d),酒醅中的酵母数量呈下降趋势。
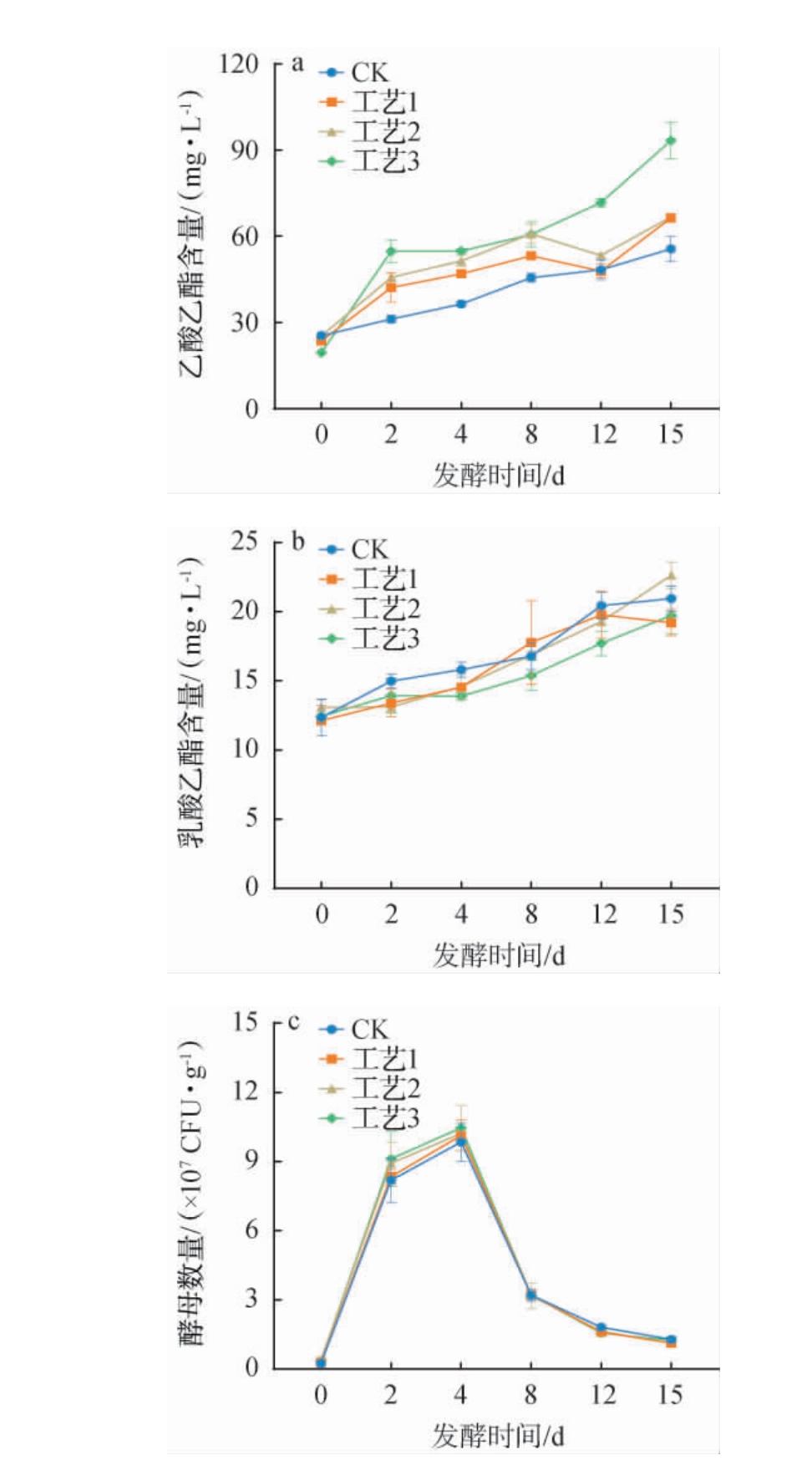
图7 发酵过程中不同根霉菌添加量对乙酸乙酯含量(a)、乳酸乙酯含量(b)及酵母数量(c)的影响
Fig.7 Effects of different Rhizopus addition on ethyl acetate content(a), ethyl lactate content (b) and yeast count (c) during fermentation process
根霉菌添加量、酵母数量及乙酸乙酯的相关性分析结果见图8。由图8可知,发酵前期(0~4 d)酵母数量与根霉菌的添加量呈显著正相关(P<0.05),当根霉菌添加量为0.5%时,酒醅中的酵母数量最多。 而酒样中乙酸乙酯含量与酵母数量呈显著正相关(P<0.05)。因此在发酵前期(0~4 d),添加0.5%的根霉菌(工艺3)酒样中的乙酸乙酯含量最高。在发酵中后期(4~15 d),酵母总体数量逐渐减少,有文献研究表明,在发酵后期酵母中酿酒酵母和生香酵母的比例发生变化:酿酒酵母丰度逐渐减少,而生香酵母丰度逐渐增加[33]。所以在发酵中后期酒样中乙酸乙酯含量的增加可能是由于生香酵母的数量增加。
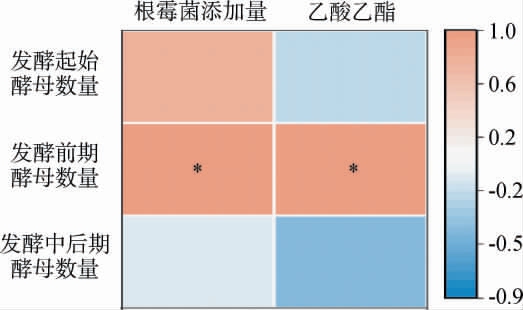
图8 根霉菌添加量、酵母数量及乙酸乙酯的相关性分析结果
Fig.8 Correlation analysis results among Rhizopus addition,yeast count and ethyl acetate
综上,当根霉菌添加量为0.5%时,发酵前期(0~4 d)酒醅中的酵母数量最多且酒样中的乙酸乙酯含量最高为93.35 U/g,比对照组升高了67.84%。丰富了小曲清香型白酒的风味物质,改善口感进而提高小曲清香型白酒的品质。
本实验通过改变模拟小曲清香型白酒工艺中根霉菌的添加量发现,根霉的添加对酒醅酶活的影响主要在糖化阶段,当根霉菌添加量为0.5%时,相对于对照组,酒醅中的糖化酶活力、液化酶活力和酸性蛋白酶活力最高,粮醅的培菌糖化效果最佳。根霉的添加对酒醅理化因子(酸度、残糖、氨基酸态氮和氨氮)的影响主要在发酵前期,在发酵起始(0 d)时,当根霉菌添加量为0.5%时,酒醅的酸度、残糖、氨基酸态氮和氨氮含量最高,相比于对照组分别上升了18.43%、14.31%、14.24%和47.98%。有利于其他微生物的生长繁殖以及白酒风味物质的形成。 另外,随着根霉菌的增加,显著影响了发酵过程中乙酸乙酯的合成(P<0.05),当发酵结束时(15 d),相对于对照组,添加0.5%的根霉菌的酒样中乙酸乙酯的含量升高了67.84%。因此添加0.5%根霉菌能够丰富酒体风味成分、改善口感进而提高小曲清香型白酒的品质。
[1]王星.清香型白酒科技研究进展及发展趋势[J].现代食品,2023,29(12):49-51.
[2]乔美灵,任宇婷,张桂莲,等.传统清香型白酒发酵过程中细菌群落演替及自组装机理[J].食品科学,2023,44(22):139-148.
[3]WANG Z,WANG Y, ZHU T T, et al.Characterization of the key odorants and their content variation in Niulanshan Baijiu with different storage years using flavor sensory omics analysis[J].Food Chem,2022,376(15):131851.
[4]HOU Q C,WANG Y R,CAI W C,et al.Metagenomic and physicochemical analyses reveal microbial community and functional differences be-tween three types of low-temperature Daqu[J].Food Res Int,2022,156(7):111167.
[5]王世伟,王卿惠,芦利军,等.白酒酿造微生物多样性、酶系与风味物质形成的研究进展[J].农业生物技术学报,2017,25(12):2038-2051.
[6]张元洪.固态发酵酱香型白酒过程中霉菌的研究进展[J].酿酒科技,2021(1):65-70.
[7]ZHENG X W,YAN Z,HAN B Z,et al.Complex microbiota of a Chinese"Fen"liquor fermentation starter(Fen-Daqu),revealed by culture-dependent and culture-independent methods[J].Food Microbiol,2012,31(2):293-300.
[8]XIAO C,YANG Y,LU Z M,et al.Daqu microbiota exhibits species-specific and periodic succession features in Chinese Baijiu fermentation process[J].Food Microbiol,2021,98:103766.
[9]LI X R, MA E B, YAN L Z, et al.Bacterial and fungal diversity in the starter production process of Fen liquor,a traditional Chinese liquor[J].J Microbiol,2013,51(4):430-438.
[10]FAN W,XU Y,ZHANG Y.Characterization of pyrazines in some Chinese liquors and their approximate concentrations[J].J Agr Food Chem,2007,55(24):9956-9962.
[11]谢再斌,常煦,何国庆,等.清香型白酒酿造过程中功能微生物及应用研究[J].中国酿造,2024,43(7):27-32.
[12]龙可,赵中开,马莹莹,等.酿酒根霉菌研究进展[J].现代食品科技,2013,29(2):443-447.
[13]成林,成坚,王琴,等.酒曲微生物菌群对酿造酒产品风味影响的研究进展[J].中国酿造,2020,39(10):1-4.
[14]万营东,唐秋香,黄钧,等.奇孢根霉强化中温大曲对糟醅发酵过程的影响[J].中国酿造,2023,42(12):45-53.
[15]王明生,程俊.根霉曲在馥郁香型白酒生产中的应用[J].酿酒科技,2018(8):70-88.
[16]温小英,廖勤俭,李扬华,等.一种酒醅糖化力的测定方法[J].酿酒科技,2013(5):100-101,104.
[17]张雪娇,田欢,刘春叶,等.可见分光光度法测定α-淀粉酶活力[J].化学与生物工程,2020,37(3):65-68.
[18]郑东影,陈玮,张卫卫,等.福林酚法测定酿酒白曲酸性蛋白酶活力的条件试验[J].酿酒,2020,47(2):63-66.
[19]沈怡方.白酒生产技术全书[M].第三版.北京:中国轻工业出版社,2005:642-652.
[20]史凤,马楷雨,史改玲,等.酱香型高温大曲发酵过程中风味物质分析[J].中国酿造,2025,44(1):52-59.
[21]李祖明,王德良,马美荣,等.不同酒曲酶系与发酵性能的比较研究[J].酿酒科技,2010(1):17-22.
[22]杨牢记,徐敏锐,祝熙,等.浓香型酒醅发酵过程中主要酶系酶活变化规律研究[J].酿酒,2017,44(4):48-51.
[23]王丹丹.白酒发酵过程中酶系与物系的相关性研究[D].北京:北京理工大学,2015.
[24]李璇,戚居胜,韩四海,等.浓香型白酒杜康酒醅发酵过程中理化指标变化规律[J].食品与发酵工业,2019,45(11):52-57.
[25]吕辉,张宿义,冯治平,等.浓香型白酒发酵过程中微生物消长与香味物质变化研究[J].食品与发酵科技,2010,46(3):37-40.
[26]黄亮.温度对白酒固态发酵的影响研究[D].自贡:四川轻化工大学,2022.
[27]杨志波.酱香型白酒糟资源化综合利用的研究[D].贵阳:贵州大学,2016.
[28]李理,钟晓敏.Rhizopus oryzae产酸性蛋白酶条件及其酶学性质研究[J].现代食品科技,2010,26(1):28-33.
[29]刘彦君.东方伊萨酵母在酱香型白酒酿造中的性能研究[D].天津:天津科技大学,2023.
[30]郭凯凯,肖楠,肖冬光.高产酯酿酒活性干酵母在清香型调味酒中的应用[J].酿酒科技,2017(7):80-83.
[31]阮玉磊.小曲清香型白酒合成微生物群落的构建[D].天津:天津科技大学,2023.
[32]黄治宇,岳松,张庆,等.浓香型白酒乙酸乙酯的产生与控制工艺研究进展[J].酿酒,2024,51(5):5-9.
[33]WANG H,WANG Y M,RUAN Y L,et al.Core microbes identification and synthetic microbiota construction for the production of Xiaoqu lightaroma Baijiu[J].Food Res Int,2024,183:114196.