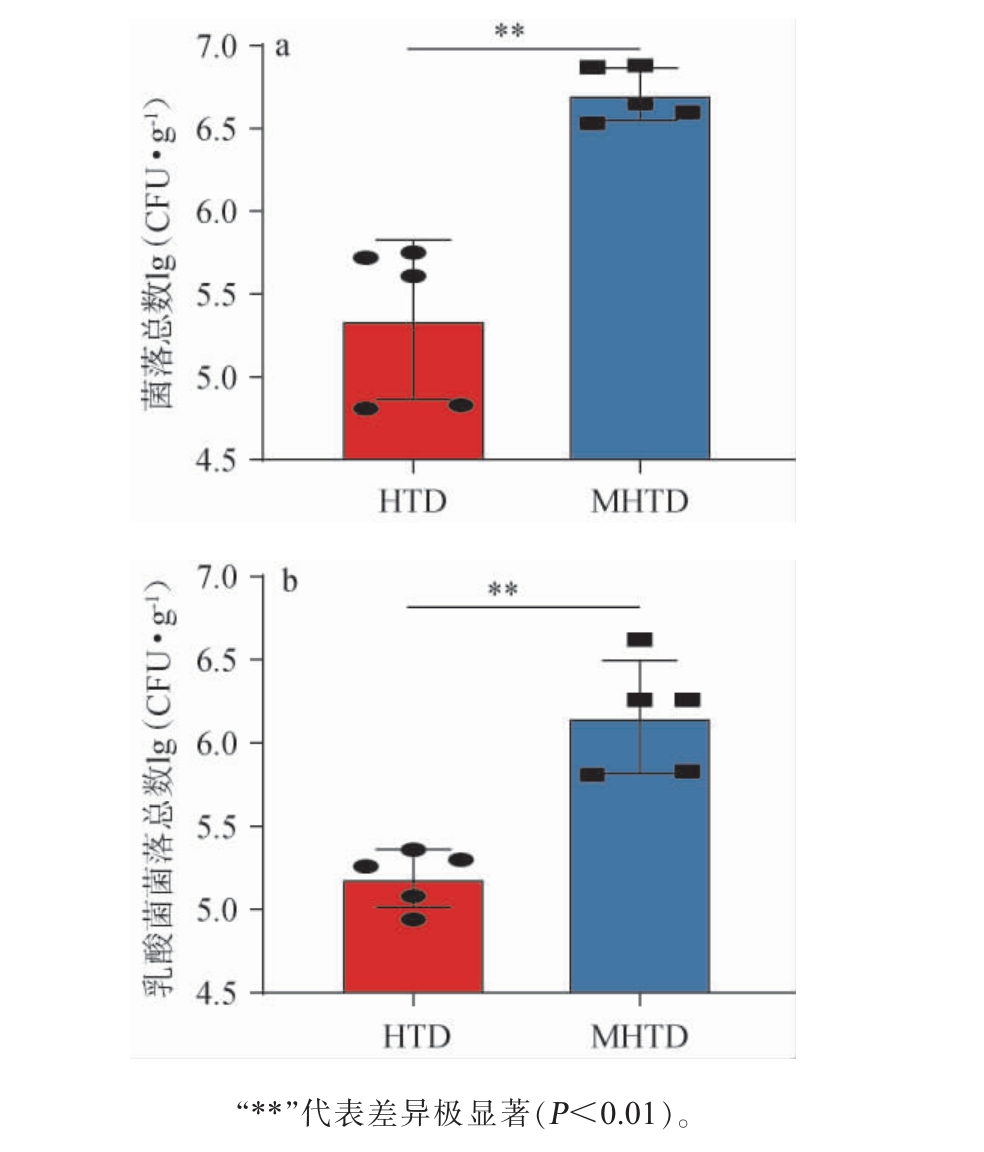
图1 高温和中高温大曲中菌落总数(a)及乳酸菌总数(b)统计结果
Fig.1 Statistical results of total colonies counts(a)and total lactic acid bacteria counts(b)in high-and medium-high-temperature Daqu
Analysis of bacterial community structure in different types of Daqu based on third-generation sequencing and pure culture techniques
白酒是我国传统的蒸馏酒,以大曲为发酵剂,经过蒸煮、发酵、蒸馏和陈化而得[1]。 大曲在白酒的酿造中发挥着不可替代的作用,一方面作为发酵底物,为风味物质的形成提供前体[2],另一方面,大曲富含丰富多样的微生物,为白酒的发酵提供动力和酶类物质[3]。 根据发酵最高温度和中挺时间长短的不同,大曲被划分为低温大曲、中温大曲、中高温大曲和高温大曲[4]。 不同类型大曲微生物群落结构存在明显差异,LIU Y等[5]研究结果表明,采集自河南仰韶酒厂的高温大曲中克罗彭斯特菌属(Kroppenstedtia)、片球菌属(Pediococcus)和魏斯氏菌属(Weissella)的丰度显著高于中温大曲(P<0.05)。张清玫等[6]研究发现,低温、中温、高温大曲3种类型大曲的微生物群落结构存在显著差异(P<0.05),其中低温大曲以乳杆菌属(Lactobacillus)等产酸产酯菌属为主,高温大曲以糖多孢菌属(Saccharopolyspora)和芽孢杆菌属(Bacillus)等耐高温菌属为主,而中温大曲菌群结构则介于这2种类型大曲之间,兼具低温与高温大曲的优势菌群的特色。了解不同类型大曲微生物群落结构差异对了解白酒酿造的机理,提升白酒品质具有重要意义。
常见的大曲微生物分离鉴定主要依赖传统微生物纯培养技术,根据分离株形态、生理生化特性及分子生物学结果来确定其种属地位[7-8],但微生物纯培养技术仅可对存活的可培养微生物进行捕获,不能完全反应大曲中微生物群落结构。近年来,随着测序技术的快速发展,对于大曲中微生物群落结构的研究不再局限于纯培养技术,更多的借助了扩增子测序技术去揭示大曲微生物的物种丰富度和多样性。与一代和二代测序技术相比较,美国太平洋生物科学公司(pacific biosciences,PacBio)的单分子实时测序技术(single molecular real time sequencing,SMRT)具有运行速度快、读长增加、提取质量高等优点[9],被广泛运用于大曲研究。唐佳代等[10]基于第三代测序技术对不同制曲工艺酱香大曲中微生物群落结构解析发现,机械仿生压曲中普通拟杆菌(Bacteroides vulgatus)、樱桃假单胞菌(Pseudomonas cerasi)的相对丰度较高,传统人工踩曲中魏格沃斯菌(Wigglesworthia glossinidia)和发酵氨基酸球菌(Acidaminococcus fermentans)相对丰度较高。 HAN P J等[11]采用PacBio SMRT测序技术对汾阳市杏花村汾酒厂大曲样品研究发现,合格大曲的细菌多样性显著高于劣质大曲,并且地衣芽孢杆菌(Bacillus licheniformis)和植物乳植杆菌(Lactiplantibacillus plantarum)在合格大曲中的含量显著高于劣质大曲(P<0.05)。 但目前鲜见不同类型大曲细菌群落结构解析研究进展。
本研究分别以高温大曲和中高温大曲为研究对象,该研究采用三代测序技术对两种大曲细菌群落结构进行解析,对细菌菌群相关性及基因功能进行分析,并采用微生物纯培养及分子生物学技术对菌株进行分离鉴定。以期揭示不同类型大曲细菌群落结构和可培养微生物之间的差异,为解析酿造机理、提升白酒品质提供数据支撑。
1.1.1 材料
高温和中高温大曲,于2023年12月采集,采集的大曲样品取自贮藏阶段,且均来源于该酒厂的制曲车间。每种类型的大曲均随机抽取5个样本作为平行样品,高温大曲编号为HTD1~HTD5,中高温大曲编号为MHTD1~MHTD5,共计10块大曲样品,采样后密封放置于采样箱中迅速运送回实验室,保存于-20 ℃冰箱中备用。
1.1.2 试剂
MRS培养基、营养琼脂(nutrient agar,NA)培养基、碳酸钙:上海国药集团化学试剂有限公司;引物27F/1492R和M13F(-47)/M13R(-48):上海桑尼生物科技有限公司;KOD One TM PCR Master Mix:北京百灵克生物科技有限责任公司;无核酸酶水、TGuide S96磁珠法土壤/粪便基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;Agencourt AMPure XP核酸纯化试剂盒:贝克曼库尔特有限公司;ExKubit dsDNA HS Assay Kit荧光定量检测试剂盒:上海吉泰依科赛生物科技有限公司。
QYC-2102C全温培养摇床:上海新苗医疗器械制造有限公司;DG250型厌氧工作站:英国Don Whitley公司;LRH-150生化培养箱:上海一恒科学仪器有限公司;ECLIPSE Ci生物显微镜:日本Nikon公司;Veriti96-Well梯度基因扩增仪:美国Applied Biosystems公司;Qubit 4.0荧光计:美国赛默飞世尔公司;164-5050基础电泳仪:美国Bio-Rad公司;UVPCDS8000凝胶成像分析系统:美国ProteinSimple公司;Sequel II测序仪:美国PacBio公司;R930机架式服务器:美国DELL公司。
1.3.1 大曲样品微生物计数
菌落总数的测定:参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验菌落总数测定》;乳酸菌总数:参照GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》。
1.3.2 细菌DNA的提取、16S rRNA扩增和PacBio SMRT测序
使用TGuide S96磁珠法土壤/粪便基因组DNA提取试剂盒对高温和中高温大曲样品的DNA进行提取,具体步骤参照说明书进行。将经1.0%琼脂糖凝胶电泳检测合格的大曲DNA使用引物27F(5'-AGRGTTTGATYNTGGCTCAG-3')和1492R(5'-TASGGHTACCTTGTTASGACTT-3')进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。16S全长扩增体系(30μL):1.5μLDNA,10.5 μL无核酸酶水,15 μL KOD One TM PCR Master Mix,1.5 μL 27F引物,1.5 μL 1492R引物;RCR扩增条件:95 ℃预变性2 min,98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸1.5 min,循环25次,最后72 ℃延伸2 min[12]。随后使用Qubit dsDNA HS测定试剂盒进行定量,使用Agencourt AMPure XP核酸纯化试剂盒进行纯化,将检测合格的PCR产物送往北京百迈客生物科技有限公司进行测序。
1.3.3 生物信息学分析
通过Smrt Link version8.0分析软件对测序生成的原始文件小循环次数为5和最低预测准确率为90%的条件进行过滤和分解,随后导出环形一致性序列(circular consensus sequencing,CCS)文件。 使用Cutadapt软件根据不含引物、最小序列长度为1 200 bp和最大序列长度为1 650 bp的条件对CCS进行质量过滤。 基于QIIME平台,使用UCHIM软件检测和去除嵌合体后,通过USEARCH软件将相似度≥97%的CCS划分到同一操作分类单元(operational taxonomic units,OTU)中,并过滤掉丰度<0.005%OTU。选取每个OTU的代表性序列与SILVA数据库(http://www.arb-silva.de/)进行比对注释,确定各OTU的分类学信息,对样品的β多样性进行计算。使用COG数据库(http://www.ncbi.nlm.nih.gov/COG/)对细菌菌群进行功能预测。所有序列上传至美国国立生物技术信息中心(national center for biotechnology information,NCBI)。
1.3.4 芽孢杆菌和乳酸菌的分离鉴定
将10 g的大曲样本加入90 mL无菌生理盐水,摇床中30 ℃振荡培养30 min。 采用10倍倍比稀释法,将菌悬液稀释到10-5,分别取100 μL的10-3、10-4和10-5的稀释液体,于MRS和NA固体培养基上进行涂布,倒置于30 ℃培养箱培养2 d。使用三区域划线对挑选的菌落进行纯化,使用甘油管藏法对其进行保藏。使用十六烷基三甲基溴化铵法(cetyltrimethylammonium bromide,CTAB)对分离株的DNA进行提取,随后进行PCR扩增,具体扩增体系及条件同1.3.1,将经1.0%琼脂糖凝胶电泳检测合格的PCR产物送往上海桑尼生物科技有限公司进行测序。将测序返回序列进行拼接和去除引物后于美国国立生物技术信息中心(NCBI)网站(https://www.ncbi.nlm.nih.gov/)进行基本局部比对搜索工具(basic local alignment search tool,BLSAT)比对,进而获得同源菌株序列,以MEGA5.0生物学软件的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.5 数据处理
使用Mann-Whitney检验对高温和中高温大曲优势菌属和种和COG不同分类单元进行显著性分析,使用R软件(v4.3.1)进行β多样性主坐标分析(principal co-ordinates analysis,PCoA)图、柱状堆积图、功能预测差异分析图和系统发育树的绘制,使用Galaxy网站(http://huttenhower.sph.harvard.edu/galaxy/)进行线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)图的绘制,使用Gephi软件对丰度排名前50属和种进行网络图的绘制。
2.1.1 高温和中高温大曲中菌落总数及乳酸菌菌落总数计数结果分析
高温和中高温大曲中菌落总数及乳酸菌总数的统计结果见图1。

图1 高温和中高温大曲中菌落总数(a)及乳酸菌总数(b)统计结果
Fig.1 Statistical results of total colonies counts(a)and total lactic acid bacteria counts(b)in high-and medium-high-temperature Daqu
由图1可知,高温大曲中菌落总数和乳酸菌菌落总数平均值分别为5.34 lg(CFU/g)和5.16 lg(CFU/g),而在中高温大曲中分别为6.71 lg(CFU/g)和6.33 lg(CFU/g),经Mann-Whitney检验发现,2种类型大曲菌落总数和乳酸菌菌落总数之间差异均极显著(P<0.01),说明发酵温度是大曲微生物的主要筛选指标,高温大曲的制作品温高达60 ℃左右,较高的温度会抑制乳酸菌等对温度耐受性较差微生物的生长,导致菌落总数和乳酸菌菌落总数较低,而中高温大曲的温度相对较低(60 ℃左右)[13],因此,中高温大曲菌落总数和乳酸菌菌落总数较高。
2.1.2 高温和中高温大曲细菌群落结构分析
本研究选取OTU代表性序列进行比对发现,2 400个平均相对含量>0.005%的OTU被鉴定为29个门、58个纲、84个目、189个科、389个属和420个种。基于门、属和种水平,对样品中平均相对含量>1%的细菌群落结构进行分析,结果见图2。
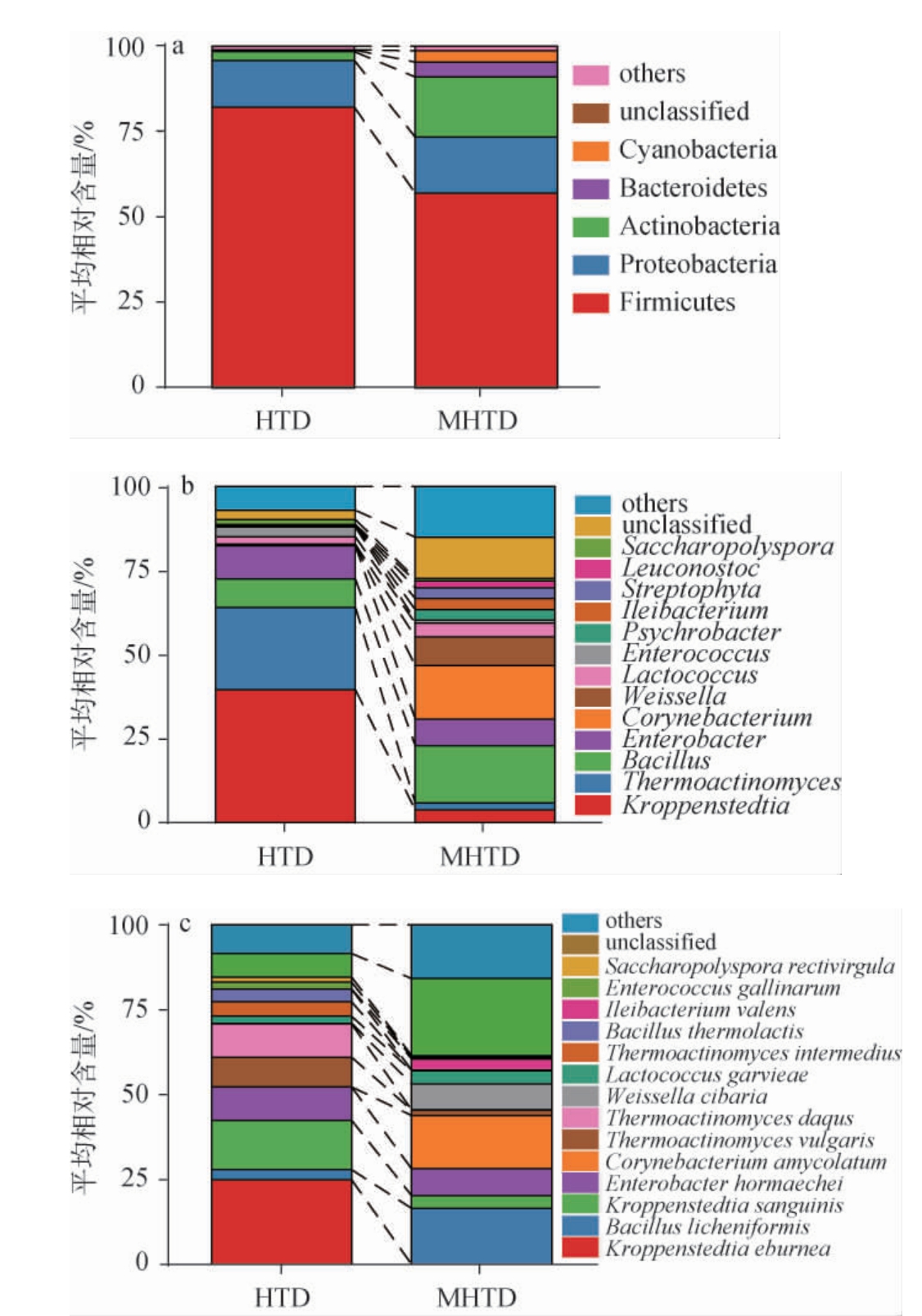
图2 基于门(a)、属(b)、种(c)水平高温和中高温大曲中细菌群落结构
Fig.2 Bacterial community structure in high- and medium-hightemperature Daqu based on phylum (a), genus (b) and species (c) levels
由图2(a)可知,在门分类水平上,平均相对含量>1%的优势细菌门有5个,2种类型大曲细菌菌群均以厚壁菌门(Firmicutes),变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和蓝菌门(Cyanobacteria)为主,其中Firmicutes在2种类型大曲中分别占比82.15%和57.04%,是纳入本研究大曲的绝对优势细菌门(每个样本均存在且平均相对含量>1%),与之前的研究结果一致[14]。 作为细菌域中的一个重要门类,Firmicutes广泛参与各种食品的发酵过程,同时其在代谢过程中能够产生乳酸、乙酸等有机酸,以及醇类、酯类、酮类等风味物质,对食品风味具有显著影响[15]。
由图2(b)可知,在属分类水平上,平均相对含量>1%的优势细菌属有13个,其中,高温大曲以克罗彭斯特菌属(Kroppenstedtia)和高温放线菌属(Thermoactinomyces)为主,平均相对含量分别为39.52%和24.51%,中高温大曲以芽孢杆菌属(Bacillus)、棒状杆菌属(Corynebacterium)和魏斯氏菌(Weissella)为主,平均相对含量分别为17.05%、15.94%和8.56%。ZHU C T等[16]对7个省份的大曲微生物群落和功能差异进行研究发现,Kroppenstedtia为高温大曲的核心产香功能微生物群,能够促进各种氨基酸和香气化合物的代谢;MAO F J等[17]研究亦发现,Kroppenstedtia的平均相对含量与己酸乙酯的含量呈正相关;Thermoactinomyces具有较强的耐热能力,同时因其具有独特的羧酸酯酶基因以及生产丁酸盐的完整途径而备受关注[18];Bacillus能够分泌淀粉酶、蛋白酶、脂肪酶、纤维素酶等功能性成分[19],从而对大曲的品质产生影响。由图1(c)可知,在种分类水平上,平均相对含量>1%的优势细菌种有8个,其中高温大曲主要以象牙色克罗彭斯特德菌(Kroppenstedtia eburnea)为主,平均相对含量为24.99%,中高温大曲主要以B.licheniformis为主,平均相对含量分别为16.50%。K.eburnea是不同地区高温大曲中常见的菌种[20-21],K.eburnean能够为大曲的发酵提供淀粉酶,赋予大曲更高的液化力[22],同时吴双全等[23]研究发现,K.eburnean能显著提高吡嗪类、酮类等挥发性风味化合物的产生,有利于酱香型白酒典型风味的形成。B.licheniformis已被发现是大曲中的主要微生物之一,能够为发酵过程提供蛋白酶和淀粉酶等丰富的酶系,对白酒风味的形成有积极作用[24],WANG P等[25]的研究发现接种B.licheniformis对大曲进行强化,调节了微生物群落代谢,同时能够显著提升芳香族化合物的含量。进一步经Mann-Whitney分析可知,K.eburnea、大曲高温放线菌(Thermoactinomyces daqus)和热酸芽孢杆菌(Bacillus thermolactis)在两种类型大曲中存在显著差异(P<0.05),表现为高温大曲中K.eburnea、T.daqus和B.thermolactis的平均相对含量分别为24.99%、9.82%和3.76%,而中高温大曲中平均相对含量为0.048%、0.037%和0。综上可知,2种类型大曲细菌群落结构之间存在明显差异。
2.1.3 高温和中高温大曲细菌群落差异分析
为了更直观的比较2种类型大曲细菌群落之间的差异,本研究基于平均相对含量>0.005%的OTU数据采用Bray-Curtis距离对样品进行主坐标分析,结果见图3。
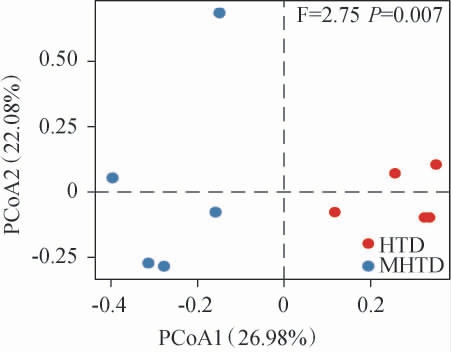
图3 基于高温和中高温大曲细菌菌群操作分类单元的主坐标分析结果
Fig.3 Principal coordinate analysis results of operational taxonomic units based on bacterial flora in high- and medium-hightemperature Daqu
由图3可知,在PCoA图中,高温大曲样品主要位于X轴正半轴,中高温大曲主要位于X轴负半轴,2种类型大曲样品在空间排布上呈现明显分离趋势,经PERMANOVA检验发现,2种类型大曲样品基于Bray-Curtis的细菌菌群结构存在极显著差异(P<0.01)。由此可见,2种类型大曲样品的细菌菌群间存在较大差异。
LEfSe分析能够对不同分类的菌群丰度差异进行甄别,线性判别分析(LDA)柱形图的长度代表该物种的差异影响大小,柱状长度越长表明该物种对组间差异的贡献值越大[26]。基于物种丰度矩阵通过LEfSe分析对2种类型大曲样品细菌菌群显著差异生物标志物(LDA>3,P<0.05)进行了分析,结果见图4。
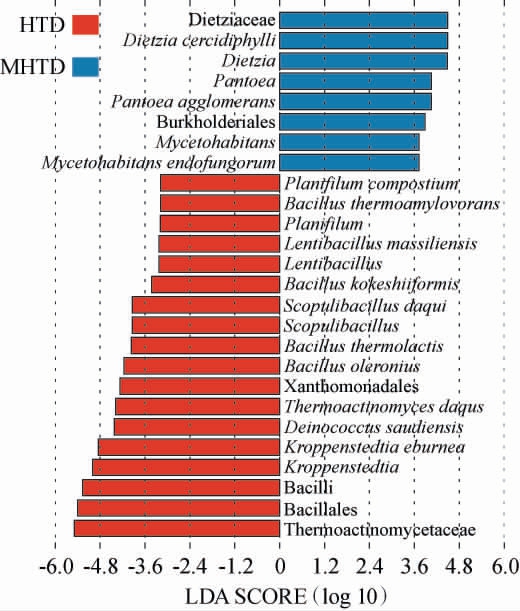
图4 高温和中高温大曲细菌线性判别分析结果
Fig.4 Linear discriminant analysis results of bacteria in high- and medium-high-temperature Daqu
由图4可知,在高温大曲中,除了K. eburnean、B. ther molactis和T.daqus这3个优势细菌种之外,还富集一些非优势物种如Planifilum compostium、热噬淀粉芽孢杆菌(Bacillus thermoamylovorans)、Lentibacillus massiliensis、木芥子形芽孢杆菌(Bacillus kokeshiiformis)、大曲岩石芽孢杆菌(Scopulibacillus daqui)、蔬菜芽孢杆菌(Bacillus oleronius)和Deinococcus saudiensis 等,而 仅Dietzia cercidiphylli 和Mycetohabitans endofungorum在中高温大曲中显著富集(P<0.05)。 根据LDA值的大小,可以将高温放线菌科(Thermoactinomycetaceae)和迪茨氏菌科(Dietziaceae)分别作为高温和中高温大曲的生物标志物。 综上可知,高温和中高温大曲之间细菌群落结构存在显著差异。随着制曲温度的升高,曲房环境中的湿度、氧气等也会相应的发生变化,无法适应该环境的细菌群落生长则受到抑制或者发生死亡[27],从而造成不同类型大曲细菌群落结构的差异,冯佳婷等[28]也证实了温度是造成不同类型大曲微生物群落组成存在差异的重要因素之一。
大曲样品细菌群落结构均较为复杂,它们之间的相互作用构成了一个复杂的生态系统。本研究进一步对高温和中高温大曲中平均相对含量排名前50的细菌种之间的相关性网络图进行了绘制,结果见图5。

图5 基于种水平高温(a)和中高温(b)大曲细菌相关性分析
Fig.5 Correlation analysis of bacteria in high- (a) and mediumhigh-temperature (b) Daqu based on species level
由图5(a)可知,高温大曲细菌种相关性网络图包含110条边,其中79个为正相关关系,31个为负相关关系;由图5(b)可知,中高温大曲细菌种相关性网络图包含166条边,其中164个为正相关关系,2个为负相关关系,可见绝大多数细菌种为正相关关系。相较于高温大曲,中高温大曲细菌群落间存在更加密切的相关性,说明中高温大曲细菌群落结构的稳定性更强,进一步证明温度的升高亦会抑制物种之间的相互作用,导致菌群的稳定性发生改变。
利用PICRUSt软件对大曲样品测序所得的OTU基因序列进行处理,进一步对COG功能进行注释,其功能预测结果见图6。
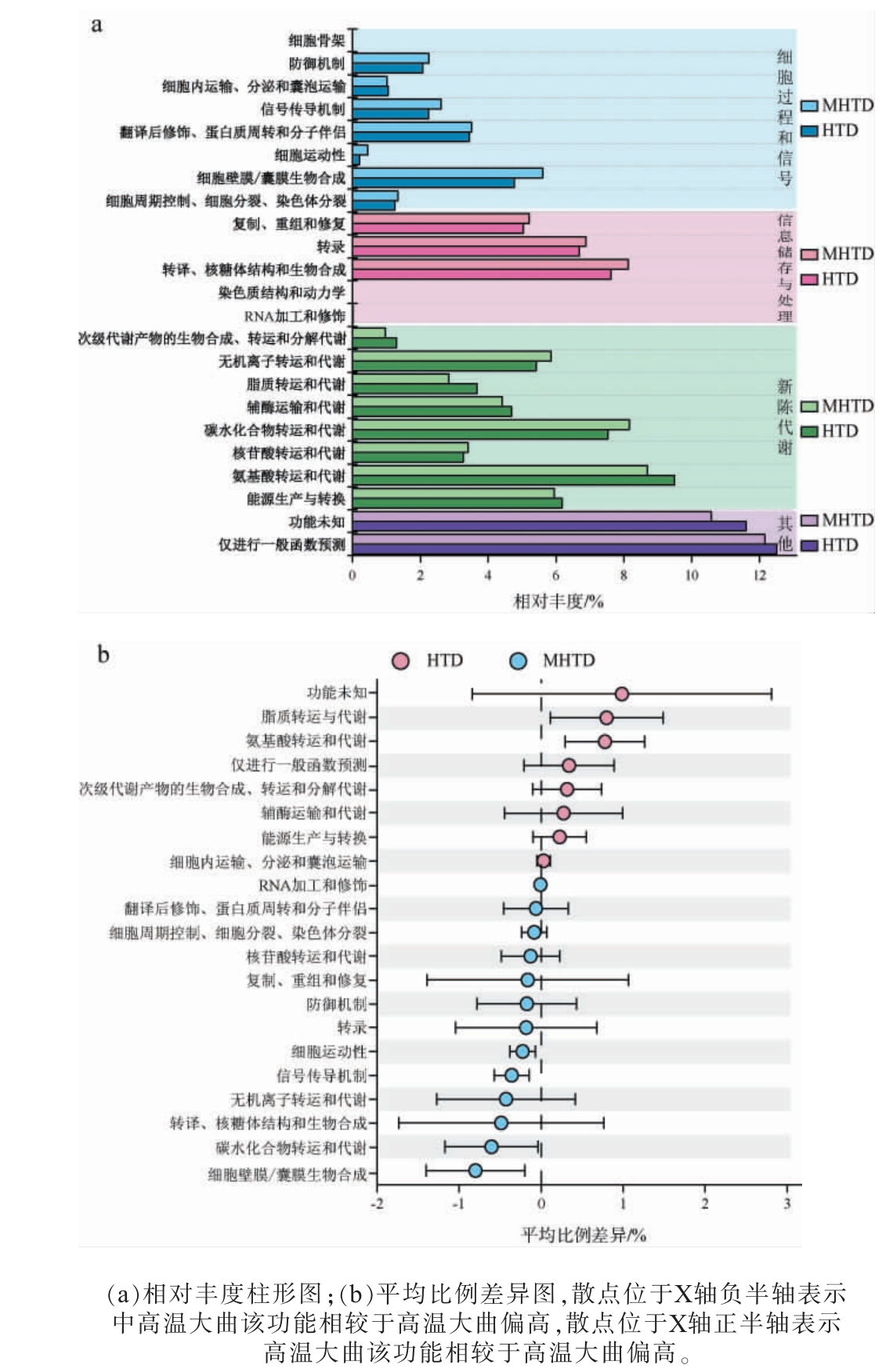
图6 高温和中高温大曲细菌基因功能预测结果
Fig.6 Prediction results of gene function of bacteria in high- and medium-high-temperature Daqu based on species level
由图6(a)可知,2种类型大曲样本得到的细菌COG功能预测信息构成相同,且都主要集中在功能未知和仅进行一般函数预测这2个COG类别中,其次是氨基酸转运与代谢,碳水化合物转运和代谢,转译、核糖体结构和生物合成和转录等方面,可见2种类型大曲样品在风味物质代谢和微生物生长繁殖方面具有较高表达。由图6(b)可知,不同COG功能类别在2种类型大曲中存在明显的差别,Mann-Whitney分析发现中高温大曲在碳水化合物的运输和代谢、细胞壁膜/囊膜生物合成、细胞运动性和信号传导机制这3个功能的平均相对丰度显著高于高温大曲(P<0.05),究其原因可能是,高温会对微生物的蛋白质和核酸结构造成破坏,从而影响物质运输与合成的效率[29]。碳水化合物的运输速率决定了其在生物体内的分布状况和可利用程度,这一因素进一步对风味物质的生成与积累产生影响[30],同时,碳水化合物的代谢过程,如糖酵解、三羧酸循环及磷酸戊糖途径等,会生成众多中间及最终代谢产物,这些产物在风味物质的形成与调节中具有重要作用。 此外,细胞壁膜或囊膜的成分与结构也对风味物质的形成具有明显影响。而高温大曲在氨基酸转运与代谢和脂质转运与代谢这2个功能的平均相对丰度显著高于中高温大曲,氨基酸与脂质的转运及其代谢过程对食品风味物质的构成与含量有着显著的影响,例如氨基酸不仅可以在转化过程中产生酯类、醇类等风味物质,还积极参与三羧酸循环,生成酮类、醛类等化合物[31],同时,脂质代谢所生成的代谢产物可能与其他风味成分相互作用,共同构建复杂多样的风味体系。 综上可知,中高温大曲与高温大曲在COG功能类别上存在明显差异,这些差异影响风味物质的生成与积累,其中,中高温大曲在碳水化合物相关功能上更为丰富,而高温大曲则在氨基酸与脂质代谢上更具优势。
本研究进一步通过传统微生物纯培养技术对大曲样品中的芽孢杆菌和乳酸菌进行了分离鉴定。 结果显示,从10块大曲样品中共分离鉴定得到114株分离株,其中84株为芽孢杆菌,30株为乳酸菌,随机挑选鉴定为同一个种的一株菌与其模式菌株构建系统发育树,结果见图7。
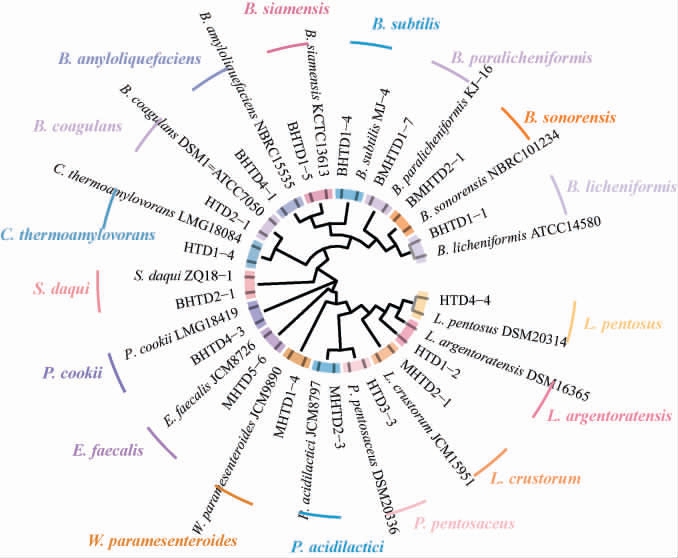
图7 基于16S rRNA基因序列部分菌株的系统发育树
Fig.7 Phylogenetic tree of some strains based on 16S rRNA gene sequences
由图7可知,所有分离株归属于9个属下的17个种,分别为隶属于Bacillus下的B. licheniformis、枯草芽孢杆菌(Bacillus subtilis)、索诺拉沙漠芽孢杆菌(Bacillus sonorensis)、凝结芽孢杆菌(Bacillus coagulans)、Bacillus amyloliquefaciens、暹罗芽孢杆菌(Bacillus siamensis)和副地衣芽孢杆菌(Bacillus paralicheniformis)共7个种,隶属于岩石芽孢杆菌属(Scopulibacillus)下的Scopulibacillus daqui,隶属于类芽孢杆菌属(Paenibacillus)下的库氏类芽孢杆菌(Paenibacillus cookii),隶属于热碱芽孢杆菌属(Caldalkalibacillus)下的热淀粉芽孢杆菌(Caldalkalibacillus thermoamylovorans),隶属于乳植物杆菌属(Lactiplantibacillus)下的斯特拉斯堡乳植物杆菌(Lactiplantibacillus argentoratensis)和戊糖乳植物杆菌(Lactiplantibacillus pentosus),隶属于Pediococcus的乳酸片球菌(Pediococcus acidilactici)和戊糖片球菌(Pediococcus pentosaceus),隶属于肠球菌属(Enterococcus)下的粪肠球菌(Enterococcus faecalis),隶属于Lactobacillus下的面包伴生乳杆菌(Lactobacillus crustorum),和隶属于魏斯氏菌(Weissella)下的类肠膜魏斯氏菌(Weissellaparamesenteroides)。基于纯培养技术高温和中高温大曲分离株结果见表1。
表1 高温和中高温大曲样品中分离菌株鉴定结果
Table 1 Identification results of isolated strains from high- and medium-high-temperature Daqu samples
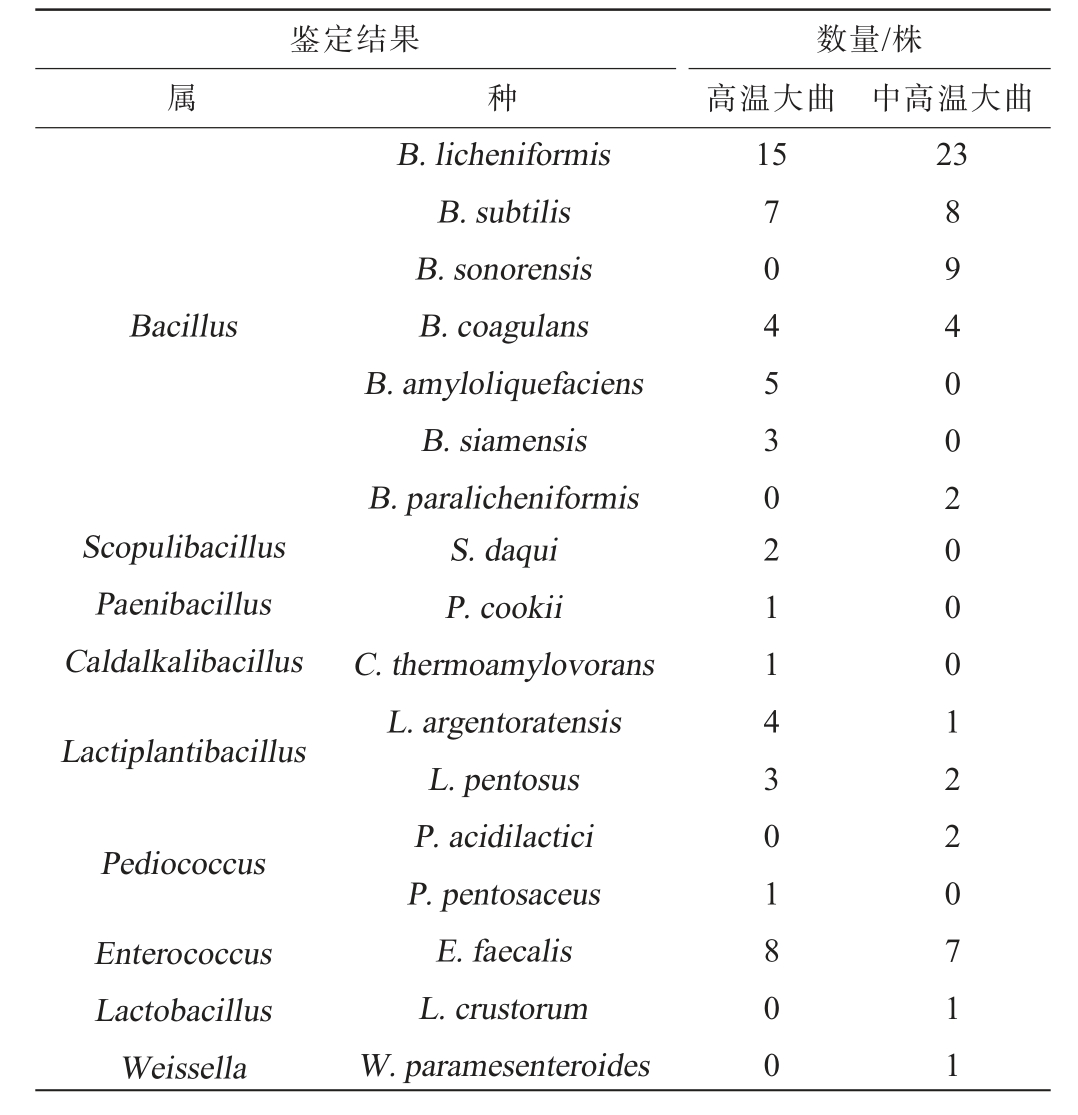
鉴定结果属种数量/株高温大曲 中高温大曲15 23 Bacillus Scopulibacillus Paenibacillus Caldalkalibacillus Lactiplantibacillus Pediococcus Enterococcus Lactobacillus Weissella B.licheniformis B.subtilis B.sonorensis B.coagulans B.amyloliquefaciens B.siamensis B.paralicheniformis S.daqui P.cookii C.thermoamylovorans L.argentoratensis L.pentosus P.acidilactici P.pentosaceus E.faecalis L.crustorum W.paramesenteroides 70453 0211 4301800 894002000122 0711
由表1可知,从高温、中高温大曲中共分离得到114株菌,隶属于9个属,17个种。其中,高温大曲中共得到54株分离株,其中隶属于Bacillus、Enterococcus、Lactiplantibacillus、Scopulibacillus、Caldibacillus、Paenibacillus和Pediococcus的菌株数量分别为34株、8株、7株、2株、1株、1株和1株,分别占分离株总数的63%、15%、13%、4%、2%、2%和2%,隶属于Bacillus的34株分离株中,共分离得出B. licheniformis、B.subtilis、B. amyloliquefaciens、B. coagulans 和B. siamensis 15株、7株、5株、4株和3株,可见高温大曲中分离株主要以Bacillus为主,且B.licheniformis为优势分离种。从中高温大曲中共得到60株分离株,其中隶属于Bacillus、Enterococcus、Lactiplantibacillus、Pediococcus、Weissella和Lactobacillus的菌株数量分别为46株、7株、3株、2株、1株和1株,分别占分离株总数的77%、12%、5%、3%、2%和2%,隶属于Bacillus的46株分离株中,共分离得出B.licheniformis、B.sonorensis、B.subtilis、B.coagulans和B.paralicheniformis 23株、9株、8株、4株和2株,可见中高温大曲中分离株亦主要以Bacillus为主,主要菌种为B.licheniformis。 进一步分析发现B.amyloliquefaciens、B. siamensis、S. daqui、C. thermoamylovorans、P. cookii 和P.pentosaceus仅在高温大曲中分离鉴定到,而B.sonorensis、B.paralicheniformis、P. acidilactici、W. paramesenteroides和L.crustorum仅在中高温大曲中分离鉴定到。导致酒曲中可培养微生物存在差异的原因可能是制曲温度导致的,为了避免烧曲,会对曲房进行通风和翻曲处理,翻曲则会导致曲房及曲块温度发生下降[32],而像P.acidilactici、W.paramesenteroides和L.crustorum这些乳酸菌对于高温的耐受性较差,所以在发酵温度更低、翻曲次数更多的中高温大曲中被分离出。 高温大曲的制曲温度较高,乳酸菌生长受到抑制,导致多样性降低,反而耐高温的芽孢杆菌多样性较高,杨阳等[33]研究发现,大曲细菌群落中的芽孢杆菌与乳酸菌之间多呈显著负相关,与本研究现象一致。综上可知,高温和中高温大曲可培养微生物存在差异。
通过第三代测序技术与传统微生物纯培养技术,深入探究了高温及中高温大曲的菌群特征。 研究结果表明,大曲样品中共鉴定出了5个优势菌门、13个优势菌属以及8个优势菌种。对不同类型大曲中的细菌多样性进行分析发现,Firmicutes为绝对优势细菌门(每个样本均存在且平均相对含量>1%)。 在属和种水平上,不同类型的大曲之间存在明显差异,高温大曲以Kroppenstedtia和K.eburnea为主,平均相对含量分别为39.52%和24.99%;而中高温大曲以Bacillus和B. licheniformis为主,其平均相对含量分别为17.05%和16.50%。Thermoactinomycetaceae和Dietziaceae分别可以作为高温大曲和中高温大曲的生物标志物。 纯培养技术的实验结果显示,无论是在高温大曲还是中高温大曲中,可培养的优势菌种均为B.licheniformis。 探究不同类型大曲微生物细菌多样性,可为白酒品质的提升提供数据支持,为大曲中特征微生物的资源开发和应用提供参考。
[1]YAN Q,ZHANG K,ZOU W,et al.Three main flavour types of Chinese Baijiu:Characteristics,research,and perspectives[J].J I Brewing,2021,127(4):317-326.
[2]LUO S,ZHANG Q, YANG F, et al.Analysis of the formation of sauceflavored Daqu using non-targeted metabolomics[J].Front Microbiol,2022,13:857966.
[3]XIA Y,LUO H,WU Z Y,et al.Microbial diversity in Jiuqu and its fermentation features:saccharification,alcohol fermentation and flavors generation[J].Appl Microbiol Biot,2023,107(1):25-41.
[4]XIAO C, LU Z M, ZHANG X J, et al.Bio-heat is a key environmental driver shaping the microbial community of medium-temperature Daqu[J].Appl Environ Microb,2017,83(23):01550-17.
[5]LIU Y,LI X,LI H,et al.Taorong-type Baijiu starter: Analysis of fungal community and metabolic characteristics of middle-temperature Daqu and high-temperature Daqu[J].Plos One,2022,17(10):0274881.
[6]张清玫,赵鑫锐,李江华,等.不同香型白酒大曲微生物群落及其与风味的相关性[J].食品与发酵工业,2022,48(10):1-8.
[7]孔祥聪,邢文慧,管桂坤,等.兰陵浓香大曲理化性质和细菌群落多样性研究[J].中国酿造,2023,42(7):126-131.
[8]张璋,赵腾飞,李红霞,等.产淀粉酶芽孢杆菌的分离鉴定、高温驯化及酶学性质研究[J].中国酿造,2023,42(9):79-84.
[9]LI Y L,SHUANG P, ZHANG S Y, et al.Spatiotemporal distribution of environmental microbiota in spontaneous fermentation workshop: The case of Chinese Baijiu[J].Food Res Int,2022,156(6):111126.
[10]唐佳代,赵益梅,冉光耀,等.基于第三代测序与理化指标评价不同压曲工艺酱大曲品质[J].中国酿造,2022,41(12):74-78.
[11]HAN P J, LUO L J, HAN Y, et al.Microbial community affects Daqu quality and the production of ethanol and flavor compounds in Baijiu fermentation[J].Foods,2023,12(15):2936.
[12]祁程,姜李欢,阿卜杜萨拉木·努尔麦麦提,等.基于SMRT测序技术的塔里木马鹿冬季肠道菌群多样性分析[J].野生动物学报,2024,45(1):58-66.
[13]WANG Y R,GAIJ S,HOU Q C,et al.Ultra-high-depth macro genomic sequencing revealed differences in microbial composition and function between high temperature and medium-high temperature Daqu[J].World J Microb Biot,2023,39(12):337.
[14]符漫,姜晨阳,田龙新,等.特香型白酒中高温和高温大曲细菌类群比较分析[J].中国酿造,2023,42(5):151-156.
[15]LIN L, WU J, CHEN X, et al.The role of the bacterial community in producing a peculiar smell in Chinese fermented sour soup[J].Microorganisms,2020,8(9):1270.
[16]ZHU C T, CHENG Y X, SHI Q L, et al.Metagenomic analyses reveal microbial communities and functional differences between Daqu from seven provinces[J].Food Res Int,2023,172(10):113076.
[17]MAO F J,HUANG J,ZHOU R Q,et al.Effects of different Daqu on microbial community domestication and metabolites in Nongxiang Baijiu brewing microecosystem[J].Front Microbiol,2022,13(6):939904.
[18]YANG Y,WANG S T,LU Z M,et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in mediumtemperature Daqu starter[J].Food Res Int,2021,140(2):110037.
[19]FAN G S,FU Z L,SUN B G,et al.Roles of aging in the production of light-flavored Daqu[J].J Biosci Bioeng,2019,127(3):309-317.
[20]XIA Y, ZHOU W, DU Y K, et al.Difference of microbial community and gene composition with saccharification function between Chinese Nongxiangxing Daqu and Jiangxiangxing Daqu[J].J Sci Food Agr,2023,103(2):637-647.
[21]YANG L,FAN W L,XU Y.Qu-omics elucidates the formation and spatio-temporal differentiation mechanism underlying the microecology of high temperature Daqu[J].Food Chem,2024,438:137988.
[22]ZHU Q, CHEN L, PENG Z, et al.The differences in carbohydrate utilization ability between six rounds of sauce-flavor Daqu[J].Food Res Int,2023,163:112184.
[23]吴双全,柴丽娟,黄廷财,等.酱香型白酒堆积酒醅中象牙色克罗彭斯特菌的分离筛选及其代谢特性解析[J].微生物学报,2024,64(7):2502-2521.
[24]LI H, LIU S, LIU Y, et al.Functional microorganisms in Baijiu Daqu:Research progress and fortification strategy for application[J].Front Microbiol,2023,14(1):1119675.
[25]WANG P, WU Q, JIANG X J, et al. Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].Int J Food Microbiol,2017,250:59-67.
[26]王妍凌,薛洁,赵昊,等.高通量测序分析新疆不同产区葡萄酒对大鼠肠道菌群多样性的影响[J].中国酿造,2023,42(2):83-88.
[27]LEI Y, CAI W, WANG Y, et al.Elucidating the physicochemical parameters, bacterial community structure, and correlation characteristics of medium-high temperature Daqu[J].Food Biosci,2024,58(4):103679.
[28]冯佳婷,陆震鸣,时伟,等.不同培养温度对大曲微生物群落结构、酶活及挥发性化合物的影响[J].应用与环境生物学报,2021,27(3):760-767.
[29]SOMERO G N.The cellular stress response and temperature:Function,regulation,and evolution[J].J Exp Zool Part A,2020,333(6):379-397.
[30]FENG L,TANG N,LIU R,et al.The relationship between flavor formation, lipid metabolism, and microorganisms in fermented fish products[J].Food Funct,2021,12(13):5685-5702.
[31]MAOZ I, LEWINSOHN E, GONDA I.Amino acids metabolism as a source for aroma volatiles biosynthesis[J].Curr Opin Plant Biol,2022,67(6):102221.
[32]ZHOU Q,MA K,SONG Y, et al.Exploring the diversity of the fungal community in Chinese traditional Baijiu Daqu starters made at low-,medium-and high-temperatures[J].LWT-Food Sci Technol,2022,162(6):113408.
[33]杨阳,禄凌飞,刘光钱,等.不同发酵顶温大曲中细菌群落结构的差异性分析[J].食品与发酵工业,2023,49(13):70-77.