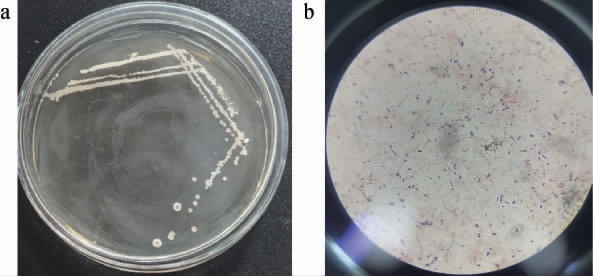
图1 菌株YH403的菌落(a)和细胞(b)形态特征
Fig.1 Morphological characteristics of colony (a) and cell (b) of strain YH403
Screening and identification of acetoin-producing Bacillus and effects of different inoculation time on solid-state fermentation of fermented grains
酱香型白酒的酿造过程具有四高两长的特点,而芽孢杆菌(Bacillus)因其耐高温的特性在高温制曲和高温堆积这两个阶段成为了优势细菌[1-2],芽孢杆菌能合成多种酶类,如能够将淀粉催化分解为小分子糖的淀粉酶,以及可以将蛋白质降解为氨基酸类物质的蛋白酶等,这些物质能为微生物的生长提供底物。 在芽孢杆菌的生长代谢中,还会产生一系列风味物质的前体物,而在众多物质中,乙偶姻作为酱香型白酒中的一种关键风味前体物质在当前的研究中备受关注,其能与胞外氨反应生成白酒中的健康因子四甲基吡嗪,对稳定白酒的风味和品质发挥了重要作用。李晨瑶[3]从酱香型大曲中筛选得到6株芽孢杆菌,结果表明,芽孢杆菌DQ-B6在接种量为5%时乙偶姻含量最高,为5.02 g/L。 康雪梅等[4]从醋醅中分离出一株中村芽孢杆菌(Bacillus nakamurai)K11,经LB培养基培养48 h后,乙偶姻含量达47.71 mg/L。DAN H等[5]在酒醅中接种枯草芽孢杆菌(Bacillus subtilis)JP1,发现微生物间的相互作用增强,促进了庚酸、己酸丁酯的产生。然而值得注意的是,酒醅中的风味物质并非由单一菌株产生的,而是以微生物组共同代谢合成的,来源于不同环境的微生物通过繁殖和对环境的适应在酒醅中定殖[6],随后在非生物因素(如温度、水分、pH值)和微生物相互作用[7-8]的影响下逐渐演替成具有酿造功能的微生物群。
随着微生态学的持续发展,近年来有研究表明,微生物群落的组成往往受到物种到达时间的影响[9]。SVOBODA P等[10]通过对两个不同来源细菌群落进行移植实验发现,本地群落的接种时间越晚,其对最终群落组成的贡献就越小。NAPPI J等[11]研究了两种具有优先效应的菌株对绿藻微生物功能的影响,结果表明,这些菌株对抗生素耐药性基因的富集和II型分泌系统基因的缺失产生了影响。由此可见,在一个生态系统中先到达的物种会利用营养资源以及改变生态位,使后来物种到达时的环境发生改变,影响后到达物种的定殖以及后续微生物间的相互作用,从而使系统最终的微生物群落结构和功能发生改变。目前在白酒领域已有学者对不同初始条件下酒醅中微生物群落的构建情况以及代谢产物的变化情况进行了研究,比如较高的初始发酵温度会加快乳酸菌的演替,提高酸类物质的含量,降低酯类物质的含量[12]。小曲酒发酵过程中随着初始含水率的增加,微生物群形成得更快,乙酸乙酯和乳酸乙酯的含量增加[13]。但白酒发酵过程中同样存在物种到达时间不一致的情况,对于白酒发酵中由物种到达时间造成的酒醅群落结构和功能改变的研究还鲜有报道。
本研究从酱香型白酒酒醅中筛选产乙偶姻芽孢杆菌,并经过形态学观察及分子生物学技术鉴定筛选菌株。以未接菌的酒醅为对照,在酒醅不同发酵时间(12 h、24 h、48 h)将筛选菌株接种于酒醅固态发酵体系中,探究其不同接种时间对酒醅发酵过程中理化指标、有机酸含量及挥发性风味物质的影响。旨在表明其在发酵过程中接种的最佳时间并应用到生产中,以期改善白酒风味,为白酒发酵过程的调控技术提供理论参考。
1.1.1 材料
酱香型白酒酒醅、高温大曲:四川省某酱香白酒厂。
1.1.2 试剂
氯化钠(分析纯):成都市科隆化学品有限公司;1-萘酚、肌酸一水(均为分析纯):上海生工生物工程股份有限公司;乙酸戊酯、亚甲基蓝(均为分析纯):Adamas试剂有限公司;匹马霉素(1 500~1 750 U/mg):上海源叶生物科技有限公司;有机酸标品(均为色谱纯):成都德思特生物技术有限公司。
1.1.3 培养基
营养肉汤(nutrient broth,NB)培养基:杭州百思生物技术有限公司;马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:北京奥博星生物技术有限责任公司;酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:青岛高科技工业园海博生物技术有限公司。 按说明书称取一定质量,加水加热溶解后,分装于三角瓶中,于121 ℃灭菌20 min。
溶菌肉汤(lysozyme broth,LB)培养基:胰蛋白胨10 g/L,酵母提取物5g/L,NaCl10g/L,琼脂15g/L。121℃灭菌20min。
高粱固体发酵培养基:称取50 g高粱(干质量),按照每一粒高粱被粉碎为三瓣的标准用粉碎机粉碎15 g,以70%整粒高粱、30%粉碎高粱的比例混合后,于干净容器中,加入95 ℃以上的热水30 mL,密封贮藏16 h进行润粮,润粮时翻拌均匀。润粮结束过后,用两层白纱布包裹高粱,放入锅中进行蒸煮糊化约2 h。 按照高粱大曲1∶1的比例,加入50 g大曲粉,一起装入三角瓶中,补充30 mL去离子水,搅拌均匀后用封口膜封住三角瓶放入培养箱进行培养。
SW-CJ-2FD 净化工作台:苏州净化设备有限公司;GI54DS立式自动压力蒸汽灭菌锅:致微(厦门)仪器有限公司;ZWYR-D2403恒温培养振荡器:上海智城分析仪器制造有限公司;LS-l201生化培养箱:美国FisherScientific公司;7890A/5975B气相色谱-质谱联用(gas chromatographymass spectrography,GC-MS)仪:美国Agilent公司;ST2100实验室pH计:奥豪斯仪器(常州)有限公司;DM500光学显微镜:德国徕卡公司;LC-2030C 3D Plus高效液相色谱(high performance liquid chromatography,HPLC)仪:岛津企业管理(中国)有限公司。
1.3.1 芽孢杆菌菌株的分离及纯化
取15 g高粱固体发酵培养基酒醅样品分别加入300 mL已灭菌的PDB、NB、YPD、LB四种培养基中,随后向各培养基内添加0.03 g匹马霉素,于37 ℃、160 r/min条件振荡培养24 h,即得细菌富集液。 在超净工作台内,将富集液进行梯度稀释,使其浓度达到10-3至10-7的菌悬液标准。 用移液枪吸取0.2 mL菌悬液涂布于PDB、YPD、NB、LB琼脂培养基上,放置在37 ℃的培养箱中,倒置培养36 h[14]。 依据芽孢杆菌的菌落形态特征,挑取形态存在差异的菌落,通过多次重复划线纯化操作,最终得到单菌株。
1.3.2 产乙偶姻芽孢杆菌菌株的筛选将1-萘酚1g、肌酸0.1 g以及NaOH 4g混合配制成100 mL肌酸混合液。将上述从酒醅中分离筛选的菌株,用接种环轻轻刮取一环菌置于装有1 mL肌酸混合液的试管内,若该肌酸混合液能够迅速呈现红色,则此菌株即为可产乙偶姻的细菌[14]。
1.3.3 产乙偶姻芽孢杆菌菌株的鉴定
形态学观察:挑取经分离筛选得到的单菌株,在LB培养基平板上进行划线接种,在37℃培养箱中倒置培养12h后,观察单菌落的颜色、大小、表面质地、边缘、透明度等特征。采用革兰氏染色法染色后在显微镜下观察其细胞形态特点。
分子生物学鉴定[15]:采用通用型脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒对菌株DNA进行提取,以提取的筛选菌株的DNA样品为模板,细菌通用引物27(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')为引物,加入一定量 的1×TSE101金牌Mix进行聚合酶链式反应(polymerase chain reaction,PCR)扩增16S rRNA基因序列。 PCR扩增体系(50 μL):1×TSE101金牌Mix45μL,27F(10pmol/L)2μL,1492R(10pmol/L)2 μL,DNA模板1 μL。PCR扩增程序:98 ℃预变性3 min;98 ℃变性3 min,55 ℃退火15 s,72 ℃延伸15 s,共39次循环;72 ℃再延伸5 min。 PCR扩增产物用琼脂糖凝胶电泳进行验证,由北京擎科生物科技股份有限公司实施序列分析工作。测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库,借助基本局部比对搜索工具(basiclocalcomparisonsearch tool,BLAST)开展同源性比对分析,进而得到相似度最高的序列信息。采用MEGA7.0软件中邻接(neighbor joining,NJ)法构建系统发育树。
1.3.4 酒醅固态发酵实验
将从酒醅中筛选得到的菌株接至斜面,37 ℃培养2 d后,每支试管用10 mL灭菌生理盐水洗脱,得到菌悬液。使用血球计数板对菌悬液进行计数,根据计数结果适当稀释,使最终细菌数为106 CFU/mL,最后取10 mL作为接种剂。
将50 g粉碎后的高粱蒸煮糊化后加入50 g大曲,用玻璃棒搅匀后分装至灭菌的三角瓶中。共设置一个空白组(CK)(不接菌)和3个实验组:EA(发酵12 h后接种)、EB(发酵24 h后接种)、EC(发酵48 h后接种),3个实验组分别加入10 mL筛选菌株菌悬液,空白组补充10 mL水分。模拟酱香型白酒实际生产中堆积酒醅的温度变化,设置初始温度为26 ℃,培养1 d后以12 ℃/d上升至50 ℃,最后以50 ℃持续至第5天。每组在培养第0、1、3、5天时取出样品进行理化指标、有机酸含量及挥发性风味物质检测。
1.3.5 分析检测
(1)酒醅的理化指标
pH值、总酸、水分、还原糖含量的测定:分别参考GB 5009.237—2016《食品pH值的测定》、GB 12456—2021《食品中总酸的测定》、GB 5009.3—2016《食品中水分的测定》、GB5009.7—2016《食品中还原糖的测定》中的方法进行测定。
(2)酒醅的有机酸含量
有机酸含量的测定采用HPLC法[16]。
定性定量方法[15]:根据标准品出峰的保留时间对酒醅中有机酸进行定性分析;采用外标法定量,以标准品的质量浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制有机酸标准曲线,通过标准曲线回归方程计算样品中各有机酸含量。
(3)酒醅的挥发性风味物质
挥发性风味物质测定采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)-GC-MS法[15]。
样品前处理:称取2g酒醅放入顶空萃取瓶中,吸取20μL质量浓度为1.05 g/L乙酸正戊酯作为内标物,使用保鲜膜封口后盖上盖子,放入萃取装置60 ℃下预热10 min后插入萃取头(50/30 μm,DVB/CAR/PDMS)萃取50 min,萃取后将萃取头插入GC-MS进样口解吸5 min,随后进行GC-MS分析。
气相色谱条件:DB-1MS熔断石英毛细管色谱柱(60 m×0.25 mm×0.25 μm);升温程序为45 ℃保持1 min,再以5 ℃/min升温至190 ℃,保持25 min,总运行时间为55 min;不分流;载气为高纯氦气(He),流速为1.0 mL/min。
质谱条件:离子源温度设定为230 ℃,四极杆温度为150 ℃,离子化方式采用电子电离(electronic ionization,EI)源,电子能量70 eV,质量扫描范围为45~500 amu。
定性定量方法:检测挥发性风味成分的保留时间和质谱数据,与相关文献以及美国国家标准技术研究所(national institute of standards and technology,NIST)05质谱库进行匹配定性,仅报道匹配度>90%的化合物;采用内标法进行定量。
1.3.6 数据处理
实验数据采用Excel 2021进行处理,使用Origin 2022、R语言4.2.2及Gephi 0.9.2软件作图。
将酒醅样品富集培养、分离纯化后,根据细菌群落形态特征,选取不同形态群落在培养基平板上进行划线,置于37 ℃培养箱中倒置培养12 h后,挑取细菌单菌落,用接种环刮一小环菌于装有1 mL肌酸混合液的试管中,最终在LB培养基上获得了一株能使肌酸液迅速变红的产乙偶姻菌株,编号为YH403。
2.2.1 菌株YH403形态学观察
将筛选得到的产乙偶姻菌株YH403分离纯化后,进行特征菌落形态和细胞形态观察,结果见图1。 由图1a可知,菌株YH403的菌落外形为圆形,色泽呈乳白色,质地不透明,黏稠,表面向上隆起,边缘轮廓不规则。 由图1b可知,菌株YH403细胞形态小(1.5~3.5 μm),呈杆状,经过革兰氏染色处理后,菌体呈现为紫色,由此可判定菌株YH403属于革兰氏阳性菌。

图1 菌株YH403的菌落(a)和细胞(b)形态特征
Fig.1 Morphological characteristics of colony (a) and cell (b) of strain YH403
2.2.2 菌株YH403分子生物学鉴定
对来自产乙偶姻菌株YH403的16S rRNA基因片段进行测序,将拼接好的序列在NCBI数据库(blast.ncbi.nlm.nih.gov)中进行BLAST比对,获得与测序菌株相近的种、属序列,通过NJ 法构建菌株YH403的系统发育树,结果见图2。由图2可知,菌株YH403与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)同属一个分支,亲缘关系最近,再结合菌株YH403的形态学观察,菌株YH403被鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。

图2 基于16S rRNA基因序列菌株YH403的系统进化树
Fig.2 Phylogenetic tree of strain YH403 based on 16S rRNA gene sequence
为了探究菌株YH403不同接种时间对酒醅发酵过程中理化指标的影响,对酒醅发酵第0、1、3、5天时的水分、pH值、酸度、还原糖进行测定,结果见图3。由图3a可知,CK组和三个实验组的水分在发酵过程中都呈上升趋势,但空白组的水分整体低于实验组,发酵结束时空白组的水分为54.65%,而实验组的水分为56.09%~56.95%,可能是由于实验组接种菌株YH403后其通过分泌多种酶促进了底物的分解,在发酵过程中产生的水分更多[17]。由图3b可知,酒醅的pH值除EC组外都呈先下降后上升的趋势,而EC组的pH值在整个发酵过程一直下降。

图3 菌株YH403不同接种时间对酒醅发酵过程中理化指标的影响
Fig.3 Effects of different inoculum time of strain YH403 on physicochemical indexes of fermented grains during fermentation process
由图3c可知,空白组、EA和EB组的酒醅总酸含量先上升后下降而EC组持续上升,在发酵过程中实验组的总酸含量整体上均低于空白组,其中CK组的总酸含量最大值达到了1.36 mmol/10 g,但发酵结束时EC组的总酸含量最高,为1.37 mmol/10 g,EA和EB组总酸含量最大值分别为1.22 mmol/10 g、0.95 mmol/10 g,可能是由于解淀粉芽孢杆菌可以通过分泌脂肽类物质抑制产酸菌从了降低酸类物质含量[18]。由图3d可知,发酵过程中EA组的还原糖含量波动较大,其余组的还原糖含量先下降后上升,但发酵结束时CK组和实验组酒醅的还原糖含量均有所上升,且空白组的还原糖含量小于实验组,在不同时间接种可能会使微生物间的相互作用不同,从而影响微生物产生和消耗还原糖的能力[19]。接种菌株YH403后实验组酒醅中的水分含量均有所增加,EA和EB组的最终pH值较空白组均有所上升而总酸含量下降,其中EC组的最终水分、总酸和还原糖含量均最高,分别为56.95%、1.37 mmol/10 g、3.46 g/100 g,pH值最低,为3.97。
为了探究菌株YH403不同接种时间对酒醅发酵过程中有机酸含量的影响,采用高效液相色谱对酒醅发酵过程中有机酸进行测定,结果见图4。由图4a可知,L-乳酸在三个实验组中的含量均高于CK组,发酵结束时相较于空白组分别提高了200.66 mg/100 g、137.66 mg/100 g、310.27 mg/100 g。L-乳酸作为白酒中的骨架酸能减轻白酒的糙辣感和苦味[20-21],使酒体更加协调,同时还能调节微生物的生长[22]。由图4b可知,发酵过程中乙酸在CK组中呈下降趋势,在实验组中呈先下降后上升的趋势,发酵结束时实验组的乙酸含量都高于CK组且EA组的乙酸含量最高。 乙酸可以作为合成丁酸和己酸的底物[23],有研究发现较高浓度的乙酸能够抑制大肠杆菌的生长[24],同时乙酸还具有保健功能,有降低胆固醇,使毛细管扩张等功能[25]。由图4c可知,各组的琥珀酸含量在发酵过程中先减少后增加,发酵结束时EA和EC组中琥珀酸含量高于其余两组,并且EB组中琥珀酸的含量最低。由图4d和4e可知,在三个实验组中的含量是先减少后增加的,发酵结束时柠檬酸和L-苹果酸的含量分别在EC组和EA组中的含量最高。琥珀酸、柠檬酸和L-苹果酸是TCA循环的重要产物,琥珀酸具有贝类特有的鲜味[26],柠檬酸具有螯合金属离子的作用[27],L-苹果酸具有止咳以及治疗高血压的功效[28],这几种有机酸对白酒的风味和品质起着重要作用[29]。由图4f可知,各组中的草酸含量均呈先下降后上升的趋势,并且第5天在EA组中的含量最高。结果表明,在三个时间点接种菌株YH403对除琥珀酸外的其余6种有机酸的合成均有促进作用,但在发酵12 h后接种菌株YH403对乙酸、琥珀酸、L-苹果酸和草酸合成的促进效果最明显,而在发酵48 h后接种对L-乳酸合成的促进最突出。
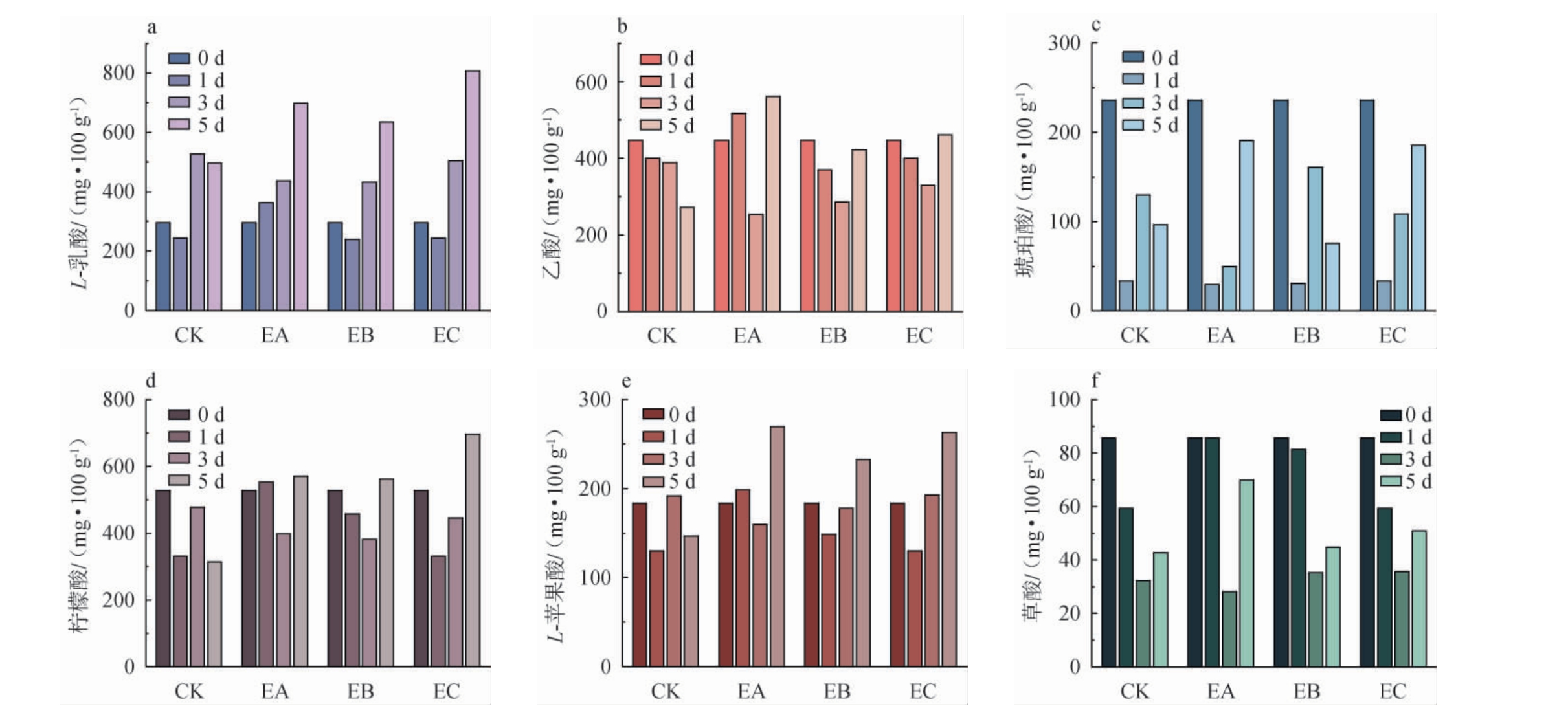
图4 菌株YH403不同接种时间对酒醅发酵过程中有机酸含量的影响
Fig.4 Effects of different inoculum time of strain YH403 on organic acids contents in fermented grains during fermentation process
采用HS-SPME-GC-MS对CK、EA、EB、EC组酒醅发酵过程中挥发性风味物质进行测定,各类别挥发性风味物质含量及聚类分析结果见图5。由图5a可知,发酵结束时,相较于空白组,三个实验组的总挥发性风味物质含量均得到了提升,CK、EA、EB、EC的总挥发性风味物质含量分别为40.78 mg/L、66.39 mg/L、75.18 mg/L、50.51 mg/L,说明在发酵24 h接种菌株YH403对酒醅总挥发性风味物质的含量提升效果最好。
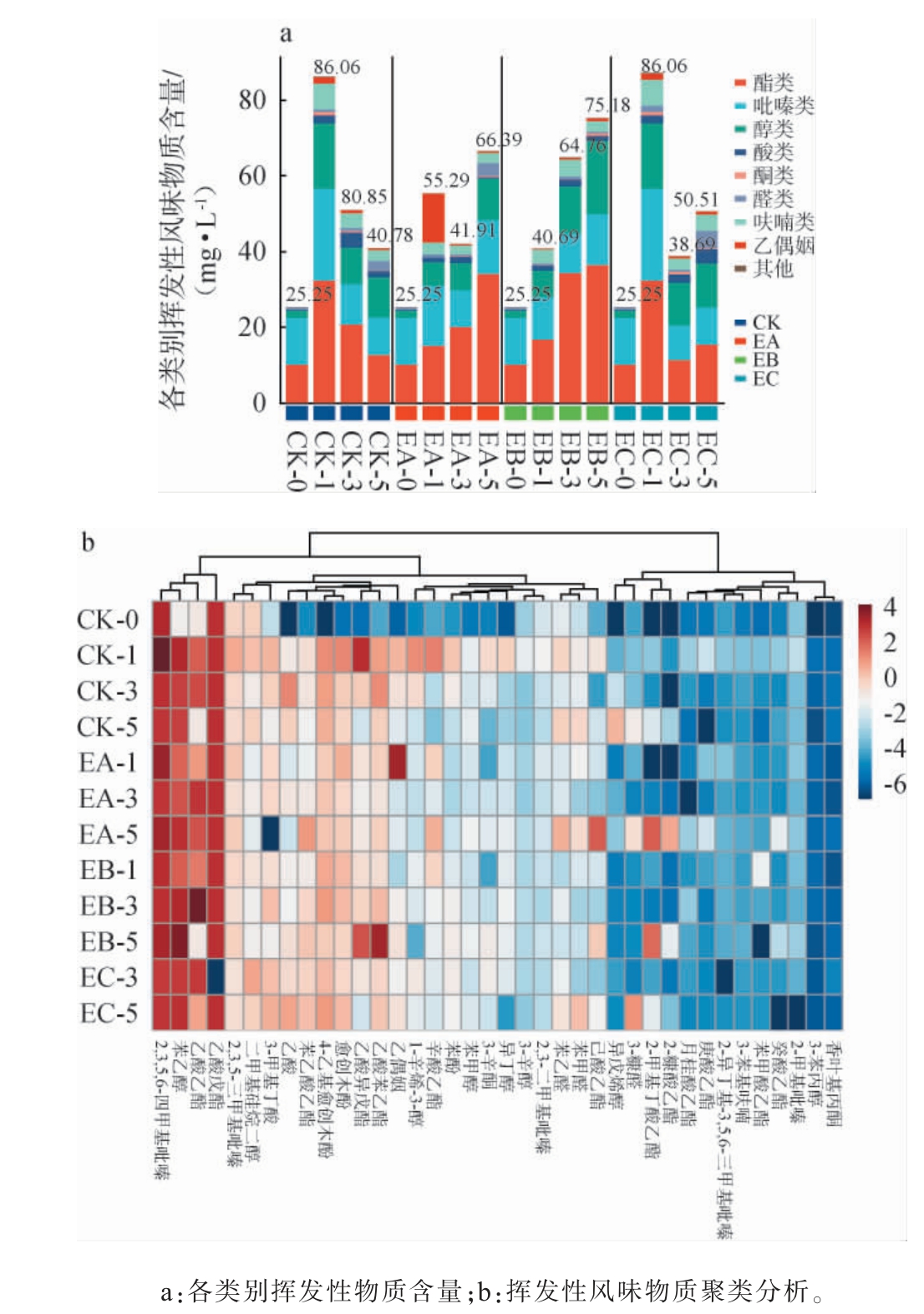
图5 菌株YH403不同接种时间对酒醅发酵过程中挥发性风味物质含量的影响
Fig.5 Effects of different inoculum time of strain YH403 on volatile flavor substances contents in fermented grains during fermentation process
由图5b可知,CK、EA、EB、EC样品共检测出38种挥发性风味物质,其中酯类13种,醇类8种,吡嗪类5种,酚类和醛类各3种,酸类和酮类各2种,乙偶姻以及其他类1种。 在接种菌株YH403酯类含量均得到了提升,比如辛酸乙酯、己酸乙酯、乙酸乙酯、庚酸乙酯、苯乙酸乙酯、2-甲基丁酸乙酯,尤其在EB组中的提升最为明显,达到了36.34 mg/L,这些酯类物质对酱香型白酒中的水果香、甜香以及花香等香味特征有较大贡献[30-31],是酱香型白酒中的关键风味化合物[32]。 EA和EB组中的吡嗪类物质相较于空白组提升较为明显,分别为14.24 mg/L和13.47 mg/L,特别是2,3,5,6-四甲基吡嗪和2,3,5-三甲基吡嗪的含量在这两组中均得到了提升,吡嗪类化合物具有独特的坚果香、烘焙香等独特的风味特性,对酱香型白酒的风格有重要贡献,同时也有研究表明[33-34],吡嗪类化合物具有减轻酒精伤害、提高人体机能和预防疾病等功能,是白酒中的健康因子。醇类物质在EB组中得到了明显提升,达到了19.36 mg/L,而EA和EC组中醇类物质含量相较于CK组的10.71 mg/L来说提升不明显,分别为11.06 mg/L和11.64 mg/L。 值得注意的是,EC组中的酸类物质和醛类物质增幅较大,分别达到了3.71 mg/L和4.59 mg/L,是CK组含量的两倍。 乙偶姻作为合成吡嗪类化合物的前体物质,在发酵中呈现先增后减的趋势且实验组中的含量高于空白组,但在EA组的提升不显著,为0.36 mg/L,而EB和EC较CK和EA提高了两倍,均为0.73 mg/L。 综上,在发酵24 h接种菌株YH403促进了酯类、吡嗪类、醇类及乙偶姻的生成,使酒醅的风味物质含量更为丰富。
风味物质的合成通常存在伴生关系,微生物代谢时一条代谢途径常涵盖多种物质的合成,新合成的物质可能干预微生物的物质能量代谢,进而影响其他物质的合成,所以探究不同接种时间对挥发性风味物质伴生关系的影响,可以更好的理解风味物质在合成过程中的潜在联系。通过共现网络分析对比了空白组、EA、EB、EC三个实验组挥发性风味物质网络的差异,其中线条颜色代表该模块的挥发性风味物质与模块内其他挥发性风味物质或其他模块内的挥发性风味物质的潜在联系,结果见图6。 由图6可知,空白组挥发性风味物质网络有33个点和121条边,模块化系数为0.24,苯乙醇、辛酸乙酯、3-辛酮、苯酚与较多挥发性风味物质关联紧密。 EA组的网络有34个点和80条边,模块化系数为0.85,辛酸乙酯、己酸乙酯同较多挥发性风味物质关联紧密。 EB组的网络有33个点和108条边,模块化系数为0.46,二甲基硅烷二醇、苯乙醇、苯甲醇与较多挥发性风味物质关联紧密。EC 组的网络有35个点和103条边,模块化系数为0.61,苯乙醇、辛酸乙酯、己酸乙酯与较多挥发性风味物质关联紧密。虽然网络中空白组与实验组的点无较大差异,但空白组的边数高于实验组且EC组中正相关的占比增大,这表明接种菌株YH403后与酒醅中的微生物发生相互作用影响了微生物的代谢从而使挥发性风味物质的网络更加稳定同时也使EB中物质间的协同关系增强。 此外,模块化指数常用于衡量网络图结构的模块化程度,模块化系数越高网络越稳定[35],3个实验组的模块化指数都大于空白组,其中EA组的模块化指数最大且边最少。结果表明,在发酵12 h接种菌株YH403提高了其发酵过程挥发性风味物质合成的稳定性还降低了EA组挥发性风味物质合成的复杂性。

图6 挥发性风味物质的共现网络分析
Fig.6 Co-occurrence network analysis of volatile flavor substances in fermented grains
本研究从酱香型酒醅中筛选出一株解淀粉芽孢杆菌YH403,探究在不同时间接种菌株YH403对固态发酵的影响。 结果表明,菌株YH403在24 h接种时对酒醅的理化、有机酸和风味物质有明显的促进作用。在发酵24 h接种菌株YH403后相较于空白组,酒醅的水分、pH值和还原糖均有所提升,总酸含量有所下降,促进了酒醅中L-乳酸、乙酸、琥珀酸、柠檬酸和L-苹果酸的合成均有促进作用。 同时,在发酵24 h接种菌株YH403的酒醅中总挥发性风味物质的含量提升最明显,尤其是酯类、吡嗪类、醇类及乙偶姻的含量有明显提高,此外,乙偶姻含量是空白组的两倍,并且挥发性风味物质合成的稳定性也有所提升。
[1]王清龙,朱甜甜,刘延波,等.白酒生产不同酒曲微生物群落结构、理化指标及挥发性风味物质研究[J].中国酿造,2023,42(7):93-102.
[2]李子健,黄丹,张曼,等.中高温大曲中两株耐热霉菌的分离鉴定及产酶特性比较[J].食品与发酵科技,2020,56(3):1-7.
[3]李晨瑶.贝莱斯芽孢杆菌在酱香型白酒生产中的作用[D].天津:天津科技大学,2023.
[4]康雪梅,罗雯,郭建,等.固态食醋自然发酵醋醅中生淀粉酶产生菌的筛选及初步应用[J].中国调味品,2023,48(10):78-84.
[5]DAN H,SONG X,XIANG G,et al.The response pattern of the microbial community structure and metabolic profile of jiupei to Bacillus subtilis JP1 addition during Baijiu fermentation[J].J Sci Food Agr,2024,104(9):5021-5030.
[6]SUN C, ZHANG B, NING D, et al.Seasonal dynamics of the microbial community in two full-scale wastewater treatment plants:diversity,composition, phylogenetic group based assembly and co-occurrence pattern[J].Water Res,2021,200:117295.
[7]WANG M Y,CHEN H B,CHANG S.Linkage among the combined temperature-retention time condition,microbial interaction,community structure,and process performance in the hydrolysis of waste activated sludge[J].Bioresource Technol,2021,331:125029.
[8]ROMDHANE S,SPOR A,AUBERT J,et al.Unraveling negative biotic interactions determining soil microbial community assembly and functioning[J].ISME J,2022,16(1):296-306.
[9]DEBRAY R,HERBERT R A,JAFFE A L,et al.Priority effects in microbiome assembly[J].Nat Rev Microbiol,2022,20(2):109-121.
[10]SVOBODA P,LINDSTRÖM E S,AHMED OSMAN O,et al.Dispersal timing determines the importance of priority effects in bacterial communities[J].ISME J,2018,12(2):644-646.
[11]NAPPI J,GONCALVES P,KHAN T,et al.Differential priority effects impact taxonomy and functionality of host-associated microbiomes[J].Mol Ecol,2023,32(23):6278-6293.
[12]ZHANG H,WANG L,WANG H,et al.Effects of initial temperature on microbial community succession rate and volatile flavors during Baijiu fermentation process[J].Food Res Int,2021,141:109887.
[13]WANG H,SUN C,YANG S,et al.Exploring the impact of initial moisture content on microbial community and flavor generation in Xiaoqu Baijiu fermentation[J].Food Chem X,2023,20:100981.
[14]张玲玲,罗惠波,黄丹,等.一株高产乙偶姻芽孢杆菌菌株筛选及发酵条件优化[J].现代食品科技,2021,37(5):71-81.
[15]陈媛媛,陈德茗,李子健,等.产乙偶姻菌株的分离鉴定及其对固态混菌发酵产物的影响[J].中国酿造,2024,43(3):84-89.
[16]宋雪苗,马世源,李子健,等.苹果内生菌Torulaspora delbrueckii强化对苹果醋风味物质合成的影响[J].食品科学,2023,44(20):330-342.
[17]廖凤平,李昆太,谭明辉,等.脂肽产生菌解淀粉芽孢杆菌HY2-1的发酵条件优化[J].中国酿造,2024,43(7):209-214.
[18]赵龙,周池虹伶,赵谋明,等.解淀粉芽孢杆菌SWJS22和米曲霉混合制曲在酱油发酵中的应用[J].食品科学,2017,38(22):125-130.
[19]JIN Z,CAI G,WU C,et al.Profiling the key metabolites produced during the modern brewing process of Chinese rice wine[J].Food Res Int,2021,139:109955.
[20]王广南.白酒中不挥发性有机酸的分析及其对白酒风味影响的研究[D].北京:北京工商大学,2022.
[21]张方,张宿义,苏占元,等.有机酸对浓香型白酒品质及其酿造过程影响的研究进展[J].酿酒科技,2016(1):94-97,102.
[22]杨帆,杨玉波,刘延峰,等.白酒酿造过程中Lactobacillus panis乳酸合成关键环境因子的鉴定[J].食品与生物技术学报,2021,40(1):36-42.
[23]张河云.酸类物质在浓香型白酒中的作用研究[D].天津:天津科技大学,2023.
[24]BJORNSDOTTIR K, BREIDT JR F, MCFEETERS R F.Protective effects of organic acids on survival of Escherichia coli O157:H7 in acidic environments[J].Appl Environ Microbiol,2006,72(1):660-664.
[25]胥小荣,王照友,王艳英,等.白酒中乙酸含量研究现状及开发前景[J].食品安全导刊,2021(26):167-168.
[26]周小兵.白酒酒糟发酵生产丁二酸[D].无锡:江南大学,2013.
[27]成晨亚琼,赵鹏涛,王晓宇,等.苹果汁褐变及抗氧化剂护色机理研究进展[J].食品工业科技,2022,43(18):447-455.
[28]孙时光,左勇,张晶,等.酱香型白酒中的风味物质及功效[J].中国酿造,2017,36(12):10-13.
[29]宁欣强,彭微,兰露聆,等.液态白酒多菌种混合发酵非靶向代谢组学分析[J/OL].食品与发酵工业,1-13[2025-03-27].https://doi.org/10.13995/j.cnki.11-1802/ts.039664.
[30]NIU Y,CHEN X,XIAO Z,et al.Characterization of aroma-active compounds in three Chinese Moutai liquors by gas chromatography-olfactometry,gas chromatography-mass spectrometry and sensory evaluation[J].Nat Prod Res,2017,31(8):938-944.
[31]郭兆阳,刘明,钟其顶,等.主成分分析OAV值评价白酒风味组分的研究[J].食品工业,2011,32(7):79-83.
[32]唐平,山其木格,王丽,等.白酒风味化学研究方法及酱香型白酒风味化学研究进展[J].食品科学,2020,41(17):315-324.
[33]LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[34]ZHANG W, SI G, RAO Z, et al.Hepatoprotective ability of tetramethylpyrazine produced by Bacillus amyloliquefaciens[J].Syst Microbiol Biomanuf,2021,1:223-233.
[35]BANERJEE S,SCHLAEPPI K,VAN DER HEIJDEN M G A.Keystone taxa as drivers of microbiome structure and functioning[J].Nat Rev Microbiol,2018,16(9):567-576.