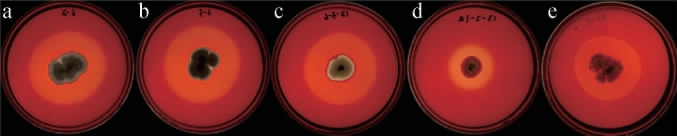
图1 产纤维素酶菌株的刚果红染色水解效果
Fig.1 Hydrolysis effect of Congo red staining of cellulase-producing strains
a~e分别为菌株6-2、6-3、12-3-6、13-2-1a和N-5。
Isolation,identification and enzymatic characteristics of a high-yield cellulase fungi
纤维素是自然界中含量最多、分布最为广泛的一种多糖物质,具有很高的利用价值[1]。 但纤维素的降解效率较低,是限制其利用的关键,目前大多数的纤维素资源被废弃或焚烧,这不仅浪费了宝贵的资源,还对环境造成了严重污染[2]。 纤维素酶是降解纤维素生成葡萄糖的一种复合酶,主要由内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶构成[3-5]。1906年,SEILLIERE首次在蜗牛的消化液中发现了可以降解天然纤维素的纤维素酶[6],自此纤维素酶受到了广泛关注。目前,纤维素酶已在食品加工[7]、动物饲料[8]以及环境保护[9]等行业广泛应用,随着相关行业对纤维素酶需求的不断增加,挖掘和利用产酶活性高、稳定性好的菌株仍是当前研究的热点。
自然界中蕴藏着丰富多样的可降解纤维素的微生物资源,包括真菌、细菌和放线菌等。其中真菌的酶系结构合理、产酶效率高,其产生的胞外酶可直接与纤维素结合进行酶降解,提高降解效率[10-12],是纤维素酶的主要生产菌株,如木霉属(Trichoderma)、青霉属(Penicillium)和曲霉属(Aspergillus)等[13-14]。 特殊环境微生物为了适应苛刻的生存条件,往往进化出独特的生理结构及代谢机制,其产生的纤维素酶通常具有降解能力强,适应范围广等特点。吐鲁番地区常年干旱少雨,紫外强度高,夏季高温可达49.6 ℃,被誉为中国的“热极”和“旱极”,相关研究发现该地区蕴藏着丰富的微生物资源,但目前有关该地区产纤维素酶的研究相对较少,因此,深入挖掘吐鲁番地区高产纤维素酶的真菌具有重要的研究意义。
本研究从新疆吐鲁番地区土壤中分离筛选高产纤维素酶的真菌,通过形态学观察和分子生物学技术对筛选菌株进行鉴定,并研究筛选菌株所产纤维素酶的酶学特性。旨在挖掘吐鲁番地区高产纤维素酶的真菌,为纤维素资源的高效利用和降低纤维素酶的生产成本提供了一定的理论依据,具有重要的应用价值和环保意义。
1.1.1 样品
土壤样品于2023年6月采自新疆吐鲁番地区(东经88°43'40″,北纬42°21'32″),使用五点采样法在每个采样点随机采集3份样品,每份样品距地表0~20 cm,充分混匀,于24 h内运回实验室,4 ℃保存备用。
1.1.2 化学试剂
羧甲基纤维素钠(分析纯):天津永晟精细化工有限公司;刚果红(分析纯):天津市致远化学试剂有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):北京索莱宝科技有限公司;真菌基因组提取试剂盒、脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶、DNA Marker:生工生物工程上海股份有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯浸粉6.0 g,葡萄糖20.0 g,琼脂20.0 g,氯霉素0.1 g,蒸馏水1 L。 121 ℃灭菌20 min。
羧甲基纤维素钠(carboxymethyl cellulose-Na,CMC-Na)培养基:CMC-Na 10.0 g,KH2PO4 2.0 g,MgSO4·7H2O 0.5 g,(NH4)2SO4 2.0 g,琼脂14.0 g,蒸馏水1 L。121 ℃灭菌20 min。
发酵产酶培养基:CMC-Na 10.0 g,MgSO4·7H2O 0.5 g,KH2PO42.0g,(NH4)2SO42.0 g,蛋白胨2.0 g,蒸馏水1 L。121 ℃灭菌20 min。
SPX-250BF生化培养箱:上海福玛实验设备有限公司;BSD-250振荡培养箱:上海博讯实业有限公司医疗设备厂;Ci-L显微镜:日本尼康公司;PLCD高速冷冻离心机:德国Sigma公司;Biotek Epoch-2酶标仪:美国伯腾仪器有限公司;DK-8D电热恒温水浴锅:上海齐欣科学仪器公司;ABI 2720聚合酶链式反应(polymerase chain reaction,PCR)仪:赛默飞世尔科技(中国)有限公司;GelDoc G0凝胶成像系统:上海孚约生物科技有限公司;DYY-6C电泳仪:北京六一生物科技有限公司。
1.3.1 菌株的分离与纯化
在无菌条件下,称取5.0 g土样加入45 mL无菌水中,充分振荡混匀,配制成10-1的悬浮液,采用梯度稀释法依次稀释至10-2、10-3浓度梯度土壤悬浮液。采用稀释涂布平板法,吸取100 μL土壤悬浮液涂布于以CMC-Na为唯一碳源的筛选平板上,30 ℃培养5~7 d后观察菌落生长情况,挑取不同形态特征的单菌落转接至CMC-Na培养基进一步分离纯化,并采用PDA斜面培养基4 ℃保存,备用。
1.3.2 产纤维素酶菌株初筛
将分离的菌株点接至CMC-Na培养基中央,30 ℃培养3 d,使用1 mg/mL刚果红溶液染色30 min,1 mol/L NaCl溶液脱色处理30 min,测量并记录透明圈直径(D)和菌落直径(d),以D/d值作为衡量菌株产纤维素酶能力的指标[15]。D/d值越高,说明菌株产纤维素酶能力越强。
1.3.3 产纤维素酶菌株复筛
粗酶液的制备:将初筛得到的菌株点接至PDA平板上,30 ℃培养6 d,用无菌水冲洗孢子,制成悬浮液备用。按5%(V/V)的接种量,将孢子悬浮液接种于发酵产酶培养基中,在30 ℃、160 r/min下振荡培养6 d。将发酵液在4 ℃、8 000 r/min下离心10 min,所得上清液即为粗酶液。
CMCase酶活和滤纸酶活(filter paper activity,FPA)是评估纤维素酶性能的常用指标,分别反映了纤维素酶的初始降解能力和整体协同作用,测定方法更为成熟和标准化,便于不同研究之间的比较。
FPA酶活测定:参照李豪等[16]的方法,将新华1号滤纸(1 cm×6 cm)置于装有1.5 mL柠檬酸-柠檬酸钠缓冲液(pH 4.8)和0.5 mL粗酶液的10 mL比色管中,使滤纸完全浸泡在液体中,将比色管置于50 ℃水浴1 h,加入2 mL DNS,沸水浴5 min,迅速用流水冷却后定容至10 mL,混匀,于波长540 nm处测定吸光度值。以100 ℃灭活10 min的粗酶液为对照。
CMCase酶活测定:参照李豪等[16]的方法,在10 mL比色管中加入1.5 mL含0.5%CMC-Na的柠檬酸-柠檬酸钠缓冲液(pH 4.8),加入0.5 mL粗酶液并混匀,将比色管置于50 ℃水浴0.5 h,加入2 mL DNS,沸水浴5 min,迅速用流水冷却后定容至10 mL,混匀,于波长540 nm处测定吸光度值。以100 ℃灭活10 min的粗酶液为对照。
FPA酶活和CMCase酶活的定义为:在50 ℃、pH 4.8的条件下,1 mL粗酶液每分钟水解底物产生1 μg葡萄糖所对应的酶量为一个酶活单位(U/mL)。
1.3.4 菌株鉴定
菌株形态学观察:将复筛得到的菌株点接至PDA固体培养基上,30 ℃培养7 d,观察菌落的生长状况及其形态特征;采用插片培养法培养真菌,利用显微镜观察其菌丝和孢子形态。 结合《真菌鉴定手册》和《中国真菌志》等进行初步分类鉴定。
菌株分子生物学鉴定:用真菌基因组提取试剂盒提取DNA,以ITS1和ITS4为引物,PCR扩增ITS基因序列。 PCR扩增体系(50μL):2.0μLDNA模板、2.5μLITS1、2.5 μLITS4、25.0 μL 2×PCR Bestaq MasterMix、18 μL双蒸水(ddH2O)。PCR扩增程序:95 ℃预变性5 min;94 ℃变性45 s,50 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃再延伸1 min,降温到4 ℃预保存。1%琼脂糖凝胶电泳检测PCR扩增产物,PCR产物电泳条带切割所需DNA目的条带,采用QIAquick琼脂糖凝胶回收试剂盒回收,将回收的PCR产物送至成都罗宁生物科技有限公司进行测序,测序结果上传至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(Basic Local Alignment Search Tool,BLAST) 比对初步确定其分类地位,选取同源性较高的序列,利用MEGA 11.0软件中的邻接(neighbor joining,NJ)法构建系统进化树。
1.3.5 菌株产酶曲线
将产酶活性最高的菌株接种至发酵产酶培养基中,30 ℃、160 r/min培养8 d,每隔1 d测定该菌发酵液中FPA酶活和CMCase酶活,绘制筛选菌株的产酶曲线,确定最佳产酶时间。
1.3.6 纤维素酶酶学特性研究
最适反应温度及热稳定性:将粗酶液与底物置于30~80 ℃水浴,其他条件不变,测定FPA酶活和CMCase酶活,确定其最适反应温度。 在进行酶活反应前,先将粗酶液分别置于30~80 ℃水浴1 h,迅速冷却后于最适反应温度下测定FPA酶活和CMCase酶活。同时以未处理的粗酶液酶活力为100%,考察纤维素酶对温度的耐受性。
最适反应pH及pH稳定性:将粗酶液在pH为3.0~8.0的磷酸氢二钠-柠檬酸缓冲液中进行酶促反应,测定FPA酶活和CMCase酶活,确定其最适反应pH。 在进行酶活反应前,先将粗酶液分别置于不同pH(3.0~8.0)的磷酸氢二钠-柠檬酸缓冲液中,4 ℃保温1 h后测定FPA酶活和CMCase酶活。同时以未处理的粗酶液酶活力为100%,考察纤维素酶对pH的耐受性。
金属离子和抑制剂对纤维素酶活力的影响:为测定金属离子和抑制剂对纤维素酶活力的影响,在最适反应条件下,向酶反应体系中分别加入不同的金属离子(K+、Mg2+、Mn2+、Fe3+、Cu2+、Ca2+)或抑制剂十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、β-巯 基 乙 醇(2-mercaptoethanol,2-Me)至其终浓度为1 mmol/L,测定FPA酶活和CMCase酶活。以未添加金属离子或抑制剂的粗酶液酶活力为对照,考察金属离子和抑制剂对纤维素酶活力的影响。
利用CMC-Na唯一碳源分离培养基和刚果红染色法分离获得5株产纤维素酶能力较强的真菌,并通过摇瓶发酵测定FPA酶活和CMCase酶活,结果见表1,刚果红染色水解效果见图1。 由表1和图1可知,菌株12-3-6产纤维素酶活性最强,水解圈直径(D)和菌落直径(d)比值为2.39,FPA酶活和CMCase酶活分别达到7.30 U/mL和39.56 U/mL。 因此,选择菌株12-3-6进行后续研究分析。

图1 产纤维素酶菌株的刚果红染色水解效果
Fig.1 Hydrolysis effect of Congo red staining of cellulase-producing strains
a~e分别为菌株6-2、6-3、12-3-6、13-2-1a和N-5。
表1 产纤维素酶菌株筛选结果
Table 1 Screening results of cellulase-producing strains
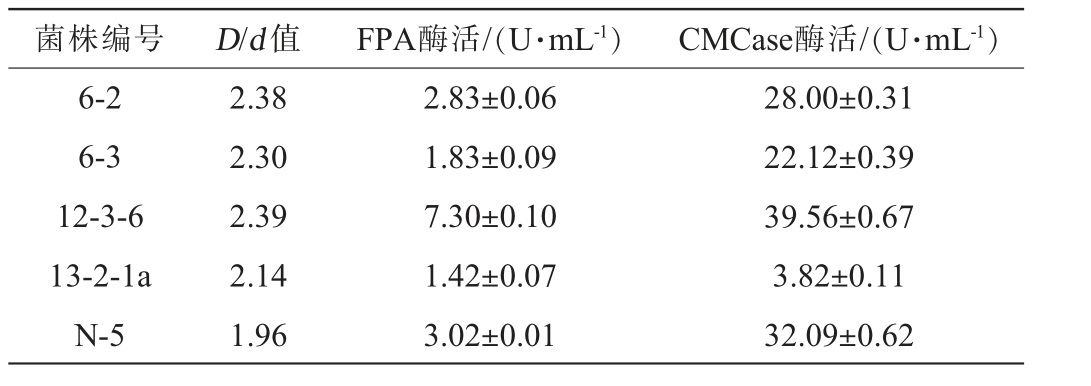
菌株编号 D/d 值 FPA酶活/(U·mL-1) CMCase酶活/(U·mL-1)6-2 6-3 12-3-6 13-2-1a N-5 2.38 2.30 2.39 2.14 1.96 2.83±0.06 1.83±0.09 7.30±0.10 1.42±0.07 3.02±0.01 28.00±0.31 22.12±0.39 39.56±0.67 3.82±0.11 32.09±0.62
2.2.1 形态学特征观察
对菌株12-3-6进行平板培养观察其菌落形态,并在显微镜下观察其孢子形态,结果见图2。
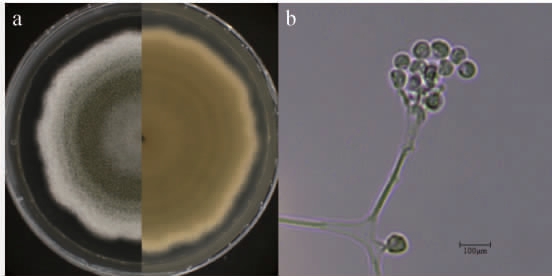
图2 菌株12-3-6的菌落形态(a)和显微结构(b)
Fig.2 Colonial morphology (a) and microstructure (b) of strain 12-3-6
由图2a可知,菌株12-3-6在PDA培养基上生长较快,30 ℃条件下培养7 d菌落直径达60~65 mm。菌落呈圆形,边缘不规则,表面呈绿色,有白色边缘,气生菌丝发达,菌落背面呈淡棕色,无裂纹。由图2b可知,菌株12-3-6有大量孢子产生,分生孢子光滑,圆形至近圆形。
2.2.2 分子生物学鉴定
将菌株12-3-6的ITS序列在NCBI的GenBank数据库进行BLAST同源性比较,结果显示,菌株12-3-6与Aspergillus egyptiacus的相似度最高(99%)。 进一步利用MEGA 11.0软件中邻接(NJ)法构建系统发育树,结果见图3。

图3 基于ITS基因序列构建菌株12-3-6的系统发育树
Fig.3 Phylogenetic tree of strain 12-3-6 based on ITS gene sequence
由图3可知,菌株12-3-6与Aspergillus egyptiacus聚为一支,置信度为99%,表现出较近的亲缘关系。结合菌株12-3-6的形态学特征,将菌株12-3-6鉴定为埃及曲霉(Aspergillus egyptiacus)。
将菌株12-3-6按5%(V/V)的接种量接种于发酵产酶培养基中,30 ℃、160 r/min培养8 d,每隔1 d测定该菌发酵液中FPA酶活和CMCase酶活,绘制其产酶曲线,结果见图4。
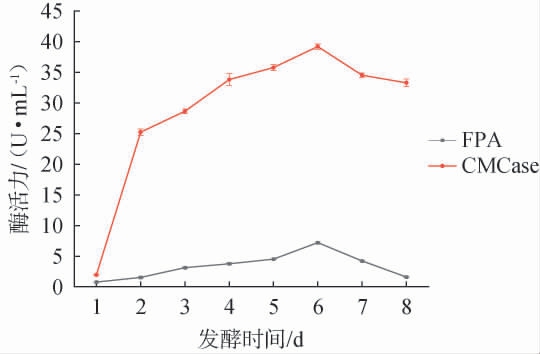
图4 菌株12-3-6产酶曲线
Fig.4 Enzyme production curve of strain 12-3-6
由图4可知,菌株12-3-6的CMCase酶活显著高于FPA酶活,酶活力随培养时间的延长而增加,在发酵2 d后酶活力迅速增加,在发酵6 d时FPA酶活和CMCase酶活均达到最大值,而后呈现下降趋势。因此,菌株12-3-6发酵6 d产纤维素酶活性最强。
2.4.1 最适反应温度及热稳定性
不同反应温度对该酶酶促反应的影响及热稳定性见图5。
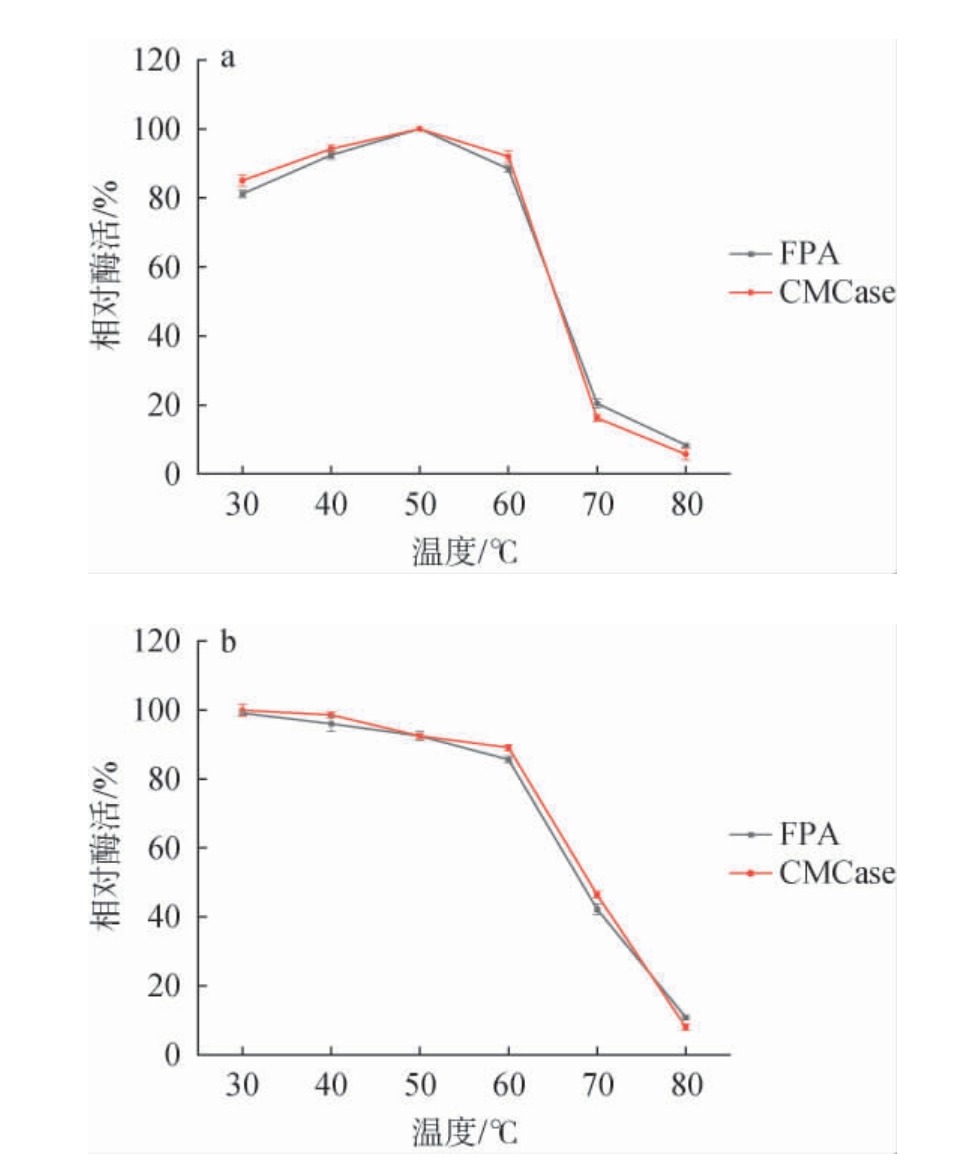
图5 滤纸酶和羧甲基纤维素酶的最适反应温度(a)及热稳定性(b)
Fig.5 Optimal reaction temperature (a) and thermal stability (b) of filter paper enzyme and carboxymethyl cellulase
由图5a可知,菌株12-3-6产生的FPA和CMCase在30~60 ℃范围内具有较高酶活力。随着反应温度的升高而提高,均于反应温度50 ℃时达到最大值,分别为7.18 U/mL和40.18 U/mL。当反应温度>60 ℃之后,酶活开始迅速下降。因此,菌株12-3-6所产纤维素酶的最适反应温度为50 ℃。由图5b可知,FPA和CMCase呈现一致的趋势,在30~60 ℃范围内较稳定,相对酶活保持到80%以上。当反应温度>60 ℃之后,酶活力开始迅速下降;反应温度为80 ℃时,FPA酶活和CMCase酶活仅剩10.86%和8.04%。
2.4.2 最适反应pH及pH稳定性
不同反应pH对该酶酶促反应的影响及pH稳定性见图6。由图6a可知,在pH值为3.0~5.0之间,FPA酶活和CMCase酶活逐渐增强,均于pH 5.0时达到最高,分别为7.15 U/mL和40.69 U/mL;当反应pH>5.0之后,纤维素酶活力呈现缓慢下降趋势。因此,菌株12-3-6所产纤维素酶的最适反应pH值为5.0。由图6b可知,在pH值为5.0~6.0时,菌株12-3-6产生的纤维素酶活力较稳定,不论是FPA酶活还是CMCase酶活,放置1 h后仍可保持80%以上的酶活力。
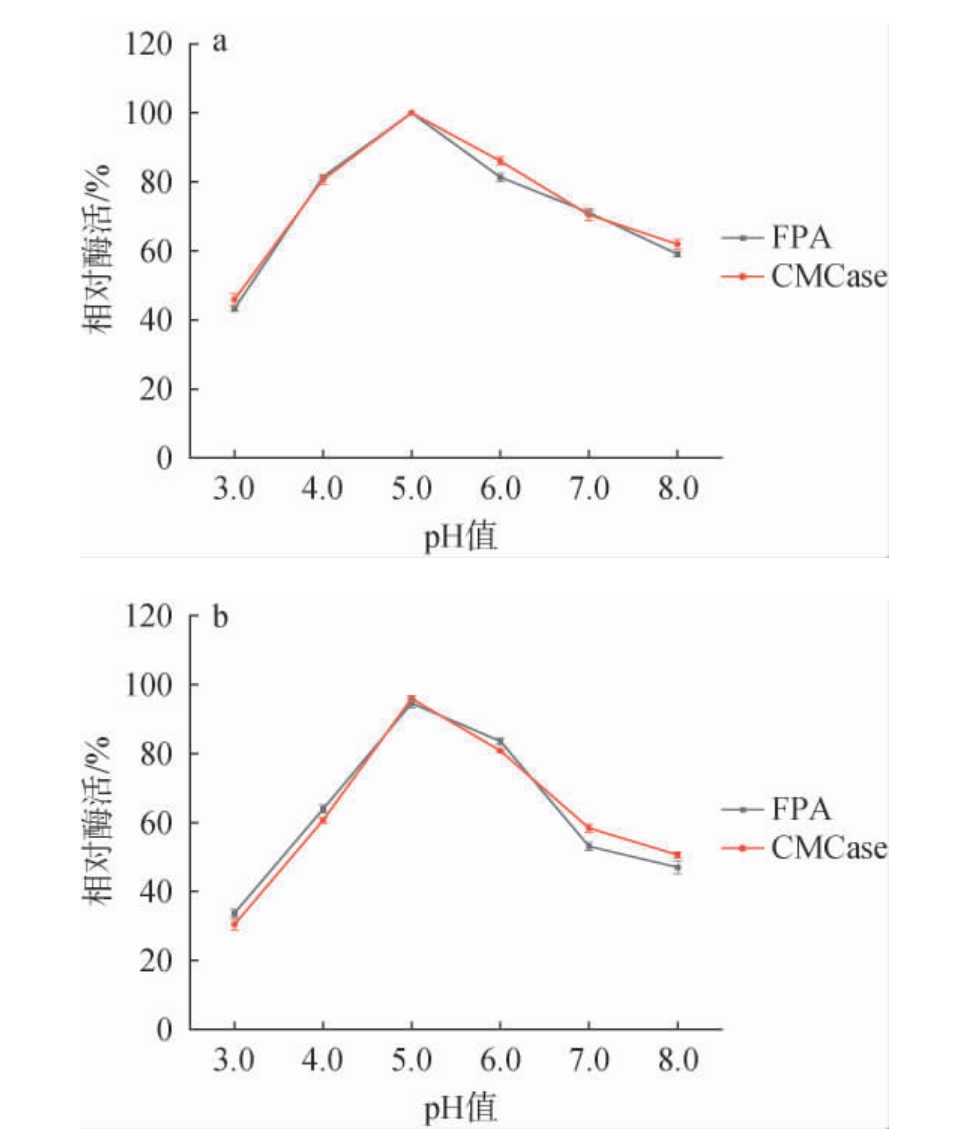
图6 滤纸酶和羧甲基纤维素酶的最适反应pH(a)及pH稳定性(b)
Fig.6 Optimal reaction pH (a) and pH stability (b) of filter paper enzyme and carboxymethyl cellulase
2.4.3 金属离子和抑制剂对纤维素酶活力的影响
不同金属离子和抑制剂对纤维素酶活力的影响结果见图7。
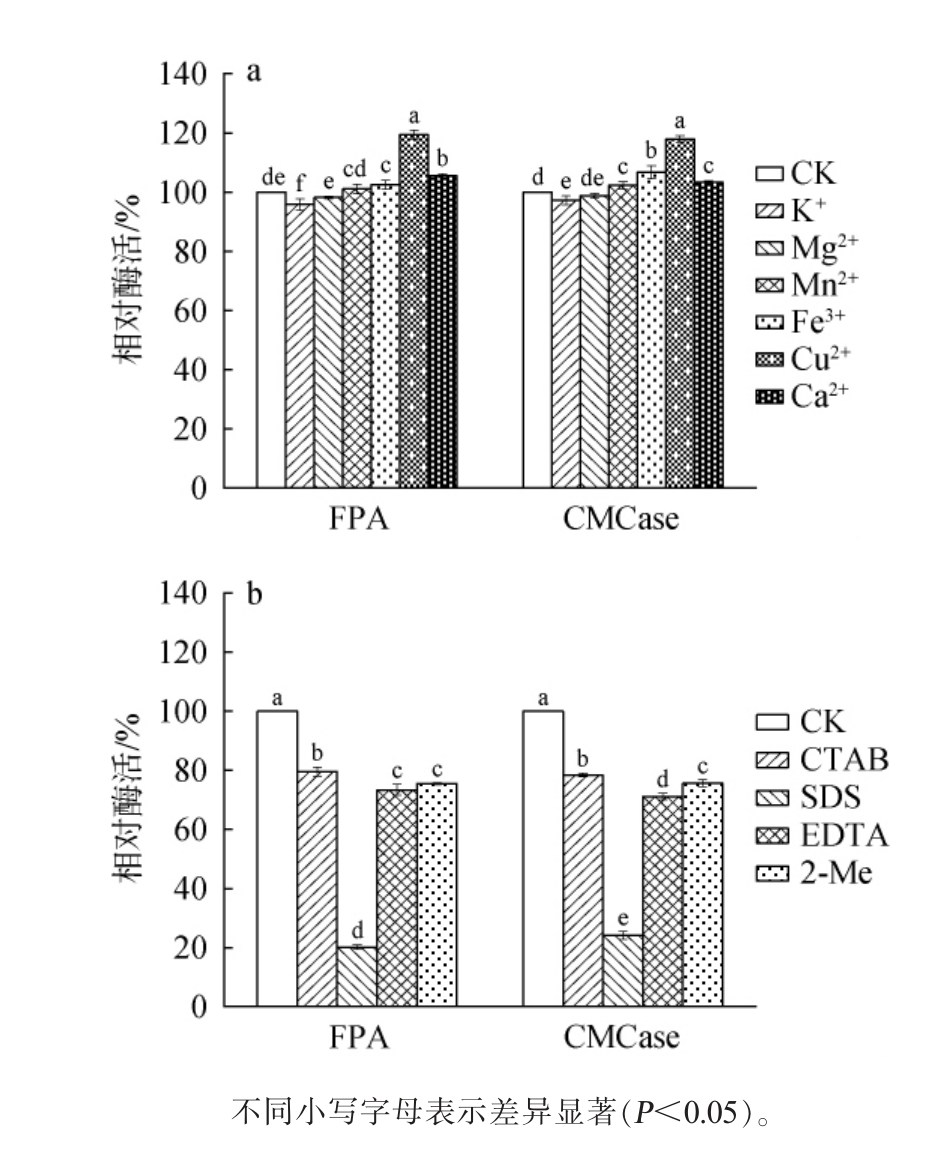
图7 金属离子(a)及抑制剂(b)对滤纸酶和羧甲基纤维素酶活性的影响
Fig.7 Effect of metal ions (a) and inhibitors (b) on activities of filter paper enzyme and carboxymethyl cellulase
由图7a可知,Cu2+对纤维素酶活力有明显的促进作用(P<0.05),FPA和CMCase相对酶活分别为119%和118%,其他金属离子对酶活力无明显影响。由图7b可知,实验选用的4种抑制剂对菌株12-3-6所产的纤维素酶活力均有一定的抑制作用,与其他3种抑制剂相比,SDS的抑制效果最为显著,FPA和CMCase相对酶活分别为20%和24%。
特殊环境蕴藏着丰富的微生物资源,如今,研究者已从特殊环境中分离得到多种可产纤维素酶的微生物。赖泳红等[17]从云南元江瓦纳温泉中分离到1株高产纤维素酶的菌株Paenibacillus ZZS-12,经初步发酵,其上清液中纤维素酶活力为25.44 U/mL;卢雨欣等[18]在西藏尼木热泉分离得到1株CMCase酶活为28.1 U/mL的Melanocarpus albomyces THN8;王贤丰等[19]在海水环境中分离到的产纤维素酶菌株Bacillus licheniformis Z4,其FPA酶活和CMCase酶活分别为1.10 U/mL和2.28 U/mL。 本研究在新疆吐鲁番地区土壤中分离得到一株高产纤维素酶的真菌12-3-6,经形态学观察及分子生物学鉴定为Aspergillus egyptiacus,该菌产生的纤维素酶活力相对较高,FPA酶活和CMCase酶活分别达到7.30 U/mL和39.56 U/mL,具有较好的开发应用价值。
酶学反应温度和pH是影响真菌纤维素酶活力的重要因素[20-21]。现有研究表明,真菌所产的纤维素酶大多为酸性酶。 曾思泉等[22]从三亚红沙河红树林区分离得到的Gladaxporism sp.SCSIO 43503分泌的纤维素酶最适反应温度为50 ℃,最适反应pH为5.0;张粲[23]研究了桧状青霉H16所产纤维素酶的酶学性质,结果表明该菌株所产纤维素酶的最适反应pH值为5.0~5.5,最适反应温度为50~55 ℃;李蕾等[24]在青海茶卡盐湖土壤中分离到一株具有降解纤维素功能的真菌Cladosporium sp.F39,该菌产生的纤维素酶最适反应温度为50 ℃,最适反应pH为5.0。 本研究对菌株12-3-6所产纤维素酶的相关酶学特性进行了测定,发现该纤维素酶的最适反应温度为50 ℃,最适反应pH为5.0,属于中温酸性酶,与此前报道一致。 酸性纤维素酶可应用于生产青贮饲料,能够适应青贮生产过程中的环境,从而提高饲料的利用率、改善饲料营养价值、降低青贮的pH值,并延长其保质期[25-26]。在热稳定性和pH稳定性方面,菌株12-3-6所产的纤维素酶在温度30~60 ℃或pH 5.0~6.0条件下保温1 h后仍有较高活力,相对酶活保持到80%以上,较蔡正安等[27]研究的冠突散囊菌所产的纤维素酶具有更好的稳定性。
不同的金属离子和抑制剂对纤维素酶活性的影响不同[28]。尹以瑞等[29]研究了各种金属离子和抑制剂对Aspergillus sp.DLCS-F18来源纤维素酶的影响,结果表明,Cu2+对粗酶液纤维素酶活性表现出激活作用,SDS对其纤维素酶活性表现出抑制作用,而李明华等[30]研究发现,在酶反应体系中添加Cu2+会抑制Trichoderma koningii SP08所产纤维素酶的催化活性。 本研究结果显示,菌株12-3-6来源的纤维素酶在大多数金属离子和抑制剂存在下表现稳定,Cu2+对酶活力有明显的促进作用,SDS对其有一定的抑制作用。
本研究从吐鲁番地区土壤中筛选到一株高产纤维素酶的真菌12-3-6,其产生的透明圈直径与菌落直径比为2.39,粗酶液FPA酶活和CMCase酶活分别达到7.30 U/mL和39.56U/mL。通过形态学观察及分子生物学鉴定,菌株12-3-6被鉴定为埃及曲霉(Aspergillus egyptiacus)。酶学特性分析结果表明,该菌所产的纤维素酶最适反应温度和pH分别为50 ℃和5.0,在温度30~60 ℃,pH 5.0~6.0具有良好的稳定性,且在大多数金属离子和抑制剂的存在下表现稳定,具有良好的应用前景。
[1]于跃,张剑.纤维素酶降解纤维素机理的研究进展[J].化学通报,2016,79(2):118-122,128.
[2]MU B,TANG W,LIU T,et al.Comparative study of high-density polyethylene-based biocomposites reinforced with various agricultural residue fibers[J].Ind Crops Prod,2021,172:114053.
[3]叶科丽,唐艳军,傅丹宁,等.纤维素水解制备葡萄糖的研究进展[J].中国造纸学报,2020,35(2):81-88.
[4]何颖慧,张慧,贾惜文,等.提高木质纤维生物炼制效率的纤维素酶生产策略[J].生物质化学工程,2024,58(3):48-56.
[5]BISWAS S,SABER M A,TRIPTY I A,et al.Molecular characterization of cellulolytic (endo-and exoglucanase)bacteria from the largest mangrove forest(Sundarbans),Bangladesh[J].Ann Microbiol,2020,70:1-11.
[6]MYERS F L,NORTHCOTE D H.Partial purification and some properties of a cellulase from Helix pomatia[J].Biochem J,1959,71(4):749-756.
[7]SOUZA T S P,KAWAGUTI H Y.Cellulases,hemicellulases,and pectinases: Applications in the food and beverage industry[J].Food Bioproc Tech,2021,14(8):1446-1477.
[8]武齐丰,陈晨,黄沁娇,等.纤维素酶和乳酸菌对杂交象草青贮结构性碳水化合物影响[J].草地学报,2024,32(7):2314-2322.
[9]INTASIT R,KHUNRAE P,MEEINKUIRT W,et al.Fungal pretreatments of Napier grass and sugarcane leaves for high recovery of lignocellulosic enzymes and methane production[J].Ind Crops Prod,2022,180:114706.
[10]徐晓,程驰,袁凯,等.里氏木霉产纤维素酶研究进展[J].中国生物工程杂志,2021,41(1):52-61.
[11]JIAO H,SONG X,LAI C,et al.Progress in preparation of cellulase from lignocellulose using fungi[J].Biotechnol Bioproc Eng,2021,26(6):871-886.
[12]董妙音,王曙阳,王雨辰,等.丝状真菌在纤维素酶合成过程中碳源代谢调控的研究进展[J].中国酿造,2016,35(10):1-4.
[13]ALI D,CHEN L,KOWAL J M,et al.Resveratrol inhibits adipocyte differentiation and cellular senescence of human bone marrow stromal stem cells[J].Bone,2020,133:115252.
[14]MA X Y, GAO M, LI Y, et al.Production of cellulase by Aspergillus niger through fermentation of spent mushroom substance:Glucose inhibition and elimination approaches[J].Proc Biochem,2022,122(9):26-35.
[15]赖国栋,秦长生,赵丹阳,等.纤维素降解菌株的分离与筛选[J].林业与环境科学,2021,37(4):24-32.
[16]李豪,邹伟,白光剑,等.高产纤维素酶真菌的筛选及鉴定[J].食品与发酵工业,2019,45(6):54-58.
[17]赖泳红,郑伟光,赵佐斯,等.一株产纤维素酶温泉高温菌的分离鉴定及发酵条件优化[J].云南大学学报(自然科学版),2012,34(S1):99-104,109.
[18]卢雨欣,赵航轲,唐小飞,等.西藏热泉1株产纤维素酶真菌的鉴定及产酶条件优化[J].河南农业科学,2019,48(10):77-83.
[19]王贤丰,单洪伟,张家松,等.从海水环境分离筛选甘蔗渣纤维素降解菌[J].微生物学通报,2015,42(6):981-989.
[20]李鹏,庄文颖.液态发酵条件下拟康宁木霉8985产纤维素酶能力初探[J].菌物学报,2022,41(2):281-290.
[21]王霞,华琳,张海龙,等.纤维素降解菌CMC-4的分离鉴定、诱变和酶学特性研究[J].土壤,2017,49(5):919-925.
[22]曾思泉,凌娟,林丽云,等.1株红树林来源枝孢属真菌的分离鉴定及纤维素酶性质分析[J].微生物学杂志,2018,38(2):37-42.
[23]张粲.纤维素酶高产菌筛选及产酶条件与酶学性质初探[D].天津:天津科技大学,2014.
[24]李蕾,李馨伟,黄裕颖,等.产自Cladosporium sp.F39的嗜酸耐盐纤维素酶及其酶学性质研究[J].生物过程,2022,12(2):138-147.
[25]石战,夏辉.田间玉米秸秆体外消化及微生物青贮的发酵特性[J].中国饲料,2020,31(8):121-124.
[26]赵士萍,周敏,蒋林树.青贮饲料添加剂的研究进展[J].中国农学通报,2016,32(20):6-10.
[27]蔡正安,刘素纯,刘仲华,等.茯砖茶中冠突散囊菌纤维素酶的酶学性质研究[J].茶叶科学,2010,30(1):57-62.
[28]ZHOU Y W,YANG J,LUO C,et al.Effect of metal ions and surfactants on the enzymatic hydrolysis of pretreated lignocellulose[J].Bioresources,2019,14(1):1653-1667.
[29]尹以瑞,杨润芬,李蕾,等.产自Aspergillus sp.DLCS-F18的嗜酸嗜热纤维素酶及其酶学性质[J].菌物学报,2021,40(6):1437-1445.
[30]李明华,孟秀梅,王成龙.纤维素酶高产菌筛选鉴定及酶学性质初步研究[J].中国酿造,2021,40(8):134-138.