中高温包包曲和平板曲理化指标及真菌群落多样性研究
王俊坤1,李富强1,曹振华1,李学思1,2*,胡晓龙3,闫培勋1,李绍亮1,孙金涛1
(1.河南省宋河酒业股份有限公司,河南 周口 477265;2.河南牧业经济学院 食品与生物工程学院,河南 郑州 450000;3.郑州轻工业大学 食品与生物工程学院,河南 郑州 450001)
摘 要:该研究采用高通量测序技术深入剖析宋河中高温平板曲与包包曲中的真菌菌群多样性,并检测两者的基本理化性质,旨在探究其理化指标与真菌群落的关联性。结果表明,从两种大曲中共划分到58个操作分类单元(OTU),隶属于3门8纲10目20科30属。两种大曲真菌群落的α-多样性指数值相近,菌群结构相似,但平均相对丰度有一定的差异。 共有优势真菌属(相对丰度>1%)为伊萨酵母属(Issatchenkia)、根霉属(Rhizopus)、假丝酵母属(Candida)、威克汉姆酵母属(Wickerhamomyces)、根毛霉属(Rhizomucor)、有孢圆酵母属(Torulaspora)、横梗霉属(Lichtheimia),包包曲与平板曲中特有的优势真菌属分别为曲霉属(Aspergillus)、链格孢属(Alternaria)。平板曲的水分、淀粉含量及糖化力较高,而包包曲的酸度、发酵力及酯化力较高,其中,水分、酸度及糖化力、发酵力、酯化力差异显著(P<0.05)。 相关性分析结果表明,大曲的理化特性对真菌群落具有不同程度的影响,其中,糖化力和酯化力对真菌群落结构的影响尤为显著。
关键词:平板曲;包包曲;理化指标;高通量测序;真菌菌群;相关性
中图分类号:TS261.1
文章编号:0254-5071(2025)05-0120-06
doi: 10.11882/j.issn.0254-5071.2025.05.018
引文格式:王俊坤,李富强,曹振华,等.中高温包包曲和平板曲理化指标及真菌群落多样性研究[J].中国酿造,2025,44(5):120-125.
收稿日期:2023-09-20
修回日期:2024-08-15
基金项目:河南省重大科技专项(181100211400)
作者简介:王俊坤(1966-),男,高级酿酒师,本科,研究方向为白酒酿造。
*通讯作者:李学思(1969-),男,副教授,硕士,研究方向为白酒酿造。
Physicochemical indexes and fungal community diversity of medium-high temperature Baobao Daqu and brick-shaped Daqu
WANG Junkun1,LI Fuqiang1,CAO Zhenhua1,LI Xuesi1,2*,HU Xiaolong3,YAN Peixun1,LI Shaoliang1,SUN Jintao1
(1.Henan Songhe Distillery Co.,Ltd.,Zhoukou 477265,China;2.School of Food and Bioengineering,Henan University of Animal Husbandry and Economy,Zhengzhou 450000,China;3.School of Food and Bioengineering,Zhengzhou University of Light Industry,Zhengzhou 450001,China)
Abstract:In this study,the diversity of fungal flora of medium-high temperature brick-shaped Daqu and Baobao Daqu from Songhe region was deeply analyzed using high-throughput sequencing technology,and the basic physicochemical properties were detected,aiming to explore the correlation between their physicochemical indexes and fungal community.The results showed that there were 58 operational taxonomic units(OTU)belonging to 3 phyla,8 classes,10 orders,20 families and 30 genera.The α-diversity index values of the two species were similar, the structure of the flora was similar,but the average relative abundance was different.The common dominant fungal genera(relative abundance>1%)were Issatchenkia,Rhizopus,Candida,Wickerhamomyces,Rhizomucor,Torulaspora,and Lichtheimia,Aspergillus and Alternaria were the unique dominant fungi in Baobao Daqu and brick-shaped Daqu, respectively.The moisture, starch content and saccharifying power of brick-shaped Daqu were higher, and the acidity, fermentation power and esterification power of Baobao Daqu were higher.Among them,there were significant differences in moisture,acidity,saccharifying power,fermentation power and esterification power(P<0.05).Correlation analysis results showed that the physiochemical characteristics of Daqu had different effects on fungal community,and the effect of saccharification and esterification power on fungal community structure was particularly significant.
Key words:brick-shaped Daqu;Baobao Daqu;physicochemical index;high-throughput sequencing;fungal community;correlation
大曲是以小麦为主要原料,经粉碎,加水拌和,压制成曲坯,通过网罗天然环境中各类微生物在曲坯上竞争繁殖加工而成,是一种同时含有微生物菌系、酶系和复合曲香物质等组成的一个微型生态产品[1]。大曲既是白酒酿造过程中的糖化剂和发酵剂[2],又是白酒酿造过程中的生香剂,在白酒酿造过程具有提供复合曲香物质及其呈香前体物质的作用[3-4],被誉为“酒之骨”[5]。
依据曲坯成型的形状分为形状像长方体的平板曲和长方体一面有隆起的包包曲,这两种曲在酒厂中普遍应用[6-7]。 平板曲作为传统形态的大曲,其表面平整,内部微生物群落结构相对简单且稳定,其中的微生物主要有细菌、霉菌、酵母菌和放线菌四大类,这些微生物组成了平板曲中复杂的微生物菌群[8]。相比之下,包包曲作为一种特殊形态的大曲,其表面凸起如“包包”,增加了与外界环境的接触面积,有利于富集更多种类的微生物[9]。不同形状大曲的内部结构有所差异,所富集的微生物也不尽相同,进而导致大曲质量也不同。大曲中微生物的物种和数量研究一般采用传统可培养的方法,但此方法培养的微生物有限[10],常常导致一些主要功能微生物无法分离出来[11-12]。 随着现代生物技术的发展,免培养技术的出现和应用为环境样品中微生物群落多样性的研究提供了技术,如高通量测序技术,其具有数据产出通量高、分析全面、灵敏、快速等特点,可准确快速地对样品中复杂的微生物菌群结构进行分析[13]。
传统上,大曲的质量评价多依赖于感官指标和理化指标(发酵力、糖化力、液化力、水分、酸度等)[14]。这些指标虽能在一定程度上反映大曲的性能,但难以全面揭示其微生物群落结构的复杂性及其对白酒风味的影响。近年来,人们开始解析大曲中真菌群落结构及其与理化指标的相关性,王清龙等[15]研究发现,大曲中的细菌群落与淀粉含量、酯化力和水分呈显著相关(P<0.05),真菌群落与酸度、酯化力、水分呈显著相关(P<0.05)。 此前的研究还发现,真菌群落结构的变化与理化性质的波动密切相关,两者共同影响着白酒的风味品质[16-20]。
尽管已有研究对大曲的微生物群落进行了一定程度的解析,但仍存在以下问题:一是对于不同形态大曲之间微生物群落差异的比较研究较少,缺乏系统性的分析;二是缺乏对中高温包包曲这一特殊形态大曲的真菌群落多样性与理化指标的相关性研究。 因此,本研究以宋河中高温平板曲和包包曲为研究对象,采用高通量测序技术解析两种大曲真菌微生物群落结构差异,并解析其理化指标之间的差异及其与真菌群落结构的相关性,为大曲质量的提高奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
中高温包包曲和中高温平板曲:均取自河南省宋河酒业酿酒生产用曲。
1.1.2 试剂
E.Z.N.ATM Mag-Bind Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit:美国Omega BioTek公司;DNA检测试剂盒:美国Life公司;SanPrep柱式DNA胶回收试剂盒、引物:生工生物工程(上海)股份有限公司。其他试剂均为分析纯或生化试剂。
1.2 仪器与设备
Pico-21台式离心机:赛默飞世尔科技公司;GL-88B漩涡混合器;海门市其林贝尔仪器制造有限公司;TND03-H-H型混匀型干式恒温器:深圳拓能达科技有限公司;DYY-6C型电泳仪电源、DYCZ-21型电泳槽:北京市六一仪器厂;FR-1000型凝胶成像系统:上海复日科技有限公司;ETC 811型聚合酶链式反应(polymerase chain reaction,PCR)仪:北京东胜创新生物科技有限公司。
1.3 方法
1.3.1 中高温大曲样品的采集
在发酵30 d的包包曲和平板曲曲垛的上、中、下层各取1块,将3块大曲混匀,粉碎,过20目筛,中高温包包曲命名为SHDQ1,中高温平板曲命名为SHDQ2。存放于无菌采样袋中,于-80 ℃冰箱存放,备用。需要注意的是,包包曲和平板曲压制成型所用的曲模不同,包包曲有一个宽的表面略有凸起,其余五个面均平整,四边厚6 cm,凸起厚5 cm;平板曲六个面均平整,类似砖块,厚度7~8 cm。其余工艺皆相同。
1.3.2 中高温大曲理化指标的检测
水分含量、酸度、淀粉含量、糖化力、发酵力、酯化力的测定:参照刘延波等[21]的方法。
1.3.3 DNA提取及PCR扩增
采用E.Z.N.ATM Mag-Bind Soil DNA Kit提取大曲样品中微生物的宏基因组DNA,采用1%琼脂糖凝胶电泳检测宏基因组DNA的完整性,并采用Qubit定量检测DNA样本浓度。 以提取的宏基因组DNA为模板,采用引物ITS1-F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2-R(5'-GCT GCGTTCTTCATCGATGC-3')在ITS1-ITS2区域进行PCR扩增。PCR扩增体系:2×HieffR Robust PCR Master Mix 15 μL,ITS1-F1 μL,ITS2-R 1 μL,样品DNA 25 ng,用双蒸水补充至30 μL。PCR扩增条件:94 ℃预变性3 min;94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,共5个循环;94 ℃变性20 s,55 ℃退火20s,72 ℃延伸30 s,共20个循环;72℃再延伸5 min,然后降温至10 ℃保存。
1.3.4 高通量测序
PCR扩增结束后,采用1%琼脂糖凝胶电泳检测PCR扩增产物,并利用SanPrep柱式DNA胶回收试剂盒回收PCR扩增产物,委托生工生物工程(上海)股份有限公司在Illumina Miseq高通量测序仪上进行测序,上机测序前使用Qubit3.0荧光定量仪进行文库浓度测定,以便得到均匀的长簇和高质量的测序数据。
1.3.5 数据分析
高通量测序下机的原始序列数据,利用Mothur软件(1.43.0)进行序列拼接、过滤、嵌合体去除、操作分类单元(operational taxonomic unit,OTU)划分和物种注释,注释采用UNITE database(https://unite.ut.ee)[22]。 使用Mothur软件(1.43.0)计算各样品真菌菌群的α-多样性指数,利用Canoco 5.0进行冗余分析(redundancy analysis,RDA)并绘图。
2 结果与分析
2.1 中高温大曲的理化指标
水分含量与大曲微生物的生长密切相关,而且也是大曲储存的关键[23]。 大曲中微生物的代谢,影响着大曲的酸度,且酸度对大曲质量的评定也至关重要[24]。 淀粉含量可以反映大曲的质量[18]。糖化力、发酵力和酯化力是反映大曲发酵功能和质量的重要指标[25]。 因此,对中高温包包曲和平板曲的水分含量、酸度、淀粉含量及糖化力、发酵力、酯化力进行测定,结果见表1。
表1 两种中高温大曲样品的理化指标
Table 1 Physicochemical indexes of 2 kinds of medium-high temperature Daqu samples

注:“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。
样品编号 水分含量/% 酸度/(mmol·10 g-1) 淀粉含量/% 糖化力/[mg葡萄糖·(g·h)-1] 发酵力/[g CO2·(0.5 g·72 h)-1] 酯化力/[mg·(50 g·7 d)-1]SHDQ1 SHDQ2 12.17±0.25 13.33±0.53*0.81±0.03 0.72±0.03*62.30±0.36 63.33±0.39 670.00±8.16 733.33±17.00**1.87±0.07 1.38±0.03**633.33±17.00 536.67±17.00**
由表1可知,平板曲的水分、淀粉含量和糖化力要高于包包曲,而包包曲的酸度、发酵力和酯化力高于平板曲,其中,水分和酸度差异显著(P<0.05),糖化力、发酵力和酯化力差异极显著(P<0.01),淀粉含量差异不显著(P>0.05)。
2.2 中高温大曲真菌菌群多样性分析
2.2.1 高通量测序结果
两种中高温大曲样品中真菌菌群的高通量测序结果见表2。由表2可知,从两种中高温大曲样品中共获得真菌原始序列98 518条,质控后共得到有效序列98 245条,平均碱基长度为243.18 bp,测序碱基最短长度为101 bp,最长碱基长度为447 bp。
表2 两种中高温大曲样品真菌菌群高通量测序结果
Table 2 High-throughput sequencing results of fungal flora of 2 kinds of medium-high temperature Daqu samples
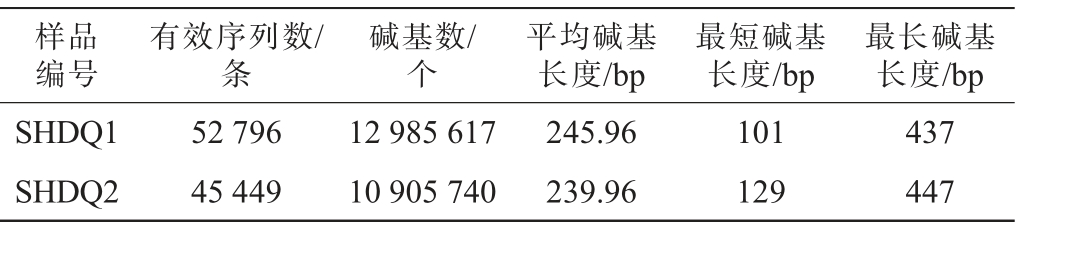
样品编号有效序列数/条碱基数/个最长碱基长度/bp SHDQ1 SHDQ2平均碱基长度/bp最短碱基长度/bp 52 796 45 449 12 985 617 10 905 740 245.96 239.96 101 129 437 447
2.2.2 真菌菌群α-多样性分析
α-多样性反映的是单个样品物种丰富度及物种多样性,有多种衡量指标,包括Chao1指数、Ace指数、Shannon指数、Simpson指数。 其中,Chao1指数和Ace指数衡量物种丰富度即物种数量的多少,Chao1指数和Ace指数值越大,说明样品的物种丰富度越高;Shannon和Simpson指数用于衡量物种多样性,受样品群落中物种丰富度和物种均匀度的影响,Shannon指数值越大,Simpson指数值越小,说明样品的物种多样性越高[16]。Coverage指数代表OTU覆盖率,其数值越高,则样本中物种被测出的概率越高,而没有被测出的概率越低。 两种中高温大曲样品中真菌菌群的α-多样性分析结果见表3。由表3可知,两种中高温大曲样品的Coverage指数均>0.999,说明本次实验所建立的文库可以比较真实、有效地反映样本真菌菌群多样性。两种中高温大曲样品的α-多样性指数均比较接近,表明两种中高温大曲样品的真菌微生物从群落物种多样性和丰富度上差异较小。
表3 两种中高温大曲样品真菌菌群α-多样性分析结果
Table 3 Results of α-diversity analysis of fungal flora of 2 kinds of medium-high temperature Daqu samples
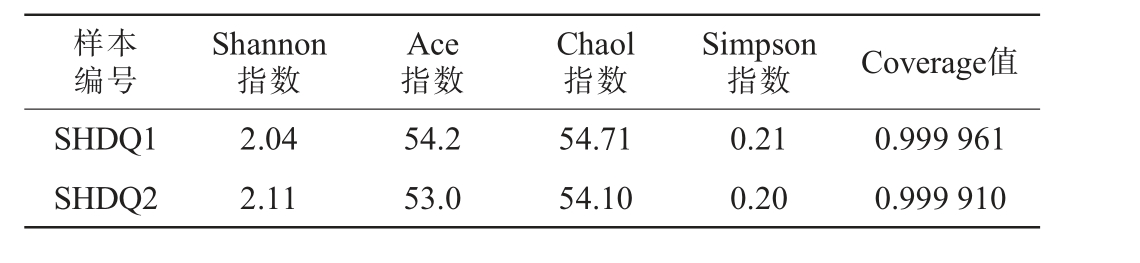
样本编号Shannon指数Ace指数Chaol指数Simpson指数 Coverage值SHDQ1 SHDQ2 2.04 2.11 54.2 53.0 54.71 54.10 0.21 0.20 0.999 961 0.999 910
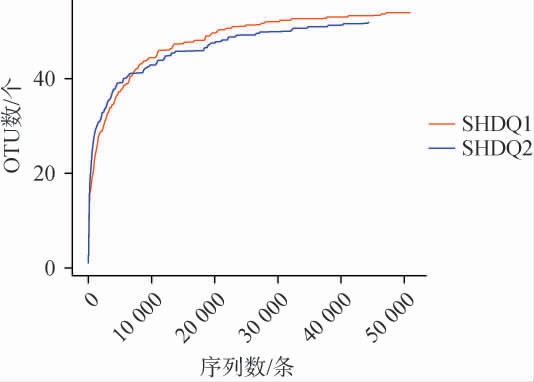
稀释曲线是从样本中随机抽取一定数量的序列,统计这些序列对应样本的α-多样性指数,可用于判断测序数据量是否足够,基于OTU数绘制两种中高温大曲样品真菌菌群的稀释性曲线,结果见图1。由图1可知,随着测序深度增加至10 000条时,中高温包包曲和平板曲样品真菌菌群的稀释性曲线均趋于平滑,即观测到的OTU数量趋于饱和,说明本次试验的测序深度覆盖了绝大多数真菌微生物,结果能够真实反映包包曲和平板曲真菌的群落结构多样性。
2.2.3 真菌菌群OTU分析
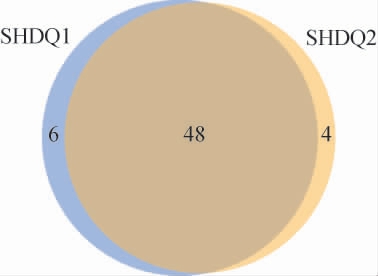
为了比较组间特有的以及共有的OTU,绘制两种中高温大曲样品的OTU韦恩图,结果见图2。由图2可知,从两种中高温大曲样品中共检测到58个OTU,其中包包曲和平板曲样品中分别检测出54个和52个OTU,两个样品共有的OTU数为48个,特有的OTU数分别为6个和4个。共有的OTU数分别占包包曲和平板曲样品中OTU总数的88.89%和92.31%,且共有的OTU的相对含量均占每种大曲样品的99.89%以上,即供试包包曲和平板曲样品中真菌OTU种类绝大多数是相同的,且这些OTU在两类中高温大曲样品中的总相对丰度均接近1,而每种样品中特有的OTU种类和含量均较低,表明菌群结构较为相似。
2.2.4 真菌菌群结构分析
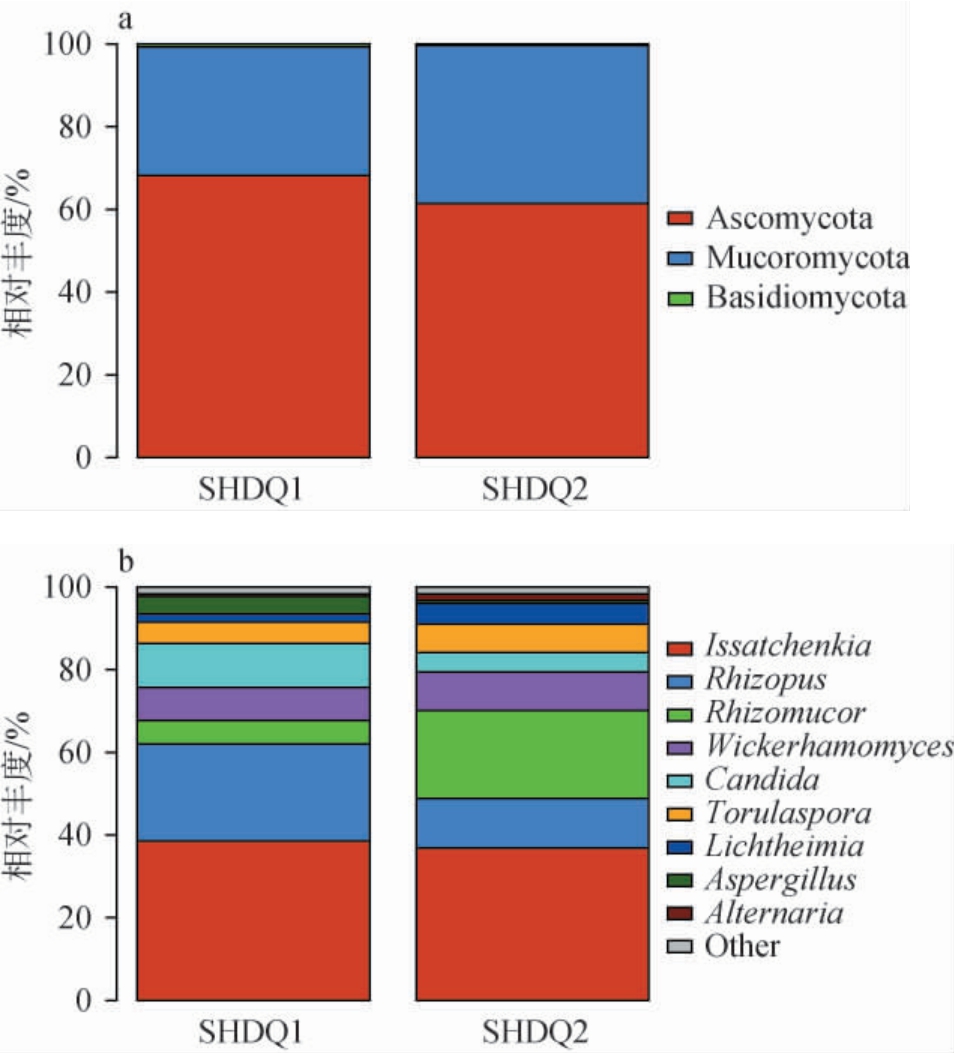
两种中高温大曲样品中检出的58个OTU共注释到3个门、8个纲、10个目、20个科及30个属。 为了进一步解析两种中高温大曲样品中真菌群落的差异,从门和属水平对两种中高温大曲样品的真菌群落结构进行分析,结果见图3。
由图3a可知,从两种中高温大曲样品中均检测出子囊菌门(Ascomycota)、毛霉门(Mucoromycota)和担子菌门(Basidiomycota)3个真菌门。其中,子囊菌门和毛霉门均为两种中高温大曲样品的优势真菌门(相对丰度>1%),平均相对丰度分别为64.78%、34.71%。尽管两种中高温大曲样品的真菌门种类一致,但其相对丰度存在一定的差异,且包包曲中的子囊菌门和担子菌门的相对丰度高于平板曲,而毛霉门的相对丰度低于平板曲,这与胡晓龙等[26]之前的相关研究结果基本一致。
由图3b可知,从包包曲和平板曲样品中均分别检测出28个真菌属,且均含有8个优势真菌属(相对丰度>1%)。包包曲中的优势真菌属包括伊萨酵母属(Issatchenkia)(38.55%)、根霉属(Rhizopus)(23.45%)、假丝酵母属(Candida)(10.63%)、威克汉姆酵母属(Wickerhamomyces)(7.98%)、根毛霉属(Rhizomucor)(5.71%)、有孢圆酵母属(Torulaspora)(5.25%)、曲霉属(Aspergillus)(4.27%)及横梗霉属(Lichtheimia)(1.93%)。 平板曲中的优势真菌属包括伊萨酵母属(Issatchenkia)(36.84%)、根毛霉属(Rhizomucor)(21.35%)、根霉属(Rhizopus)(11.96%)、威克汉姆酵母属(Wickerhamomyces)(9.31%)、有孢圆酵母属(Torulaspora)(6.92%)、横梗霉属(Lichtheimia)(4.95%)、假丝酵母属(Candida)(4.65%)、链格孢属(Alternaria)(1.54%)。结果表明,包包曲和平板曲样品的真菌菌群结构相似,但在相对丰度上存在差异。 尽管本研究检测到的多个优势真菌属与之前报道的优势真菌属一致,但他们存在一定的差异,如本研究中高温大曲样品中的第一优势真菌属均为伊萨酵母属,而其他地域的中高温大曲的第一优势真菌属为嗜热子囊菌属(Thermoascus)或复膜孢酵母属(Saccharomycopsis)[26-27],表明大曲的微生物群落结构除了与大曲的形状有关之外,地域对大曲真菌群落结构的影响可能更大。
上述优势真菌属在白酒酿造环境中已被发现或应用,刘婷婷[28]在白云边酒中筛选出一株耐高温、耐高酒精度等特性的东方伊萨酵母,且该菌株具有较强的产乙酸乙酯能力。 和晶晶等[29-30]从酒曲中筛选出一株高产糖化酶的米根霉,其中含有丰富的糖化型淀粉酶,能将糯米淀粉结构中的α-1,4糖苷键和α-1,6糖苷键切断,使淀粉绝大部分转化为可发酵性糖,且米根霉在发酵过程中产生乙酸乙酯、丙酸乙酯、正丙醇、3-甲基丁醇、乙醛等芳香性成分。 假丝酵母属(Candida)中有许多种具有酒精发酵的能力[31-32]。任勰珂等[33]在茅台地区酱香型酒糟中分离筛选出一株具有一定的淀粉、纤维素和蛋白质分解能力的微小根毛霉(Rhizomucor pusillus)。 威克汉姆酵母属(Wickerhamomyces)属于非酿酒酵母,虽然其发酵能力较低,但其可以合成多种酶,将原料中的前体物质转化成酯、酸、高级醇和醛等风味物质,对白酒风味的形成有着重要的作用[34]。 FU Z L等[35]在白酒酿造环境中筛选出一株高产乙酸乙酯的异常威克汉姆(Wickerhamomyces anomalus)。 有孢圆酵母属(Torulaspora)属于非酿酒酵母,但其发酵过程中产生的特殊果香对葡萄酒有着重要作用,如乙酸己酯、乙酸异戊酯和乙酸苯乙酯等[36]。 横梗霉属(Lichtheimia)菌株发酵能产生高活性的酯酶[37],吕梅[38]在大曲中筛选到一株产酯酶活性较高的横梗霉,该菌株发酵液的酶活达15.58 U/mL。
2.3 两种中高温大曲的理化指标与真菌群落的相关性分析
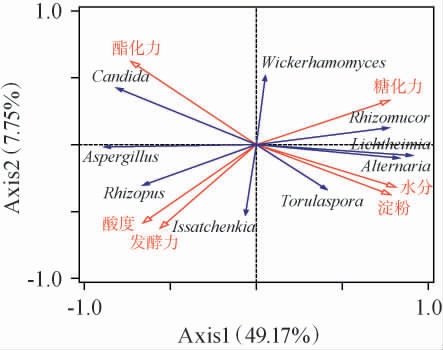
利用中高温大曲的理化指标及排名前9的真菌属进行RDA,结果见图4。由图4可知,Axis1和Axis2轴共解释了优势真菌群落56.92%的变异率,表明大曲真菌微生物群落与大曲理化性质之间存在着一定的相关性。通过条件限制性分析用于了解大曲理化指标对真菌菌群的影响,结果表明,其影响程度分别为糖化力(55.00%)>酯化力(25.70%)>发酵力(17.80%)>酸度(1.20%)>淀粉含量(0.10%)=水分含量(0.10%)。其中,糖化力和酯化力对真菌群落具有显著影响(P<0.05),其余理化因子均无显著性影响(P>0.05)。9个真菌属分布规律明显,如Candida、Aspergillus和Rhizopus主要分布在Axis1轴中心垂直线的左侧并与酯化力、酸度和发酵力呈正相关,说明这几个属的微生物具有耐酸的能力,与糖化力、水分和淀粉含量呈负相关。 Rhizomucor、Lichtheimia、Alternaria和Torulaspora 4个真菌属均分布在Axis1轴中心垂直线的右侧,主要与糖化力、水分和淀粉含量呈正相关,与酯化力、酸度和发酵力呈负相关,说明这几个属的微生物不耐酸;Wickerhamomyces和Issatchenkia在Axis1轴中心垂直线的附近,Wickerhamomyces与酯化力和糖化力呈正相关,与其余理化指标呈负相关,而Issatchenkia则恰好与其相反。 此前也有研究发现,Candida与酯化力、酸度和发酵力呈正相关,Issatchenkia与酯化力呈负相关[39]。 综上,糖化力和酯化力是影响大曲中优势真菌微生物菌群结构的主要理化因子。
3 结论
本研究通过高通量测序技术对宋河中高温包包曲与平板曲真菌群落结构进行分析,结果从两种大曲中共划分到58个OTU,隶属于3门8纲10目20科30属。 两种大曲真菌群落的α-多样性指数值相近,菌群结构相似,但平均相对丰度有一定的差异。 共有优势真菌属(相对丰度>1%)为Issatchenkia、Rhizopus、Candida、Wickerhamomyce、Rhizomucor、Torulaspora、Lichtheimia,包包曲与平板曲中特有的优势真菌属分别为Aspergillus、Alternaria。通过测定两种大曲的理化性质发现,包包曲平板曲的水分、淀粉含量及糖化力较高,而包包曲的酸度、发酵力及酯化力较高,其中,水分、酸度及糖化力、发酵力、酯化力差异显著(P<0.05)。RDA结果表明,大曲的理化特性对真菌群落具有不同程度的影响,其中,糖化力和酯化力是影响大曲中优势真菌微生物菌群结构的主要理化因子。 本研究结果对不同形状大曲真菌群落结构的研究提供了理论基础,同时对大曲品质的提升奠定了依据。
参考文献:
[1]谢再斌,常煦,何国庆,等.清香型白酒酿造过程中功能微生物及应用研究[J].中国酿造,2024,43(7):27-32.
[2]惠丰立,褚学英,冯金荣,等.大曲中可培养霉菌多样性的分子分析[J].食品与生物技术学报,2007,26(2):76-79.
[3]明红梅,余欢,周健,等.大曲中产香兼性厌氧细菌的筛选及挥发性成分分析[J].食品与机械,2015,31(2):7-10.
[4]沈怡方.白酒风味质量形成的主要因素[J].酿酒科技,2005(11):19-23.
[5]戴学东.大曲生产车间智能制造系统设计及智能曲房系统设计[D].自贡:四川轻化工大学,2021.
[6]崔如生,崔凤元,孔祥玉.包包曲在洋河大曲酒生产上的应用研究[J].酿酒,2007(5):45-46.
[7]刘安然,罗俊,易贵云,等.包包曲生产和应用试验[J].酿酒科技,2006(7):62-64.
[8]WANG C L, SHI D J, GONG G L.Microorganisms in Daqu: A starter culture of Chinese Maotai-flavor liquor[J].World J Microb Biot,2008,24(10):2183-2190.
[9]赵东,牛广杰,彭志云,等.五粮液包包曲中微生物区系变化及其理化因子演变[J].酿酒科技,2009(12):38-40.
[10]张双燕,廖永红,纪南,等.基于高通量测序技术分析北京清香型大曲微生物多样性[J].中国酿造,2016,35(11):49-53.
[11]徐占成,徐姿静,刘孟华,等.高通量测序法对剑南春大曲真菌群落结构的分析[J].酿酒科技,2018(4):22-25,32.
[12]高亦豹,王海燕,徐岩.利用PCR-DGGE未培养技术对中国白酒高温和中温大曲细菌群落结构的分析[J].微生物学通报,2010,37(7):999-1004.
[13]秦楠,栗东芳,杨瑞馥.高通量测序技术及其在微生物学研究中的应用[J].微生物学报,2011,51(4):445-457.
[14]商海林.中高温大曲高产糖化酶及蛋白酶活力菌株的筛选与应用研究[D].济南:齐鲁工业大学,2024.
[15]王清龙,李海登,刘延波,等.河南不同地区浓香型白酒大曲理化性质和微生物多样性分析[J].中国酿造,2022,41(11):31-38.
[16]王玉荣,侯强川,田龙新,等.邯郸地区不同类型高温大曲细菌群落与理化特性差异性分析[J].现代食品科技,2024,40(10):136-145.
[17]毛文定,冯文聪,孙威,等.不同香型白酒酿造大曲微生物群落与理化指标关联分析[J].中国酿造,2024,43(7):147-153.
[18]徐锦,冯文聪,朱澳迪,等.不同香型大曲微生态结构及其发酵特性相关性分析[J].食品科学,2024,45(13):104-114.
[19]刘石雪,武艳丽,王秀菊,等.中高温大曲发酵过程中理化指标及微生物消长规律研究[J].酿酒科技,2024(8):25-29,37.
[20]孙亮霞,王生艳,林一心,等.中高温大曲贮存期间理化指标及微生物群落动态分析[J].食品与发酵工业,2025,51(7):122-128.
[21]刘延波,王一菲,赵志军,等.包包曲与平板曲理化指标及细菌群落结构研究[J].轻工学报,2021,36(6):9-20.
[22]KÕLJALG U,NILSSON R H,ABARENKOV K,et al.Towards a unified paradigm for sequence-based identification of fungi[J].Mol Ecol,2013,22(21):5271-5277.
[23]印丽,邱树毅,曹文涛,等.酱香型白酒核心产区大曲的酶系分析[J].现代食品科技,2021,37(3):89-96.
[24]杨牛恬.清香型白酒酿造微生物菌群结构及其与理化参数及风味物质的相关性研究[D].晋中:山西农业大学,2022.
[25]侯强川,王文航,徐媛媛,等.徐坊中高温大曲发酵过程中理化品质、风味及真菌群落结构变化规律研究[J].食品工业科技,2024,45(19):133-141.
[26]胡晓龙,王康丽,牛广杰,等.基于高通量测序技术的中温大曲中微生物群落多样性解析[J].轻工学报,2019,34(4):21-29.
[27]刘延波,魏蒙蒙,王琳琳,等.包包曲和平板曲挥发性风味成分及真菌群落结构研究[J].轻工学报,2022,37(5):12-23.
[28]刘婷婷.白云边酒酿造微生物分析及东方伊萨酵母发酵特性研究[D].武汉:武汉工业学院,2011.
[29]和晶晶,伍时华,伍保龙,等.高糖化力米根霉的筛选和鉴定[J].中国调味品,2014,39(10):1-6,14.
[30]BRAMORSKI A, CHRISTEN P, RAMIREZ M, et al.Production of volatile compounds by the edible fungus Rhizopus oryzae during solid state cultivation on tropical agro-industrial substrates[J].Biotechnol lett,1998,20(4):359-362.
[31]施安辉,关纪奎,张文璞,等.徐坊大曲的微生物区系及其优势菌的鉴定[J].酿酒科技,2001(6):26-28.
[32]吕旭聪,翁星,黄若兰,等.红曲黄酒酿造用曲及传统酿造过程中酵母菌的多样性研究[J].中国食品学报,2012,12(1):182-190.
[33]任勰珂,陈莉,卢红梅,等.茅台地区酱香型酒糟中高温真菌的分离鉴定[J].中国酿造,2017,36(2):69-74.
[34]简晓平,简章容,余丽辰,等.1株Wickerhamomyces酵母菌对浓香型白酒发酵的影响[J].酿酒科技,2017(9):33-38.
[35]FU Z L,SUN B G,LI X T,et al.Isolation and characterization of a high ethyl acetate-producing yeast from Laobaigan Daqu and its fermentation conditions for producing high-quality Baijiu[J].Biotech Biotechnol Equip,2018,32(5):1218-1227.
[36]宿萌,李蕊蕊,王欢,等.戴尔有孢圆酵母对品丽珠和马瑟兰葡萄酒香气物质的影响[J].食品与发酵工业,2020,46(21):62-69.
[37]齐白羽,洪梦楠,陈誉文,等.优良本土戴尔有孢圆酵母的筛选及其在冰葡萄酒酿造中的应用[J].中国酿造,2021,40(10):118-122.
[38]吕梅.Lichtheimia属HSM菌株酯酶发酵条件及酶学特性研究[D].武汉:湖北工业大学,2014.
[39]侯小歌,惠明,王文琪,等.不同品种小麦中温大曲真菌群落多样性及其品质分析[J].中国酿造,2024,43(7):162-170.