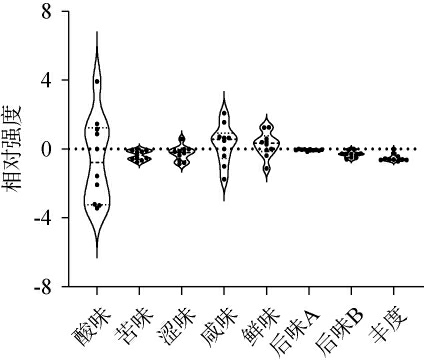
图1 梁山地区低温大曲样品电子舌分析在各滋味指标上的相对强度
Fig.1 Relative intensity of various taste indicators for low-temperature Daqu samples from Liangshan region analysis by electronic tongue
小提琴中的实心点表示数据点,小提琴中的虚线从上往下分别表示1/4位线、1/2位线和3/4位线。
Analysis of sensory characteristics and bacterial community structure of low-temperature Daqu
大曲是酿造白酒不可缺少的辅料之一,为白酒的酿造提供了糖化和发酵动力[1]。由于制作环境开放,大曲可从原料、车间环境、生产工具以及操作人员等多个途径接种微生物,也因此形成了一个由细菌、酵母和霉菌组成的复杂微生物体系[2]。按照发酵的顶温,大曲可被分为低温大曲、中温大曲、中高温大曲和高温大曲四类[3-4]。相较于其他三类大曲,低温大曲的发酵温度最低,发酵顶温在45~47 ℃之间,因而蕴含的微生物类群相对丰富[5]。低温大曲采用大麦和豌豆为原料,通常被用于酿造清香型白酒,对白酒的风味特征产生了不容忽视的影响。ZHENG Y F等[6]研究发现,低温大曲为清香型白酒酿造提供了关键糖化酶,同时还贡献了与乙醇和风味化合物相关的关键微生物和酶。 XIANG F S等[7]通过解析山西太原和湖北随州地区的清香型大曲微生物群落结构,发现两个产区的低温大曲在乳酸菌群和嗜热菌群上有很大差异,说明大曲的微生物可能受到了地域生态环境和生产工艺的影响。我国山东省梁山县的酿酒历史可追溯至北宋时期,该县聚集了酱香、浓香、清香和芝麻香型等多种香型白酒,形成了产业集群优势[8]。然而,目前梁山县生产的低温大曲品质及其微生物类群鲜见研究报道。
随着检测技术的不断更新迭代,电子鼻和电子舌等电子传感技术的出现使得不适用于感官品鉴法的样品感官特征得以被客观评估[9-10]。 传统纯培养方法效率低且难以实现对大曲微生物类群的全面解析,而MiSeq第二代测序技术能够同时满足检测快速、数据量大、准确性高和低成本等需求[11]。 CAI W C等[12]采用电子传感技术与MiSeq测序技术分别对湖北襄阳地区清茬、后火和红心低温大曲的感官特征和微生物多样性进行解析,结果发现,红心曲能够增加芳香化合物含量,后火曲能够调节酸味和苦味,清茬曲能够降低有机硫化物的生成;CAI W C等[13]采用相同的技术还解析了不同颜色高温大曲的感官特征和真菌类群,结果表明,不同颜色的高温大曲在真菌群落结构上差异显著,各自的滋味和气味特征亦有所不同。此外,芽孢杆菌(Bacillus sp.)是大曲中功能微生物类群之一,它们在水解淀粉和蛋白质方面具有突出贡献,同时还能产生一些香味物质[14]。 因此,对大曲中的芽孢杆菌资源进行挖掘具有积极意义。
本研究首先使用电子鼻和电子舌分别对山东省梁山地区低温大曲中的挥发性风味成分和滋味指标进行检测,然后采用MiSeq高通量测序技术对低温大曲的细菌群落结构进行解析,并对两者进行相关性分析。在此基础上,进一步将梁山地区低温大曲与前期研究的襄阳地区低温大曲细菌群落结构进行比较分析[12]。最后,采用纯培养技术及分子生物学技术对梁山地区低温大曲中的芽孢杆菌进行分离鉴定。 通过本研究的开展以期为低温大曲的生产工艺提升提供一定的理论数据指导。
1.1.1 材料
低温大曲样品(编号为LS1~LS10):采集自山东省梁山市某制曲企业。
1.1.2 试剂
Magnetic Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit DP336基因组提取试剂盒:天根生化科技(北京)有限公司;引物对338F/806R、27F/1495R:上海赛恒生物科技有限公司;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)、rTaq DNA聚合酶(5 U/μL):宝日医生物技术(北京)有限公司;Illumina MiSeq测序试剂盒v3:美国Illumina公司;电子舌内部液、阴离子溶液、阳离子溶液、参比溶液:日本INSENT公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
营养琼脂培养基(nutrientagar,NA):10g/L蛋白胨、3g/L牛肉粉、5 g/L氯化钠和15 g/L琼脂。115 ℃高压蒸汽灭菌20 min。
Vetiri梯度聚合酶链式反应(polymerase chain reaction,PCR)基因扩增仪:美国AB公司;164-5050基础电泳仪:美国BIO-RAD公司;Fluor Chem FC3型化学发光凝胶成像系统:美国Protein Simple公司;MiSeq PE300高通量测序平台:美国Illumina公司;R930机架式服务器:美国DELL公司;SA402B电子舌:日本INSENT公司;PEN3电子鼻:德国Airsense公司。
1.3.1 低温大曲的气味指标检测
称取8.0 g低温大曲样品于电子鼻检测顶空瓶中,使样品体积占据顶空瓶的1/3容积。 装样的顶空瓶于25 ℃下平衡30 min,每份样品进行3组平行实验,然后参照刘芳等[15]的方法设置进样参数,最后选取传感器第49 s、50 s和51 s的检测响应值平均值作为后续分析数据。
1.3.2 低温大曲的滋味指标检测
称取30 g低温大曲样本加入到120 mL纯水中搅拌均匀后浸泡30 min,之后将浸泡液在10 000 r/min条件下离心10 min,收集上清液并使用定性滤纸过滤,最后滤液被收集用于上机检测,每份样品进行4次平行实验,取后3次实验数据的平均值用于后续分析[16]。
1.3.3 宏基因组DNA提取、PCR扩增和高通量测序
首先参照基因组DNA提取试剂盒说明书提取低温大曲样品中的宏基因组DNA,然后使用含有Barcode(核苷酸标签)信息的正向引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和反向引物806R(5'-GGACTACHVGGGTWTCTAAT-3')对细菌16S rRNA V3~V4区域进行PCR扩增,扩增体系和程序均参照腾军伟等[17]的方法并稍作修改。 PCR扩增体系(25 μL):0.5 μL DNA模板、2 μL dNTP、2.5 μL Buffer缓冲液、0.5 μL rTaq DNA聚合酶、正反引物各0.5 μL和18.5 μL超纯水。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火45 s,72 ℃延伸90 s,循环30次;70 ℃末端延伸10 min,4 ℃保存。采用1.0%琼脂糖凝胶电泳法检测扩增产物的质量,将质量合格的扩增产物纯化后委托上海美吉生物医药科技有限公司完成高通量测序。
1.3.4 序列质控和生物信息学分析
基于QIIME(v1.9.0)平台完成生物信息学分析。 首先采用PyNAST软件(v 9.0)依据Barcode信息对序列进行归并,过滤掉错配率≥0.2、引物碱基错配数≥2 bp或barcode碱基有错配的低质量序列[18],余下高质量序列按照97%序列相似度构建操作分类单元(operational taxonomic units,OTU)[19],之后采用UCHIME(v 4.1)软件对OTU进行嵌合体检查和删除[20],最后基于核糖体数据库项目(ribosomal database project,RDP)数据库完成细菌物种信息的注释[21]。
此外,从美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中下载湖北襄阳地区低温大曲细菌菌群的16S rRNA V3~V4区域序列(SRR28504965)[12],进一步将梁山地区低温大曲与襄阳地区低温大曲的细菌群落结构进行合并分析。基于合并分析划分得到的OTU计算各样品中细菌菌群的超1(Chao 1)指数和香农(Shannon)指数,并基于非加权和加权的UniFrac距离主坐标分析(principal coordinate analysis,PCoA)对两个地区低温大曲细菌菌群的β多样性进行分析;最后采用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)分析甄别两个地区低温大曲中的生物标志物。
1.3.5 芽孢杆菌菌株的分离与鉴定
参照刘雪婷等[22]的方法对低温大曲样品进行预处理和倍比稀释,选择10-4~10-6梯度稀释液涂布于NA培养基,于28 ℃恒温培养箱中培养2~3 d,培养结束后根据菌落形状、表面颜色和湿润程度的不同挑取单菌落并进行三次划线纯化,对纯化的菌株进行革兰氏染色并镜检,最后使用甘油保藏法将纯化的菌株保藏于-80 ℃。 同时参照1.3.3部分的方法提取分离菌株的基因组DNA,然后使用正向引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')、反向引物1495R(5'-CTACGGCTACCTTG-3')对菌株16S rRNA全域序列进行PCR扩增,纯化的PCR扩增产物委托上海赛恒生物科技有限公司进行测序,测序结果提交至NCBI的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行搜索。 选取同源性较高的模式菌株的16S rRNA基因序列进行系统发育分析。
1.3.6 数据处理
使用GraphPad Prism9.0软件绘制小提琴图对电子舌检测数据进行可视化;使用Origin 2021软件对细菌门和细菌属相对丰度进行可视化;使用SAS(v 8)软件计算优势细菌属与滋味品质间的相关性系数,并使用R(v 4.2.2)对数据进行可视化;梁山和襄阳地区低温大曲细菌菌群的α多样性、β多样性和核心OTU数据均使用R(v 4.2.2)实现可视化;使用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)在线工具(http://huttenhower.sph.harvard.edu/galaxy/)实现生物标志物的甄别与可视化;使用MAFFT(v 7.49)软件将菌株序列进行对齐,然后使用iqtree(v 2.1.3)软件构建分离菌株与模式菌株的系统发育树,最后使用figtree(v 1.4.3)软件对系统发育树进行可视化。
采用电子鼻和电子舌分别对低温大曲中的挥发性香气成分及滋味品质进行检测,结果分别见表1和图1。

图1 梁山地区低温大曲样品电子舌分析在各滋味指标上的相对强度
Fig.1 Relative intensity of various taste indicators for low-temperature Daqu samples from Liangshan region analysis by electronic tongue
小提琴中的实心点表示数据点,小提琴中的虚线从上往下分别表示1/4位线、1/2位线和3/4位线。
表1 梁山地区低温大曲样品电子鼻传感器检测响应值
Table 1 Electronic nose sensor detection response values of lowtemperature Daqu samples from Liangshan region

注:响应值表示检测的最小值~最大值。
金属传感器 性能描述 响应值W1C W3C W5C W1W W2S W2W W3S对芳香成分和苯类物质灵敏对芳香类和氨类物质灵敏对短链烷烃芳香成分灵敏对硫化物灵敏对乙醇和醛酮类物质灵敏对芳香成分和有机硫化物灵敏对长链烷烃类物质灵敏0.35~0.40 0.45~0.51 0.46~0.52 11.98~15.79 4.29~5.55 1.11~1.13 1.13~1.20
由表1可知,W1W传感器对低温大曲样品的响应值最高,其次为W2S、W3S和W2W传感器,最后是W1C、W3C和W5C传感器,表明低温大曲中的挥发性香气成分主要体现在硫化物上,其次为乙醇和醛酮类物质、长链烷烃类物质以及芳香成分和有机硫化物。挥发性硫、醇类化合物是酒精饮料香气的重要贡献者,其具有低阈值,可表现出强烈的香气特征[23-24]。然而,当浓度过高时,这些挥发性香气成分亦会产生类似泡菜等令人不愉快的气味,影响白酒的质量[25-26]。
由图1可知,低温大曲样品在咸味和鲜味指标上的平均相对强度较高,均>0;其次为苦味、后味A(苦的回味)、涩味和后味B(涩的回味)指标,它们的相对强度大致处于-0.3~0,而酸味和丰度(鲜的回味)指标上的相对强度较低,均<-0.5。大曲中的酸味主要来源于微生物利用碳水化合物、蛋白质和脂质等大分子物质代谢产生的有机酸和游离氨基酸等[27]。因而,大曲中微生物类群的差异或许是导致其酸味强度存在差异的原因之一。
经测序,10份低温大曲样品共得到291 700条序列,经质控过滤掉11 188条低质量序列,余下28 0512条高质量序列。按照97%序列相似度,所有高质量序列共划分到6 056个OTU。每个样品平均获得28 051条高质量序列和675个OTU,各样品的测序结果及α多样性指数见表2。
表2 梁山地区低温大曲样品的细菌菌群测序结果及α多样性指数
Table 2 Sequencing results and α-diversity indexes of bacterial flora in low-temperature Daqu samples from Liangshan region
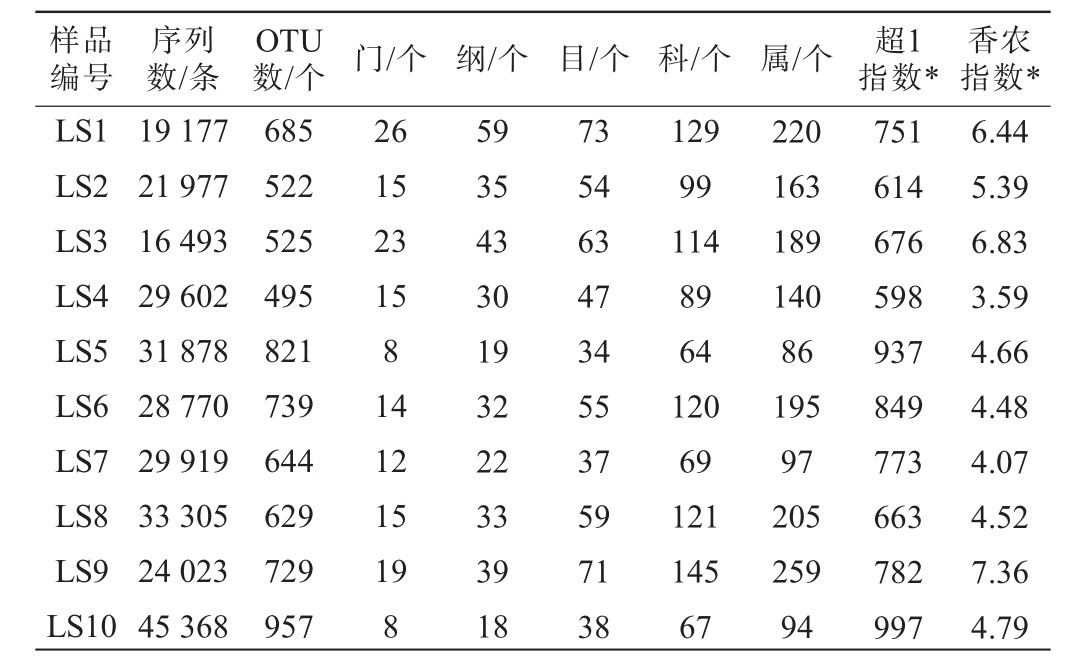
注:“*”表示均在测序深度为38 010条序列时计算得到。
样品编号序列数/条数/个 门/个 纲/个 目/个 科/个 属/个 超1指数*OTU 香农指数*LS1 LS2 LS3 LS4 LS5 LS6 LS7 LS8 LS9 LS10 19 177 21 977 16 493 29 602 31 878 28 770 29 919 33 305 24 023 45 368 685 522 525 495 821 739 644 629 729 957 26 15 23 15 8 14 12 15 19 8 59 35 43 30 19 32 22 33 39 18 73 54 63 47 34 55 37 59 71 38 129 99 114 89 64 120 69 121 145 67 220 163 189 140 86 195 97 205 259 94 6.44 5.39 6.83 3.59 4.66 4.48 4.07 4.52 7.36 4.79 751 614 676 598 937 849 773 663 782 997
由表2可知,所有高质量序列共鉴定到了26个门、59个纲、73个目、145个科和259个属,分别有0.21%和2.20%的序列未鉴定到门和属水平。α多样性指数结果显示,低温大曲样品中细菌菌群的超1指数和香农指数的范围分别在598~997之间和3.59~7.36之间,其中,样品LS4中细菌菌群的超1指数和香农指数均最低,而样品LS9中细菌菌群的超1指数和香农指数均最高。超1指数和香农指数分别用于表征物种丰富度和多样性,它们的数值越高则表明物种丰富度和多样性越高[28-29],说明样品LS4中细菌菌群的丰富度和多样性最低,而样品LS9中细菌菌群的丰富度和多样性最高。 为进一步探究其中的细菌类群,本研究基于门和属水平对其中的优势细菌类群进行分析,结果见图2。
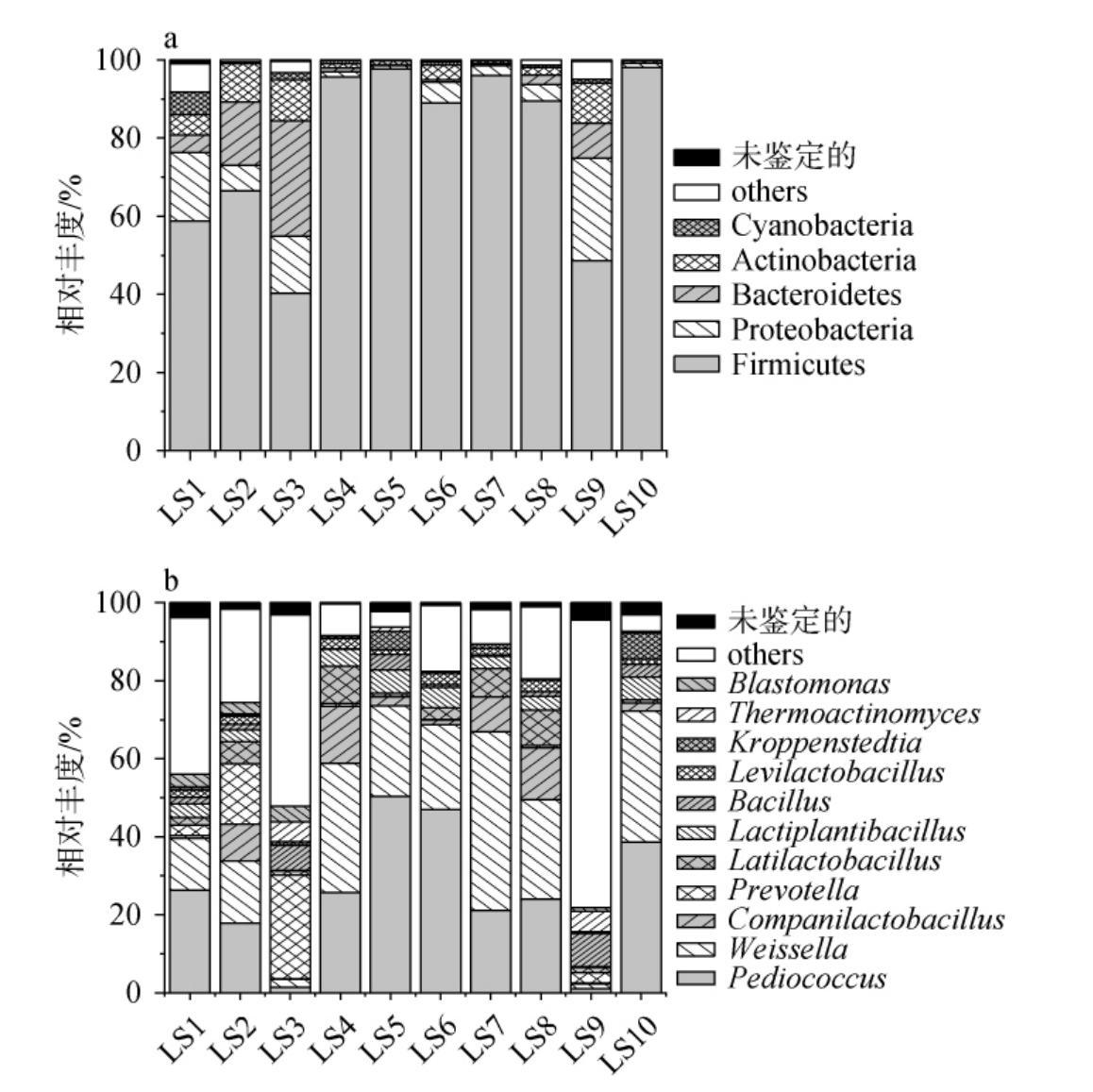
图2 基于门(a)和属(b)水平梁山地区低温大曲样品中的细菌类群
Fig.2 Bacterial community in low-temperature Daqu samples from Liangshan region based on phylum(a)and genus(b)levels
由图2a可知,所有样品中共检出5个优势细菌门(平均相对丰度>1.0%),分别为厚壁菌门(Firmicutes)(78.02%)、变形菌门(Proteobacteria)(8.05%)、拟杆菌门(Bacteroidetes)(6.34%)、变形菌门(Actinobacteria)(4.46%)和蓝细菌门(Cyanobacteria)(1.19%);所有样品中共检出11个优势细菌属,分别为片球菌属(Pediococcus)(25.33%)、魏斯氏菌属(Weissella)(21.58%)、伴生乳杆菌属(Companilactobacillus)(5.27%)、普雷沃氏菌属(Prevotella)(4.92%)、广布乳杆菌属(Latilactobacillus)(4.05%)、乳植杆菌属(Lactiplantibacillus)(3.49%)、芽孢杆菌属(Bacillus)(2.74%)、发酵剂乳杆菌属(Levilactobacillus)(1.69%)、克罗彭斯特德菌属(Kroppenstedtia)(1.55%)、高温放线菌属(Thermoactinomyces)(1.28%)和芽殖单胞菌属(Blastomonas)(1.12%)。值得注意的是,优势细菌属以外的其他属在样品LS1、LS2、LS3和LS9中的平均相对丰度亦较高,均>20%,且在样品LS9中最高(73.84%),其中相对丰度>1.0%细菌属有16个,如链球菌属(Streptococcus)(5.49%)、假单胞菌属(Pseudomonas)(5.40%)和不动杆菌属(Acinetobacter)(3.57%)等。此外,不同样品中的优势细菌属相对丰度分布具有明显差异。如Pediococcus在样品LS5和LS6中的相对丰度均>40%,而在样品LS3和LS9中的相对丰度<2.0%。Weissella、Companilactobacillus、Latilactobacillus和Lactiplantibacillus等乳酸菌类群在样品中亦表现出与Pediococcus类似的现象。 因而,乳酸菌含量不同或许是造成不同低温大曲样品酸味强度存在差异的原因之一。 另一个值得注意的现象是,低温大曲样品中乳酸菌类群含量较高,累计平均相对丰度达61.41%,而Bacillus累计平均相对丰度较低,仅有2.74%。此前,HU Y等[5]对山西地区3种类型低温大曲研究时亦发现,Bacillus含量并不丰富,但具有丰富的Pichia、Saccharomycopsis和Rhizopus等真菌类群。 出现这一现象的原因可能是,低温大曲的发酵温度低,这使得霉菌和酵母等不耐热菌群有较适宜的生长空间。 它们亦具有良好的产酶和产酯特性,也是酿酒过程中发挥糖化和酯化作用的主要菌群[30]。
进一步使用Pearson检验计算优势细菌属与感官指标之间的相关性,结果见图3。
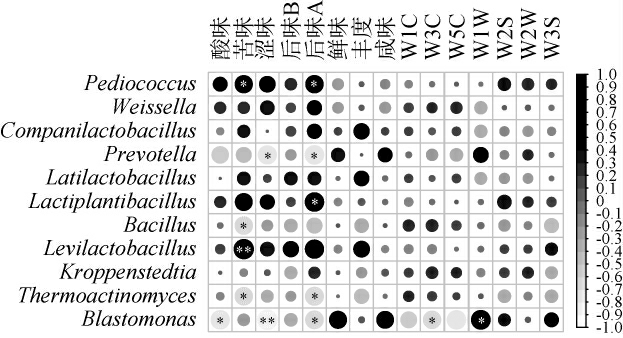
图3 梁山地区低温大曲样品中优势细菌属与感官指标间的相关性分析结果
Fig.3 Correlation analysis between dominant bacterial genera and sensory indicators of low-temperature Daqu from Liangshan region
“*”表示相关性显著(P<0.05);“**”表示相关性极显著(P<0.01)。
由图3可知,Pediococcus与苦味(R=0.645)和后味A(R=0.657)之间存在显著正相关关系(P<0.05),而Thermoactinomyces与Pediococcus则恰好相反。 Lactiplantibacillus与后味A之间呈显著正相关关系(R=0.737,P<0.05),Bacillus与苦味之间呈显著负相关关系(R=-0.653,P<0.05),Levilactobacillus与苦味之间呈极显著正相关关系(R=0.805,P<0.01)。值得一提的是,低温大曲中的优势细菌属与滋味指标间存在的显著相关关系较多,而与气味指标间的显著相关关系较少。 CAI W C等[12]在探讨湖北襄阳地区低温大曲中优势菌群与感官指标的相关关系时发现了细菌主要影响大曲的滋味品质,这与本研究结果相一致。此外,Pediococcus、Lactiplantibacillus和Levilactobacillus等乳酸菌类群都和苦味或后味A之间呈显著或极显著正相关关系(P<0.05或P<0.01),这或许和它们产乳酸的特性有关。乳酸是白酒中重要的风味成分,能够影响白酒的回味,过高的乳酸含量会导致白酒的回味发苦[31]。
CAI W C等[12]对湖北襄阳地区低温大曲样品中微生物类群进行研究,结果发现,其中的细菌菌群主要为Bacillus、Lactobacillus和Saccharopolyspora等。本研究在NCBI的GenBank数据库中下载了该研究的核苷酸序列(SRR28504965)[12],将其与梁山地区低温大曲样品的细菌群落结构进行合并分析,结果见图4。
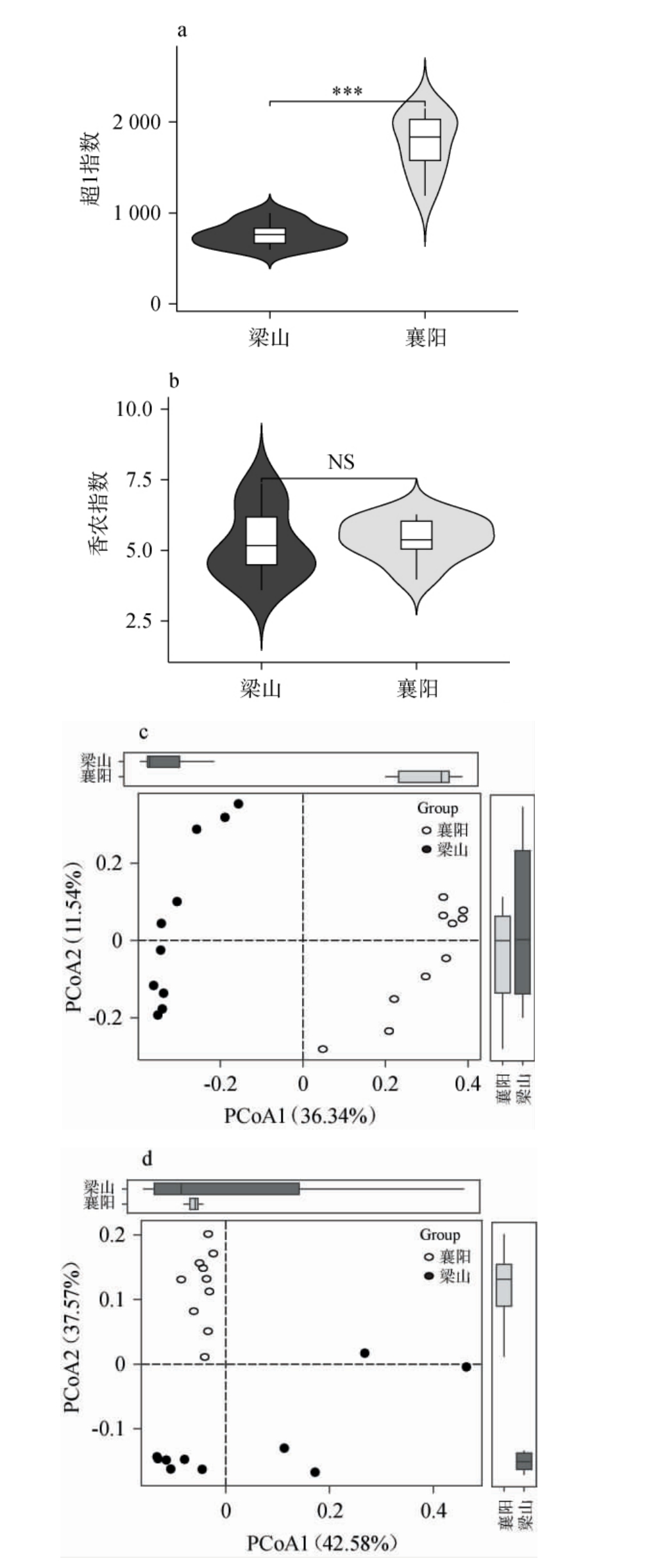
图4 梁山和襄阳地区低温大曲样品细菌菌群的α多样性和β多样性比较结果
Fig.4 Comparative analysis of α and β diversity of bacterial communities of low-temperature Daqu samples between Liangshan and Xiangyang regions
图a和b分别为两个地区低温大曲的超1指数和香农指数的小提琴图,测序深度为16 010条序列;c和d分别为基于非加权UniFrac距离和加权UniFrac距离的PCoA结果。 “NS”表示差异不显著(P>0.05);“**”表示差异极显著(P<0.01)。
由图4a和4b可知,梁山和襄阳地区低温大曲样品细菌菌群的平均超1指数分别为764和1 764,而平均香农指数分别为5.21和5.39。经Wilcoxon检验发现,两个地区低温大曲样品的细菌菌群在超1指数上存在极显著差异(P<0.01),而在香农指数上不存在显著差异(P>0.05),表明梁山地区低温大曲样品中的细菌菌群丰富度显著低于襄阳地区。
由图4c可知,在基于非加权UniFric距离的主坐标中,两个地区低温大曲样品在空间排布上呈现出明显的分离趋势,梁山地区低温大曲样品主要集中在x轴的负半轴区域,而襄阳地区低温大曲样品主要集中在x轴的正半轴区域。由图4d可知,在基于加权UniFric距离的主坐标中,两个地区的低温大曲样品在空间排布上亦呈现出明显的分离趋势。由此可见,梁山和襄阳地区低温大曲样品在细菌群落结构上有很大差异。为进一步探究两个地区菌群存在的具体差异和共性,通过使用LEfSe分析和核心OTU(在所有样品中均出现的OTU)统计分别甄别出两个地区各自的特征微生物和共有的核心细菌类群,结果见图5。
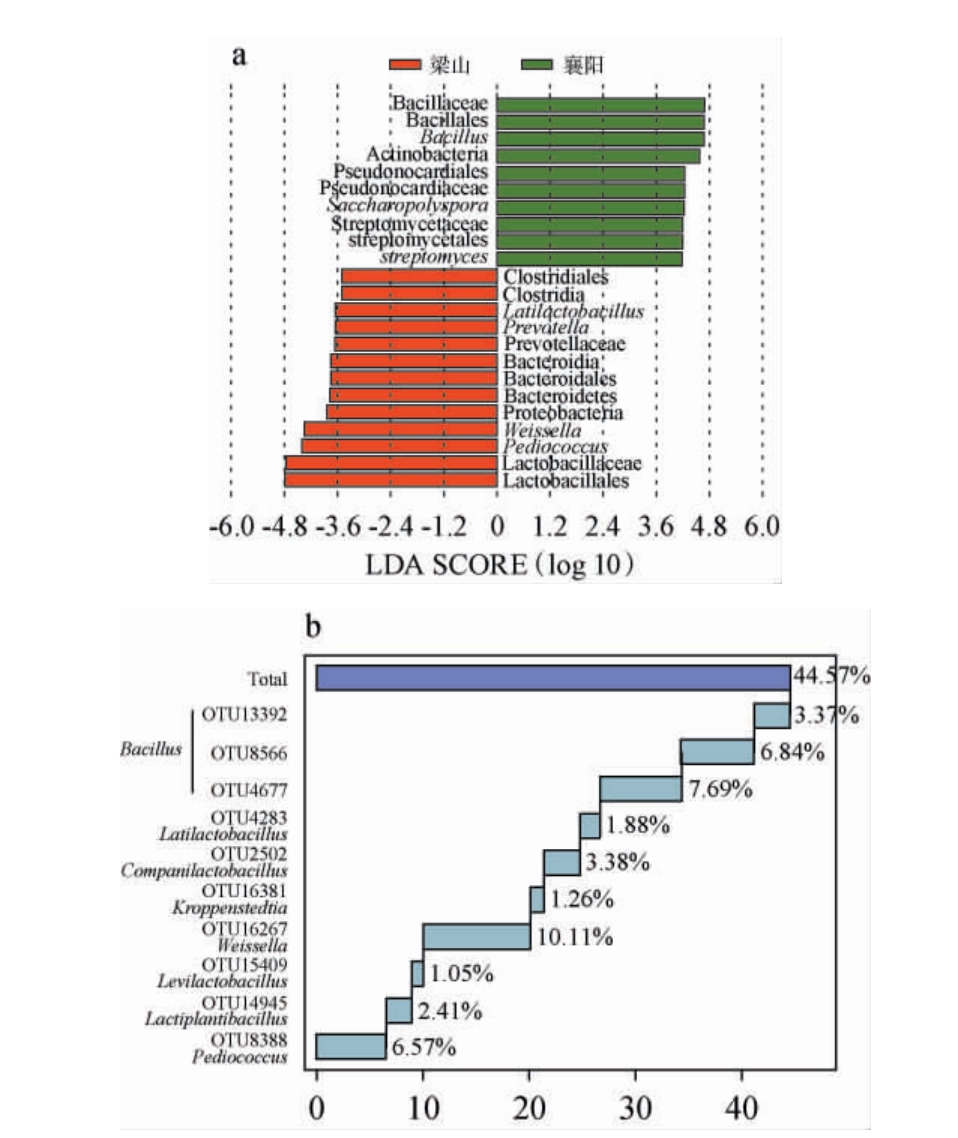
图5 梁山和襄阳地区低温大曲样品细菌菌群的线性判别分析效应大小分析(a)和核心类群分析(b)
Fig.5 Linear discriminant analysis effect size analysis (a) and core fungal taxa analysis (b) of low-temperature Daqu from Liangshan and Xiangyang regions
由图5a可知,当LDA得分阈值设为3.5时,梁山地区低温大曲样品中含有13个特征细菌类群,而襄阳地区低温大曲样品中含有10个特征细菌类群。梁山地区低温大曲样品中的特征细菌类群主要为隶属于Firmicutes的Pediococcus、Weissella、Latilactobacillus 和 隶 属 于Bacteroidetes 的Prevotella,而襄阳低温大曲样品中的特征细菌类群主要为隶属于Firmicutes的Bacillus和隶属于Actinobacteria的Saccharopolyspora和Streptomyces。由图5b可知,两个地区低温大曲样品中共含有10个核心OTU,分别被鉴定为Bacillus(OTU13392、OTU8566和OTU4677,累计平均相对含量为17.91%)、Weissella(OTU16267,10.11%)、Pediococcus(OTU8388,6.57%)、Companilactobacillus(OTU2502,3.38%)、Lactiplantibacillus(OTU14945,2.41%)、Latilactobacillus(OTU4283,1.88%)、Kroppenstedtia(OTU16381,1.26%)和Levilactobacillus(OTU15409,1.05%),累计平均相对含量为44.57%。由此可见,Bacillus、Kroppenstedtia和一些乳酸菌类群广泛存在于两个地区的低温大曲中。 然而,相较于襄阳地区低温大曲,梁山地区低温大曲样品中的乳酸菌类群更丰富,而芽孢杆菌类群较少。
尽管高通量测序结果显示,梁山地区低温大曲样品中的Bacillus含量较低,但其被认为是参与酿酒的重要微生物,具有良好的耐热和产酶特性[32]。因此,进一步通过纯培养技术从中分离芽孢杆菌菌株。 结果从10份低温大曲样品中共分离出8株疑似芽孢杆菌,编号分别为HBUAS69347、HBUAS69348、HBUAS69349、HBUAS69350、HBUAS69351、HBUAS69352和HBUAS69353。基于16S rRNA序列构建8株分离菌株与其亲缘关系最近的模式菌株的系统发育树,结果见图6。

图6 基于16S rRNA基因序列梁山地区低温大曲样品中8株芽孢杆菌分离株的系统发育树
Fig.6 Phylogenetic tree of 8 Bacillus isolates in low-temperature Daqu from the Liangshan region based on 16S rRNA gene sequence
由图6 可知,菌株HBUAS69348、HBUAS69349 和HBUAS69350与地衣芽孢杆菌(Bacillus licheniformis)ATCC 14580聚为一支,菌株HBUAS69346和HBUAS69347与索诺拉沙漠芽孢杆菌(Bacillus sonorensis)NBRC 101234聚为一支,菌株HBUAS69353与海恩斯氏芽孢杆菌(Bacillus haynesii)NRRL B-41327聚为一支,而菌株HBUAS69351和HBUAS69352与副地衣芽孢杆菌(Bacillus paralicheniformis)KJ-16聚为一支。 分离菌株与模式菌株之间的序列相似度均>99.50%,因而,鉴定菌株HBUAS69348、HBUAS69349和HBUAS69350均为B. licheniformis,菌株HBUAS69346和HBUAS69347均为B. sonorensis,菌株HBUAS69353为B.haynesii,菌株HBUAS69351和HBUAS69352均为B.paralicheniformis。
电子传感技术分析结果显示,梁山地区低温大曲中硫化物、乙醇和醛酮类物质较为丰富,咸味和鲜味指标较为突出,酸味和鲜的回味较弱。MiSeq高通量测序技术结果表明Pediococcus、Weissella、Companilactobacillus和Prevotella等构成了梁山地区低温大曲中的优势菌群,其中乳酸菌类群含量较高。优势细菌属大多与滋味指标间存在显著相关关系(P<0.05),且乳酸菌类群大多与苦味或苦味的回味指标间存在正相关关系(P<0.05)。 梁山和襄阳地区低温大曲共有的细菌类群包括Bacillus、克罗彭斯特德菌属(Kroppenstedtia)和部分乳酸菌,且与襄阳地区低温大曲群落结构相比较,梁山低温大曲中的细菌菌群丰富度较低,芽孢杆菌含量较少,乳酸菌含量较高。采用纯培养技术从梁山低温大曲中共分离鉴定出8株芽孢杆菌,包括3株Bacillus licheniformis、2 株Bacillus sonorensis、2 株Bacillus paralicheniformis和1株Bacillus haynesii。因而,在后续生产低温大曲时控制乳酸菌含量过高的现象或许能进一步改善低温大曲及其酿造的清香型白酒产品品质。
[1]ZHOU Q F,MA K,SONG Y,et al.Exploring the diversity of the fungal community in Chinese traditional Baijiu daqu starters made at low-,mediumand high-temperatures[J].LWT-Food Sci Technol,2022,162(6):113408.
[2]XU Y Q,ZHAO J R,LIU X,et al.Flavor mystery of Chinese traditional fermented Baijiu: The great contribution of ester compounds[J].Food Chem,2022,369(2):130920.
[3]DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].Int J Food Microbiol,2019,297(5):32-40.
[4]ZHU M,ZHENG J,XIE J,et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Res Int,2022,153(3):110955.
[5]HU Y,HUANG X N,YANG B,et al.Contrasting the microbial community and metabolic profile of three types of light-flavor Daqu[J].Food Biosci,2021,44(12):101395.
[6]ZHENG Y F, LIANG F, WU Y, et al.Unraveling multifunction of lowtemperature Daqu in simultaneous saccharification and fermentation of Chinese light aroma type liquor[J].Int J Food Microbiol,2023,397(7):110202.
[7]XIANG F S,CAI W C,HOU Q C,et al.Comparative analysis of the microbial community structure in light-flavor Daqu in Taiyuan and Suizhou regions,China[J].LWT-Food Sci Technol,2023,177(3):114599.
[8]徐秋慧.关于山东白酒市场营销问题与对策的探讨——以古贝春酒业为例[J].经济研究导刊,2021(22):50-52.
[9]KARAKAYA D,ULUCAN O,TURKAN M.Electronic nose and its applications:A survey[J].Int J Automation Comput,2020,17(2):179-209.
[10]ROSS C F.Considerations of the use of the electronic tongue in sensory science[J].Curr Opin Food Sci,2021,40(8):87-93.
[11]EL SHEIKHA A F,HU D M.Molecular techniques reveal more secrets of fermented foods[J].Crit Rev Food Sci Nutr,2020,60(1):11-32.
[12]CAI W C,WANG Y R, NI H, et al.Diversity of microbiota, microbial functions,and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150(12):110734.
[13]CAI W C,XUE Y,WANG Y R,et al.The fungal communities and flavor profiles in different types of high-temperature Daqu as revealed by highthroughput sequencing and electronic senses[J].Front Microbiol,2021,2021(12):784651.
[14]梁栩煜,钱敏,白卫东,等.白酒酿造过程中的微生物研究进展[J].中国酿造,2020,39(7):11-15.
[15]刘芳,杨康卓,张建敏,等.基于电子鼻和气质联用技术的浓香型白酒分类[J].食品与发酵工业,2020,46(2):73-78.
[16]王玉荣,张俊英,潘婷,等.籼米米酒和糯米米酒品质的评价[J].食品与发酵工业,2017,43(1):186-191.
[17]腾军伟,赵笑,杨亚威,等.酒曲中产凝乳酶微生物菌株的分离筛选及鉴定[J].食品科学,2017,38(16):23-28.
[18]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nat Meth,2010,7(5):335-336.
[19]WEI Z G, ZHANG X D, CAO M, et al.Comparison of methods for picking the operational taxonomic units from amplicon sequences[J].Front Microbiol,2021,12(3):644012-644026.
[20]EDGAR R C, HAAS B J, CLEMENTE J C, et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[21]BRANDT M I, TROUCHE B, QUINTRIC L, et al.Bioinformatic pipelines combining denoising and clustering tools allow for more comprehensive prokaryotic and eukaryotic metabarcoding[J].Mol Ecol Resour,2021,21(6):1904-1921.
[22]刘雪婷,王子媛,刘继明,等.清香型白酒酒醅发酵菌株分离鉴定及细菌群落结构分析[J].中国酿造,2021,40(1):39-43.
[23]XIANG D,LI P,GONG R,et al.Quantification and distribution of thiols in fermented grains of Sauce-aroma Baijiu production process[J].Foods,2023,2023(12):2658.
[24]CHEN S, SHA S, QIAN M, et al.Characterization of volatile sulfur compounds in Moutai liquors by headspace solid-phase microextraction gas chromatography-pulsed flame photometric detection and odor activity value[J].J Food Sci,2017,82(12):2816-2822.
[25]MESTRES M,BUSTO O,GUASCH J.Analysis of organic sulfur compounds in wine aroma[J].J Chromatogr A,2000,881(1-2):569-581.
[26]JIMENEZ-LORENZO R,BLOEM A,FARINES V,et al.How to modulate the formation of negative volatile sulfur compounds during wine fermentation?[J].FEMS Yeast Res,2021,21(5):foab038.
[27]王俏,郭聃洋,王旭亮,等.中国白酒不同香型酒曲理化性能对比分析[J].酿酒科技,2015(6):6-10.
[28]QIU Z, LI N, LU X, et al.Characterization of microbial community structure and metabolic potential using Illumina MiSeq platform during the black garlic processing[J].Food Res Int,2018,106(7):428-438.
[29]姚国强.传统发酵乳中细菌多样性及其功能基因研究[D].呼和浩特:内蒙古农业大学,2017.
[30]唐佳代,刘力萍,龙亚飞,等.不同感官特性酱香大曲真菌群落结构与理化特性[J].食品科学,2022,43(14):193-198.
[31]PANG X N,CHEN C,HUANG X N,et al.Influence of indigenous lacti c acid bacteria on the volatile flavor profile of light-flavor Baijiu[J].LWTFood Sci Technol,2021,147(7):111540.
[32]WANG P, WU Q, JIANG X J, et al. Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].Int J Food Microbiol,2017,250(6):59-67.