Isolation and identification of Monascus strains and its degradation treatment of pit bottom wastewater of the sauce-flavor Baijiu byproduct
酱香型白酒酿造过程会产生大量高浓度有机废水[1],尤其是窖底水,拥有较大的环境负荷,其生化需氧量(biochemical oxygen demand,BOD5)约为1 000~20 000 mg/L,化学需氧量(chemical oxygen demand,CODcr)约为2 500~45 000 mg/L。窖底水源于谷物在窖池中发酵时,其中的结晶水、微生物自溶物、色素、可溶性淀粉沉降聚集在窖池底部,形成的黏稠深褐色液态[2]。据不完全统计,每生产1 t的白酒,约耗水60 t,产生窖底水18 t,使得酿酒已成为我国排放有机污染物浓度和排量最高的行业之一[3],对白酒企业周遭环境造成较大生态压力。 此外,白酒酿造废水的处理成本较高,依照贵州省仁怀市污水处理收费标准,白酒酿造废水处理费用高达600元/t,是城市污水处理成本的300倍[4]。
目前,处理窖底水等高浓度有机废水的生物方法多采用细菌和微藻处理[5-6]。 细菌和微藻虽能显著降低废水的BOD5和CODcr值,但需采用电化学等物理化学手段对废水进行前处理[7],且存在菌体分离困难并导致二次污染的风险。现行工艺多局限于污染物消减,未能挖掘窖底水的高值转化潜力。因此,迫切需要一种既能直接降解窖底水,又易于从窖底水中分离去除,且能从窖底水中富集高附加值代谢产物的微生物,从而降低废水处理成本。
红曲霉(Monascus spp.)是一种异养自然分解微生物,能通过吸附、转化、矿化等将有机物分解为水和二氧化碳[8]。同时,其以生产各种生物活性物质而闻名,包括洛伐他丁、γ-氨基丁酸、生育酚等[9],洛伐他丁和γ-氨基丁酸具有镇静,降血压和降血脂的作用[10-11]。更值得关注的是,Monascus spp.还展现出独特的极端环境适应性[12]。因此,Monascus spp.常用来给食品加工副产物或废水等增值[13]。ZHENG Y等[4]利用丛毛红曲霉(M.pilosus)在气升式生物反应器中处理高浓度有机废水废水以生产短链脂肪酸[4]。 ABDEL-RAHEAM H等[14]利用M.purpureus处理马铃薯加工废水以获取更多红曲色素。SOUZA F P等[15]同样利用M.purpureus将豌豆加工废水转化为可食用真菌蛋白。而TERAN H R等[16]曾利用Monascus spp.在黑暗条件下发酵甘蔗渣废水,并实现了最高的红曲色素产量。因此筛选具有降解性能和产高附加值代谢物性能的优良红曲霉具有重要意义。
本研究采用传统培养分离法从酱香型白酒大曲中筛选红曲霉菌株,通过形态学观察及分子生物学技术对筛选菌株进行鉴定,利用生物量评估红曲霉的生长能力,考察筛选红曲霉菌株发酵窖底水对有机污染物的降解效果及对产洛伐他汀和γ-氨基丁酸的影响,并解析高附加值代谢产物合成机制。旨在利用红曲霉发酵窖底水高效生产洛伐他汀或γ-氨基丁酸,这种污染治理-资源回收的创新模式,与酿酒产业倡导的“清洁生产-循环利用”理念高度契合,为白酒酿造副产物资源化利用提供科学依据。
1.1.1 原料
酱香型白酒大曲、窖底水、大米、高粱:贵州龙黔威酒业有限责任公司。
1.1.2 化学试剂
洛伐他丁标准品、γ-氨基丁酸标准品(纯度均>98%)、甲醇、乙腈和磷酸(均为色谱纯):北京Solarbio科技有限公司;乙醇、葡萄糖、氯化钠、磷酸二氢钠、己酸、丁酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、α-萘酚、重铬酸钾、硫酸亚铁、硝酸钾、磷酸盐缓冲液(phosphate buffer solution,PBS)、对硝基苯酚(p-nitrophenol,p-NP)和对硝基苯-β-D-葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,pNPG)(均为分析纯):上海Macklin生化科技股份公司;植物脱氧核糖核酸提取试剂盒(通用型):北京擎科生物科技有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato glucose agar,PDA)培养基、马铃薯葡萄糖肉汤(potato glucose broth,PDB)培养基:上海源叶生物科技有限公司。
1%氯霉素的PDA培养基:称取1 g氯霉素粉末溶解于10 mL无水乙醇中,搅拌至完全溶解,0.22 μm滤膜过滤除菌制成氯霉素母液。121 ℃高温蒸汽灭菌30 min后冷却至50 ℃,按每100 mL PDA培养基加1 mL氯霉素母液,摇匀迅速倒平板。
大米培养基的制备:新鲜大米用蒸馏水浸泡过夜备用。称取20g大米加入10mL蒸馏水,121℃高温蒸汽灭菌30min。
高粱培养基的制备:新鲜高粱用蒸馏水浸泡过夜备用。称取20g高粱加入10mL蒸馏水,121℃高温蒸汽灭菌30min。
含有窖底水的PDA培养基的制备:按照10 mL窖底水加入90 mL PDA培养基,121 ℃高温蒸汽灭菌15 min。
含有窖底水的PDB培养基的制备:按照10 mL窖底水加入90 mL PDB培养基,121 ℃高温蒸汽灭菌15 min。
含有窖底水的大米培养基的制备:称取3 g窖底水加入到配制好的大米培养基中,121 ℃高温蒸汽灭菌15 min。
含有窖底水的高粱培养基的制备:称取3 g窖底水加入到配制好的高粱培养基中,121 ℃高温蒸汽灭菌15 min。
A1260高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦公司;C18固相萃取柱(solid phase extraction column,SPEC):成都思为科学仪器有限公司;ZSD-2270电热恒温培养箱:上海智诚分析仪器制造公司;PL6001-S电子天平、DELTA 320pH计:梅特勒-托利多仪器有限公司;YXQ-LS-75SII压力蒸汽灭菌器:上海博讯实业公司医疗设备厂;JSM IT300LV扫描电子显微镜:日本电子株式会社;WD-9405B水平摇床:沃德生物医学仪器公司Multiskan SkyHigh全波长酶标仪:美国赛默飞公司;Trizol总核糖核酸(ribonucleic acid,RNA)抽提试剂盒、TruseqTM RNA sample prep试剂盒、Dynal M280磁珠:美国Invitrogen公司;NanoDrop2000:美国Thermo Scientific公司;LH-BOD602便携式生化需氧量测定计:中国联华科技公司;DR1010化学需氧量测试仪:美国HACH水质分析仪器(上海)有限公司;VeritiPro聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Thermo Scientific公司;DYCP-31CN电泳仪:北京六一生物科技有限公司;Tanon-4100凝胶成像仪:上海天能科技有限公司;TF-LYO-30冻干机:上海田枫实业有限公司。
1.3.1 酱香型白酒大曲中红曲霉的筛选
将酱香型白酒大曲粉粹,称取10 g大曲样品于100 mL无菌生理盐水中,120 r/min振荡1 h,按10倍梯度进行稀释。具体操作为取1 mL样液加入9 mL无菌生理盐水中,混匀得到10-2稀释液。重复上述操作,依次制备10-3、10-4、10-5梯度稀释液。取各梯度稀释液涂布于含有1%氯霉素的PDA培养基平板上,30 ℃恒温静置培养5 d,观察菌落情况。当菌丝生长较为明显时,用接种环挑取红色菌丝移植于另一PDA培养基平板中,进行多次分离纯化,得到纯化单菌落。
1.3.2 筛选红曲霉的鉴定
(1)孢子悬浮液的制备
按照TAO Z J等[17]的方法制备红曲霉孢子悬浮液。将分离纯化菌株在PDA培养基上于30 ℃培养8 d,然后使用pH值为7.4的无菌磷酸盐缓冲液(PBS)冲洗培养基并收集孢子。 利用定性滤纸(直径12.5 cm,孔径11 μm)过滤孢子悬浮液中的菌丝,最后利用全波长酶标仪在波长600 nm处测得的孢子悬浮液的光密度均为0.655,得到红曲霉孢子悬浮液。
(2)形态学观察
将200 μL红曲霉孢子悬浮液被接种到PDA培养基中,并在30 ℃下静置培养7 d后,观察其宏观菌落形态;按照ZHU L S等[18]的方法将成熟红曲霉菌丝体在4%戊二醛溶液中固定12 h,使用JSM IT300LV扫描电子显微镜在3 000倍放大倍数下观察红曲霉微观菌丝体形态。
(3)分子生物学技术鉴定
将纯化菌株接种于PDB培养基,30 ℃恒温培养5 d。使用植物DNA提取试剂盒(通用型)提取纯化菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和IST4)5'-TC-CTCCGCTTATTGATATGC-3')聚合酶链式反应(PCR)扩增ITS区基因序列。 PCR扩增体系(50 μL):DNA聚合酶0.25 μL,10×PCR Buffer 5 μL,25 mmol/L MgCl2 3 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP) Mixture 4 μL,DNA提取物、引物ITS1、引物ITS4各1 μL,双蒸水34.75 μL。
PCR扩增程序:95 ℃预变性5 min,36次循环(94 ℃变性1 min、52 ℃退火1 min、72 ℃延伸1.5 min),72 ℃延伸min,12 ℃结束。
PCR扩增产物经1%琼脂糖凝胶电泳检测合格后,委托北京擎科生物科技有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(National Center for BiotechnologyInformation,NCBI)的GenBank数据库中利用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性检索,选取同源性较高的模式菌株的ITS基因序列,采用MEGA 7.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.3 筛选红曲霉生长能力评估
为了在所筛选的红曲霉中获得一株生长能力最强的红曲霉,利用生物量来评估红曲霉的生长能力。 按照CHEN J等[19]的方法将100 μL红曲霉孢子悬浮液接入装液量为100 mL/250 mL的PDB培养基中,30 ℃、120 r/min下孵育7 d。5 000×g条件下离心3 min收集菌丝,用无菌水洗涤3次。 利用冻干机先在-50 ℃预冻2 h,后又在真空度10 Pa,温度-30 ℃冻干8 h至恒质量。红曲霉生物量计算公式如下:
式中:B为生物量,g/L;M为菌丝体干质量,g;V为培养基的体积,L。
1.3.4 筛选红曲霉菌株模拟发酵窖底水(1)窖底水添加量的确定
由于窖底水有机物含量高,并不适合微生物生长。 因此,需明确窖底水的添加量。采用单因素试验,将100 μL红曲霉孢子悬浮液接种到分别含有0、5%、10%、15%和20%(V/V) 窖底水的装液量为100 mL/250 mL的PDB培养基中,30 ℃、120 r/min条件下振荡培养7 d,测定红曲霉的生物量,确定窖底水的最佳添加量。
(2)红曲霉对窖底水的降解效果
利用BOD5和CODcr评估红曲霉对窖底水的降解率。将100 μL红曲霉孢子悬浮液接种至含有10%(V/V)窖底水的装液量为100 mL/250 mL的PDB培养基中,30 ℃、120 r/min条件下振荡培养15 d。 使用便携式生化需氧量测定计测量发酵0 d和15 d的BOD5值。 用0.1 mol/L NaOH将10 mL样品调节至pH值为6.0,并在8 000×g条件下离心2 min。 上清液通过0.45 μm滤膜过滤,加入消解液(0.005 mol/L磷酸盐缓冲液+0.1 mol/L氯化钾)在150 ℃条件下消解2 h后进行测量。使用化学需氧量测试仪测定发酵0 d和15 d的CODcr值。 向2 mL样品中加入1 mL K2Cr2O7-HgSO4混合液和4 mL H2SO4-AgSO4混合液,150 ℃孵育2 h后在波长610 nm条件下测定CODcr值。
1.3.5 筛选红曲霉菌株发酵窖底水产洛伐他汀和γ-氨基丁酸
按照1%的接种量将红曲霉孢子悬浮液分别接种到大米培养基、含窖底水的大米培养基、高粱培养基和含窖底水的高粱培养基中摇匀。在30 ℃下静置培养15 d,测定其中洛伐他汀和γ-氨基丁酸含量。
1.3.6 分析检测
(1)洛伐他汀
洛伐他汀的含量采用HPLC法[20]进行测定。样品前处理:取红曲霉固态发酵的产物适量,于55 ℃烘干,粉碎过40目筛。准确称取0.5 g试样,加入体积分数为75%乙醇混匀,定容至50 mL。室温下超声1 h。以8 000×g条件下离心5 min,取上清液经0.45 μm滤膜过滤后,进行HPLC分析。
内酯式(闭环)洛伐他汀标准曲线的制作:准确称取一定量的洛伐他汀标准品(内酯式),以体积分数为75%乙醇作为溶剂,配制质量浓度分别为0.005 mg/mL、0.030 mg/mL、0.045 mg/mL、0.090 mg/mL、0.270 mg/mL洛伐他汀标准溶液。 高效液相色谱检测条件:色谱柱为C18色谱柱(4.6 mm×250 mm),流动相为甲醇∶水∶磷酸=385∶115∶0.14(V/V),检测波长为238 nm,流速为1 mL/min,柱温为25 ℃,进样量为20 μL,以洛伐他汀标准溶液质量浓度(x)为横坐标,峰面积(y)为纵坐标绘制洛伐他汀标准曲线,得到线性回归方程为y=65.706 43x-5.299 64,相关系数R2为0.999。
酸式(开环)洛伐他汀的制备:称取洛伐他汀(内酯式)标准品4 mg,以0.2 mol/L氢氧化钠溶液定容至100 mL,在50 ℃条件下超声转化1 h,放置至室温后再放置1 h。将样品中酸式(开环)洛伐他汀峰面积与内酯式(闭环)洛伐他汀峰面积相加,两者峰面积之和代入标准曲线回归方程计算,得到样品中的洛伐他汀含量。
(2)γ-氨基丁酸
γ-氨基丁酸含量采用HPLC法[21]进行测定。 样品前处理:分别取发酵后的上清液1.0 mL,加入10 mL体积分数为75%的乙醇,超声提取30 min,旋涡混匀器振荡2 min,静置5 min。8 000×g条件下离心5 min取上清液。 吸取1 mL试样溶液加入4%碳酸氢钠溶液0.2 mL和0.2%4-二甲基胺基偶氮苯-4-磺酰氯衍生试剂0.4 mL,混匀,70 ℃水浴避光中衍生反应20 min,0.45 μm滤膜过滤后,进行HPLC分析。
γ-氨基丁酸标准曲线的制作:将配制好的1 000.0 mg/L的γ-氨基丁酸标准品溶液稀释成质量浓度为10.0 mg/L、20.0 mg/L、40.0 mg/L、80.0 mg/L、160.0 mg/L的标准工作液,加入4%碳酸氢钠溶液0.2 mL和0.2%的4-二甲基胺基偶氮苯-4-磺酰氯衍生试剂0.4 mL,混匀,在70 ℃且避光条件下水浴20 min,0.45 μm滤膜过滤备用。 高效液相色谱检测条件:使用C18色谱柱(4.6 mm×250 mm);检测波长为436 nm;柱温为30 ℃;进样量为10 μL;流速为1.0 mL/min;流动相为乙腈+0.68%三水合乙酸钠溶液(35%∶65%,V/V)。以γ-氨基丁酸标准液质量浓度(x)为横坐标,峰面积(y)为纵坐标,绘制γ-氨基丁酸标准曲线,得到标准曲线回归方程为y=69.789 08x+627.825 28,相关系数R2为0.998。按照标准曲线回归方程计算样品中γ-氨基丁酸含量。
1.3.7 转录组分析窖底水对红曲霉产γ-氨基丁酸的影响
(1)总RNA的提取
取1.3.7中分别在PDB培养基和PDB+10%窖底水中成熟的红曲霉孢子,按照ZHU L S等[18]的方法提取总RNA,然后采用质量浓度为1 g/100 mL琼脂糖凝胶电泳、微量分光光度计和生物分析仪评估总RNA的纯度和完整性。
(2)文库的构建和Illummina Hiseq测序
采用Oligo(dT)磁珠与poly A通过腺嘌呤-胸腺嘧啶特异性配对,从样本总RNA中高效分离出信使核糖核酸(mes senger ribonucleic acid,mRNA)。 随后,通过加入fragmentation buffer使mRNA发生随机断裂,获得平均碱基长度约为200 bp的片段化产物。 在逆转录反应体系中,采用六碱基随机引物引导,以片段化的mRNA为模板,在逆转录酶催化下合成第一链互补脱氧核糖核酸(complementary DNA,cDNA),继而通过第二链合成反应构建稳定的双链cDNA结构。后续对双链cDNA进行末端修复、连接测序接头等修饰处理,并通过片段筛选获得符合测序要求的文库。最终,将构建完成的文库进行Illumina Hiseq高通量测序,以获得完整的转录组信息。
1.3.8 数据分析
所有试验均重复进行3次,结果以“平均值±标准差”表示,采用SPSS 25.0软件和Duncan方法,对数据进行方差分析和多重测试分析。 采用Origin 2021软件和GraphPad Prism 9.5.1软件绘图。
从酱香型大曲样品中共分离筛选得到4株不同形态的红色霉菌菌落,分别编号为HSHM、AKHM、ZSHM和CMHM。4株红色霉菌菌落的宏观形态及显微形态特征见图1。
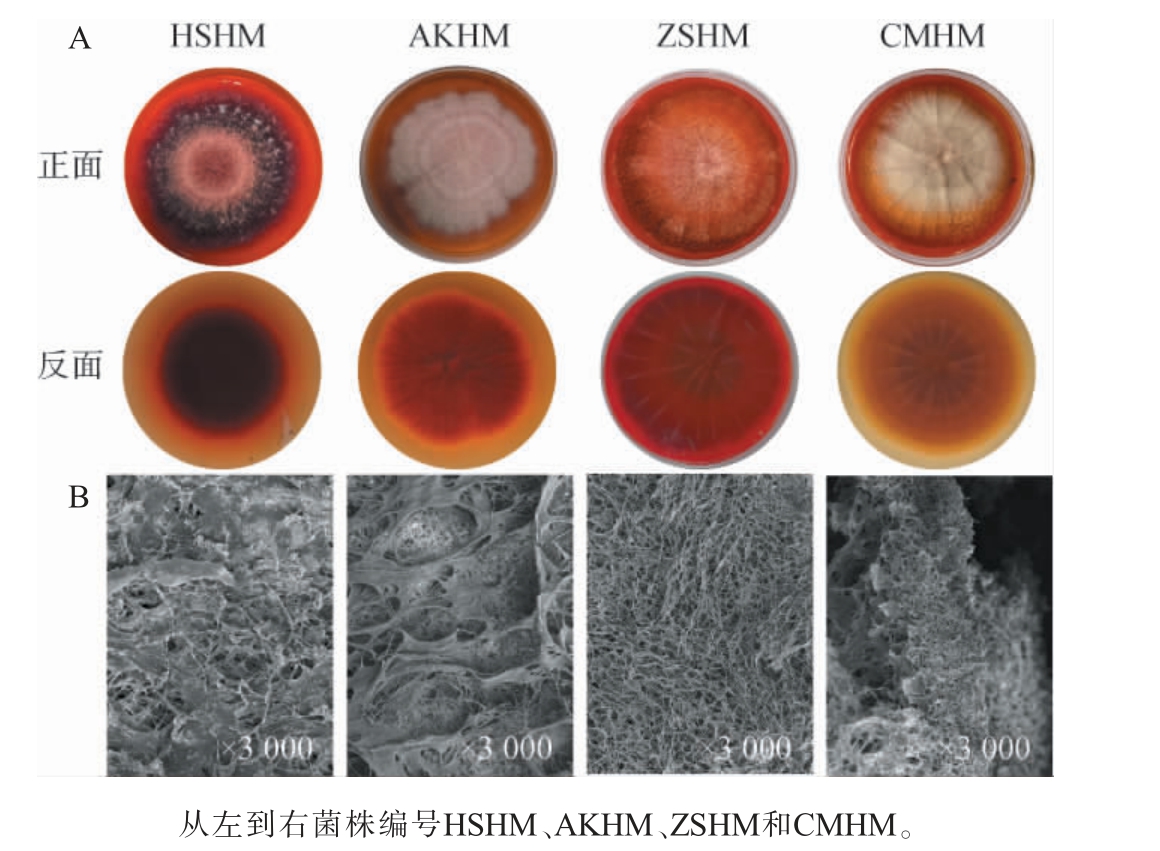
图1 酱香型大曲中分离4株红曲霉的宏观菌落(A)及微观电镜形态(B)
Fig.1 Macroscopic colony (A)and microscopic electron microscope morphology (B)of 4 Monascus insolated from sauce-flavor Daqu
由图1可知,菌株HSHM的宏观形态表现为不规则边缘,并呈现深红色。菌株AKHM的宏观形态呈现粉色辐射圈。菌株ZSHM的宏观形态呈现明亮的橙红色,同时覆盖有绒毛。 菌株CMHM宏观形态呈现出棕色绒毛状,边缘光滑。进一步观察其微观电镜形态,4株不同的菌株的电镜形态都包括闭囊、分生孢子、细胞隔膜和分枝菌丝。 宏观和微观形态均符合红曲霉属(Monascus spp.)的特征,因此,初步鉴定菌株HSHM、AKHM、ZSHM和CMHM都属于红曲霉属(Monascus spp.)。
红曲霉的DNA提取液的凝胶电泳结果及基于ITS基因序列构建菌株的系统发育树,结果见图2。 由图2A可知,4株红曲霉扩增的ITS rDNA条带大小在500~750 bp之间,判断本次试验提取4株红曲霉菌株PCR产物质量合格,条带大小与目标产物一致,符合检测要求。为进一步明确4株红曲霉的分类,利用其特征区域序列在NCBI进行比对并通过系统发育树进行分析。由图2B可知,菌株HSHM与红色红曲霉(Monascusruber)聚于一支,亲缘关系最近。菌株AKHM与安卡红曲霉(Monascus anka)聚于一支,亲缘关系最近。 菌株ZSHM与紫色红曲霉(Monascus purpureus)聚于一支,亲缘关系最近。菌株CMHM与从毛红曲霉(Monascus pilosus)聚于一支,亲缘关系最近。其所有分支自展值均>70%,并结合形态学特征,菌株HSHM、AKHM、ZSHM和CMHM分别被鉴定为红色红曲霉(Monascus ruber)、安卡红曲霉(Monascus anka)、紫色红曲霉(Monascus purpureus)和从毛红曲霉(Monascus pilosus)。
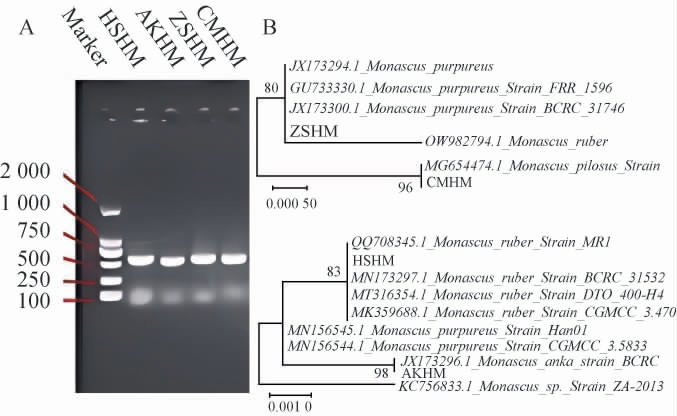
图2 筛选红曲霉菌株的DNA提取液的电泳图(A)和基于ITS基因序列构建的系统发育树(B)
Fig.2 Electrophoresis of DNA extraction solution(A)and phylogenetic tree based on the ITS gene sequence (B) of screened Monascus strains
为了在4株红曲霉中获得1株生长能力最强的红曲霉,利用生物量来评估红曲霉的生长能力,结果见图3。 由图3可知,菌株ZSHM的生物量最高,为(0.098±0.016) g/L,而菌株HSHM的生物量最低,仅为(0.014±0.011) g/L。 菌株AKHM和CMHM的生物量分别为(0.061±0.019) g/L和(0.046±0.006)g/L。 据报道,紫红曲霉(M.purpureus)是目前应用最广泛的红曲霉属,XIE N等[22]研究表明,紫红曲霉一般表现出较强生长能力,这与本研究结果基本一致。 此外,M.purpureus强大的水解酶活性和生长能力还可能有助于催化窖底水中大分子物质水解,从而实现窖底水的有效降解。因此,选择菌株ZSHM降解窖底水。
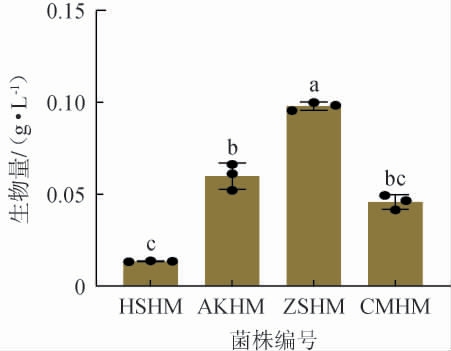
图3 筛选菌株的生物量的比较
Fig.3 Comparison of screened strains biomass of screened strains
不同字母表示差异显著(P<0.05)。
2.4.1 窖底水最佳添加量
由于窖底水有机物浓度过高,因此并不适合微生物生长。为了获得紫红曲霉ZSHM发酵窖底水的最佳浓度,利用菌株ZSHM的生物量来评估窖底水的添加量,结果见图4。
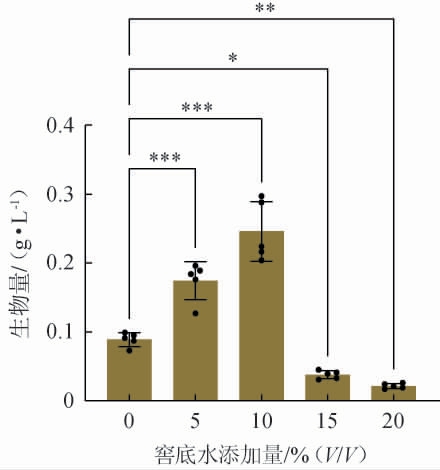
图4 窖底水的添加量对菌株ZSHM生物量的影响
Fig.4 Effect of pit bottom wastewater addition on strain ZSHM biomass
“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01),“***”表示差异高度显著(P<0.001)。
由图4可知,菌株ZSHM在不含窖底水的PDB培养基中生物量仅有(0.089±0.004)g/L。 当PDB培养基中窖底水添加量分别为5%(V/V)、10%(V/V)时,菌株ZSHM的生物量分别上升至(0.174 4±0.012)g/L和(0.245 8±0.024)g/L;当PDB培养基中窖底水添加量>10%(V/V)时,菌株ZSHM的生物量开始显著下降(P<0.05);当PDB培养基中窖底水添加量为15%时,菌株ZSHM的生物量降至(0.0378±0.003)g/L;当PDB培养基中窖底水添加量达到20%(V/V)时,菌株ZSHM的生物量最低,仅有(0.0214±0.001)g/L。窖底水的添加量达到10%时,能最好的促进红曲霉的生长。当当PDB培养基中窖底水添加量>10%(V/V)之后,窖底水中过高的乙醇、有机酸等可能会抑制紫红曲霉的生长。还可能由于窖底水中碳源浓度过高导致碳氮比失调,从而影响菌体的生长,最终降低其生物量。 因此,PDB培养基中最佳窖底水添加量为10%(V/V)。
2.4.2 红曲霉对窖底水有机物的降解效果
为了评估菌株ZSHM对窖底水有机物的降解效果,以其他3株红曲霉(HSHM、AKHM、CMHM)作为对照,测定了菌株ZSHM在PDB培养基中添加10%(V/V)窖底水发酵前后的BOD5值和CODcr值,结果见图5。
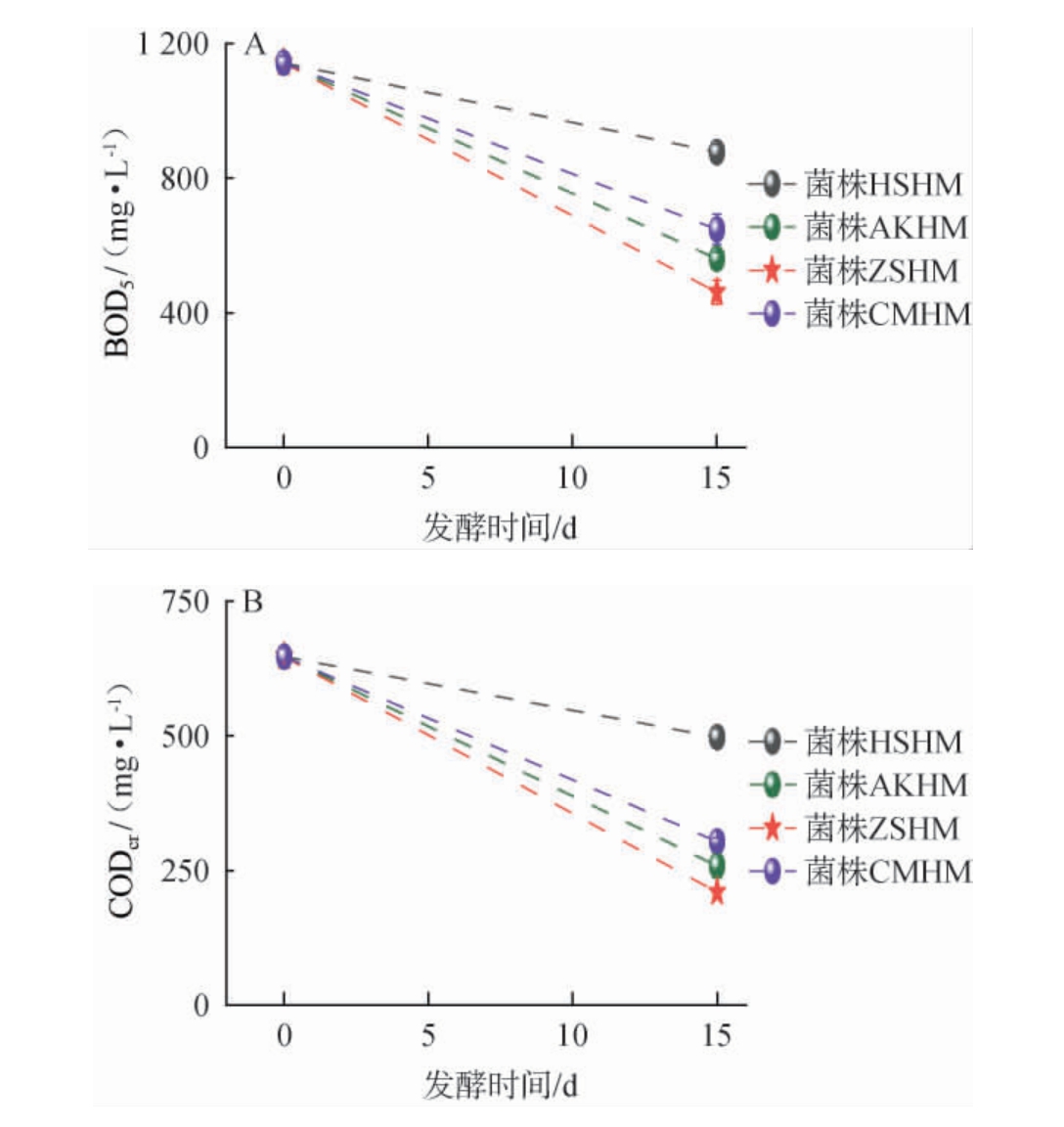
图5 菌株ZSHM对马铃薯葡萄糖肉汤培养基添加10%(V/V)窖底水中生物需氧量(A)及化学需氧量(B)降解效果
Fig.5 Degradation effect of strain ZSHM on biochemical oxygen demand (A) and chemical oxygen demand (B) in potato dextrose broth medium with 10% (V/V) pit bottom wastewater addition
由图5可知,4株红曲霉均能有效降低PDB培养基中添加10%(V/V)窖底水中BOD5和CODcr水平。在4株红曲霉中,菌株ZSHM的BOD5和CODcr降解能力最强,BOD5和CODcr分别从(1141.63±43.76)mg/L和(646.68±27.41)mg/L下降至(502.23±13.66)mg/L和(225.89±31.14)mg/L。菌株ZSHM对BOD5和CODcr的去除率分别达到56.76%和67.63%。据报道,紫红曲霉是一种高效的自然分解微生物,可以通过吸附、转化和矿化将窖底水中的有机物转化为CO2和水[23]。此外,紫红曲霉的细胞壁通常包含多种可用于生物吸收官能团,包括羟基、胺和羧基等[24]。这种生物吸附能促使紫红曲霉更好的从外界获取营养,同时又大量消耗外界的有机物。最终使窖底水中的BOD5值和CODcr值显著下降。
由表1可知,窖底水具有典型的高有机负荷特征,其化学需氧量(CODcr)与五日生化需氧量(BOD5)分别达到(7 014±19.26)mg/L和(13 714±58.42) mg/L,窖底水体系中酒精度高达(12.69±1.01)%vol,总酸含量(以乳酸计)达(44.85±1.85)g/L,pH值介于3.17~3.81之间。此极端酸性环境结合高乙醇浓度胁迫形成了微生物生存压力,致使大多数微生物可能无法利用窖底水中的营养物质,进而导致其无法在窖底水中正常生长。 这也解释了菌株ZSHM在窖底水添加量>10%(V/V)的环境中生长时生物量显著下降的原因。
表1 窖底水理化指标测定结果
Table 1 Determination results of physicochemical indexes of pit bottom wastewater

项目 结果总酸(以乳酸计)/(g·L-1)pH值酒精度/%vol CODcr/(mg·L-1)BOD5/(mg·L-1)44.85±1.85 3.17~3.81 9.69±1.01 7 014±19.26 13 714±58.42
通过HPLC检测紫红曲霉ZSHM了分别发酵大米培养基、含有窖底水大米培养基、高粱培养基和含有窖底水高粱培养基后洛伐他汀及γ-氨基丁酸的产量,结果见图6。由图6A可知,当添加窖底水后,菌株ZSHM在高粱和大米中产洛伐他汀的能力都显著下降(P<0.05)。发酵大米培养基时,菌株ZSHM的洛伐他汀产量达到(23.26±2.08)mg/100 g。但在大米培养基中加入10%(V/V)窖底水后,菌株ZSHM的洛伐他汀产量显著下降至(16.56±0.71)mg/100g(P<0.05)。此外,相比于大米培养基,菌株ZSHM发酵高粱培养基后洛伐他汀产量上升至(53.67±0.74)mg/100 g(P<0.05)。据报道,相较于大米,高粱中的硒元素(Se)含量较高[25]。而Se元素能有效提高红曲霉菌株合成洛伐他汀的能力[26]。因此,菌株ZSHM在高粱培养基中能生产更多洛伐他汀。此外,高粱支链淀粉含量显著高于大米,使其具有更复杂的α-1,6-糖苷键网络,因此高粱具备更持久的糖供给[27],促使红曲霉在高粱上能获得更多营养以富集洛伐他汀。值得注意的是,高粱培养基相较于大米培养基会更疏松,能使红曲霉在发酵时获得更多氧气,最终使洛伐他汀产量提高[28]。同样,在高粱培养基中添加10%(V/V)窖底水后,总洛伐他汀产量减少为(35.16±2.08)mg/100 g。 窖底水中富含的微量物质虽能促使红曲霉的生物量增高,但其中富含的乙醇、甘油和有机酸等物质可能会抑制红曲霉的细胞呼吸,从而显著减少洛伐他汀的前体物质—乙酰辅酶A(acetyl coenzyme A,acetyl-CoA)[29]的合成,最终降低了洛伐他丁的产量。 值得注意的是,在高粱培养基中,窖底水能促使内酯型洛伐他汀的提高,使其从(12.95±0.23) mg/100 g升高到(24.88±2.24)mg/100 g。 这一现象说明了窖底水或许仍能以其他方式提高紫红曲霉产洛伐他汀的能力。
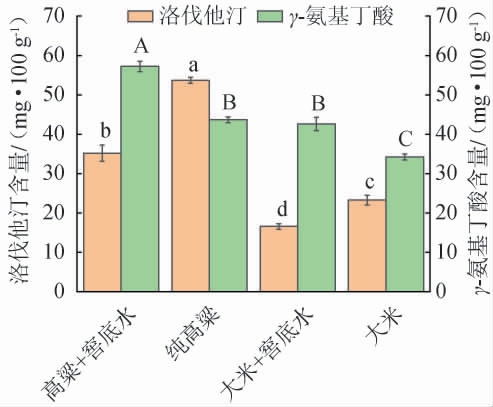
图6 窖底水添加对菌株ZSHM产洛伐他汀和γ-氨基丁酸的影响
Fig.6 Effect of pit bottom wastewater addition on lovastatin and γ-aminobutyric acid production by strain ZSHM
不同小写字母表示洛伐他汀含量差异显著(P<0.05)。不同大写字母表示γ-氨基丁酸含量差异显著(P<0.05)。
由图6B可知,当添加10%(V/V)窖底水后,菌株ZSHM在高粱和大米中产γ-氨基丁酸的能力都显著上升(P<0.05)。菌株ZSHM发酵纯高粱培养基中的γ-氨基丁酸产量为(43.66±0.75)mg/100 g。 值得注意的是,在高粱培养基+10%(V/V)窖底水后,γ-氨基丁酸产量显著提高至(57.12±1.31)mg/100 g(P<0.05)。窖底水的添加促使菌株ZSHM在高粱中的γ-氨基丁酸产量增加了30.89%。 同样,菌株ZSHM发酵纯大米培养基中的γ-氨基丁酸产量仅为(34.27±0.29)mg/100 g。 当添加10%(V/V)窖底水后,γ-氨基丁酸产量达到(42.58±1.68)mg/100 g,相比于纯大米培养基显著增加了24.24%(P<0.05)。此外,与菌株ZSHM产洛伐他汀趋势相同的是,在高粱上能获得更多的γ-氨基丁酸。再次证实了高粱可能更适合作为紫红曲霉ZSHM的生长基质。这可能是因为该菌筛选于酱香型白酒发酵过程中,且酱香型白酒最主要的原料则是高粱[30],因此,来源于这种环境中的菌株ZSHM可能具有高效的蛋白酶系,能分解高粱基质,释放更多游离谷氨酸(γ-氨基丁酸合成前体),直接催化γ-氨基丁酸的合成。γ-氨基丁酸属于一种非蛋白质氨基酸,在微生物中主要依靠在三羧酸(tricarboxylic acid,TCA)循环中获取α-酮戊二酸后,进一步经谷氨酸脱氢酶(glutamate dehydrogenase,GDH2)和谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)催化生成[31]。 因此,微生物产γ-氨基丁酸的能力与其生长能力应成正比。 添加窖底水后能促使菌株ZSHM生长能力显著增强,这可能进一步促进了菌株ZSHM的代谢活性,最终使得菌株ZSHM产γ-氨基丁酸的能力提高。本研究表明,当前菌株ZSHM在固态发酵基质中的γ-氨基丁酸产量最高为57.12mg/100g,而文献报道中M.purpureus ML01通过复合物理诱变(低频磁场1.6 mT联合紫外照射)及响应面法优化碳氮比(C/N=28∶1)等系统调控策略,其γ-氨基丁酸产量可达6 000 mg/100 g[32],为本研究的100倍。这一显著差异提示,通过多维代谢工程改造与发酵工艺协同优化具有巨大潜力。
2.7.1 窖底水对下紫红曲霉基因表达的影响及功能注释
为了进一步阐明窖底水对紫红曲霉ZSHM基因表达的调控,采用转录组分析来验证菌株ZSHM发酵纯PDB培养基和PDB+10%(V/V)窖底水的基因表达,结果见图7。

图7 菌株ZSHM基因表达火山图(A)和lg(P值)排名前20的京都基因与基因组百科全书富集通路(B)
Fig.7 Volcano plot of strain ZSHM gene expression (A) and the lg(P value) ranks the top 20 Kyoto Encyclopedia of Genes and Genomes enrichment pathways (B)
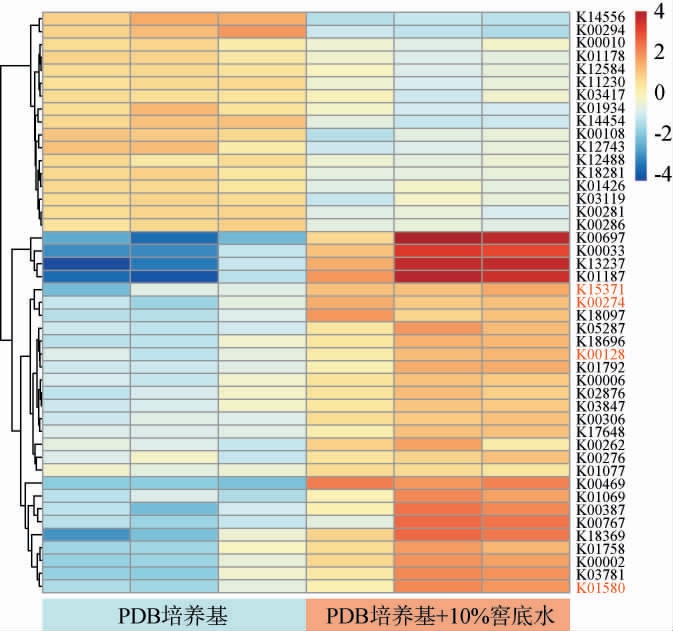
图8 菌株ZSHM排名前50的差异表达基因的调控
Fig.8 Regulation of the top 50 differentially expressed genes in strain ZSHM
由图7可知,与菌株ZSHM发酵纯PDB培养基相比,菌株ZSHM发酵PDB+10%(V/V)窖底水中共检测到有491个显著上调基因和370个显著下调基因(P<0.05)。上调基因的增多表明了添加窖底水后能促使菌株ZSHM的代谢活性增强。 采用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析分析进一步注释基因的表达。 结果表明,在lg(P值)排名前20的KEGG富集通路中,添加窖底水能提高菌株ZSHM代谢糖和氨基酸的能力,尤其是代谢精氨酸(arginine)和谷氨酸(glutamate)的能力。精氨酸和谷氨酸已被报道能促进微生物的生长以及减弱微生物对环境的应激性[33],这也解释了在10%(V/V)窖底水环境中菌株ZSHM生物量增高的原因。此外,精氨酸和谷氨酸都是微生物生物合成γ-氨基丁酸的重要前体物质[34],这可能解释了在添加窖底水后,菌株ZSHM生产γ-氨基丁酸能力增强的原因。另一方面,富集分析也表明,窖底水的添加能使得菌株ZSHM提高木质素分解代谢能力、氧化还原活性和从底物中汲取能量的能力。 木质素代谢和氧化还原活性被认为是废水生物降解的重要介质,再次间接阐明了菌株ZSHM对窖底水的降解作用。
2.7.2 菌株ZSHM的差异表达基因
进一步根据|log2FC|≥1鉴定差异表达的基因(differentially expressed genes,DEGs),筛选排名前50的DEGs。结果表示共有17个下调DEGs,33个上调DEGs,再次证明了窖底水能间接增强ZSHM的代谢活性。 在对上调的DEGs时发现,共有4个关于γ-氨基丁酸合成的相关基因,分别为谷氨酸脱羧酶(glutamate decarboxylase,GAD)K01580、谷氨酸脱氢酶(glutamate dehydrogenas,GDH2)K15371、乙醛脱氢酶(aldehyde dehydrogenase,ALDH)K00128和单胺氧化酶(monoamine oxidase,aofH)K00274[35]。其log2FC值分别为1.02±0.17、2.31±0.83、2.97±0.96、3.31±0.11。GDH2能促使在TCA循环中产生的2-氧化甲酸酯(2-oxoglutarate)转化为L-谷氨酸(L-glutamate),并释放出NH3[36]。 而L-谷氨酸最终在GAD基因调节下生成γ-氨基丁酸。 另一方面,L-谷氨酸也能在腐胺途径生成精氨酸,并通过aofH和ALDH产生γ-氨基丁酸[37],这些基因的显著上调能促使γ-氨基丁酸的积累。这进一步证实了添加10%(V/V)的窖底水能显著提高菌株ZSHM合成γ-氨基丁酸的能力。
本研究从酱香型白酒大曲中筛选获得4株红曲霉菌株HSHM、AKHM、ZSHM和CMHM,经形态学与分子生物学鉴定分别为红色红曲霉(Monascus ruber)、安卡红曲霉(Monascus anka)、紫色红曲霉(Monascus purpureus)和从毛红曲霉(Monascus pilosus)。 其中,紫红曲霉ZSHM(保藏于中国典型培养物保藏中心,保藏编号为CCTCC NO:M 20242448)在标准条件下生物量达(0.098±0.016)g/L,显著优于其他菌株,10%(V/V)窖底水添加量可显著提升菌株ZSHM生物量至(0.245 8±0.024)g/L,其在PDB培养基添加10%(V/V)窖底水中对生化需氧量(BOD5)和化学需氧量(CODcr)的去除率分别为56.76%、67.63%。菌株ZSHM在大米与高粱基质中发酵时,洛伐他汀、γ-氨基丁酸产量分别为(23.26±2.08)mg/100 g、(34.27±0.29)mg/100 g;(53.67±0.74)mg/100 g、(43.66±0.75)mg/100 g。 在大米与高粱基质中添加10%(V/V)窖底水后,洛伐他汀产量显著降低至(16.56±0.71) mg/100 g、(35.16±2.08) mg/100 g (P <0.05), 而γ-氨基丁酸产量则显著提升至 (42.58±1.68)mg/100 g、(57.12±1.31)mg/100 g(P<0.05)。转录组分析揭示,窖底水通过上调谷氨酸脱羧酶(GAD)、谷氨酸脱氢酶(GDH2)、醛脱氢酶(ALDH)及单胺氧化酶(aofH),激活GABA合成代谢通路,阐明了紫红曲霉在窖底水添加体系中介导的代谢机制。本研究创新性提出红曲霉对酱香型白酒副产物的资源化利用策略,揭示了窖底水对功能代谢产物的双向调控规律,为白酒酿造副产物的高值转化及目标产物定向调控提供了理论依据。后续研究将基于生物反应器优化菌株ZSHM的窖底水降解效能与γ-氨基丁酸合成能力,推动技术转化应用。
[1]CHU Z H,TANG X,LI Y,et al.Simultaneous removal of organic matter and inorganic nitrogen in Baijiu wastewater by methanotrophic denitrification[J].Biores Technol,2025,418:131956.
[2]Gao L, Xie F, Ren X, et al.Correlation between microbial diversity and flavor metabolism in Huangshui:A by-product of solid-state fermentation Baijiu[J].LWT-Food Sci Technol,2023,181:114767.
[3]JIANG Y S, SUN J, CHANDRAPALA J, et al.Current situation, trend,and prospects of research on functional components from by-products of Baijiu production:A review[J].Food Res Int,2024,180:114032.
[4]ZHENG Y,ZHANG T,LU Y,et al.Monascus pilosus YX-1125:An efficient digester for directly treating ultra-high-strength liquor wastewater and producing short-chain fatty acids under multiple-stress conditions[J].Biores Technol,2021,331:125050.
[5]SHI Y T,DU C,CHEN B H,et al.Evaluating the performance and stability of microalgal-bacterial granular sludge in municipal wastewater treatment plants[J].J Environ Manage,2025,373:123912.
[6]GUAN X,WU Q,LI S,et al.Starch waste addition as a novel strategy enhances pollutant removal and biomass production by microalgae-fungi consortia for swine wastewater treatment[J].Chem Eng J, 2025, 506:160127.
[7]CHA J,CHOI Y,PARK H,et al.Combining pre-fermentation and microbial electrolysis for efficient hydrogen production from food wastewater[J].Proc Safety Environ Protect,2024,187:1471-1480.
[8]ZHANG X, CHEN W, WANG C.Regulation of citrinin biosynthesis in Monascus purpureus:Impacts on growth,morphology,and pigments production[J].Food Microbiol,2025,127:104698.
[9]AGBOYIBOR C,KONG W,CHEN D,et al.Monascus pigments production, composition, bioactivity and its application: A review[J].Biocatal Agr Biotechnol,2018,16:433-447.
[10]GUO Z,LAI Y,GOU Y,et al.Screening of Monascus to produce highyield monacolin K by solid-state fermentation on medium of coix seed and gluten fractions[J].Food Biosci,2025,63:105754.
[11]ZENG H,WANG Y D,HAN H Y,et al.Changes in key aroma compounds and esterase activity of Monascus-fermented cheese across a 30-day ripening period[J].Foods,2022,11(24):3390.
[12]RICHTER P, PANCHALINGAM J, MIEBACH K, et al.Studying microbial triglyceride production from corn stover saccharides unveils insights into the galactose metabolism of Ustilago maydis[J].Microbial Cell Factories,2024,23(1):12934.
[13]SRIANTA I,KUSDIYANTINI E,ZUBAIDAH E,et al.Utilization of agro-industrial by-products in Monascus fermentation:A review[J].Biores Bioproc,2021,8(1):129.
[14]ABDEL-RAHEAM H, ALRUMMAN S A, GADOW S I, et al.Optimization of Monascus purpureus for natural food pigments production on potato wastes and their application in ice lolly[J].Front Microbiol,2022,13:862080.
[15]SOUZA F P, NAIR R B, ANDERSSON D, et al.Vegan-mycoprotein concentrate from pea-processing industry byproduct using edible filamentous fungi[J].Fungal Biol Biotechnol,2018,5:5.
[16]TERAN H R, DE SOUZA R A, MARCELINO P F, et al.Sugarcane bagasse hydrolysate as a potential feedstock for red pigment production by Monascus ruber[J].Food Chem,2018,245:786-791.
[17]TAO Z J, ZHANG J, NIU F G, et al.Polygonati rhizoma fermentation by Monascus ruber and evaluation of fermentation products in vitro[J].Proc Biochem,2024,146:21-28.
[18]ZHU L S,LONG P C,HU M,et al.Insight into selenium biofortification and the selenite metabolic mechanism of Monascus ruber M7[J].Food Chem,2024,455:139740.
[19]CHEN J,WANG H,CHEN Y,et al.Inhibitive effect and mechanism of cinnamaldehyde on growth and OTA production of Aspergillus niger in vitro and in dried red chilies[J].Food Res Int,2023,168:112794.
[20]ZHANG C,WANG H,SUN Q,et al.Improvement of Monacolin K and pigment production in Monascus by 5-Azacytidine[J].J Fungi, 2024,10(12):819.
[21]JIN Y Y,RITTHIBUT N,LIM S T,et al.Antioxidant and in vitro cosmeceutical activities of chestnut inner shell fermented by Monascus kaoliang[J].Food Sci Biotechnol,2023,32(6):813-822.
[22]XIE N,LIU Q,CHEN F.Deletion of pigR gene in Monascus ruber leads to loss of pigment production[J].Biotechnol Lett, 2013, 35(9): 1425-1432.
[23]TULY J A,MA H.Bioconversion of food industrial waste okara by microbial fermentation: Scope of omics study and possibility[J].Trends Food Sci Technol,2024,146:104391.
[24]MESACASA L, CABRAL F S, FOCHI D A T, et al.Constructed wetlands and the role of the fungal community for wastewater treatment:A review[J].Ecohydrol Hydrobiol,2024,8:1642-3593.
[25]KERKETTA A, KUMAR H, POWELL M A, et al.Trace element occurrence in vegetable and cereal crops from parts of Asia: A meta-data analysis of crop-wise differences[J].Curr Pollut Rep,2023,9:1-21.
[26]QI J, GUO X, HAN W, et al.The potency of Monascus purpureus to achieve the transformation from inorganic selenium into organic selenium during the fermentation process[J].Food Biosci,2024,62:105091.
[27]TAKAHAMA U,ANSAI T,HIROTA S.Slow hydrolysis of amylose in soluble starch and amylopectin in suspendable starch liberated from non-glutinous rice flour heated with a sorghum extract[J].Heliyon,2022,8(11):e11605.
[28]SRIANTA I,ZUBAIDAH E,ESTIASIH T,et al.Comparison of Monascus purpureus growth,pigment production and composition on different cereal substrates with solid state fermentation[J].Biocatal Agr Biotechnol,2016,7:181-186.
[29]SEENIVASAN A,SANKAR P,GUMMADI S N,et al.Metabolic pathway analysis and dynamic macroscopic model development for lovastatin production by Monascus purpureus using metabolic footprinting concept[J].Biochem Eng J,2020,154:107437.
[30]TANG J,WEI J,YANG Y,et al.Spatio-temporal scales of the Chinese Daqu microbiome: Heterogeneity, niche differentiation, and assembly mechanisms[J].Trends Food Sci Technol,2025,156:104832.
[31]UTAMA G L, SAHAB N, NURMILAH S, et al.Unveiling microbial dynamics in terasi spontaneous fermentation:Insights into glutamate and GABA production[J].Curr Res Food Sci,2025,10:100950.
[32]WU A,LI L,ZHANG S,et al.Optimization of the hongqu starter preparation process for the manufacturing of red mold rice with high gammaaminobutyric acid production by solid-state fermentation[J].Biotechnol Appl Bioc,2023,70(1):458-468.
[33]TANG T, ZHAO Z, WANG Y, et al.Internal mechanism of microbial nitrogen removal under prolonged low-temperature stress: A focus on microbial communities,metabolic pathways,and microbial function[J].Chem Eng J,2024,500:157522.
[34]FENG Y,ZHANG Y,LIU C,et al.Metabolism,application in the food industry, and enrichment strategies of gamma-aminobutyric acid[J].Trends Food Sci Technol,2024,154:104773.
[35]JANKOVIC S M,DJESEVIC M,JANKOVIC S V.Experimental GABA a receptor agonists and allosteric modulators for the treatment of focal epilepsy[J].J Exp Pharm,2021,13:235-244.
[36]JENA R, CHOUDHURY P K.Lactic acid bacteria in fermented dairy foods:Gamma-aminobutyric acid(GABA)production and its therapeutic implications[J].Food Biosci,2024,62:105276.
[37]AKASAKA N, KATO S, KATO S, et al.Agmatine production by Aspergillus oryzae is elevated by low pH during solid-state cultivation[J].Appl Environ Microbiol,2018,84(15):00722-18.