四川传统发酵蔬菜是蔬菜原料经过多轮次盐水自然发酵后,形成相对稳定的微生物群落结构及富含多种风味和滋味物质的发酵基质[1],因其独特的味道咸酸、口感脆爽等特点而广受人们喜爱。发酵蔬菜是典型的“多菌共酵”自发发酵体系,乳酸菌是其最为核心的微生物,不同的乳酸菌属共同维持微生物网络结构的稳定,并基于不同菌株代谢偏好的差异产生相应的特征酸香代谢产物[2]。传统发酵蔬菜发酵体系的微生物菌群受到包括酸、盐和其他逆境因子等非生物因素的环境选择[3],但因多轮次盐水具有相对稳健的群落结构,使其在应对环境变化时可保持优势菌群结构稳定,仅丰度略有波动[4]。目前,已有大量研究基于脱氧核糖核酸(deoxyribonucleic acid,DNA)测序技术表征老卤水的群落特征,其在属水平上以乳杆菌属(Lactobacillus)、毕赤酵母属(Pichia)和哈萨克斯坦酵母属(Kazachstania)等为主[1,5],在种水平上以戊糖乳杆菌(Lactobacillus pentosus)、植 物 乳 植 杆 菌(Lactiplantibacillus plantarum)、Kazachstania saulgeensis和膜醭毕赤酵母(Pichia membranifaciens)等为优势菌[6]。 此外,发酵蔬菜被视作益生菌的潜在宝库[7],故基于信使核糖核酸(messenger ribonucleic acid,mRNA)测序的宏转录组技术有助于探究发酵终产品中的活性微生物,对发酵蔬菜的功能性开发具有重要意义。
噬菌体(phage)是侵袭细菌的病毒,是控制细菌种群密度和分布的主要手段之一[8]。在奶酪、发酵黄瓜、发酵豆制品、泡菜、酸面包和葡萄酒等发酵食品体系中鉴定出多种以长尾噬菌体科(Siphoviridae)和肌病毒科(Myoviridae)为主的噬菌体,其宿主涉及到Lactobacillus、芽孢杆菌属(Bacillus)和明串珠菌属(Leuconostoc)等多种细菌[9]。这些天然噬菌体可能通过对细菌施加物种特异性控制来影响微生物群落的多样性或代谢[10]。如在白酒发酵体系中噬菌体显著抑制地衣芽孢杆菌(Bacillus licheniformis),且调控碳水化合物和氨基酸代谢[11]。此外,噬菌体对靶细菌的作用具有生态效应[12]。噬菌体处理靶标菌后引起非目标菌的连锁效应,改变体系微生物组并进一步影响代谢[13]。然而,目前对发酵蔬菜体系的病毒组成尚不清楚,尤其是与活性微生物间的作用网络值得深入研究。
本研究以一种具有代表性的发酵蔬菜泡萝卜为研究对象,通过宏转录组测序技术解析泡萝卜发酵过程中的活性微生物和病毒结构及代谢特征,并跟踪监测发酵过程中微生物菌群、理化指标和有机酸的动态变化规律,重点表征主发酵Lactobacillus的种水平结构,并对Lactobacillus噬菌体与Lactobacillus特征菌间相关性进行分析,以期为深度揭示病毒群在发酵蔬菜体系中对微生物菌群的调控机制奠定基础。
1 材料与方法
1.1 材料与试剂
多轮次盐水(最终盐度为3.6%、pH值为4.50、总酸含量为0.45 g/100 g):四川省眉山市东坡区某泡菜企业参照参考GE L H等[14]的方法制备而成;新鲜萝卜、泡菜盐、矿泉水:四川省成都市锦江区观音桥菜市场;柠檬酸(纯度99.5%)、苹果酸(纯度98%)、琥珀酸(纯度98%)、乳酸(纯度98%)、乙酸(纯度95%)标准品:Sigma-Aldrich(上海)有限公司;TRIzol Reagent Kit试剂盒:美国Invitrogen公司;其他试剂均为国产分析纯或生化试剂。
1.2 仪器与设备
Seven Compact S210型pH计:梅特勒-托利多仪器(上海)有限公司;JA5003型电子天平:上海佑科仪器仪表有限公司;Agilent G1260高效液相色谱(high performance liquid chromatography,HPLC)仪(配有可变波长紫外检测器和Chemstation A.01.04):美国Agilent公司。
1.3 方法
1.3.1 泡萝卜的制备
参考ZHAO N等[15]的方法制备泡萝卜,具体操作:新鲜萝卜经清洗、晾干表面水分后切分为长条柱状,与多轮次盐水按质量比1∶1放入泡菜坛中混匀,坛沿水封后置于25 ℃条件下恒温发酵5 d,每天取样。 每次取3坛样品充分混匀,纱布过滤后滤液(水样)保存于-80 ℃,萝卜块打碎(菜样)后保存于-20 ℃备用。
1.3.2 基本理化指标的检测
菜样的前处理参考ZHAO N等[16]的方法略作修改,取10.00 g菜样经超声波(40 kHz,室温)提取后于100 mL容量瓶中定容,滤纸过滤后取滤液进行测定。 pH值的测定:采用pH计;还原糖含量的测定:参考GB 5009.7—2016《食品安全国家标准食品中还原糖的测定》的3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法;总酸含量的测定:参考GB 12456—2021《食品安全国家标准食品中总酸的测定》的酸碱中和滴定法;盐含量的测定:参考GB 5009.42—2016《食品安全国家标准食盐指标的测定》的方法。
1.3.3 有机酸的测定
菜样滤液于10 000 r/min离心10 min,经0.22 μm滤膜过滤后采用HPLC检测有机酸种类及含量[14]。
1.3.4 核糖核酸提取及宏转录组学测序
采用TRIzolReagentKit试剂盒提取水样样品的总RNA,并经1%琼脂糖凝胶电泳和NanoPhotometer分光光度计评估总RNA纯度和完整性。 去除核糖体RNA(ribosomal RNA,rRNA)后获得可作为模板的片段化mRNA,以其为模板,随机寡核苷酸为引物合成互补DNA(complementary DNA,cDNA)后构建文库。 使用Qubit 2.0荧光计和Agilent 2100生物分析仪进行insert size检测测序文库,采用实时荧光定量聚合酶链式反应(quantitative real time-polymerase chain reaction,qRT-PCR)准确定量文库的有效浓度后,进行Illumina测序[17-18]。文库的构建和测序均在北京诺禾致源科技股份有限公司Illumina HiSeq 2000平台上完成。
1.3.5 生物信息学分析
对下机原始数据进行严格质控,剔除含N碱基、adapter污染、低质量reads(Qphred≤20的碱基数占整个read长度的50%以上的reads)、低Q20碱基及宿主污染的reads,并去除rRNA残留后得到高质量短序列(clean reads)。 使用Trinity v2.6.6 软 件(http://trinityrnaseq.github.io/)对clean reads进行从头组装,使用CD-HIT-EST(version 4.6)软件(http://weizhongli-lab.org/cd-hit/)删除repeat(设置序列识别阈值0.95),获得Unigene数据集。使用DIAMOND v0.8.22软件与美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)数据库中的细菌、真菌、古菌和病毒序列进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对(Evalue≤10-5)。序列过滤后,与某些基因序列相匹配的reads被放置在已知具有该基因的分类中这些物种的最低共同祖先(lowest common ancestor,LCA)节点上。根据LCA标注结果和基因丰度表,得到每个样本在各分类水平的丰度信息和基因数表。为了获得全面的基因功能信息,在京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库中编写了基因功能注释。使用DIAMOND v0.8.22软件将Unigene基因映射到每个功能数据库进行序列功能注释。采用转录本序列每百万碱基对(fragments per kilobase of transcript sequence per millions base pairs sequenced,FPKM)归一化方法对转录本和基因进行定量得到FPKM值。
1.3.6 数据处理与统计分析
采用SPSS 19.0软件对原始数据进行单因素方差分析(one-way ANOVA)和Lactobacillus phage与Lactobacillus间的Spearman相关性分析。使用Cytoscape 3.7.2软件(http://manual.cytoscape.org/en/3.7.2/index.html)对相关性进行可视化绘图。 采用Origin 2021软件绘制柱状图、折线图及热图等。 使用SIMCA 14.1软件进行主坐标分析(principal coordinates analysis,PCoA)图。
2 结果与分析
2.1 泡萝卜发酵过程中理化指标的动态变化
2.1.1 基本理化指标
对泡萝卜发酵过程中理化指标的监测可以反映体系中微生物的生长及代谢情况[19],因此,测定泡萝卜发酵过程中pH值、还原糖含量、总酸含量、盐含量的动态变化,结果见表1。由表1可知,泡萝卜发酵过程中,pH值呈先下降后趋于稳定的趋势,在发酵0 d时,pH较高,分析原因可能是由于加入新鲜萝卜所致;还原糖含量呈下降趋势,在发酵2 d后迅速降低至检测限以下,表明发酵体系中活跃的微生物快速消耗糖以维持其生长代谢[20];总酸含量呈先升高后下降的趋势,在发酵3 d时达到峰值后与盐水环境交换达到平衡,发酵终点时总酸含量稳定在(0.46±0.04)g/100 g;盐含量呈非单调增加趋势,最终与盐水环境中的盐浓度动态平衡。
表1 泡萝卜发酵过程中基本理化指标的变化
Table 1 Variation of basic physicochemical indexes during the fermentation of radish Paocai
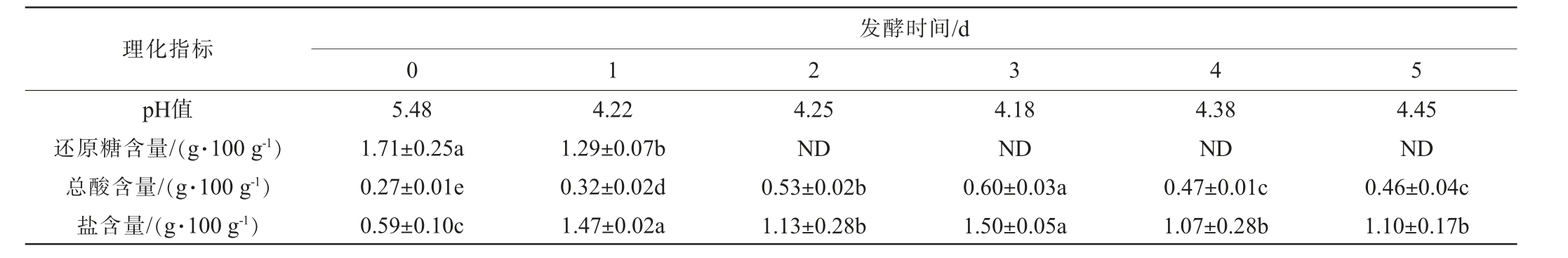
注:ND表示未检出;不同小写字母表示发酵过程中同一指标差异显著(P<0.05)。下同。
理化指标pH值还原糖含量/(g·100 g-1)总酸含量/(g·100 g-1)盐含量/(g·100 g-1)发酵时间/d 0 1 2 3 5.48 1.71±0.25a 0.27±0.01e 0.59±0.10c 4.22 1.29±0.07b 0.32±0.02d 1.47±0.02a 4.25 ND 0.53±0.02b 1.13±0.28b 4.18 ND 0.60±0.03a 1.50±0.05a 4 4.38 ND 0.47±0.01c 1.07±0.28b 5 4.45 ND 0.46±0.04c 1.10±0.17b
2.1.2 有机酸
微生物发酵代谢产生的有机酸是泡萝卜重要的呈酸滋味物质,其组成及含量显著影响发酵蔬菜产品品质[21]。因此,对泡萝卜中主要的5种有机酸(柠檬酸、苹果酸、琥珀酸、乳酸和乙酸)[14]进行定量检测,结果见表2。由表2可知,泡萝卜发酵过程中,总有机酸含量仅在发酵初期略有降低,后基本维持稳定,为(8.01±0.17)~(10.77±0.08)g/kg。苹果酸和琥珀酸仅在发酵0 d的样品中检出,二者可作为中间产物代谢产乳酸和乙酸[22],多轮次盐水的环境加速二者的代谢。 泡萝卜是典型的乳酸发酵体系,发酵过程中乳酸含量先增加后降低,在发酵2 d时达到峰值,为(9.08±0.39)g/kg。原料本身的乙酸含量较高,与盐水环境体系物质交换后大幅降低,随着发酵的进行逐渐增加,之后保持相对稳定;乙酸是典型的乳酸菌异型发酵产物[23],其含量的变化与微生物群落结构和代谢型有关。 此外,在发酵过程中均未检出柠檬酸,与之前的研究一致[24],有机酸的组成受原料的影响。
表2 泡萝卜发酵过程中有机酸的变化
Table 2 Variation of organic acids during the fermentation of radish Paocai
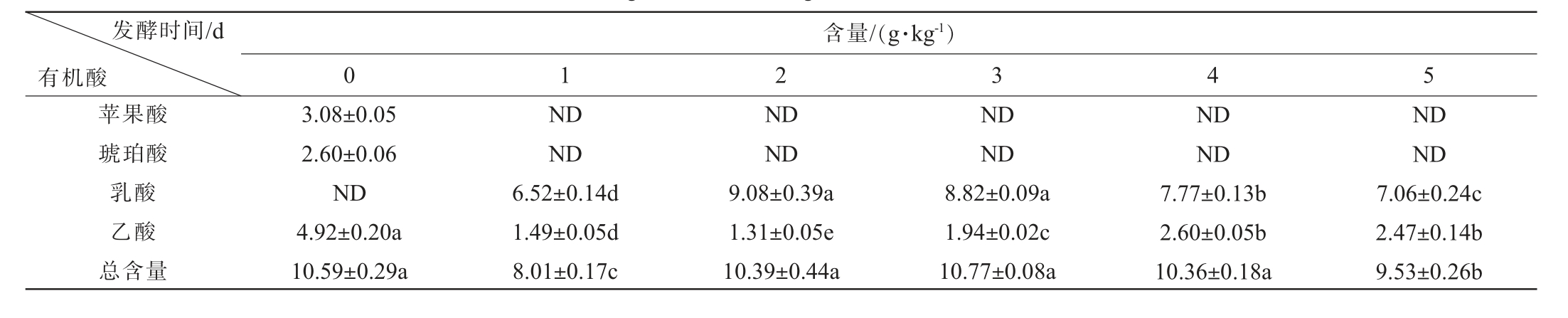
发酵时间/d有机酸苹果酸琥珀酸乳酸乙酸总含量含量/(g·kg-1)0 1 2 3 3.08±0.05 2.60±0.06 ND 4.92±0.20a 10.59±0.29a ND ND 6.52±0.14d 1.49±0.05d 8.01±0.17c ND ND 9.08±0.39a 1.31±0.05e 10.39±0.44a ND ND 8.82±0.09a 1.94±0.02c 10.77±0.08a 4 ND ND 7.77±0.13b 2.60±0.05b 10.36±0.18a 5 ND ND 7.06±0.24c 2.47±0.14b 9.53±0.26b
2.2 活性微生物菌群结构及功能分析
2.2.1 活性微生物菌群结构
测序数据经质控后Q20值>97%,Q30值>93%,说明测序数据可靠。 宏转录组序列中的鸟嘌呤(guanine,G)胞嘧啶(cytosine,C)含量略有波动,表明在不同发酵时间点样品中的活性微生物群落组成或转录序列组成基本保持稳定。泡萝卜发酵过程中活性微生物菌群结构的变化见图1。
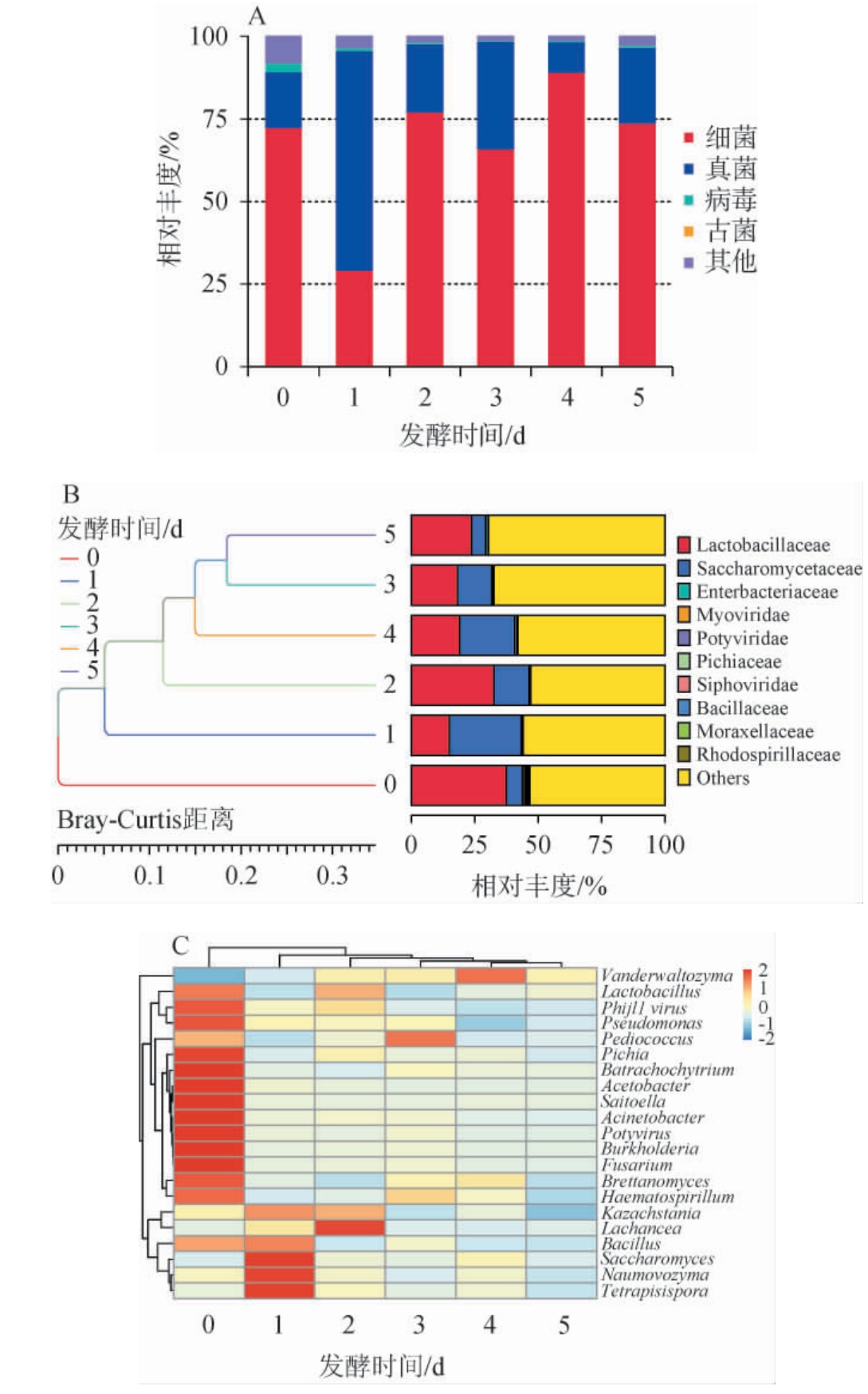
图1 基于界(A)、科(B)和属(C)水平泡萝卜发酵过程中的活性微生物菌群结构的动态演替
Fig.1 Dynamic succession of active microbial community structure during the fermentation of radish Paocai based on phylum(A),family (B) and genus (C) levels
由图1A可知,细菌(29.26%~89.10%)、真菌(9.31%~66.53%)和病毒(0.22%~2.70%)构成了微生物菌群的主体结构。在泡萝卜发酵过程中,细菌和真菌菌群动态演替,而病毒群则在发酵初期最为活跃而后迅速降低至较低水平保持稳定。 由图1B可知,在科水平上,乳杆菌科(Lactobacil laceae)和酵母科(Saccharomycetaceae)的相对丰度最高,这符合发酵蔬菜微生物菌群结构的普遍规律[25]。 基于Bray-Curtis距离的聚类分析结果表明,泡萝卜中的微生物菌群结构随发酵时间有序变化,新鲜原料的加入扰动发酵体系,发酵后期逐渐稳定且趋于相似。由图1C可知,在属水平上的优势活性微生物为乳杆菌属(Lactobacillus),其在发酵体系中的相对丰度呈现先降低后增加再降低的趋势,为7.91%~22.68%,推测可能的原因是新鲜原料稀释了发酵体系中原始的菌群浓度,营养物质的加入维持Lactobacillus生长代谢,而后在发酵后期相对丰度增加使活菌数维持在较高水平。同时,发现发酵初期由于新鲜原料的扰动活性微生物丰富且相对丰度较高,尤其是Lactobacillus、假单胞菌属(Pseudomonas)、Pichia和不动杆菌属(Acinetobacter)等。Acinetobacter已被证明是发酵初期的优势菌[26]。 同样Lactobacillus是发酵蔬菜的优势发酵菌[27],其作为核心产香菌与4-乙基愈创木酚等多种芳香活性物质相关[28]。类似的Pseudomonas与多种β-紫罗酮等风味组分呈显著正相关[29]。 发酵初期(1 d)多种酵母如Kazachstania、酵母属(Saccharomyces)和Naumovozyma的相对丰度有所增加,其中Kazachstania是多轮次发酵蔬菜盐水的极优势真菌[5],且有助于正己醛、2,3-丁二醇等风味成分的形成[29]。随着发酵的进行,Lachancea(2 d)、片球菌属(Pediococcus)(3 d)和Vanderwaltozyma(4 d)的相对丰度逐渐增加,可能作为发酵阶段的关键辨别标志。Lachancea可能使泡菜具有产膜风险[6],其相对丰度受到发酵体系的强烈抑制,整个发酵过程相对丰度均<0.01%。Pediococcus被鉴定为四川盐渍蔬菜中与风味产生相关的关键微生物[28]。发酵末期(5 d)的活性微生物菌群组成相对平衡且稳定,仍以Lactobacillus为主(19.76%)。
2.2.2 活性微生物代谢通路分析
基于KEGG数据库进一步揭示活性微生物的功能及其代谢通路,不同层级的代谢通路见图2。 由图2A可知,活性微生物群落的第一级(level1)代谢途径主要为代谢(Metabolism)和遗传信息处理(Genetic Information Processing)。在Metabolism的第二层级(level2)以碳水化合物、氨基酸、核苷酸和能量代谢等为主,保证微生物的增殖及代谢活性。进一步对第二层级中绝对丰度排前25的功能途径进行分析,由图2B可知,在发酵0 d,由于新鲜原料的加入,微生物菌群的环境适应及与生长有关的通路尤为活跃。 值得注意的是,包括次级代谢产物的生物合成(Biosynthesis of other secondary metabolites)等多条途径都在发酵1 d时Unigenes最多,表明此阶段是整个发酵周期中最活跃的关键点。 伴随着多种高丰度噬菌体,体系中的活性微生物菌群可能与相应噬菌体免疫应答,激活免疫系统(Immune system)相关通路(1 d);外源物质的生物降解和代谢(Xenobiotics biodegradation and metabolism)在发酵1 d时较为活跃,可能是代谢萝卜原料中的硫苷类物质及其衍生物并以此来减弱其抑菌性[30]。发酵2~5 d,活性微生物群落的增殖和衰亡保持动态平衡,同时体系中微生物群代谢也趋于稳定,这与体系中的碳源(还原糖)的消耗趋势一致。 进一步基于Bray-Curtis距离及第三层级(level3)对发酵样品进行主坐标分析(principal coordinates analysis,PCoA)。由图2C可知,发酵初期的样品距离较远,随发酵的进行逐渐趋于接近,表明泡萝卜发酵体系中微生物群落的代谢随发酵的进行逐渐稳定。
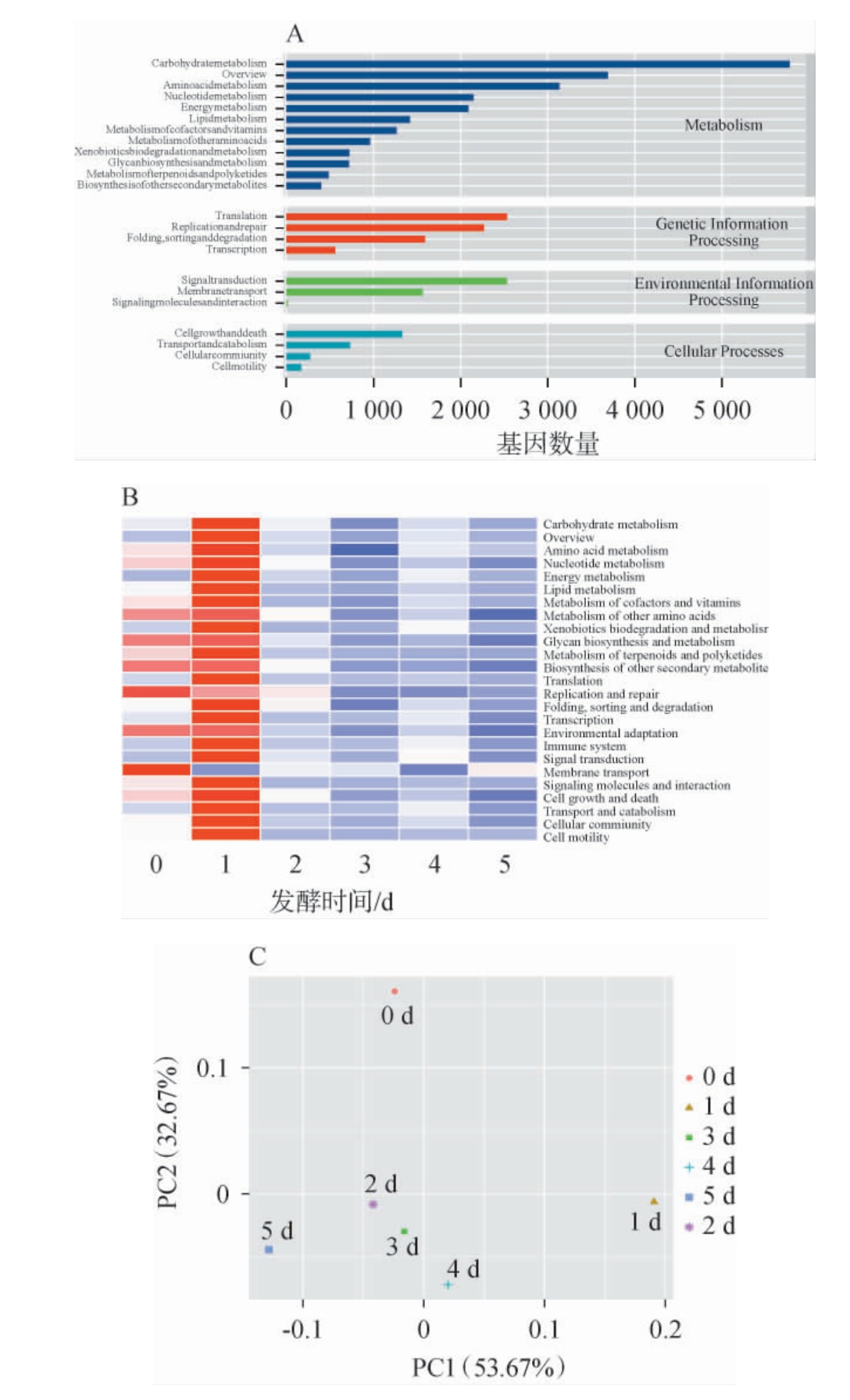
图2 活性微生物群落功能在第一层级Unigenes数目注释(A)、第二层级聚类分析(B)和第三层级主坐标分析(C)结果
Fig.2 Results of Unigenes numbers annotation at level 1 (A), cluster analysis at level 2 (B) and principal coordinates analysis at level 3 (C) for function of active microbial community
2.3 Lactobacillus phage与活性Lactobacillus关联分析
2.3.1 Lactobacillus属种水平结构的动态变化
从泡萝卜样品中共检出62种活性Lactobacillus属菌种,整个发酵周期有19种在体系中持续存在,结果见图3。由图3可知,戊糖乳杆菌(Lactobacillus pentosus)、类谷糠乳杆菌(Lentilactobacillus parafarraginis)、植物乳植杆菌(Lactiplantibacillus plantarum)、 那慕尔促生乳杆菌(Levilac tobacillusnamurensis)、副柯林斯乳杆菌(Secundilactobacillus paracollinoides)、Lentilactobacillus kisonensis 和Lactobacillus fabifermentans为优势种(TRINITY数>100),且在发酵过程中动态变化。微生物属间竞争使多种菌的相对丰度波动变化,除L.parafarraginis外,其余6种优势菌的最终相对丰度都低于初始值,这可能与新鲜原料携带的菌属有关,微生物在原位体系中的生存性和选择性具有种间差异[31]。值得注意的是,L.parafarraginis是多种发酵蔬菜的典型菌种[7],其相对丰度在发酵中期至末期持续激增,成为极优势的活性菌种。 短乳杆菌(Lactobacillus brevis)、发酵乳杆菌(Lactobacillus fermentum)和清酒乳杆菌(Latilactobacillus sakei)等菌种都对发酵制品的风味品质有贡献[32-33]。此外,如Companilactobacillus ginsenosidimutans和Lacticaseibacillus thailandensis等多种活性菌种在发酵初期存在,但随着发酵的进行逐渐降低至无法检出,可能是这些菌种受到体系的环境因素和内源菌种的生物胁迫[24],从而无法在体系中存活。
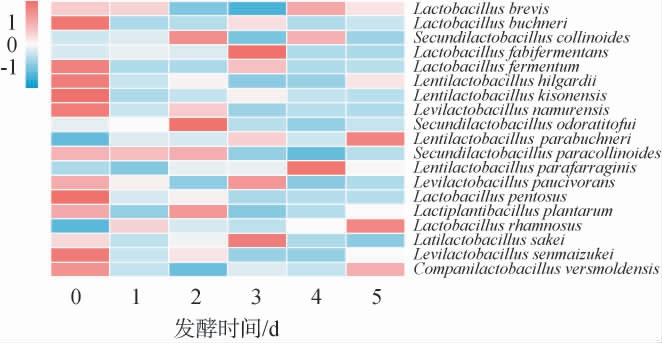
图3 泡萝卜发酵过程中持续存在的19种活性Lactobacillus属菌种相对丰度变化热图
Fig.3 Heat map of relative abundance change of 19 active Lactobacillus species persisting during the fermentation of radish Paocai
2.3.2 病毒群结构的动态变化
在复杂环境的微生态研究中,病毒群极大的影响生态循环和生物进化[34]。泡萝卜样品在科水平上的病毒群以长尾病毒科(Siphoviridae)、肌病毒科(Myoviridae)和马铃薯Y病毒科(Potyviridae)为主,这与多种发酵食品原位环境中的病毒群结构一致[9]。泡萝卜样品在属水平上的病毒群主要包括Phijl1 virus、马铃薯Y病毒(Potyvirus)和Unclassified等。 泡萝卜样品在种水平上的病毒群结构及主要Lacto bacillus phage随发酵过程的动态变化见图4。由图4A可知,发酵0 d时,在种水平上,泡萝卜样品中的病毒群结构以芜菁花叶病毒(Turnip mosaic virus)和Lactobacillus phage为主。在发酵0 d时Turnip mosaic virus在病毒群中的相对丰度极高(57.2%),而随着发酵的进行逐渐降到极低水平。该病毒存在于多种十字花科蔬菜中且具有寄主关联性和地域性[35],推测是因新鲜原料的加入而使该病毒的比例增加,而泡萝卜这种高酸环境并不适合其生长故降低。泡萝卜发酵过程中检出6 种Lactobacillus phage,主要包括LP65、ATCC8014-B2、LfeInf、phijl1和Lb338-1,它们在发酵0 d时的相对丰度最高,在Lactobacillus phage中的相对丰度分别为21.1%、17.0%、2.4%、1.0%和0.7%。 这5种Lactobacillus phage均为烈性噬菌体,其中LP65和Lb338-1均隶属于代列尔噬菌体科(Herelleviridae),该科在发酵制品中已被表征[36]。由图4B可知,随着发酵时间的延长,多种烈性噬菌体的TRINITY数迅速降低至较低水平,尤其是初始数较高的LP65和ATCC8014-B2降幅达到85.6%和91.1%。整体而言,发酵初期病毒群丰富且活跃,而至发酵末期都维持在极低水平,推测可能的原因是新鲜萝卜携带的菌群扰动体系,使体系中存在的多种病毒增殖且活跃,在侵袭相应宿主后恢复平静,体系菌群结构维持稳定。
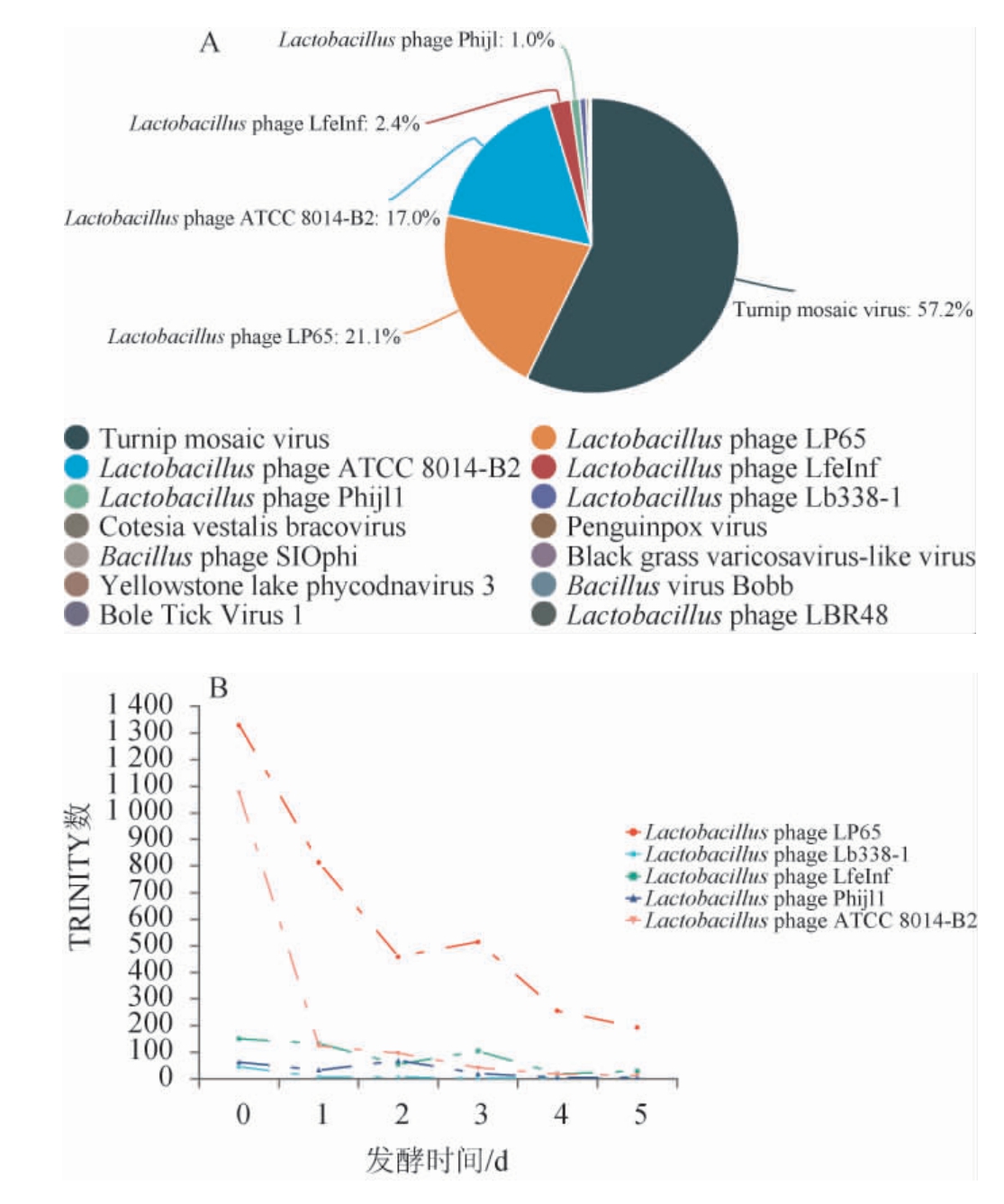
图4 基于种水平泡萝卜发酵0 d的病毒群结构(A)及主要Lactobacillus phage的动态变化(B)
Fig.4 Virus structure (A) and dynamic changes of main Lactobacillus phage (B) in radish Paocai at 0 d based on species level
2.3.3 Lactobacillus phage与不同种活性Lactobacillus间相关性分析
种水平的噬菌体差异决定宿主特异性,伴随在发酵过程中其活性的动态变化来影响发酵体系菌群结构。 基于Spearman相关系数计算6种Lactobacillus phage与62种活性Lactobacillus的相关性,具有显著性的相关网络见图5。 由图5可知,共有30条显著正相关关系和14条显著负相关关系(|r|>0.8,P<0.05)。优势的L.pentosus与Lactobacillus phage Lb338-1呈极显著正相关(r=0.943,P<0.01),表明L.pentosus可能作为Lactobacillus phage Lb338-1的侵染宿主,最终使该菌数大幅降低。 L.namurensis与Lactobacillus phage Lb338-1(r=0.886,P<0.05)和S.paracollinoides与Lactobacillus phage phijl1(r=0.829,P<0.05)也互为显著正相关。L.parafarraginis与Lactobacillus phageLP65(r=-0.829,P<0.05)、ATCC8014-B2(r=-0.886,P<0.05)、LfeInf(r=-0.886,P <0.05)和LBR48(r=-0.845,P<0.05)为显著负相关,这可能与复杂环境中细菌与噬菌体的共存有关[37],并且多种烈性噬菌体裂解靶标菌后减轻对L.parafarraginis的互作胁迫,从而使该菌在发酵后期快速增殖到高位。 然而,L.plantarum、L.kisonensis和L.fabifermentans等优势菌与烈性噬菌体间的相关性不显著(|r|>0.8,P>0.05),但其活性数量水平仍动态变化,这可能与噬菌体通过调节靶标菌来影响非目标菌群的结构有关[13]。 此外,Liquorilactobacillus nagelii、罗伊氏乳杆菌(Lactobacillus reuteri)和F.rossiae等多种活菌在发酵后期降低至无法检出,可能是烈性噬菌体的靶向裂解作用。因此,Lactobacillus phage在发酵蔬菜原位体系或可起到调节Lactobacillus属内细菌结构及数量的作用,维持体系生态结构稳定。
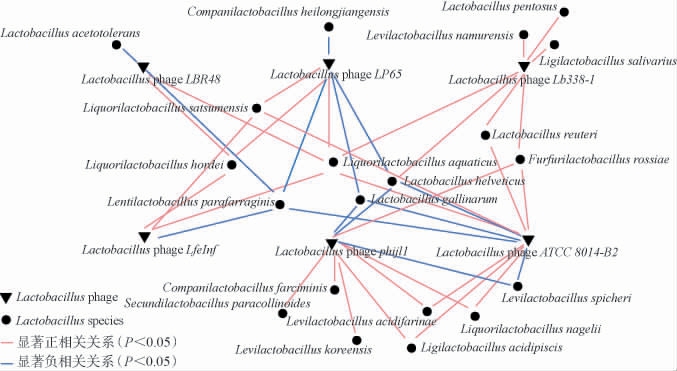
图5 基于种水平乳杆菌噬菌体与乳杆菌相关性分析网络图
Fig.5 Correlation analysis network between Lactobacillus phage and Lactobacillus based on species level
3 结论
泡萝卜发酵过程中,pH在发酵初始略有升高,还原糖含量被迅速消耗降低,盐含量呈现非单调增加的趋势,总酸含量呈先升高后下降的趋势,苹果酸和琥珀酸被快速消耗,乳酸和乙酸成为主要的有机酸。活性微生物随发酵逐渐演替为以乳杆菌属(Lactobacillus)(7.91%~22.68%)为主,从Lactobacillus中共鉴定到62种,其中戊糖乳杆菌(Lactobacillus pentosus)、类谷糠乳杆菌(Lactobacillus parafarraginis)和植物乳植杆菌(Lactiplantibacillus plantarum)等为优势菌种。活性微生物群的主要代谢途径为代谢和遗传信息处理,且免疫系统相关通路在发酵前期是活跃的。泡萝卜中主要的病毒群为长尾噬菌体科(Siphoviridae)和肌病毒科(Myoviridae)等,其中,Lactobacillus phage尤其是LP65 和ATCC8014-B2 等 在 发 酵 初 期 极 为 活 跃。 6 种Lactobacillus phage与62种Lactobacillus间共有30条显著正相关关系和14条显著负相关关系(|r|>0.8,P<0.05),但Lactobacillus phage与相应Lactobacillus间的靶向作用及对非目标菌群的调节模式需进一步研究。 本实验结果为深入研究发酵蔬菜微生态结构及区系组装机制奠定了一定的理论基础。
[1]胡此海,杨絮,郭全友,等.四川泡菜母水的微生物群落与理化特性分析[J].中国食品学报,2024,24(2):281-291.
[2]ZHAO Y J,WANG Y,LI H Y,et al.Integrating metabolomics and metatranscriptomics to explore the formation pathway of aroma-active volatile phenolics and metabolic profile during industrial radish paocai fermentation[J].Food Res Int,2023,167:112719.
[3]WOLFE B E, BUTTON J E, SANTARELLI M, et al.Cheese rind communities provide tractable systems for in situ and in vitro studies of microbial diversity[J].Cell,2014,158(2):422-433.
[4]HUANG Y L, GE L H, LAI H M, et al.Seasonal alteration of environmental condition-driven shift in microbiota composition,physicochemical attributes and organic compound profiles in aged Paocai brine during intermittent back-slopping fermentation[J].Food Biosci,2022,50:102111.
[5]李恒,陈功,伍亚龙,等.高通量测序方法研究传统四川泡菜母水中微生物群落的动态变化[J].食品科学,2018,39(24):131-138.
[6]XIAN S,ZHONG H Y,YI B,et al.Identification of pellicle formation related microorganisms in traditional Sichuan paocai through metagenomic sequence and the effects of Baijiu/salt on pellicle and volatile components[J].Food Res Int,2022,159:111130.
[7]YASIR M, AL-ZAHRANI I A, BIBI F, et al.New insights of bacterial communities in fermented vegetables from shotgun metagenomics and identification of antibiotic resistance genes and probiotic bacteria[J].Food Res Int,2022,157:111190.
[8]SHKOPOROV A N,TURKINGTON C J,HILL C.Mutualistic interplay between bacteriophages and bacteria in the human gut[J].Nat Rev Microbiol,2022,20:737-749.
[9]PAILLET T, BONY E D.Bacteriophage ecology of fermented foods:anything new under the sun?[J].Curr Opin Food Sci,2021,40:102-111.
[10]RANVEER S A,DASRIVA V,AHMAD M F,et al.Positive and negative aspects of bacteriophages and their immense role in the food chain[J].Npj Sci Food,2024,8:1.
[11]KANG J M,CHEN X X,HAN B Z,et al.Insights into the bacterial,fungal, and phage communities and volatile profiles in different types of Daqu[J].Food Res Int,2022,158:111488.
[12]HITCH T C A,HALL L J,WALSH S K,et al.Microbiome-based interventions to modulate gut ecology and the immune system[J].Mucosal Immunol,2022,15:1095-1113.
[13]HUS B B,GIBSON T E,YELISEYEV V,et al.Dynamic modulation of the gut microbiota and metabolome by bacteriophages in a mouse model[J].Cell Host Microbe,2019,25:803-814.
[14]GE L H, HUANG Y L, LI X, et al.Temperature-driven divergence in molecular distribution and microbial invasion and the associated texture softening during dual-phase fermentation of Paocai[J].Food Chem,2024,457:140171.
[15]ZHAO N,HUANG Y L,LAI H M,et al.Illumination and reconstruction of keystone microbiota for reproduction of key flavor-active volatile compounds during paocai (a traditional fermented vegetable) fermentation[J].Food Biosci,2023,56:103148.
[16]ZHAO N,GE L H,LAI H M,et al.Unraveling the contribution of presalting duration to microbial succession and changes of volatile and nonvolatile organic compounds in Suancai(a Chinese traditional fermented vegetable)during fermentation[J].Food Res Int,2022,159:111673.
[17]QIU D J,HUANG L M,LIN S J.Cryptophyte farming by symbiotic ciliate host detected in situ[J].PNAS,2016,113(43):12208-12213.
[18]胡晓龙,田瑞杰,李保坤,等.基于宏转录组学技术解析浓香型酒醅活性微生物群落结构及功能变化特征[J].食品科学,2022,43(10):124-132.
[19]MOON E W,YANG J S,YOON S R,et al.Application of colorimetric indicators to predict the fermentation stage of kimchi[J].J Food Sci,2020,85(12):4170-4179.
[20]ZHAO Y J,WU Z Y,MIYAO S,et al.Unraveling the flavor profile and microbial roles during industrial Sichuan radish paocai fermentation by molecular sensory science and metatranscriptomics[J].Food Biosci,2022,48:101815.
[21]ZHENG Z M, ZHOU Q, LI D, et al.Effects of enhanced fermentation with Lactiplantibacillus plantarum WWPC on physicochemical characteristics and flavor profiles of radish paocai and dried-fermented radish[J].Food Biosci,2024,59:103941.
[22]JI G Y, LIU G P, LI B, et al.Influence on the aroma substances and functional ingredients of apple juice by lactic acid bacteria fermentation[J].Food Biosci,2023,51:102337.
[23]BANGAR S P, SURI S, TRIF M, et al.Organic acids production from lactic acid bacteria:A preservation approach[J].Food Biosci,2022,46:101615.
[24]ZHAO N,HUANG Y L,LAI H M,et al.The role of abiotic and biotic factors of aged brine in directing microbial assembly and volatile profiles of Paocai during fermentation[J].Food Biosci,2024,57:103592.
[25]XIAO M Y,PENG Z,HARDIE W J,et al.Exploring the typical flavours formation by combined with metatranscriptomics and metabolomics during Chinese Sichuan paocai fermentation[J].LWT-Food Sci Technol,2022,153:112474.
[26]YU Y Y, XU Y J, LI L, et al.Dynamic evolution of flavor substances and bacterial communities during fermentation of leaf mustard(Brassica juncea var.multiceps)and their correlation[J].LWT-Food Sci Technol,2022,167:113796.
[27]CHEN A J,LUO W,PENG Y T,et al.Quality and microbial flora changes of radish paocai during multiple fermentation rounds[J].Food Control,2019,106:106733.
[28]ZHAO Y J,WEI W L,TANG L,et al.Characterization of aroma and bacteria profiles of Sichuan industrial paocai by HS-SPME-GC-O-MS and 16S rRNA amplicon sequencing[J].Food Res Int,2021,149:110667.
[29]WANG D D,CHEN G,TANG Y,et al.Correlation between autochthonous microbial communities and flavor profiles during the fermentation of mustard green paocai(Brassica juncea Coss.),a typical industrial-scaled salted fermented vegetable[J].LWT-Food Sci Technol, 2022, 172:114212.
[30]张睿,于建丽,宋璇,等.西兰花萝卜硫苷提取物的抑菌及体外免疫活性探究[J].食品研究与开发,2021,42(4):1-7.
[31]HAYASHIDA S,TAKADA K,MELNIKOV V G,et al.How were Lactobacillus species selected as single dominant species in the human vaginal microbiota? Coevolution of humans and Lactobacillus[J].Med Hypotheses,2022,163:110858.
[31]ZHANG X R,LI Y X,ZHAO Y R,et al.Effect of Levilactobacillus brevis as a starter on the flavor quality of radish paocai[J].Food Res Int,2023,168:112780.
[32]LUO W S,WU W L,DU X Y,et al.Regulation of the nitrite,biogenic amine and flavor quality of Cantonese pickle by selected lactic acid bacteria[J].Food Biosci,2023,53:102554.
[33]LÓPEZ E M,CORONA N R,MALO A L.Latilactobacillus sakei as a starter culture to ferment pepper fruits[J].Food Humanity,2024,2:100233.
[34]LIANG G X,BUSHMAN F D.The human virome:assembly,composition and host interactions[J].Nat Rev Microbiol,2021,19:514-527.
[35]吴斌,张眉,姜珊珊,等.大白菜、萝卜芜菁花叶病毒系统进化及CP序列分析[J].山东农业科学,2018,50(8):100-105.
[36]YOU L J,YANG C C,JIN H,et al.Metagenomic features of traditional fermented milk products[J].LWT-Food Sci Technol,2022,155:112945.
[37]GUERRERO L D,PÉREZ M V,ORELLANA E,et al.Long-run bacteriaphage coexistence dynamics under natural habitat conditions in an environmental biotechnology system[J].ISME J,2021,15:636-648.