人参(Panax ginseng)为五加科多年生草本植物,具有增强免疫、抗氧化、抗肿瘤、缓解疲劳等多种生理活性,人参皂苷是发挥功效的主要成分之一,已鉴定出的种类有70余种,同时人参中蛋白质、氨基酸、多糖、黄酮、微量元素等成分等均具有协同增效的功能[1]。其中,人参皂苷Ra、Rb、RC、Rd、Re等普通人参中含量较高(被称为常见皂苷),在人体中的吸收利用度较低,主要通过肠道微生物的代谢作用转化为稀有人参皂苷后被吸收利用[2],而人参皂苷Re、Rg、CK、F1、F2、Rh、Rk2、原人参二醇等通过炮制转化之后形成,含量较低(称为稀有人参皂苷),生物活性更强,药用价值更高。 研究表明,发酵可促进人参皂苷转化形成稀有人参皂苷,是一种新型的人参炮制方式,可提高人体吸收利用度[3-4]。
利用微生物发酵对人参进行的炮制方式研究较多,涉及乳酸菌、酵母菌、芽孢杆菌和曲霉等的单一发酵或复合发酵[5-6]。台雪月等[7]用保加利亚乳杆菌发酵人参,增加稀有皂苷Re、Rg1、Rb1、Rc,提高总酚及总黄酮含量,减少总糖。石洪洋等[8]研究发现,马克斯克鲁维酵母发酵人参可产生大量Rg3,并增强降压效果。严建刚等[9]用副干酪乳杆菌B16NY2107和B04 WI2501复配发酵人参,可显著提高Rg3含量。微生物发酵能转化常见皂苷为稀有人参皂苷,改变人参成分,影响其功效[10-11]。人参对慢性疲劳[12]、中枢性疲劳[13]和心理疲劳[14]有积极作用。杨佳丹等[15]研究发现,人参皂苷Rg3能增强大鼠游泳耐力,改善骨骼肌功能。 李秋阳等[16]研究发现,发酵后的黑参也能延长小鼠游泳时间,改善运动疲劳指标,如降低乳酸、提高糖原水平等。目前,鲜见发酵人参缓解运动性疲劳作用的研究报道。
基于酿酒酵母(Saccharomyces cerevisiae)与植物乳杆菌(Lactobacillus plantarum)在糖代谢途径、酶系统功能及代谢产物多样性方面的互补特性发酵人参。本研究分析发酵前后人参粉中总皂苷、稀有皂苷(Rg3、Rg3R、Rg5)、多糖、蛋白质、氨基酸及短链脂肪的含量变化,并构建小鼠实验模型验证其对运动性疲劳的缓解效果。旨在深化人参资源的精细化加工利用,为抗疲劳功能性食品开发及中草药微生物发酵炮制技术提供创新性理论依据与实践参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与原料
人参粉:吉林长白山种植,9月~10月采收;酿酒酵母(Saccharomyces cerevisiae)、植物乳植杆菌(Lactiplantibacillus plantarum):安琪酵母股份有限公司。
1.1.2 试剂
苯酚、硫酸、香草醛、高氯酸:国药集团化学试剂有限公司;Rg3、Rg3R和Rg5标准品(纯度均≥98%):酒石酸、甲酸、乙酸、丙酸、乳酸、苹果酸和琥珀酸标准品(纯度均≥99%):上海源叶生物科技有限公司;血乳酸(blood lactic acid,BLA)、肝糖原(liver glycogen,LG)、血尿素氮(blood urea nitrogen,BUN)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxidedismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)及腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)酶测试盒:南京建成生物工程公司;C反应蛋白酶联免疫吸附试验(enzyme-Linked Immunosorbent assay,ELISA)试剂盒:上海碧云天生物技术有限公司;IL-6酶联免疫吸附试验(ELISA)试剂盒:武汉博士德生物工程有限公司;肿瘤坏死因子(tumor necrosis factor,TNF)-α ELISA试剂盒:深圳市达科为生物技术股份有限公司;甲酸、甲醇、乙腈、L-2-氯苯丙氨酸(纯度均≥99%):上海恒创生物科技有限公司。
1.1.3 实验动物
无特定病原体动物(specific pathogen free animal,SPF)级健康雄性BALB/c小鼠(8周龄,17~20 g),许可证编号SCXK(浙)2019-0001,浙江维通利华实验动物技术有限公司。
1.2 仪器与设备
HH-6恒温水浴锅:常州天瑞仪器股份有限公司;UV-1780型紫外可见分光光度计:日本岛津公司;HQ-mini恒温培养箱:上海赫田科学仪器有限公司;AR223CN型电子天平:奥豪斯(常州)仪器有限公司;Artemis 6000C全自动氨基酸分析仪:北京百奥创新科技有限公司;LGJ-10N/B真空冷冻干燥机:北京亚星仪科科技发展有限公司;KWY-PT小鼠跑台、KWY-BD小鼠睡眠剥夺平台:南京科唯研生物科技有限公司;Neofuge 23R冷冻离心机、HF160W恒温培养箱:力康生物医疗科技控股有限公司;BioTek Synergy H1全功能微孔板检测仪:上海迭戈生物科技有限公司;LNG-T98冷冻浓缩干燥器:太仓市华美生化仪器厂;AB Triple TOF 5600高分辨质谱仪、1260高效液相色谱仪:安捷伦科技(中国)有限公司。
1.3 方法
1.3.1 发酵人参粉的制备
称取600 g人参粉加入纯化水3 000 g配制成20%的溶液在90~95 ℃水浴处理2 h,结束后121 ℃灭菌15 min,降温至28~30 ℃,采用柠檬酸调节pH至5.5~6.0,按0.05%(V/V)接种量接种酿酒酵母,于28~30 ℃温度发酵28 h后90 ℃灭菌30 min,降温至35~37 ℃,采用食品级氢氧化钠调节pH至6.5~7.0,按0.1%(V/V)接种量接种植物乳杆菌发酵60 h后90 ℃灭菌30 min,然后10 000 r/min离心10 min,取澄清上清液真空冷冻干燥成发酵人参粉。
1.3.2 分析检测
多糖含量的检测:采用苯酚-硫酸法[17];蛋白质含量的检测:参照GB 5009.5—2016《食品中蛋白质的测定》[18];人参总皂苷含量的检测:参照《中华人民共和国药典(二部2020年版)》[19];稀有皂苷(Rg3、Rg3R和Rg5)含量的检测:参照文献[20];多肽分子质量、短链脂肪酸的检测:参照文献[21-22];游离氨基酸、水解氨基酸的检测:参照文献[23]。
多糖分子质量的检测:参照刘旭等[24]的检测方法,略加改动,采用示差折光检测器,Waters MltrahydrogelTM Linear色谱柱(8 μm,300 mm×7.8 mm),流动相为水,流速为0.5 mL/min,柱温为45 ℃,1 mg/mL样品溶液过0.45 μm滤膜后进样,进样量为20 μL。 以保留时间(x)为横坐标,lgMw(y)为纵坐标绘制标准曲线,获得标准曲线回归方程为:y=-1.107 94x+12.76,相关系数R2=0.992 1。 根据标准曲线回归方程计算多糖含量。
1.3.3 小鼠抗疲劳测试
(1)动物分组及给药
将小鼠随机分为8组,每组12只。 相应地将这8组分别命名为空白对照组,模型对照组,人参粉(Panax ginseng powder,PG)高(PG-H)、中(PG-M)、低剂量组(PG-L),发酵人参粉(fermented Panax ginseng powder,PG)高(FPG-H)、中(FPG-M)、低剂量组(FPG-L)。 给药量参照《药理与中药药理实验》[25]按推荐剂量成人一天服用20 g生药材为中剂量组,10 g、30 g为低剂量和高剂量,折换成小鼠服用剂量。口服样品(每天一次),从给药12 d开始造小鼠疲劳模型(适应3 d+休息2 d+跑台6 d+休息2 d+睡眠剥夺3 d=16 d)。在空白对照组(正常喂养小鼠)和模型对照组(疲劳模型小鼠)中给小鼠相同体积的蒸馏水(0.2 mL/10 g)。
(2)造模(跑台+睡眠剥夺)[26-27]
疲劳模型对照组先进行3 d的适应性训练(速度为10 m/min,坡度为0,时间为1 h),休息2 d,从第5天开始进行正式跑台运动。初始速度为10 m/min,在10 min内逐渐增加负荷使速度达到28 m/min,一直持续到力竭。以这种运动方式持续运动6 d。(力竭标准:运动末期动物不能坚持原跑速,先后滞跑道后1/3处达3次以上,刺激驱赶无效,停跑后体征表现为呼吸急促、神情倦怠、腹卧位,对刺激反应迟钝,再进行连续3 d不间断的睡眠剥夺造模)。 休息2 d,再进行后续睡眠剥夺造模,通过观察动物是否达到力竭标准及停跑后的特异性体征,可判断疲劳模型是否构建成功。 记录小鼠的体质量和摄食量,每3 d/次。疲劳造模开始后记录小鼠的行为学变化,记录小鼠在跑台上的运动持续的力竭时间,并监测小鼠体力的变化。
(3)小鼠抗疲劳外周生化指标的测定
造模结束后,从每组中取出6只小鼠麻醉,心脏取血、将小鼠的血样收集在肝素化的试管中,及时采用试剂盒测定BLA。 收集血液后,立即解剖小鼠肝脏,分析LG浓度。取小鼠后肢肌肉组织,采用试剂盒检测肌肉组织中三磷酸腺苷酶的含量。另从每组中取出6只小鼠麻醉,从心脏抽出血液,并通过在4 ℃下以3 000 r/min离心10 min制备血清,使用相应试剂盒确定BUN、MDA、SOD、GSH-Px、LDH和CK的水平及炎症因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)-α、白细胞介素-6(Interleukin-6,IL-6)、C反应蛋白(C-reactive protein,CRP)。
1.3.4 数据分析
数据采用Minitab21、Origin2023软件绘图分析,比较采用单因素方差分析显著性,当P<0.05时,认为组间差异具有统计学意义。
2 结果与分析
2.1 人参粉发酵前后主要成分变化分析
2.1.1 人参粉发酵前后多糖、蛋白质、总皂苷和稀有皂苷含量变化分析
由图1a可知,人参粉经过发酵后多糖含量减少44.8%,总皂苷含量增加44.4%,蛋白质含量增加50%。因发酵微生物代谢酶的剪切作用较大,使多糖转化成寡糖或单糖被利用[28];初级代谢产物消耗,与纤维多糖等结合的皂苷类成分被释放,使总皂苷含量增加[29];发酵过程引入菌体自溶蛋白成分,使蛋白质提高[30]。由图1b可知,经发酵处理后的人参粉中稀有皂苷Rg3、Rg3R与Rg5含量较未发酵人参粉显著升高(P<0.05),其增量倍数分别达86倍、9.3倍和120倍,主要原因是代谢产生的糖苷键水解酶系将常见皂苷的C-3、C-6和C-20位的糖苷键水解,糖链长度减少,使稀有皂苷含量增加[29]。因此酿酒酵母与植物乳杆菌协调发酵可以显著提升常见皂苷的转化效率,提升发酵人参粉中稀有皂苷的含量。这与台雪月等[7]利用保加利亚乳杆菌发酵转化人参皂苷研究结果类似。 因此,人参粉经发酵后可极显著提高稀有人参皂苷成分含量(P<0.01)。
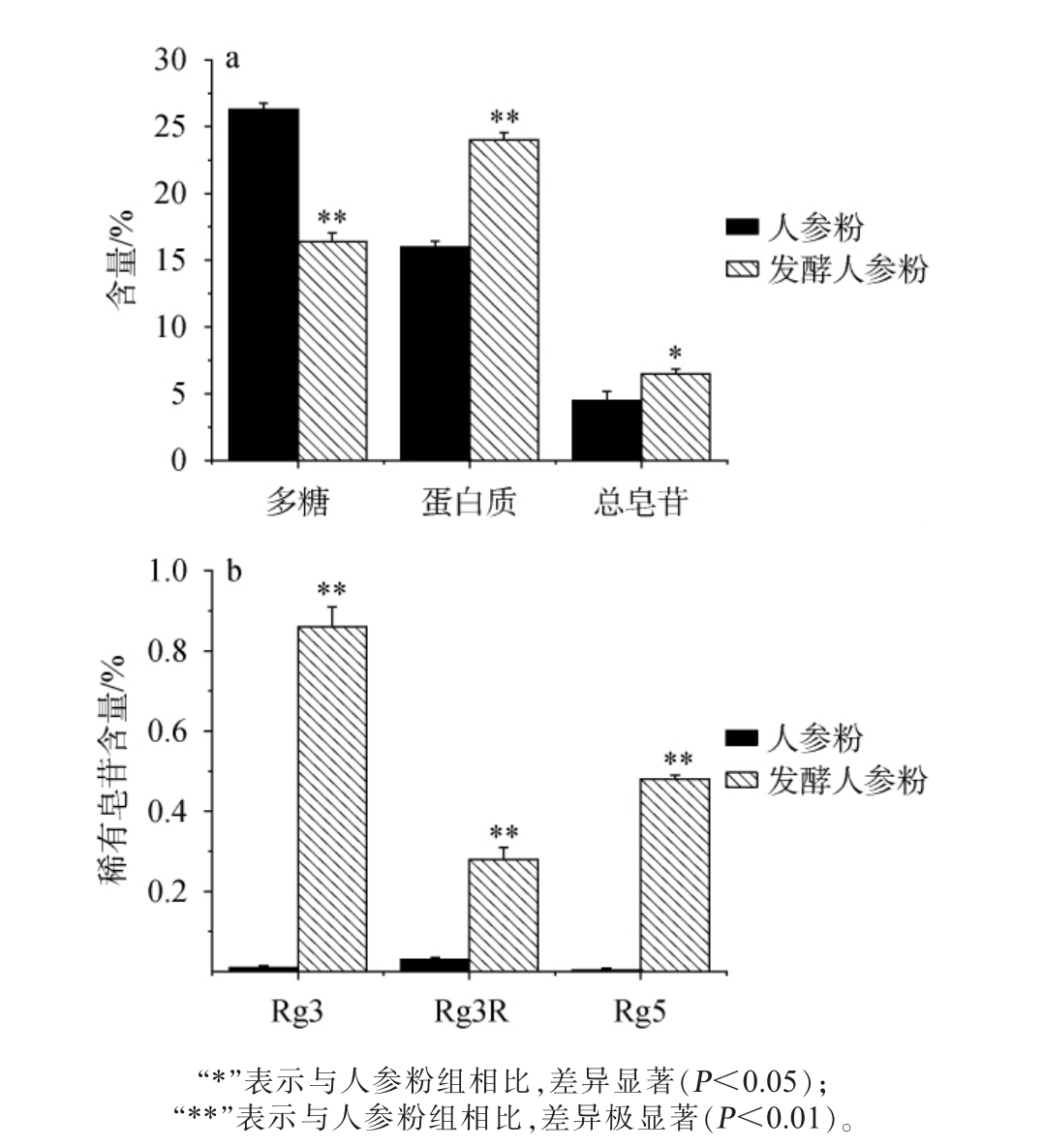
图1 人参粉发酵前后多糖、蛋白质、总皂苷(a)和稀有皂苷(b)含量分析
Fig.1 Analysis of polysaccharide, protein, total saponins (a) and rare saponins (b) contents in ginseng powder before and after fermentation
2.1.2 人参粉发酵前后游离氨基酸、水解氨基酸和短链脂肪酸含量变化分析
由表1可知,经研究发现人参粉在发酵后其游离氨基酸的种类从16种增加至20种,总含量从4.04%提升至5.76%,其中天门冬氨酸、甘氨酸、精氨酸等关键氨基酸含量明显增加。这些氨基酸在运动后肌肉恢复和能量代谢中发挥重要作用,如天门冬氨酸促进肌肉蛋白质合成,甘氨酸参与血红蛋白合成,精氨酸提高运动耐力并促进肌肉生长[31-32]。此外,发酵人参粉通过微生物代谢显著提高了游离态必需氨基酸的总量,总游离必需氨基酸(包括缬氨酸、苏氨酸、亮氨酸、异亮氨酸、苯丙氨酸)含量从0.15%提升至0.28%;尽管部分水解态必需氨基酸(包括缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸、赖氨酸、组氨酸)因微生物消耗或转化而下降,但关键氨基酸如苏氨酸和缬氨酸仍维持在较高水平,支持免疫球蛋白合成和肌肉代谢需求[33]。表明发酵过程促进了氨基酸的释放,增加了营养物质的种类和含量,从而更好地支持运动后的恢复。
表1 人参粉发酵前后游离氨基酸、水解氨基酸和短链脂肪酸检测结果
Table 1 Detection results of free amino acids, hydrolyzed amino acids and short-chain fatty acids before and after ginseng fermentation

指标 人参粉 发酵人参粉游离氨基酸/%水解氨基酸/%短链脂肪酸/(mg·kg-1)磷酸丝氨酸天门冬氨酸苏氨酸丝氨酸谷氨酸甘氨酸丙氨酸瓜氨酸α-氨基正丁酸缬氨酸胱硫醚异亮氨酸亮氨酸酪氨酸苯丙氨酸β-丙氨酸β-氨基异丁酸γ-氨基丁酸鸟氨酸精氨酸脯氨酸总计天门冬氨酸苏氨酸丝氨酸谷氨酸甘氨酸丙氨酸胱氨酸缬氨酸蛋氨酸异亮氨酸亮氨酸酪氨酸苯丙氨酸赖氨酸组氨酸精氨酸脯氨酸总计酒石酸甲酸乙酸丙酸乳酸琥珀酸苹果酸总和0.80±0.08 0.05±0.01 0.01±0.00 0.02±0.00 0.30±0.03 0.05±0.01 0.00±0.00 0.02±0.00 0.01±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.13±0.02 0.03±0.00 0.01±0.00 0.01±0.00 0.05±0.01 0.02±0.00 0.00±0.00 2.44±0.24 0.09±0.01 4.04±0.33 1.24±0.12 0.49±0.05 0.42±0.04 1.68±0.17 0.44±0.04 0.52±0.05 0.19±0.02 0.49±0.05 0.12±0.01 0.42±0.04 0.81±0.08 0.37±0.04 0.27±0.03 0.65±0.07 0.26±0.03 3.02±0.30 0.42±0.04 11.82±0.26 11 786.56±1 178.66 6 380.50±638.05 1 650.58±165.06 0.00±0.00 35.89±3.59 8 520.89±852.09 16 050.53±1 605.05 44 424.95±4 442.50 1.05±0.10 0.14±0.01 0.02±0.00 0.01±0.00 0.30±0.04 0.12±0.01 0.01±0.00 0.03±0.00 0.01±0.00 0.01±0.00 0.06±0.01 0.04±0.01 0.20±0.01 0.03±0.01 0.01±0.00 0.02±0.00 0.01±0.00 0.43±0.04 0.04±0.01 3.15±0.31 0.07±0.01 5.76±0.42 1.41±0.14 0.52±0.05 0.41±0.04 2.41±0.24 0.59±0.06 0.60±0.06 0.14±0.01 0.45±0.05 0.05±0.01 0.35±0.04 0.52±0.05 0.31±0.03 0.18±0.02 0.54±0.05 0.23±0.03 4.01±0.40 0.68±0.07 13.39±0.47 17 632.90±1 763.29 48.46±4.85 1 495.07±149.51 400.43±40.04 19 702.20±1 970.22 8 009.05±800.91 1 405.77±140.58 48 693.88±4 869.39
表2 不同组别小鼠跑台力竭时间
Table 2 Running treadmill exhaustion time of different groups of mice min
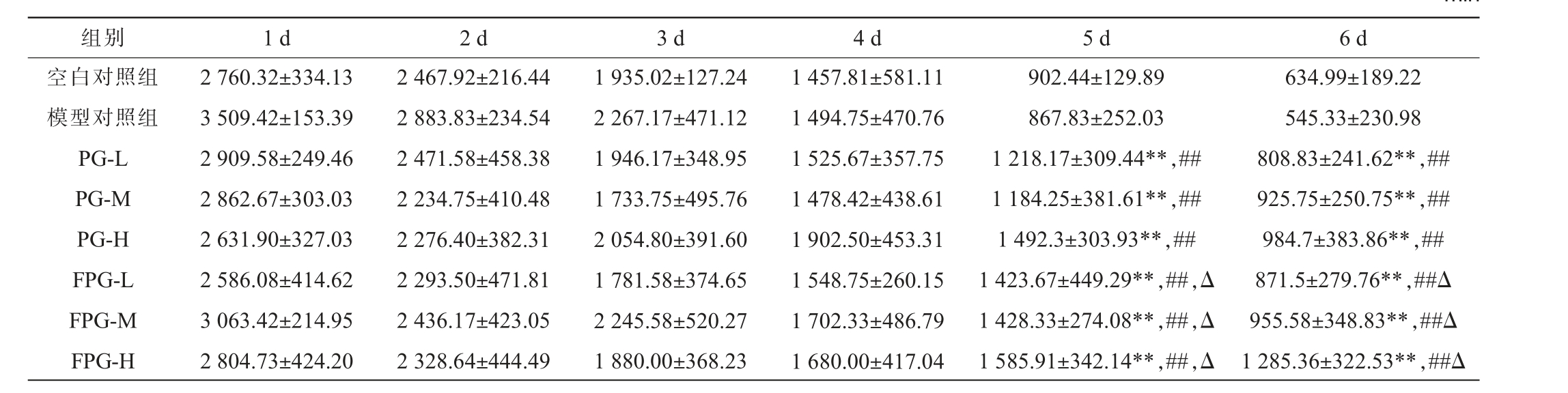
注:“*”、“**”分别表示与空白对照组相比,各处理组别差异显著(P<0.05)、极显著(P<0.01)。“#”、“##”分别表示与模型对照组相比,各组别差异显著(P<0.05)、极显著(P<0.01)。 “Δ”、“ΔΔ”分别表示与同剂量人参粉组相比,发酵人参粉组差异显著(P<0.05)、极显著(P<0.01)。下同。
组别 1 d 2 d 3 d 4 d 5 d 6 d空白对照组模型对照组PG-L PG-M PG-H FPG-L FPG-M FPG-H 2 760.32±334.13 3 509.42±153.39 2 909.58±249.46 2 862.67±303.03 2 631.90±327.03 2 586.08±414.62 3 063.42±214.95 2 804.73±424.20 2 467.92±216.44 2 883.83±234.54 2 471.58±458.38 2 234.75±410.48 2 276.40±382.31 2 293.50±471.81 2 436.17±423.05 2 328.64±444.49 1 935.02±127.24 2 267.17±471.12 1 946.17±348.95 1 733.75±495.76 2 054.80±391.60 1 781.58±374.65 2 245.58±520.27 1 880.00±368.23 1 457.81±581.11 1 494.75±470.76 1 525.67±357.75 1 478.42±438.61 1 902.50±453.31 1 548.75±260.15 1 702.33±486.79 1 680.00±417.04 902.44±129.89 867.83±252.03 1 218.17±309.44**,##1 184.25±381.61**,##1 492.3±303.93**,##1 423.67±449.29**,##,Δ 1 428.33±274.08**,##,Δ 1 585.91±342.14**,##,Δ 634.99±189.22 545.33±230.98 808.83±241.62**,##925.75±250.75**,##984.7±383.86**,##871.5±279.76**,##Δ 955.58±348.83**,##Δ 1 285.36±322.53**,##Δ
表3 不同组别小鼠血清生化指标检测结果
Table 3 Results of serum biochemical indexes in different groups of mice
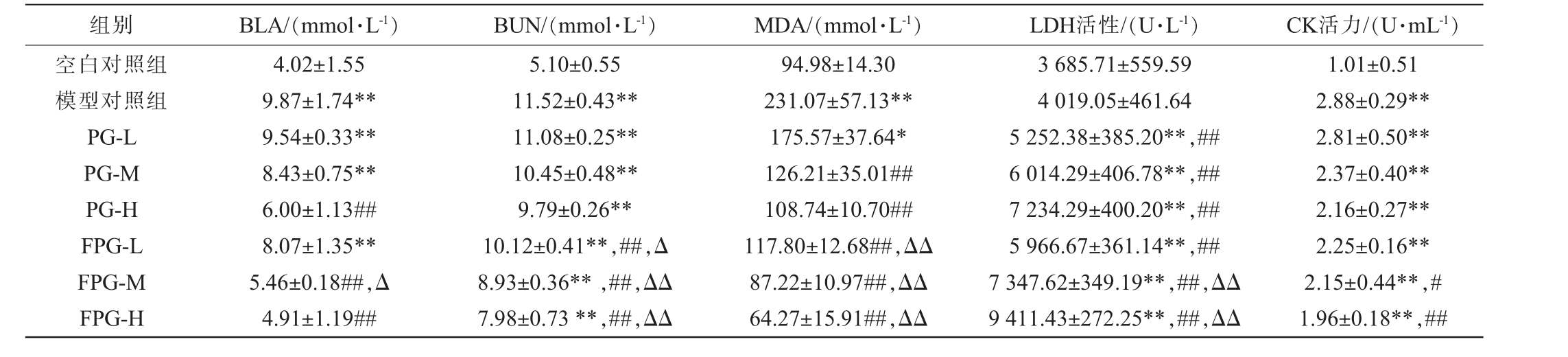
组别 BLA/(mmol·L-1) BUN/(mmol·L-1) MDA/(mmol·L-1) LDH活性/(U·L-1) CK活力/(U·mL-1)空白对照组模型对照组PG-L PG-M PG-H FPG-L FPG-M FPG-H 4.02±1.55 9.87±1.74**9.54±0.33**8.43±0.75**6.00±1.13##8.07±1.35**5.46±0.18##,Δ 4.91±1.19##5.10±0.55 11.52±0.43**11.08±0.25**10.45±0.48**9.79±0.26**10.12±0.41**,##,Δ 8.93±0.36** ,##,ΔΔ 7.98±0.73**,##,ΔΔ 94.98±14.30 231.07±57.13**175.57±37.64*126.21±35.01##108.74±10.70##117.80±12.68##,ΔΔ 87.22±10.97##,ΔΔ 64.27±15.91##,ΔΔ 3 685.71±559.59 4 019.05±461.64 5 252.38±385.20**,##6 014.29±406.78**,##7 234.29±400.20**,##5 966.67±361.14**,##7 347.62±349.19**,##,ΔΔ 9 411.43±272.25**,##,ΔΔ 1.01±0.51 2.88±0.29**2.81±0.50**2.37±0.40**2.16±0.27**2.25±0.16**2.15±0.44**,#1.96±0.18**,##
短链脂肪酸在人参粉发酵后表现出显著变化,其总含量从(44 424.95±4 442.50) mg/kg提升至(48 693.88±4 869.39)mg/kg,表明发酵过程促进了短链脂肪酸的生成。其中,这可能是由于乳酸菌代谢活动增强所致。 乳酸作为运动中的重要能量来源,能够被快速利用,有助于提升运动耐力[34]。 此外,酒石酸和丙酸等其他短链脂肪酸的含量也有所增加,这些短链脂肪酸在能量代谢中扮演关键角色,能够为机体提供额外的能量支持,从而有助于缓解运动后的疲劳[35]。
2.2 发酵人参粉对小鼠体质量的影响
不同组别小鼠在训练期间体质量变化见图2。由图2可知,在28 d周期内,对照组、模型对照组以及实验组的小鼠均呈现出稳定的生长态势,其体质量增长的趋势一致,且经过统计学分析发现各组别小鼠体质量增长差异不显著(P>0.05),表明人参粉及发酵人参粉均未对小鼠的健康状况产生任何不利的影响。
图2 不同组别小鼠在训练期间体质量变化
Fig.2 Changes of body mass of mice in different groups during training
2.3 发酵人参粉对小鼠力竭运动时间的影响
小鼠跑台力竭时间是反映其运动能力和抗疲劳能力的重要指标之一[36]。随着实验时间延长,各组小鼠的运动耐受时间均下降,符合体能自然消耗规律。与空白对照组、模型对照组相比,灌胃给予人参粉及发酵人参粉的小鼠,在实验第5天和第6天的力竭时间极显著延长(P<0.01),表明人参粉和发酵人参粉显著增强了小鼠的耐力。 此外,实验第5天和第6天发酵人参粉处理的小鼠力竭时间长于同剂量人参粉组(P<0.05),说明发酵过程可能提升了人参粉的生物活性成分或吸收效率,从而更有效地提升了小鼠的耐力。 SUN Z等[35]研究表明,人参水提取物中的多糖和小分子皂苷对缓解运动性疲劳有显著作用,肠道微生物群通过调节人参次生皂苷及胆汁酸和短链脂肪酸的水平,介导了多糖的抗疲劳效应,有效减轻疲劳相关的能量代谢异常和氧化应激状态。
2.4 发酵人参粉对跑台小鼠外周疲劳相关生化指标的影响
2.4.1 发酵人参粉对跑台小鼠外周疲劳相关血清生化指标的影响
长时间高强度的训练会导致机体产生大量乳酸(BLA),导致内环境酸碱失衡,这是产生运动疲劳的重要原因之一,通过减少乳酸积累及加速其清除能够有效缓解运动性疲劳[37]。与空白对照组乳酸含量(4.02±1.55)mmol/L相比,模型对照组小鼠的BLA含量(9.87±1.74)mmol/L极显著增加(P<0.01),说明剧烈运动导致大量的乳酸堆积,小鼠的运动状态受到影响,出现疲劳状态。与模型对照组相比,不同实验组小鼠的BLA含量降低,且在一定范围内呈剂量依赖性,PG-H和FPG-M、FPG-H均极显著降低了BLA水平(P<0.01)。其中,FPG-H组小鼠的BLA含量最低(4.91±1.19)mmol/L,与同剂量人参粉组小鼠PG-M相比,FPG-M组小鼠的BLA含量显著降低,为(5.46±0.18)mmol/L(P<0.05)。说明人参粉可以降低乳酸含量,且发酵人参粉缓解疲劳效果更好。
尿素氮(BUN)是剧烈运动后蛋白质降解的代谢产物之一,是与疲劳和应激相关的重要指标[38]。 与空白对照组(5.10±0.55) mmol/L相比,模型对照组小鼠的BUN含量(11.52±0.43)mmol/L极显著增加(P<0.01),说明在持续运动后,小鼠体内糖与脂肪供能不足,蛋白质参与提供能量,小鼠出现运动性疲劳。与模型对照组相比,人参粉及发酵人参粉各剂量组小鼠的血清BUN含量均极显著降低(P<0.01),说明摄入人参粉或发酵人参粉可以减少尿素的产生,提高小鼠的运动耐性,达到抗疲劳的效果。 且发酵人参粉组小鼠血清BUN含量均低于同剂量未发酵人参粉组小鼠。
与空白对照组小鼠血清丙二醛(MDA)含量(94.98±14.30)mmol/L相比,模型对照组小鼠血清MDA含量(231.07±57.14)mmol/L极显著升高(P<0.01),表明剧烈运动后自由基增多,脂质过氧化增强,生物膜受损[39]。 实验组小鼠MDA含量随剂量增加而降低,其中,PG-L组小鼠血清MDA含量(175.57±37.64)mmol/L差异显著(P<0.05),其余组别差异不显著(P>0.05),此外,与PG各组别相比,FPG中、低、高剂量组MDA含量极显著下降(P<0.01)。结果表明,发酵人参粉可减轻运动引起的自由基损伤,减少MDA产生,具有抗疲劳作用。
乳酸脱氢酶(LDH)催化乳酸脱氢生成丙酮酸,减少体内乳酸蓄积,是评估糖酵解系统能量供应能力的重要指标[40]。 LDH活性在一定范围内的升高,表明机体清除乳酸的能力增强。实验组小鼠血清LDH活力极显著高于模型对照组(4 019.05±461.64)U/L(P<0.01),能有效降低运动后血乳酸水平。FPG-M组和FPG-H组小鼠血清LDH活力极显著高于同剂量PG-M组和PG-H组小鼠(P<0.01),酶活力分别为(7 347.62±349.19) U/L和(9 411.43±272.25) U/L,说明发酵人参粉的效果优于未发酵人参粉,通过提高LDH活力,降低血乳酸水平,发酵人参粉发挥抗疲劳作用。
肌酸激酶(CK)在外周组织中将肌酸磷酸化形成磷酸肌酸,后者可将磷酸键转移至ADP生成ATP,防止或延缓ATP耗尽。 疲劳时ATP大量消耗,CK活性升高以产生更多ATP,延缓疲劳,因此CK活性越高,疲劳越严重[40]。运动后,模型组小鼠血清CK活力为(2.88±0.29)U/L,实验组小鼠血清CK活力均降低,且FPG-M、FPG-H组小鼠血清CK活力分别显著、极显著低于同剂量PG-M、PG-H组小鼠(P<0.05、P<0.01)。
人参粉及发酵人参粉均能缓解运动性疲劳,且发酵人参粉缓解效果更显著,其可降低乳酸、尿素氮和丙二醛水平,提升乳酸脱氢酶活力,并抑制肌酸激酶活性升高。TANG X等[41]发现双歧杆菌亚种CCFM1274可体外转化人参皂苷Rb1、Rc为Rd,其发酵产物F-GE显著提高抗疲劳活性,改善游泳耐力及生化指标,表明人参发酵产品在缓解运动疲劳方面具有潜力,与本研究结果一致。
2.4.2 发酵人参粉对跑台小鼠肝脏糖原含量的影响
糖原是机体剧烈运动时的能量来源,其储备量会影响到机体的疲劳度[42]。由图3可知,空白对照组小鼠肝脏糖原含量为(12.05±0.55)mg/g,模型对照组小鼠肝脏糖原含量因剧烈运动极显著降低至(10.28±0.40)mg/g(P<0.01),说明剧烈运动中肌糖原消耗的同时肝糖原也会被分解为葡萄糖来维持机体血糖水平。人参粉处理组(PG-L、PG-M、PG-H)肝脏糖原含量均显著高于模型对照组(P<0.05),表明其有助于补充肝糖原。 发酵人参粉组中,FPG-L组小鼠肝脏糖原含量与模型对照组无显著差异(P>0.05),而FPG-M和FPG-H组小鼠肝脏糖原含量极显著高于模型对照组(P<0.01),表明发酵人参粉在补充肝糖原方面效果更显著。结果表明,人参粉及其发酵产品能有效补充因运动消耗的肝糖原,缓解疲劳,高剂量发酵人参粉效果更为明显。
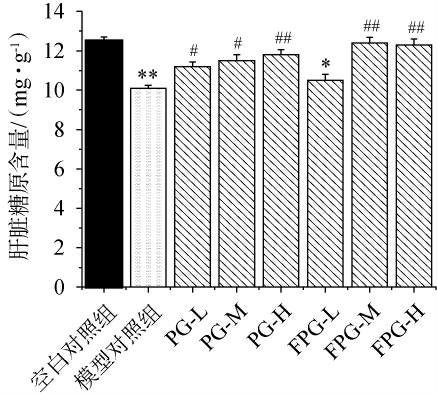
图3 不同组别小鼠肝脏糖原含量检测结果
Fig.3 Detection results of liver glycogen contents in different groups of mice
2.4.3 发酵人参粉对跑台小鼠血清抗氧化酶的影响
超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)是机体内重要的抗氧化酶,也是与疲劳相关的生理标志物,可间接反映肌肉组织是否受损[43]。
由图4可知,与空白对照组相比,FPG-L、FPG-M和FPG-H组小鼠血清的SOD和GSH-Px活性均明显提高,且FPG-H组小鼠血清的SOD活力(193.87±3.85)U/mL极显著优于PG-H组(178.39±5.10)U/mL(P<0.01);与模型对照组小鼠血清的GSH-Px活性(277.95±97.90)nmol/(mg·min)相比,PG-H、FPG-M、FPG-H组小鼠血清的GSH-Px活性均提高(分别为(617.01±276.22)nmol/(mg·min)、(618.11±197.96) nmol/(mg·min)、(1 116.85±189.32)nmol/(mg·min)),且FPG-H组GSH-Px活性极显著高于PG-H(P<0.01)。综上,发酵人参粉能够通过提高机体抗氧化能力、清除机体内的自由基来帮助减少自由基的伤害,从而提升机体的抗疲劳能力。
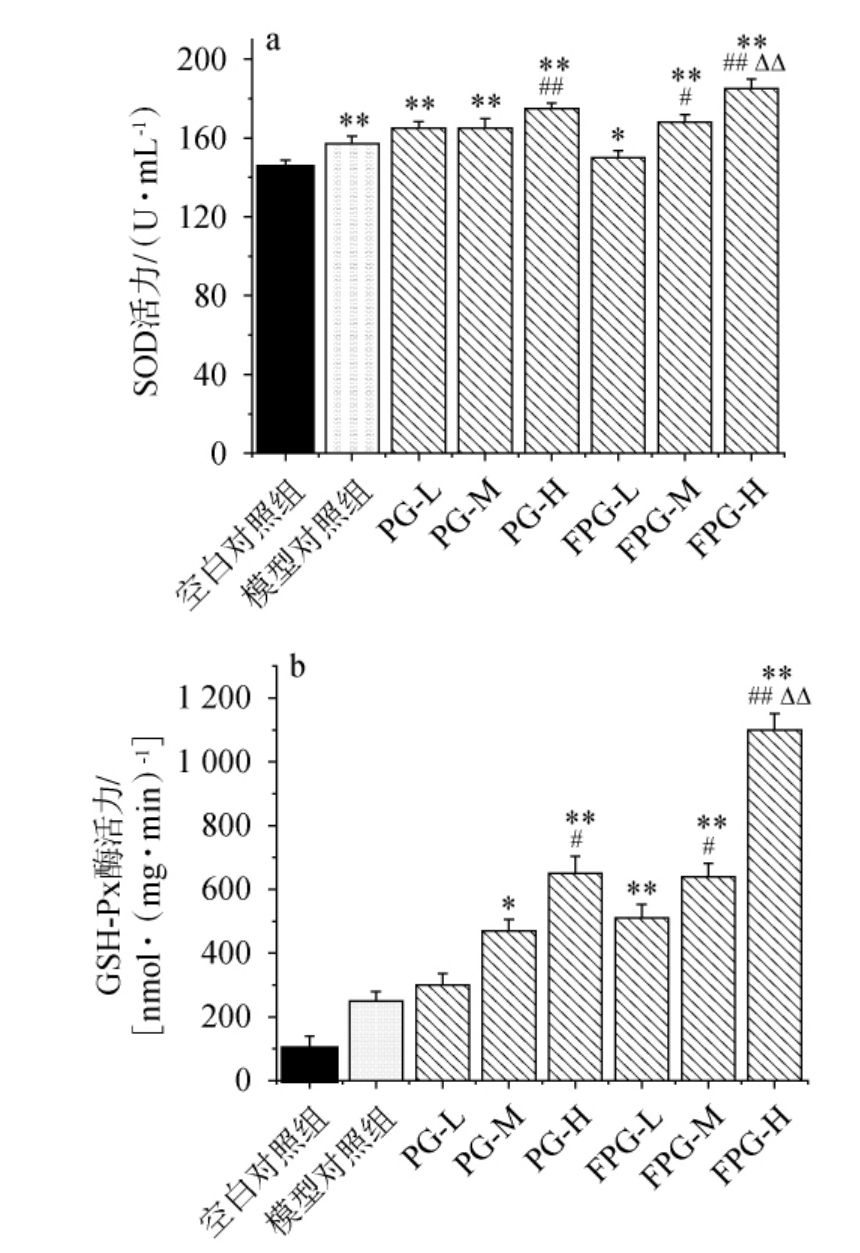
图4 不同组别小鼠血清超氧化物歧化酶和谷胱甘肽过氧化物酶活性
Fig.4 Superoxide dismutase and glutathione peroxidase activities in serum of different groups of mice
2.4.4 发酵人参粉对跑台小鼠肌肉组织ATP酶活力的影响
肌肉组织中的ATP酶活力与疲劳之间存在着密切的关系,三磷酸腺苷(ATP)是肌肉细胞内的主要能量来源,而ATP酶则是催化ATP分解以释放能量的关键酶。 ATP酶活力反映了肌肉组织中ATP分解的速率和效率,当肌肉需要能量时,ATP酶会催化ATP分解为二磷酸腺苷(adenosine diphosphate,ADP)和磷酸,同时释放出能量供肌肉收缩使用。由图5a可知,空白对照组的小鼠肌肉组织Na+-K+-ATP酶活力为(0.22±0.11)μmol/(mg·h),模型对照组为(0.34±0.05)μmol/(mg·h),PG组和FPG组小鼠肌肉组织Na+-K+-ATP酶活力均极显著高于空白对照组和模型对照组(P<0.01),且FPG-L、FPG-M、FPG-L组小鼠肌肉组织Na+-K+-ATP酶活力极显著高于同剂量的PG组(P<0.01)。 由图5b可知,FPG-M、FPG-H组小鼠肌肉组织Mg2+-ATP酶活均极显著高于空白对照组(0.27±0.13)μmol/(mg·h)和模型对照组(0.37±0.03) μmol/(mg·h)(P<0.01),且FPG-M、FPG-H组小鼠肌肉组织Mg2+-ATP酶活极显著高于同剂量的PG-M、PG-M组(P<0.01)。由图5c可知,空白对照组的小鼠肌肉组织Ga2+-ATP酶活为(0.41±0.08) μmol/(mg·h),模型对照组为(0.66±0.15) μmol/(mg·h),PG-H组和FPG-L、FPG-M、FPG-H组小鼠肌肉组织Ga2+-ATP酶均极显著高于模型对照组(P<0.01),且FPG各组别极显著高于同剂量的PG组(P<0.01)。 由图5d可知,空白对照组的小鼠肌肉组织Ga2+-Mg2+-ATP酶活力为(0.47±0.07)μmol/(mg·h),模型对照组小鼠肌肉组织Ga2+-Mg2+-ATP酶活为(0.49±0.16)μmol/(mg·h),PG-H组和FPG组小鼠肌肉组织Ga2+-Mg2+-ATP酶活均极显著高于模型对照组(P<0.01),且FPG-L、FPG-M、FPG-H组极显著高于同剂量的PG组(P<0.01)。 这说明发酵人参粉可以通过增加肌肉组织中Na+-K+-ATP酶、Mg2+-ATP酶、Ga2+-ATP酶以及Ca2+-Mg2+-ATP酶活性,提高骨骼肌的收缩力和收缩速度来抵抗疲劳的产生。
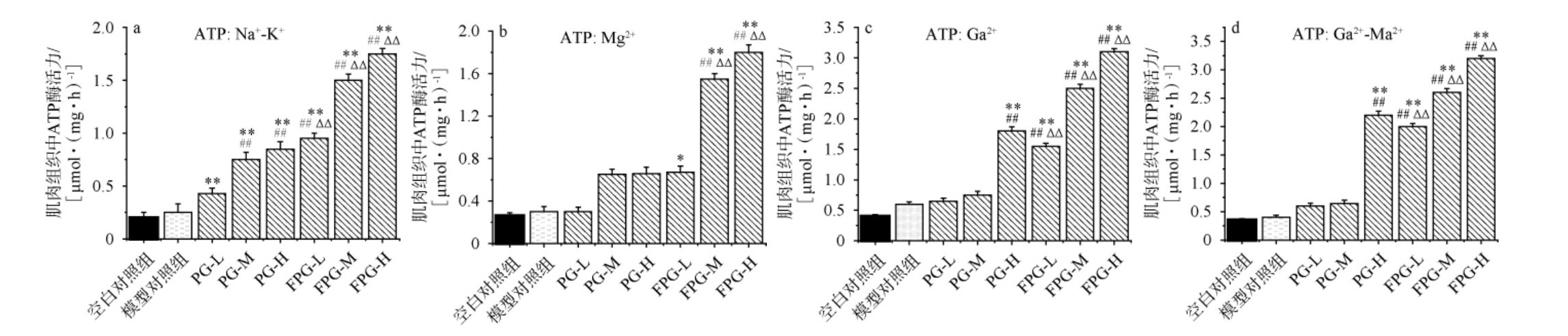
图5 不同组别小鼠肌肉组织三磷酸腺苷酶活力
Fig.5 Adenosine triphosphate activity in muscle tissue of different groups of mice
2.4.5 发酵人参粉对跑台小鼠血清中炎症指标TNF-α、IL-6、CRP含量的影响
持续的炎症反应可能导致机体的能量代谢异常和疲劳感增加,TNF-α、IL-6和CRP等炎症指标的水平升高可能反映机体的炎症反应状态,进而影响机体的抗疲劳能力[44]。由图6可知,与空白对照组相比、模型对照组各炎症因子含量极显著升高(P<0.01),经过人参粉和发酵人参粉的干预,炎症因子水平有不同程度地下降。 与模型对照组相比,FPG-M、FPG-H组的IL-6和TNF-α含量均极显著下降(P<0.01),各剂量组的CRP极显著下降(P<0.01)。 结果表明小鼠经剧烈运动促进炎症因子的增加,发酵人参粉可有效降低运动炎症水平。
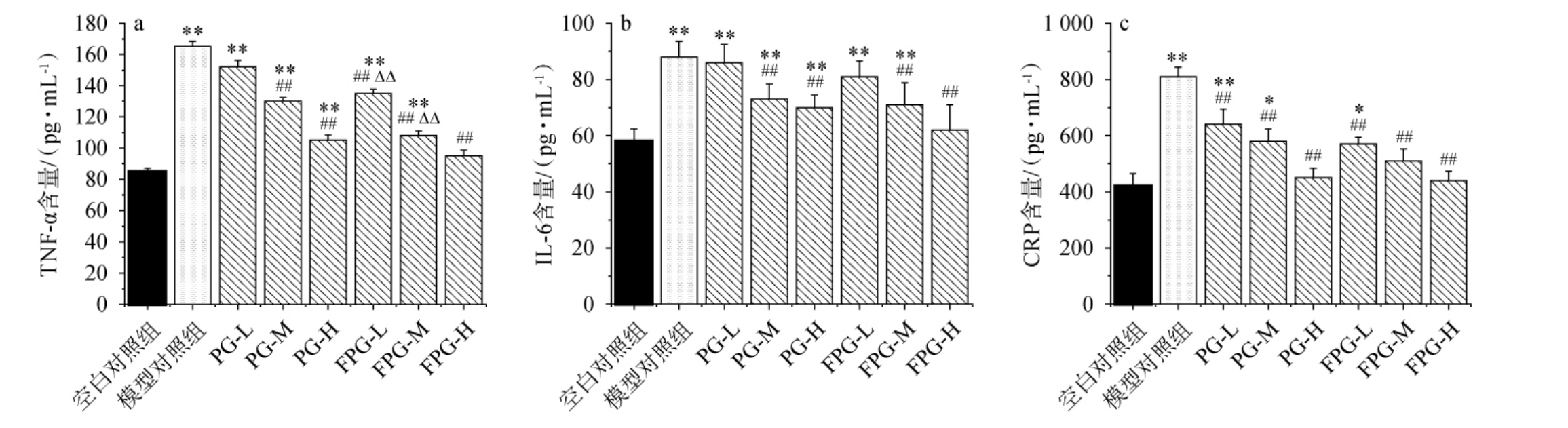
图6 不同组别小鼠血清中炎症因子肿瘤坏死因子-α(a)、白细胞介素-6(b)、C反应蛋白(c)含量
Fig.6 Contents of tumor necrosis factor-α (a), interleukin-6 (b) and C reactive protein (c) in serum of different groups of mice
3 结论
经酿酒酵母与植物乳杆菌协同发酵后,人参粉总皂苷、稀有人参皂苷(Rg3、Rg3R、Rg5)含量提升,关键氨基酸(如天冬氨酸、甘氨酸、精氨酸)及短链脂肪酸(如乳酸、酒石酸、丙酸)含量增加。 与未发酵人参粉相比,发酵人参粉在改善疲劳相关生化指标方面优势显著,与模型对照组相比,发酵人参粉能明显延长小鼠力竭时间,降低小鼠血清中乳酸、丙二醛(MDA)、尿素氮(BUN)含量及肌酸激酶(CK)水平,增加肝脏糖原含量及乳酸脱氢酶(LDH)、抗氧化酶水平、三磷酸腺苷(ATP)酶活力,表明其在缓解运动性疲劳方面效果明显。然而,发酵人参在运动疲劳状态下对是否能改善肠道屏障功能等功能仍有待进一步研究。
[1]刘朝金,张晓梅,庹呈杰,等.4种达玛烷型人参皂苷元结构改造及生物活性研究进展[J].云南中医药大学学报,2024,47(3):82-93.
[2]颜红娇,赵庆宇靖,郭琰,等.理化及生物转化稀有人参皂苷的方法[J].中南农业科技,2024,45(4):238-241.
[3]GUO B Y,LIANG Y L,FU B R,et al.Integrated analysis of ginsenoside content and biomarker changes in processed ginseng:Implications for anticancer mechanisms[J].Foods,2024,13(16):2497.
[4]QU Q S,YANG F,ZHAO C Y,et al.Effects of fermented ginseng on the gut microbiota and immunity of rats with antibiotic-associated diarrhea[J].J Ethnopharmacol,2021,267:113594.
[5]GAO Y,FENG Y D,CHANG Y Y,et al.Biotransformation of ginsenoside Rb1 to ginsenoside Rd and 7 rare ginsenosides using Irpex lacteus with HPLC-HRMS/MS Identification[J].ACS omega,2024,9(21):22744-22753.
[6]张倩,国立东,都晓伟.人参的益生菌发酵及其发酵产品研究进展[J].食品与发酵工业,2022,48(13):311-319.
[7]台雪月,卢忠魁,刘超,等.保加利亚乳杆菌发酵转化人参皂苷工艺研究[J].食品安全质量检测学报,2024,15(6):1-9.
[8]石洪洋,洪兰.马克斯克鲁维酵母发酵人参对血压调节作用的初步研究[J].延边大学农学学报,2023,45(3):51-55.
[9]严建刚,陆路,付少委,等.乳酸菌发酵转化人参皂苷Rg3工艺研究[J].食品与发酵工业,2023,49(16):222-230.
[10]郑怡菲,李涛,赵余庆.人参有效成分抗疲劳作用机制的研究进展[J].药物评价研究,2023,46(11):2496-2504.
[11]王学芳,任红贤,封颖璐.人参皂苷单体的抗疲劳作用研究进展[J].解放军医药杂志,2019,31(12):114-116.
[12]SUNG W S,KANG H R,JUNG C Y,et al.Efficacy of Korean red ginseng(Panax ginseng)for middle-aged and moderate level of chronic fatigue patients: A randomized, double-blind, placebo-controlled trial[J].Complement Ther Med,2020,48:102246.
[13]KANG J Y, KIM D Y, LEE J S, et al.Korean red ginseng ameliorates fatigue via modulation of 5-HT and corticosterone in a sleep-deprived mouse model[J].Nutrients,2021,13(9):3121.
[14]ST-LAURENT S, HAMMAMI R.The untapped potential of ginsenosides and american ginseng berry in promoting mental health via the gutbrain axis[J].Nutrients,2022,14(12):2523.
[15]杨佳丹,向荣凤,戴青,等.人参皂苷Rg3对模拟高原缺氧大鼠的抗疲劳效应和骨骼肌线粒体功能的影响[J].第三军医大学学报,2019,41(2):110-115.
[16]李秋阳,唐金鑫,刘士伟,等.黑参发酵对疲劳应激诱导氧化损伤的防护作用及与白参、红参和人参浆果的比较[J].食品科学,2022,43(21):226-232.
[17]孙国强,董金颖,董建生.苯酚-硫酸法测定灵芝菌丝多糖含量的研究[J].山西化工,2024,44(4):50-52,72.
[18]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.5—2016 食品安全国家标准 食品中蛋白质的测定[S].北京:中国标准出版社,2016.
[19]国家药典委员会.中华人民共和国药典(二部2020年版)[M].北京:中国医药科技出版社,2020:8-9.
[20]屈文佳,徐文娟,李春帅,等.HPLC法同时测定红参中6种稀有人参皂苷的含量[J].中华中医药杂志,2023,38(6):2874-2877.
[21]王千慧,刘颖,孙思琪,等.两种方法制备的蛹虫草小分子肽分子量分布及体外抗氧化能力对比研究[J].食品与药品,2024,26(2):175-178.
[22]中华人民共和国卫生和计划生育委员会.GB 5009.157—2016 食品中有机酸的测定[S].北京:中国标准出版社,2016.
[23]王华芬,王强,刘双燕,等.不同品种山药粉中游离氨基酸和水解氨基酸含量分析[J].安徽农业科学,2022,50(14):164-166,173.
[24]刘旭,孟继坤,葛鑫会,等.低共熔溶剂提取的黄精多糖性质分析[J].食品工业科技,2022,43(11):52-57.
[25]彭成.药理与中药药理试验[M].北京:科学出版社,2021.
[26]叶南.运动结合生慧汤对睡眠剥夺模型大鼠学习记忆的影响及其机制探讨[D].武汉:湖北中医药大学,2021.
[27]林基伟,汪栋材,吴海滨,等.慢性疲劳综合征动物模型研究概况[J].新中医,2019,51(3):19-22.
[28]海梅.黄精微生物转化及其多糖类成分的抗氧化活性研究[D].成都:成都大学,2024.
[29]李倩,于丹,国立东,等.微生物发酵转化皂苷类化合物机制的研究进展[J].中草药,2022,53(22):7264-7278.
[30]吴泳锡.人参发酵液的成分分析及对肝脏的影响[D].长春:长春中医药大学,2023.
[31]孙宇昊,王珍珍,戴静,等.三叶木通果发酵过程中氨基酸组成及营养价值评价[J].食品研究与开发,2024,45(20):172-182.
[32]FENG Y,ZHANG Y,LIU C,et al.Metabolism,application in the food industry, and enrichment strategies of gamma-aminobutyric acid[J].Trends Food Sci Tech,2024,154:104773.
[33]王能凤,杨家荣,蒲云峰,等.红枣中γ-氨基丁酸的功能及检测方法的研究进展[J].农产品加工,2022(14):94-96,100.
[34]刘心仪,陈孟涵,李培实,等.植物乳杆菌体外发酵藜麦水不溶性膳食纤维对肠道菌群及产短链脂肪酸的影响[J].食品科学,2024,45(13):138-145.
[35]SUN Z, ZENG Z, CHEN L X, et al.Integrated anti-fatigue effects of polysaccharides and small molecules coexisting in water extracts of ginseng:gut microbiota-mediated mechanisms[J].J Ethnopharmacol,2024,337:118958.
[36]王平,LI C G,崔迪,等.急性递增负荷跑台运动对小鼠腓肠肌自噬和葡萄糖转运功能的影响[J].中国运动医学杂志,2021,40(1):19-28.
[37]叶懂焕.相同BMI肥胖与非肥胖男大学生低温环境下运动时底物代谢及相关生化指标变化特征研究[D].广州:广州体育学院,2024.
[38]孔凡秀,董佳萍,杨琪,等.人参饮料缓解免疫抑制小鼠运动性疲劳的研究[J].黑龙江八一农垦大学学报,2021,33(6):48-53,64.
[39]GHASEMNIAN A,IDDEHLOEI Z,RAHMANI A,et al.Effects of ginger along with exercise training on serum levels of ALT and AST liver enzymes and malondialdehyde and the activity of liver tissue superoxide dismutase in male Wistar rats[J].J Shahrekord Univ Med Sci,2020,22(2):67-73.
[40]关静涛,廖力坚,王丽娟.基于Nrf2信号通路的骨骼肌氧化应激作用探讨藏红花素对小鼠力竭运动疲劳的改善作用[J].中国食品添加剂,2023,34(6):66-77.
[41]TANG X,LIU C C,WANG B L,et al.Enhancing the anti-fatigue effect of ginsenoside extract by Bifidobacterium animalis subsp.lactis CCFM1274 fermentation through biotransformation of Rb1, Rb2 and Rc to Rd[J].Food Biosci,2024,62:105251.
[42]张振刚,王峰.有氧运动联合补充D-核糖对小鼠抗疲劳和抗氧化的作用[J].食品工业科技,2022,43(2):368-375.
[43]ANAND T,KUMAR G P,PANDAREESH M D,et al.Effect of bacoside extract from Bacopa monniera on physical fatigue induced by forced swimming[J].Phytother Res,2012,26(4):587-593.
[44]付梦凡,张纯,刘炳浩,等.多酚复合配方缓解小鼠运动疲劳[J].食品与机械,2023,39(12):145-152,161.