藠头(Allium chinense)在中国具有上千年的食用历史。成熟藠头个大肥厚、辛香软糯,富含多种维生素和矿物质,具有抗癌、抗肿瘤、抑制脂质代谢、改善高血脂的功效[1];发酵藠头兼具藠头与发酵蔬菜的优点,减少了生藠头的辛辣刺鼻气味还丰富了口感与发酵风味,具有脆嫩爽口、开胃解腻,保质期长的特点[2]。传统发酵藠头是高盐腌制或利用藠头本身带有的微生物自然发酵而成的,在加工成品前通常要经过脱盐处理,不仅浪费资源、污染环境,还增加工序以及人工成本[3-4],而自然发酵藠头不同批次的发酵风味与口感无法达到一致,发酵过程中的卫生状况及成品质量也不可控,发酵时间也较长[5]。
乳酸菌广泛存在于发酵食品中,它们不仅能改善食品感官性状还能大大提高食品营养价值、延长保质期。作为发酵蔬菜的主导菌群,乳酸菌不仅直接影响蔬菜风味,还具有提高人体免疫力、调节肠道微生态平衡、预防心脑血管疾病等保健功能[6]。低盐发酵蔬菜缺少高盐发酵的强渗透压作用,无法有效抑制有害微生物,因此在制作时可以人为添加乳酸菌来丰富口感、抑制其他污染物。多菌接种发酵相较于纯种发酵,可以产生更多代谢物丰富产品的风味,优势菌群的构建也能抑制有害微生物生长,弥补低盐发酵的不足,提高产品保藏性[7]。ZHAO N等[8]研究发现,植物乳植杆菌、布氏乳杆菌、耐乙醇片球菌在泡菜卤水中混合发酵可显著提升泡菜的鲜味、甜味、酸味等特征滋味。XIANG W L等[9]研究发现,食窦魏斯氏菌与植物乳植杆菌混合接种发酵四川豇豆,能显著增加挥发性风味物质并且泡豇豆的亚硝酸盐与生物胺含量均有所下降,从而整体改善产品的品质。目前已有将纯种乳酸菌剂投入藠头进行发酵的报道,如汤水平等[10]从盐渍藠头中分离纯化出9种菌株,并通过发酵各时期的主导菌相确定短乳杆菌、发酵乳杆菌能作为盐渍藠头发酵过程中人工接种的试验菌株。王雪骊等[11]将植物乳植杆菌接种至低盐藠头中进行发酵,发现乳酸菌纯种发酵能优化低盐发酵工艺且发酵好的藠头亚硝酸盐含量低于国标。但迄今为止,研究大多集中在单一菌株的发酵特性上,对于多株乳酸菌协同发酵以及专为藠头发酵的复合菌剂的研究相对较少。
为提升发酵藠头品质,本研究基于高通量测序(high throughput sequencing,HTS)平台,分析传统自然发酵藠头及其发酵液的细菌多样性和优势菌群,从产酸、产香、产氨基酸态氮三方面入手,筛选具有优良发酵特性的乳酸菌,建立多菌复合发酵体系,并考察筛选乳酸菌的抑菌效果,旨在研发发酵藠头专用的乳酸菌直投式发酵剂,为生产口感丰富、安全、健康的高品质发酵藠头提供菌种资源及研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
传统自然发酵藠头(JT)、传统发酵藠头液(JY):常德市津市台龙食品有限公司。
大肠杆菌(Escherichia coli):中国普通微生物菌种保藏管理中心;金黄色葡萄球菌(Staphylococcus aureus)、李斯特菌(Listeria monocytogenes)、志贺氏菌(Shigella castellani)、鼠伤寒沙门氏菌(Salmonella typhimurium):美国典型培养物保藏中心。
1.1.2 试剂
革兰氏染色试剂盒:广东环凯微生物科技有限公司;Soil DNA Kit D5635-02土壤基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国Omega公司;细菌DNA提取试剂盒:北京索莱宝科技有限公司;3%过氧化氢溶液:广东光华化学厂有限公司;Dream Taq Green聚合酶链式反应(polymerase chain reaction,PCR)Master Mix:赛默飞世尔科技有限公司;乙偶姻标准品(纯度>98%):上海阿拉丁生化科技股份有限公司;碳酸钙、氯化钠、氢氧化钠、肌酸、α-萘酚、正丙醇、酚酞、硝酸钠、氨基苯磺酸、冰醋酸(均为分析纯):国药集团化学试剂有限公司。 其他试剂均为国产分析纯。
1.1.3 培养基
MRS肉汤培养基、MRS琼脂培养基、LB肉汤培养基、LB固体培养基、产H2S培养基、V-P培养基、氨基酸脱羧酶培养基、葡萄糖产气培养基[12]:广东环凯微生物科技有限公司。
1.2 仪器与设备
SPL250生化培养箱:天津市莱玻特瑞仪器设备有限公司;2720 聚合酶链式反应(PCR)扩增仪:美国ABI公司;MiniPro300VPowerSupply电泳仪:美国MajorScience 公司;Tecan Spark多功能酶标仪:西安纵横仪器科技有限公司;Bante920pH酸度计:上海般特仪器制造有限公司;YP-B10002电子天平:上海光正医疗仪器有限公司;SW-2FD涡旋振荡器:上海医科大学科学仪器厂;UV-1801紫外/可见光分光光度计:北京北分瑞利分析仪器有限责任公司;Heraeus Multifuge X1R高速冷冻离心机:赛默飞世尔科技(中国)有限公司;DK-8D电热恒温水浴锅:北京市永光明医疗仪器厂;101-2AB电热鼓风干燥箱:天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 传统发酵藠头及其发酵液总DNA提取及纯化
采用Soil DNA Kit D5635-02试剂盒对样本DNA进行提取与纯化,使用0.8%琼脂糖凝胶电泳进行分子大小判断,之后使用酶标仪对DNA进行定量。
1.3.2 PCR扩增及高通量测序[13]
细菌通用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rRNA的V4区进行PCR扩增。PCR扩增体系:Mix预混液12.25 μL、引物338F和806R各1 μL、基因组DNA模板2 μL和双蒸水(ddH2O)8.75 μL。PCR扩增程序:98 ℃预变性5 min,1个循环;98 ℃变性30 s,退火52 ℃,30 s,72 ℃延伸45 s,循环25次,使扩增的DNA片段大量富集。 最后,在72 ℃保持5 min,使产物延伸完整,12 ℃保存。PCR产物于Microplate reader上进行定量,利用Illumina公司的TruSeq Nano DNA LT Library Prep Kit进行建库;最后将合格文库在Illlumina MiSeq(PE300双端测序)平台上进行高通量测序(HTS)。
1.3.3 菌株的分离与纯化
分别取1 g传统自然发酵藠头(JT)及其发酵液(JY)样品,用0.9%生理盐水做10倍梯度稀释,稀释10-6梯度,分别吸取不同梯度的稀释液100 μL均匀涂布在MRS平板上,于37 ℃培养箱中培养48 h[14]。挑出疑似乳酸菌的单个菌落,涂布于添加1.5%碳酸钙的MRS固体培养基,随后挑取具有溶钙圈的单菌落,在固体培养基中重复划线分离、纯化培养3次,得到纯化后的菌株,随后加入等体积甘油,于-80 ℃冰箱中保存[15]。
1.3.4 乳酸菌的筛选
(1)初筛
将已纯化并冻藏的菌株取出活化3代后,以2%(V/V)接种量接种于MRS培养基,用接种环取一环菌液于载玻片进行革兰氏染色,以金黄色葡萄球菌和大肠杆菌分别作为阳性、阴性对照,观察疑似乳酸菌的染色情况和菌体状态[16]。
挑取疑似乳酸菌的单菌落于载玻片上,滴加3%过氧化氢溶液,观察是否有气泡产生。有气泡为接触酶阳性,反之则为接触酶阴性。
硝酸盐还原试验:将活化菌株以2%(V/V)接种量接种至硝酸钠培养基中,不接菌培养基为空白对照,37 ℃培养72 h。取2 mL培养液于洁净试管中,滴加1~2滴格里斯氏试剂A液和B液,若出现红色则为阳性,若未出现红色则再添加少许锌粉观察,如果还是没有红色,即为阴性[17]。
葡萄糖产气试验:将活化菌株以2%(V/V)接种量接种至葡萄糖产气液体培养基,培养基里放入杜氏小管,若倒放小管中有气泡为阳性,无气泡则为阴性[18]。
(2)复筛
将待测菌株活化后接种于MRS培养基,37 ℃培养24 h。借鉴郑琦锴等[19-20]的方法,测定发酵液中的总酸含量(以乳酸计)。
参照杨剑[21]的方法,先采用感官嗅闻筛选出乳酸香气相对浓烈的乳酸菌,再根据肌酸比色法[22]测定培养液中乙偶姻含量。
参考许惠雅等[23]的方法并略作修改。测定培养24 h后乳酸菌发酵上清液的氨基酸态氮含量,以未接菌MRS培养基为空白对照,选取产氨基酸态氮含量>0.20 g/100 mL的菌株。
1.3.5 氨基酸脱羧酶活性试验
发酵蔬菜中的生物胺(组胺、腐胺、精胺等)是影响其安全性的重要指标,主要由具有氨基酸脱羧作用的微生物分泌而来,对乳酸菌进行氨基酸脱羧酶活性试验是有效评估乳酸菌是否具有产生有害胺类化合物的重要方法。
将所筛产酸、产香、产氨基酸态氮能力强的3株菌分别活化三代后,取100 μL菌液于含有0.6 g/L溴甲酚紫的MRS液体培养基,并分别添加1%已过滤灭菌的L-酪氨酸、L-精氨酸、L-组氨酸,未加菌液的作空白对照,37 ℃培养3~7 d。培养液颜色由黄色变成紫色,即为氨基酸脱羧酶阳性菌株[24]。
1.3.6 16S rDNA遗传学鉴定
根据试剂盒说明书对细菌DNA进行提取,以提取DNA基因组为PCR扩增模板,采用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3') 和1492R(5'-GGTTACCTTGTTACGACTT-3')进行PCR扩增,得到菌株的16S rDNA序列片段。PCR扩增体系:Mix预混液25 μL、引物27F和1492R各2 μL、基因组DNA模板1 μL和双蒸水(ddH2O)20 μL。PCR扩增程序:98 ℃预变性2 min;98 ℃变性10 s、57 ℃退火10 s、72 ℃延伸30 s,30个循环;72 ℃再延伸5 min[25],测序结果提交美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)GenBank数据库,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,并在MEGA X10.1.8软件中邻接(neighbor-joining,NJ)法构建系统发育树,进一步确定菌株的分类学地位。
1.3.7 乳酸菌菌株共生拮抗性分析
拮抗性:将活化后的3株乳酸菌菌株调整至同一浓度,采用琼脂扩散牛津杯法进行拮抗性分析[26]。培养后通过观察菌落稀疏性及有无抑菌圈判断是否有拮抗性,如果越靠近牛津杯附近菌落越稀疏或有抑菌圈则判定为具有拮抗性,反之则无拮抗性。
共生性:将活化后的3株乳酸菌菌株调整至同一浓度。混合培养时,将各菌株分别两菌混合、三菌混合,以相同比例接种,总接种量为2%(V/V),在MRS培养基中加入2%体积的生理盐水作为对照,37 ℃恒温静置培养24 h。OD600nm值高于空白对照组且有显著差异的为有促进作用,能够共生;低于空白对照组且有无显著差异的则为无促进作用,不能够共生[27]。
1.3.8 抑菌试验
采用牛津杯打孔法测定乳酸菌对金黄色葡萄球菌ATCC 6538、大肠杆菌CGMCC 9181、沙门氏菌ATCC 14028、志贺氏菌、李斯特菌等食源性致病菌的抑菌能力[28]。使用平板计数将指示菌终浓度调整为1.0×106 CFU/mL左右,向培养皿中倒入1.5%琼脂10 mL,凝固后再将指示菌菌悬液以1%接种量与灭菌并冷却到50 ℃左右的LB琼脂培养基混合后倒平板,待其凝固,将200 μL待测菌株上清液加入至牛津杯孔中。 于4 ℃环境中扩散2 h后,放于37 ℃恒温培养24 h。 采用十字交叉法及游标卡尺测定抑菌圈直径。 根据抑菌圈直径大小判断待测菌株抑菌性能。 抑菌的判定依据为抑菌圈直径>7 mm时,即认定为有抑菌作用。
1.3.9 生长曲线及产酸能力的测定
将待测菌株活化后接种于MRS液体培养基,37 ℃恒温培养24 h,每2 h测定OD600nm值及pH值。
1.3.10 乳酸菌复合菌系的构建及接种比例的确定
将戊糖乳杆菌D1、植物乳植杆菌D1-9、戊糖片球菌D2-3活化后分别接种于MRS液体培养基,进行扩大培养。 将发酵液在8 000 r/min的条件下离心10 min,去掉上清液,将菌泥用生理盐水清洗3次后,用生理盐水将三株菌的菌悬液浓度统一调整到1.0×108 CFU/mL,即为后续接种至藠头中的种子液。将菌株D1、D1-9、D2-3的种子液以1∶0∶0、0∶1∶0、0∶0∶1、1∶1∶1、1∶1∶2、1∶2∶1、2∶1∶1、1∶2∶2、2∶2∶1、2∶1∶2的比例进行混合。 藠头去掉老叶、根须,洗净后沥干水分,称1 kg放入坛内,将食盐、不同比例的混合菌种子液分别以藠头和凉开水总质量的4%、1%加入凉开水(凉开水与藠头等质量)中溶解,然后将水倒入坛中,淹没藠头。 将坛盖盖上,坛沿周围放水密封,室温放置30 d,测定不同比例混合乳酸菌发酵藠头的总酸含量、氨基酸态氮含量、乙偶姻含量并进行感官评价。感官评价标准见表1。
表1 发酵藠头的感官评价标准
Table 1 Sensory evaluation standards of fermented Allium chinense

指标 评分依据 分数/分色泽(20分)脆度(20分)滋味(30分)乳白色、有光泽乳白色略带黄色、光泽稍淡淡黄、光泽暗黄色脆度好、断裂清脆有声脆度较好、断裂有声脆度还好、断裂声减弱脆度不好、断裂无声酸爽可口、回味无穷酸味适口、咸味适宜酸甜一般、偏咸咸酸味太重、偏苦16~20 11~15 6~10 0~5 16~20 11~15 6~10 0~5 24~30 16~23 8~15 0~7
续表

指标 评分依据 分数/分香气(30分)香味浓郁、柔和,具乳酸发酵芳香味有明显香味、较柔和淡雅香气、无异味无香气、有异味24~30 16~23 8~15 0~7
1.3.11 数据统计分析
数据用“平均值±标准差”表示,使用IBM SPSS 16.0、Origin 8.0、Graph Pad 9.0等软件进行数据分析和图形绘制,使用QIIME2.0软件、R软件进行细菌群落组成及多样性分析,MEGA-X10.1.8软件构建系统发育树。
2 结果与分析
2.1 传统发酵藠头及其发酵液微生物群落多样性分析
2.1.1 Alpha多样性指数分析
Alpha多样性是解释物种丰富度、均匀度以及多样性的综合指标,其中的Chao1和Observed species指数象征物种丰富度,Shannon和Simpson指数表征细菌群落的物种多样性,两者值越高代表样本的物种多样性越高[29]。传统发酵藠头及其发酵液微生物群落多样性分析结果见表2。 由表2可知,传统发酵藠头及其发酵液两样本的Observed指数均为0.999,表明采样充分,几乎所有可能的物种都已被检测到,样本的物种丰富度很高,JT组的Chao1指数略低于JY组,说明传统发酵藠头的物种丰富度略低于藠头发酵液;JY组的Shannon指数高于JT组,说明藠头发酵液的物种多样性更高;JY组的Simpson指数为0.942,表明发酵液的物种均匀性好,JT组的Simpson指数为0.893,进一步表明相比发酵液,发酵藠头的细菌群落多样性更高。
表2 传统发酵藠头及藠头发酵液样品中微生物菌群Alpha多样性分析
Table 2 Analysis on Alpha diversity of microbial flora in traditional fermented Allium chinense and fermentation broth samples
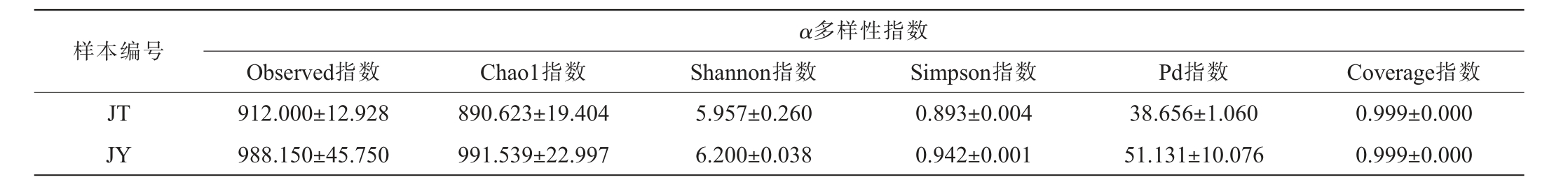
样本编号α多样性指数Observed指数 Chao1指数 Shannon指数 Simpson指数 Pd指数 Coverage指数JT JY 912.000±12.928 988.150±45.750 890.623±19.404 991.539±22.997 5.957±0.260 6.200±0.038 0.893±0.004 0.942±0.001 38.656±1.060 51.131±10.076 0.999±0.000 0.999±0.000
2.1.2 门水平及属水平上细菌物种组成及丰度
传统发酵藠头及其发酵液样品门水平及属水平上细菌物种组成及丰度见图1。对97%相似水平的操作分类单元(operational taxonomic unit,OTU)代表序列进行分类学统计,在传统发酵藠头样品中总共检测到20个门、41个纲、98个目、181个科、323个属、187个种,其中乳酸菌菌种67个;在藠头发酵液样品中共检测到25个门、49个纲、107个目、190个科、329个属、204个种,其中乳酸菌菌种75个。
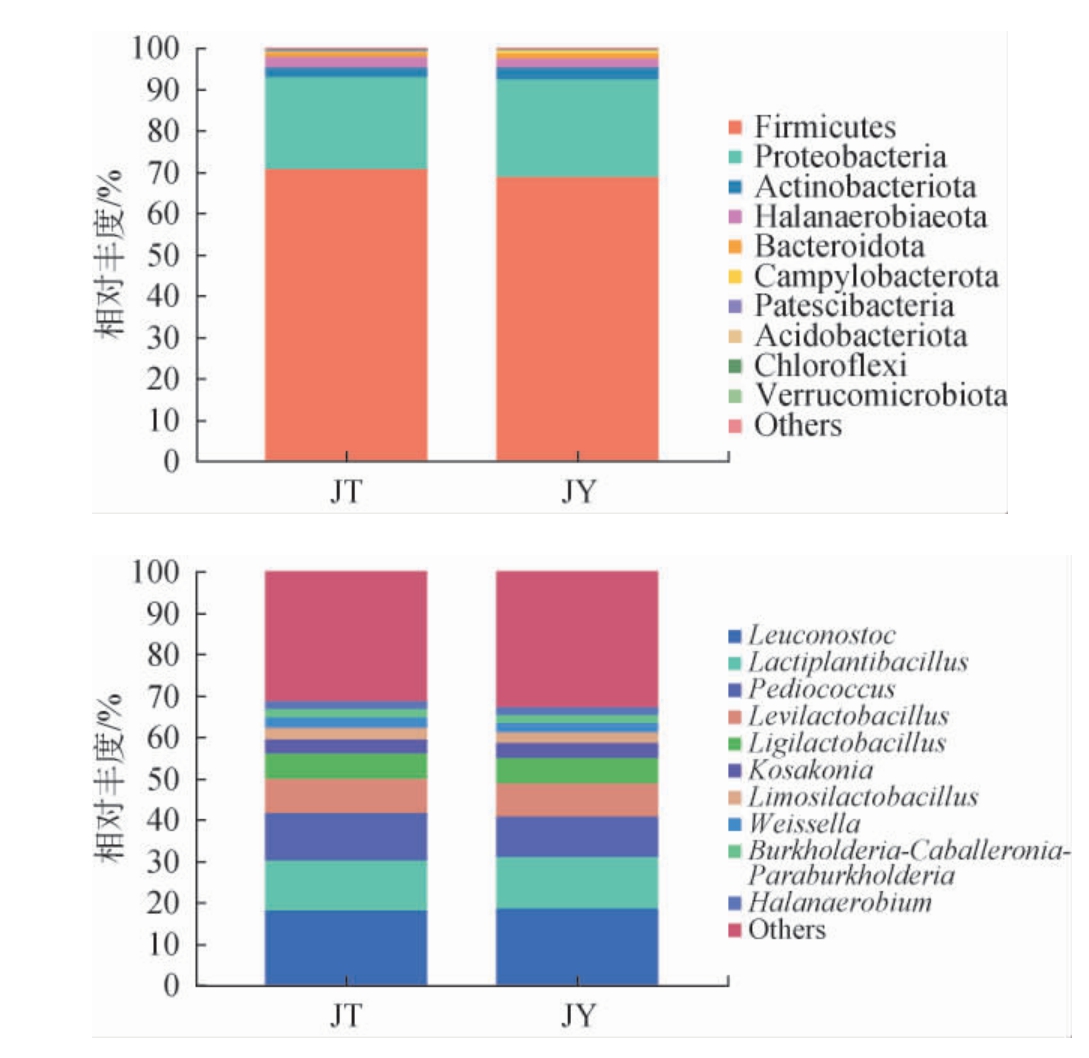
图1 传统发酵藠头及其发酵液样品在门(A)及属(B)水平上的细菌菌群相对丰度
Fig.1 Relative abundance of bacterial flora at phylum (A) and genus(B) levels from traditional fermented Allium chinense and fermentation broth samples
由图1a可知,厚壁菌门(Firmicutes)为传统发酵藠头及其发酵液的绝对优势菌,丰度分别为70.67%、68.71%,其次是变形菌门(Proteobacteria)(22.15%、23.80%)、放线菌门(Actinobacteriota)(2.52%、2.75%)、盐厌氧菌门(Halanaerobiaeota)(2.40%、2.13%)以及拟杆菌门(Bacteroidota)(1.17%、1.10%);由图1b可知,明串珠菌属(Leuconostoc)为传统发酵藠头及其发酵液的第一优势菌属,物种丰度分别达到31.76%、32.89%,其次是乳植杆菌属(Lactiplantibacillus)(12.16%、12.42%)和片球菌属(Pediococcus)(11.36%、9.90%),其他的乳酸菌属还有轻乳杆菌属(Levilactobacillus)、近乳杆菌属(Ligilactobacillus)、黏乳杆菌属(Limosilactobacillus)和魏斯氏菌属(Weissella),其余均为物种丰度在10%以下的非乳酸菌属,包括高沙克菌属(Kosakonia)(3.37%、3.68%)、伯克氏菌属(Burkholderia)、盐厌氧菌属(Halanaerobium)和其他属。 葛东颖等[30]检测湖北来凤地区的盐渍藠头液,发现其优势菌属为乳杆菌属(Lactobacillus)和假单胞菌属(Pseudomonas);杨振光等[31]研究发现,云南泡藠头中乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、乳球菌属(Lactococcus)为明显的优势菌属。由此可见,不同地域、不同制作工艺藠头的乳酸菌类群虽有差异,但乳杆菌属、明串珠菌属等乳酸菌都不同程度地存在于其中,这也与本研究结果相符。
2.2 菌株初筛结果
从传统发酵藠头及其发酵液样品中共分离出31株形态不同的菌株。参考《常见细菌系统鉴定手册》[32]与《伯杰细菌鉴定手册》[33],部分菌株菌落及细胞形态见图2,筛选菌株的生理生化结果见表3。
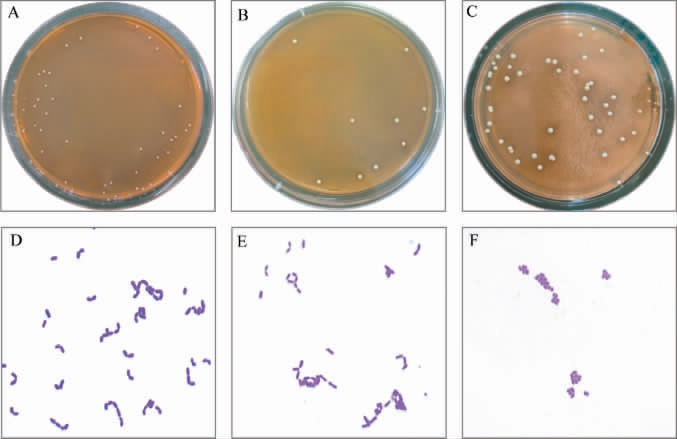
图2 菌株D1、D1-9、D2-3的菌落(A,B,C)及细胞(D,E,F)形态
Fig.2 Colony (A, B, C) and cell (D, E, F) morphology of strains D1,D1-9 and D2-3
表3 发酵藠头及其发酵液样品中筛选菌株生理生化试验结果
Table 3 Physiological and biochemical experiments results of screened strains from fermented Allium chinense and fermentation broth samples

项目 菌株数量/株 结果 菌株数量/株革兰氏染色阳性过氧化氢酶阴性硝酸盐还原阴性葡萄糖不产气28 28 28 25 24 h后pH值<5吲哚阴性不产H2S明胶液化阴性28 28 28 25
由图2可知,3株具有代表性的菌株均为革兰氏阳性菌,菌株D1的菌落较小且表面光滑凸起,边缘整齐,菌落颜色为乳白色,镜检呈短杆状、细胞以短链形式排列;菌株D1-9菌落中等大小、表面光滑轻微凸起,边缘整齐,菌落颜色为乳白色,镜检呈短杆状、细胞成对聚集;菌株D2-3菌落中等大小且表面光滑凸起,边缘略不整齐,菌落颜色为乳白色不透明,镜检呈四联球状、细胞聚集呈现团簇。
由表3可知,所得的31株菌有28株革兰氏染色阳性、过氧化氢接触酶阴性、硝酸盐还原阴性,吲哚阴性,且培养24 h后pH值均下降至5.0以下;有25株产气且明胶液化阴性。因此,初步确定25株为乳酸菌属(编号分别为D1、D2、D1-1~D1-10、D2-2~D2-14)。
2.3 菌株复筛结果
2.3.1 菌株产酸能力
乳酸菌菌群通常在传统发酵泡菜的中后期占据优势,成为起主要作用的微生物。直投式接种发酵能让乳酸菌群在初期就作为优势菌进行发酵,从而快速降低发酵环境的pH值,抑制腐败菌的生长[34]。
从发酵藠头及其发酵液中分离纯化的25株菌株,在MRS液体培养基培养24 h后的产总酸含量测定结果见图3。由图3可知,菌株产酸能力由强到弱依次为:菌株D1-9>菌株D1>菌株D2-14>菌株D2-5>菌株D1-1,发酵24 h乳酸的含量达到17.00 g/L以上,其中菌株D1-9产酸量最高,达到18.60 g/L,故选择菌株D1-9作为高产酸菌用于后续试验。
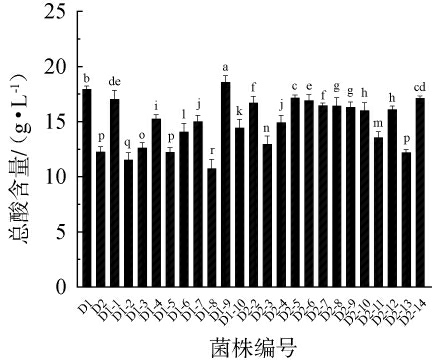
图3 筛选乳酸菌菌株的产酸性能
Fig.3 Acid production capacity of screened lactic acid bacteria strains
不同小写字母表示差异显著(P<0.05)。下同。
2.3.2 菌株产香能力
某些微生物如乳酸菌、酵母菌、醋酸菌、芽孢杆菌等,在发酵过程中可以产生天然的乙偶姻,具有十分浓郁的奶酪香和酯香,它能与主要由氨基酸转化而来的氨发生非酶促反应生成四甲基吡嗪,从而提高发酵产品香气及风味[35]。
从25株菌中去除不产乙偶姻的菌株,剩余18株菌的乙偶姻产量测定结果见图4。 由图4可知,乙偶姻产量超过40mg/L的乳酸菌有3株,其中菌株D2-3乙偶姻产量达到47.16 mg/L、菌株D1-9达到42.08 mg/L、菌株D1-1达到40.83 mg/L。有研究表明,戊糖片球菌拥有的假过氧化氢酶系统能够在有氧条件下将丙酮酸转化为乳酸、乙酸、乙偶姻、CO2等物质[36]。因此,选择菌株D2-3作为产香菌用于后续试验。
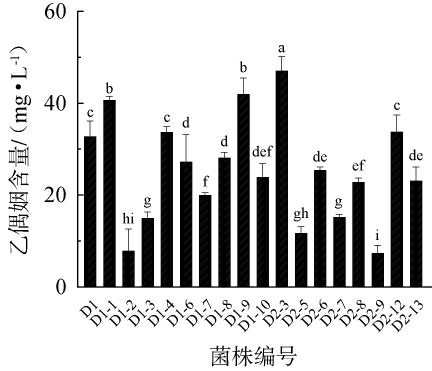
图4 筛选乳酸菌菌株的产香性能
Fig.4 Acetoin production capacity of screened lactic acid bacteria strains
2.3.3 菌株产氨基酸态氮能力
氨基酸态氮含量反映了发酵过程中蛋白质水解成氨基酸的程度。 氨基酸态氮含量越高,产品鲜味越足,风味越足,并且大分子蛋白质降解为小分子氨基酸和多肽有利于提高消化吸收率,可在一定程度上提高人体对蛋白质的消化吸收[37]。
20株可产鲜菌株在MRS液体培养基中培养24 h后的产氨基酸态氮总量见图5。 由图5可知,产氨基酸态氮含量>0.20 g/100 mL的有菌株D1、D2、D1-3、D1-10、D2-3。接种菌株D1培养24 h后其产氨基酸态氮总量达到0.32 g/100 mL,说明菌株D1有较强的将大分子蛋白质转化成小分子氨基酸的能力,可以有效提高发酵食品的鲜味。 因此,选择菌株D1进行后续试验。
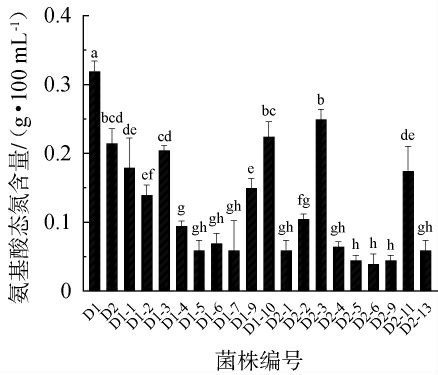
图5 筛选乳酸菌的产氨基酸态氮性能
Fig.5 Amino acid nitrogen production capacity of screened lactic acid bacteria strains
2.4 氨基酸脱羧酶活性试验
发酵蔬菜中的生物胺主要由具有氨基酸脱羧作用的微生物分泌而来,如果生物胺含量超过一定量会引起人体中毒现象[38]。 因此,确保用于藠头发酵的乳酸菌不产生物胺对提高终产品安全性具有重要意义。 3株乳酸菌(菌株D1、D1-9、D2-3) 的氨基酸脱羧酶试验结果表明,3株乳酸菌试验结果均为阴性,即不产生生物胺,可用于后续的藠头发酵。
2.5 16S rDNA遗传学鉴定
基于16S rDNA基因序列在NCBI数据库中进行比对并构建3株优良乳酸菌的系统发育树,结果见图6。
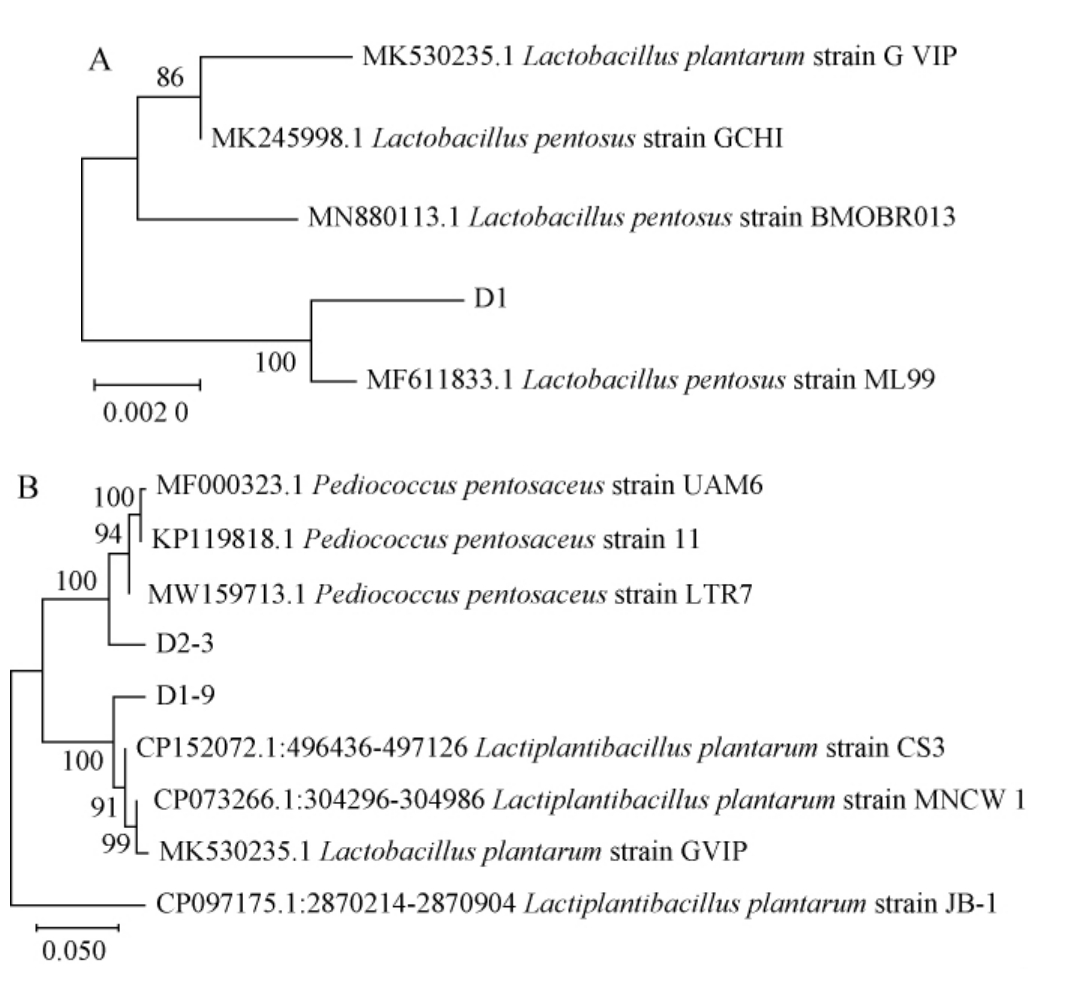
图6 基于16S rDNA基因序列菌株D1(A)及菌株D1-9,D2-3(B)的系统发育树
Fig.6 Phylogenetic tree of strain D1 (A) and strains D1-9, D2-3 (B)based on 16S rDNA gene sequences
由图6A可知,菌株D1与戊糖乳杆菌(Lactobacillus pentosus)在同一分支,置信度为100%。因此,菌株D1被鉴定为戊糖乳杆菌(Lactobacillus pentosus)。由图6B可知,菌株D1-9与植物乳植杆菌(Lactiplantibacillus plantarum)聚于一支,亲缘关系最近,置信度为100%。 因此,菌株D1-9被鉴定为植物乳植杆菌(Lactiplantibacillus plantarum)。菌株D2-3与戊糖片球菌(Pediococcus pentosaceus)在同一分支上,亲缘关系最近,置信度为100%。因此,菌株D2-3被鉴定为戊糖片球菌(Pediococcus pentosaceus)。 本次筛选鉴定出的菌株也与范茹茹[39]从藠头中所筛乳酸菌菌株基本一致。
2.6 乳酸菌拮抗性与共生分析
乳酸菌菌株是否能进行复配直接影响到后续混合菌株的抑菌能力和发酵特性,因此考察混合菌株两两之间的拮抗性十分必要。将活化后的3株乳酸菌菌株调整至同一浓度,使3株菌依次作为指示菌,指示菌菌悬液以1%接种量与琼脂培养基混合后倒平板,其余两株菌分别作为待测菌,取发酵液200 μL加入牛津杯孔中,培养后通过观察有无抑菌圈判断是否有拮抗性。结果发现,无论以哪株菌为指示菌,牛津杯孔附近均无抑菌圈出现,说明3株乳酸菌菌株之间不存在拮抗反应,适宜进行复配。
将3株乳酸菌菌株活化后调整至同一浓度,以三株菌单独培养作为对照(CK),将3株菌按相同比例接种混合培养,测定各组合培养24 h后的OD600 nm值。菌株共生性结果见表4。由表4可知,戊糖乳杆菌D1与戊糖片球菌D2-3混合(1∶1)培养、植物乳植杆菌D1-9与戊糖片球菌D2-3混合(1∶1)培养均能极显著促进戊糖片球菌D2-3的生长(P<0.01);戊糖乳杆菌D1与植物乳植杆菌D1-9混合(1∶1)培养的OD600 nm值相较于单独培养的有显著提升(P<0.05),3株菌混合培养(1∶1∶1)与单独培养对比也有显著的促进生长作用(P<0.05)。因此,可以确定3株乳酸菌菌株间存在互利共生关系,适宜作为复配菌株,构建多菌共生体系。
表4 乳酸菌菌株之间共生结果
Table 4 Result of symbiosis between lactic acid bacteria strains

注:“*”、“**”分别表示与菌株单独培养相比差异显著(P<0.05)、极显著(P<0.01)。
菌株编号 OD600 nm值 混菌配比 OD600 nm值D1 D1-9 D2-3 1.901±0.02 1.969±0.01 1.780±0.03 D1+D1-9(1∶1)D1+D2-3(1∶1)D1-9+D2-3(1∶1)D1+D1-9+D2-3(1∶1∶1)1.979±0.03*1.865±0.02**1.944±0.01**1.939±0.03*
2.7 乳酸菌抑菌试验
乳酸菌的代谢产物一般含有有机酸、细菌素、过氧化氢等抑菌物质,这些抑菌活性物质对食源性致病菌均具有不同程度的抑菌效果[40]。
戊糖乳杆菌D1、植物乳植杆菌D1-9、戊糖片球菌D2-3单菌株及D1、D1-9、D2-3以1∶1∶1比例混合对食源性致病菌的抑菌效果见表5。 由表5可知,3株菌对金黄色葡萄球菌、大肠杆菌、沙门氏菌、志贺氏菌及李斯特菌的抑菌效果均较好,且菌株D1、D1-9、D2-3以1∶1∶1比例混合培养后的抑菌效果相比单菌更为显著(P<0.05)。由此可见,将3株菌混合培养,可以显著抑制食源性致病菌的活性,如将其应用到蔬菜中进行发酵,可以提升产品的贮藏品质,延长保质期。
表5 乳酸菌菌株对指示菌的抑菌效果
Table 5 Antibacterial effect of lactic acid bacteria strains to indicator bacteria
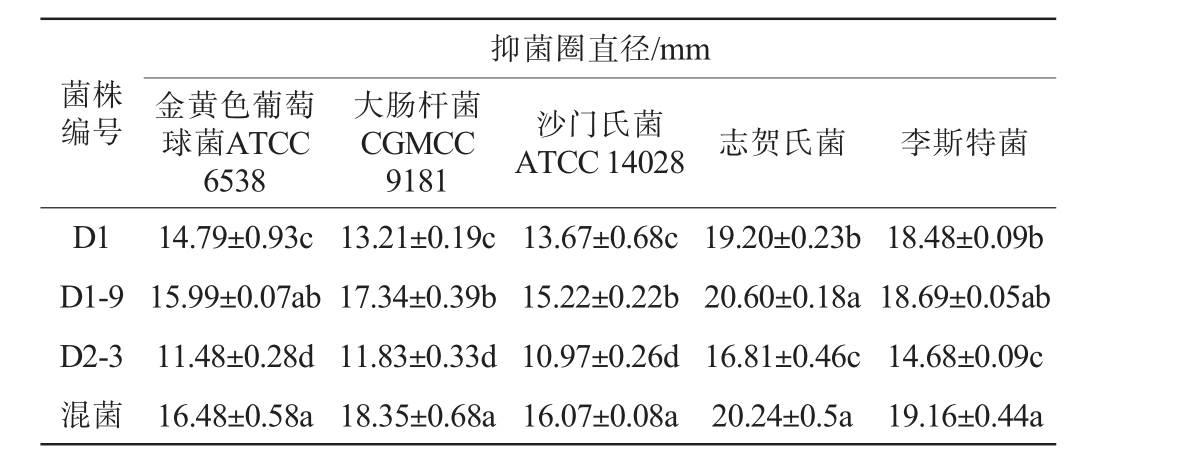
注:不同字母表示不同乳酸菌菌株对同一指示菌的抑菌效果差异显著
(P<0.05)。
抑菌圈直径/mm菌株编号 金黄色葡萄球菌ATCC 6538大肠杆菌CGMCC 9181沙门氏菌ATCC 14028 志贺氏菌 李斯特菌D1 D1-9 D2-3混菌14.79±0.93c 15.99±0.07ab 11.48±0.28d 16.48±0.58a 13.21±0.19c 17.34±0.39b 11.83±0.33d 18.35±0.68a 13.67±0.68c 15.22±0.22b 10.97±0.26d 16.07±0.08a 19.20±0.23b 20.60±0.18a 16.81±0.46c 20.24±0.5a 18.48±0.09b 18.69±0.05ab 14.68±0.09c 19.16±0.44a
2.8 乳酸菌生长曲线及产酸能力
通过乳酸菌生长曲线、产酸曲线可了解乳酸菌的生长周期及产酸速度的快慢,推断乳酸菌用于藠头发酵时发酵周期的长短,它们是评价菌种发酵活力的重要指标[41]。3株菌在37 ℃培养24 h的过程中生长情况及产酸变化见图7。
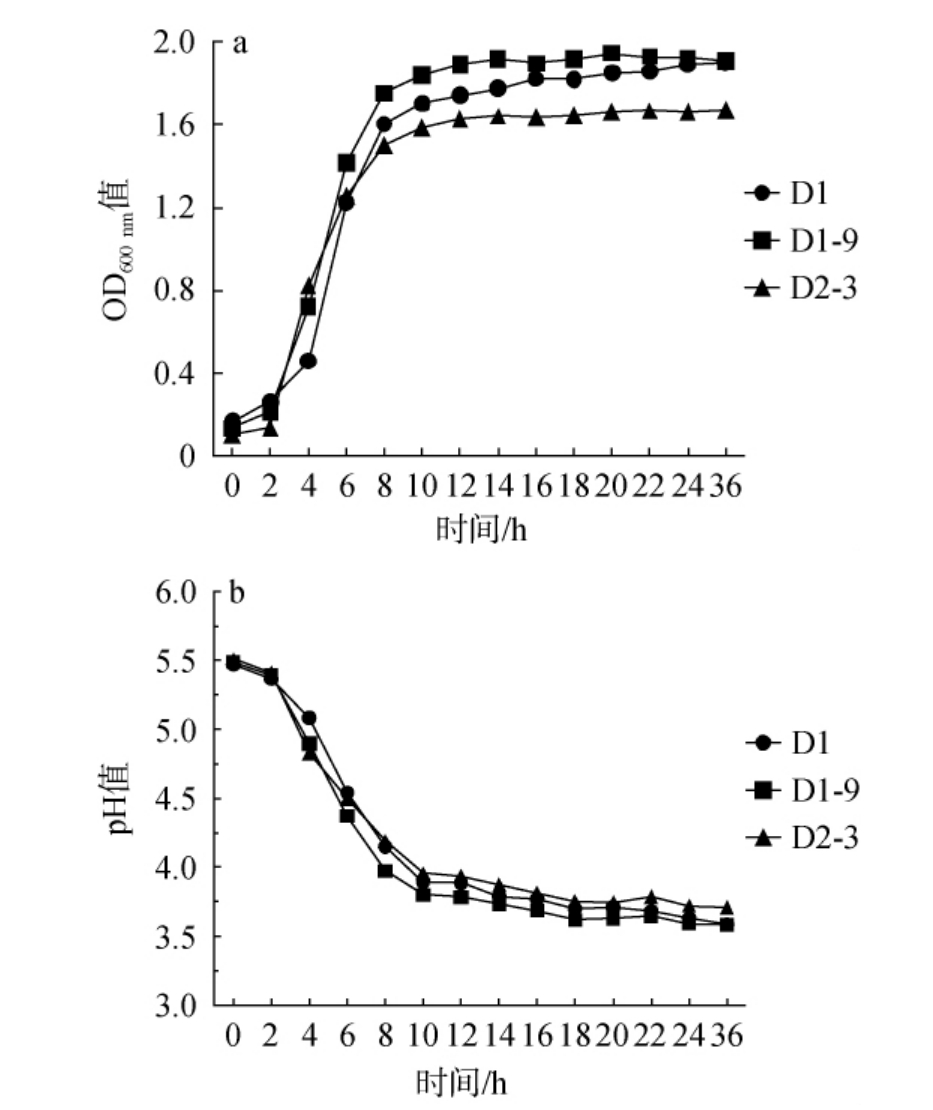
图7 筛选乳酸菌菌株生长曲线(a)及产酸曲线(b)
Fig.7 Growth curves (a) and acid production curves (b) of screened lactic acid bacteria strains
由图7a可知,戊糖乳杆菌D1在0~4 h处于生长迟缓期,随后的4~14 h为对数生长期,在此期间菌株生长迅速、大量繁殖,14 h后菌株进入稳定期,OD600 nm值最高达到1.823;植物乳植杆菌D1-9在前0~2 h为生长迟缓期,随后的2~14 h为对数生长期,之后生长基本稳定,进入稳定期,在此期间OD600 nm值达到最高值1.916;戊糖片球菌D2-3在2~12 h为对数生长期,12~24 h为生长稳定期,OD600 nm值最高为1.687。3株菌在MRS培养基中的生长曲线趋势基本一致,进入稳定期的时间相差不大,3株菌的OD600 nm值均>1.6,说明3株菌的生长习性相近且都有较好的生长活力。
在同一培养条件下,发酵液的pH值越低说明菌株产乳酸越多,产酸能力越强。 由图7b可知,3株乳酸菌产酸趋势大体一致,0~2 h期间,乳酸菌菌株需要适应环境,此时的产乳酸量较低,3株菌的pH值都是从5.5左右降低至5.4左右;2~12 h时,随着3株菌进入对数生长期快速增殖,乳酸的产量也迅速增加,这一阶段的产酸曲线呈指数增长;12~24 h时,3株菌已达到最大生长密度,乳酸的产量增长速度开始减缓,曲线趋于平缓,在此期间,戊糖乳杆菌D1、植物乳植杆菌D1-9、戊糖片球菌D2-3达到最低pH值,分别为3.6、3.6、3.7。
2.9 乳酸菌复合菌系的构建及接种比例的确定
乳酸菌复配比例不同,产生的发酵效果也会截然不同。陈偲等[42]筛选到具有互促关系的乳酸菌和酵母菌组合,发现酿酒酵母Y21与植物乳植杆菌J05在共培养比例为30∶1和40∶1时,泡菜的pH值更低,总酸含量更高,亚硝酸盐含量更低,适宜的复配比例对泡菜的品质和安全性有显著正效应。 由此可见,乳酸菌的复配比例是影响发酵产品质量的关键因素之一,合理的复配可以优化产品的风味、营养价值和安全性[43]。
3株菌不同复配比例对发酵藠头理化指标的影响结果见表6。
表6 菌株D1、D1-9、D2-3不同复配比例对藠头发酵的影响
Table 6 Effect of different ratios of strains D1, D1-9 and D2-3 on Allium chinense fermentation
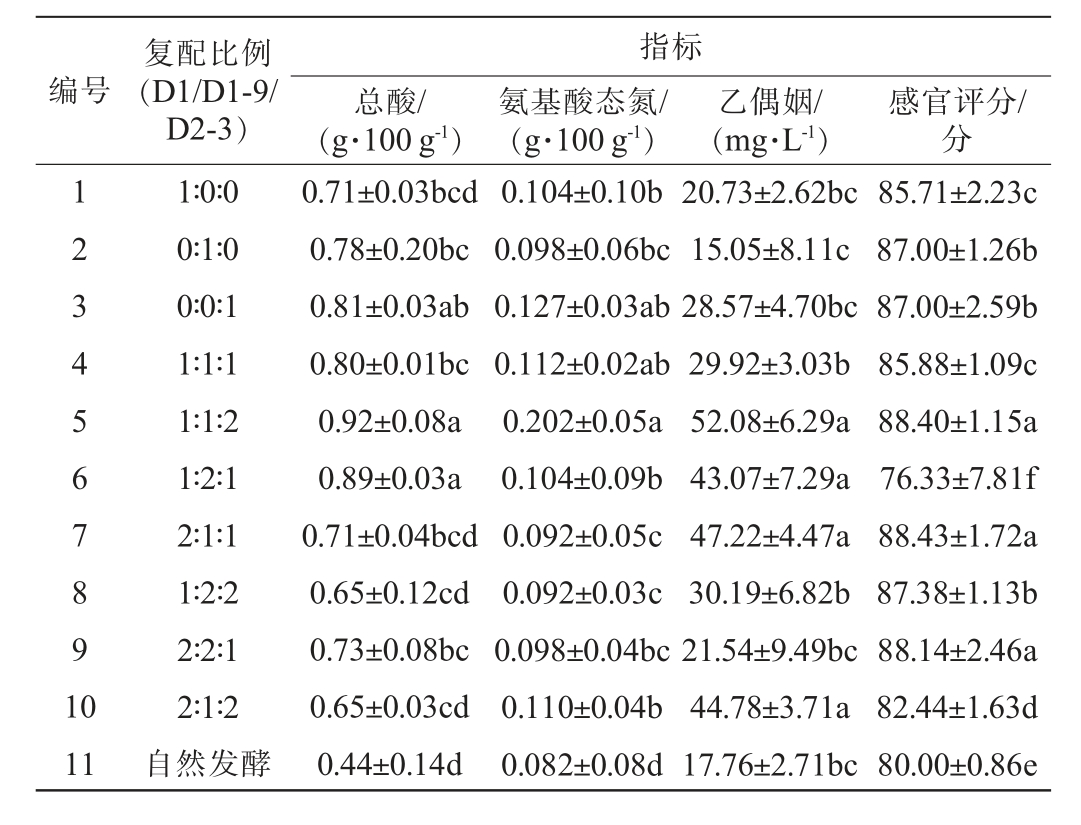
编号复配比例(D1/D1-9/D2-3)指标总酸/(g·100 g-1)氨基酸态氮/(g·100 g-1)乙偶姻/(mg·L-1)感官评分/分123 4567891 0 11 1∶0∶0 0∶1∶0 0∶0∶1 1∶1∶1 1∶1∶2 1∶2∶1 2∶1∶1 1∶2∶2 2∶2∶1 2∶1∶2自然发酵0.71±0.03bcd 0.78±0.20bc 0.81±0.03ab 0.80±0.01bc 0.92±0.08a 0.89±0.03a 0.71±0.04bcd 0.65±0.12cd 0.73±0.08bc 0.65±0.03cd 0.44±0.14d 0.104±0.10b 0.098±0.06bc 0.127±0.03ab 0.112±0.02ab 0.202±0.05a 0.104±0.09b 0.092±0.05c 0.092±0.03c 0.098±0.04bc 0.110±0.04b 0.082±0.08d 20.73±2.62bc 15.05±8.11c 28.57±4.70bc 29.92±3.03b 52.08±6.29a 43.07±7.29a 47.22±4.47a 30.19±6.82b 21.54±9.49bc 44.78±3.71a 17.76±2.71bc 85.71±2.23c 87.00±1.26b 87.00±2.59b 85.88±1.09c 88.40±1.15a 76.33±7.81f 88.43±1.72a 87.38±1.13b 88.14±2.46a 82.44±1.63d 80.00±0.86e
由表6可知,复合菌株发酵藠头的总酸含量、氨基酸态氮含量、乙偶姻含量、感官评分基本均比单一菌株发酵藠头、自然发酵藠头的高,这说明复合菌株接种藠头发酵具有显著优势及可行性。将菌株D1、D1-9、D2-3按照复配比例1∶1∶2接种藠头进行发酵时,得到的发酵藠头品质最佳,具有特殊发酵香气,色泽乳白脆嫩爽口,感官评分为88.40分,总酸含量为0.92 g/100 g、氨基酸态氮含量为0.202 g/100 g、乙偶姻含量为52.08 mg/L。因此,综选择菌株D1、D1-9、D2-3复配比例为1∶1∶2接种藠头进行发酵。
3 结论
本研究以传统发酵藠头及其发酵液为研究对象,微生物群落多样性分析发现厚壁菌门(Firmutes)为两者的绝对优势菌门,相对丰度分别为70.67%和68.71%,其次是变形菌门(Proteobacteria)(22.15%、23.80%)、放线菌门(Actinobacteriota)(2.52%、2.75%),明串珠菌属(Leuconostoc)、乳植杆菌属(Lactiplantibacillus)和片球菌属(Pediococcus)为主要优势菌属,相对丰度分别为31.76%和32.89%、12.16%和12.42%、11.36%和9.90%,相对丰度在10%以下的非乳酸菌属包括高沙克菌属(Kosakonia)、伯克氏菌属(Burkholderia)、盐厌氧菌属(Halanaerobium)等;通过初筛和复筛,获得1株产酸能力强的菌株D1-9、1株产香能力强的菌株D2-3以及1株产氨基酸态氮能力强的菌株D1。 菌株D1-9、D2-3及D1分别被鉴定为植物乳植杆菌(Lactiplantibacillus plantarum)、戊糖片球菌(Pediococcus pentosaceus)和戊糖乳杆菌(Lactobacillus pentosus),其培养24 h后总酸、乙偶姻、氨基酸态氮含量分别为18.60 g/L、47.16 mg/L、0.32 g/100 mL。3株菌共培养时无拮抗作用能互利共生,并且对金黄色葡萄球菌、大肠杆菌、沙门氏菌等食源性致病菌均具有显著的抑菌效果;将菌株D1、D1-9、D2-3以1∶1∶2的复配比例发酵藠头时,发酵藠头的整体品质为最佳,总酸含量为0.92 g/100 g、氨基酸态氮含量为0.202 g/100 g、乙偶姻含量为52.08 mg/L,感官评分为88.40分。结果表明,所筛选的3株菌复配使用提高了发酵藠头品质,可为发酵藠头工艺改良和品质提升提供参考依据,可为发酵蔬菜的优质菌种资源开发提供技术支撑。
[1]敖礼林,鄢用亮,邹春平.特色蔬菜——藠头的丰产优质栽培技术[J].科学种养,2020,11(11):56-58.
[2]沈阳药科大学.中药薤白改善高血脂症组成物:CN1237432A[P].1999-12-08.
[3]刘源源.花菜叶低盐腌制及其调味酱的研制[D].长沙:湖南农业大学,2022.
[4]付咪.腌制蔬菜的脱盐过程、腐败菌菌相分析及基于ε-聚赖氨酸的防腐研究[D].杭州:浙江工商大学,2019.
[5]葛东颖,仇港,赵楠,等.盐渍藠头盐水细菌多样性及基因功能预测分析[J].中国酿造,2020,39(10):157-161.
[6] 朱孔亮.泡菜用乳酸菌的筛选、高密度培养及菌剂配方的研究[D].无锡:江南大学,2014.
[7]赵德安.纯种发酵、混合发酵与传统发酵食品[J].中国酿造,2010,29(9):15-17.
[8]ZHAO N,ZHANG C C,YANG Q,et al.Selection of taste markers related to lactic acid bacteria microflora metabolism for Chinese traditional Paocai:A gas chromatography-mass spectrometry-based metabolomics approach[J].J Agr Food Chem,2016,64(11):2415-2422.
[9]XIANG W L, ZHANG N D, LU Y, et al.Effect of Weissella cibaria co-inoculation on the quality of Sichuan pickle fermented by Lactobacillus plantarum[J].LWT-Food Sci Technol,2020,121:108975.
[10]汤水平,张青燕,谢伟岸,等.盐渍藠头发酵过程中乳酸菌的分离及特性研究[J].中国酿造,2007(8):61-64.
[11]王雪郦,帅莲,刘雪婷,等.藠头纯种低盐发酵工艺的优化研究[J].现代食品,2023,29(7):66-72.
[12]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:100-150.
[13]洪家丽,李秋艺,潘雨阳,等.红曲黄酒传统酿造过程挥发性风味组分及微生物菌群多样性分析[J].食品科学,2019,40(12):137-144.
[14]LUO Y L,LIU Y L,REN T,et al.Sichuan paocai fermented by mixedstarter culture of lactic acid bacteria[J].Food Sci Nutr,2020,8(10):5402-5409.
[15]RYU E H,YANG E J,WOO E R,et al.Purification and characterization of antifungal compounds from Lactobacillus plantarum HD1 isolated from kimchi[J].Food Microbiol,2014,41:19-26.
[16]YI L H,QI T,HONG Y,et al.Screening of bacteriocin-producing lactic acid bacteria in Chinese homemade pickle and dry-cured meat,and bacteriocin identification by genome sequencing[J].LWT-Food Sci Technol,2020,125:109177.
[17]白友菊.传统发酵型泡菜中乳酸菌的分离筛选及直投式发酵剂的制备[D].武汉:华中农业大学,2016.
[18]ROHMAH PUJI A.Karakterisasi bakteri asam laktat genus Leuconostoc Dari pekasam ale-ale hasil formulasi skala laboratorium[J].J Kimia Khatulistiwa,2012,1(1):14-20.
[19]郑琦锴,蔡常,王临好,等.传统泡菜中高产酸乳酸菌的筛选与鉴定[J].现代食品科技,2023,39(9):96-105.
[20]LUO Y,LIU Y,REN T,et al.Sichuan paocai fermented by mixed-starter culture of lactic acid bacteria[J].Food Sci Nutr,2020,8(5):1743-1752.
[21]杨剑.传统发酵辣椒产香微生物的选育及产香机理研究[D].长沙:湖南农业大学,2020.
[22]高文睿,贠建民.凉州熏醋中高产乙偶姻菌株的分离筛选及发酵特性初探[J].农业科技与信息,2015(16):26-29.
[23]许惠雅,张强,王逸鑫,等.不同乳酸菌对发酵草鱼品质的影响[J].水产学报,2022,46(2):289-297.
[24]PRASTUJATI A U,HILMI M,KHUSNA A,et al.Isolation and identification of lactic acid bacteria of bekamal (banyuwangi traditional fermented meat)[J].IOP Conf Ser: Earth Environ Sci, 2022, 1020(1):012026.
[25]刘建利,何旭,孙钦飞.降解草酸盐乳酸菌株的筛选及其酸乳发酵特性[J].食品工业科技,2021,42(12):111-118.
[26]ZHANG F, ZHOU K, ZHAO Q, et al.Screening and identification of lactic acid bacteria with antimicrobial abilities for aquaculture pathogens in vitro[J].Arch Microbiol,2022,204(12):689.
[27]焦媛媛.酵母菌—乳酸菌共发酵低醇梨酒的研制[D].天津:天津科技大学,2018.
[28]WANG X, WANG W D, LV H X, et al.Probiotic potential and widespectrum antimicrobial activity of lactic acid bacteria isolated from infant feces[J].Probiot Antimicrob Prot,2021,13(1):90-101.
[29]刘廷菊,王义强,戴奕杰,等.贵州锦屏腌鱼细菌群落结构多样性分析及乳酸菌筛选[J].食品与发酵科技,2022,58(6):39-46.
[30]葛东颖,仇港,赵楠,等.盐渍藠头盐水细菌多样性及基因功能预测分析[J].中国酿造,2020,39(10):157-161.
[31]杨振光,任洪冰,苏舒,等.云南泡藠头和泡辣椒中细菌与真菌群落结构和多样性分析[J].食品与发酵工业,2022,48(16):196-202.
[32]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:52-120.
[33]希坎南R E.伯杰氏细菌鉴定手册[M].北京:科学出版社,1989:45-78.
[34]吕欣然,李叙波,佟鑫瑶,等.东北传统腌渍蔬菜中产γ-氨基丁酸乳酸菌的筛选及其生物特性研究[J].中国食品学报,2023,23 (12):61-69.
[35]陈媛媛,陈德茗,李子健,等.产乙偶姻菌株的分离鉴定及其对固态混菌发酵产物的影响[J].中国酿造,2024,43(3):84-89.
[36]DIMITROV S T,MAY C D,TZE M L,et al.Beneficial features of pediococcus:from starter cultures and inhibitory activities to probiotic benefits[J].World J Microbiol Biotechnol,2022,39(1):4.
[37]王晓雯,王灵娟,王哲,等.发酵对蛋白质组成、结构与功能特性及风味影响的研究进展[J].食品与发酵工业,2024,50(9):314-320.
[38]KIM B, BYUN B Y, MAH J.Biogenic amine formation and bacterial contribution in Natto products[J].Food Chem,2012,135(3):2005-2011.
[39]范茹茹.不同盐度藠头发酵过程中微生物及相关指标变化规律研究[D].长沙:湖南农业大学,2020.
[40]FUOCHI V,EMMA R,FURNERI P M.Bacteriocins,a natural weapon against bacterial contamination for greater safety and preservation of food:a review[J].Curr Pharm Biotechnol,2021,22(2):216-231.
[41]吴海波,张兰威,崔洪斌.不同地域发酵蔬菜中的优势产酸菌及其发酵特性的研究[J].食品工业科技,2007(11):63-66,69.
[42]陈偲,张明,付竹贤,等.乳酸菌与酵母菌的复配筛选及在传统泡菜中应用[J].食品工业科技,2023,44(16):155-163.
[43]PISTARINO E, ALIAKBARIAN B, CASAZZA A A, et al.Combined effect of starter culture and temperature on phenolic compounds during fermentation of Taggiasca black olives[J].Food Chem, 2013, 138(3):2043-2049.