酱香型白酒作为我国主流香型之一的白酒,历史悠久,源远流长[1],因其酒体醇厚、酱香突出、幽雅细腻、空杯留香持久、香味谐调、回味悠长等特点而独具风格[2-3]。“中国酱酒之乡”古蔺毗邻的赤水河,对于生产好酒有着不可或缺的地理优势,代表型酱酒有郎酒“青花郎”、潭酒“紫气东来”、川酒“国酿”等,而同处酱酒黄金酿酒带的建瓯,则有“中国山海酱酒之城”称号,可见,不同的地理环境与风土人情能赋予各地域出产的白酒具有截然不同的属性,即产区特色[4]。
白酒作为独特的地域生态产品,极大地依托生态环境。酿酒工业园区及周边生态环境中,水(水质、微生物)、土(土质、微生物)、气(空气微生物、气候)、生(生物环境-动物、植物、微生物等)等各要素的独特性共同造就了白酒的独特性[5-6],而贯穿了整个发酵过程的酿酒微生物,就显得尤为重要。
研究发现,生产环境空气和土壤中存在有酿酒相关微生物[7],白酒产区空气中的细菌微生物会选择性地聚集,形成了菌体密度大、结构复杂且稳定的微生物区系[8],并且区系空气中部分酿酒微生物会随着开放式的生产过程进入到发酵过程中去[9],并且少数的土壤微生物也会在白酒酿造中发挥作用[10]。可见,环境微生物对酿酒过程有着直接或间接的影响。
本研究采用高通量测序技术分析古蔺和建瓯代表酱香型白酒生产企业厂区环境土壤、空气的真菌群落结构,探明两地环境共性与特有真菌群落,为解析酱酒产区特色提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
2023年5月,采集古蔺某酱酒集团代表性酱香型白酒生产厂区环境土壤和空气,在每个研究样地均匀布设5个5 m×5 m的研究样方,用铁锹在每个采样点采集5个表层土壤(0~20 cm)样品,去除样品中可见的植物根系、凋落物、石子等其他杂物,充分混合后形成1个混合样品。 空气样品通过JCQ-5浮游菌采样器,放置于酿造车间的内环境和外环境,设置采样时间1 h,结束后,将采样用的滤纸用无菌袋保存。
古蔺酱酒集团(川酒集团),该集团有两个具有代表性的厂区,分别为二郎厂区和永乐厂区。二郎厂区酿造车间周围土壤、空气样品分别记为GS1、GA1,永乐厂区酿造车间周围土壤、空气样品分别记为GS2、GA2。
建瓯福茅酱酒集团(福茅集团),该集团有三个具有代表性的厂区,分别为福茅老厂区、双龙戏珠新厂区和双龙戏珠老厂区。福茅老厂区酿造车间周围土壤、空气样品分别记为JS1、JA1,双龙戏珠新厂区酿造车间周围土壤、空气样品分别记为JS2、JA2;双龙戏珠老厂区酿造车间周围土壤、空气样品分别记为JS3、JA3。
1.1.2 试剂
E.Z.N.A.R Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:美国Omega公司;FastPfu Polymerase:北京全式金生物技术有限公司。
1.2 仪器与设备
T100 Thermal Cycler 聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIO-RAD公司;DYY-6C电泳仪:北京六一生物科技有限公司;UVPCDS8000凝胶成像分析系统:美国Protein Simple公司。
1.3 实验方法
1.3.1 基因组提取
基因组提取采用间接提取法,首先通过0.1 mol/L磷酸盐缓冲液(phosphate buffer solution,PBS)(pH=7.3)重复洗涤样品及环境样品并收集菌体。DNA提取方法参照SONG Z W等[11]的方法。
1.3.2 IlluminaMiseq高通量测序
在完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。之后进行PCR扩增,按指定测序区域,合成带有barcode的特异引物。 随机选取具有代表性的样本进行预实验,确保在低循环数中使绝大多数样本能够扩增出浓度合适的产物。 全部样本按照正式实验条件进行,每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用E.Z.N.A.R Soil DNA Kit DNA凝胶回收试剂盒切胶回收PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测。扩增产物回收、定量后按照所需数据深度进行文库制备,然后在IlluminaMiseq平台上进行2×250 bp双端测序。测序由上海美吉生物公司完成。
1.3.3 高通量数据分析
使用Illumina测序得到的PEreads进行样本拆分后,首先根据测序质量对双端Reads进行质控和过滤,同时根据双端Reads之间的overlap关系进行拼接,获得质控拼接之后的优化数据。然后使用序列降噪方法(DADA2/Deblur等)处理优化数据,获得扩增子序列变体(amplicon sequence variant,ASV)代表序列和丰度信息。基于ASV代表序列及丰度信息,进行物种分类学分析、群落多样性分析、物种差异分析和相关性分析等一系列的统计学或可视化分析。
1.3.4 数据处理
使用非度量多维尺度法(non-metric multidimensional scaling,NMDS)对真菌群落相似性和差异性进行分析,使用Excel 2019以及IBM SPSS 25.0软件进行数据统计分析,真菌门水平和属水平使用Source tracker软件分析追踪微生物来源,使用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)软件根据分类学组成对样本按照不同的分组条件进行线性判别分析(linear discriminant analysis,LDA)。
2 结果与分析
2.1 真菌多样性指数分析
古蔺和建瓯代表酱香型白酒生产企业厂区环境土壤、空气样品真菌α多样性分析结果见表1。
表1 不同土壤、空气样品真菌α多样性
Table 1 Alpha diversity of fungi in different soil and air samples
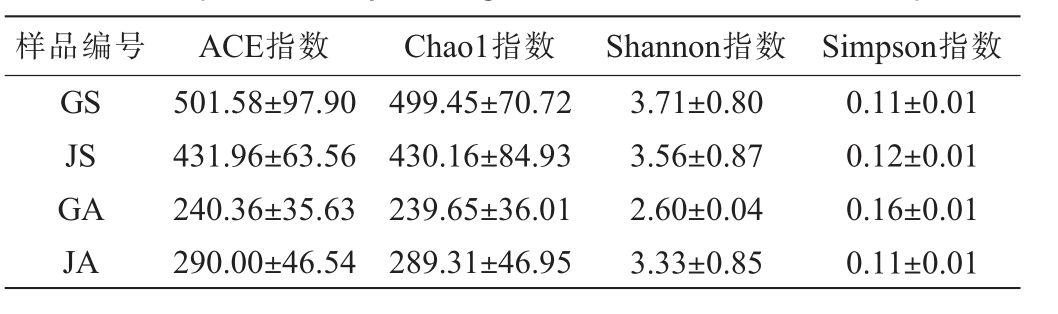
样品编号 ACE指数 Chao1指数 Shannon指数 Simpson指数GS JS GA JA 501.58±97.90 431.96±63.56 240.36±35.63 290.00±46.54 499.45±70.72 430.16±84.93 239.65±36.01 289.31±46.95 3.71±0.80 3.56±0.87 2.60±0.04 3.33±0.85 0.11±0.01 0.12±0.01 0.16±0.01 0.11±0.01
由表1可知,古蔺厂区土壤真菌的Ace指数、Chao1指数和Shannon指数最大,Simpson指数最小,说明古蔺厂区土壤真菌的物种丰富度和群落多样性都高于建瓯土壤;建瓯厂区空气真菌的Ace指数、Chao1指数和Shannon指数最大,Simpson指数最小,说明建瓯厂区的空气真菌的物种丰富度和群落多样性都高于古蔺空气真菌物种。 通过SPSS 25.0分析,两厂区土壤真菌α多样性指数之间均无显著性差异(P>0.05)。
2.2 土壤真菌群落特征分析
古蔺和建瓯代表酱香型白酒生产企业厂区环境土壤样品真菌属水平Upset韦恩图及非度量多维尺度法(NMDS)分析见图1。由图1a可知,5个土壤样品共有的真菌菌属共有69个,两个厂区土壤样品共有的真菌属占土壤总真菌属的17.29%。古蔺酒厂特有的真菌菌属有155个,其中GS1所特有的真菌属有46个,GS2所特有的真菌属有73个,其余36个真菌属为GS1和GS2共有;建瓯酒厂特有的真菌属有175个,其中JS1特有的真菌菌属有50个,JS2所特有的真菌属有28个,JS3特有69个真菌属,剩余10个真菌菌属为JS1,JS2和JS3所共有。 由图1b可知,从NMDS1来看,JS1和JS2距离更近,群落结构更为相似;从NMDS2来看,GS1和GS2距离更近,群落结构更为相似。 五个样品点相互都有距离相近的样品点,又有距离较远的样品点,说明五个样品点都有相似的群落结构,同时又有各自的特异性群落结构。
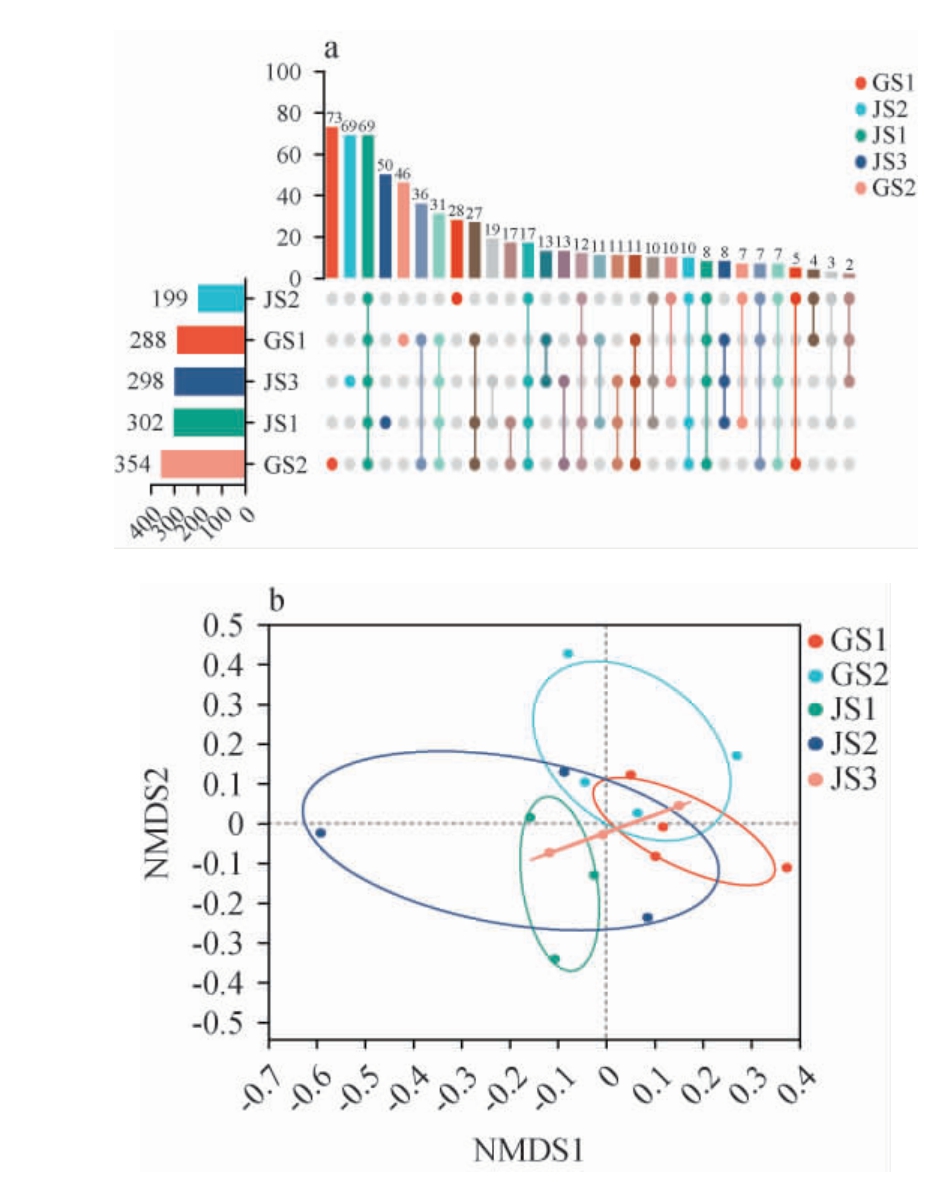
图1 不同土壤样品真菌群落Upset韦恩图(a)及非度量多维尺度法分析(b)
Fig.1 Upset Venn diagram (a) and non-metric multidimensional scaling analysis (b) of fungi flora in different soil samples
由图2a可知,5个土壤样品检测出的优势菌门共有19种,其中包括子囊菌门(Ascomycota),unclassified_k__Fungi,担子菌门(Basidiomycota),被孢酶门(Mortierellomycote),罗兹菌门(Rozellomycote),GS01和球囊菌门(Glomeromycota),壶菌门(Chytridiomycota),捕虫霉门(Zoopagomycota),Aphelidiomycota,被孢酶门(Mucoromycota),梳霉菌门(Kickxellomycota),油壶菌门(Olpidiomycota),Calcarisporiellomycota,根肿黑粉门(Entorrhizomycota)。两厂区土壤真菌门水平分布大致相似,建瓯厂区土壤真菌相对于古蔺厂区土壤真菌,担子菌门(Basidiomycota)占比更大。JS1样品点的罗兹菌门(Rozellomycote)占比相对于其他样品点更大,更为丰富。
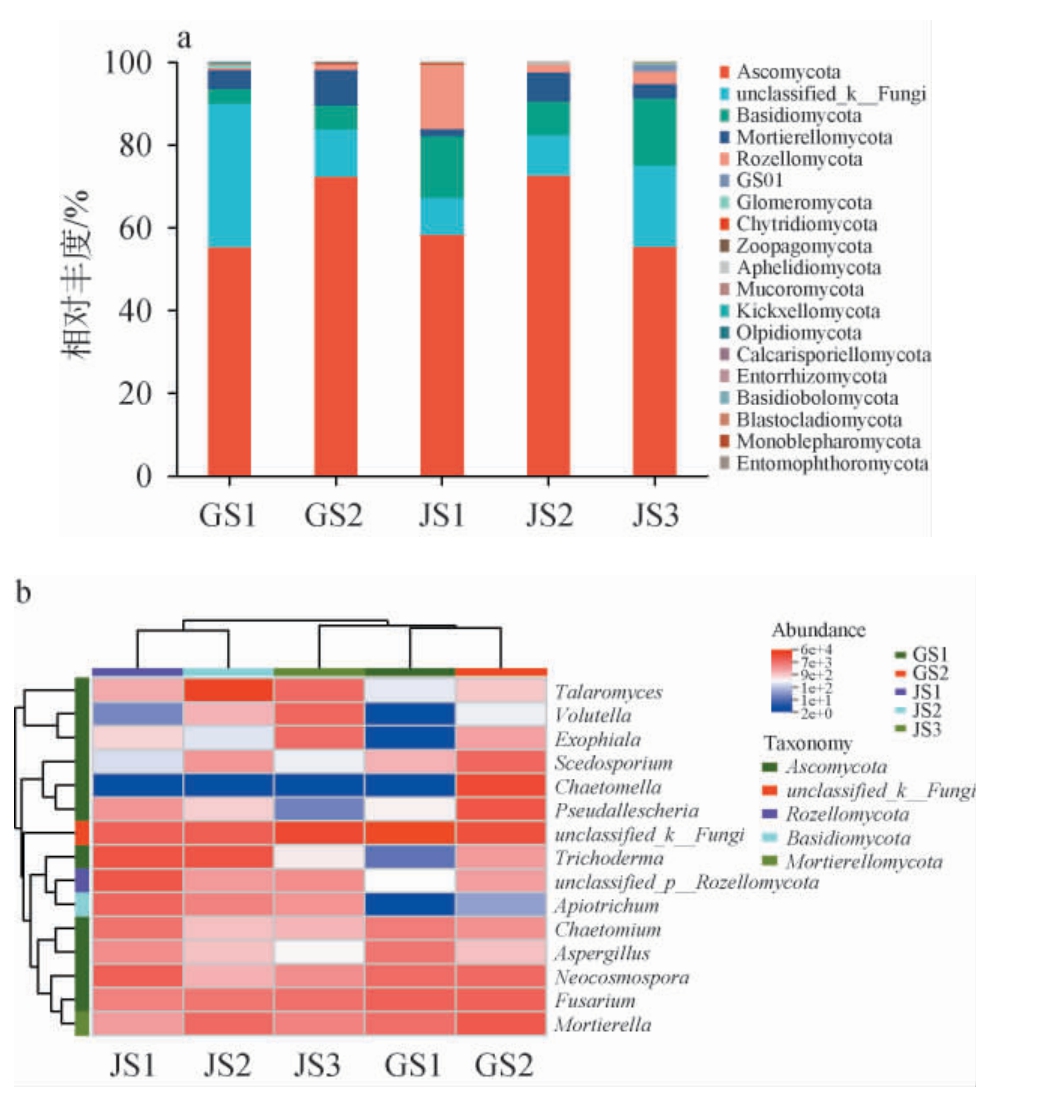
图2 基于门(a)和属(b)水平不同土壤样品真菌群落结构分析
Fig.2 Analysis of fungal community structure of different soil samples based on phyla (a) and genera (b) levels
由图2b可知,5个土壤样品检测出了15种优势菌属,其中包括篮状菌属(Talaromyces),周刺座霉属(Volutella),外瓶霉属(Exophiala),赛多孢菌属(Scedosporium),刺孢壳属(Chaetomella),假霉样真菌属(Pseudallescheria),unclassified_k__Fungi,木霉属(Trichoderma),unclassified_p__Rozellomycota,Apiotrichum,毛壳菌属(Chaetomium),曲霉属(Aspergillus),新赤壳属(Neocosmospora),镰刀菌属(Fusarium),被孢霉属(Mortierella)。 结果表明,JS1和JS2更为接近,GS1、GS2和JS3三个样品点更接近,其中GS1和GS2最接近。 篮状菌属(Talaromyces),赛多孢菌属(Scedosporium),unclassified_k__Fungi,unclassified_p__Rozellomycota,毛壳菌属(Chaetomium),曲霉属(Aspergillus),新赤壳属(Neocosmospora),镰刀菌属(Fusarium),被孢霉属(Mortierella)等菌属在两厂区的土壤中检测均存在。有研究发现,曲霉属分泌的酸性水杨酸能够分解纤维素和淀粉等大分子糖类,有助于酱香型白酒中风味物质的形成[12]。
为了找出古蔺和建瓯代表酱香型白酒生产企业厂区环境的差异性显著的真菌,基于5个土壤样品真菌数据进行线性判别分析效应大小(LEfSe)分析,结果见图3。
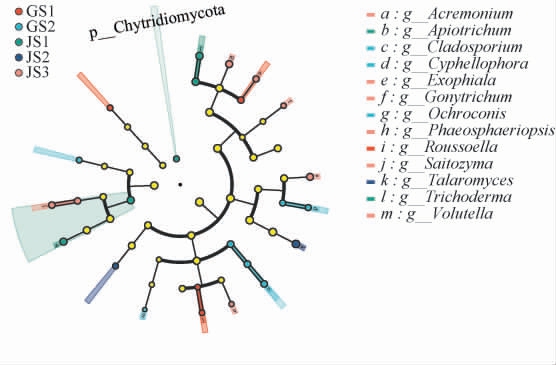
图3 不同土壤样品真菌群落线性判别分析效应大小分析
Fig.3 Linear discriminant analysis effect size analysis of fungal communities in different soil samples
线性判别分析(LDA)阈值>3.5为显著差异菌属[13]。由图3可知, 古蔺厂区土壤中差异性最显著的菌属为un classified_o__Chaetothyriales,Roussoella,unclassified_f__Chaetomiaceae,丹毒丝菌属(Ochroconis),枝孢菌属(Cladosporium),怀梗孢属(Cyphellophora);建瓯厂区土壤中差异性最显著的菌属(LDA阈值>3.5)为木霉属(Trichoderma),Apiotrichum,篮状菌属(Talaromyces),周刺座霉 属(Volutella),外 瓶 霉 属(Exophiala),unclassified_o__Pleosporales,unclassified_p__Basidiomycota,Saitozyma,unclassified_f__Didymellaceae,顶孢霉属(Acremonium),膝梗孢属(Gonytrichum),拟暗球腔菌属(Phaeosphaeriopsis),unclassified_c__Sordariomycetes。 黄婷婷[14]研究发现,木霉属(Trichoderma)和多种生物胺的降解有关。 Apiotrichum在建瓯厂区的土壤中含量较高,古蔺厂区几乎没有。
2.3 空气真菌群落结构分析
古蔺和建瓯代表酱香型白酒生产企业厂区环境空气样品真菌属水平Upset韦恩图及非度量多维尺度法(NMDS)分析见图4。 由图4a可知,五个空气样品共有45个真菌属,两个厂区空气样品共有的真菌属占空气样品总真菌属的12.43%。 古蔺酒厂特有的真菌属有147个,其中GA1特有52个真菌属,GA2特有65个真菌属,还有30个真菌属为GA1和GA2所特有的真菌属;建瓯酒厂特有的真菌属有170个,其中JA1特有17个真菌属,JA2特有130个真菌属,JA3特有16个真菌属,还有7个真菌属为JA1,JA2和JA3所特有的真菌属。由图4b可知,从NMDS1看,GA1和GA2的相对距离很近,说明古蔺酒厂的空气真菌群落结构相似。 从NMDS2看,JA1和JA2相对距离更近,说明建瓯厂区JA1和JA2空气真菌群落结构相似。

图4 不同空气样品真菌群落Upset韦恩图(a)及非度量多维尺度法分析(b)
Fig.4 Upset Venn diagram (a) and non-metric multidimensional scaling analysis (b) of fungal flora in different air samples
由图5a可知,5个空气样品共检测出7个优势菌门,其中包括子囊菌门(Ascomycota),担子菌门(Basidiomycota),unclassified_k__Fungi,毛 霉 门(Mucoromycota),壶 菌 门(Chytridiomycota),梳菌门(Kickxellomycota)和罗兹菌门(Rozellomycota)。 两地的优势菌门都是子囊菌门(Ascomycota),也有研究发现,子囊菌门(Ascomycota)是浓香型白酒酿造酒醅的关键真菌微生物类群[15-16]。
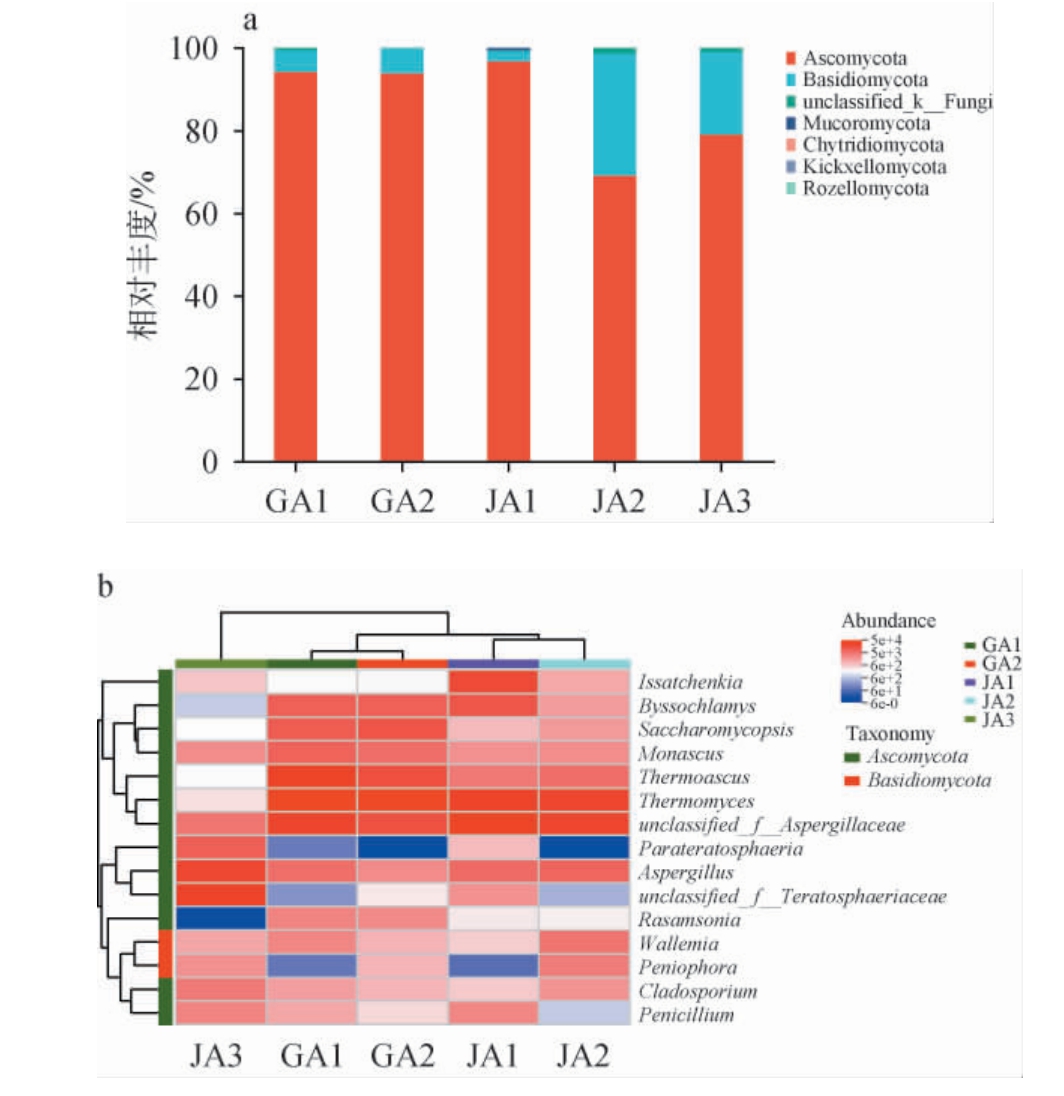
图5 基于门(a)和属(b)水平不同空气样品真菌群落结构分析
Fig.5 Analysis of the fungal community structure of different air samples based on phyla (a) and genera (b) levels
由图5b可知,5个空气样品检测出了前15种优势菌属。从图中可以看出GA1,GA2,JA1,JA2的聚类更好,JA3与其他几个样品点的聚类程度较差,其中GA1和GA2聚类程度更高,JA1和JA2聚类程度更高,与NMDS分析结果一致。检测出的优势菌属包含伊萨酵母属(Issatchenkia),丝衣霉属(Byssochlamys),复膜孢酵母属(Saccharomycopsis),红曲霉属(Monascus),栖热菌属(Thermoascus),嗜热真菌属(Thermomyces),unclassified_f__Aspergillaceae,Parateratosphaeria,曲霉属(Aspergillus),unclassified_f__Teratosphaeriaceae,节担菌属(Wallemia),柄孢壳属(Peniophora),平革菌属(Phanerochaete),枝孢菌属(Cladosporium)和隔孢伏革菌属(Peniophora)。 其中嗜热真菌属能在高温大曲较高的温度下生长繁殖,参与高温大曲中各种酶和风味物质的代谢[17],能够在白酒生产工艺中较高温度下保持稳定的催化效率[18],该菌属在两地均有分布,但JA3中的丰度较低。有研究发现,茅台古镇的空气细菌的优势菌属是曲霉属[19],JA3中的曲霉属丰度最高,可见曲霉属是酱酒生产中重要的酿造微生物之一。 此外,丝衣霉属和曲霉属为淀粉酶和糖化酶的主要生产者,是发酵前期淀粉含量快速下降,还原糖含量增加的主要原因[20]。
为了找出古蔺和建瓯代表酱香型白酒生产企业厂区环境的差异性显著的真菌,基于5个空气样品真菌数据进行线性判别分析效应大小(LEfSe)分析,结果见图6。由图6可知,古蔺厂区空气真菌中差异性最显著的(LDA阈值>3.5)菌属为嗜热子囊菌属(Thermoascus),红曲霉属(Monascus),顶孢霉属(Acremonium),冠突散囊菌属(Eurotium),嗜热真菌属(Thermomyces),复膜孢酵母属(Saccharomycopsis),Rasamsonia; 建瓯厂区空气真菌中差异性最显著的(LDA阈值>3.5)菌属为unclassified_f__Aspergillaceae,丝衣霉属(Byssochlamys),毛孢子菌属(Trichosporon),Xeromyces属,节担菌属(Wallemia),平革菌属(Phanerochaete),隔孢伏革菌属(Peniophora),Phlebiopsis,unclassified_f__Peniophoraceae霉,曲霉菌属(Aspergillus),弯孢霉属(Curvularia),黑孢属(Nigrospora),裂褶菌属(Schizophyllum),尾孢菌属(Cercospora),Exidia。 有研究发现,嗜热子囊菌属与5种脂肪酸显著相关[21]。此外,红曲霉属(Monascus)还可以促进酿酒酵母的酒精发酵,且其产生的有机酸可以有效提高发酵前期乙酸酯类和乳酸乙酯的含量[22]。 冠突散囊菌属(Eurotium)可作为产生多种胞外酶(多酚氧化酶、果胶酶、纤维素酶、蛋白酶等)、胞外多糖和色素等的生产菌株[23]。杨少勇等[24]采集自湖北襄阳市某酒厂的高温大曲和中高温大曲的真菌群落结构进行解析,结果表明高温大曲真菌类群以嗜热真菌属(Thermomyces)为绝对优势菌属。 王乃军[25]研究发现,复膜孢酵母属(Saccharomycopsis)具产淀粉酶、糖化酶、β-葡糖苷酶、酸性蛋白酶的能力,且酶的活性较高;具产乙醇的发酵能力;具有产酸类、醇类、醛酮类、酯类等白酒风味物质的能力。 复膜酵母属(Saccharomycopsis)应用于白酒酿造,能增加酒体的绵甜感,提升原酒品质;用于酒糟处理,可提高酒糟的附加值。这些差异性真菌可能就是导致两个厂区的白酒的风味有所不同的原因之一。
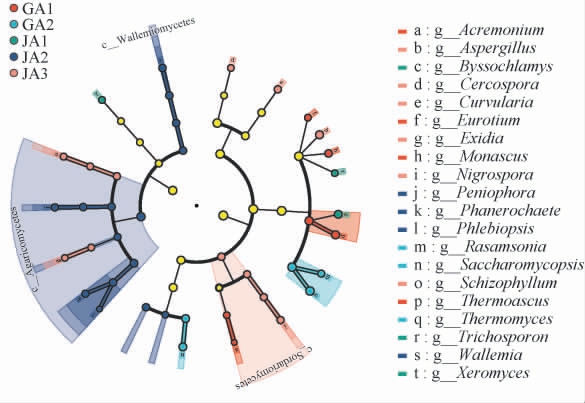
图6 不同空气样品真菌群落线性判别分析效应大小分析
Fig.6 Linear discriminant analysis effect size analysis of fungal communities in different air samples
3 结论
通过对比建瓯和古蔺两个酱香型白酒产区外环境土壤和空气真菌群落结构发现,古蔺厂区外环境土壤的真菌物种丰富度和群落多样性高于建瓯厂区,而空气真菌物种丰富度和群落多样性低于建瓯厂区。两个厂区环境中既具有共有的真菌类群,也含有各自独特的真菌群落,两个产区环境优势真菌群落结构在门、属水平上大致相似,两个厂区环境优势真菌群落结构在门、属水平上大致相似,两个厂区共有的土壤和空气真菌属分别为69种,45种,占土壤和空气真菌菌属总数的14.98%。当LDA阈值>3.5时,两个产区包含以冠突散囊菌属(Eurotium)、嗜热真菌属(Thermomyces)、复膜孢酵母属(Saccharomycopsis)为代表的41个显著差异的真菌属。 由此可见,古蔺和建瓯厂区环境真菌群落结构上存在一些相似的群落结构,但也存在明显差异,进一步证实了不同产区拥有独特的酿酒微生物生态环境。 本研究不仅丰富了不同产区的真菌种类和丰度差异,也为进一步建立更适合酿造环境的有益微生物的培养环境提供数据和理论支撑。
[1]ZHENG X W, HAN B Z. Baijiu, Chinese liquor: History, classification and manufacture[J].J Ethnic Foods,2016,3(1):19-25.
[2]CAI W C,WANG Y R,WANG W P,et al.Insights into the aroma profile of sauce-flavor Baijiu by GC-IMS combined with multivariate statistical analysis[J].J Anal Met Chem,2022(1):4614330.
[3] 孙时光,左勇,张晶,等.酱香型白酒中的风味物质及功效[J].中国酿造,2017,36(12):10-13.
[4]张卜升,袁丛丛,高杏,等.不同产地酱香型白酒化学风味和感官特征差异分析[J].食品科学,2023,44(12):235-243.
[5]李家民.生态酿酒与生态经营[J].酿酒,2009,36(6):91-95.
[6]信春晖.生态酿酒出佳酿-扳倒井酿酒工艺与生态环境关系探讨[J].酿酒科技,2017(1):65-67.
[7]杨代永,王和玉,刘华,等.习酒镇特殊生态环境及酿造微生物多样性的研究与展望[J].酿酒科技,2013(7):49-51.
[8]王兴初,郭坤亮.茅台酒不同生产环境中空气细菌区系研究[J].酿酒科技,2011(9):29-31.
[9]陈泽军,周瑞平,田文,等.多粮浓香型酒厂空气环境中细菌的初步研究[J].酿酒科技,2009(5):74-76.
[10]甄攀,郭瑾,郝希桐,等.汾酒酿造微生物来源分析[J].酿酒,2017,44(6):46-49.
[11]SONG Z W,DU H,ZHANG Y,et al.Unraveling core functional microbiota in traditional solid-state fermentation by high-throughput amplicons and metatranscriptomics sequencing[J].Front Microbiol,2017,14(8):1294.
[12]谢翔云.酱香型白酒功能性霉菌的筛选与应用[D].天津:天津科技大学,2024.
[13]李孟芝,封貌,高丽,等.不同连作年限西红花种植土壤微生物多样性及网络特征的差异[J].安徽农业科学,2024,52(24):137-144,176.
[14]黄婷婷.六种小曲用于米香型白酒酿造的研究[D].成都:四川大学,2021.
[15]王秀秀,汪俊卿,吕志远,等.浓香型白酒酿造区域空气微生物群落结构研究[J].中国酿造,2024,43(3):33-39.
[16]ZHANG W X, QIAO Z W, TANG Y Q, et al.Analysis of the fungal community in zaopei during the production of Chinese Luzhou-flavour liquor[J].J I Brewing,2012,113(1):21-27.
[17]邓灿.兼香型白酒不同品级高温大曲的特性分析及优势嗜热真菌功能研究[D].武汉:武汉轻工大学,2022.
[18]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[19]张亚丽.贵州省仁怀地区茅台空气微生物的鉴定与分析[D].北京:北京化工大学,2015.
[20]杨贵,张宿义,赵金松,等.一种调味白酒发酵过程中微生物菌群结构及代谢研究[J].食品与发酵工业,2022,48(14):209-217.
[21]张晶.酱香型白酒发酵过程脂肪酸合成核心微生物及其影响因素解析[D].无锡:江南大学,2024.
[22]蔡琪琪.红曲霉在红曲黄酒酿造过程中的作用研究[D].福州:福州大学,2015.
[23]杨妮.冠突散囊菌液态发酵产胞外黑色素生物特性的研究[D].长沙:湖南农业大学,2020.
[24]杨少勇,黎婷玉,蔡文超,等.襄阳地区高温大曲和中高温大曲真菌多样性解析[J].中国酿造,2021,40(5):76-80.
[25]王乃军,马美荣.扣囊复膜酵母在白酒生产中的应用研究进展[J].酿酒科技,2023(3):115-119.