酱油是广泛使用的发酵调味品之一,源自中国,至今已有数千年历史。 经过悠久的发展蕴育形成一种色鲜、香醇、味美、营养丰富的调味佳品[1-3],在发酵调味品市场中占相当大的比例,据中国调味品行业分析报告报道,2022年其总产量超过12 00万t,约占调味品总产量的30%~40%。目前,酱油酿造主要采用高盐稀态和低盐固态发酵两种方式。 高盐酱油以鲜美和醇厚的风味著称,其含盐量通常在14%~20%,但长期食用可能导致高血压等健康问题。 相比之下,低盐酱油含盐量较传统高盐酱油低,通常在7%~12%之间。随着饮食健康观念的改变,市场对低盐酱油的需求量逐渐增加,使得关于低盐酱油发酵过程中微生物是如何演替的探究已成为食品工业的重要研究方向。秦倚天等[4]研究认为,减盐酱油是酱油产业发展中的热点方向。LUO J等[5]通过两步纳滤工艺生产低盐酱油和浅色酱油,将原酱油稀释后经过纳滤处理,进行浓缩和脱盐,从而得到低盐酱油。 通过低盐发酵生产酱油的方法,不仅能够降低盐分含量,在保持酱油的风味和口感基础上为消费者提供了一个更健康的调味选择,符合现代对健康饮食的需求去趋势,具有重要的市场意义。
酱油发酵分为酱曲制作和酱醅发酵两个阶段,其中酱醅发酵是获得酱汁的重要来源[6-7]。在传统的高盐稀态发酵方式中,其发酵周期长通常为3~6个月,生产效率较低。而低盐固态发酵方式的发酵周期短,生产效率相较高盐稀态发酵法高,成为现代酱油生产的趋势。德阳低盐固态酱油是历史悠久的老字号品牌,其起源可追溯至清朝同治年间,并于2011年被列为中国地理标志保护产品。 但由于在低盐开放式环境下发酵,该过程对微生物生长的抑制作用会减弱,易受到杂菌污染[8],这可能对酱醅微生物生长及酱油的风味形成会产生影响[9]。LIN X等[10]指出,研发减盐酱油的关键在于有效调控和利用酵母与乳酸菌在发酵过程间的相互作用,以降低有害微生物的污染,同时确保酱油风味物质的生成。梁恒宇等[11-13]研究表明,酱油发酵过程中微生物群落经历复杂的演替,众多微生物和有益菌种的协同作用使物料被分解,生成小分子醇类、醛类、酸类、酯类和酚类等风味物质,这些是酱油风味的主要来源。发酵初期,酵母和细菌大量繁殖,参与糖类发酵,随着发酵的进行,产酸细菌和厌氧微生物逐渐占据主导地位,促进风味物质的生成。 GAO X L等[14]研究显示,混合发酵显著提高了挥发性风味化合物和氨基酸的含量,微生物群落的变化直接影响其代谢活动。YAN Y Z等[15]通过传统微生物培养方法对低盐酱油发酵过程中微生物变化进行分析,发现乳酸菌是主要的菌群,其次是酵母菌和霉菌,以往对于微生物开展的研究采用培养技术,随着分子技术发展,近年来利用扩增子技术、宏基因手段对酱油中微生物的研究成为主要手段之一。
本研究采用德阳低盐固态发酵工艺制成的酱醅作为研究对象,对德阳酱油低盐固态发酵过程中酱醅的理化指标进行分析,采用高通量测序技术解析发酵过程中微生物群落组成和演替规律,并对理化指标与微生物菌属进行Spearman相关性分析。旨在为德阳低盐固态发酵酱油酿造机理研究提供理论依据,为了更好地调控发酵酱油的品质,以及为低盐固态发酵工艺制作酱油的发酵过程与品质之间的相互作用关系提供数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酱醅样品:酱醅样品于四川德阳某酱油厂进行采集,酱醅样品采集分别从发酵池的上、中、下3 层(见图1A)运用竹制的取样器从(见图1B)数字标记点进行采集,将3层样品混合均匀后作为该发酵节点的酱醅样品(约500 g)。在酱醅发酵期内,分别从同一窖池取发酵0、5 d、10 d、15 d的样品。样品采集后暂存于-20 ℃,并及时进行酒醅微生物基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取和理化指标检测。
图1 取样点示意图
Fig.1 Schematic diagram of sampling sites
1.1.2 试剂
OMEGA Soil DNA Kit(D5635-02)试剂盒:美国Omega Bio-Tek公司;75510-019琼脂糖凝胶:美国Invitrogen公司;琼脂糖凝胶电泳缓冲液(Tris-Acetate-EDTA,TAE)、Quant-iT Pico Green dsDNA Assay Kit:美国Invitrogen公司。
1.2 仪器与设备
PRACTUM313-1CN分析天平:赛多利斯科学仪器(北京)有限公司;NC2000-Nanodrop超微分光光度计:美国Thermo Scientific公司;BG-gdsAUTO(130)-凝胶成像系统:北京百晶生物技术有限公司;DYY-6C-电泳仪:北京六一仪器厂;Tissuelyser-48-研磨仪器:上海净信实业发展有限公司;ABI2720聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国赛默飞公司。
1.3 方法
1.3.1酱醅理化指标检测
pH:利用pH计测定;还原糖:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定[16];氨基酸态氮:参考国标GB 5009.235—2016《食品中氨基酸态氮的测定》中的甲醛滴定法测定;总酸:采用酸碱中和法测定;酸性蛋白酶、碱性蛋白酶、中性蛋白酶酶活测定:按照我国行业标准SB/T 10317—1999《蛋白酶活力测定法》中的福林法。蛋白酶活力单位定义:在40 ℃下,每分钟水解酪蛋白产生1微克酪氨酸为一个酶活单位。
1.3.2 微生物多样性分析
总DNA提取:采用OMEGA Soil DNA Kit提取采集酱醅样品中总DNA,采用0.8%的琼脂糖凝胶电泳检测DNA,并用Nanodrop 超微分光光度计对所提取DNA进行浓度检测后定量。
细菌和真菌特定片段的PCR扩增:以上述所提取的DNA为模板,对细菌16S rRNA基因的V3-V4高可变区及真菌ITS区进行PCR,细菌上游Barcode的引物用338F(ACTCCTACGGGAGGCAGCA),下游引物用806R(GGACTACHVGGGTWTCTAAT)。PCR扩增程序为:98 ℃预变性5 min;98 ℃变性30 s、53 ℃退火30 s、72 ℃延伸45 s,25个循环;而后72 ℃延伸5 min,12 ℃保存。 真菌上游引物用ITS1F(CTTGGTCATTTAGAGGAAGTAA),下游引物用ITS2(GCTGCGTTCTTCATCGATGC)。PCR扩增程序为:98 ℃预变性5 min;98 ℃变性30 s、55 ℃退火45 s、72 ℃延伸45 s,28个循环;而后72 ℃延伸5 min,12 ℃保存。 PCR扩增体系为:Q5 high-fidelity DNA polymerase 0.25 mL,5×Reaction Buffer和5×High GC Buffer各5 mL,脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)(10 mmol/L)和模板DNA各2 mL,正、反引物(10 mol/L)各1 mL,加双蒸水(ddH2O)8.75 mL。
PCR产物纯化及定量:扩增结束后用Quant-iT PicoGreen dsDNA Assay Kit对PCR产物进行检测,参照初步定量结果,将PCR产物在Microplate reader进行定量检测的结果混合备用。
文库构建及测序:通过Illumina公司TruSeq Nano DNA LT Library Prep Kit试剂盒进行文库的构建。构建好的文库经过Quant-iT定量和文库检测,建库合格后使用NovaSeq 6000 SP Reagent Kit(500 cycles)进行测序。
1.3.3 数据分析
测序得到的原始序列首先根据demux进行解码,cutadapt插件进行引物切除同时使用DADA对序列质量进行质控和过滤,区分样本后按照100%的相似度划分特征性序列得到ASVs。 采用Silva数据库进行注释结构比对,获得每个样本的功能信息和丰度信息。 Alpha多样性指数分析运用QIIME2软件分析,利用Origin 9.5软件与R语言,ggplot 2对微生物群落结构的变化规律分析,以上分析在上海派森诺生物科技有限公司分析平台完成(https://www.genescloud.cn/home)。
2 结果与分析
2.1 酱醅发酵过程中理化指标分析
德阳酱油低盐固态发酵过程中酱醅的理化指标测定结果见图2。 由图2A可知,pH值从发酵初始时的5.74下降至发酵15 d时的4.81,整体是处于下降趋势,总酸含量从发酵初始阶段的(0.35±0.19)g/100 g逐渐上升至发酵结束的(0.72±0.007)g/100 g。 根据上述变化趋势表明,随着总酸含量的增加,pH值出现下降。这与郭婷等[17]研究结果一致。这是因为有机酸的积累会增加溶液的酸性,从而导致pH值降低。
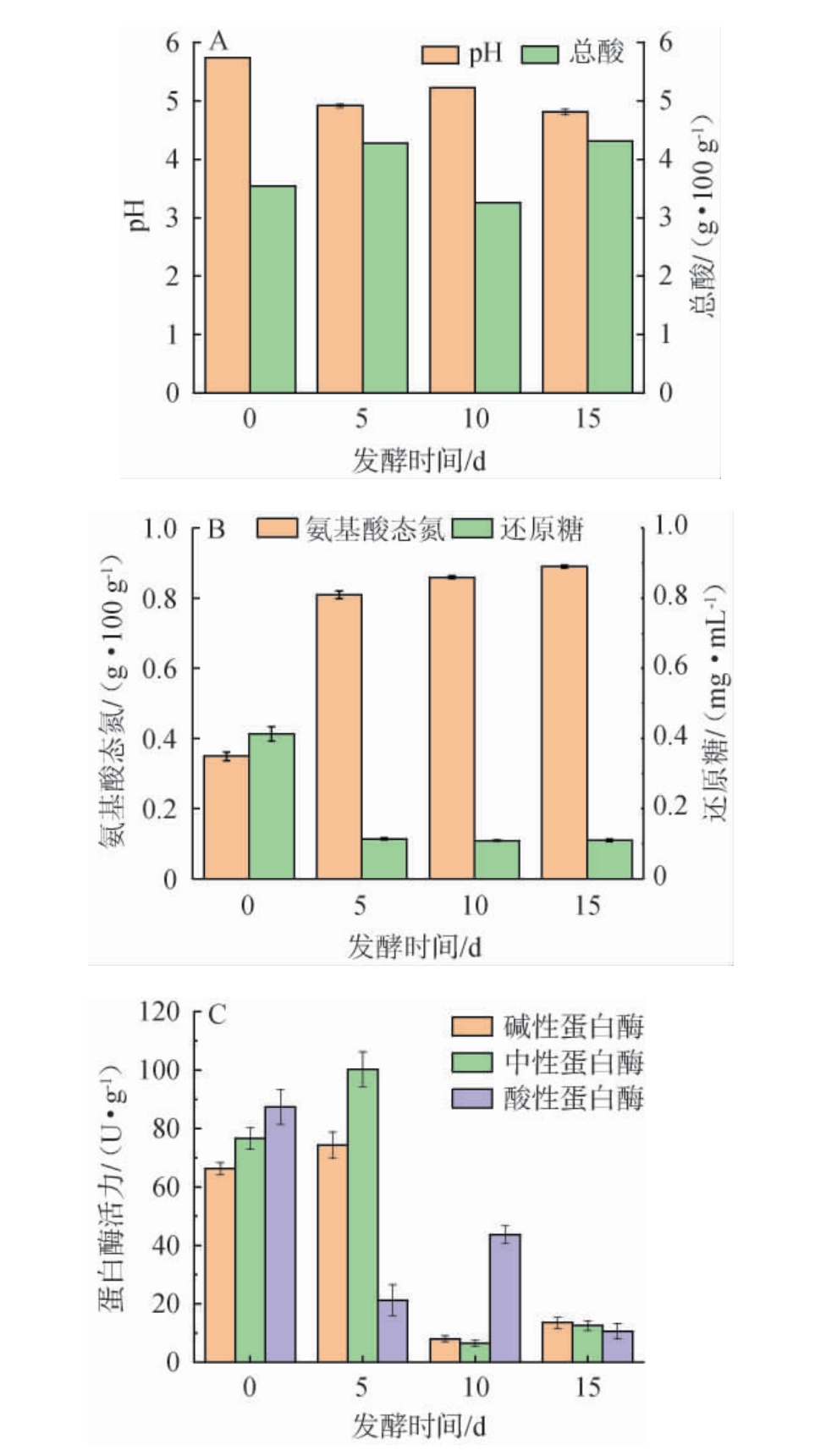
图2 酱醅发酵过程中理化指标的变化
Fig.2 Changes of physicochemical indicators of fermented grains of soy sauce during fermentation process
由图2B可知,在发酵开始时酱醅中氨基酸态氮含量最低为0.35 g/100 g,还原糖含量最高为0.45 mg/mL。氨基酸态氮在整个发酵过程中变化趋于平缓,在发酵15 d时氨基酸态氮含量最高(0.88 g/100 g)。还原糖含量从发酵开始就逐渐降低,是因为在发酵初期糖尚未明显转化为酒精或酸,所以前期还原糖含量高。 随着发酵进行,还原糖含量由发酵初始时0.45 mg/mL下降至发酵15 d的0.11 mg/mL,表明物料中的糖类被微生物利用,转化为有利发酵的物质在酱醅中积累形成[18]。由图2C可知,在发酵初始时,3种蛋白酶活性变化趋势相对平衡。 其中,酸性蛋白酶活力最大为87.4 U/g,其次是中性和碱性蛋白酶。 在发酵5 d时,中性和碱性蛋白酶活力稳定,但酸性蛋白酶活力显著下降。 这可能是由于发酵环境下pH值较低的原因。随着发酵进行,酱醅在发酵10 d时,酸性蛋白酶活性大幅上升,而中性和碱性蛋白酶减少,这表明在发酵阶段,酸性条件下有利于蛋白质的分解,在发酵结束时,由于发酵环境趋于稳定,酶活总体下降,反映着发酵阶段结束,酶活性转向较低的趋势。 根据上述理化指标可知,在发酵早期(0~5 d)时,酱醅进行主动发酵,物料中蛋白质被分解,酶活含量上升,催化糖类向酸类转化速度,还原糖被迅速消耗。在发酵5~10 d时,酸含量持续上升,还原糖稳定,各自酶活力开始促进蛋白质分解。 酶活性以及有机酸和还原糖变化表明了发酵的进程,微生物活性驱动了底物的分解和有机酸和酒精等关键代谢物的形成。
2.2 酱醅发酵过程中微生物Alpha多样性
在发酵过程中,Alpha生物多样性反映酱醅在生长环境中物种丰富度及物种多样性,酱醅样品中细菌的有效序为814 464条,真菌的有效序列为1 537 699条。 酱醅样品检测覆盖率达到99.99%,表明测序结果能有效表示微生物群落的信息。 对酱醅发酵过程中细菌和真菌α多样性分析结果见图3。由图3可知,酱醅中细菌在不同发酵阶段中Chao1指数先升高后降低再小幅上升,Simpson指数和Shannon指数呈现先上升后保持平稳下降现象。
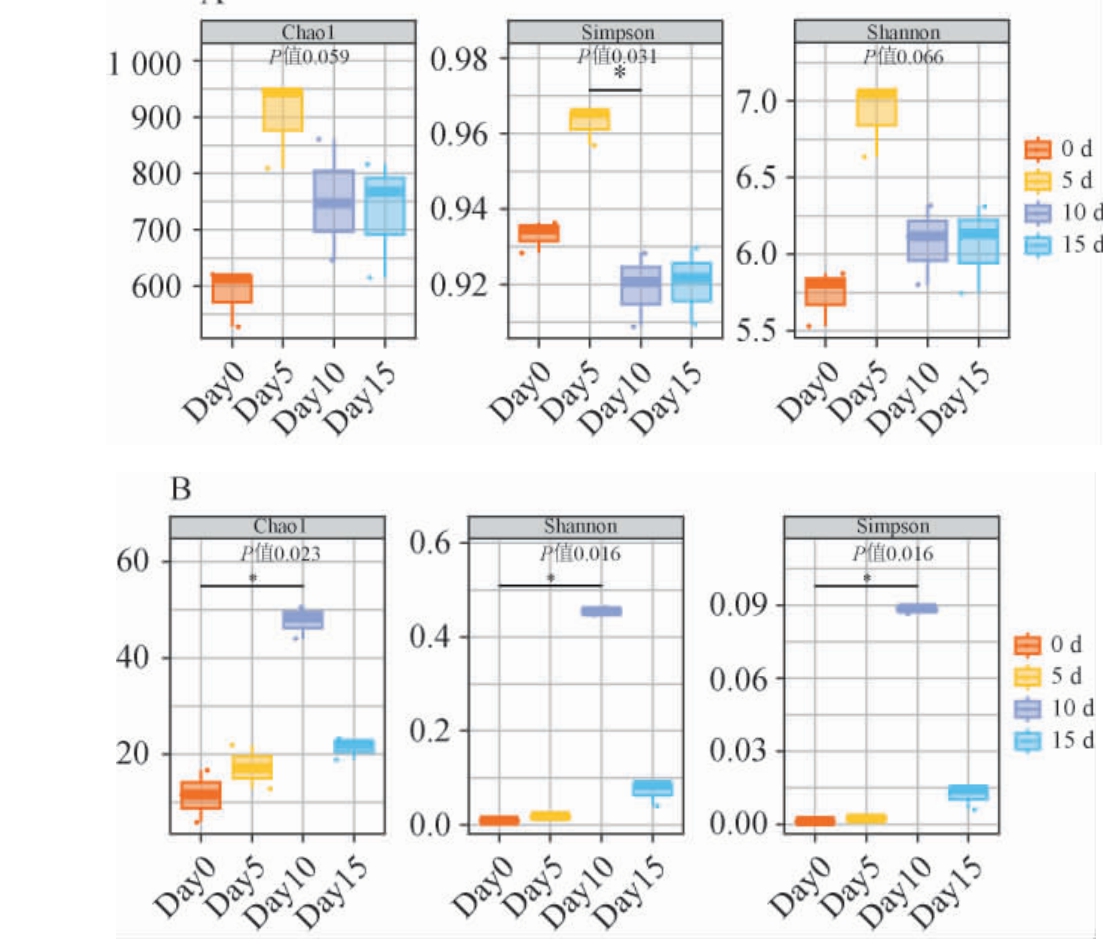
图3 酱醅发酵过程中细菌(A)及真菌(B)Alpha多样性分析结果
Fig.3 Alpha diversity analysis results of bacteria (A) and fungi (B) in fermented grains of soy sauce during fermentation process
“*”表示差异显著(P<0.05)。
酱醅中真菌在不同发酵阶段Chao1指数在发酵0~5 d呈现缓慢小幅上升趋势,10 d之后上升趋势变大而后降低,有别于细菌是在0~5 d呈现快速上升趋势。可能由于生长环境中在该发酵阶段氧浓度较高,细菌和真菌对营养物质的竞争和抑制作用在发酵前期氧含量充足适宜细菌生长,而随着发酵的进行,氧含量消耗后可能会导致有利于真菌的优势生长环境,所以出现以上现象。真菌Simpson指数和Shannon指数变化趋势基本一致,表明群落的多样性组成体系也基本一致[19]。值得注意的是用于衡量物种多样性的Shannon指数在细菌和真菌中随着发酵时间的推移,在酱醅中都呈先升高后降低的趋势,与王鹏等[20-21]研究结果相似,这可能是酒醅发酵前期存在大量来源于大曲的微生物,且酒醅营养丰富,适宜的酸度使酒醅微生物大量繁殖,导致酒醅细菌多样性增加。
2.3 酱醅发酵过程中微生物Beta多样性
基于Bray curtis算法,对发酵过程酱醅样本进行主坐标分析(principal coordinates analysis,PCoA)及层次聚类分析(hierarchical cluster analysis,HCA),对酱醅发酵过程中细菌和真菌Beta多样性分析,结果见图4。
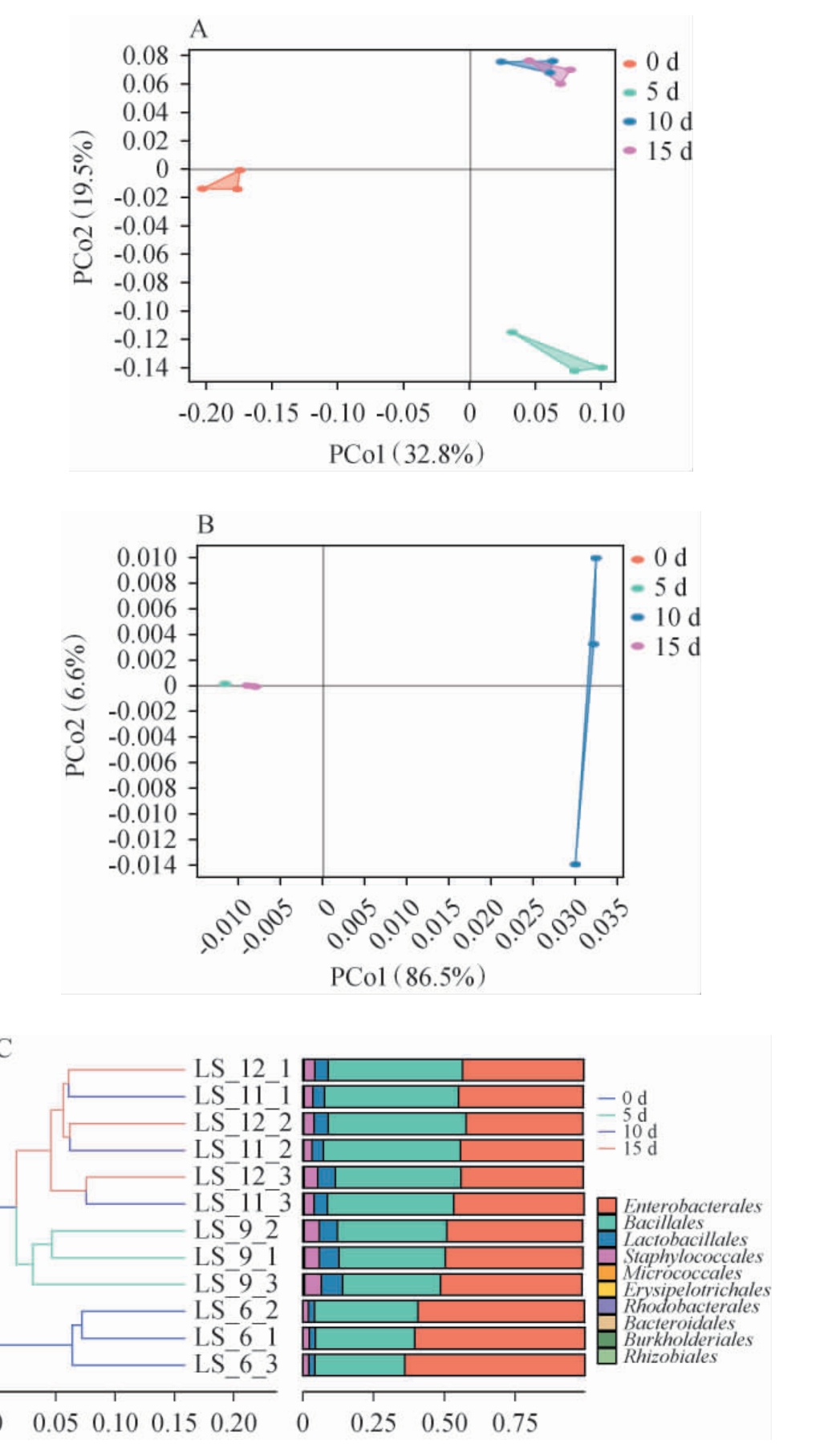
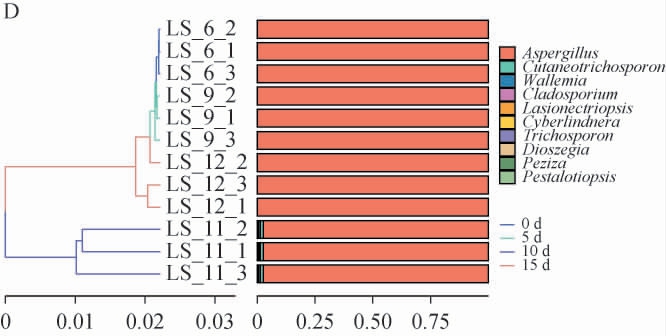
图4 酱醅发酵过程中细菌、真菌主坐标分析(A、B)及层次聚类分析(C、D)
Fig.4 Principal coordinate analysis (A, B) and hierarchical cluster analysis (C, D) of bacteria and fungi in fermented grains of soy sauce during fermentation process
LS-6、LS-9、LS-11、LS-12分别代表发酵时间0、5 d、10 d、15 d的平行酱醅样本。
由图4A可知,发酵0、5 d样品细菌β-生物多样性与发酵10 d、15 d样品有较好区分,但发酵10 d、15 d样品细菌β-生物多样性相似,未能区分。细菌族群PC1和PC2的方差贡献率分别为32.8%和19.5%,累计方差贡献率为52.3%。其中细菌菌群结构在发酵的第5和10天形成较为相似的族群,且两个发酵阶段的生物多样性没有显著差异,可以表明,发酵环境呈稳定趋势。由图4B可知,真菌发酵过程可动态划分为二组:0~10 d归类为组别I,15 d归为组别II。发酵0 d、5 d样本在坐标轴上发生重叠。组别I中β-生物多样性差异小且往同一个方向上演变,且与PCoA坐标轴距离较近,即样品间群落组成相似性高,生物多样性相似度小。 真菌在不同发酵阶段β-生物多样性与细菌的演变规律不同。 真菌的PC1和PC2的方差贡献率分别为86.5%和6.6%。累计方差贡献率为93.1%。 由图4C可知,对酱醅样本进行层次聚类分析,酱醅细菌群落中第5~15天样本与0天样本差异较大。第10天和15天样本差异较小。由图4D可知,酱醅真菌群落中第10天样本与发酵0 d、5 d、15 d样本差异较大。第15天样本与第0天、第5天样本差异较小。
综上可知,由真菌的累计方差贡献率可知样本中生物多样性的信息能够在酱醅样本中体现[22]。细菌的累计方差贡献率较低(53.2%)这可能受多因素驱动影响。说明细菌群落的多样性和变异性更加复杂,在细菌的调查和分析中,可能需要更多维度或因素来全面解释其分布模式。
2.4 酱醅发酵过程中特征微生物
采用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)对不同发酵时间的酱醅样本进行微生物差异分析,以探究各分类水平的物种差异。 对酱醅发酵过程中细菌和真菌进行门、纲、目、科、属线性判别分析效应大小分析,结果见图5。 经过KW多组检验,筛选P<0.05的物种。 然后wilcoxon进行两两组检验,最后筛选线性判别分析中(linear discriminant analysis,LDA)>2的物种,作为识别不同样本的组间稳健差异物种的比较分析。由图5A可知,细菌在发酵初始时特征微生物标记菌包括戴阿利斯特杆菌属(Dialister)、魏斯氏菌属(Weissella)、泛菌属(Pantoea)、克雷伯氏菌属(Klebsiella);发酵15d的特征微生物标记菌为Dubosiella;发酵5 d特征微生物标记菌是考克氏菌属(Kocuria)和肠球菌属(Enterococcus)。 由图5B可知,在真菌中,在发酵0~10 d特征微生物标记菌包括曲霉菌(Aspergillus)、芽枝霉(Cladosporium),发酵15 d标记菌则是盘菌(Peziza)等其他菌属。
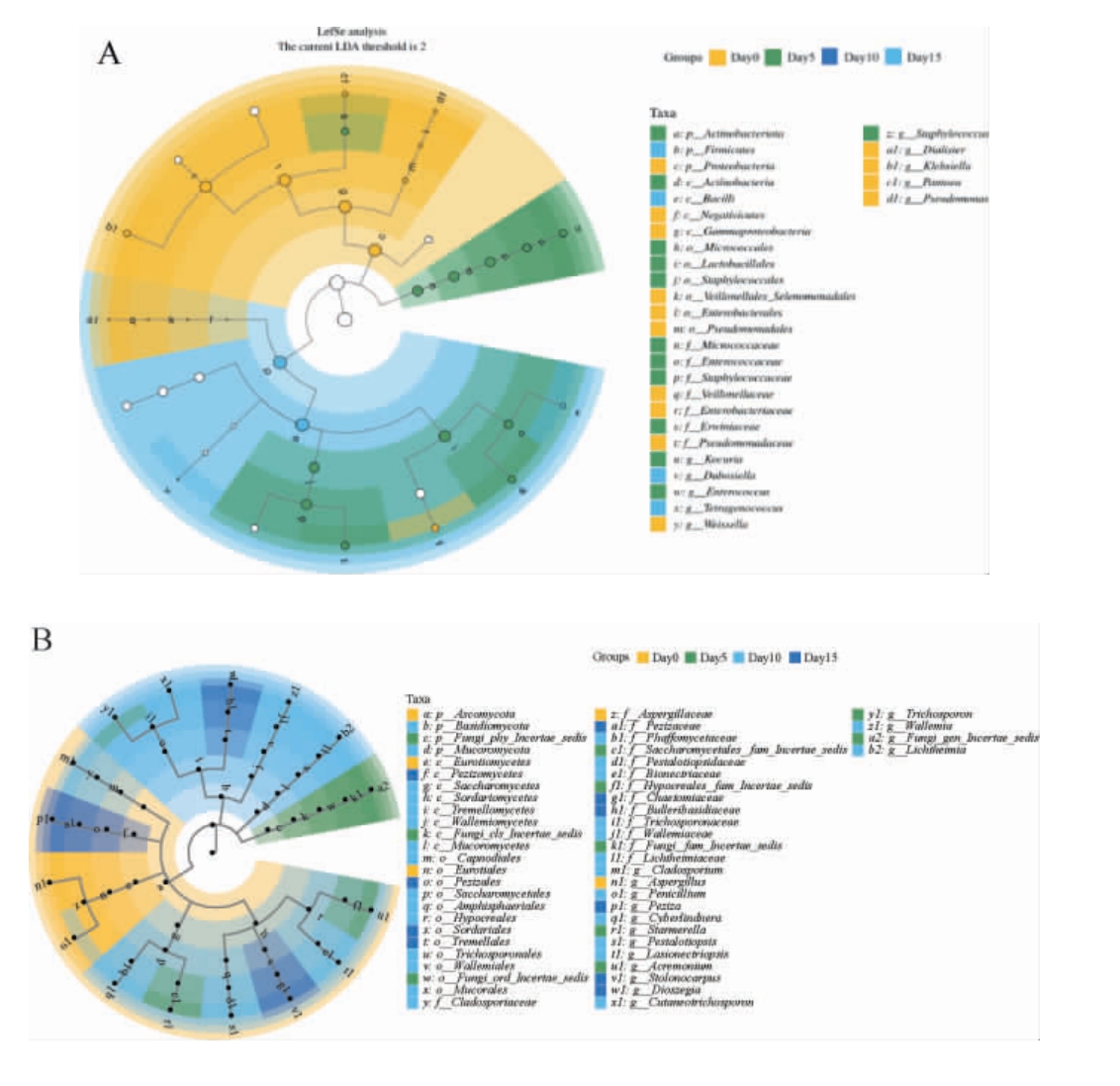
图5 酱醅发酵过程中细菌(A)及真菌(B)的线性判别分析效应大小分析
Fig.5 Linear discriminant analysis effect size analysis of bacteria (A)and fungi (B) in fermented grains of soy sauce during fermentation process
p:门水平;c:纲水平;o:目水平;f:科水平;g:属水平。
综上所述,通过LEfSe分析,可知在酱醅发酵不同阶段中显著差异的微生物标记菌,并且细菌和真菌在每个发酵阶段和组别都有其特定的促进发酵环境生长的标记菌,这些标记菌能够作为稳定的生物标志物,用于区分不同发酵阶段的酱醅样本,同时也能为后续对影响发酵的标记菌研究提供参考。
2.5 酱醅发酵过程中微生物群落组成分析
2.5.1 酱醅发酵过程中细菌群落组成分析
样本去噪后按相似度100%进行聚类,获得所需高质量ASV序列数,得到不同分类类群。在酱醅细菌中最终识别出42门、48纲、82目、127科、192属和106种。在不同发酵时段,酱醅中细菌的相对丰度选择样品中属和目水平绘制百分比堆积柱状图,并对酱醅发酵过程中的细菌和真菌相对丰度进行分析,结果见图6。由图6A可知,在酱醅发酵过程中,取相对丰度前10的物种作为优势菌属进行分析,属水平上分别是芽孢杆菌属(Bacillus)、克雷伯氏菌属(Klebsiella)、肠杆菌属(Enterobacter)、肠球菌属(Enterococcus)、葡萄球菌属(Staphylococcus)、克罗诺杆菌属(Cronobacter)、魏斯氏菌属(Weissella)、气球菌属(Aerococcus)、巨球菌属(Macrococcus)、考克氏菌属(Kocuria)。 其中,芽孢杆菌属(Bacillus)、克雷伯氏菌属(Klebsiella)和肠杆菌属(Enterobacter)的相对丰度最大,这三种菌属在整个酱醅发酵过程中占据了主导地位,其相对丰度之和平均为67.25%。随着发酵时间的推移,克雷伯氏菌属(Klebsiella)的相对丰度逐渐降低,从发酵初始时的23.58%下降到发酵5 d时的8.84%,下降幅度达到62.51%。相对而言,芽孢杆菌属(Bacillus)在发酵结束时的相对丰度整体高于初始发酵,达到31.77%~48.60%。而肠杆菌属(Enterobacter)在整个发酵过程中变化趋于稳定,平均相对丰度保持在12.41%。肠杆菌属和克雷伯氏菌属根据文献报道在酱油发酵过程中属于优势菌属,与该研究结果相似[23]。 据相关文献报道克罗诺杆菌属(原称阪崎肠杆菌)生长繁殖速度较快,属于革兰氏阴性杆菌,是一种条件性致病菌,通常对人体健康不会造成危害[24]。该菌在水果、蔬菜、谷物、水产品、调味品、豆制品和肉类制品等多种食品中被检测到[25]。Weissella在发酵过程中能够生成一些酸性物质,例如乳酸和醋酸,这些物质有助于形成丰富的风味[26]。
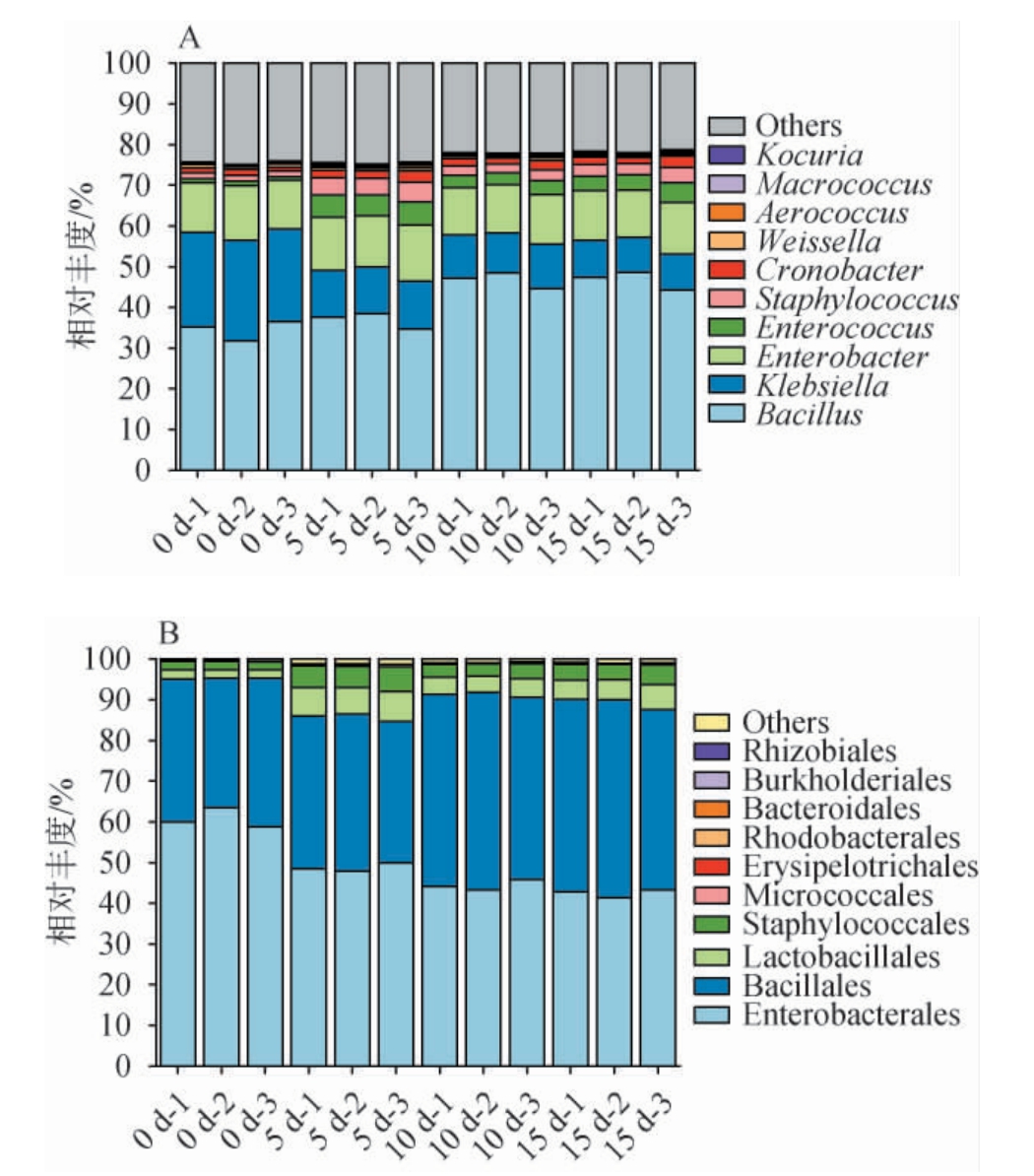
图6 酱醅发酵过程中细菌群落结构属水平(A)和目水平(B)的变化
Fig.6 Changes of bacterial community structure of fermented grains of soy sauce during fermentation process at genus (A) and order (B) levels
由图6B可知,酱醅发酵过程中检测到丰度前10的优势菌目分别为肠杆菌目(Enterobacterales)、芽孢杆菌目(Bacillales)、乳酸菌目(Lactobacillales)、葡萄球菌目(Staphylococcales)、微球菌目(Micrococcales)、丹毒丝科菌目(Erysipelotrichales)、红 杆 菌 目(Rhodobacterales)、拟 杆 菌 目(Bacteroidales)等。 其中,肠杆菌目(Enterobacterales)、芽孢杆菌目(Bacillales)两种菌相对丰度最大,平均相对丰度之和为90.34%,在发酵过程中占优势地位。这表明在发酵过程中Enterobacterales和Bacillales在促进细菌环境生长方面占有利的优势。 随着发酵时间进行,在目水平上可直观看出Enterobacterales和Bacillales呈相反变化趋势,前者随发酵时间推移含量逐渐下降, 后者随着发酵时间推移含量逐渐上升。 值得注意的是,在细菌发酵过程中,无论是在属水平还是目水平上,肠杆菌属(Enterobacter)和芽孢杆菌属(Bacillus)都是优势菌属,在发酵环境中普遍存在,肠杆菌属和芽孢杆菌属可能对酱油发酵中高盐、高温和低氧等生长环境具有较强的适应能力,而且这两个菌属具有良好的发酵能力。此外,在属水平和目水平上,还发现了葡萄球菌属(Staphlococcales)和肠杆菌属的存在。 据认为,葡萄球菌在酱油发酵中是优势菌,它可以通过培养依赖性和非依赖性相结合的方式培养出来[27]。以上分析表明,清晰的描述酱油发酵过程中细菌群落的动态变化,可以为进一步的研究提供基础数据和理论支持。
2.5.2 酱醅发酵过程中真菌群落组成分析
在酱醅的发酵过程对不同分类学水平注释,得到真菌群落的构成有27门、69纲、88目、88科、103属、118种。 并以目和属水平绘制百分比堆积柱状图,并对酱醅发酵过程中真菌相对丰度进行分析,结果见图7。 由图7A可知,选择相对丰度前10的微生物群落得到优势真菌属,其中,曲霉菌属(Aspergillus)在酱醅发酵过程中占绝对主导优势,这主要是由于选择的发酵剂以曲霉为主,曲霉产孢子能力强的因素相关。曲霉属的平均相对丰度高达99.28%。呈先升高,中期下降,最后在发酵结束时再次上升趋势[28],具体来看,0 d和5 d中Aspergillus的平均相对丰度分别为99.98%和99.89%;发酵10 d时略微下降至97.34%;而在发酵15 d时又回升至99.91%。除曲霉属外,酱醅中还检测到其他低相对丰度真菌属。 例如,属于酵母菌大类的Cutaneotrichosporon在发酵第10天开始出现,但其相对丰度变化趋势不明显。根据相关文献报道,酱醅发酵过程中的真菌主要包括霉菌和酵母[29],两者有协同发酵作用有利于促进生长,与本研究结果一致。
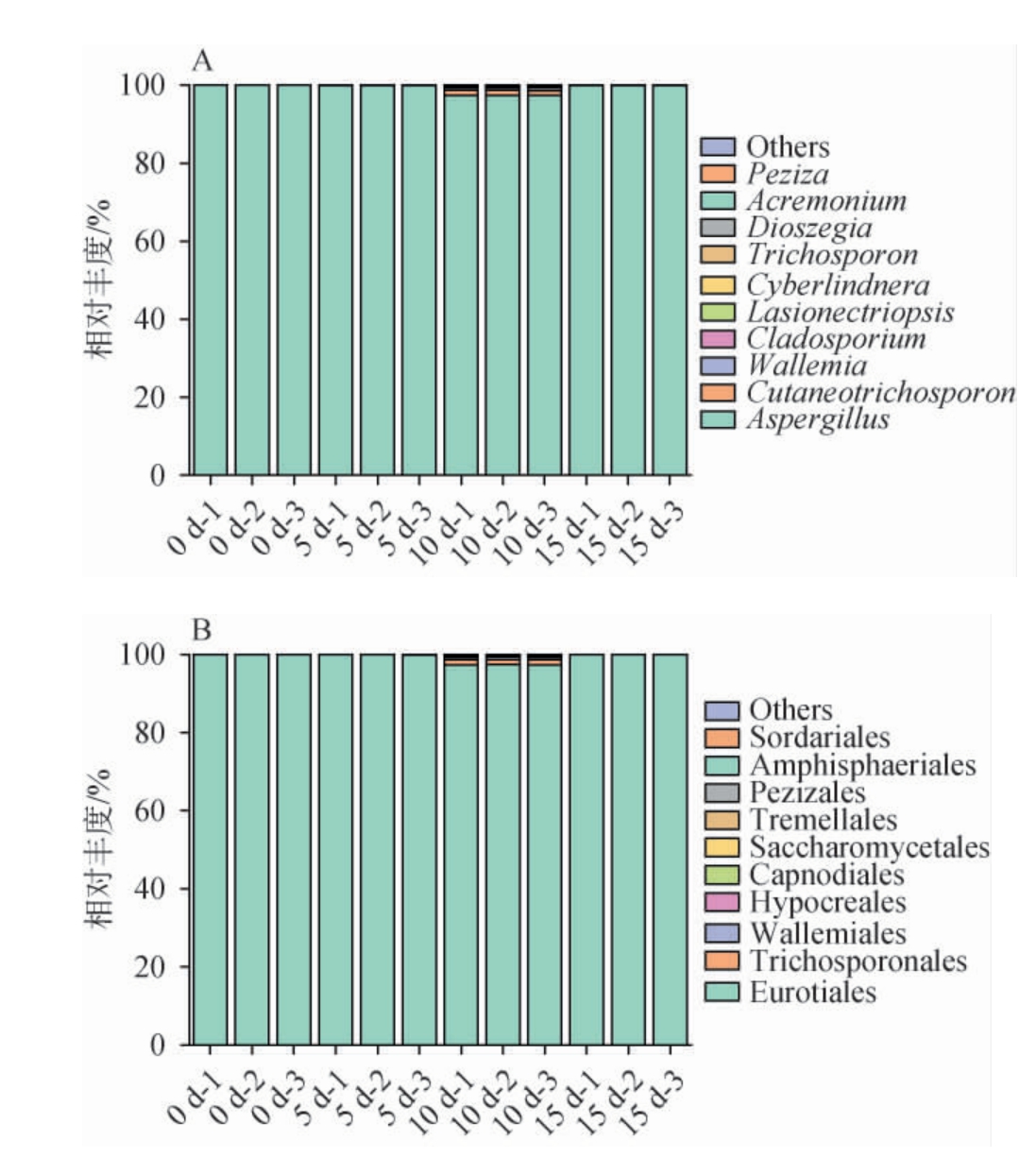
图7 酱醅发酵过程中真菌群落结构属水平(A)和目水平(B)的变化
Fig.7 Changes of fungal community structure of fermented grains of soy sauce during fermentation process at genus (A) and order (B) levels
由图7B可知,在目水平上散囊菌目(Eurotiales)在发酵过程中占绝对优势,平均相对丰度总和高达99.29%。该菌在发酵初始和发酵5 d时的平均相对丰度分别为99.98%和99.90%,而在第10天时相对丰度略微下降至97.35%,最终在第15天时,相对丰度回升至99.92%。通过对不同发酵阶段酱醅的分析,可以得出,曲霉菌是发酵过程中共有的优势真菌。不同发酵天数的真菌物种组成存在较大的差异。除了曲霉菌外,各发酵时期还有其他少量物种存在于发酵环境中。 在酱醅发酵的第10天,Trichosporonales的相对丰度开始增加,此时曲霉菌的相对丰度则小幅下降,在酱醅发酵过程中,散囊菌和曲霉菌的动态变化,以及其他低丰度真菌的演替,会共同影响发酵的质量与风味。
综上,细菌和真菌中魏氏菌、葡萄球菌、曲霉菌等属于发酵过程中优势菌。据报道,这些物种在其他发酵食品中也是主要物质,例如在泡菜豆酱和白酒的大曲中[30-32],魏氏菌在发酵过程中虽不是绝对优势菌,但其可以在发酵生长环境中产生胞外多糖和纤维素,能起到降低血压胆固醇的作用[33]。
2.6 酱醅理化指标与微生物群落结构的相关性分析
根据发酵过程中物种组成,采用皮尔逊Person相关系数将理化指标(pH、总酸、还原糖、氨基酸态氮、酸性蛋白酶、碱性蛋白酶、中性蛋白酶)与细菌和真菌进行相关性分析,结果见图8。 方形代表理化指标,圆形代表物种组成。分别用红色和绿色填充。线条表示关联性,黄色实线代表正相关,灰色虚线代表负相关。 线条越粗表示理化与微生物群落间相关性越大。

图8 酱醅理化指标与细菌(A)和真菌(B)相关性分析
Fig.8 Correlation analysis between physicochemical indicators and bacteria (A) and fungi (B) in fermented grains of soy sauce
由图8A可知,还原糖与Cronobacter、Aerococcus、Staphylococcus和Enterococcus呈正相关,其中与Enterococcus的相关性最强,而与Cronobacter的相关性最弱。中性蛋白酶与Enterobacter呈正相关。Bacillus与氨基酸态氮呈正相关,而与碱性蛋白酶呈负相关。 Cronobacter与酸性蛋白酶及pH值呈负相关,而与还原糖呈正相关。 结果表明,在发酵过程中,还原糖是影响4种微生物物种的最主要理化指标。Cronobacter、Aerococcus、Staphylococcus、Enterococcus、Bacillus和Enterobacter这六种微生物物种分别受还原糖和中性蛋白酶、氨基酸态氮影响,它们均与还原糖、中性蛋白酶和氨基酸态氮呈正相关。
由图8B可知,氨基酸态氮与Aspergillus、Acremonium、Trichosporon呈负相关,与Peziza等余下6种菌呈正相关。中性蛋白酶、酸性蛋白酶与Aspergillus、Acremonium、Trichosporon呈正相关,与Peziza等余下6种菌属呈负相关。 还原糖与Aspergillus呈负相关,与Acremonium等余下5种菌呈正相关。 总酸与Peziza、Aspergillus、Acremonium、Trichosporon、Dioszegia呈正相关,与余下5种菌属呈负相关。pH与Cutaneotrichosporon、Lasionectriopsis、Cladosporium、Wallemia、Cyberlindnera呈正相关,与余下5种菌属呈负相关。 反之,在微生物与理化指标的相关性中,相对丰度占比最大的Aspergillu与中性蛋白酶、碱性蛋白酶、总酸之间呈正相关,和氨基酸态氮、还原糖等呈负相关。
综上,细菌和真菌发酵过程中,理化指标与微生物物种之间存在显著的相互关系,表现为不同微生物对环境变化的不同响应。细菌在发酵过程中,还原糖、中性蛋白酶和氨基酸态氮在多个微生物物种中起到共同促进发酵的作用,且还原糖被确认是最为重要的理化指标。真菌中,氨基酸态氮、还原糖、总酸和pH与不同真菌的相关性存在差异,Aspergillus等主要菌种表现出特定的相关性模式,蛋白酶的动态变化与曲霉密切相关,一方面是曲霉对原料分解利用的体现,另一方面是“酶活力大小”对促发酵优劣影响的体现,这与发酵温度高低,盐含量浓度及发酵环境中pH的酸碱性有密切相关性,反映了理化指标和微生物在发酵过程中的多样化响应的变化趋势。
3 结论
通过对德阳低盐固态酿造酱油发酵过程中细菌和真菌的群落结构及多样性变化进行系统性分析,结果显示:随着时间推移,优势细菌以芽孢杆菌属(Bacillus)和克雷伯氏菌属(Klebsiella)为主,真菌优势菌以Aspergillus为主导。 随发酵进行,芽孢杆菌属(34.4%~46.7%)和肠球菌属(Enterococcus)(1.0%~4.1%)等相对丰度显著升高(P<0.05),未分类肠杆菌科(21.9%~17.8%)和克雷伯氏菌属(23.6%~8.8%)等相对丰度显著降低(P<0.05)。 Bacillus在发酵15 d相对丰度整体高于0 d。Enterobacter在整个发酵过程中变化趋于稳定。理化指标与真菌物种组成的相关性强,且氨基酸态氮、还原糖、总酸和pH与不同真菌物种组成相关性存在差异。细菌在发酵过程中,还原糖、中性蛋白酶和氨基酸态氮在多个微生物物种中起到共同促进发酵的作用,还原糖被确认是最为重要的理化指标。
综上所述,本研究系统分析了德阳酱醅发酵过程中细菌和真菌的变化及物种组成与理化间的相关作用,这些变化反映了微生物对发酵环境的适应与竞争,为酿造过程提供更精确的理论指导。目前关于德阳低盐酱油微生物与风味代谢机制尚不透彻清晰,可将理化因素与微生物相互作用的角度作为深入探讨的重点,挖掘其内在机制,以便更清晰地揭示微生物代谢与风味形成的关系。
[1]ZHAO G Z,HOU L H,YAO Y P,et al.Comparative proteome analysis of Aspergillus oryzae 3.042 and A.oryzae 100-8 strains:Towards the production of different soy sauce flavors[J].J Proteomics,2012,75(13):3914-3924.
[2]ZHANG L,XIONG S,DU T,et al.Unraveling the core functional microbiota involved in metabolic network of characteristic flavor development during soy sauce fermentation[J].Food Biosci,2024,58:103697.
[3]朱娅媛,王晓谦,苗春雷,等.风味酵母A10-2的高密度培养及其生长动力学[J].食品工业科技,2022,43(24):153-159.
[4]秦倚天,王永福.低盐酱油趋势及膜分离用于酱油脱盐研究进展[J].食品工业,2023,44(4):292-299.
[5]LUO J,DING L,CHEN X,et al.Desalination of soy sauce by nanofiltration[J].Sep Purif Technol,2009,66(3):429-437.
[6]侯小歌,王俊英,李学思,等.浓香型白酒糟醅及窖泥产香功能菌的研究进展[J].微生物学通报,2013,40(7):1257-1265.
[7]ZHANG L, ZHOU R, CUI R, et al.Characterizing soy sauce moromi manufactured byhigh-salt dilute-state and low-salt solid-state fermentation using multiphase analyzing methods[J].J Food Sci,2016,81(11):C2639-C2646.
[8]李心智,刘希,徐新玉,等.梯度升温发酵工艺对不同盐分稀态发酵酱油微生物变化和风味形成的影响[J].食品工业科技,2024,45(9):106-114.
[9]罗艺璇,张菊华,赖慧婷,等.酱油发酵过程中的微生物多样性及功能研究进展[J/OL].食品工业科技,1-23[2025-02-28].https://doi.org/10.13386/j.issn1002-0306.2024090391.
[10]LIN X,TANG Y,HU Y,et al.Sodium reduction in traditional fermented foods: Challenges,strategies, and perspectives[J].J Agr Food Chem,2021,69(29):8065-8080.
[11]梁恒宇.传统发酵大豆食品中乳酸菌的分布、功能和应用[J].食品科学,2013,34(19):381-385.
[12]ZHAO G Z,LI J J,ZHENG F P,et al.The fermentation properties and microbial diversity of soy sauce fermented by germinated soybean[J].J Sci Food Agr,2021,101(7):2920-2929.
[13]LI J,WANG B, CHEN J, et al.Heme dependent catalase conditionally contributes to oxygen tolerance of Tetragenococcus halophilus strains isolated from soy sauce moromi[J].Appl Sci,2022,12(16):8039.
[14]GAO X L,ZHAO H F,FENG Y Z,et al.A comparative study on physicochemical properties of Chinese-type soy sauces prepared using pure koji and mixed kojis[J].Afr J Biotechnol,2010,9(40):6740-6747.
[15]YAN Y Z,QIAN Y L,JI F D,et al.Microbial composition during Chinese soy sauce koji-making based on culture dependent and independent methods[J].Food Microbiol,2013,34(1):189-195.
[16]闫华娟.小麦麸皮酶解液对低盐固态发酵酱油品质的影响[D].晋中:山西农业大学,2014.
[17]郭婷,王凤军,周新运,等.米曲霉盐胁迫对酱油发酵理化指标及微生物群落的影响[J].中国酿造,2023,42(6):97-102.
[18]贾丽艳,郭晋田,刘帅,等.清香型白酒发酵过程中微生物及理化指标的变化规律[J].中国食品学报,2020,20(8):162-167.
[19]ORZHENKOV A A,TOSHCHAKOV S V,BARGIELA R,et al.Archaea dominate the microbial community in an ecosystem with low-to-moder ate temperature and extreme acidity[J].Microbiome,2019,7(1):11.
[20]王鹏,蒋超,常强,等.绵甜型白酒酒醅原核微生物群落结构分析[J].食品科学技术学报,2018,36(5):19-25.
[21]ZHANG Y Y,ZHU X Y,LI X Z,et al.The process-related dynamics of microbial community during a simulated fermentation of Chinese strongflavored liquor[J].BMC Microbiol,2017,17(1):196.
[22]RIVAS M N,BURTON O T,WISE P,et al.A microbiota signature associated with experimental food allergy promotes allergic sensitizationand anaphylaxis[J].J Allergy Clin Immun,2013,131(1):201-212.
[23]胡传旺.酱油发酵过程微生物群落解析及功能研究[D].无锡:江南大学,2017.
[24]孙晶莹,李宏铎,孙丽君,等.RT-PCR快速检测婴幼儿奶粉中的克罗诺杆菌活菌研究[J].食品安全质量检测学报,2018,9(3):598-602.
[25]李远宏,姜华,焦阳,等.食品香辛料和调味品中克罗诺杆菌的分离与鉴定[J].食品工业科技,2017,38(19):125-130.
[26]FUSCO V,QUERO G M,CHO G S,et al.The genus Weissella:Taxonomy,ecology and biotechnological potential[J].Front Microbiol,2015,6:155.
[27]WEI Q Z, WANG H, CHEN Z, et al.Profiling of dynamic changes in the microbial community during the soy sauce fermentation process[J].Appl Microbiol Biot,97(20):9111-9119.
[28]范林旭.高产蛋白酶米曲霉的筛选及其在豆瓣酱中的应用[D].无锡:江南大学,2022.
[29]DEVANTHI P V P,GKATZIONIS K.Soy sauce fermentation:Microorganisms,aroma formation,and process modification[J].Food Res Int,2019,120:364-374.
[30]KIM M J,KWAK H S,JUNG H Y,et al.Microbial communities related to sensory attributes in Korean fermented soy bean paste(doenjang)[J].Food Res Int,2016,89(Pt 1):724-732.
[31]LIU P, XIANG Q, SUN W, et al.Correlation between microbial communities and key flavors during post-fermentation of Pixian broad bean paste[J].Food Res Int,2020,137:109-513.
[32]YANG Y,WANG S T,LU Z M,et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in mediumtemperature daqu starter[J].Food Res Int,2021,140:110-037.
[33]LIU H,CHEN Z Q,MA M T,et al.Metagenomic analysis of the relationship between microorganisms and flavor development during soy sauce fermentation[J].Food Biosci,2023,56:103-193.