白酒作为中国传统发酵酒精饮料的瑰宝,历来以自然发酵的独特工艺著称。不同香型白酒基于原料、生产工艺、香气特点以及口感都有其独特的主体风味物质,这些微量的风味物质,赋予了白酒独特的风格和滋味[1]。然而,由于多种因素,部分白酒香气不足,品质有待提升。 因此,如何改善白酒的品质,使其香气更为浓郁、口感更为醇厚,成为白酒行业面临的重要课题。但我国对于白酒的生产有着严格的法规标准,白酒中禁止添加任何非自身发酵产生的呈香和呈味物质[2]。因此,通过添加外源物质来提升白酒品质的做法都是不合法的。
产酯香酵母是一类具有特殊代谢功能的微生物,能够在白酒发酵过程中产生丰富的酯类香气成分[3]。这些酯类物质不仅赋予了白酒独特的香气特征,还能够有效改善白酒的口感。 通过合理使用产酯香酵母,可以在不添加任何外源物质的前提下,显著提高白酒中酯类香气成分的含量,从而实现对白酒品质的改善[4-5]。目前,国内外学者对产香酵母在白酒中的增香提酯作用进行了深入而广泛的研究,其中一种形式是制备功能型强化大曲再发酵,另一种是将产香酵母直接投入发酵前酒醅中进行酿造,以酵母菌、霉菌以及芽孢杆菌的研究最多[6-10],吕磊[11]对芝麻香型白酒关键微生物进行分析,发现酿酒酵母(Saccharomyces cerevisiae)主要产乙醇及少量的己酸乙酯,而汉逊酵母(Hansenula)、球拟酵母(Torulopsis)、意大利酵母是主要的产香酵母;ROJAS V等[12]从葡萄和葡萄酒中分离的季也蒙有孢汉逊酵母(Hanseniaspora guilliermondii)11104和异常毕赤酵母(Pichia anomala)10590具有高产乙酸乙酯、乙酸异戊酯及其他乙酸酯的能力;庞博等[13]从金沙窖酒酒醅中获得一株产香酵母属(Saccharomyces)菌株,其发酵酒样中乙醇含量最高,其次是乙酸乙酯;LI W等[14]通过在大曲生产中加入酿酒酵母,从而有效提高了大曲中己酸乙酯等酯类物质含量;刘霄等[15]将一株产酯能力强的扣囊复膜酵母(Saccharomycopsis fibuligera)M1制备成强化麸曲,并用于小曲白酒酿造中,发现其显著提高了白酒中乙酸乙酯的含量,是对照组中的1.58倍;余安岭等[16]将异常威克汉姆酵母(Wickerhamomyces anomalus)应用于麸曲制作并投入到白酒酿造中,其乙酸乙酯含量是大曲白酒组的6.25倍;周钰涵[17]将酵母AY12 1-C和乳酸片球菌(Pediococcus acidilactici)Pea 30混合发酵制备新型麸曲并进行白酒酿造,其乙酸乙酯含量高达596.32 mg/mL;ZHA M等[18]研究发现,异常威克汉姆酵母GZ3和S.cerevisiae G20分别高产乙酸乙酯(2.76 g/L)和2-苯乙醇,将其混合应用于白酒酿造中,提高了香气物质含量。 然而,对产香酵母的利用受到许多因素的制约,包括菌株的特异性和发酵环境的变化,极端条件下酵母的生长与风味物质的合成会受到抑制,从而影响其功能性和白酒品质[19]。 基于此,产香酵母的筛选和生长、耐受特性分析,对于改善白酒和其他发酵食品的品质具有重要意义。 对于筛选的产香酵母的来源也比较广泛,这些酵母资源值得去挖掘并应用,为白酒酿造提供更为优质的菌种资源。
本研究采用传统培养分离法结合嗅闻法方法从中、高温大曲样品中分离筛选产酯香酵母,通过分子生物学技术对其进行菌株鉴定,并测定其生长曲线、耐受性及挥发性风味物质的组成与产香特性,以期为菌株强化白酒酿造以及增香提味提供优良的酵母资源。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
中温大曲、高温大曲、传统大曲粉:漯河某公司;红高粱、稻壳:市售。
1.1.2 试剂
2-辛醇(色谱纯)、乙醇、乙酸(均为分析纯):上海麦克林生化科技有限公司;葡萄糖(分析纯):北京言必信生物科技有限公司;琼脂粉(生化试剂)、酵母菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京索莱宝科技有限公司;内部转录间隔区1(internal transcribed spacer-1,ITS1)、ITS4引物:生工生物工程(上海)股份有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
麦芽汁培养基、虎红(孟加拉红)培养基、酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、Wallerstein Laboratory Nutrient(WLN)培养基:青岛海博生物科技有限公司。
1.2 仪器与设备
PHS-25 pH计:上海仪电科学仪器股份有限公司;LRH-70生化培养箱:上海一恒科学仪器有限公司;ZQLY-180ES振荡培养箱:上海知楚仪器有限公司;UV-2802紫外分光光度计:上海尤尼柯仪器有限公司;8890-7250气相色谱-四级杆飞行时间质谱联用(gas chromatography-quadrupole time of flight mass spectrometry,GC-Q/TOF MS)仪、5191-5874三项纤维萃取头、DB-WAX毛细管色谱柱(30 m×250 μm×0.25 μm):安捷伦科技有限公司;Mastercycler nexus聚合酶链式反应(polymerase chain reaction,PCR)仪:德国艾本德股份公司;Gel Doc XR+凝胶成像仪:美国伯乐公司。
1.3 方法
1.3.1 酵母菌菌株的分离纯化及形态学观察
称取粉碎至10目的中、高温大曲粉末各0.5 g加入至20 mL麦芽汁液体培养基中,于30 ℃、150 r/min条件下培养富集24 h。取1 mL富集液,采用0.85%的无菌生理盐水按10倍梯度稀释至10-9,取200 μL稀释液涂布于虎红(孟加拉红)培养基平板,于30 ℃恒温培养箱中培养48 h后;挑取典型的酵母菌单菌落接种至WLN培养基上,并在30 ℃条件下培养72 h,观察菌落的颜色、大小、质地以及凸起程度,同时关注菌落边缘的整齐度和表面的光滑度等特征,并采用电子显微镜观察其细胞形态。挑取单菌落接种于YPD液体培养基,30 ℃、150 r/min条件下培养48 h,得到酵母菌纯培养物,吸取1mL菌液与等体积的60%甘油混合,于-80℃保存[20]。
1.3.2 产酯香酵母菌菌株的筛选
挑取分离的酵母菌菌株单菌落接种于YPD液体培养基中,于30 ℃、150 r/min条件下培养24 h,采用无菌水稀释将菌液浓度调节为108 CFU/mL作为作为种子液,备用。 取种子液按2%(V/V)的接种量接种于YPD液体培养基中,于30 ℃、150 r/min条件下培养24 h后,将其划线于YPD固体培养基平板,以不接菌的YPD培养基为空白对照,采用嗅闻法[21]嗅闻菌株在YPD液体及固体培养基代谢产生的风味,筛选产酯香酵母菌菌株。
1.3.3 产酯香酵母菌菌株的鉴定
采用酵母菌DNA提取试剂盒提取产酯香酵母菌的基因组DNA,以其为模板,采用引物ITS1(5'-CCGTAGGTGAACCTGCGG-3')、ITS4(5'-TCCTCCGCTTATTGATATGC-3')PCR扩增5.8 ITS rDNA基因序列。PCR扩增体系:DNA模板1.0 μL;Taq PCR Master Mix 15 μL;ITS1 1.2 μL;ITS4 1.2 μL;双蒸水(ddH2O)11.6 μL。PCR扩增程序:95 ℃预变性3 min;94 ℃变性20 s,55 ℃退火15 s,72 ℃延伸30 s,循环32次;72 ℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后委托生工生物工程(上海)股份有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,选取同源性较高的模式菌株的5.8 ITS rDNA基因序列,采用Clustalw 2.0.10软件对ITS序列进行比对,利用MEGA 7.0软件中的邻接法(neighbor joining,NJ)构建系统发育树。
1.3.4 产酯香酵母菌菌株的生长曲线
将种子液以2%(V/V)的接种量接种于YPD液体培养基中,于30 ℃、150 r/min条件下培养24 h。 每隔2 h在波长600 nm处测定吸光度(OD600 nm)值,以培养时间为横坐标,OD600nm值为纵坐标,绘制菌株生长曲线。
1.3.5 产酯香酵母菌菌株耐受性分析
将种子液以2%(V/V)的接种量分别接种于不同乙醇体积分数(7%、10%、13%、15%、17%)、葡萄糖含量(30%、40%、50%、60%、70%)及乙酸体积分数(0.5%、1.0%、1.5%、2.0%、2.5%)的YPD液体培养基中,于30 ℃、150 r/min条件下培养24 h,在波长600 nm处测定发酵液的吸光度值[22]。
1.3.6 产酯香酵母菌菌株的产香特性分析
称取一定高粱,加入70%的60 ℃热水进行浸泡,每隔6 h翻拌一次,浸泡24 h。浸泡结束后滤干,115 ℃糊化30 min,40~45 ℃冷水焖粮20 min后进行复蒸(115 ℃,30 min)。摊平晾凉,加入原料总质量30%的凉水,对照组(CK)为传统大曲粉发酵:加入10%传统大曲粉及10%稻壳;实验组为菌株强化发酵:加入10%的传统大曲粉、10%稻壳及2%的产酯香酵母菌种子液,装入灭菌梅森瓶进行密封发酵15 d[23]。采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)结合GC-Q/TOF-MS测定挥发性风味物质[24]。
参照文献[25]的方法计算香气活度值(odor activity value,OAV)。其OAV计算公式如下:
式中:OAVx作为挥发性化合物x的香气活度值;Cx为挥发性化合物x的质量浓度,μg/kg;OTx为挥发性化合物x在水中的阈值,μg/kg。
其中,0≤OAV≤1表明该挥发性化合物对整体风味没有实质性影响,但在一定程度上起到修饰作用;OAV>1说明该化合物对整体风味具有直接影响,进而被确定为关键香气成分。
1.3.7 数据处理
每个试验重复3次,采用SPSS Statistics 26.0软件处理数据,结果以“平均值±标准差”的形式呈现;采用Origin 2023b软件绘制相关图表。
2 结果与分析
2.1 酵母菌菌株的分离纯化及形态学特征
采用传统培养分离法从中、高温大曲样品中共分离得到10株具有典型酵母菌特征的菌株,其在WLN培养基上的形态学特征见表1及图1。

图1 部分分离酵母菌菌株在WLN培养基上的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of partially isolated yeast strains on WLN medium
表1 分离酵母菌菌株在WLN培养基上的形态学特征及数量
Table 1 Morphological characteristics and number of isolated yeast strains on WLN medium

样品 菌株编号 菌落形态 细胞形态 数量/株中温大曲ZDL1 GK2、GK010、GK03、Z-3 G-2、G-3竹节发芽状球形球形、椭球型高温大曲GNW9球形G-1、G-8圆形、凸起、白色绒毛、干燥圆形、凸起、乳白色、光滑无光泽圆形、凸起、乳白色、光滑有光泽圆形、凸起、半透明、光滑有光泽圆形、扁平中凸、乳白色、干燥无光泽短条形14 2 1 2
由表1及图1可知,从中、高温大曲样品中分别分离得到5株酵母菌株,根据形态特征初步分为5类:菌株ZDL1的菌落呈圆形、凸起、白色绒毛、干燥,细胞呈竹节发芽状;菌株GK2、GK010、GK03、Z-3的菌落呈圆形、凸起、乳白色、光滑无光泽,细胞呈球形;菌株G-2、G-3的菌落呈圆形、凸起、乳白色、光滑有光泽,细胞呈球形或椭球型;菌株GNW9的菌落呈圆形、凸起、半透明、光滑有光泽,细胞呈球形;菌株G-1、G-8的菌落呈圆形、扁平中凸、乳白色、干燥无光泽,细胞呈短条形。
2.2 产酯香酵母菌菌株的筛选
采用嗅闻法测定10株酵母菌菌株在YPD液体及固体培养基发酵后的风味,结果见表2。 由表2可知,根据风味初步将10株酵母菌菌株分为4类(I~Ⅳ),I类酵母的主要风味为淡酒香,II类酵母的风味较强,具有浓烈的酯香和果香气,III类酵母的风味为清爽酸香、淡酒香,Ⅳ类酵母的风味为花粉香,每个类别中菌株Z-3、G-1、G-2、G-3、G-8的风味较为突出且香气宜人,因此,选择将这几株菌作为代表菌株。
表2 产酯香酵母风味特性的初步分析结果
Table 2 Preliminary analysis results of flavor characteristics of ester aroma-producing yeast strains
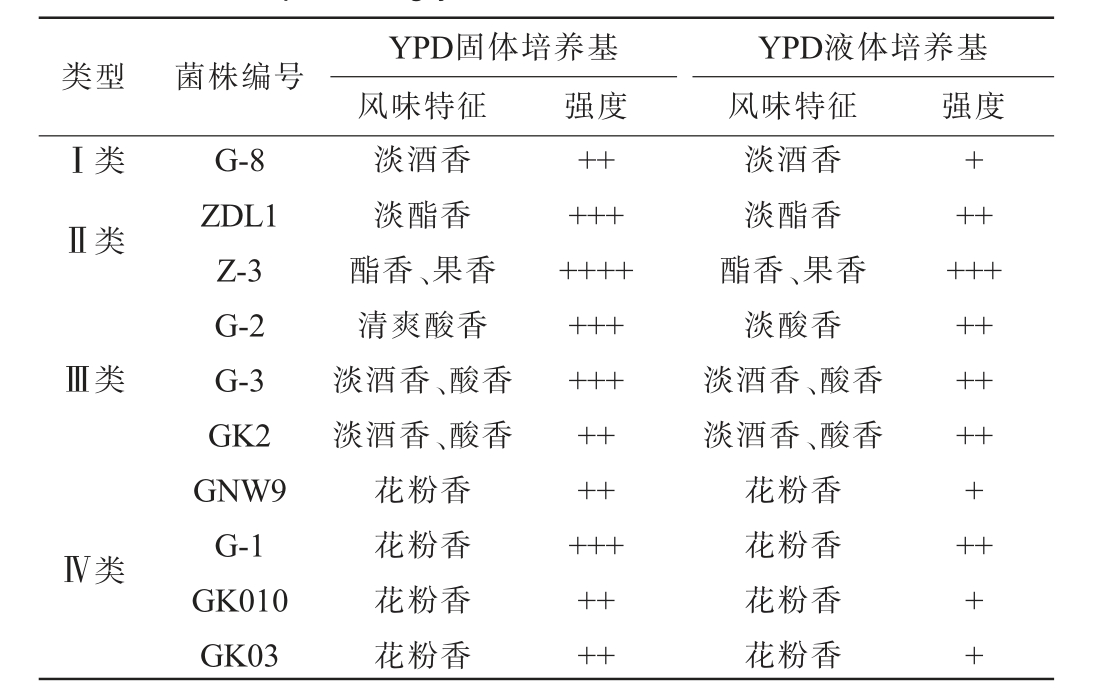
注:“+”越多表示风味强度越强。
YPD液体培养基风味特征 强度Ⅰ类Ⅱ类YPD固体培养基风味特征强度+Ⅲ类Ⅳ类类型 菌株编号G-8 ZDL1 Z-3 G-2 G-3 GK2 GNW9 G-1 GK010 GK03淡酒香淡酯香酯香、果香清爽酸香淡酒香、酸香淡酒香、酸香花粉香花粉香花粉香花粉香++++++++++++++++++++++++++淡酒香淡酯香酯香、果香淡酸香淡酒香、酸香淡酒香、酸香花粉香花粉香花粉香花粉香++++++++++++++++
2.3 产酯香酵母菌菌株的鉴定
基于5.8 ITS rDNA基因序列构建菌株Z-3、G-1、G-2、G-3、G-8的系统发育树,结果见图2。

图2 基于5.8 ITS rDNA基因序列产酯香酵母菌菌株系统发育树
Fig.2 Phylogenetic tree of ester aroma-producing yeasts strains based on 5.8 ITS rDNA gene sequences
由图2可知,菌株Z-3、G-1、G-2、G-3、G-8分别与异常威客汉姆酵母(Wickerhamomyces anomalus)(NR 111210.1)、库德里阿兹威毕赤酵母(Pichia kudriavzevii)(NR131315.1)、卡利比克迈耶氏酵母(Meyerozymacaribbica)(NR149348.1)、阿德利长西氏酵母(Naganishia diffluens)(NR 111051.1)、扣囊复膜酵母(Saccharomycopsis fibuligera)(KX 904348.1)聚于一支,亲缘关系最近,结合形态学特征,最终将菌株Z-3、G-1、G-2、G-3、G-8分别鉴定为异常威客汉姆酵母(Wickerhamomyces anomalus)、库德里阿兹威毕赤酵母(Pichia kudriavzevii)、卡利比克迈耶氏酵母(Meyerozyma caribbica)、阿德利长西氏酵母(Naganishia diffluens)、扣囊复膜酵母(Saccharomycopsis fibuligera)。
2.4 产酯香酵母菌菌株的生长曲线
5株产酯香酵母菌菌株的生长曲线见图3。由图3可知,菌株Z-3生长较快,6 h起逐渐进入对数生长期,16 h进入稳定期。 其次是菌株G-1、G-2、G-8、G-3,其中菌株G-3生长最慢,24 h后才达到稳定期。
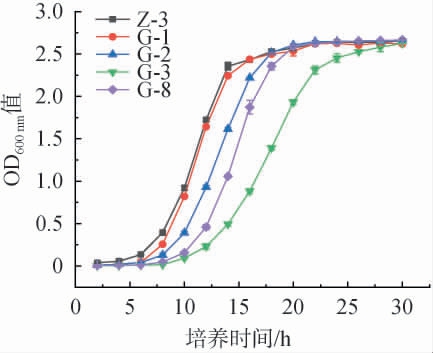
图3 产酯香酵母菌菌株的生长曲线
Fig.3 Growth curves of ester aroma-producing yeasts strains
2.5 产酯香酵母菌菌株的耐受性分析
不同发酵环境中,酵母所受到的胁迫因素可能有所不同,而乙醇、酸碱性通常是酿造环境中酵母面临的主要应激因素[26]。一定体积分数的乙醇和乙酸对酵母的生存有促进作用,但体积分数过高会对酵母产生毒性作用[27]。同时,乙醇是固态白酒发酵过程中菌落菌落演替的重要推动力,但随着乙醇体积分数的升高,对酵母会产生毒效应,抑制酵母的生存和繁殖[28]。糖是发酵生产乙醇的主要基质和酵母赖以生存的能源物质,但是高浓度的糖环境对酵母生长繁殖有抑制作用,高渗透压会导致酵母细胞水分流失[29]。因此,考察5株产酯香酵母菌菌株对乙醇、乙酸及糖的耐受性,结果见图4。
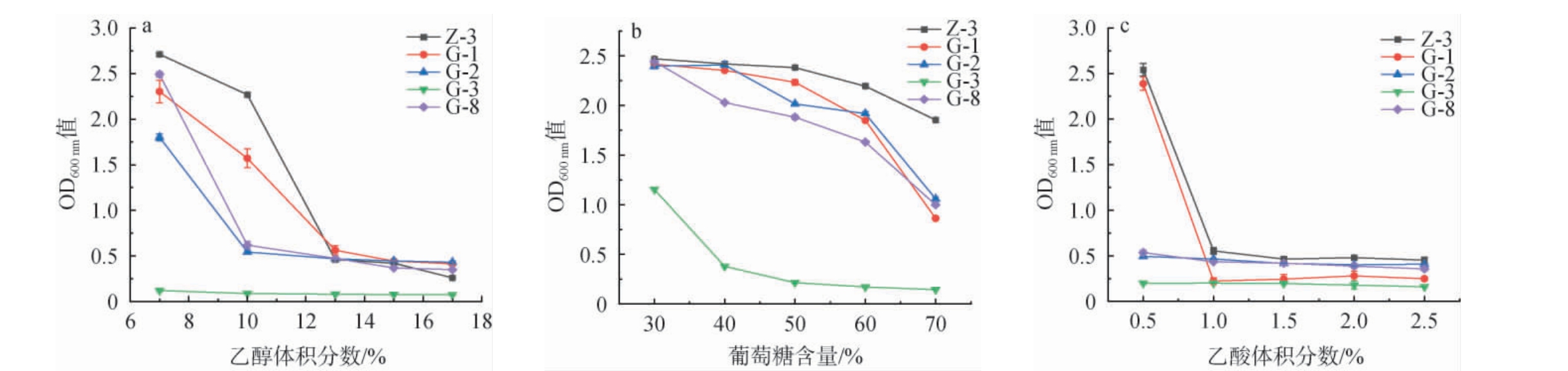
图4 产酯香酵母菌菌株对乙醇(a)、葡萄糖(b)及乙酸(c)的耐受性
Fig.4 Tolerance of ester aroma-producing yeast strains to ethanol (a), glucose (b) and acetic acid (c)
由图4可知,随着乙醇体积分数、葡萄糖含量及乙酸体积分数的升高,5株产酯香酵母菌菌株的OD600 nm值均呈下降趋势。 其中,菌株G-3对乙醇、葡萄糖及乙酸的耐受性最差;菌株G-2和G-8对乙酸的耐受性较差;其余两株酵母均展示出较好的耐受性,且菌株Z-3的耐受性最好,可耐受乙醇体积分数13%、葡萄糖含量70%,乙酸体积分数1%。
2.6 产酯香酵母菌菌株的产香特性分析
2.6.1 固态发酵产物的挥发性香气成分分析
利用HS-SPME结合GC-Q/TOF-MS技术分析发酵产物的挥发性风味物质,结果见表3。
表3 产酯香酵母菌菌株固态发酵产物的挥发性风味物质分析结果
Table 3 Analysis results of volatile flavor substances in solid-state fermentation products of ester aroma-producing yeast strains

种类 化合物异丙醇正丙醇1,3-戊二醇异丁醇正丁醇异戊醇正己醇2-壬醇2,3-丁二醇苯乙醇乙醇3-甲基-1-己醇1-辛烯-3-醇3-甲硫基丙醇总计乙酸甲酯乙酸乙酯丙酸乙酯异丁酸乙酯乙酸丙酯乙酸异丁酯丁酸乙酯己酸乙酯乙酸丁酯乙酸异戊酯丁酸丙酯丁酸戊酯乳酸乙酯苯甲酰甲酸乙酯乙酸苯乙酯乳酸异戊酯总计乳酸乙酸异丁酸正丁酸异戊酸总计醇类酯类酸类含量/(μg·g-1)CK Z-3 G-1 G-2 G-3 G-8--0.34±0.00c 0.45±0.02-3.99±0.60e 1.79±0.07c 41.01±2.28b 0.32±0.00 0.07±0.02 0.58±0.18b 0.69±0.12d 17.33±3.52d 0.84±0.08-6.16±0.10c 2.65±0.23b 42.96±1.44b 0.30±0.03-1.00±0.02b 0.46±0.12d 35.77±3.57b--2.29±0.15f 5.87±0.30a 19.70±0.89d 9.63±0.77c-0.19±0.10b 7.28±0.21b 0.98±0.04d 44.44±0.73b 11.90±0.50b-0.05±0.03bc 4.70±0.17d 0.21±0.21e 32.21±1.27c 12.76±1.41a-0.73±0.11a 8.52±0.67a 2.58±0.10b 49.42±4.65a————1.09±0.47b 6.73±0.01c 26.76±0.34c 4.15±1.67b 11.25±0.11a 27.17±7.87c 2.12±0.51b 6.68±0.67c 39.52±0.26ab-- --- ——- --- -66.78±0.19d 0.02±0.00 12.14±0.11d 0.09±0.03b 0.07±0.02 0.09±0.00 62.87±0.51d-29.66±2.20c 0.03±0.00c 105.10±7.9b-39.60±1.22b 97.40±3.12bc-22.96±0.43c 10.94±4.23a 8.62±0.54b 45.07±5.20a 0.15±0.13 0.25±0.22-139.08±7.89a-5.36±0.81d-- -90.46±5.34c 0.11±0.01 84.12±9.79a 0.43±0.02a-0.13±0.01 0.34±0.00-- -14.16±1.38 0.09±0.01 0.54±0.11 0.53±0.01bc--1.57±0.17 2.16±0.70a—— - - - - --- - - - - --- - - - - -0.16±0.16c 0.62±0.07bc 0.07±0.01c——--1.21±0.09a 0.47±0.15b-- --- ——-0.11±0.09c 0.28±0.24a 0.30±0.03a 0.07±0.00 14.76±0.10d 0.17±0.02e 0.28±0.03d 0.32±0.01a-0.32±0.04c 1.08±0.04f 0.03±0.01 89.36±9.11a 0.24±0.01e 16.10±0.97a 0.42±0.02a-0.56±0.06b 17.32±1.05c 0.84±0.05b 0.31±0.12 0.48±0.17 0.35±0.00b 0.14±0.06ab 0.18±0.00-46.16±3.31b 2.26±0.46d 3.36±0.31b 0.36±0.18a 27.22±0.10a 0.83±0.03a 34.03±0.65a 0.30±0.03a 0.21±0.01-40.73±1.18b 7.64±1.07b 0.59±0.10d-0.30±0.06b 0.38±0.04c 8.91±0.96d——23.51±0.89c 4.73±0.57c 1.91±0.08c--0.06±0.06d 6.70±0.55e 5.73±0.85e 16.44±1.64a 2.21±0.01c-0.08±0.01c 0.38±0.02c 19.10±1.54b
续表
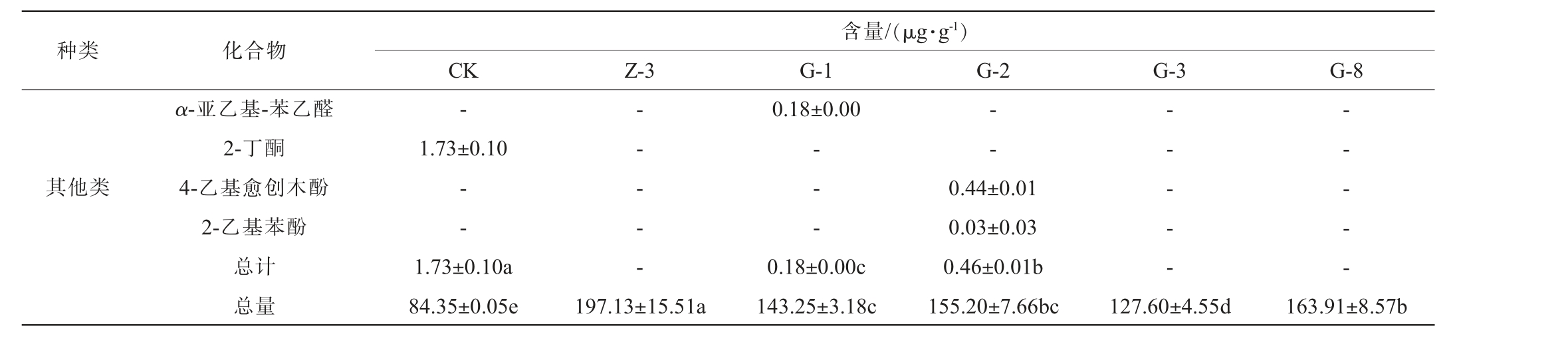
注:同行不同字母表示差异显著(P<0.05),“-”表示未检出。下同。
种类 化合物含量/(μg·g-1)CK Z-3 G-1 G-2 G-3 G-8其他类α-亚乙基-苯乙醛2-丁酮4-乙基愈创木酚2-乙基苯酚总计总量-1.73±0.10--1.73±0.10a 84.35±0.05e-- - - -197.13±15.51a 0.18±0.00-- -0.18±0.00c 143.25±3.18c--0.44±0.01 0.03±0.03 0.46±0.01b 155.20±7.66bc-- - - -127.60±4.55d-- - - -163.91±8.57b
由表3可知,从6组固态发酵产物中共检出39种挥发性风味物质,其中共有的挥发性风味化合物有11种,分别是异丁醇、正丁醇、异戊醇、2,3-丁二醇、苯乙醇、乙醇、乙酸乙酯、乙酸异戊酯、乳酸、乙酸和异戊酸。 对照组检出23种,其独有的挥发性风味物质有4种,分别是2-壬醇、异丁酸乙酯、己酸乙酯及2-丁酮。菌株Z-3固态发酵产物中检出21种,其独有的挥发性风味物质有2种,分别是乙酸丙酯及乙酸异丁酯。菌株G-1固态发酵产物中检出23种,其独有的挥发性风味物质有5种,分别是3-甲硫基丙醇、丁酸乙酯、丁酸丙酯、丁酸戊酯及α-亚乙基-苯乙醛。 菌株G-2固态发酵产物中共检出18种,其独有的挥发性风味物质有2种,分别是4-乙基愈创木酚及2-乙基苯酚。菌株G-3固态发酵产物中检出15种。 菌株G-8固态发酵产物中检出17种,其独有的挥发性风味物质有2种,分别3-甲基-1-己醇及1-辛烯-3-醇。与对照组相比,产酯香酵母菌的加入并没有增加过多种类的挥发性香味物质,但是增加了特殊挥发性风味成分的种类及含量。与对照组相比,5株产酯香酵母菌菌株均能显著提高发酵产物的挥发性风味物质总含量(P<0.05),醇类物质含量大小为G-8>G-2>G-3>Z-3>CK>G-1,其中,菌株G-8固态发酵产物中挥发性风味物质是对照组的1.08倍,含有较高的异戊醇、异丙醇及异丁醇;酯类物质含量大小为Z-3>G-1>G-2>G-3>CK>G-8,其中菌株Z-3在提高固态发酵产物总酯含量方面的能力较强,是对照组的5.05倍,含有较高的乙酸乙酯及乙酸异戊酯,其含量分别为84.12μg/g、2.16μg/g。 酸类物质含量大小为G-1>G-8>Z-3>G-2>G-3>CK,其中,菌株G-1在提高固态发酵产物总酸含量方面的能力较强,是对照组的30.51倍,含量最高的为正丁酸(27.22 μg/g)。 这5株产酯香酵母均不能提高2-丁酮的含量,但是菌株G-1能提高微量成分α-亚乙基-苯乙醛的含量;菌株G-2能提高4-乙基愈创木酚和2-乙基苯酚的含量;菌株G-3在提升风味物质含量方面效果较差的原因可能与其耐受性较差导致其生长代谢受到抑制有关。目前也有相关研究表明,W.anomalus作为产酯香酵母具有较好的增酯提香能力[30];陈妍等[31]从特香型白酒大曲中筛到一株异常威克汉姆酵母(W.anomalus),其酯化力高达60 U/g,将其添加到麸皮固态发酵培养基中发酵20 d,利用SPME-GC-MS分析其挥发性代谢产物,总含量达7.73 mg/kg,其中苯乙醇含量最高为3 016.65 μg/kg;夏玙等[32]利用分离到的一株异常威克汉逊酵母制备麸曲,并将其投入到清香型小曲酒的酿造中,发现在糖化后添加新型麸曲,可使总酯含量提高2倍左右,其中乙酸乙酯含量提高3倍左右。 结果表明,虽然这几株产香酵母在提升发酵产物的挥发性风味物质种类方面能力不强,但菌株Z-3在乙酸乙酯含量的提升方面效果较为显著(P<0.05),根据这一特性可以考虑将其用于改善清香型白酒的品质。
2.6.2 固态发酵产物的关键挥发性风味物质分析
根据OAV>1确定不同固态发酵产物中的关键挥发性风味物质,结果见表4。
表4 产酯香酵母菌菌株固态发酵产物中的关键挥发性风味物质
Table 4 Key volatile flavor substances in solid-state fermentation products of ester aroma-producing yeast strains
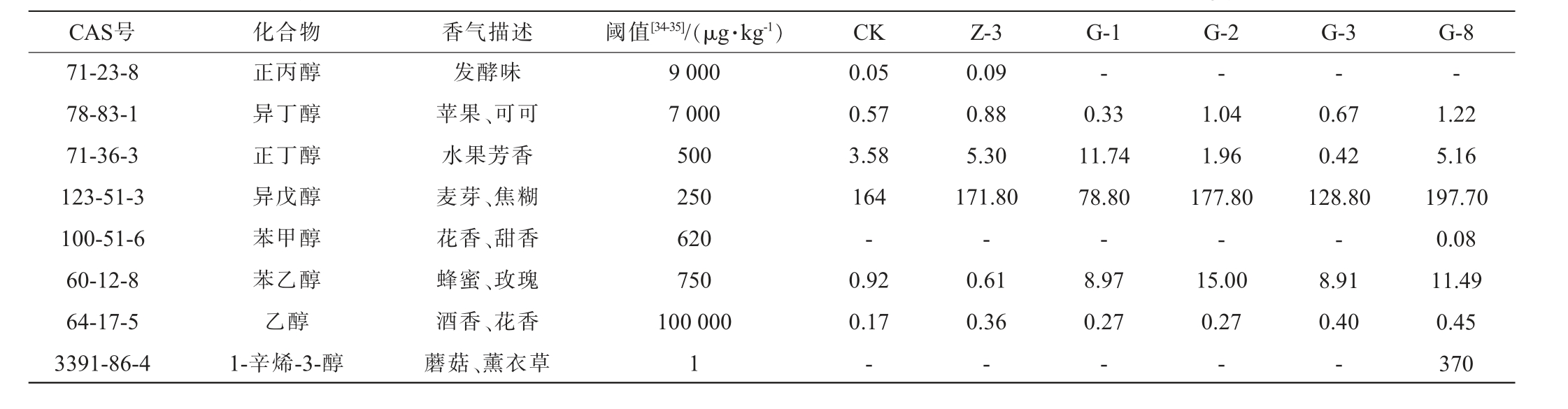
CAS号 化合物 香气描述 阈值[34-35]/(μg·kg-1) CK Z-3 G-1 G-2 G-3 G-8 71-23-8 78-83-1 71-36-3 123-51-3 100-51-6 60-12-8 64-17-5 3391-86-4正丙醇异丁醇正丁醇异戊醇苯甲醇苯乙醇乙醇1-辛烯-3-醇发酵味苹果、可可水果芳香麦芽、焦糊花香、甜香蜂蜜、玫瑰酒香、花香蘑菇、薰衣草9 000 7 000 500 250 620 750 100 000 1 0.05 0.57 3.58 164-0.92 0.17-0.09 0.88 5.30 171.80-0.61 0.36——-0.33 11.74 78.80-8.97 0.27-1.04 1.96 177.80-15.00 0.27-0.67 0.42 128.80-8.91 0.40-1.22 5.16 197.70 0.08 11.49 0.45 370
续表
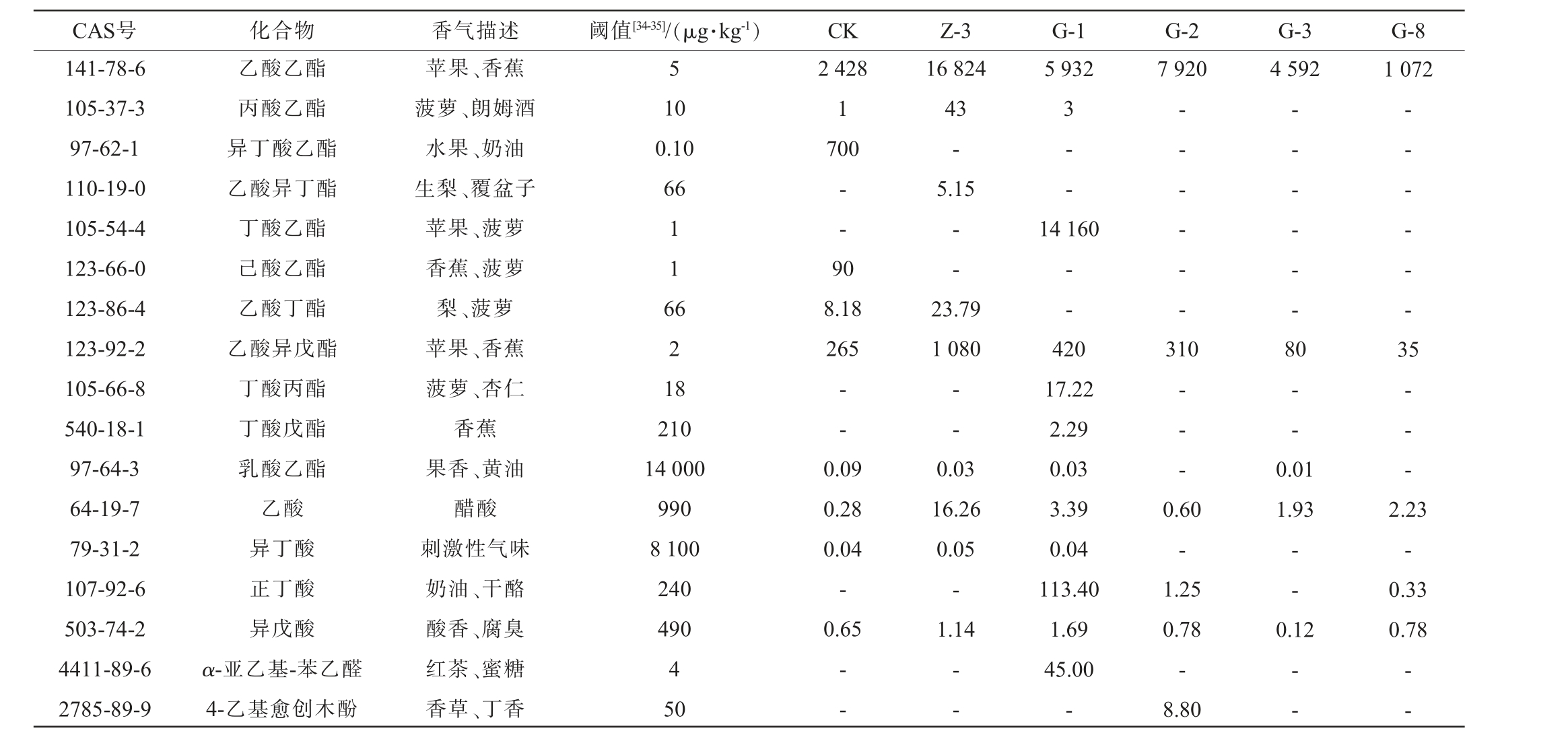
注:“-”为该物质OAV<0.001;香气特征从https://www.femaflavor.org/查询获得。
CAS号 化合物 香气描述 阈值[34-35]/(μg·kg-1) CK Z-3 G-1 G-2 G-3 G-8 141-78-6 105-37-3 97-62-1 110-19-0 105-54-4 123-66-0 123-86-4 123-92-2 105-66-8 540-18-1 97-64-3 64-19-7 79-31-2 107-92-6 503-74-2 4411-89-6 2785-89-9乙酸乙酯丙酸乙酯异丁酸乙酯乙酸异丁酯丁酸乙酯己酸乙酯乙酸丁酯乙酸异戊酯丁酸丙酯丁酸戊酯乳酸乙酯乙酸异丁酸正丁酸异戊酸α-亚乙基-苯乙醛4-乙基愈创木酚苹果、香蕉菠萝、朗姆酒水果、奶油生梨、覆盆子苹果、菠萝香蕉、菠萝梨、菠萝苹果、香蕉菠萝、杏仁香蕉果香、黄油醋酸刺激性气味奶油、干酪酸香、腐臭红茶、蜜糖香草、丁香5 5 932 7 920 4 592 1 072 10 0.10 66 2 428 1 700 16 824 43-5.15 3- -11 6-- 9 0--14 160 62 1 8 8.18 265 23.79 1 080—— - - - -310-- - - - - 8-- - - - - 3 210 14 000 990 8 100 240 490 4 50——0- -0.09 0.28 0.04-0.65 0.03 16.26 0.05-1.14---0.01 1.93 5- - -420 17.22 2.29 0.03 3.39 0.04 113.40 1.69 45.00-0.60-1.25 0.78-8.80--0.12 2.23-0.33 0.78————
由表4可知,对照组以及菌株Z-3、G-1、G-2、G-3和G-8固态发酵产物中OAV>1的挥发性风味物质分别有8种、9种、13种、8种、5种和8种,其共有的关键挥发性风味成分有3种,分别是异戊醇、乙酸乙酯和乙酸异戊酯。乙酸乙酯因其较低的阈值及较高的含量使其OAV均达到1 000以上,在每组固态发酵产物的风味贡献中较为突出。除乙酸乙酯外,各组也存在其他OAV较高的挥发性风味物质,CK中的异丁酸乙酯OAV高达700,赋予了发酵产物独特的水果香及奶油香;菌株Z-3固态发酵产物中具有水果芳香气味的乙酸乙酯的OAV最高,说明其对该组固态发酵产物特征挥发性风味物质的贡献最大。 菌株G-1固态发酵产物中含有特有的丁酸乙酯,赋予了其菠萝水果的香气,同时,OAV较高的的正丁醇和丁酸也使得发酵产物香气较为丰富。菌株G-2固态发酵产物特有的挥发性风味物质为4-乙基愈创木酚,其含量虽低,但其OAV>1,赋予了香草与丁香气味[33]。 菌株G-3固态发酵产物组中OAV最高的是乙酸乙酯;具有水果、蜂蜜及玫瑰芳香属性的异戊醇、正丁醇、异丁醇及苯乙醇在菌株G-8固态发酵产物中的OAV较高,使其浓郁的醇香气息高于其他菌株。
3 结论
本研究采用传统培养分离法结合嗅闻法从中、高温大曲中分离筛选得到5株产酯香酵母菌代表菌株,通过形态学观察及分子生物学鉴定,菌株G-8、Z-3、G-1、G-2、G-3分别为扣囊复膜酵母(Saccharomycopsis fibuligera)、异常威客汉姆酵母(Wickerhamomyces anomalus)、库德里阿兹威毕赤酵母(Pichia kudriavzevii)、卡利比克迈耶氏酵母(Meyerozyma caribbica)、阿德利长西氏酵母(Naganishia diffluens)。其中,菌株Z-3生长较快、耐受性较好且对挥发性风味物质含量提升效果最好,可耐受对乙醇体积分数13%、葡萄糖含量70%及乙酸体积分数1.0%;其固态发酵产物中检出21种挥发性风味物质,总含量为197.13 μg/g,关键挥发性风味物质(OAV>1)有8种,包括乙酸乙酯、乙酸异戊酯等,对改善白酒风味有较好的应用潜力,丰富了白酒酿造的酵母资源,后续可深入研究其对固态酿造过程中理化因子及挥发性风味物质的动态影响并进一步分析其对发酵中微生物群落与理化因子及挥发性风味物质相关性的影响,从而拓宽其应用前景。
[1]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:51-56.
[2]胡雨.白酒食品安全风险研究现状与相关标准[J].中国食品工业,2024(19):76-78.
[3]王国良,宋俊梅,曲静然.生香酵母及其应用[J].食品工业,2004(3):16-7,29.
[4]徐岩.现代白酒酿造微生物学[M].北京:科学出版社,2019:1-10.
[5]胡建华,王旭亮,盛力,等.一株高产乙酸乙酯酵母的筛选及其在牛栏山白酒酿造中的应用[J].酿酒科技,2013(1):69-70,74.
[6]LARROQUE M N,CARRAU F,FARIÑA L,et al.Effect of Saccharomyces and non-Saccharomyces native yeasts on beer aroma compounds[J].Int J Food Microbiol,2021,337:108953.
[7]WANI M A,SANJANA K,KUMAR D M,et al.GC-MS analysis reveals production of 2--phenylethanol from Aspergillus niger endophytic in rose[J].J Basic Microb,2010,50(1):110-114.
[8]王奇盛.异常威克汉姆酵母的筛选及其对米酒发酵的风味研究[D].武汉:武汉轻工大学,2022.
[9]LI X, LI B, CAI S, et al.Identification of rhizospheric actinomycete Streptomyces lavendulae SPS-33 and the inhibitory effect of its volatile organic compounds against Ceratocystis fimbriata in postharvest sweet potato(Ipomoea batatas(L.)Lam.)[J].Microorganisms,2020,8(3):319.
[10]曾婉俐,许力,蒋佳芮,等.产香细菌的筛选及产香特性分析[J].基因组学与应用生物学,2020,39(2):636-643.
[11]吕磊.芝麻香型白酒关键微生物产香分析研究[D].济南:齐鲁工业大学,2014.
[12]ROJAS V,GIL J V,PIÑAGA F,et al.Studies on acetate ester production by non-Saccharomyces wine yeasts[J].Int J Food Microbiol,2001,70(3):283-289.
[13]庞博,王晓丹,魏燕龙,等.金沙窖酒酒醅中产香酵母分离与鉴定[J].中国酿造,2014,33(12):42-46.
[14]LI W,FAN G,FU Z,et al.Effects of fortification of Daqu with various yeasts on microbial community structure and flavor metabolism[J].Food Res Int,2020,129:108837.
[15]刘霄,黄治国,卫春会,等.扣囊复膜酵母麸曲制备及其在小曲白酒中的应用[J].食品科学,2025,46(1):56-63.
[16]余安玲,张小娜,李红.酵母麸曲培养条件优化及其固态发酵应用研究[J].食品与发酵工业,2024,50(11):47-54.
[17]周钰涵.生香酵母的风味物质分析及其在麸曲白酒中的应用[D].天津:天津科技大学,2022.
[18]ZHA M,SUN B,WU Y,et al.Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Wickerhamomyces anomalus for Chinese Baijiu making[J].J Biosci Bioeng,2018,126(2):189-195.
[19]YANRU C, YIN W, WENQIN C, et al.Effects on cell membrane integrity of Pichia anomala by the accumulating excessive reactive oxygen species under ethanol stress[J].Foods,2022,11(22):3744-3744.
[20]艾明,董孝元,李俊薇,等.清香型白酒酿造体系中酵母菌的分离鉴定及生产特性分析[J].食品科技,2021,46(7):29-36.
[21]张亭妍,王宏雁,刘钟栋.一株产香酵母菌的筛选及应用于发酵馒头的研究[J].中国酿造,2020,39(7):69-73.
[22]牟飞燕,夏博宇,张维,等.清香大曲中高耐受性功能酵母的筛选[J].中国酿造,2023,42(11):163-168.
[23]卢延想,梁慧珍,陈鹏,等.高温大曲中产香酵母的筛选及特征香气分析[J].食品研究与开发,2021,42(11):167-174.
[24]石馨,惠明,田青,等.异常威克汉姆酵母Y-1对模拟固态发酵白酒酒醅理化指标及风味的影响[J].中国酿造,2022,41(9):31-36.
[25]刘登勇,周光宏,徐幸莲.确定食品关键风味化合物的一种新方法:“ROAV”法[J].食品科学,2008(7):370-374.
[26]CHEN Y, YANG Y, CAI W, et al.Research progress of anti-environmental factor stress mechanism and anti-stress tolerance way of Saccharomyces cerevisiae during the brewing process[J].Crit Rev Food Sci Nutr,2022,63(33):11-16.
[27]李小龙,吴群,徐岩.乙醇与酸度协同作用推动芝麻香型白酒固态发酵过程的微生物群落演替[J].微生物学通报,2019,46(1):1-10.
[28]KAZUMAS T,MITSUHIKO K,THI P P,et al.Production of high-concentration bioethanol from cassava stem by repeated hydrolysis and intermittent yeast inoculation[J].Int Biodeter Biodegr,2019,138:1-7.
[29]LIU G,TAO C,ZHU B,et al.Identification of Zygosaccharomyces mellis strains in stored honey and their stress tolerance[J].Food Sci Biotechnol,2016,25(6):1645-1650.
[30]谢再斌,王太玉,王茜,等.异常威克汉姆酵母在白酒酿造中的应用研究[J].中国酿造,2022,41(5):18-22.
[31]陈妍,蔡文琴,陈延儒,等.特香型白酒大曲中酵母菌的筛选及产香性能[J].南昌大学学报(理科版),2021,45(4):351-357.
[32]夏玙,谢军,黄丹,等.异常威克汉逊酵母的麸曲制作工艺优化[J].食品研究与开发,2018,39(22):118-123.
[33]李婷婷,黄名正,唐维媛,等.刺梨汁中挥发性成分测定及其呈香贡献分析[J].食品与发酵工业,2021,47(4):237-246.
[34]孙宝国,陈海涛.食用调香术[M].第三版,北京:化学工业出版社,2017:29-39.
[35]里奥·范海默特.化合物香味阈值汇编[M].北京:科学出版社,2015:221-228.