琥珀酸脱氢酶抑制剂类(succinate dehydrogenase inhibitors,SDHIs)杀菌剂的主要靶标是线粒体呼吸链中的复合体II(EC1.3.5.1)。 该酶复合体在细胞呼吸中将琥珀酸氧化为延胡索酸,并还原泛醌为泛醌醇。 琥珀酸脱氢酶抑制剂类(SDHIs)化合物通过占据泛醌的结合位点,抑制细菌的三羧酸循环,阻断病原菌的能量代谢,从而抑制细菌的生长和繁殖[1-3]。 SDHIs类化合物的杀菌谱广、杀菌效果好[4-6],目前被广泛应用于植物的真菌危害,如治疗农作物及经济作物上的白粉病、霜霉病、疫霉病、菌核病、灰霉病等[7]。随着SDHIs的广泛使用,蔬菜水果等使用对象中的残留量会对消费者的身体健康造成较大的影响。有报道指出,虽然SDHIs对哺乳动物、鸟类及一些环境生物是相对安全的,但对水生生物的毒性则较高[8],且在环境中不易降解[9-11]。因此建立快捷高效的检测方法意义重大。
已有报道的SDHIs相关检测方法主要为免疫分析(immunoassay,IA)法[12-13]、气相色谱(gas chromatography,GC)法[14]、液相色谱(liquid chromatography,LC)法[15]、气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)法[16-17]和液相色谱-质谱联用(liquid chromatography-mass spectrography,LC-MS)法[18-22]。免疫分析法虽然特异性高,方法灵敏度高,但检测成本也较高,一般实验室的批量检测不适用。气相色谱和液相色谱虽然均能对多组分化合物进行检测,但分离难度大,且灵敏度也较低,对于含量较小的样品可能无法达到检出限。质谱法则更适合用于检测多组分且含量小的样品,对目标物的选择性更高,且能在短时间内分析多种化合物,灵敏度较高,适合于一般实验室的日常批量测定。 QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe),是近年来国际上最新发展起来的一种用于农产品检测的快速样品前处理技术,QuEChERS法操作简便、快速高效,结合盐析辅助液液萃取和分散固相萃取,提取和净化效果好,适用性广,已广泛应用于食品检测等领域[23-25]。此外,我国在GB 2763—2021《食品中农药最大残留限量》中,对氟吡菌酰胺、氟唑菌酰胺、氟唑环菌胺、啶酰菌胺、吡噻菌胺、联苯吡菌胺、苯并烯氟菌唑和吡唑萘菌胺等物质,在不同蔬菜中的残留量作出了明确的限量规定[26]。例如,规定韭菜中啶酰菌胺的限量为10 mg/kg,白菜中氟唑菌酰胺的限量为4 mg/kg。然而,在目前的国标分析方法中,仅有GB 23200.68—2016《食品中啶酰菌胺残留量的测定气相色谱-质谱法》[27]等少数方法,对少量琥珀酸脱氢酶抑制剂的检测方法作出了规定。这些方法覆盖的化合物类型不够全面,无法对多种琥珀酸脱氢酶抑制剂进行高通量检测。
本研究基于分散固相萃取(dispersive solid-phase extraction,DSPE)为前处理手段,建立了同时测定蔬菜中9种琥珀酸脱氢酶抑制剂类杀菌剂的气相色谱-串联质谱(gas chromatography-tandem mass spectrometry,GC-MS/MS)分析方法,并对该方法进行方法学考察。 旨在为多种蔬菜基质中琥珀酸脱氢酶抑制剂类杀菌剂残留量的高效检测提供技术支持,保障消费者身体健康;同时,为相关高通量分析方法的开发提供支持,推动农产品检测技术的发展。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
韭菜、大白菜、番茄、冬瓜、豇豆和芦笋:上海市松江区市售。
1.1.2 试剂
氟吡菌酰胺(1 000 mg/L)、氟唑菌酰胺(1 000 mg/L)、氟唑菌苯胺(1 000 mg/L)、氟唑环菌胺(1 000 mg/L,含顺反异构体)、啶酰菌胺(纯度99.0%)、联苯吡菌胺(纯度99.2%)、苯并烯氟菌唑(1 000 mg/L)和吡唑萘菌胺(1 000 mg/L):坛墨质检科技股份有限公司;吡噻菌胺(纯度99.9%):英国LGC公司;乙腈、乙酸乙酯、丙酮(均为色谱级)、N-丙基乙二胺(primary secondary amine,PSA)QuEChERS填料(40~63 μm)、十八烷基硅烷键合硅胶(octadecylsilane chemically bonded silica,C18)QuEChERS填料(40~60 μm)、石墨化碳黑(graphitized carbon black,GCB)QuEChERS填料(40~60μm)、硅胶填料(40~63μm):上海安谱实验科技股份有限公司;氯化钠、无水硫酸镁(均为分析纯):广州化学试剂厂。
1.2 仪器与设备
Agilent GC 8890气相色谱系统、7 000E气相色谱三重串联四极杆质谱仪:美国Agilent公司;H1850台式离心机:湖南湘仪实验室仪器开发有限公司;IKA MS 3 digital涡旋振荡器:德国IKA集团;Multi Reax多点涡旋振荡器:德国Heidolph公司;ML204T电子天平:瑞士Mettler Toledo公司;OMMI Analytic超纯水系统:厦门锐思捷水纯化技术有限公司;E-EVAP 112氮吹仪:美国Organomation公司;3K15高速离心机:美国Sigma-Aldrich公司。
1.3 方法
1.3.1 样品前处理方法
根据GB 2763—2021 附录A的测定部位要求,取适量蔬菜制备样品[26]。准确称取5 g(精确至0.01 g)均质后的蔬菜样品于50 mL具塞离心管中,加入10 mL水,涡旋分散基质,依次加入10 mL乙腈,4 g无水硫酸镁和1 g 氯化钠,涡旋振摇15 min。以4 000 r/min离心5 min。准确移取5 mL乙腈相于预先装有1 g无水硫酸镁、30 mg PSA和30 mg C18固相萃取剂的15 mL离心管中,涡旋混匀1 min后,取上层溶液于2 mL离心管中,以10 000 r/min离心5 min。吸取上层乙腈相1 mL于氮吹管中浓缩至近干,再用0.5 mL乙酸乙酯复溶,过0.22 μm有机相滤膜后待GC-MS/MS测定。
1.3.2 标准溶液配制
分别称取适量啶酰菌胺和联苯吡菌胺,用丙酮溶解并定容至10 mL,配制成1 000 mg/L标准储备液;剩余7种琥珀酸脱氢酶抑制剂以原标准品(1 000 mg/L)作为储备液。分别准确吸取9种琥珀酸脱氢酶抑制剂的储备液各5 μL至10 mL容量瓶中,用丙酮定容,得到0.500 mg/L混合标准中间液。随后,分别准确吸取9种琥珀酸脱氢酶抑制剂标准中间溶液0、3.0 μL、4.0 μL、6.0 μL、7.5 μL、15.0 μL、20.0 μL、50.0 μL、100.0 μL至试管中,用基质溶液定容至0.5 mL,配制成质量浓度分别为0、3.0 μg/L、4.0 μg/L、6.0 μg/L、7.5 μg/L、15.0 μg/L、20.0 μg/L、50.0 μg/L、100.0 μg/L的混合标准系列基质工作溶液。
1.3.3 气相色谱条件
采用超惰性(5%-苯基)-甲基聚硅氧烷毛细管柱(30 m×250 μm×0.25 μm)。升温程序为70 ℃保持1 min,然后以45℃/min程序升温至160℃,保持1min,再以10℃/min升温至280 ℃,保持5 min。载气为高纯氦气(He)(纯度>99.999%),流速1.5 mL/min;进样口温度250 ℃;进样量1 μL;进样方式为不分流进样。
1.3.4 质谱条件
电子电离(electronic ionization,EI)源;电子能量70 eV;离子源温度280 ℃;传输线温度240 ℃;溶剂延迟4 min;扫描方式为多反应监测(multiple-reaction monitoring,MRM)模式。
1.3.5 质谱条件优化
分别取1.0 mg/L的9种SDHIs标准溶液,在质荷比(m/z)为50~550 amu范围内进行全扫描,即得9种SDHIs的全扫描数据,根据全扫描数据优化确定仪器分析参数、定量离子、定性离子以及碰撞能量。
1.3.6 前处理条件优化
分别称取5 g空白韭菜样品置于50 mL离心管,加入50 μg/kg的9种SDHIs、10 mL水、4 g无水硫酸镁和1 g氯化钠,再分别加入10 mL甲醇、乙腈、丙酮、乙酸乙酯,经涡旋振荡15 min提取目标成分,考察不同提取溶剂对蔬菜中SDHIs回收率的影响。 确定最优提取溶剂后,分别研究提取溶剂用量(5 mL、10mL、15 mL、20 mL、25 mL)、吸附剂种类(PSA、GCB、C18、硅胶)及吸附剂用量(10 mg、20 mg、30 mg、40 mg、50 mg)对蔬菜中SDHIs的回收率的影响。 采用相同前处理方法制备空白基质韭菜溶液,用于基质标曲定量。
1.3.7 方法学考察
(1)线性关系、相关系数与检出限、定量限
选取了6种不同蔬菜1.3.1部分处理后,按照1.3.2要求配制混合标准基质曲线,以目标分析物的质量浓度(X)为横坐标,以其对应峰面积(Y)为纵坐标,分别绘制琥珀酸脱氢酶抑制剂类化合物标准曲线,得到标准曲线线性回归方程。 以1.3.3及1.3.4节条件进行测定,以约3倍信噪比(signal to noise ratio,S/N=3)测定本方法下不同蔬菜的仪器检出限(limits of detection,LODs),以约10倍信噪比(S/N=10)测定方法定量限(limits of quantitation,LOQs)。
(2)加标回收率实验和精密度实验
根据9种SDHIs的定量限为基准,对阴性样品进行定量限的1、2、5倍3个不同水平进行标准添加,每个水平重复6组平行实验,最终测定结果与添加量作比值得到回收率,并通过6组平行实验的测定结果计算出相应的相对标准偏差。
2 结果与分析
2.1 离子碎片的确定及质谱条件优化
配制1.0 mg/L的混标溶液,在50~550 m/z的范围内对所有碎片进行全扫描,导出所有碎片列表后,选择相对丰度较高的特征碎片为前体离子,建立对应的碰撞能量优化方法。最终相对丰度最高的离子对为定量离子对,一级离子和二级离子及碰撞能量见表1。 9种琥珀酸脱氢酶杀菌剂的定量离子的提取离子流色谱图见图1。
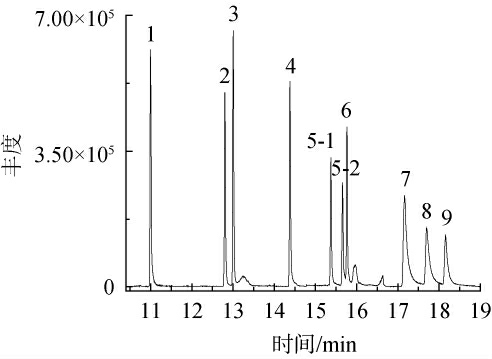
图1 9种琥珀酸脱氢酶抑制剂类化合物混合标准品GC-MS/MS分析总离子流色谱图
Fig.1 Total ion chromatogram of mixed standards of 9 succinate dehydrogenase inhibitors compounds analysis by GC-MS/MS
1.氟吡菌酰胺;2.吡噻菌胺;3.氟唑菌苯胺;4.氟唑菌酰胺;5-1.反式-氟唑环菌胺;5-2.顺式-氟唑环菌胺;6.吡唑萘菌胺;7.啶酰菌胺;8.联苯吡菌胺;9.苯并烯氟菌唑。
表1 9种琥珀酸脱氢酶抑制剂类化合物分析质谱条件
Table 1 Mass spectrometry conditions of 9 succinate dehydrogenase inhibitors compounds analysis

注:“*”表示定量离子。
化合物 保留时间/min母离子(m/z)子离子(m/z)碰撞能量/eV氟吡菌酰胺11.0 173.0吡噻菌胺12.8 302.0氟唑菌苯胺13.0 274.0氟唑菌酰胺14.4 381.0反式-氟唑环菌胺15.4 159.0顺式-氟唑环菌胺15.7 159.0吡唑萘菌胺15.8 159.0啶酰菌胺17.2 140.0联苯吡菌胺17.7 159.0苯并烯氟菌唑18.2 237.0 145.0*75.0 177.0*75.0 141.0*77.0 159.0*41.9 42.0*130.0 42.0*130.0 42.0*57.0 111.9*76.0 42.0*57.0 173.9*42.0 20.0 25.0 15.0 30.0 15.0 25.0 10.0 27.0 27.0 15.0 27.0 15.0 27.0 27.0 15.0 15.0 27.0 27.0 25.0 27.0
2.2 提取溶剂的选择
在实验的初步阶段,发现韭菜基质对9种琥珀酸脱氢酶抑制剂类化合物的响应影响显著。为获得较优的前处理参数,选择韭菜作为测试基质。在提取溶剂的选择上,在5 g阴性韭菜基质中加入50 μg/kg的9种琥珀酸脱氢酶抑制剂类化合物,并配制空白基质标准曲线以用于定量分析。 实验重复6次(n=6),以平均回收率作为评价指标。采用甲醇、乙腈、丙酮和乙酸乙酯四种有机溶剂(各10 mL)对9种琥珀酸脱氢酶抑制剂类化合物进行提取,考察不同提取试剂对9种琥珀酸脱氢酶抑制剂类化合物回收率的影响,结果见图2。由图2可知,甲醇对9种琥珀酸脱氢酶抑制剂类化合物的回收率最低,可能原因是甲醇与水混合时未因盐析作用而分层,导致共萃物较多,进而影响回收率。丙酮和乙酸乙酯的回收率相近且高于甲醇。在大量盐存在的情况下,这两种溶剂均能与水相分离,且与9种化合物的极性相近,因此回收率较高。然而,由于乙腈极性与9种目标化合物相近,作为提取溶剂时,9种目标化合物的平均回收率最高,范围在85.1%~95.2%之间。因此,选择乙腈为最适提取溶剂。
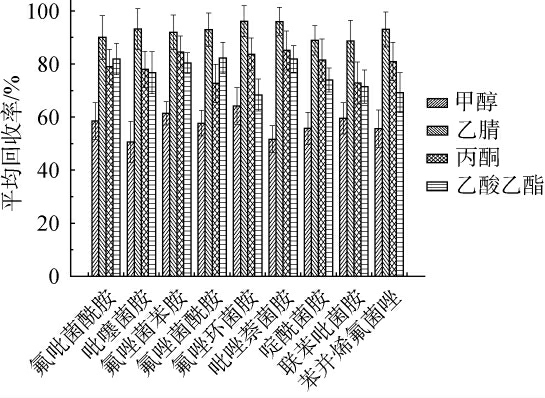
图2 不同提取溶剂对9种琥珀酸脱氢酶抑制剂类化合物平均回收率的影响
Fig.2 Effect of different extraction solvents on the average recovery rates of 9 succinate dehydrogenase inhibitors compounds
2.3 提取溶剂用量的优化
实验中分别采用了5 mL、10 mL、15 mL、20 mL、25 mL不同体积的乙腈对样品进行提取,进一步优化乙腈用量对9种琥珀酸脱氢酶抑制剂类化合物回收率的影响,结果见图3。
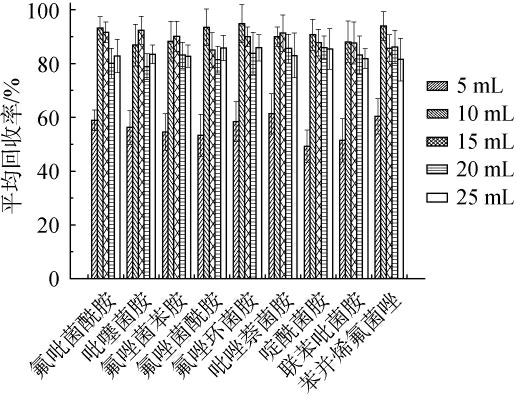
图3 不同乙腈用量对9种琥珀酸脱氢酶抑制剂化合物的平均回收率影响
Fig.3 Effect of different acetonitrile dosages on the average recovery rates of 9 succinate dehydrogenase inhibitors compounds
由图3可知,当乙腈用量为5 mL时,由于料液比不足,导致提取不充分,回收率较低。随着乙腈用量的增加,回收率逐渐提高,当乙腈用量达到10 mL时,回收率基本达最大值,范围在86.9%~94.7%。 然而,当乙腈用量超过20 mL时,回收率开始下降。这可能是因为乙腈用量过大,导致提取过程中带入了大量样品中的色素或糖分,进而影响了目标物的提取率和复溶效率,最终影响了回收率。因此,选择最适乙腈用量为10 mL。
2.4 吸附剂种类的优化
实验使用了30 mg的PSA、GCB、C18、硅胶4种固相萃取剂,考察不同吸附剂对9种琥珀酸脱氢酶抑制剂类化合物回收率的影响,结果见图4。 由图4可知,PSA和C18的回收率最高,GCB的回收率最低,针对蔬菜中的糖分和色素,PSA和C18的吸附效果较佳回收率分别为85.2%~92.0%和86.3%~96.1%。 尽管GCB也能吸附一些甾醇和平面结构的物质,但是由于9种琥珀酸脱氢酶抑制剂类化合物也为平面结构,GCB对目标化合物的吸附明显,回收率仅为48.4%~66.8%。 而硅胶吸附材料虽然回收率比GCB高,但回收率仍达不到测定的要求。因此,选择PSA和C18作为吸附剂进行净化。
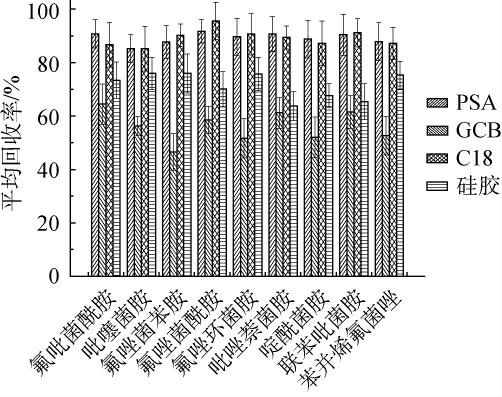
图4 不同吸附剂对9种琥珀酸脱氢酶抑制剂类化合物的平均回收率的影响
Fig.4 Effect of different adsorbent on the average recovery rates of 9 succinate dehydrogenase inhibitors compounds
2.5 吸附剂用量的优化
进一步探究PSA与C18的用量优化。确保9种目标化合物的回收率的前提下,使用尽可能多的固相萃取剂以去除杂质。 然而,固相萃取剂用量的增加也可能对目标化合物产生吸附作用。 因此,实验以9种琥珀酸脱氢酶抑制剂类化合物的平均回收率为参考,在此基础上优化PSA与C18的最大用量。考察PSA与C18的用量对9种琥珀酸脱氢酶抑制剂类化合物回收率的影响,结果见图5。由图5a可知,PSA和C18对9种琥珀酸脱氢酶抑制剂类化合物的吸附主要依赖于氢键和范德华力。在固相萃取剂用量较少时,对杂质的吸附效果有限,这可能导致在溶剂转换过程中杂质重新吸附目标物,进而降低回收率。当PSA的用量>30 mg时,吸附剂对目标物的吸附也开始变得显著。在PSA用量为30 mg的条件下,9种目标化合物的回收率最高,为87.4%~94.6%。由图5b可知,在PSA 30 mg的条件下,分别考察10 mg、20 mg、30 mg、40 mg、50 mg的C18用量对平均回收率的影响,C18用量为30 mg的条件下,9种目标化合物的回收率范围为86.1%~97.4%。因此,选择PSA和C18的最适用量均为30mg。
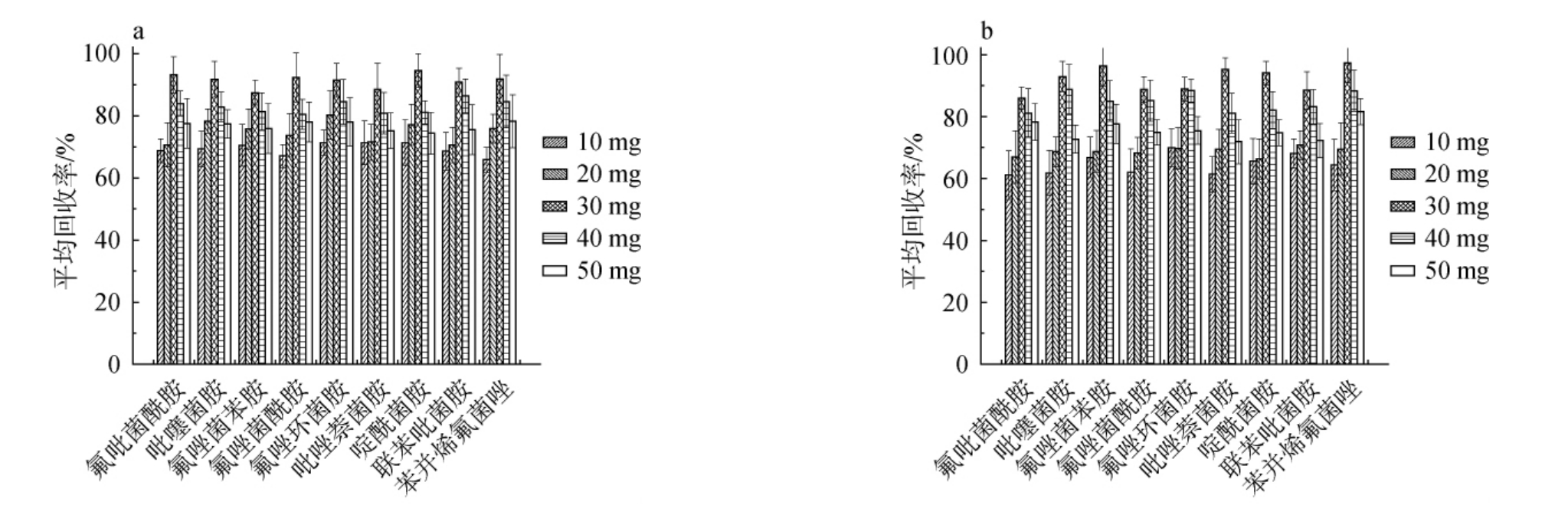
图5 不同N-丙基乙二胺(a)及C18(b)用量对9种琥珀酸脱氢酶抑制剂类化合物的平均回收率的影响
Fig.5 Effect of different N-primary secondary amine (a) and C18 (b) dosages on the average recovery rates of 9 succinate dehydrogenase inhibitors compounds
2.6 基质效应的探究
本实验探究了韭菜、大白菜、番茄、冬瓜、豇豆和芦笋共6种蔬菜基质效应的影响。采用1.3.1前处理方法,得到空白基质液,配制基质标准曲线,再使用乙酸乙酯配制溶剂标准曲线,通过基质标准曲线斜率与溶剂标准曲线斜率的比,得到比值K。当K<0.8时表示存在基质抑制现象,当K>1.2时表示存在基质增强现象。结果表明,几乎在所有蔬菜基质中的9种化合物均出现不同程度的基质抑制或增强现象,各化合物在各基质中,K值在0.37~1.35之间。因此应使用基质标准曲线定量。
2.7 方法学考察
2.7.1 线性关系、相关系数、检出限与定量限
9种琥珀酸脱氢酶抑制剂类化合物的回归方程、相关系数、线性范围、检出限及定量限见表2。
表2 9种琥珀酸脱氢酶抑制剂类化合物的标准曲线回归方程、线性范围、相关系数、检出限及定量限
Table 2 Regression equation, linear range, correlation coefficient of standard curve, limits of detection and limits of quantification of 9 succinate dehydrogenase inhibitors compounds
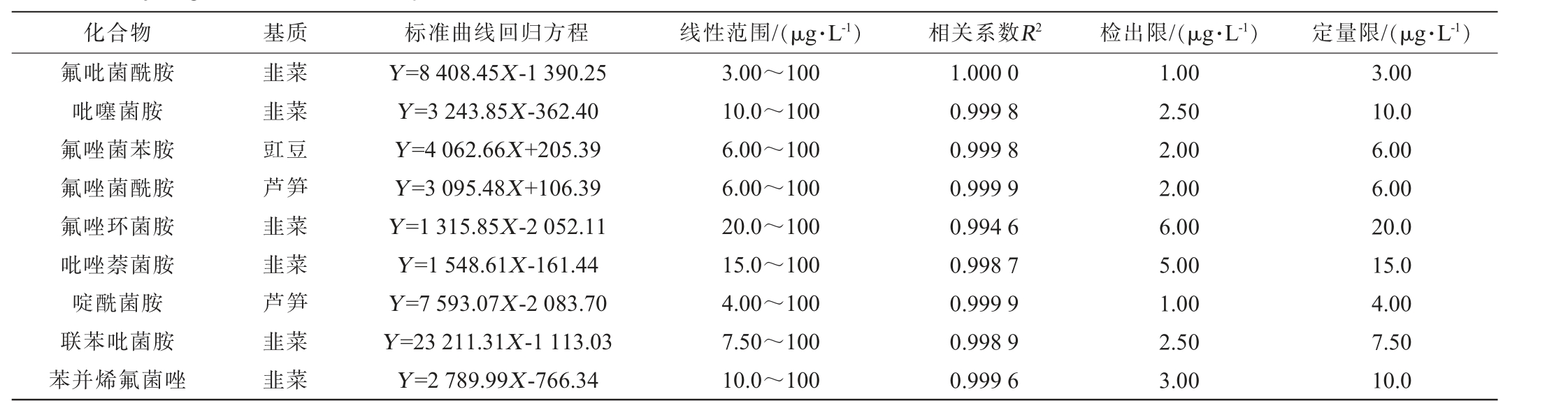
化合物 基质 标准曲线回归方程 线性范围/(μg·L-1) 相关系数R2 检出限/(μg·L-1) 定量限/(μg·L-1)氟吡菌酰胺吡噻菌胺氟唑菌苯胺氟唑菌酰胺氟唑环菌胺吡唑萘菌胺啶酰菌胺联苯吡菌胺苯并烯氟菌唑韭菜韭菜豇豆芦笋韭菜韭菜芦笋韭菜韭菜Y=8 408.45X-1 390.25 Y=3 243.85X-362.40 Y=4 062.66X+205.39 Y=3 095.48X+106.39 Y=1 315.85X-2 052.11 Y=1 548.61X-161.44 Y=7 593.07X-2 083.70 Y=23 211.31X-1 113.03 Y=2 789.99X-766.34 3.00~100 10.0~100 6.00~100 6.00~100 20.0~100 15.0~100 4.00~100 7.50~100 10.0~100 1.000 0 0.999 8 0.999 8 0.999 9 0.994 6 0.998 7 0.999 9 0.998 9 0.999 6 1.00 2.50 2.00 2.00 6.00 5.00 1.00 2.50 3.00 3.00 10.0 6.00 6.00 20.0 15.0 4.00 7.50 10.0
由表2可知,9种SDHIs化合物在其线性范围内呈现良好线性,相关系数在0.994 6~1.000 0。9种分析物的方法检出限(LODs)为1.00~6.00 μg/kg,定量限(LOQs)为3.00~20.0 μg/kg。
2.7.2 加标回收率实验及精密度试验
采用基质曲线进行定量,进一步设计方法学实验验证9种琥珀酸脱氢酶抑制剂类化合物加标回收率和精密度。选择9种琥珀酸脱氢酶抑制剂类化合物的韭菜、大白菜、番茄、冬瓜、豇豆、芦笋为加标样品,为了方便加标实验的进行,以最大定量限的1倍、2倍、5倍3个水平进行添加,每个浓度水平于同一日内重复6组平行。 回收率及精密度实验结果相对标准偏差(relative standard deviation,RSD)结果见表3。
表3 9种琥珀酸脱氢酶抑制剂类化合物的加标回收率和精密度试验结果
Table 3 Experimental results of standard recovery rates and precision of 9 succinate dehydrogenase inhibitors compounds
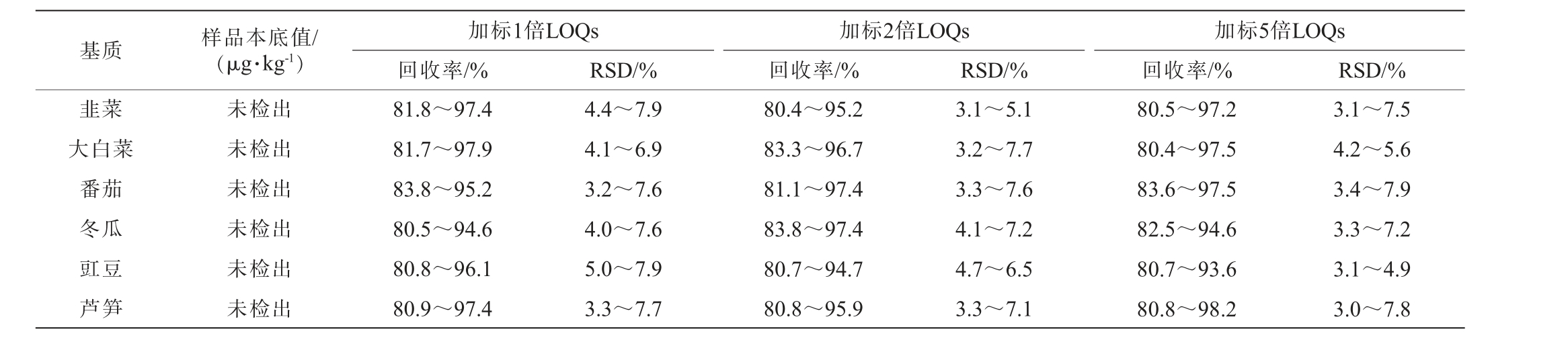
基质 样品本底值/(μg·kg-1)加标1倍LOQs回收率/%RSD/% RSD/%加标2倍LOQs回收率/%加标5倍LOQs回收率/% RSD/%韭菜大白菜番茄冬瓜豇豆芦笋未检出未检出未检出未检出未检出未检出81.8~97.4 81.7~97.9 83.8~95.2 80.5~94.6 80.8~96.1 80.9~97.4 4.4~7.9 4.1~6.9 3.2~7.6 4.0~7.6 5.0~7.9 3.3~7.7 80.4~95.2 83.3~96.7 81.1~97.4 83.8~97.4 80.7~94.7 80.8~95.9 3.1~5.1 3.2~7.7 3.3~7.6 4.1~7.2 4.7~6.5 3.3~7.1 80.5~97.2 80.4~97.5 83.6~97.5 82.5~94.6 80.7~93.6 80.8~98.2 3.1~7.5 4.2~5.6 3.4~7.9 3.3~7.2 3.1~4.9 3.0~7.8
由表3可知,9种琥珀酸脱氢酶杀菌剂的回收率在80.4%~98.2%,RSD为3.0%~7.9%。结果表明,该检测方法的准确度高,精密度高好,符合样品的检测要求。
2.8 方法的实际应用
随机选取了6种蔬菜的实际样品进行9种琥珀酸脱氢酶抑制剂类化合物GC-MS/MS测定,其中,每种蔬菜5份,共30份。其中1份韭菜样品中9种琥珀酸脱氢酶抑制剂类化合物GC-MS/MS分析总离子流色谱图见图6。结果表明,2份番茄中检出氟吡菌酰胺,含量分别为15.0 μg/kg、20.1 μg/kg,1份韭菜样品中检出氟吡菌酰胺和啶酰菌胺,含量分别为35.4 μg/kg和42.0 μg/kg,其余样品均未检出9种琥珀酸脱氢酶抑制剂类化合物。
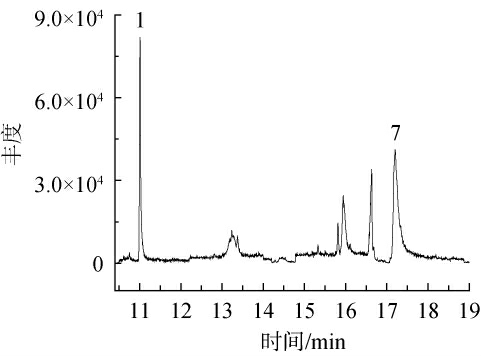
图6 阳性韭菜样品中9种琥珀酸脱氢酶抑制剂类化合物GC-MS/MS分析的总离子流色谱图
Fig.6 Total ion chromatogram of 9 succinate dehydrogenase inhibitors compounds in the positive Chinese chives samples analysis by GC-MS/MS
1.氟吡菌酰胺;7.啶酰菌胺。
3 结论
本研究基于建立了QuEChERS-气相色谱-串联质谱法同时测定蔬菜基质中的9种琥珀酸脱氢酶抑制剂类化合物的分析方法。通过QuEChERS技术,快速、方便地对批量化样品进行检测。通过优选提取溶剂、优化提取溶剂用量和优化吸附剂的种类和用量,并采用基质标准曲线校正结果,确认采用10 mL乙腈提取目标成分,30 mg C18和30 mgPSA作为吸附剂。 方法回收率和精密度较高,可满足日常检测需求。 适用于多种蔬菜中9种新型琥珀酸脱氢酶抑制剂的类化合物含量测定,可为SDHIs杀菌剂在蔬菜中残留量和安全性的评估提供技术支撑。
[1]魏阁,高梦琪,朱晓磊,等.靶向琥珀酸脱氢酶的酰胺类杀菌剂的研究进展[J].农药学学报,2019,21(Z1):673-680.
[2]YANG D, ZHAO B, FAN Z, et al.Synthesis and biological activity of novel succinate dehydrogenase inhibitor derivatives as potent fungicide candidates[J].J Agr Food Chem,2019,67(47):13185-13194.
[3]HUANG X P,LUO J,LI B X,et al.Bioactivity,physiological characteristics and efficacy of the SDHI fungicide pydiflumetofen against Sclerotinia sclerotiorum[J].Pestic Biochem Phys,2019,160(2019):70-78.
[4]汤晨.LC-MS/MS测定水产品中3种琥珀酸脱氢酶抑制剂类杀菌剂[J].粮食与油脂,2023,36(7):155-158.
[5]STEINHAUER D, SALAT M, FREY R, et al.A dispensable paralog of succinate dehydrogenase subunit C mediates standing resistance towards a subclass of SDHI fungicides in Zymoseptoria tritici[J].PLoS Pathog,2019,15(12):e1007780.
[6]OLIVEIRA M S, CORDOVA L G, PERES N A.Efficacy and baseline sensitivity of succinate-dehydrogenase-inhibitor fungicides for management of Colletotrichum crown rot of strawberry[J].Plant Dis,2020,104(11):2860-2865.
[7]李良孔,袁善奎,潘洪玉,等.琥珀酸脱氢酶抑制剂类(SDHIs)杀菌剂及其抗性研究进展[J].农药,2011,50(3):165-169.
[8]International Union of Pure and Applied Chemistry(IUPAC).Environmental fate-ecotoxicology-human health-A to Z index-home[EB/OL].(2020-05-01).http://sitem.herts.ac.uk/aeru/iupac/Reports/564.htm.
[9]AÑASCO N C,KOYAMA J,UNO S.Pesticide residues in coastal waters affected by rice paddy effluents temporarily stored in a wastewater reservoir in southern Japan[J].Arch Environ Con Tox,2010,58(2):352-360.
[10]TSUDA T, NAKAMURA T, INOUE A, et al.Pesticides in water and sediment from littoral area of lake Biwa[J].B Environ Contam Tox,2009,82(6):683-689.
[11]REILLY T J, SMALLING K L, ORLANDO J L, et al.Occurrence of boscalid and other selected fungicides in surface water and groundwater in three targeted use areas in the United States[J].Chemosphere,2012,89(3):228-234.
[12]ESTEVE-TURRILLAS F A,MERCADER J V,AGULLO C,et al.Highly sensitive monoclonal antibody-based immunoassays for boscalid analysis in strawberries[J].Food Chem,2018,267(30):2-9.
[13]CEBALLOS-ALCANTARILLA E, AGULLO C, ABAD-SOMOVILLA A,et al.Highly sensitive monoclonal antibody-based immunoassays for the analysis of fluopyram in food samples[J].Food Chem,2019,288(3):117-126.
[14] 郑振山,陈勇达,张少军,等.气相色谱法测定黄瓜中吡唑萘菌胺及其代谢物[J].食品安全质量检测学报,2016,7(2):540-544.
[15]冯玉洁,潘飞,谢圣华,等.超高效液相色谱法测定啶酰菌胺和咯菌腈在番茄与土壤中的残留[J].热带作物学报,2019,40(3):596-600.
[16]许晓霞.气相色谱-串联质谱法测定土壤中5种琥珀酸脱氢酶抑制剂类杀菌剂的残留量[J].理化检验-化学分册,2024,60(9):937-941.
[17]吴雪梅,马丽,何会珍,等.气相色谱-串联质谱法测定牛肉中4种琥珀酸脱氢酶抑制剂类杀菌剂的残留量[J].理化检验-化学分册,2023,59(10):1187-1191.
[18]李敏青,陈姿竹,李菊,等.QuEChERS-高效液相色谱-串联质谱法同时测定动物源性食品中21种琥珀酸脱氢酶抑制剂类杀菌剂的残留量[J].分析科学学报,2024,40(5):501-510.
[19]倪炜华,张丽娟,朱洪亮,等.超高效液相色谱-串联质谱法测定谷物中4种新型琥珀酸脱氢酶抑制剂类杀菌剂[J].现代食品,2023,29(23):205-209.
[20]张丽娟,鲍晓瑾,蓝小飞,等.QuEChERS-UPLC-MS/MS测定肉类中8种琥珀酸脱氢酶抑制剂类杀菌剂[J].食品安全导刊,2023(35):55-60.
[21]汤晨.LC-MS/MS测定水产品中3种琥珀酸脱氢酶抑制剂类杀菌剂[J].粮食与油脂,2023,36(7):155-158.
[22]毛静春,伍旭东,罗发美,等.QuEChERS-液相色谱-串联质谱法测定生咖啡中19种琥珀酸脱氢酶抑制剂类杀菌剂残留[J].粮油食品科技,2023,31(3):159-167.
[23]郭欣妍,赵毅然,陈真,等.QuEChERS-UPLC-MS/MS分析有机肥中33种抗生素类药物残留[J/OL].分析试验室,1-15[2025-02-27].http://kns.cnki.net/kcms/detail/11.2017.tf.20250107.1611.016.html.
[24]林彬彬,杨志金,黄旭良,等.QuEChERS结合超高效液相色谱-串联质谱法同时测定畜禽肉中9种新烟碱类杀虫剂及5种代谢物残留量[J].食品科学,2024,45(24):273-281.
[25]张婧文,王禹衡,刘俊宁,等.响应曲面优化QuEChERS法结合液相色谱-高分辨质谱检测尿液中的新烟碱类杀虫剂及其代谢物[J].分析化学,2023,51(11):1802-1816.
[26]中华人民共和国国家健康委员会,中华人民共和国农业农村部,国家市场监督管理总局.GB 2763—2021 食品安全国家标准 食品中农药最大残留限量[S].北京:中国标准出版社,2021.
[27]中华人民共和国国家卫生和计划生育委员会,中华人民共和国农业农村部,国家市场监督管理总局.GB 23200.68—2016 食品安全国家标准食品中啶酰菌胺残留量的测定气相色谱-质谱法[S].北京:中国标准出版社,2016.